摘要
背景
磷缺乏是限制植物生长的主要营养胁迫之一。植物对磷的吸收被认为是由一些属于Pht1家族的高亲和力磷酸盐(Pi)转运体介导的。虽然Pht1基因已在多种植物中被广泛发现,但至今仍缺乏对茄科植物中Pht1基因家族的系统分析。
结果
本文报道了番茄中Pht1基因的全基因组分析、系统进化和表达模式。茄属植物lycopersicum).共有八个推测的Pht1基因(LePT1来8),分布在3条染色体(3、6和9)上,通过对已发布的番茄基因组序列数据库的广泛搜索确定。染色体组织和系统发育树分析表明,6个Pht1副核苷酸,LePT1/ 3,LePT2/ 6和LePT4/5被分成三对,它们的物理距离非常近,它们是在茄科与其他双子科分裂后发生的串联复制事件中产生的。这些Pht1成员的表达分析显示,除了LePT8,其中的转录本在所有组织中都检测不到,其他7个副基因表现出差异但部分重叠的表达模式。LePT1而且LePT7在所有被检测的组织中普遍表达,它们的转录本在对磷饥饿的反应中被大量诱导;LePT2而且LePT6,两个编码序列相同的副核苷酸主要表达在pi缺陷根中;LePT3,LePT4而且LePT5在低磷条件下,丛枝菌根真菌定植的根中均有较强的活性,而在高磷条件下则无明显活性。组织化学分析显示1250 bpLePT3启动子片段和471 bpLePT5包含MYCS和P1BS两种元素的启动子片段足以指导菌根根中GUS报告基因的表达,并且仅限于含有AM真菌结构的不同细胞。另外,四个副句,LePT1,LePT2,LePT6而且LePT7,在低磷供给条件下菌根中表达极显著下调。
结论
本研究结果为研究番茄Pht1基因在磷缺乏症和菌根共生中的进化扩展、功能分化和遗传冗余提供了新的思路。
背景
磷(P)是植物最必需的三种宏量营养素之一。它被公认为具有广泛的结构和生物学作用,如能量代谢、信号转导、大分子生物合成、呼吸调节、光合作用和其他代谢过程[1].植物吸收磷的主要来源是土壤中的正磷酸盐。由于磷的扩散速度慢和化学固定,人们普遍认为磷是植物最难寻找的营养物质之一,往往是作物产量的主要限制因素[2,3.].
土壤溶液中的Pi浓度通常不超过10 μM,而植物细胞需要将细胞质中的Pi浓度维持在毫摩范围内[4,5],这决定了植物从土壤中获取磷所需的代谢能和特定运输系统[6,7].在过去的几十年里,通过对模式植物的分子生物学和功能基因组学的系统研究,人们积累了大量关于植物体内磷转运机制的知识,揭示了植物体内磷的吸收和随后的再分配是由位于等离子体或细胞器膜上的多个具有不同亲和力的磷酸盐转运体介导的[8].
第一个编码植物Pi转运蛋白的基因(AtPT1)被分离到拟南芥[9的高亲和力Pi转运蛋白编码基因序列一致酿酒酵母(Pho84) [10),在血管球versiforme(GvPT) [11].后来的研究进一步导致分离出其他八个同系物,这些同系物显示出与AtPT1在拟南芥基因组(12],表明在进化过程中,Pi转运体基因在高等植物中扩增。到目前为止,随着全基因组分析的完成,模型植物,如拟南芥在水稻中,通过比较基因组方法已在各种植物物种中鉴定出数十个编码不同亲和性和Pi转运蛋白组的同源基因[13].对蛋白序列和系统发育关联性的研究表明,目前鉴定的大多数Pi转运蛋白是典型的H+/Pi转运体,可归为高亲和力Pht1家族,包括在超级促进物超家族(MFS) [14- - - - - -16].
早期关于Pht1调控和组织/细胞分布的研究表明,许多物种中的Pht1家族成员在功能上存在差异,在植物发育过程中或在对不同P状态的响应中表达差异[17,18].根系中,特别是根表皮和根毛中,一些Pht1基因的转录本或蛋白水平相对较高,对磷缺乏的响应很好地支持了这些基因在磷捕获和吸收中的作用[19,20.].例如,在拟南芥9个Pht1基因中的8个在根和两个成员中表达,AtPT1而且AtPT4,对磷缺乏症的反应表达水平最高。敲除这两个基因中的任何一个都表明,在低磷供应条件下,对磷的吸收存在显著缺陷[21,22].在某些情况下,一些Pht1成员的转录本在植物组织中分布更广泛,对磷缺乏的反应较少,这为支持某些Pht1成员可能参与了磷的内部动员,如从木质部或韧皮部加载或卸载,沉积到种子或其他存储器官提供了强有力的证据[19,23- - - - - -25].除了响应Pi的Pht1基因外,越来越多的丛枝菌根诱导的Pi转运体属于Pht1家族,它们的功能已被反复证实与根内共生界面的Pi吸收有关[26- - - - - -33].
番茄是茄科的一种植物,由于其相对低拷贝的DNA序列和近乎完整的基因组测序,不仅是世界上主要的蔬菜作物植物,而且是生物学和遗传学研究的模式植物[34].尽管先前的研究已经确定了番茄中个别Pht1成员的潜在作用[30.,35],迄今为止还缺乏对番茄和其他茄科植物中Pht1基因家族的全基因组分析。而且,与其他模式物种相比,如拟南芥从芸苔科和稻科,茄科Pht1基因在Pi的获取和动员中的进化机制、转录调控和可能的功能仍有待进一步研究[36- - - - - -39].
本文报道了番茄和马铃薯中Pht1家族基因的全基因组鉴定和比较表征,并进一步研究了番茄Pht1基因在低磷和高磷条件下对AM真菌接种响应的表达规律。本研究主要对番茄Pht1家族各成员的染色体组织、系统进化、组织特异性表达和调控进行分析。本研究结果不仅有助于加深我们对番茄Pht1基因进化扩展、保守和功能分化的分子机制的认识,而且为进一步开展茄科全科的基因组比较研究提供了有价值的线索。
结果
番茄Pht1家族基因的鉴定
此前,已有5个Pht1基因(3个全长,2个部分mRNA序列)编码番茄高亲和力磷酸盐(Pi)转运体(PT)的报道[30.,40].为了确定番茄Pht1家族中是否还有其他尚未确定的成员,我们对其mRNA和氨基酸序列进行了分析拟南芥利用水稻Pht1基因对最近发布的番茄基因组序列数据库进行BLASTN和TBLASTN搜索(http://solgenomics.net/),结果共识别出8个非等位基因序列作为假定的番茄Pht1基因(附加文件1).对这些序列在NCBI数据库中的BLAST搜索表明,8个序列中有5个与加入的番茄Pht1基因相同,LePT1来5.其余三个假定基因(命名为LePT6来8),显示出与番茄和其他植物物种中已知的Pht1基因高度的序列一致性(表1).此外,LePT6,表示一个不同的位点,其编码序列与已知的相同LePT2,但在两个同源体之间的非翻译区域有很大差异(附加文件2).
结果表明,8个Pht1蛋白包含528-538个氨基酸,12个预测的跨膜旋转结构域,与其他植物Pht1转运蛋白的分子特征相似。此外,所有的番茄Pht1氨基酸序列都共享蛋白激酶C和酪蛋白激酶II磷酸化的共识位点,以及n -糖基化的保守残基(图1).使用DNAMAN多序列比对程序,保守结构域GGDYPLSATIxSE被认为是Pht1蛋白的典型特征,也在所有这些蛋白中被识别出来(图1).这些发现表明,所有被识别的基因都可以被认为是番茄的Pht1基因。
预测了8个番茄Pht1基因的氨基酸序列LePT1来8.序列比对分析采用DNAMAN 7.0程序内的多重比对算法(http://www.lynnon.com/).相同的氨基酸用阴影表示,间隙用圆点表示。蛋白激酶C和酪蛋白激酶II磷酸化的共识位点由两个红色箭头所示,保守的n -糖基化残基由绿色箭头所示。标记了Pht1特征特征。用Toppred算法(http://bioweb.pasteur.fr/seqanal/interfaces/toppred.html).
对NCBI、SGN和TIGR数据库的番茄EST数据库进行进一步的爆炸搜索发现,除了LePT8,另外两个新发现的Pht1基因,LePT6而且LePT7,可以与至少一个重要的EST序列完美匹配,这表明这两个基因,就像之前报道的五个副基因一样,在特定的组织中具有转录活性。还应该强调的是,除了上面提到的8个Pht1基因,另一个序列(命名为LePTx在本研究中)鉴定出的番茄支架数据库的搜索也显示出对番茄的高度认同LePT7而且LePT8基因,但可能是不活跃的,因为包括一些无意义的突变和索引(插入和删除)在其假定的编码区域(附加文件3.),以及缺乏任何精确匹配的EST序列。
马铃薯中番茄Pht1同源基因的鉴定及两个茄科基因组的比较分析
由于最近在SGN数据库中也获得了一套近乎完整的马铃薯基因组序列[41],为了进一步研究两种茄科植物之间Pht1基因家族的进化保守性和差异,以番茄Pht1基因为查询对象,对马铃薯基因组序列数据库进行了广泛的搜索,最终确定了10个不同的基因作为马铃薯Pht1基因(附加文件4).对马铃薯的Pht1基因进行序列比较,发现其氨基酸大小与番茄的相应同源基因相似,且具有较高的序列一致性4而且5).值得注意的是,在马铃薯基因组中还有另外两个序列与植物的Pht1基因有很大的同源性,但可能是假基因(命名为StPTx1而且StPTx2,分别),这是因为存在一些无意义的突变,以及在其假定的编码区域内包含了一些索引(插入和删除)。
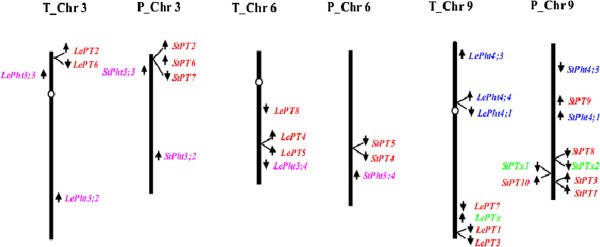
与番茄和马铃薯的Pht1成员之间的高度序列一致性相似,两个茄科物种的Pht1同源体染色体组织高度保守。数字2显示了Pht1基因在番茄和马铃薯染色体上的定位。结果表明,番茄和马铃薯的Pht1基因分布明显不均匀,仅集中在两种植物的3条染色体上(3,6,9)。此外,假定的三个假基因(LePTx,StPTx1而且StPTx2)被限制分配在两株植物的第9染色体上。有趣的是,除了一些个体成员,比如LePT8在番茄6号染色体和StPT9在马铃薯9号染色体上,对应染色体上的其他Pht1基因/假基因大多以簇状分布,物理距离很短1,图2),提示这些聚类基因可能是在茄科Pht1基因家族进化过程中由独立的串联复制产生的。
除了Pht1基因本身,每个Pht1成员周围的潜在基因也被仔细研究,结果确定了几个假定的基因在相应染色体上表现出与植物Pht3和Pht4家族基因的实质性同源性(图2).通过比较这些基因的位置,比如LePht3; 4而且StPht3; 4,我们证实了番茄/马铃薯6号和9号染色体长臂上存在两个片段倒置,导致了两个物种之间对应染色体区域上PT4/PT5和PT1/PT3的同源对线性顺序颠倒(图2).
番茄和其他植物中Pht1基因家族的系统发育分析
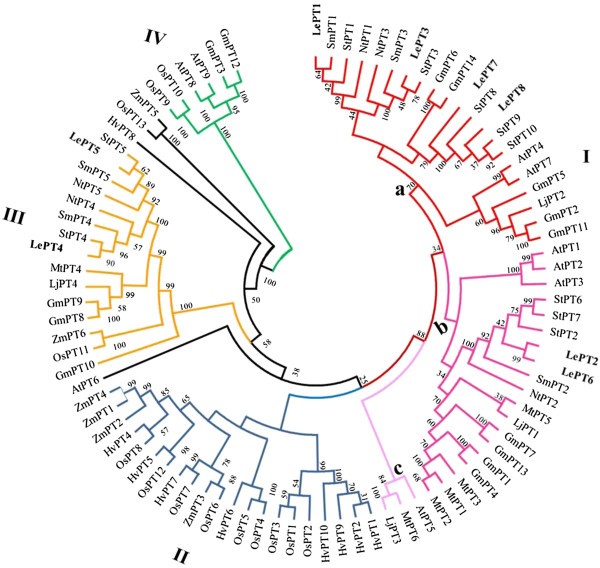
为了全面分析番茄与其他植物物种之间Pht1基因的进化关系,包括番茄的8个Pht1蛋白,我们对来自禾本科、芸苔科、豆科和茄科4个植物科11个物种的共90个植物Pht1蛋白序列进行了比对,并构建了无根系统发育树。如图所示3., AtPT6除外拟南芥邻近连接树中的其他植物Pht1蛋白均被很好地聚为4个不同的类群,包括一个双子叶特异性类群(I)、一个单子叶特异性类群(II)和两个混合类群(III和IV),成员分别来自双子叶和单子叶。
番茄Pht1基因与其他植物Pht1同源基因的系统发育分析。利用MEGA 5.0程序近邻连接法构建了植物Pht1蛋白的无根系统发育树。转运蛋白和对应的植物种类是:番茄,LePT1到8 [30.,42),本研究;马铃薯,StPT1 ~ 10 [30.,43,44),本研究;烟草,NtPT1至5 [45,46];茄子,SmPT1到5 [45,46];拟南芥, AtPT1到9 [47];Medicago truncatula, MtPT1至6 [8,48,49];Lotus对虾, LjPT1至4 [31,50];大豆,GmPT1 ~ 14 [13];水稻OsPT1 ~ 13 [28];大麦,HvPT1 ~ 12 [14,51];玉米,ZmPT1 ~ 6 [18,29].
类群I只包含双子叶植物的蛋白质,根据系统发育将其分为三个亚群(分别命名为a、b和c亚群)。此外,除了亚群c(三个物种各只有一个成员)之外,拟南芥,Medicago而且Lotus对虾,另外两个亚群a和b都包含多个Pht1成员,来自豆科、芸苔科和茄科三个植物科。对于番茄来说,8个Pht1转运蛋白(LePT1 - 3和LePT6 - 8)中的6个属于三个亚群中的两个。在亚群a中,两个番茄成员,LePT1和LePT3,与其来自马铃薯、茄子和烟草的同源对组合在一起,而不包括其他两个副同源,LePT7和LePT8,它们与其他三个马铃薯同源物组合在一起,并与两个大豆同源物GmPT6和GmPT14形成集群。在双子亚群b中,两个番茄副基因,LePT2和LePT6,紧密地组合在一起,并与三个马铃薯同源基因,StPT2, StPT6和StPT7聚集在一起。LePT2和LePT6的分组是预期的,因为这两个副序列包含相同的编码序列。剩下的两个副歌,LePT4而且LePT5虽然第IV组也包含双子代和单子代的成员,但只属于第III组。在第三组中,这两个基因,就像它们的两个副手LePT1而且LePT3在第I组中,也与其他茄科同源植物组合在一起,形成一个独立的茄科分支,包括两个亚纲。这两个亚类都含有来自番茄、马铃薯、茄子和烟草的PT4或PT5的同源对,表明与PT4和PT5以及番茄和其他茄科物种中PT1和PT3的产生相关的复制事件发生在茄科谱系形成之前。此外,III组中的大部分Pht1蛋白,包括PT4和PT5同源对,已被实验证明在丛枝菌根(AM)真菌定植的根中被强烈诱导[8].此外,Pht1成员来自拟南芥,其中的根无法形成AM共生,在第III组中均不存在。有趣的是,尽管第四类群的成员比其他三类群少得多,但三个物种各有两名成员,拟南芥但在第IV组中没有任何一种茄科植物的同源物,这表明在茄科与芸苔科和豆科分离后,茄科植物谱系中相应的同源物已经丢失。
低磷条件下番茄Pht1基因在不同组织中的表达分析
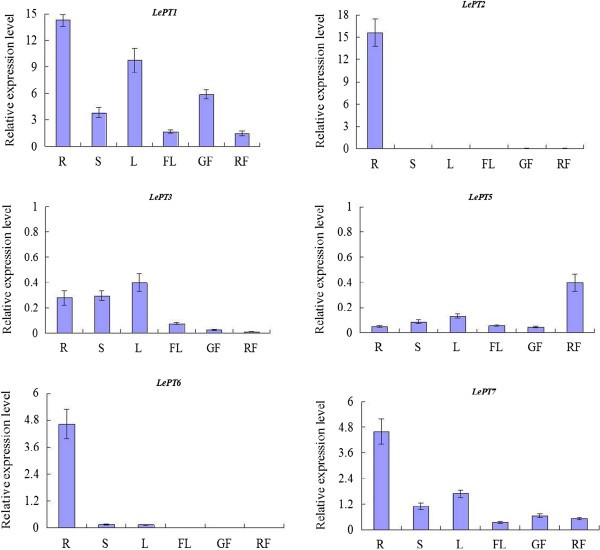
为了更好地了解番茄中特异性Pht1基因可能的功能,本研究采用Real-time RT-PCR技术,检测了番茄各Pht1基因在根、茎、幼叶、花以及幼熟果实等不同组织中的组织特异性表达模式。定量数据表明,除LePT4而且LePT8,其中的转录本在所有被检测的组织中均未检测到,而其他Pht1旁基因的转录本在某些组织中均可检测到,并表现出明显但部分重叠的表达谱(图4).
LePT1在所有被检测的组织中都有表达,其转录本大量存在于根和叶中,少量存在于茎和花以及果实中。的成绩单LePT1绿色水果中的含量是成熟水果中的四倍。相比之下,无处不在的表达谱LePT1的表达式。LePT2表现出相对明显的组织特异性,其转录本集中在根中,在其他一些组织中极微弱,如在绿色和成熟的果实中。的表达模式LePT3而且LePT5有一点相似,因为这两种基因在所有组织中都表达得很弱。即便如此,最高的记录水平公爵在成熟水果中检测到5,约为绿色水果的10倍。LePT6最亲密的伙伴LePT2在系统发育中,也主要表达在根中,但表达量仅为的三分之一LePT2在根组织中。此外,该基因在茎和叶中也检测到非常弱的转录水平。LePT7也在所有组织中广泛表达,有非常相似的表达倾向,但在所有组织中的表达水平明显低于它的副手,LePT1(图4).Pht1基因的差异但重叠表达很好地反映了番茄植株中Pht1转运体的进化保守和功能分歧。
番茄Pht1基因在高、低磷条件下对AMF定植的响应表达分析
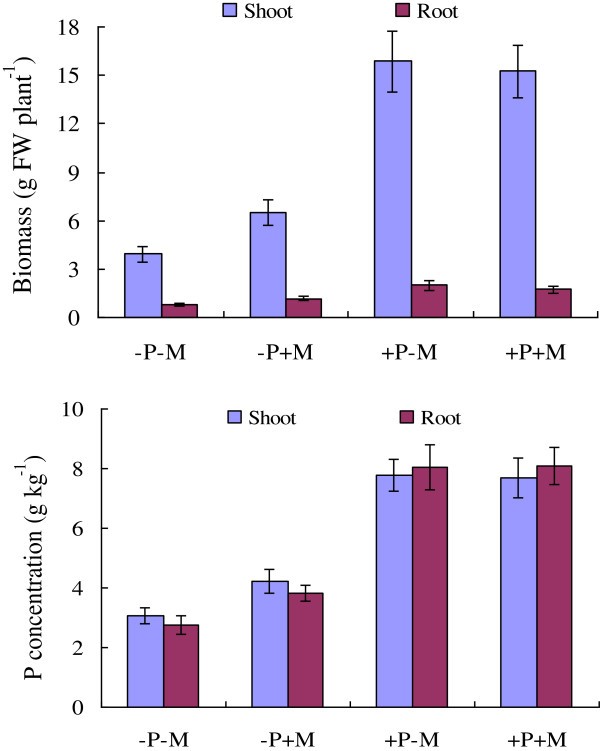
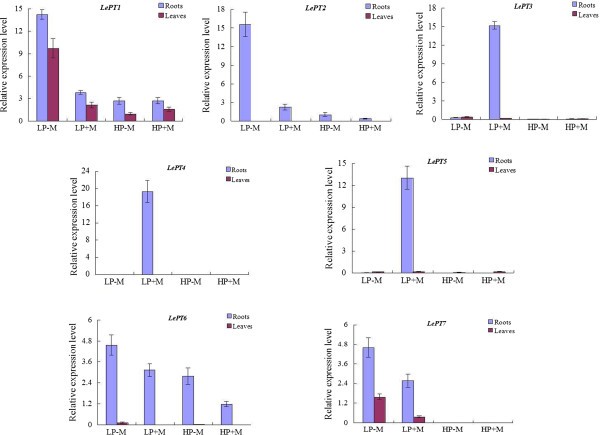
由于一些Pht1基因在番茄和其他植物中的表达被认为是am诱导和pi响应的[21,52],从而进一步确定番茄根和叶中各Pht1成员的相对表达量,以响应AM真菌(血管球intraradices)在低(50 μM)和高(1 mM) Pi供应条件下定植。如图所示5在低磷条件下,AM真菌的定殖不仅提高了番茄植株的生物量,而且提高了磷的浓度;而在高磷供给条件下,定植植株与非定植植株的生物量和磷浓度均无显著差异。
qRT-PCR分析结果显示,除三个副语外,LePT3,LePT4而且LePT5,其中转录本仅在低磷供给条件下在接种根中被强烈增强或特异性激活LePT8,其中的转录本在任何处理下都无法在两种组织中检测到,其他四个副基因的表达,LePT1,LePT2,LePT6而且LePT7,在高Pi供应条件下显著被抑制(图6).这种下调的情况在两个副句中更为明显,LePT2而且LePT7,因为它们在根和叶组织中的转录本都急剧减少(LePT2)甚至完全不存在(LePT7)在高Pi条件下,无论是否有AM定植。此外,在低磷供给量条件下,定植番茄植株的根和叶中,与非定植对照相比,4个副基因的转录丰度也显著下降(图6).这四种分子对高磷供应和amf定殖反应的显著下调可能部分是由于处理后番茄植株中磷浓度显著增加所致(图5).有趣的是,尽管LePT2而且LePT6被认为是番茄Pht1家族中最接近的基因,因为它们的编码序列相同,LePT6在低磷条件下,根系对AM共生的响应要温和得多LePT2.这种表达水平的差异强烈提示调控成分控制激活或抑制LePT2而且LePT6在一个相对较近的重复事件产生的两个副句之后产生了分歧。
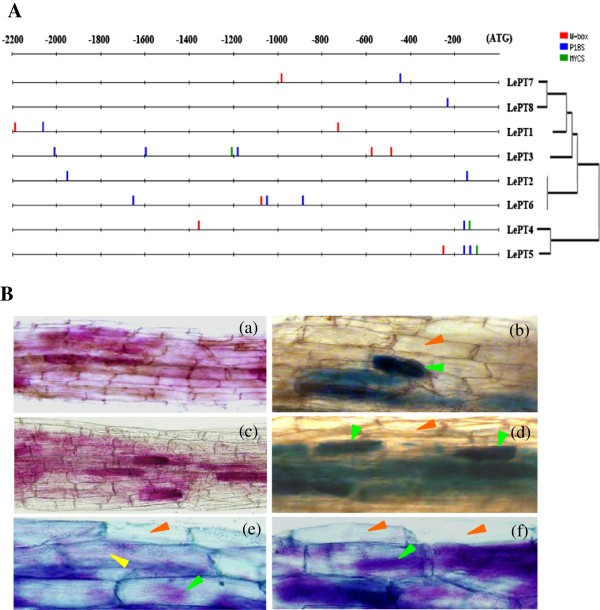
番茄Pht1基因在AM共生或不同Pi状态下的特异性表达谱促使我们对其启动子区域进行研究。如图所示7A,两个pi调节(P1BS和W-box)的数量和定位[53,54]和一个am响应元件(MYCS) [45,55]在这8个Pht1基因的启动子区域差异很大,即使一些副基因的编码序列和表达谱高度保守。然而,与其他双子叶植物中am诱导的Pht1基因相似,MYCS基序被发现只存在于三个am激活的Pht1旁基的启动子区域,LePT3,LePT4而且LePT5,与pi调控的P1BS元件非常接近[45].组织化学染色分析进一步显示LePT3而且LePT5启动子区域(pLePT3-1250年而且pLePT5-471年含有MYCS和P1BS这两种元素的真菌,足以在菌根根中特异性地指导β-葡糖苷酸酶(GUS)的表达,并且仅限于含有AM真菌结构(丛或细胞内菌丝)的不同细胞(图)7B),类似于先前报道的来自其他各种植物物种的LePT4和其他am诱导Pht1同源物的细胞分布[30.,55- - - - - -57].
番茄Pht1基因启动子的分析。(一)假定的比较分析独联体-调控元件负责Pi-和am调节八个番茄Pht1启动子之间的表达。使用dna模式匹配算法(DNA-pattern matching algorithm) (http://rsat.ulb.ac.be/rsat/).P1BS GNATATNC;myc TTCTTGTTC;W-box TTGACY。(B)对两个am诱导的Pht1成员启动子活性的组织化学分析,LePT3而且LePT5.(模拟)β-葡糖苷酸酶(GUS)活性定位(一个而且b洋红色的格斯;c而且d,蓝色GUS)在菌根的启动子驱动下LePT3(a, c)而且公爵5(b, d),分别。(e, f)GUS活性的共定位(用紫色表示,从品红-GUS和台潘蓝染色的覆盖)表明LePT3而且LePT5启动子片段(pLePT3-1250年而且pLePT5-471年)足以指导GUS在菌根中的表达,并且仅限于含有AM真菌结构(丛枝或细胞内菌丝)的不同皮层细胞。绿色箭头表示丛枝状或丛枝状菌丝,黄色箭头表示胞内菌丝,红色箭头表示非定植细胞。
讨论
在最近的研究中,得益于模型植物全基因组序列的可用性,使用比较基因组方法从各种植物物种中鉴定出数十个编码高亲和力Pi转运蛋白的基因,它们属于Pht1家族。番茄是茄科的模式物种,历史上被认为至少有5个Pht1基因[58].我们目前的研究,通过对现有数据库的广泛搜索,导致在番茄基因组中总共识别了8个假定的Pht1基因。由于这是对茄科植物Pht1基因家族的首次全基因组分析,本研究对番茄Pht1基因的染色体组织、进化关系以及表达模式的研究具有重要意义,将为更好地理解整个茄科植物Pht1基因的扩展、保存和功能分化的进化机制提供基础。
番茄Pht1基因的进化扩展
一般来说,多基因家族可以通过串联复制产生聚集性,也可以通过基因组/片段复制产生家庭成员的离散分布[59].由于大多数番茄Pht1基因都是集群分配的(如PT1/PT3, PT2/PT6和PT4/PT5),不仅物理定位非常接近(图2),但也有非常高水平的序列标识(表1额外的文件5),这强烈暗示串联复制可能是番茄Pht1家族扩展的主要贡献者。此外,由于大多数番茄Pht1成员通过形成独立的茄科分支而排斥其他双子体同源体,从而与其他茄科物种(如马铃薯、茄子和烟草)的同源体组合在一起(图3.),表示与出现的耦合副句相关的重复,如PT1/PT3而且PT4/PT5在茄科物种中,发生在来自一个共同祖先的茄科谱系形成之前。有趣的是,在观察番茄的定位时LePT2/6和土豆StPT2/6/7在它们对应的染色体上,很容易得出一个有倾向性的结论,即复制产生了番茄LePT2而且LePT6可能发生在西红柿和土豆分裂之前。然而,分布的LePT2而且LePT6在系统发育树的末端子分支中,它们共享的相同的编码序列很好地反映了两个副序列是由番茄谱系中发生的更近的复制事件产生的,这些复制事件发生在番茄谱系从马铃薯共有的一个共同祖先分裂后。
最近有文献记载,茄属植物谱系基因组经历了两轮连续的全基因组三重复制事件,一轮是古老的,与大多数双子叶植物科共享,另一轮是较近的,发生在番茄和马铃薯谱系分化之前[34],这导致了基因组多倍体产生的片段复制可能对Pht1家族的扩展也有重要影响的假设。的位点LePT2/6在染色体3上LePT4/5在第6号染色体两侧分别有两个副染色体,LePht3; 3而且LePht3; 4(与Pht1基因不同源)(图2)强烈提示PT2/PT6和PT4/PT5这两对染色体的产生可能源于一个片段复制,随后是两个独立的随机复制,最终导致两对Pht1成员固定在3号和6号染色体上。在系统发育树中,当PT4和PT5副株与双子叶和单子叶的其他成员聚集在一起时(图3.),表明产生两对亲本PT2/PT6和PT4/PT5前体的片段复制发生在单子代和双子代分化之前。至于其他四个副句,群句LePT1而且LePT3,和个人LePT7而且LePT8,它们可能是发生在番茄和马铃薯系系形成之前的几个相对较近的片段或单基因复制事件的结果,随后发生了至少一个独立的随机复制事件(产生了两个副基因,LePT1而且LePT3).有充分的文献证明,基因组多倍体通常伴随着大量染色体重排[60].在我们的研究中,通过比较番茄和马铃薯Pht1基因的系统发育树和染色体分布,在两个茄科基因组之间发现了导致PT1/PT3和PT4/PT5线性顺序不一致的两个片段倒置,很好地支持了最近的发现,即在番茄和马铃薯谱系之间存在至少9个大的和几个小的倒置[41].
番茄Pht1基因家族的功能保守与发散
人们普遍认为,基因复制之后的功能分化在推动进化的新颖性方面发挥了关键作用,使植物增加了对新环境的适应性[47].根据资料,由于缺乏对任何茄科植物中Pht1基因的全基因组调查,目前还没有对番茄Pht1家族组织特异性表达模式的系统分析。在我们目前的工作中,我们发现Pht1基因的差异但部分重叠表达发生在番茄中,这个家族的成员也发生在其他几种植物物种中,如拟南芥,大米和大豆[13,28,43].这些基因的特化表达很好地反映了在番茄植株生长过程中,控制磷的吸收和在特定组织或细胞内调动所需的调节元件的进化差异。
基于Pht1基因在几个不同植物科的组织特异性表达和细胞分布研究的早期结果显示,许多Pht1基因主要在根系中表达,特别是在根表皮和根毛中,以应对磷的剥夺,这表明这些基因在磷的捕获和吸收中具有潜在作用[12,19].本研究获得的转录数据确实为低磷供给条件下番茄大部分Pht1基因在根系中强表达提供了直接证据(图6).这表明,尽管抄本LePT1在根和叶中,对Pi充分性的响应显著降低,在整个植株中可以检测到低水平的本构表达,与其同源物的表达模式一致,StPT1,在potato中[46),这表明LePT1其同源物可能不仅涉及从土壤溶液中吸收磷,而且还涉及植物内部的磷再分配。LePT2以前的文献表明,它只在缺磷根中表达。然而,在本研究中,在高Pi (1 mM)溶液灌溉的根中可以检测到一个相对较弱但仍然可以观察到的转录水平,从我们之前的研究中也可以观察到类似的结果LePT2其他三种茄科植物,茄子,辣椒和烟草的同源物[61].另外,非常轻微的LePT2在低磷条件下,青熟期茎、花和果实中均可检测到转录本。虽然公爵2的编码序列与它的对偶相同,公爵6、无论是在低Pi供应条件下,还是在AM共生条件下,这两个成员的转录丰度都有显著差异。这可能是由于P1BS和W-box等pi响应元件在其启动子中的分布不一致造成的7) (53,54,62- - - - - -64].即便如此,相同的蛋白活性和高度重叠的表达强烈暗示了两个成员之间存在功能冗余。
关于三个am激活的Pht1旁对话,LePT3,LePT4而且公爵5,因为它们的转录本只有在低Pi条件下才会在接种根中大量诱导,而在高Pi条件下则不会,这与烟草、辣椒和茄子中它们的同源物的表达相似,表明am激活的表达LePT3-5,就像它们的茄科同源物一样,也可能由至少两个保守分子调节独联体-元素,P1BS和MYCS [45].对比筛选番茄Pht1基因的启动子区域确实导致了两个motif的识别,这两个motif在三个am激活的Pht1基因的启动子中紧密且专门定位(图7A).与水稻等许多其他菌根植物相比,am诱导的Pht1基因在茄科植物中存在/保留的比例较高,在一定程度上反映了这些基因在茄科进化过程中调节共生的重要性。此外,这些共生激活的Pht1基因的强表达水平,与菌根根中负责磷直接吸收的磷转运体的显著下调形成对比,也为早期的研究结果提供了强有力的证据,即共生吸收途径贡献了菌根番茄和其他植物吸收的大部分累积磷[65- - - - - -67].值得注意的是,尽管LePT4是低Pi条件下番茄菌根中表达量最高的基因(图6),变异的LePT4AM共生关系的建立几乎不受影响[30.,40],这似乎与最近敲除/敲除am特异性或上调的Pht1基因的研究结果相矛盾Lotus对虾,Medicago而且紫云英显著损害AM相互作用的发展和共生磷的吸收[31,55,68].番茄中缺乏am相关表型lept4敲除突变体可能是番茄Pht1基因家族中的基因冗余[30.,69].因此,这种解释可能是合理的LePT4以及am诱发的副相声,LePT5,被认为是通过随机复制从一个共同的前体分离出来的(图2),因此也就不足为奇LePT5有相似的生理作用吗LePT4在番茄。有趣的是,虽然存在两个am特异性的Pht1基因,但强烈激活OsPT11和诱导OsPT13,在水稻Pht1家族中,两个旁基之间没有观察到功能冗余,因为沉默两个旁基中的任何一个都会导致AM共生的显著抑制[70].由于水稻OsPT11和OsPT13在系统发育树中分布相对较远,与茄科植物PT3和PT4/PT5的系统发育关系相似,我们很容易猜测Pht1转运蛋白的两组(PT3和PT4/PT5)在调节AM共生发展过程中可能不存在功能冗余。
有趣的是,在其他一些植物物种中,如大豆,存在着专门的Pht1成员,主要在汇组织中表达,如在花中,这暗示了这些基因在Pi从源到汇输入中的可能功能[13,71].然而,在我们目前的研究中,我们没有观察到番茄Pht1家族中的任何成员主要表达在花或果实组织中。相对较高的转录水平LePT1而且LePT7在这些沉陷组织中比较其他六个副譬喻导致了这两个成员的暗示,尤其是LePT1,可能是为了满足从源到汇器官或细胞运输Pi的要求。基因复制的潜在进化命运之一被认为是使其中一个副本沉默(非功能化)[72].的失活LePT8在所有的组织中都显示出LePT8可能就要变成假基因了。在番茄和马铃薯基因组中,有几个片段与植物Pht1基因具有高度同源性,但编码区域不完整,这也很好地支持了基因组多倍体化以及以下基因丢失(二倍体化)是植物基因组的共同特征的理论[73,74].
结论
综上所述,本研究首次对番茄Pht1家族每个成员的染色体组织、系统进化和组织特异性表达模式进行了全面分析。本研究结果为进一步研究Pht1基因在番茄生长过程中响应缺磷和AM共生的进化调控机制提供了有益的基础。番茄和马铃薯的Pht1同源体不仅在编码序列上高度保守,而且在染色体分布上也高度保守,这也为进一步开展茄科植物全科的比较基因组学分析提供了有力的证据。然而,我们也认识到,尽管Pht1家族通常被认为是一个高亲和力的Pi转运蛋白家族,但在其他植物物种中,该家族越来越多的成员已被证明对异源酵母或卵母细胞表达系统中的Pi摄取具有低亲和力甚至双重亲和力[75,76].因此,在不久的将来,需要更多的信息,特别是敲除/敲除突变体的运输动力学、细胞分布和生理表型,以确定每个番茄Pht1基因更精确的功能作用。
方法
植物材料和生长条件
番茄(茄属植物lycopersicum简历。Micro-Tom),在本研究中使用。用1/2 MS + 1.5%蔗糖培养基对种子进行表面杀菌、发芽、组织培养3周。然后将无菌苗转移到盆栽中进行高/低磷处理或接种AM真菌。
在盆栽栽培中,两个植株移植到一个3dm3.塑料壶装满消毒过的沙子。沙基接种剂含有血管球intraradices(胃肠道)是用来接种的。每株植株根部周围接种5 g接种剂或蒸压接种剂。植物生长在光照14小时(28-30°C)和黑暗10小时(18-20°C)的生长室内。灌溉液中含有以下营养物质:1 mM NH4没有3., 2毫米KNO3., 0.5 mM Ca(NO3.)2, 0.25 mM CaCl2, 0.5 mM MgSO420 μM Fe-EDTA, 9 μM MnCl2, 46 μm h3.薄3., 8 μM ZnSO4, 3 μM CuSO4, 0.03 μm (nh4)2MoO41 mM(高磷处理)或0.05 mM Pi(低磷处理)NaH2阿宝4.每个处理设4个重复。接种6周后,收集植株的根、茎和幼叶样本,或继续生长,收集幼嫩和成熟阶段的花和果实样本。收集的样品立即在液氮中冷冻,并在-80°C保存,用于后续的RNA分离。
番茄和马铃薯基因组中Pht1基因的鉴定
利用BLAST 2.2.27+应用程序中的BLASTN和TBLASTN算法对番茄基因组中的Pht1基因家族成员进行了鉴定。目的:鉴定番茄基因组中潜在的Pht1基因,并对其进行编码序列(cds)和推导出的蛋白序列拟南芥分别在番茄基因组序列数据库(Solanaceae Genomics Network)下载的番茄基因组序列数据库(http://www.sgn.cornell.edu).查询大于50%且e-value小于-10的序列作为Pht1候选序列。所有获得的序列提交给NCBI (http://www.ncbi.nlm.nih.gov/)和Pfam数据库(http://www.sanger.ac.uk/Software/Pfam/search.shtml)作进一步的确证分析。为了染色体定位分析,番茄Pht1候选基因进一步被用作针对SGN番茄全基因组支架数据的BLASTN搜索查询(2.40)(http://solgenomics.net/organism/Solanum_lycopersicum/genome).
为了从马铃薯基因组中寻找番茄Pht1基因的潜在同源物,从SGN数据库(http://solgenomics.net/organism/Solanum_tuberosum/genome)也使用番茄Pht1基因作为查询进行了广泛的搜索。马铃薯Pht1基因的命名部分基于它们与番茄同源基因的系统发育关系。
系统发育分析
本研究使用的序列数据是在NCBI数据库中使用已知的Pht1家族基因序列进行查询搜索收集的拟南芥和米饭。使用ClustalX(版本1.8)程序执行多个序列对齐,并使用默认间隔惩罚。利用MEGA 5.1系统发育程序中的邻居连接算法推导出Pht1基因的氨基酸序列,生成了无根系统发育树(http://www.megasoftware.net).进行了1000次重复的Bootstrap分析。
RNA提取和实时RT-PCR分析
总RNA从100 mg的各种组织样本中分离,包括根、茎、幼叶和花,使用Trizol试剂的硫氰酸胍萃取法(Invitrogen),从水果样本中使用ctaba -酸酚萃取法(Chang [77].提取后的RNA样品经DNA酶ⅰ(DNase I, TaKaRa)处理,去除基因组DNA的微量污染物。为了进行逆转录(RT) PCR分析,我们从每个样品中提取约2微克的总RNA,使用反转录试剂盒(TaKaRa)合成第一链cDNA,并将合成的cDNA作为模板用于后续的PCR反应。
采用Real-time RT-PCR方法,相对定量分析番茄不同组织或根、叶对菌根定植在高、低磷状态下的Pht1基因表达量。在应用生物系统公司(ABI) Plus Real-Time PCR系统上使用SYBER预混ExTaq试剂盒(TaKaRa)进行反应。每个番茄Pht1基因转录本的相对定量标准化到番茄本构的表达水平肌动蛋白由公式Y = 10计算——(ΔCt / 3)× 100% (ΔCt为目标Pht1基因与对照的周期阈值差值肌动蛋白(产品)47,78].qRT-PCR引物设计的特异性(附加文件6)经PCR反应后测序证实。
组织化学GUS染色及菌根真菌定植检测
1250年英国石油公司LePT3启动子片段和471 bpLePT5扩增翻译启动子ATG上游的启动子片段,分别克隆到二元载体pBI12中,以取代β-葡糖苷酸酶(GUS)基因前的CaMV35S启动子。得到的两个构念被指定为pLePT3-1250年而且pLePT5-471年,分别引入根癌土壤杆菌菌株EHA105进行遗传转化。
如前所述,对新鲜转基因根进行组织化学GUS染色[44].为了显示真菌结构,将Magenta-GUS染色的根段用10% KOH溶液加热到90°C处理1 h,然后用1% HCl (v/v)溶液中和5 min。然后用0.3%台虫蓝溶液在90°C反染2 h。Magenta-GUS和台盼蓝的共定位用紫色表示。染色材料用50%的甘油冲洗,并用带有彩色CCD相机(Olympus)的立体显微镜拍摄。
缩写
- PT:
-
磷酸盐转运蛋白
- 美国东部时间:
-
表达序列标签
- 问:
-
丛枝菌根
- AMF:
-
丛枝菌根真菌
- Indels:
-
插入和删除。
参考文献
- 1.
孟格尔·K,柯克比·EA:植物营养学原理。荷兰,Dordrecht: Kluwer学术出版社,2001。
- 2.
Abel S, Ticconi CA, Delatorre CA:高等植物的磷酸盐感应。植物工程学报,2002,29(3):347 - 347。10.1034 / j.1399-3054.2002.1150101.x。
- 3.
顾明,徐坤,陈安魁,朱媛媛,唐国光,徐广华:表达分析表明,在丛枝菌根信号转导和磷酸盐方面,microrna具有潜在的作用茄属植物lycopersicum.植物工程学报,2010,38(4):326 - 326。10.1111 / j.1399-3054.2009.01320.x。
- 4.
沙赫特曼·DP,里德·RJ,艾林·SM:植物对磷的吸收:从土壤到细胞。植物生理学报,1998,16(4):447-453。10.1104 / pp.116.2.447。
- 5.
Smith SE, Jakobsen I, Grønlund M, Smith FA:丛枝菌根在植物磷营养中的作用:丛枝菌根吸收磷途径之间的相互作用对理解和控制植物磷的获取具有重要意义。植物生理学报,2011,29(3):366 - 366。10.1104 / pp.111.174581。
- 6.
哈里森·MJ:丛枝菌根共生中的信号。微生物学通报,2005,50:361-389。
- 7.
Raghothama KG, Karthikeyan AS:磷酸盐捕获。植物生态学报,2005,27(4):347 - 347。10.1007 / s11104 - 004 - 2005 - 6。
- 8.
贾沃特·H, Pumplin N,哈里森·MJ:磷酸盐在丛枝菌根共生中的转运特性和调节作用。植物细胞环境学报,2007,30:310-322。10.1111 / j.1365-3040.2006.01617.x。
- 9.
Muchhal US, Pardo JM, Raghothama KG:来自高等植物的磷酸盐转运蛋白拟南芥.《医院护理》1996,93:10519-10523。
- 10.
本雅M,西村M,原岛M,原岛S,大岛Y:酿酒酵母的PHO84基因编码一种无机磷酸盐转运蛋白。中国生物医学工程学报,1998,21(3):369 - 369。
- 11.
ML:菌根真菌中的磷酸盐转运体血管球versiforme.自然学报,1995,378:626-629。10.1038 / 378626 a0。
- 12.
Mudge SR, Rae AL, Diatloff E, Smith FW:表达分析表明磷酸转运蛋白Pht1家族成员在拟南芥.植物学报,2002,31:341-353。10.1046 / j.1365 - 313 x.2002.01356.x。
- 13.
秦丽,郭云霞,陈丽丽,梁荣坤,顾明,徐光华,赵娟,沃涛,廖红:酵母14个Pht1家族基因的功能特征及其在大豆营养饥饿响应中的表达。科学通报,2012,7:e47726-10.1371/journal.pone.0047726。
- 14.
Rae AL, Cybinski DH, Jarmey JM, Smith FW:大麦中两个磷酸盐转运体的表征;Pht1家族成员之间的不同功能和动力学特性的证据。植物生物学杂志,2003,32(3):366 - 366。
- 15.
Preuss CP,黄春阳,Tyerman SD:大麦根质膜转运体HvPHT1在Xenopus中的异源特性揭示的质子耦合高亲和力磷酸盐转运;植物细胞环境学报,2011,34:681-689。10.1111 / j.1365-3040.2010.02272.x。
- 16.
刘峰,常新军,叶燕,谢文平,吴萍,连小明:水稻磷酸转运体基因家族的全生命周期表达谱分析。植物学报,2011,4:1105-1122。10.1093 / mp / ssr058。
- 17.
邱廷杰,刘宏,Harrison MJ:植物中磷酸转运蛋白MtPT1的空间表达谱Medicago truncatula表明在根/土壤界面的磷酸盐运输中的作用。植物学报,2001,29(4):371 - 371。10.1046 / j.1365 - 313 x.2001.00963.x。
- 18.
Nagy R, Vasconcelos MJ, Zhao S, McElver J, Bruce W, Amrhein N, Raghothama KG, Bucher M:玉米5个Pht1磷酸盐转运蛋白的差异调控(玉蜀黍L)。植物生物(Stuttg)。2006年,8:186 - 197。10.1055 / s - 2005 - 873052。
- 19.
Gordon-Weeks R, Tong YP, Davies TG, Leggewie G:一种高亲和力磷酸盐转运蛋白在马铃薯根系中的空间表达受限。中国生物医学工程学报,2004,24(3):356 - 356。10.1242 / jcs.00615。
- 20.
肖凯,刘娟,Dewbre G, Harrison M,王志英:植物根特异性磷酸盐转运蛋白启动子的分离与鉴定Medicago truncatula.植物生物(Stuttg)。2007年,8:439 - 449。
- 21.
Misson J, Thibaud MC, Bechtold N, Raghothama KG, Nussaume L:拟南芥Pht1的转录调控和功能特性;4,在缺磷植物中对磷酸盐摄取有重要作用的高亲和力转运蛋白。植物生理学报,2004,25(3):366 - 366。10.1007 / s11103 - 004 - 1965 - 5。
- 22.
Shin H, Shin HS, Dewbre GR, Harrison MJ:磷酸盐转运拟南芥: Pht1;1和Pht1;4在低磷和高磷环境中都起主要作用。植物学报,2004,29(4):359 - 361。10.1111 / j.1365 - 313 x.2004.02161.x。
- 23.
贾洪峰,任海燕,顾敏,赵建军,孙树顺,张旭,陈建勇,吴萍,徐广华:水稻磷酸盐转运体基因OsPht1;8参与了水稻磷酸盐稳态。植物生理学报,2011,29(4):366 - 366。10.1104 / pp.111.175240。
- 24.
Nagarajan VK, Jain A, Poling MD, Lewis AJ, Raghothama KG, Smith AP:拟南芥Pht1;5在源库器官之间调动磷酸盐,影响磷酸盐稳态与乙烯信号转导之间的相互作用。植物生理学报,2011,29(3):369 - 369。10.1104 / pp.111.174805。
- 25.
孙树生,顾敏,曹勇,黄雪平,张旭,艾福平,赵金珺,范晓荣,徐广华:一个本构表达的磷酸盐转运蛋白OsPht1;1在全磷水稻中调节磷酸盐的吸收和转运。植物生理学报,2012,29(4):359 - 359。10.1104 / pp.112.196345。
- 26.
Rausch C, Daram P, Brunner S, Jansa J, Laloi M, Leggewie G, Amrhein N, Bucher M:一种表达于马铃薯丛枝细胞中的磷酸盐转运蛋白。自然学报,2001,414:462-466。10.1038 / 35106601。
- 27.
Harrison MJ, Dewbre GR, Liu J:一种磷酸盐转运蛋白Medicago truncatula参与获取丛枝菌根真菌释放的磷酸盐。植物学报,2002,14:2413-2429。10.1105 / tpc.004861。
- 28.
Paszkowski U, Kroken S, Roux C, Briggs SP:水稻磷酸盐转运蛋白包括一个在丛枝菌根共生中特异激活的进化发散基因。中国生物工程学报,2002,29(4):369 - 369。10.1073 / pnas.052161299。
- 29.
Glassop D, Smith S, Smith F:谷物磷酸盐转运蛋白与根吸收磷酸盐的菌根途径相关。植物学报,2005,32(5):688-698。10.1007 / s00425 - 005 - 0015 - 0。
- 30.
Nagy R, Karandashov V, Chague V, Kalinkevich K, Tamasloukht MB, Xu G, Jakobsen I, Levy AA, Amrhein N, Bucher M:新型菌根特异性磷酸盐转运蛋白的表征Lycopersicon esculentum而且茄属植物tuberosum揭示茄科植物共生磷酸盐转运的功能冗余。植物学报,2005,32(4):366 - 366。10.1111 / j.1365 - 313 x.2005.02364.x。
- 31.
Maeda D, Ashida K, Iguchi K, Chechetka SA, Hijikata A, Okusako Y, Deguchi Y, Izui K, Hata S:一株丛枝菌根诱导的磷酸盐转运基因的敲除Lotus对虾抑制互惠共生。植物生理学报,2006,29(4):371 - 371。10.1093 /卡式肺囊虫肺炎/ pcj069。
- 32.
Wegmüller S, Svistoonoff S, Reinhardt D, Stuurman J, Amrhein N, Bucher M:转dTph1插入诱变系统在矮牵牛菌根磷酸盐转运中的正向遗传研究。植物学报,2008,32(4):366 - 366。10.1111 / j.1365 - 313 x.2008.03474.x。
- 33.
葛ether M, Balestrini R, Hannah M, He J, Udvardi MK, Bonfante P:丛枝菌根共生过程中调控网络、转运、细胞壁和膜生物发生的全基因组重编程Lotus对虾.植物学报,2009,32(4):366 - 366。10.1111 / j.1469-8137.2008.02725.x。
- 34.
番茄基因组联盟:番茄基因组序列为肉质果实的进化提供了深刻的见解。自然学报,2012,485:635-641。10.1038 / nature11119。
- 35.
杨丽娟,张丽娟,张丽娟,等:番茄磷酸转运蛋白的功能分析及细胞特异性表达。植物学报,1998,26(4):366 - 366。10.1007 / s004250050394。
- 36.
Catarecha P, Segura MD, Franco-Zorrilla JM, garciga ' A - ponce B, Lanza M, Solano R, Paz-Ares J, Leyva A:一种突变体拟南芥磷酸转运蛋白Pht1;1显示砷积累增强。植物学报,2007,29(3):366 - 366。10.1105 / tpc.106.041871。
- 37.
吴萍,寿红霞,徐光华,连晓明:在了解磷信号和体内平衡的基础上提高水稻磷效率。植物学报,2013,16:205-212。10.1016 / j.pbi.2013.03.002。
- 38.
Remy E, Cabrito TR, Batista RA, Teixeira MC, Sá-Correia I, Duque P: Pht1;9和Pht1;8转运蛋白介导无机磷酸盐的获取拟南芥在缺磷时根系。中国植物学报,2012,29(5):356-371。10.1111 / j.1469-8137.2012.04167.x。
- 39.
刘峰,王志英,任海燕,沈长杰,李颖,凌海萍,吴春春,连小明,吴萍:OsSPX1抑制OsPHR2在调控OsPT2以及水稻嫩枝中磷酸盐的内稳态。植物学报,2010,32(5):563 - 566。10.1111 / j.1365 - 313 x.2010.04170.x。
- 40.
徐光华,Chague V, Melamed BC, Kapulnik Y, Jain A, Raghothama KG, Levy AA, Silbere A:番茄中磷酸盐转运蛋白LePT4的功能表征。中国机械工程学报,2007,38(5):557 - 557。
- 41.
马铃薯基因组测序联盟:块茎作物马铃薯的基因组测序和分析。自然学报,2011,475:189-195。10.1038 / nature10158。
- 42.
Liu C, Muchhal US, Uthappa M, Kononowicz AK, Raghothama KG:番茄磷酸转运蛋白基因在植物组织中受磷的差异调控。植物学报,1998,16(4):381 - 381。10.1104 / pp.116.1.91。
- 43.
Poirier Y, Bucher M:磷酸盐的转运和体内稳态拟南芥.拟南芥的书。编辑:Somerville CR, Meyerowitz EM. 2002, Rockville:美国植物生物学家协会
- 44.
Karandashov V, Nagy R, Wegmuller S, Amrhein N, Bucher M:丛枝菌根共生中磷酸盐转运蛋白的进化保护。中国生物工程学报,2004,29(5):561 - 561。10.1073 / pnas.0306074101。
- 45.
陈安魁,顾敏,孙树生,朱丽丽,洪森,徐广华:两个守恒的识别独联体-作用元件MYCS和P1BS参与调控菌根激活的磷酸盐转运蛋白。植物生态学报,2011,29(4):359 - 359。10.1111 / j.1469-8137.2010.03556.x。
- 46.
Leggewie G, Wilmitzer L, Riesmeier JW:从马铃薯中提取的两个cdna能够补充一个磷酸盐摄取不足的酵母突变体:鉴定来自高等植物的磷酸盐转运蛋白。植物科学学报,1997,19(3):381-392。
- 47.
陈安强,何世胜,李富芳,李铮,丁明克,刘秋萍,荣建军:棉花蔗糖合酶基因家族的结构、系统发育和表达模式分析。植物工程学报,2012,29(3):366 - 366。
- 48.
刘浩,Trieu AT, Blaylock LA, Harrison MJ:两个磷酸盐转运蛋白的克隆和表征Medicago truncatula根:对磷酸盐和丛枝菌根(AM)真菌定植的响应调节。植物生态学报,1998,34(4):326 - 326。
- 49.
刘j, Versaw WK, Pumplin N, Gomez SK, Blaylock LA, Harrison MJ:密切相关的成员Medicago truncatulaPht1磷酸转运蛋白基因家族编码具有独特生化活性的磷酸转运蛋白。中国生物医学工程学报,2008,29(4):394 - 394。10.1074 / jbc.M802695200。
- 50.
Volpe V, Dell 'aglio E, Giovannetti M, Ruberti C, Costa A, Genre A, Guether M, Bonfante P: am诱导的myb家族基因Lotus对虾(LjMAMI)以独立于am的方式影响根的生长。植物学报,2013,33(4):449 -455。10.1111 / tpj.12045。
- 51.
黄春春,Shirley N, Genc Y, Shi B, Langridge P:大麦中磷酸盐利用率与低亲和力磷酸盐转运体和非编码RNA IPS1的表达相关。植物生理学报,2011,29(4):359 - 359。10.1104 / pp.111.178459。
- 52.
Nagy R, Drissner D, Amrhein N, Jakobsen I, Bucher M:番茄菌根吸收磷途径是受磷抑制和转录调节的。植物学报,2009,29(4):359 - 359。10.1111 / j.1469-8137.2008.02721.x。
- 53.
Rubio V, Linhares F, Solano R, Martín AC, Iglesias J, Leyva A, Paz-Ares J:维管植物和单细胞藻类中参与磷酸饥饿信号传递的MYB转录因子基因学报,2001,15:2122-2133。10.1101 / gad.204401。
- 54.
Devaiah BN, Karthikeyan AS, Raghothama KG: WRKY75转录因子是一种磷酸盐获取和根系发育的调节因子拟南芥.植物生理学报,2007,29(4):369 - 371。10.1104 / pp.106.093971。
- 55.
谢晓妮,黄伟,刘长峰,唐乃伟,刘勇,林红,赵斌:新型菌根特异性磷酸盐转运蛋白AsPT1和PHT1家族的功能分析紫云英在丛枝菌根共生过程中。新植物学报,2013,32(4):366 - 366。10.1111 / nph.12188。
- 56.
arandashov V, Bucher M:丛枝菌根的磷酸盐共生转运。植物科学进展,2005,10:22-29。
- 57.
Loth-Pereda V、Orsini E、courtty PE、Lota F、Kohler A、Diss L、Blaudez D、Chalot M、Nehls U、Bucher M、Martin F:菌根中磷酸Pht1转运蛋白基因家族的结构和表达谱杨树trichocarpa.植物生理学报,2011,29(4):381 - 381。10.1104 / pp.111.180646。
- 58.
Balestrini R, Gómez-Ariza J, Lanfranco L, Bonfante P:激光显微解剖发现丛枝细胞中同时存在5个植物和1个真菌磷酸盐转运蛋白基因的转录本。植物生态学报,2007,29(5):555 - 562。10.1094 / mpmi - 20 - 9 - 1055。
- 59.
刘庆平:水稻TUBBY-like基因的鉴定及其进化。中华医学杂志,2008,32(4):369 - 371。10.1111 / j.1742-4658.2007.06186.x。
- 60.
植物基因复制与进化新颖性研究。植物学报,2009,32(4):557-564。10.1111 / j.1469-8137.2009.02923.x。
- 61.
陈安淇,胡娟,孙树生,徐光华:磷酸盐和菌根调控的茄科植物磷酸盐转运蛋白生理反应和表达模式的保守与发散。植物学报,2007,29(4):447 - 447。10.1111 / j.1469-8137.2006.01962.x。
- 62.
Schünmann PHD, Richardson AE, Vickers CE, Delhaize E:大麦Pht1;1磷酸盐转运蛋白基因的启动子分析确定了控制根系表达和对磷酸盐缺乏反应的区域。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.104.045823。
- 63.
Sobkowiak L, Bielewicz D, Malecka EM, Jakobsen I, Albrechtsen M, Szweykowska-Kulinska Z, Pacak A:启动子驱动基因P1BS元件在植物Pi转运和体内平衡中的作用植物科学进展,2012,3:58-
- 64.
Jain A, Nagarajan VK, Raghothama KG:高等植物获取磷酸盐的转录调控。中国生物医学工程学报,2012,29(4):369 - 369。10.1007 / s00018 - 012 - 1090 - 6。
- 65.
Smith SE, Smith FA, Jakobsen I:无论植物的生长反应如何,菌根真菌都可以主导植物的磷酸盐供应。植物生理学报,2003,32(3):366 - 366。10.1104 / pp.103.024380。
- 66.
Smith SE, Smith FA, Jakobsen I:丛枝菌根(AM)共生的功能多样性:菌根磷吸收途径的贡献与菌根对生长或总磷吸收的响应无关。植物学报,2004,24(4):514 -524。10.1111 / j.1469-8137.2004.01039.x。
- 67.
丛枝菌根在植物营养和生长中的作用:从细胞到生态系统尺度的新范式。植物生态学报,2011,29(4):447 - 447。10.1146 / annurev - arplant - 042110 - 103846。
- 68.
Javot H, Penmetsa RV, Terzaghi N, Cook DR, Harrison MJ:丛枝菌根不可或缺的磷酸盐转运体Medicago truncatula共生关系。中国生物工程学报,2007,29(4):447 - 447。10.1073 / pnas.0608136104。
- 69.
杨永春,Paszkowski U:丛枝中磷酸盐的输入:只是一种营养物。植物学报,2011,24:1296-1299。10.1094 / mpmi - 06 - 11 - 0151。
- 70.
Yang SY, rønlund M, Jakobsen I, Grotemeyer MS, Rentsch D, Miyao A, Hirochika H, Kumar CS, Sundaresan V, Salamin N, Catausan S, Mattes N, Heuer S, Paszkowski U:两个磷酸盐转运蛋白1基因家族成员对水稻丛枝菌根共生的非冗余调控。植物生态学报,2012,24(4):436 -4251。10.1105 / tpc.112.104901。
- 71.
范晨,王鑫,胡瑞斌,王艳红,肖长波,蒋燕,张晓明,郑春春,付艳芳:植物中磷酸转运蛋白1基因进化分化的模式大豆中国生物医学工程学报,2013,29(3):366 - 366。
- 72.
Lynch M, Conery JS:复制基因的进化命运和后果。科学通报,2000,29(4):381 - 381。10.1126 / science.290.5494.1151。
- 73.
Guyot R, Keller B:水稻的祖先基因组复制。中国生物医学工程学报,2004,29(4):359 - 361。10.1139 / g04 - 016。
- 74.
谢智,李鑫,Glover BJ,白松,饶桂英,罗婕,杨娟:非种子植物基因组中HAP3基因的复制和功能多样化导致种子发育调节基因LEC1 (leaf COTYLEDON1)的起源。中华分子生物学杂志,2008,25:1581-1592。10.1093 / molbev / msn105。
- 75.
Preuss CP, Huang CY, Gilliham M, Tyerman SD:低亲和力大麦磷酸转运蛋白Pht1;6在xenopus卵母细胞中表达时的通道样特性。植物生理学报,2010,32(4):441 - 441。10.1104 / pp.109.152009。
- 76.
艾PH,孙sb,赵金珺:两个水稻磷酸盐转运蛋白OsPht1;2和OsPht1;6在吸收和转运过程中具有不同的功能和动力学特性。植物学报,2009,29(4):394 - 394。10.1111 / j.1365 - 313 x.2008.03726.x。
- 77.
张淑娟,Puryear J, Cairney J:一种简单高效的松木RNA分离方法。植物生物学杂志,1998,11:113-116。10.1007 / BF02670468。
- 78.
李小波,范雪碧,王晓丽,蔡磊,杨卫东:棉花ACTIN1基因在纤维中有功能表达,参与纤维伸长。植物学报,2005,17:859-875。10.1105 / tpc.104.029629。
确认
国家自然科学基金项目(31372121,31272225)、江苏省基础研究计划项目(BK2012765)和国家优秀博士学位论文作者基金项目(FANEDD, 201264)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
AQC和GHX参与了实验设计和手稿起草。MG参与了稿件编辑工作。XC、HMW和DHL分别进行RNA提取、引物设计、RT-PCR验证。AQC和HYQ进行生物信息学分析。所有作者已阅读并认可最终稿。
陈爱群、小陈对这项工作也有同样的贡献。
电子辅料
的编码序列和假定的非平移区域的对齐
额外的文件2:LePT2而且LePT6.(医生120 KB)
的部分编码序列的对齐
额外的文件3:LePT7和假基因LePTx.(DOC 42 KB)
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原始作品的名称正确。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
陈阿、陈X、王荷。et al。全基因组研究和表达分析表明,Pht1家族基因在番茄缺磷反应中的作用和遗传冗余性不同。BMC植物杂志14日,61(2014)。https://doi.org/10.1186/1471-2229-14-61
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-61
关键字
- 磷酸盐转运蛋白
- Pht1家庭
- 进化
- 功能差异
- 表达式模式
- 茄属植物lycopersicum