摘要
背景
在植物中,EIF4E翻译启动因子及其EIFISO4E同种型是许多RNA病毒的必要敏感因素,包括盆腔病毒。改变这些因素的突变是对病毒抗性的主要来源。这eIF4E等位基因系列与作物中的特定电阻光谱相关联Capsicum annum..遗传证据表明,potyvirus对特定的4E亚型有特定的要求,这取决于宿主植物。例如,烟草腐蚀病毒(TEV)使用EIF4E1感染甜椒但使用eifiso4e感染拟南芥蒂利亚纳.在这里,我们研究了TEV如何利用不同的翻译引起因子同种型以感染这两种植物物种。
结果
建立了互补系统拟南芥测试TEV的系统性感染恢复。使用此系统,拟南芥用敏感辣椒补充对TEV的敏感性EIF4E1等位基因,但没有抗性等位基因。因此,在拟南芥,TEV可以使用Pepper EIF4E1而不是内源性EIFISO4E同种型,所以能够在翻译启动因子4e同种型之间切换相同的主机。此外,我们表明过度表达了胡椒EIF4E1等位基因足以制作拟南芥对其他不亲和的TEV菌株敏感。最后,我们展示了抗药EIF4E1等位基因同样被打破抗性的TEV菌株所克服,如胡椒,证实了这一点拟南芥TEV-易感性互补系统是特定的等位基因。
结论
我们在此报告一个互补系统拟南芥这使得评估辣椒的作用成为可能pvr2-eIF4E易感等位基因对TEV的影响。异源互补实验表明,4E和ISO4E蛋白的特质性质为不同宿主的病毒感染产生了一个主要的检查点。该系统可用于筛选自然或诱导的EIF4E等位基因以查找和研究植物育种的感兴趣等位基因。
背景
当通过EIF4F蛋白质复合物认识到信使RNA的5'末端的帽结构时,启动概率依赖性真核转换。EIF4F由EIF4E组成,小蛋白质,直接与帽相互作用,EIF4G,大型支架蛋白[1].高等植物有另一种形式的eIF4F, eIFiso4F复合物,由eIFiso4E和eIFiso4G蛋白组成[2].
各种RNA病毒,特别是那些属于的RNA病毒Potyvirus属,需要植物基因编码这些翻译启动因子,以完成其传染性周期。eIF4E那如果并且编码其各自同种型的基因赋予对这些病毒的隐性抗性[3.那4.].Eifiso4e.据报道,有一个作用拟南芥蒂利亚纳抵抗potyviruses芜菁花叶病毒(tumv)和烟草腐蚀病毒(TEV)并恰如地,EIF4E1被证明具有作用甜椒(胡椒)抵抗马铃薯Y病毒(PVY)及TEV [5.-7.].自那时起,eIF4E的变异,主要与导致eIF4E蛋白氨基酸(AA)变化的多态性有关,已被揭示为几种疾病系统中已知抗性等位基因的基础,包括Lactuca sativa/莴苣马赛克病毒(lmv)和Pisum一/豌豆种子传播马赛克病毒(PSBMV),而EIFISO4E被证明涉及阻力李属有到李子痘病毒(PPV) [8.-10].在Capsicum annum.那辣椒呜咽斑驳病毒和辣椒静脉斑点病毒能够同时使用eIF4E1和eIFiso4E,因此,植物抗性与影响这两个基因的突变有关[11那12].基于EIF4E的阻力/易感性的另一个有趣特征是,在同一宿主不同的盆腔中,特别是招募不同的EIF4F同种型。例如,在拟南芥蒂利亚纳TuMV专门使用eIFiso4F复合体,而三叶草黄脉病毒(ClYVV)使用eIF4F复合体[6.那13那14].
potyviruses可以影响多个主机。potyviruses lmv,tev,ppv和clyvv所有影响拟南芥,虽然他们各自的自然宿主通常是生菜(Lactuca sativa)、胡椒或番茄(Solanum lycopersicum.), 李子 (李属有)和豌豆(Pisum sativum)(桌子1).对于这些病毒中的每一个,两者都需要感染主机翻译启动因子4e拟南芥在作物。PPV依赖于相同的eIFiso4E亚型来感染两者拟南芥和李子[10那15Clyvv依赖于两豌豆的EIF4E拟南芥[13那16].有趣的是,TEV和LMV根据感染的植物物种的不同,使用不同的同种型[5.-7.那9.那14那17那18].
它不完全清楚,但为什么选择不同的eif4e蛋白质同种型以感染不同的宿主。在里面拟南芥/TuMV and pepper/TEV-PVY pathosystems, it is known that the eIF4E1 or eIFiso4E initiation factors interact specifically with VPg, a virus-encoded protein that is covalently linked to the 5’ end of the viral genomic RNA in place of a cap structure [17那19那20.].然而,植物对potyvirus的敏感性和eIF4E/VPg相互作用之间的相关性并不适用于所有的致病系统[21.那22.].因此,需要由病毒或主机编码的其他因素需要加强启动因子和VPG之间的相互作用,并指定招募哪种同种型,EIF4E或EIFISO4e。
在这里,我们努力通过分析依赖于的TEV易感性来确定EIF4E或EIFISO4E蛋白是否单独确定哪种复杂的特定斑疹患者招募EIF4E1在胡椒中Eifiso4e.在拟南芥.我们专注于两个辣椒EIF4E1等位基因,PVR2.+和PVR2.2(以下CA.EIF4E1-PVR2.+和CA.EIF4E1-PVR2.2分别和两个TEV菌株对那些等位基因,帽子和CA10的对比行为。这CA.EIF4E1-PVR2.+等位基因使植物易于帽子和CAA10菌株的影响。CA.EIF4E1-PVR22等位基因赋予TEV帽子菌株的抵抗力,但TEV CAA10应变克服了这种阻力[5.那17].我们建立了一个互补系统拟南芥蒂利亚纳测试辣椒EIF4E1是否可以恢复对抗TEV的易感性拟南芥基因型。我们的研究表明,辣椒eIF4E1的异体表达足以恢复辣椒的易感性拟南芥植物缺乏敏感因子EIFISO4e并且足以定义电阻谱拟南芥主持人。
结果
对于特定的4E同种型的Tev的要求未被序列同源性或与病毒VPG的相互作用解释
在作物和中,据报道了4E基电阻的斑疹病毒拟南芥被认为是(表1).为了检查涉及易患Pot病毒的易感性的4E蛋白被分配给正确的同种型组,构建了基于其蛋白质序列的系统发育。分析表明,属于六个远距离相关的高原植物物种的4E蛋白被正确地分为EIF4E和EIFISO4E植物(图1一个)。
对TEV和LMV的抵抗取决于EIF4E的不同同种型。一种,基于全长EIF4E1和EIFISO4E蛋白序列的系统发育树Lycopersicon esculentum(le),Capsicum annum.(加利福尼亚州),Lactuva sativa.(Ls),Pisum一(PS),李属有(PD)和拟南芥蒂利亚纳(在)。请参阅访问中的方法。表示支持BranchPoints的Bootstrap值超过0.6。患上患者的耐药性拟南芥并且在另一种植物物种中,即TEV,LMV,ClyVV和PPV,由4E蛋白旁边的盒装病毒缩写表示,它已被证明依靠(见表1参考)。B.,蛋白序列比对甜椒和拟南芥蒂利亚纳eIF4E1 eIFiso4E。至少3个序列中相同或相似的氨基酸分别用黑色和灰色突出显示。仅eIF4E1或eIFiso4E序列中常见的氨基酸分别以蓝色和绿色突出显示。Monzingo等人定义的异构体特异性氨基酸[23.]标有星号。以红色标记的EIF4E1盒I和II是具有雄性腺和Caranta所定义的抗穴毒性的自然变化的簇[3.].
我们重点研究了TEV HAT菌株的植物敏感性,该菌株涉及辣椒中的eIF4E1和辣椒中的eIFiso4E拟南芥.辣椒和辣椒和eifiso4e蛋白的序列拟南芥比对Ca.eIF4E1与At序列是否同源。Eifiso4e.could explain why the TEV uses different isoforms depending on the host (Figure1b)。然而,Ca.eif4e1蛋白与AT.eif4e1比AT.eifiso4e(分别为63.8%和42.9%)更相似。总序同源物和先前识别的签名残留物[23.都确认Ca.eIF4E1和At.]。EIF4E1on one hand and Ca.eIFiso4E and At.eIFiso4E on the other hand are assigned to the correct isoform group. In total, 48 AA are specific to eIF4E1 sequences and 41 AA to eIFiso4E sequences. Among these specific residues, 23 were mutually exclusive. Furthermore, the analysis of several resistant alleles in crops has made it possible to delimit regions I and II in the eIF4E1 protein sequence where AA substitutions involved in resistance to potyviruses tend to cluster [3.].可以在Eifiso4e中分隔区域I和II,因为三维模型表明EIF4E1和EIFISO4E采用类似的结构[24.那25.].在Ca.eif4e1和At.eifiso4e之间的区域I和II中预期了更高程度的相似性,但是区域I和II实际上在AT.eif4e1和Ca.eif4e1和At.eifiso4e和Ca.eifiso4e之间更加守恒,分别(图1总的来说,蛋白质序列分析并不能解释为什么TEV HAT依赖于不同的亚型来感染拟南芥分别和胡椒。
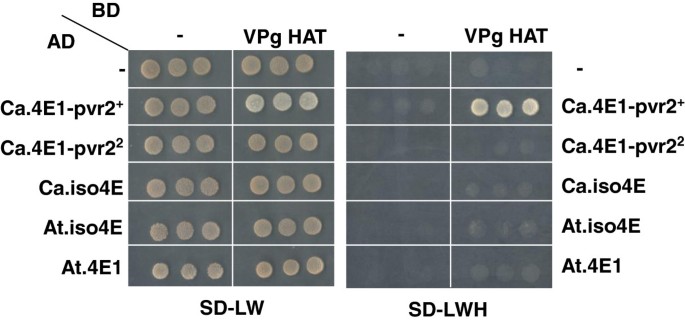
在胡椒和拟南芥,已经显示EIF4E或EIFISO4E与盆腔VPG的物理相互作用与对病毒的宿主敏感性相关。我们在酵母 - 两个混合测定中测试了4E启动因子和TEV VPG之间的差异相互作用可能对不同的同种型要求负责拟南芥和胡椒(图2).正如之前报道的,我们发现TEV HAT VPg与易感Ca.eIF4E1-pvr2强烈相互作用+蛋白质,但不具有抗性Ca.eif4e1-PVR22[17].这种差异相互作用仅限于Ca.eif4E1蛋白,因为Tev帽VPG不会与辣椒Ca.eifiso4e蛋白相互作用。Tev帽子VPG没有与AT.eif4e1或AT.eifiso4e互动,尽管遗传学研究表明,AT.eifiso4e是必需的拟南芥Tev感染[6.那7.那26.].一个解释是,在某些物种中,植物特异性取决于额外因素在Planta.调节病毒蛋白与4E引发因子之间的相互作用。或者,额外的因素可能会损害病毒的eif4e1招募拟南芥.
设置TEV辅助系统拟南芥
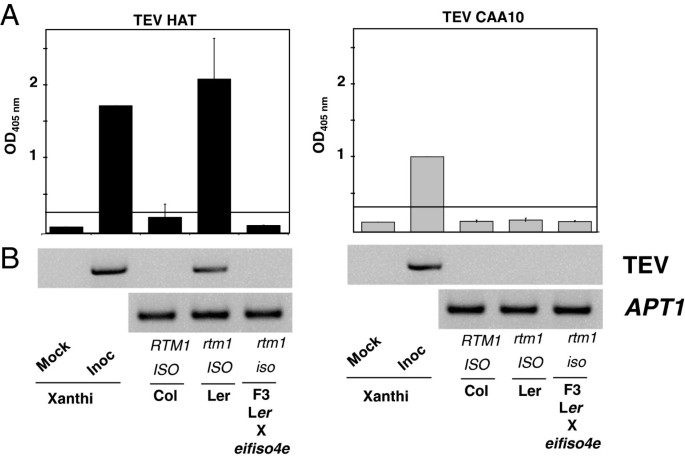
如果其他因素影响TEV与eIF4E亚型的相互作用,并参与宿主特异性,易感Ca.eIF4E1在TEV耐药的表达拟南芥背景不应恢复敏感性。我们的目的是测试辣椒eIF4E1是否可以补充拟南芥行缺少内生At。Eifiso4e.和hence resistant to TEV. However, in the拟南芥蒂利亚纳哥伦比亚加入,抵抗Tev触发Eifiso4e.突变被存在所掩盖RTM1,一种天然显性抗性基因,抑制包括TEV- hat在内的大多数TEV病毒株的系统性传播[27.那28.].规避掩蔽效果RTM1抵抗,哥伦比亚Eifiso4e.线被越过陆地伯格erecta.(左呃),带有缺陷rtm1等位基因。纯合子Eifiso4e RTM1.在F2群体中选择双突变体。将这些植株进行自交,并对结果F3植株的TEV敏感性进行了评估。哥伦比亚大学(Eifiso4e / Eifiso4e.;RTM1 / RTM1),L.呃(Eifiso4e / Eifiso4e.;RTM1 / RTM1)和f3Eifiso4e RTM1.双突变体(eifiso4e / eifiso4e;RTM1 / RTM1)被TEV HAT或CAA10挑战。通过检测病毒基因表达和病毒蛋白表达来检测任一病毒是否全身感染来评估植物的易感性(图)3.).如前所述[28.] Tev帽子可以全身感染L.呃加入但不是哥伦比亚。这Eifiso4e RTM1.植物对Tev帽子抵抗暗示Eifiso4e.ko等位基因是Tev帽的有效且完全的阻力等位基因[6.].TEV CAA10菌株克服了Ca。EIF4E-PVR2.2辣椒中的等位基因,无法感染col或l呃(数字3.),建议在工作中不相容或其他一些形式的抵抗。
这RTM1 EIFISO4E.双突变体对Tev帽和Tev CaA10没有感染拟南芥蒂利亚纳L.呃或者加入了。一个月的拟南芥用Tev帽或CaA10菌株手动接种并在24 dpi下测定。野生型加入哥伦比亚(Eifiso4e / Eifiso4e;RTM1 / RTM1)和Landsberg.erecta.(Eifiso4e / Eifiso4e;RTM1 / RTM1)与双突变体进行比较Eifiso4e / Eifiso4e;RTM1 / RTM1。尼科尼亚塔哈瓦姆以未接种(mock)或接种(Inoc)的苍耳cv作为对照。一种,测定植物以ELISA在24dPI下进行病毒涂层蛋白质积累。显示每个基因型的6个独立植物的平均值,并且误差杆代表标准误差。水平黑线是易感性阈值。B,全身叶组织中TEV VPG基因的RT-PCR表达。APT1.作为本构控制在拟南芥植物。
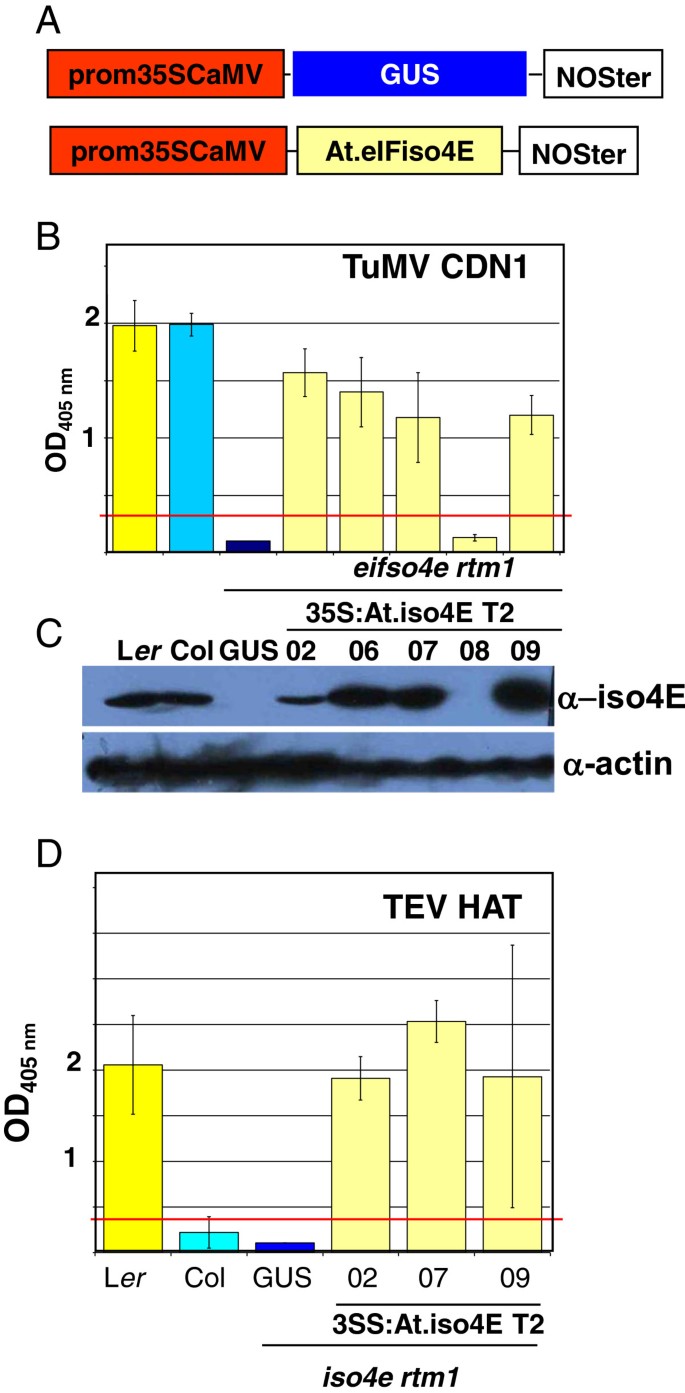
为了验证互补系统AT.eifiso4e.cDNA过表达Eifiso4e RTM1.突变体。作为AT.eifiso4e.通常普遍表达mRNA拟南芥组织,其cDNA在二元载体中的35scamv启动子的控制下克隆并转化为Eifiso4e RTM1.植物。阴性对照为35S:GUS构建,表达报告基因Uida,在相同的背景下进行转换(图4.一个)。
同源互补Eifiso4e RTM1.通过AteIFiso4E过表达恢复对TuMV和TEV HAT的敏感性。一种,插入的T-DNA构建体的示意图eifiso4e rtm1 rabidopsis.植物。B.,一个月大的拟南芥用Tumv CDN1菌株接种植物,并在24dPI下测定Das-ELISA的病毒外壳蛋白质积累。用35s转换的一个T2线:测试GUS构建体,并用35秒改变了五条独立的T2线路:ATEIFISO4E。C,从1个月大叶中提取的总蛋白质中Eifiso4e蛋白水平的蛋白质印迹分析。肌动蛋白蛋白水平被评估为负载控制。D.,一个月大的拟南芥用TEV-HAT接种植物,在24dpi时用ELISA法检测病毒外壳蛋白的积累。
转基因植物首先用Tumv CDN1攻击,因为Eifiso4e.KO等位基因被描述为对这种病毒株具有抗性[6.那20.], (数字4.5个独立的35S中的4个。Eifiso4e.T2 lines tested showed complete susceptibility to TuMV (Figure4.b),显示成功的互补Eifiso4e.通过过表达的突变在at.eifiso4e。平行,通过使用特定的多克隆血清(图)在植物提取物中评估植物提取物中的蛋白质水平(图4.C).在野生型Col和L中检测到预期21 kDa大小的特定波段呃植物提取物,但缺乏摘录Eifiso4e RTM1.植物。对TuMV敏感的4个转基因株系均积累了大量的eIFiso4E。值得注意的是,在对TuMV CDN1耐药的08株中未检测到eIFiso4E转基因的表达。
三个独立35秒:Ateifiso4e.显示高水平对Tumv易感性的线攻击Tev帽子并被发现是高度敏感的(图4.d)。这些结果验证了TEV-易感性互补系统的效率。
外源Ca.eIF4E1在拟南芥恢复对TEV HAT的敏感性
为了测试辣椒EIF4E等位基因是否可以补充对TEV的易感性拟南芥的全长cDNA编码Ca.eIF4E1-pvr2.+和ca.eif4e1-PVR2.2被克隆到二元载体中并转化为eifiso4e rtm1 rabidopsis.植物(图5.A).当TEV HAT激发时,在6个过表达Ca.eIF4E1-的T2序列中有5个PVR2.+易感性等位基因在全身组织中累积了高水平的病毒外壳蛋白,因此对这种菌株非常敏感(图5.B和数据未显示)。由此编码的辣椒EIF4E1PVR2.+因此,Tev帽子可以使用等位基因拟南芥而不是其异常同种型Ateifiso4e。相比之下,过度表达ca.eif4e1.-PVR2.2等位基因相同Eifiso4e RTM1.背景未在测试的6个独立线中的任何一个中恢复对Tev帽的易感性(图5.B和数据未显示)。为了确保这些表型不是由于转基因表达的差异,水平ca.eif4e1.通过RT-PCR分析植物叶片中的mRNA(图5.C).相似的大量ca.eif4e1.在测试的所有线条中累积的mRNA。即使是那个ca.eif4e1 pvr2.2等位基因高度表达Eifiso4e RTM1.植物,对Tev帽的易感性没有恢复.总的来说,这些数据表明拟南芥,Tev帽子使用了ca.eif4e1.-PVR2.+易感等位基因而不是AT.eifiso4e.,因此能够在同一主机内交换其4E同种型要求。对TEV的易感性无法恢复PVR2.2EIF4E1抗性等位基因。因此,该TEV易感性互补系统是特定的等位基因。
互补拟南芥与异源CA.EIF4E1产生与TEV CAA10不相容的损失
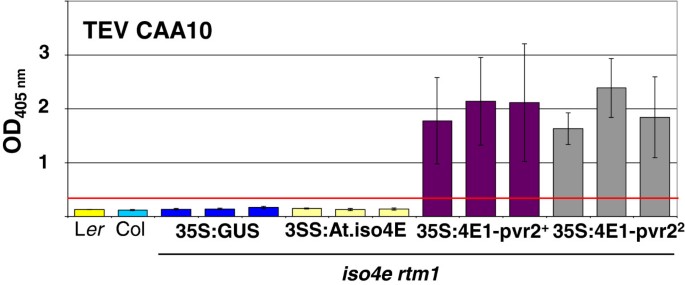
既不是哥伦比亚也没有ara rabidopsis.植物对TEV CAA10品系敏感。这ISO4E RTM1.用35秒转化的植物:AT.eifiso4e构建体与TEV CAA10受到挑战,但at.eifiso4e的过度表达不足以引发易感性拟南芥(数字6.).如果这种敏感性的缺乏与积极的抗性有关,我们希望这种机制在表达转基因植物中保持功能ca.eif4e1.等位基因和植物将保持抗性。相反,如果抗性依赖于不亲和机制,则可能通过过度表达TEV CAA10所需的eIF4E1等位基因来缓解抗性。为了验证这一点,拟南芥表达辣椒eIF4E1等位基因的T2细胞系受到TEV CAA10的攻击。转基因T2植株过表达Ca.eIF4E1-PVR2.+或Ca.eIF4E1 -PVR2.2CDNA非常易受TEV CAA10(图6.).因此,异源敏感性宿主因子的表达足以在其他不兼容的加入中产生易感性。有趣的是,转基因拟南芥植物overexpressing Ca.eIF4E1 -PVR2.2对TEV帽进行耐药,但易于TEV CAA10,精确镜像在辣椒/ TEV Pathosystem中观察到的阻力效应.
讨论
病毒依赖于宿主因子来完成其复制循环并成功感染主机。植物启动因子EIF4E和EIFISO4E及其各自的伴侣EIF4G和EIFISO4G是POTYVIRUSES感染植物所需的宿主因子的实例。由于宿主因子不存在或修饰并且不能被病毒使用,这可以解释非宿主阻力的一些方面,主要发生抗性(或受损的易感性)主要发生。29.那30.].要感染多个宿主,病原体必须能够适应不同的细胞机制[31.].在这里,我们研究了TEV菌株如何利用不同的翻译起始因子亚型来感染来自不同双子叶属的两种植物,拟南芥和辣椒.
验证互补系统后,我们能够恢复拟南芥通过过度表达易感辣椒对TEV帽的易感性PVR2.+等位基因编码eIF4E1。Ca的敏感。eIF4E1-pvr2+等位基因足以取代被敲除的基因拟南芥eIFiso4E让病毒在体内进行感染循环拟南芥.通过辣椒和辣椒之间的Tev使用EIF4E同种型的转变拟南芥鉴于Ca.eif4E1蛋白与AT.eifiso4e更相似的令人惊讶的是。此外,在确定对病毒的易感性方面至关重要的地区I和II在Ca.eif4e1和At.eif4e1和At.eifiso4e之间的易感性中具有重要意义。在胡椒中,耐药患者辣椒呜咽斑驳病毒及其亲密的相对辣椒静脉斑点病毒已经表征为Digenic并依赖于CA.EIF4E1和CA.EIFISO4E [11那12],所以Potyvirus可以在同一植物中使用两种同种型。类似地,eif4e和eifiso4e等位基因的过表达Brassica Rapa.在抗性eifiso4e rapididopsis.恢复对tumv的易感性[32.表明TuMV也可以使用这两种亚型。这里研究的TEV - 4E系统的不同之处在于,4E亚型的TEV需求的转移发生在植物物种之间,并且是高度特异性的。换句话说,令人惊讶的是,TEV HAT不能使用这两个At。eIF4E1在拟南芥辣椒中的ca.eifiso4e。这种特异性不太可能出现不同的表达模式,值得注意的是,因为AT.eif4e1.也参与了对ClyVV的易感性,因此可以假设广泛的表达模式AT.eif4e1.它的表达使它成为其他potyvirus可用的靶标。可能是由于AteIF4E1的I区和II区AA差异使其与TEV不相容,即使在At。eIF4E1不具有抗性等位基因的多态性PVR2.2、V67E及L79R [17].这一假设与At之间缺乏相互作用相一致。eIF4E1和TEV VPg在酵母双杂交中的表达。
基因冗余可以使基于生物学功能的丧失设计实验,并且函数获得方法提供了一个有趣的替代方案。例如,异源表达四种不同芸苔属rapa eif4e.和Eifiso4e.抗病基因eifiso4e rapididopsis.突变体恢复对tumv的易感性[32.,尽管候选基因的异位表达可能被证明具有误导性[33.].我们采用了类似的策略来测试从更远亲分离的翻译起始4E基因拟南芥和胡椒。有趣的是,区分不同病毒株的精确等位基因行为维持在拟南芥.另外,表达CA.EIF4E1-PVR2.+或Ca.eIF4E1 -PVR2.2等位基因抑制了与TEV CAA10菌株的不亲和性,该菌株通常不能感染Col或L呃.相似地,卡莫病毒甜瓜坏死斑病毒(MNSV)MA5能够繁殖尼古利亚娜·宾夕法尼亚州如果供应易感甜瓜eIF4E [34.].因此,翻译起始因子是对正链RNA病毒易感性的主要决定因素。
设置实验系统拟南芥,我们利用自然变异的抗性在RTM1轨迹。通过组合Ateifiso4e.突变与自然结合rtm1来自L.的等位基因呃,可以抑制Col的TEV的全身显性抗性。这产生了明显的背景,其中试验不同EIF4E蛋白的转基因过表达和对植物易感性的影响。辣椒e的变异if4e1.还利用基因来比较两种TEV菌株的差异抗性。已经表征了大量的EIF4E1等位基因辣椒。,[17那35.那36.]下一代测序输出和大种质收集的联合可用性可能会扩大此池[37.那38.].然而,在遗传背景中干扰显性抗性的存在也可能阻碍这些等位基因在抗性中的作用[35.].如果野生相对物种之间的交叉不相容,这种等位基因的遗传验证可能需要困难和耗时的遗传研究。除了可用的自然等位基因,等位基因替代技术和诱变方法,如耕种,可能在不久的将来提供更好的机会在不久的将来产生量身定制的等位基因。使用一个测试等位基因拟南芥如本文所述的易感互补系统,可能是一种快速和经济的方法来评估等位基因对TEV的抗性,以选择最佳的作物育种策略。
结论
PotyViruses可以通过依赖于主机翻译启动因子4e或其同种型ISO4e来感染多个主机。我们展示了这一点拟南芥蒂利亚纳是一种良好的异源系统,以评估来自作物植物胡椒的4E引发因子是否充当TEV抗性/易感等位基因,通过过度表达在耐药遗传背景中。拟南芥辣椒eifiso4e1可以以一种特定的方式恢复对TEV的敏感性,这表明4E和/或iso4E蛋白的特性创造了一个主要的检查点,允许或不允许病毒感染不同的宿主。此外,这种易感性的恢复是等位基因特异性的,模仿拟南芥eif4e的行为 -PVR2.辣椒的等位基因。这些结果表明拟南芥可以是评估新的EIF4E等位基因的良好模型,用于抵抗TEV,也可用于评估其耐用性。
方法
蛋白质加入数和系统发育
系统发育分析采用以下蛋白序列,登录号如括号:Pd。eIF4E1 (JX137116)和Pd。eIFiso4E (JX137117)李属有;ps.eif4e1(aar04332)和ps.eifiso4e(abh09880)来自Pisum一;ls.eif4e1(aap86602)和ls.eifiso4e(aap86603)来自Lactuca sativa;CA.EIF4E1(AAN74644)和CA.EIFISO4E(AAY62607)来自甜椒;AT.EIF4E1(NP_193538)和AT.eifiso4e(NP_198412)来自拟南芥蒂利亚纳;和Sl.eIF4E1 (ABF83563)和Sl.eIFiso4E (ABV23495)的Solanum lycopersicum..系统发育树使用系统发育。fr [39.].
使用MultiAlin对蛋白序列进行比对(http://multalin.toulouse.inra.fr)及BoxShade (http://www.ch.embnet.org/software/box_form.html.).
酵母双杂交相互作用试验
如前所述,使用Matchmaker 3酵母双杂交系统(Clontech)检测蛋白质相互作用。图中显示了含有猎物和诱饵载体的酵母菌落的生长作为对照2在缺乏亮氨酸,色氨酸和组氨酸(SD-LWH)的选择性辍学培养基上选择缺乏亮氨酸和色氨酸(SD-LW)和相互作用的选择性辍学培养基。每次测试每个组合都会测试。Tev帽子Vpg与Gal4的结合结构域(BD)融合,而不同的EIF4E1和EIFISO4E融合到激活结构域(AD)。先前描述了所有质粒[17那20.].
质粒结构
本研究中使用的所有质粒和寡核苷酸均列于附加文件中1:表S1和附加文件2:表S2。通过RT-PCR扩增,将attB1/attB2 Gateway重组序列导入pDONR207载体(Invitrogen),然后将BP克隆酶重组,获得进入克隆。所有克隆在进一步使用前都经过了测序检查。通过LR克隆酶重组反应在目的载体pMDC32中获得CaMV 35s驱动过表达的其他克隆[40].
植物材料和植物改造
拟南芥蒂利亚纳以哥伦比亚0 (Col)株系作为野生型对照,Landsberg株系作为野生型对照erecta.(左呃)加入用于其rtm1突变等位基因[28.].纯合Ateifiso4e.通过插入DSPM元素引起的ko等位基因已经描述了[6.].在18 ~ 20℃条件下,光照16 h (100 μmol光子m-2S.-1荧光)和8小时暗循环。在病毒试验中,植物在相同的条件下生长,但在短时间内(光照8 h)。
对于遗传杂交,未成熟的花朵被阉割并手动交叉。所有二进制载体都被转化为ATEIFISO4E RTM1 Arabidopsis.植物使用花卉DIP方法[41.].在添加15mg /L潮霉素b的萌发培养基上选择所有T1和T2植株,每个植株约选择10株独立的T1植株自生。植物对潮霉素的抗性和PCR分型结果表明,该转基因在T2植株中存在。这Eifiso4e RTM1.背景也通过基因分型确认(附加文件3.:图S1)。通过GUS染色检查表达GUS报告基因的对照植物(数据未显示)。
病毒接种和检测由ELISA
tumv cdn1菌株[20.Tev帽和CaA10菌株都是[17]在萝卜上繁殖(Brassica Rapa.),尼古利亚娜·宾夕法尼亚州简历萨丁分别。1个月时接种病毒拟南芥通过ELISA使用分别的反气(AGDIA)和ANTIATV(SEDIAG)抗血清和检测集在24天后测定Tumv和Tev病毒累积。呈现的所有结果都是从6个独立植物的平均值,每个基因型和误差杆代表标准误差。易感性的阈值由每个曲线图上的一条线表示,并在ELISA中的405nm处的吸光度值等于健康对照的平均值的三倍。yolo奇迹和佛罗里达州VR2辣椒涂抹在本研究中的所有病毒感染中都被用作对照(附加文件4.:图S2)。
植物基因分型和RT-PCR
这Ateifiso4e.突变等位基因是由缺陷基因的插入引起的DSPM.元素进入第二个外显子Ateifiso4e.(AT5G35620)。在具有引物Z2835和Z2835和Z2835的基因组DNA上对野生型等位基因进行PCR基因分型,并且使用引物Z2835和Z524进行突变等位基因,是在3'的3'中杂交的寡核苷酸。DSPM.元素。这rtm1用CAPS标记对等位基因进行基因分型,结果如下。一个340 bp的DNA片段覆盖RTM1用引物Z2322F和Z2323F扩增基因座,并用限制酶HinFi消化。由Col产生的碎片RTM1等位基因和Ler rtm1等位基因主条带长度分别为260 bp和298 bp。
抗体和蛋白质印迹
将完整的ATEIFISO 4E cDNA序列克隆到表达载体pET15b(NOVAGEN)中。重组他标记的ATEIFISO4E蛋白质,纯化并用于通过蛋白质原带(Oberhausbergen,法国)在兔子(新西兰白,SPF)中产生多克隆抗体。通过亲和纯化将所得血清纯化在其标记的ateifiso4e蛋白上。
对于Western印迹分析,从Laemmli缓冲液中的1个月叶中提取总蛋白质。电泳在SDS-聚丙烯酰胺凝胶上电泳等量的蛋白质提取物,并呈吹塑到杂金ECL硝酸纤维素膜上(GE Healthcare,Buckinghamshire,英国)。将抗ATEIFISO 4E血清以1/2000稀释,并与1/5000稀释的二次山羊抗HRP标记的抗兔血清(Sigma-Aldrich)。作为加载控制,单克隆抗植物肌肽抗体(1/2000稀释)(Sigma-Aldrich)与HRP标记的兔抗小鼠血清(1/2000稀释)(Sigma-Aldrich)使用。使用Lumiglo储备化学发光底物试剂盒(KPL,LES ULIS,FRANCE)和X-OMAT LS薄膜(柯达)检测HRP活性。
逆转转录分析
总RNA用三试剂(Sigma-Aldrich)从1个月大的叶片中提取。通过DNA酶I处理去除污染的DNA。按照供方说明书,用AMV逆转录酶(Promega)对1 μg总RNA进行RT-PCR。腺嘌呤磷酸酯基转移酶1(APT1., At1g27450)作为本构对照。C. Annuum EIF4E1和APT1.分别用Z3221-Z3222和Z1734-Z1735引物扩增cDNA。
参考文献
- 1.
陈志强,陈志强,陈志强:真核生物翻译起始机制的起源与进化。生物化学进展,2010,35(2):63-73。10.1016 / j.tibs.2009.10.009。
- 2。
Patrick RM,Browning Ks:EIF4F和EIFISO4F植物复合物:进化的视角。Comp Funct基因组学。2012,2012:287814-
- 3.
翻译起始因子:植物RNA病毒感染的一个薄弱环节。植物科学进展,2006,11(1):40-45。10.1016 / j.tplants.2005.11.004。
- 4。
王A,Krishnaswamy S:真核翻译引发因子4e介导的植物病毒隐性抗性及其在作物改进中的效用。莫尔植物途径。2012,13(7):795-803。10.1111 / J.1364-3703.2012.00791.x。
- 5。
Ruffel S, Dussault MH, Palloix A, Moury B, Bendahmane A, Robaglia C, Caranta C:天然隐性抗性基因马铃薯Y病毒与真核起始因子4E (eIF4E)相对应。植物学报,2002,32(6):1067-1075。10.1046 / j.1365 - 313 x.2002.01499.x。
- 6。
Duprat A,Caranta C,Revers F,Menand B,Browning Ks,Robaglia C:拟南芥真核起始因子(iso)4E对植物生长是必需的,但对potyvirus的敏感性是必需的。植物学报,2002,32(6):927-934。10.1046 / j.1365 - 313 x.2002.01481.x。
- 7。
Lellis A,Kasschau K,Whitham S,Carrington J:易感性突变体拟南芥蒂利亚纳揭示了eIF(iso)4E在potyvirus感染过程中的重要作用。中国生物医学工程学报,2002,12:1046-1051。10.1016 / s0960 - 9822(02) 00898 - 9。
- 8。
高志强,杨志强,杨志强,杨志强,杨志强,杨志强。SBM1.,识别在细胞到细胞贩运中的翻译发起因子EIF4E的新颖作用。工厂J. 2004,40:376-385。10.1111 / J.1365-313x.2004.02215.x。
- 9.
nicaise v,德语 - retana s,sanjuan r,dubrana mp,mazier m,maisonneuve b,烛台t,caranta c,le gall o:真核翻译开始因子4e控制莴苣对盆腔的易感性莴苣马赛克病毒.植物理性。2003,132(3):1272-1282。10.1104 / pp.102.017855。
- 10.
王X,Kohalmi Se,Svircev A,Wang A,Sanfacon H,Tian L:宿主因子EIF(ISO)4E基因赋予梅花李的梅花病毒抗性。Plos一个。2013,8(1):E50627-10.1371 / journal.pone.0050627。
- 11.
Ruffel S,Gallois JL,Moury B,Robaglia C,Palloix A,Caranta C:需要在翻译启动因子中同时突变EIF4E和EIF(ISO)4e需要预防辣椒呜咽斑驳病毒感染的胡椒。中华卫生杀虫药杂志,2006,27(4):489 - 498。
- 12.
刘黄J,李J,王寅,SJ,曹H, NH, Yeam我,金正日D,公元前康:双突变eIF4E和eIFiso4E带来隐性阻力在辣椒辣椒矿脉的斑点病毒。无机材料学报。2009,27(3):329-336。10.1007 / s10059 - 009 - 0042 - y。
- 13。
佐藤M,Nakahara k,Yoshii M,Ishikawa M,Uyeda I:通过Potviruses的拟南芥感染真核激发因子4e家族的成员选择性地参与。费用。2005,579(5):1167-1171。10.1016 / J.Febslet.2004.12.086。
- 14。
Nicaise V,Gallois JL,Chafiai F,Allen LM,Schurdi-Levraud V,Browning Ks,Candress T,Caranta C,Le Gall O,德国Retana S:协调和选择性地招募EIF4E和EIF4G因素的鸟粪病毒感染因子拟南芥蒂利亚纳.费用。2007,581(5):1041-1046。10.1016 / J.Febslet.2007.02.007。
- 15.
关键词:拟南芥,梅痘病毒,多重抗性性状,拟南芥植物营养与肥料学报,2006,19(5):541-549。10.1094 / mpmi - 19 - 0541。
- 16。
brun- rasmussen M, Moller IS, Tulinius G, Hansen JK, Lund OS, Johansen IE:相同的等位基因翻译起始因子4E介导了Pisum sativum对两种Potyvirus的抗性。植物营养与肥料学报。2007,20(9):1075-1082。10.1094 / mpmi - 20 - 9 - 1075。
- 17。
Charron C, Nicolai M, Gallois JL, Robaglia C, Moury B, Palloix A, Caranta C:自然变异和功能分析为植物eIF4E和potyvirus VPg之间的协同进化提供了证据。植物学报,2008,54(1):56-68。10.1111 / j.1365 - 313 x.2008.03407.x。
- 18。
Ruffel S,Gallois JL,Lesage ML,Caranta C:隐性Potyvirus抗性基因Pot-1是辣椒PVR2-eIF4E基因的番茄原基因。Mol Genet基因组学。2005,274(4):346-353。10.1007 / s00438-005-0003-x。
- 19。
Jiang J,Laliberte JF:植物病毒的基因组与植物病毒 - 具有许多合作伙伴的蛋白质。Currination病毒。2011,11(5):347-354。10.1016 / J.Coviro.2011.09.010。
- 20。
Gallois JL, Charron C, Sanchez F, Pagny G, Houvenaghel MC, Moretti A, Ponz F, Revers F, Caranta C, germanretana S:芜菁花叶病毒基因组连接蛋白(VPg)的单个氨基酸的变化与真核起始因子eIF(iso)4E和eIF(iso)4G敲除拟南芥突变体的毒力有关。中华流行病学杂志,2010,31(1):1 - 4。
- 21.
Ashby Ja,Stevenson Ce,Jarvis Ge,Lawson DM,Maule AJ:基于结构的突变分析与SBM1对豌豆种子的豌豆种子的抗性病毒有关的eIF4e。Plos一个。2011,6(1):E15873-10.1371 / journal.pone.0015873。
- 22.
rouet - tavert G, Michon T, Walter J, Delaunay T, Redondo E, Le Gall O: potyvirus VPg的中心结构域参与了与宿主翻译起始因子eIF4E和病毒蛋白HcPro的相互作用。中华卫生杀虫药杂志。2007,28(3):429 - 433。
- 23.
Monzingo AF, Dhaliwal S, Dutt-Chaudhuri A, Lyon A, Sadow JH, Hoffman DW, Robertus JD, Browning KS:小麦真核翻译起始因子- 4e的结构揭示了一个新的二硫键。植物营养与肥料学报。2007,27(4):441 - 446。10.1104 / pp.106.093146。
- 24.
Miyoshi H,Suehiro N,Tomoo K,Muto S,Takahashi T,Tsukamoto T,Ohmori T,Natsuaki T:植物病毒基因组连接蛋白(VPG)与植物转化起始因子之间的相互作用。生物chimie。2006,88(3-4):329-340。
- 25。
Okade H,Fujita Y,Miyamoto S,Tomoo K,Muto S,Miyoshi H,Natsuaki T,Rhoads Re,Ishida T:萝卜镶嵌病毒基因组连接蛋白VPG结合帽结合引发因子4e正轨的C末端区域而不呈现宿主细胞特异性。j生物学习。2009,145(3):299-307。10.1093 / JB / MVN180。
- 26。
Contreras-Paredes CA, Silva-Rosales L, Daros JA, Alejandri-Ramirez ND, Dinkova TD:真核起始因子eIF(iso)4E的缺失影响烟草蚀印病毒分离物在拟南芥中的系统传播。植物营养与肥料学报,2013,26(4):461-470。10.1094 / mpmi - 09 - 12 - 0225 - r。
- 27。
Mahajan SK,Chisholm St,Whitham Sa,Carrington JC:限制拟南芥烟草蚀刻病毒的远程运动的轨迹(RTM1)的识别和表征。工厂J.998,14(2):177-186。10.1046 / J.1365-313x.1998.00105.x。
- 28。
Chisholm ST, Mahajan SK, Whitham SA, Yamamoto ML, Carrington JC:控制烟草蚀刻病毒远距离移动的拟南芥RTM1基因的克隆。中国科学(d辑:地球科学),2000,19(1):489-494。10.1073 / pnas.97.1.489。
- 29。
Maule Aj,Caranta C,Boulton MI:对植物病毒的自然抗性来源:地位和前景。莫尔植物途径。2007,8(2):223-231。10.1111 / J.1364-3703.2007.00386.x。
- 30。
弗雷泽RSS:抗植物病毒的遗传学。Annu Rev phytopathol。1990年,28:179-200。10.1146 / annurev.py.28.090190.001143。
- 31。
植物RNA病毒的多宿主实验进化揭示了局部适应性和宿主特异性突变。中国生物医学工程学报,2012,29(5):1481-1492。10.1093 / molbev / msr314。
- 32。
Jenner CE,Nellist CF,Barker GC,Walsh Ja:萝卜马塞病毒(Tumv)能够从二倍体Brassica Rapa的多个基因座中使用EIF4E和EIF(ISO)4e的等位基因。Mol植物微生物相互作用。2010,23(11):1498-1505。10.1094 / mpmi-05-10-0104。
- 33.
Nellist CF, Qian W, Jenner CE, Moore JD, Zhang S, Wang X, Briggs WH, Barker GC, Sun R, Walsh JA:真核翻译起始因子的多个拷贝促进冗余,通过剪切变异和广谱病毒抗性的多样化。植物学报,2013,77(2):261-268。
- 34.
Nieto C,Rodriguez-Morenoz Am,Aranda Ma,Trunier V:尼古利亚娜·宾夕法尼亚州抗性对未适应的甜瓜坏死点病毒的抵抗力来自病毒RNA和翻译引发因子4e之间的不相容相互作用。工厂J.2011,66(3):492-501。10.1111 / J.1365-313x.2011.04507.x。
- 35.
Ibiza VP,Canizares J,Nuez F:辣椒物种中的生态化:寻找新的病毒电阻。BMC基因组学。2010,11:631-10.1186 / 1471-2164-11-631。
- 36.
Jeong H-J,Kwon J-K,Pandeya D,Hwang J,Hoang N,Bae J-H,Kang B-C:使用高分辨率熔化分析在Capsicum中使用高分辨率熔化分析的天然和乙基甲烷磺酸盐诱导变化的调查。mol繁殖。2012,29(2):349-360。10.1007 / s11032-011-9550-5。
- 37。
Perez-De-Castro Am,Vilanova S,Canizares J,Pascual L,Blanca JM,Diez MJ,Prohens J,Pico B:基因组工具在植物育种中的应用。Curr基因组学。2012,13(3):179-195。10.2174 / 138920212800543084
- 38。
Tanksley SD,McCouch SR:种子银行和分子图:从野外解锁遗传电位。科学。1997,277(5329):1063-1066。10.1126 / Science.277.5329.1063。
- 39。
Dereeper A, Guignon V, Blanc G, Audic S, Buffet S, Chevenet F, Dufayard JF, Guindon S, Lefort V, Lescot M, Claverie JM, Gascuel O:系统发育学。fr:非专家的健壮系统发育分析。核酸学报2008,36(3):465-469。10.1093 / nar / gkn180。
- 40.
柯蒂斯MD,Grossniklaus U:一种Gateway克隆传染媒介,用于Planta中基因的高通量功能分析。植物理性。2003,133(2):462-469。10.1104 / pp.103.027979。
- 41.
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J.998,16(6):735-743。10.1046 / J.1365-313x.1998.00343.x。
致谢
这项工作得到了法国国家研究机构(ANR)在电影项目(ANR-08- genm -128)框架下的资助。我们感谢Luc Sofer和Frédéric Revers提供的rtm1dCAPS标记。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
JLG设计了实验。JE,AMA,Ccallot,AMO和JLG进行了实验。SL贡献了新的试剂。CCANTAA和JLG写了稿件。所有作者阅读并认可的终稿。
电子辅料
一种
附加文件3:图S1:转基因拟南芥T2植物的基因分型。对于每个构造,显示了3个独立T2的结果。,基因分型ISO4E RTM1.T2转基因植物的遗传背景(参见方法)。B.,插入的T-DNA的基因分型,允许过表达AT.eifiso4e.Ca。eIF4E1-pvr2+和Ca。eIF4E1-pvr22, 分别。(PPT 376 KB)
12870_2014_1506_moesm4_esm.ppt.
附加文件4:图S2:Capsicum Annuum Yolo Wonder和佛罗里达州VR2 Accessions的TEV易感性的控制试验。在子叶阶段用Tev帽或Tev CaA10机械地接种植物,并在24dPI下测定ELISA的病毒涂层积累。(PPT 674 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Estevan,J.,Maréna,A.,Callot,C.等等。用于翻译启动因子4e或其同种型驱动工厂宿主敏感性的具体要求烟草腐蚀病毒.BMC植物BIOL.14,67(2014)。https://doi.org/10.1186/1471-2229-14-67
已收到:
公认:
发表:
关键词
- Potyvirus
- 翻译起始因子
- eIF4E
- 拟南芥蒂利亚纳
- 甜椒