- 研究文章
- 开放访问
- 发表:
生长素反应途径的抑制增强了对Phytophthora cinnamomi.虽然亚磷酸盐介导的抗性刺激了疾病信号通路
BMC植物生物学体积14.文章编号:68.(2014年)
抽象的
背景
Phytophthora cinnamomi.是全世界和亚磷酸盐(PHI)的毁灭性病原体,磷酸盐(PI)的类似物在对该病原体的控制方面非常有效。PHI还干扰了PI饥饿响应(PSR),其中助长信号传导是一体组分。在目前的研究中,PI和蟾蜍素信号传导途径在宿主和PHI介导的抗性中的累积P. Cinnamomi.通过筛选来调查拟南芥生态型COL-0和几种突变体在PSR和蟾蜍蛋白反应途径中缺陷,以敏感到该病原体。通过监测其对PI-和蟾蜍蛋白响应途径的影响,还研究了对PHI治疗的反应。
结果
这里我们演示一下phr1-1(磷酸饥饿反应1),响应于PI饥饿的突变体缺陷高度易感P. Cinnamomi.与父母背景Col-0相比。此外,分析了拟南芥tir1-1(运输抑制剂响应1)突变体,缺乏血液刺激的SCF(SKP1 - Cullin - F盒)普发型途径也高易受影响P. Cinnamomi.和突变体的易感性RPN10.和pbe1进一步支持26s蛋白酶在耐受性的作用P. Cinnamomi..蟾蜍的作用也得到了重要的支持(P< 0.001)对蓝卢平(卢比斯angustifolius)P. Cinnamomi.随后用生长素转运抑制剂TIBA(2,3,5-三碘苯甲酸)处理。鉴于生长素和PSR信号明显参与了抗性P. Cinnamomi.,这些途径可能参与Phi介导的抗性也进行了研究。Phi(特别是在高浓度下)减弱某些Pi饥饿诱导基因的反应,如AT4,ATACP5.和ATPT2.饥饿的植物。然而,Phi提高了的转录水平Phr1.生长素反应基因(AUX1,AXR1和AXR2),抑制初级根伸长,并增加了足够的PI植物中的根毛形成。
结论
一种悬垂响应途径,特别是养灵敏感性和运输,在抵抗力中起重要作用P. Cinnamomi.在拟南芥而磷酸盐介导的抗性在一定程度上可能是通过其对PSR和生长素反应途径的刺激而产生的。
背景
植物病原体Phytophthora cinnamomi.对世界各地的农业、园艺和本地植物群落造成相当大的破坏[1- - - - - -6].亚磷酸(Phi)是磷酸(Pi)的类似物,是一种磷酸盐(H3.阿宝3.)并且在控制方面非常有效P. Cinnamomi.[3.,5,7,8].然而,Phi在诱导对该病原菌产生抗性方面的作用方式尚不清楚。了解植物潜在的分子机制Phytophthora cinnamomi.相互作用和Phi对这些相互作用的影响可能有助于设计策略来提高抗病能力或更有效地利用Phi。
对潜在病原菌的抗性取决于不同植物防御信号通路之间的相互作用,如由植物激素水杨酸(SA)、茉莉酸(JA)、乙烯(ET)、脱落酸(ABA)和生长素调控的信号通路[9].植物激素诱导的不同信号通路之间的协同和拮抗相互作用以及它们在诱导对生物营养或坏死营养病原体的抗性方面的作用已被充分证明[9- - - - - -14.].
PHI被认为模仿PI并干扰了各种生化和发育PI饥饿反应(PSR)的表现拟南芥和其他植物物种[15.- - - - - -18.].钾离子状态对确定通过生长素信号通路介导的根结构非常重要,而生长素信号对充分的钾离子饥饿反应是必需的[19.- - - - - -23.].
生长素信号主要是由SCF介导的TIR1E3泛素连接酶复合物(UPP复合物)加速生长素/吲哚-3-乙酸(AUX/IAA)抑制蛋白降解[24.- - - - - -27.].AUX/IAA阻遏蛋白通过一个包含E1 (AXR1和ECR1)、E2 (RCE1)和SCF的泛素偶联循环识别和泛素化TIR1E3,由Cullin-Cul1,SKP1-Ask1,RBX1和F-Box蛋白TIR1(传输抑制剂响应1)组成[28.].Pi通过生长素受体TIR1调节生长素的敏感性,而Pi饥饿会增加生长素的表达TIR1基因拟南芥导致奥克斯/ IAA阻遏物降解的幼苗和下游养液反应的激活[24.,25.].SCF-TiR1中的SGT1B蛋白质功能介导AUX / IAA蛋白的降解[29.- - - - - -31.,并与RAR1;R-基因介导的抗性的组分[31.- - - - - -33.].RAR1和SGT1B与COP9相互作用,COP9参与26S蛋白酶体的蛋白质降解[32.,34.].此外,生长素还参与了对一些坏死营养病原体的抗性诱导,包括Plectosphaerella cucumerina和葡萄孢菌[9,35.].
总之,植物素信号通路在植物防御和PI信令中的参与,以及PI稳态和PSR中PHI的干扰表明植物素信令通路可能涉及一些抗性信号拟南芥进入P. Cinnamomi.以前据报道,以主要是坏养殖生活方式36.]和PHI介导的抗性。本研究的目的是检查PI和疾病信号传导途径在抵抗力中的潜在累及P. Cinnamomi.通过筛选PSR,毒素和遍突素信号传导途径缺陷的突变体,以易于对该病原体的敏感性,并研究PHI是否诱导耐受性P. Cinnamomi.通过研究Phi对Pi信号的影响以及它们对与PSR相关的生长素反应通路的激活/抑制的重要性,调控PSR和生长素信号通路。通过研究Phi对PSR形态学响应的影响,分析Pi充分和不足条件下Phi处理后的Pi饥饿基因表达,以及生长素和ABA对生长素信号转导的响应调控,进一步探讨Phi的作用机制。
结果
抵抗力P. Cinnamomi.在PI饥饿反应突变体中降低
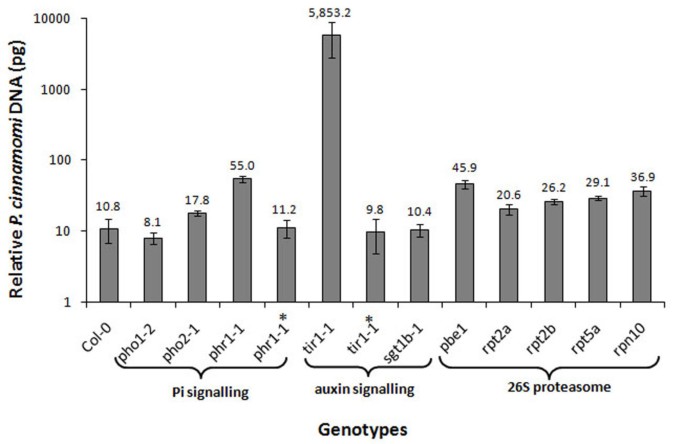
调查PI信令是否会影响响应拟南芥到P. Cinnamomi.,生态型Col-0和几个PSR突变体phr1-1,pho2-1,pho1-2根据Eshraghi等人的方法筛选其对病原体的敏感性,并定量测定感染水平[37.].感染的QPCR分析显着显示出来(P < 0.001) greaterP. Cinnamomi.生物质在phr1-1与它的野生背景Col-0相比突变体(图1)提示Pi信号在抵抗P. Cinnamomi..此外,转移克隆Phr1.基因进入易感性phr1-1突变体恢复抗性到亲本背景Col-0的水平(图1)证实该突变体由于失去了PHR1功能而易感。的Phr1.基因通过调控Pi响应基因的表达促进下游Pi信号传导[38.- - - - - -40]和phr1突变体在Pi信号通路中有缺陷[38.].Pho1和Pho2都行动下游Phr1.调控Pi局部摄取或转运的转录因子[41.- - - - - -44.].的pho2-1和pho1-2突变体没有显着(P> 0.05)P. Cinnamomi.与Col-0相比(图1).
Phytophthora cinnamomi.几个突变体中的反应拟南芥在养肝信号传导中有缺陷,磷酸磷信号和26s蛋白酶体亚基。定量PCR (QPCR)评价Phytophthora cinnamomi.接菌后72 h内的生物量(pg DNA / sample)均高于对照拟南芥生态型哥伦比亚(Col-0)和几个拟南芥突变体在pi信号传导中有缺陷(pho1-1,pho2-1,phr1-1),生长素信号通路(Tir1.-1和sgt1b-1)和26S蛋白酶体亚基(pbe1,rpt2a,rpt2b,RPT5A.和RPN10.).条形图表示由四个感染叶片组成的5个重复的平均值和标准误差。单因素方差分析显示显著(P< 0.001)。LSD.(5%)是8.92。phr1-1* =phr1-1突变体与补充Phr1.基因(AT4G28610)和Tir1.-1* =Tir1.-1突变体与补充TIR1基因(AT3G62980)。
自洽场的TIR1复杂涉及抵抗力P. Cinnamomi.感染
高易感性phr1-1结合生长素信号通路在PSR和植物抗性中的作用[19.,35.建议促进信号传导在抵抗力中可能参与P. Cinnamomi..对病原菌生物量的QPCR检测结果表明Tir1.-1;一个生长素刺激的SCF (Skp1 - Cullin - F-Box)泛素化途径缺失的生长素应答突变体[45.- - - - - -48.非常容易受到P. Cinnamomi.(图1).此外,转移克隆TIR1基因的Tir1.-1突变体恢复抗性到亲本背景Col-0的水平(图1)并确认易感性是由于突变体中的TiR1功能的丧失。
自从拟南芥SGT1B有助于SCF控制的助长响应TIR1复杂的(30.,45.]植物疾病阻力信号中的功能[29.[我们调查了SGT1b中的突变是否影响抵抗力P. Cinnamomi..QPCR检测结果无显著性差异(P > 0.05) differences in susceptibility ofsgt1b-1与其野生父母背景Col-0相比(图1)表明SGT1B没有促进与SCF相关的过程P. Cinnamomi..
26s的蛋白酶体亚基涉及抗性P. Cinnamomi.
26S蛋白酶体参与AUX/IAA蛋白的降解,进而激活生长素应答基因[49.].在目前的研究中,有几个拟南芥26S蛋白酶体亚单位缺陷突变体(pbe1,rpt2a, rPT2B.,RPT5A.和RPN10.)被筛选为他们的敏感性P. Cinnamomi..对感染的分析显示拟南芥突变体pbe1,20S蛋白酶蛋白酶蛋白酶突变体[50.] 和RPN10.减少养蛋白灵敏度[51.[既有重要意义(P< 0.001)更容易受到P. Cinnamomi.与亲本Col-0相比,其病原菌生物量(pg DNA)分别为45.9和36.9(图1).此外,磁化率拟南芥26s蛋白酶体亚基突变体rpt5(29.1 pg),rpt2a(20.6 pg),和rpt2b(同源物的rpt2a;26.2 pg)显著(P < 0.001) higher compared to that in their background Col-0 (10.8 pg, Figure1).
TIBA处理对生长素运输的抑制作用增强P. Cinnamomi.感染
磁化率拟南芥生长素响应基因突变Tir1.-1[35.提示生长素反应途径参与了结果A. Thaliana.―P. Cinnamomi.抵抗(图1).进一步测试这一点,蓝羽羽(易受影响P. Cinnamomi.)用毒素传输抑制剂,TIBA处理幼苗,并确定它们的敏感性。对于这些研究,我们使用了蓝羽羽而不是拟南芥由于根系的大尺寸和易感性P. Cinnamomi.允许更清楚地观察潜在的差异。用蒂巴治疗的羽扇豆幼苗根系感染显着(P < 0.001) greater than in non-treated plants 72 h after inoculation (Figure2).
PI-和养蛋白信号相关基因的表达响应于PHI治疗方法
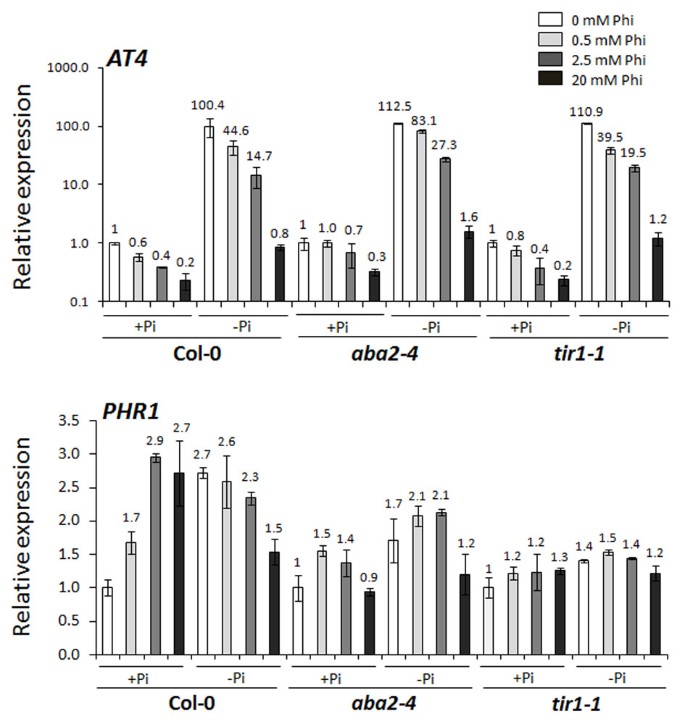
Pi响应基因的相对表达率ATPT2.,ATACP5.和AT4(附加文件1在充分磷或缺磷条件下生长的Col-0在Phi处理后进行了分析(表S1)1).转录水平AT4,ATPT2.,ATACP5.显著增加(P< 0.001)1).相比之下,转录水平AT4,ATPT2.,ATACP5.2.5 mM Phi处理对Pi饥饿植株的抑制率分别为55.6倍、8.9倍和4.2倍。此外,高水平的Phi (20 mM)抑制了的上调AT4(1.1倍),ATPT2.(1.1倍),和ATACP5.(1.07倍)响应PI缺乏对PI生长的植物中观察到的水平足够(对照)条件,证明PHI对PSR的影响(表1).
鉴于PI和毒素信号传导途径在COL-0的电阻中的表观累积,这些途径与ABA信号的相互作用[42.先前观察Eshraghi等人的ABA信号传导突变体的易感性。[52.],在Col-0,ABA2-4和Tir1.-1植物(图3.).转录水平AT4在PI缺陷,非PHI处理的COL-0,ABA2-4和Tir1.-1显着地 (P< 0.05)分别是Pi充足的100倍、112倍和111倍。然而,Phi处理导致抑制AT4所有植物中的基因在这种抑制水平测试的依赖于施加的PHI的浓度(图3.).
亚磷矿对Col-0磷酸盐饥饿响应基因的影响,ABA2-4和Tir1.-1。的相对表达比AT4和Phr1.记录在拟南芥野生型(Col-0)和拟南芥突变体ABA2-4和Tir1.-1在1.25 mM的磷酸盐(Pi)充足培养基中培养3周,然后在不同的Pi (1.25 mM Pi;+Pi和0 mM Pi;−Pi)和亚磷酸(Phi)(0, 0.5, 2.5和20 mM)水平。突变体的转录水平根据肌动蛋白2的表达归一化(ACT2.)在相同的样品中测量并相对于非pHI处理的归一化表达水平,Pi足够生长的COL-0呈现。酒吧呈现来自四种植物的四个重复的平均值和标准误差。每条条上的数字表明基因转录物水平相对于相对于相应的PI足够的(+ PI),非PHI处理的植物的折叠变化。单因素方差分析显示显著(P< 0.001)。LSD.(5%)AT4和Phr1.分别为23.96和1.01。
在非PHI治疗的COL-0中,转录水平Phr1.(磷酸盐饥饿反应1)响应于PI缺乏增加(2.7倍),并且PHI治疗抑制了该基因的转录物水平,在20mM Phi处理的植物中抑制了最高的抑制(图3.).虽然PI缺乏种植样品的PHI治疗抑制了表达Phr1.,该基因的转录水平在Pi充足培养基中培养的Col-0样本中被诱导,该诱导水平取决于本研究中应用的Phi浓度(图)3.).的表达Phr1.对Pi的反应是饥饿减少ABA2-4和Tir1.-1与Col-0相比,表明ABA2和TIR1诱导中的基因Phr1..此外,PHI治疗没有重要(P> 0.05)影响转录水平Phr1.基因在其中ABA2-4或Tir1.-1突变体表明突变ABA2和TIR1基因可能破坏Phi对Pi信号的影响。
高易感性拟南芥突变体Tir1.-1(图1)和增强的水平P. Cinnamomi.在胫骨治疗的羽扇豆根中感染(图2)表明生长素反应途径在抗性中起重要作用P. Cinnamomi..此外,诱导Phr1.在PI足够培养基中生长的Col-0样品中PHI的基因表明PHI诱导PSR和损失Phr1.基因表达Tir1.-1突变体强调了Phi处理可能诱导生长素反应途径。因此,我们假设Phi介导的抗性P. Cinnamomi.可能是通过生长素反应途径的诱导。
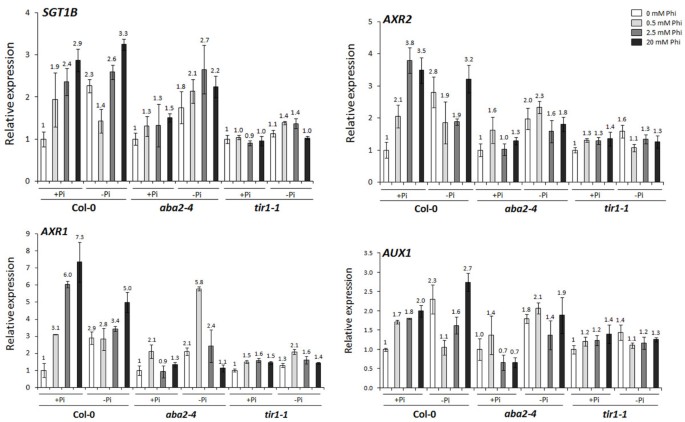
为了测试该假设,PHI和PI对PI足以/ PI缺陷种群的植物素信号传导的伴随效果,ABA2-4和Tir1.-1通过测量疾病响应基因的相对表达比,评估0,0.5,2.5和20mM PHI治疗后的突变体,AUX1,AXR1,AXR2和SGT1B成绩单(附加文件1:表S1)。在非PHI治疗的COL-0幼苗中,PI缺乏增加了转录水平AUX1(2.3倍),AXR1(2.9倍),AXR2(2.8倍)和SGT1B(2.3倍)基因,表明PI缺乏植物中蟾蜍蛋白响应途径的激活(图4).在PI足够的COL-0,PHI治疗(2.5和20 mm)显着诱导(P< 0.05)AUX1,AXR1,AXR2和SGT1B基因和这种诱导的水平依赖于所用的PHI浓度(图4).在磷饥饿植株上添加0.5 mM的Phi抑制了增强的转录水平AUX1(由2.3倍增至1.1倍);而在0.5 mM处的Phi处理则无显著差异(P> 0.05)AXR1,AXR2和SGT1BPi缺陷的Col-0(图4).然而,在较高浓度(2.5和20mm)至PI饥饿植物的施用不显着(P> 0.05)AUX1,AXR1,AXR2和SGT1B基因(图4).
亚磷酸对生长素响应基因诱导的影响。的相对表达比AUX1,AXR1,AXR2和SGT1B记录在拟南芥野生生态型(Col-0)和突变体(ABA2-4和Tir1.-1)在1.25 mM的磷酸盐(Pi)充足培养基中培养3周,然后在不同的Pi (1.25 mM Pi;+Pi和0 mM Pi;−Pi)和亚磷酸(Phi)(0, 0.5, 2.5和20 mM)水平。突变体的转录水平根据肌动蛋白2的表达归一化(ACT2.)在相同的样品中测量并相对于非pHI处理的归一化表达水平,Pi足够生长的COL-0呈现。数据代表每个三个工厂的四个复制的平均值和标准误差。每个条上的数字表明相对于相应的PI足够(+ PI),非PI处理植物,转录水平的折叠增加/降低。Anova表示重要(P< 0.05)。LSD.(5%)SGT1B,AXR1,AXR2,AUX1分别为1.06,1.25,1.16和0.82。
缺磷者,非磷处理ABA2-4突变体,转录水平AUX1,AXR1,AXR2和SGT1B基因没有显著增加(P> 0.05)ABA2-4突变体(图4),提示生长素响应基因PSR的表达依赖于ABA信号转导。进一步,应用到ABA2-4在足够或Pi缺乏条件下生长的突变体不增加疾病响应基因的转录物水平(AUX1,AXR1,AXR2和SGT1B)除了0.5毫米PHI处理的植物AXR1基因(图4).这些结果表明,PHI介导的疾病响应基因的活化可能涉及ABA信号。在里面Tir1.-1突变体,PI饥饿没有大大改变毒素响应基因的转录水平AUX1,AXR1,AXR2和SGT1B证实了TIR1在诱导PSR中的作用。进一步,在充分或不足条件下的应用Tir1.-1不影响生长素应答基因的转录水平,除AXR1在0.5mm phi处理的pi缺陷植物中(图4).结果表明ABA2对PSR诱导的生长素应答基因和Phi诱导的生长素应答基因表达都有一定的要求。同样的,TIR1PSR和PHI介导的疾病响应基因表达是必需的,表明PHI可以通过涉及ABA和AUXIN的机制作用。
Phi处理对生长素介导的根构型的影响
考虑到Phi在生长素响应基因表达方面模仿PSR的潜力,我们研究了Phi干扰植物根系对磷饥饿的形态响应的潜力。
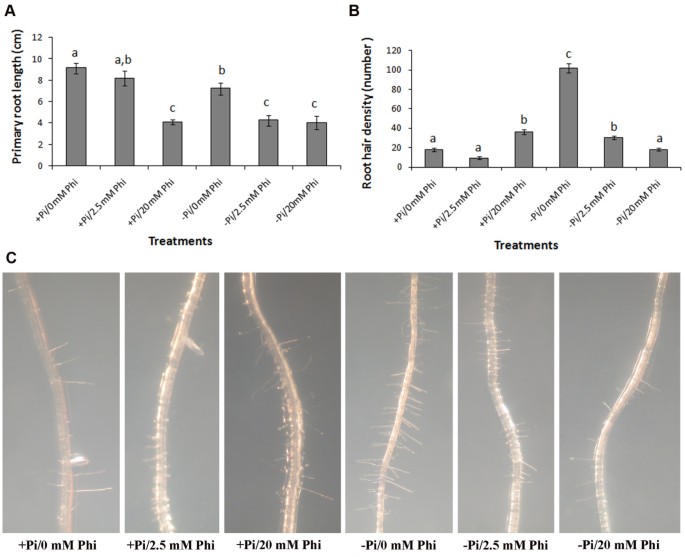
Pi饥饿的Col-0幼苗的主根长度显著(P < 0.05) shorter than that in seedlings grown in Pi sufficient media (Figure5A). Phi的应用导致在足够Pi的培养基中生长的幼苗的主根生长受到抑制,这种抑制的水平取决于Phi的浓度(图)5一种)。PI饥饿诱导的非PHI处理幼苗的根毛形成与PI足够生长的COL-0幼苗观察到(图5此外,用低浓度的Phi (2.5 mM)处理幼苗会抑制足够Pi生长的幼苗的根毛形成,而在20 mM Phi处理的幼苗中根毛密度增加(图)5B, C)。2.5 mM和20 mM浓度的Phi均抑制了磷饥饿诱导的根毛形成。
亚磷矿对磷酸盐缺乏初始毛发密度的抑制作用。亚硝酸盐(Phi)处理对主根长度的影响(一种)根毛密度(b)的拟南芥生态型哥伦比亚(Col-0)在不同的磷酸盐(+ PI和-PI)制度下生长。(一种)移栽不同Pi (+Pi;1.25 mM和-Pi;0 mM)和Phi介质。数据是每次处理的10个根的平均值,有标准误差,根据Tukey HSD测试,相同字母的棒没有显著差异。(b)将幼苗转入不同的Pi (+Pi和-Pi)和Phi培养基7 d后根毛密度(数量)。根毛密度以距离根尖2.5 mm的5 mm根段的毛数来确定,每条棒代表6株的平均值,有标准误差棒,相同字母的棒不显著(P> 0.05)。(C)显示不同PHI浓度对+ PI或-PI培养基生长的幼苗根毛形成的影响。
讨论
这项研究的结果支持生长素信号在诱导抵抗主要的坏死营养病原体的作用P. Cinnamomi..我们进一步说明了Phi对Pi信号的影响,以及它们对与PSR相关的生长素反应通路的激活/抑制的共同作用的重要性。
磷酸盐饥饿反应突变体表现出易感性P. Cinnamomi.
phi致力于抵抗力P. Cinnamomi.[53.及其对磷酸盐饥饿反应的干扰[15.,54.,55.]建议PI信号在结果中的可能作用A. Thaliana.―P. Cinnamomi.交互。QPCR分析结果表明phr1-1,致敏感术语缺陷的突变体是高敏感的P. Cinnamomi.;同时,突变体pho2-1和pho1-2保持抵制。由此编码的MYB样转录因子磷酸盐饥饿反应1(Phr1.)是适应磷素缺乏的关键拟南芥[56.]该基因通过调节PI响应基因的表达来有助于下游PI信号传导[38.- - - - - -40].的PHO2拟南芥s是在下游功能的PI信令网络的子组件Phr1.并调节Pi依赖反应的子集,包括茎和根之间的Pi分配[43.,44.].因此,突变Phr1.基因损害许多Pi信号相关功能[38.], 尽管pho1和pho2突变单独减弱Pi的摄取和组织内的分布[57.,58.].上调的PHO1是依赖于Phr1.转录因子[41.,42.].此外,Ribot等人提出了Pi、ABA和生长素信号转导途径之间的交叉[42.[展示外源ABA和养蛋白的应用下调表达PHO1独立于植物的Pi状态[42.].因此,基因突变Phr1.除了依赖于PHO1和PHO2以及这些反应的调节之外,还可能影响其他PI反应以及对这些反应的调节P. Cinnamomi.,可能与ABA和/或生长素信号转导有关。
生长素反应途径参与P. Cinnamomi.反抗
除参与健康植物的发展和增长的许多方面外,植物激素毒素59.- - - - - -62.]在植物病原体相互作用中起重要作用[9,63.].生长素(IAA)信号通路在PSR中的作用[19.,植物抗病能力[35.的高易感性phr1-1在本研究中观察到表明,疾病信号传导在抵抗力中可能参与P. Cinnamomi..QPCR分析P. Cinnamomi.对col0和生长素相关突变体接种叶片的侵染结果表明Tir1.-1,一个生长素受体突变体高度敏感P. Cinnamomi..有效的生长素反应拟南芥取决于通过SUXIN刺激的SCF刺激结合去除转录因子(TF)压缩机的AUX / IAA系列TIR1复杂的(46.,48.[TiR1蛋白作为一种疾病受体的作用,其直接将养蛋白感知与Aux / IAA阻遏蛋白的降解链接。在拟南芥生长素应答突变体,AUX/IAA转录抑制蛋白降解缺陷影响生长素应答因子(ARFs)的诱导,进而影响生长素应答基因的表达[64.].因此,易感性Tir1.-1在F盒TiR1蛋白和Aux / IAA降解中有缺陷的突变体[45.- - - - - -47.建议泛素介导的Aux / IAA蛋白质降解在植物抵抗力中是重要的P. Cinnamomi..
TIBA(一种极性生长素转运抑制剂)处理也增强了扁桃幼苗对黄萎病的敏感性P. Cinnamomi.这表明,抑制生长素转运体进而干扰生长素信号通路在植物抗病性中具有重要意义P. Cinnamomi..Llorente等[35.]也表明生长素信号通路参与了对坏死营养病原体的抗性,表明抑制生长素反应通路增强了对坏死营养病原体的敏感性拟南芥到葡萄孢菌和Plectosphaerella cucumerina.
在拟南芥,SGT1B有助于SCF控制的助长响应TIR1复杂的(30.,45.],通过SCF-TiR1介导的Aux / IAA阻遏蛋白的降解[29.- - - - - -31.].SGT1B还功能R基因介导的植物疾病抗性信号和在这方面与RAR1相互作用[29.,33.].当挑战时P. Cinnamomi.的sgt1b-1突变体显示没有显着(P > 0.05) difference to its parental background Col-0, suggesting that SGT1B contributes a redundant role to resistance toP. Cinnamomi..在一起的敏感性Tir1.-1,增强蒂巴处理植物的易感性和抗性sgt1b-1说明生长素在抗性中起重要作用P. Cinnamomi.通过一个scf.TIR1介导的泛素化力学机械,与SGT1B功能无关。
26S蛋白酶体参与A. Thaliana.- - - - - -P. Cinnamomi.相互作用
26s的蛋白酶涉及Aux / IAA蛋白的泛素,因此活化促进响应基因[49.[26s蛋白酶体活性的突变体抑制植物素敏感性和其他植物方法,如根顶部分发,叶器官尺寸和配子体发育[28.,65.- - - - - -68.].在目前的研究中,有几个拟南芥26S蛋白酶体亚单位缺陷突变体(pbe1,rpt2a, rPT2B.,RPT5A.和RPN10.)被筛选为他们的敏感性P. Cinnamomi..对病原体感染的分析显示pbe1,20S蛋白酶体敲除突变体非常敏感P. Cinnamomi.与它的父母背景相比。此外,RPN10.突变体在生长素和ABA信号转导中泛素/26S蛋白酶体介导的蛋白水解过程中存在缺陷P. Cinnamomi..RPN10是26S蛋白酶体通路的一个亚基,影响多种调节过程拟南芥通过将不需要的蛋白质导向26S蛋白酶体进行降解[51.].的拟南芥RPN10突变体表明对蟾蜍素的敏感性降低,对ABA的外源应用非常敏感[51.].生长素敏感性的降低RPN10.可能与其易感性有关P. Cinnamomi.并进一步支持抗抗抗肌蛋白的作用P. Cinnamomi..
此外,拟南芥26s蛋白酶体亚基突变体RPT5A.,rpt2a和rpt2b(同源物的rpt2a)也显示出更高水平的易感性,相比于观察到的亲代背景Col-0。26S蛋白酶体亚基缺陷突变体对P. Cinnamomi.提示26S蛋白酶体亚基在抗P. Cinnamomi.,可能通过降解生长素抑制剂蛋白后,其泛素化的TIR1。
Phi和Pi的共同作用与PSR和生长素相关基因的激活/抑制有关
phi在抗抵抗力诱导中的作用Phytophthora.已经在几项研究中证实了其复杂的作用模式,包括(i)通过抑制病原体生长直接作用,(ii)通过诱导病原体释放应激代谢物引发防御反应间接作用,以及(iii)间接刺激宿主防御反应[53.,69.- - - - - -72.].Eshraghi等[53.发现phi介导的抗性P. Cinnamomi.在易感中拟南芥生态型LER类似于抗性生态型COL-0的响应,并诱导的防御响应。报道了类似的PHI介导的抗性观察P. Infestans.-Challenged马铃薯[73.] 和P. Palmivora.- 挑战A. Thaliana.[71.].以前的研究表明,PHI突出了防御反应的一些方面,例如在没有病原体的情况下涉及SA,JA / ET途径的防御基因的表达[53.,71.,73.].然而,在存在/不存在PHI的情况下筛选SA和JA / ET相关的敲除突变体表明PHI介导的抗性P. Cinnamomi.在A. Thaliana.独立于SA、JA或ET信号通路[52.].
PHI也被证明干扰了广泛的生化和发育反应,包括PSR在植物中[15.- - - - - -18.许多已经被证明依赖于涉及SCF的生长素信号TIR1UPP复杂(19.- - - - - -21.].易感性拟南芥蟾蜍蛋白响应途径突变体和PI响应突变体小时-1到P. Cinnamomi.在这项研究中,与PI稳态的PHI干扰及其在植物防御反应诱导中的作用P. Cinnamomi.[53.提示Phi介导的抗性可能是通过其对Pi信号通路的影响,特别是对生长素信号通路的影响。
PSR响应基因的转录物水平ATPT2.,ATACP5.,AT4对缺磷的反应增加。然而,不同水平的Phi处理均抑制了其增强的表达,这与在充足Pi培养基中生长的植物中观察到的表达相似,表明Phi抑制PSR的作用。Ticconi等人支持这些结果[54.报告了Phi对PSR基因抑制的类似作用。而Phr1.在Pi充分条件下,Col-0经Phi处理后表达增加,表达量增加类似ATPT2.,ATACP5.和AT4没有观察到。这可能是因为Phr1.通过调节PI响应基因的表达来有助于下游PI信号传导[38.,40] 和PHO1和PHO2两者都作用于Phr1.调控调控局部吸收或Pi在茎和根之间的分配ATPT2.,AT4和ATACP5.[41.,44.,74.].虽然突变了Phr1.基因损害了许多PI信号传导相关的功能,通过Ribot等人的研究。[42.表示。的表达PHO1与植物的Pi状态无关。因此,除了那些依赖于PHO1和PHO2的反应以及这些反应的调控外,PHR1还可能影响其他的Pi反应。
Perez-Torres等[25.表明在缺磷条件下生长素敏感性增强拟南芥植物很大程度上通过增加的表达TIR1,加速了Aux / IAA蛋白的降解。除了与上述PSR / AUXIN信号传导的潜在相互作用之外,OSHRAGHI等人。[52.提示Phi部分通过ABA依赖机制发挥作用。因此,要考察Phi是否通过TIR1或ABA2在这两个基因中的突变是否影响了PHI对PSR的影响,PHI对表达的影响AT4和Phr1.在Pi充足和Pi缺陷培养的Col-0中进一步检测,ABA2-4和Tir1.-1.虽然在Col-0 Phi治疗中抑制了增强的转录水平Phr1.PI缺乏诱导,PHI增强了转录水平Phr1.在PI充足的种植样品和该诱导的水平依赖于使用的PHI浓度。这些结果表明,虽然PHI抑制了PI饥饿植物中的PSR,但在PI中施加PI足够的植物导致PSR的活化。对此的一个解释可能是PI和PHI之间的竞争,用于吸收或运输。它已被展示芸苔SPP。高PHI浓度通过竞争PI吸收来抑制植物发育[75.,76.].我们的结果表明Phr1.响应PI饥饿受到影响ABA2-4和Tir1.-1突变体表明了。的重要性ABA2和TIR1诱导的基因Phr1.和PSR。此外,Phi处理对转录水平没有显著影响Phr1.基因在ABA2-4或Tir1.-1突变体表明ABA2和TIR1基因可能破坏Phi对Pi信号的影响。
诱导的Phr1.在足够的Pi培养基中培养的Col-0样品中,Phi诱导了PSR和损失Phr1.基因表达Tir1.-1突变体强调了Phi处理可能诱导生长素反应途径。为了进一步测试这一点,Phi和Pi对Pi充足/Pi缺乏生长的Col-0的生长素信号的伴随影响,ABA2-4和Tir1.-1通过测量生长素应答基因的相对表达率来评估突变体,AUX1,AXR1,AXR2和SGT1B记录。缺磷增加了所有基因的转录水平,表明在缺磷植物中诱导了生长素反应途径。在Pi充足的Col-0, Phi处理(2.5和20 mM)诱导的转录水平AUX1,AXR1,AXR2和SGT1B这个诱导的水平取决于所用的Phi浓度。此外,磷饥饿对生长素应答基因的转录水平没有显著影响AUX1,AXR1,AXR2和SGT1B在里面ABA2-4和Tir1.-1突变体证实了一个角色ABA2和TIR1在PSR的诱导中。总的来说,结果表明ABA2和TIR1PSR和PHI介导的疾病响应基因表达需要基因,表明PHI可以通过ABA和唾液途径作用。
Phi对根系形态的影响
考虑到Phi在生长素响应基因表达方面模仿PSR的潜力,我们研究了形态对磷饥饿的响应,因为磷状态通过生长素信号作用对确定根结构非常重要[19.- - - - - -21.].磷缺乏可抑制col0生态型根的主根长度并诱导根毛的形成,而在充足磷和缺磷培养基中施用Phi均可抑制幼苗的主根生长。Pi饥饿根的形态反应与前面描述的一致[20.,21.,77.- - - - - -79.].较低浓度(≤2.5 mM)的Phi抑制磷酸饥饿诱导的根毛形成;而在磷充足的植株中,20mm Phi可诱导根毛的形成。Gilbert等人[80还表明,PHI显着增加了PI足够羽扇籽幼苗中的蛋白质根部(磷酸盐饥饿反应)的数量。总体而言,形态学和基因表达数据都表明蟾蜍素信号传导途径和磷脂信号在对PHI治疗的反应中的累积。
方法
植物和病原体材料
拟南芥加入哥伦比亚(Col-0)和几个A. Thaliana.突变体/转基因线(表2在本研究中使用了在不同的信号通路中有缺陷的Col-0背景。拟南芥基因型Col-0购自LEHLE Seeds (Round Rock, TX)及突变体rpt2a,RPT5A.,RPN10.,CNI1.由Dr Derek Gotto和Junji Yamaguchi(日本北海道大学)提供。剩余的突变体是从中获得的拟南芥生物资源中心(俄亥俄州州立大学Abrc);https://abrc.osu.edu/.蓝羽扇(l .狭叶的L.,CV。弥补的种子是从西澳大利亚西澳大利亚州农业和食品系(Dafwa)获得的种子。
Phytophthora cinnamomi.(分离株MP 94.48)Phytophthora.默多克大学的科学与管理(CPSM)。Phytophthora cinnamomi.根据Byrt & Grant所描述的方法无菌地产生游动孢子[81.],用亮线血球计测定游动孢子密度,并将浓度调整为1 × 105延长毫升−1使用无菌蒸馏水。
植物生长条件和接种程序
拟南芥生态型Col-0和突变体在半强度Gamborg的B-5基础培养基上发芽,0.8%(w / v)phytagar [82.].另外,将2.5mm MES [2-(N-(N-醛啉) - 乙磺酸] -KOH(pH5.7)和0.5%(w / v)蔗糖(pH 5.7,用KOH调节)。在培养培养基上播种后,在黑暗中,在4℃下将种子分层3天,然后用10-H光周期以100μmol的光子荧光速率在21℃下转移到生长柜中m−2年代−1.学习A. Thaliana.―P. Cinnamomi.相互作用,用3μl1×10接种了四周幼苗的附着叶子5P. Cinnamomi.延长毫升−1或3 μL无菌蒸馏水(对照)。接种72 h后,每个基因型采集5份样品进行侵染定量PCR (QPCR)分析,实验进行2次。
卢平(卢比斯angustifoliusL.,CV。蛋白碱在70%乙醇中灭菌2分钟,然后浸入50%漂白溶液(6.25%可用氯)5分钟。将灭菌的种子萌发在预润湿的无菌滤纸上,在黑暗中在25℃下蒸馏水3天。将幼苗置于潮湿的吸收纸(24×38.5cm)床上,置于两层透明塑料之间,卷起并置于填充50ml半强度水培Hoagland介质的200ml烧杯中[83.]并在具有10-H Photopheriod的生长柜中进一步增长(100μmolm−2年代−1在21±1°C)直至治疗。通过放置4毫米直径的塞子接种羽扇豆幼苗P. Cinnamomi.菌丝体在根的尖端。在接种后,在48小时和72小时内收集根组织样品的病变尺寸评估。
感染的定量PCR分析
为了定量测定感染水平,进行QPCR分析并相对量P. Cinnamomi.生物量(DNA)拟南芥根据Eshraghi等人[37.].接种后收集样品并在接种后冷冻72小时。收集每次处理的五个样品,每种处理含有来自一个幼苗的四个叶片(直径为7mm)。
羽扇豆的TIBA治疗和病变大小评估
生长素转运抑制剂TIBA(2,3,5 -三碘苯甲酸;(Sigma Aldrich)溶解在无水乙醇中,并将过滤过的灭菌TIBA加入到灭菌的半浓液Hoagland培养基中,最终浓度为10 μM。TIBA处理5日龄平方根苗,将平方根苗转移到含10 μM TIBA (+TIBA)的半强水培Hoagland培养基中。对于对照(−TIBA),将幼苗转移到含有与+ TIBA相同数量乙醇的半强度水培Hoagland培养基中。处理48 h后,用直径为4mm的牙根塞接种P. Cinnamomi.根尖和幼苗的菌丝在半强度水培霍格兰培养基中保存,直至收获。
每次治疗至少评估10个卢平根的病变发展情况,实验重复两次。分别于48和72 h后测定感染水平P. Cinnamomi.接种和数据被呈现为均值百分比感染的根区域。作为EPSON表达式1680扫描仪的根源的数字图像被捕获,并且由此形成的病变面积P. Cinnamomi.使用WinRHIZO™程序(Régents Instruments, Inc.)计算感染。
克隆phr1和tir1
以恢复的功能Phr1.和TIR1基因phr1-1和Tir1.-1敲除突变体,这些基因被克隆并转移到敲除突变体如下。以Col-0基因组DNA为模板进行克隆Phr1.基因(AT4G28610)和TIR1基因(AT3G62980)。使用Phusion®高保真DNA聚合酶(BioLabs)根据制造商说明进行PCR,使用包含attB重组位点的引物(Phr1.- forward 5´- GGG GAC AAG TTT GTA CAA AAA AGC AGG CT TCTC TTC CTT GGT CCT gga TTG和Phr1.-reverse 5'-GGG GAC CAC TTT GTA CAA GAA AGC TGG GTCTCT TCC TTG GGG ATC TGT TG,TIR1-forward 5´-GGG GAC AAG TTT GTA CAA AAA AGC AGG CTTCCG CTG TCC aac TTC TTC CTC和TIR1-reverse 5´-GG G GAC CAC TTT GTA CAA GAA AGC TGG GTCgtt cct aaa ccg gaa cac ga.根据制造商的说明使用Gateway®BPClonase®II酶混合物(Invitrogen)克隆PCR产物至PDONR207(Invitrogen)并转化为大肠杆菌主管细胞(DH5α)。测序确认后,将插入片段克隆到含有CAMV 2x35S启动子和带有Gateway a盒的CAMV终止子的Gateway®兼容表达载体pGREEN0179中[84.]使用Gateway®LR克隆酶®II酶混合物(Invitrogen公司)根据制造商说明。阳性克隆经PCR和PCR鉴定phr1-1,Tir1.-1突变体被转化使用农杆菌肿瘤术C58C1 (pCH32) [85.].
使用qRT-PCR定量检测基因转录
用于定量测量基因转录,生态型Col-0的种子和A. Thaliana.突变体ABA2-4和Tir1.-1在0.8% (W/V) phytagar-Gamborg B-5基础培养基(pH 5.7)上萌发。幼苗在21±1℃的生长箱中生长,光周期10小时,光子荧光速率100 μmol m−2年代−1转至0.8% (W/V) phytagar-Hoagland培养基[83.](用KOH调节pH 5.7,用不同浓度的PI(0和1.25mm)和PHI(0,0.5,2.5和20mm)在完全随机的设计中,并在5天进一步生长。用磷酸(Aldrich Chemicals)的过滤灭菌钾pHI(pH5.7,调节的pH5.7,调节的pH5.7)的储备溶液用磷酸(Aldrich Chemicals),并与灭菌培养基混合,得到特定的PHI浓度。收集样品,在液氮中冷冻并在-80℃下储存直至RNA提取和QRT-PCR。
为基因表达分析随机收集每处理的四个生物样品,每个样品是三种植物的池。组织样品使用Tissuelyser®(Qiagen,Inc。)均质化,RNEasy植物迷你套件(Qiagen,Inc。)用于根据制造商的说明分离RNA。使用上标III第一链合成系统用于RT-PCR(Invitrogen)大致,使用3μg的无DNA RNA用于第一链cDNA合成。基因特异性引物(附加文件1:表S1)使用Primer Express 1.5软件(Applied Biosystems Inc.)和QRT-PCR设计设计,根据[53.].突变体中所有基因的转录物水平是基于肌动蛋白2的表达(ACT2.)在相同的样品中测量,并相对于相应的PI足够的归一化表达水平呈现,非PI处理的植物作为折叠表达。
根形态学评估
对于形态学评估A. Thaliana.生态型Col-0的根和种子在0.5强度的Gamborg B-5基础培养基上生长,该培养基为0.8% (W/V) phytagar (pH 5.7)。1周龄幼苗转入含0.8% (W/V) phytagar的半强度Hoagland培养基[83.] (pH 5.7),不同浓度的Pi(0和1.25 mM)和Phi(0, 2.5和20 mM),完全随机设计,再生长7天。使用数码相机(尼康;Cool PIX 995),实验重复了两次。每次处理至少6棵幼苗,使用双目显微镜(奥林巴斯SZ40)和数码相机(尼康;Cool PIX 995),实验重复了两次。根毛密度是由5毫米根段(从根尖)的毛的数量来确定的。
数据分析
在所有测量中使用ANOVA以比较治疗,并且使用Genstat软件(第14版)测试残留的正常性。计算5%最低差异(LSD)用于使用Genstat软件(第14版)的治疗和基因型的平均比较。
缩写
- PSR:
-
磷酸盐饥饿反应
- 阿巴:
-
脱盐酸
- SA:
-
水杨酸
- 是:
-
茉莉酸
- 等:
-
乙烯
- IAA:
-
Indole-3-acetic酸
- 三碘苯甲酸:
-
2,3,5-三碘苯甲酸
- UPP:
-
泛素蛋白酶体途径
- 存在:
-
定量逆转录聚合酶链反应
- QPCR:
-
定量实时聚合酶链反应。
参考
- 1。
Brasier CM:国际植物贸易对英国和全球环境的生物安全威胁。植物病理学杂志。2008,57(5):792-808。10.1111 / j.1365-3059.2008.01886.x。
- 2。
汉森em:外星森林病原体:Phytophthora.物种正在改变世界森林。北方环境学报,2008,13:33-41。
- 3.
Shearer BL,Fairman RG:磷矿的茎注射保护银行物种和桉树marginata从Phytophthora cinnamomi.至少四年。植物病理学杂志。2007,36(1):78-86。10.1071 / AP06085。
- 4。
Hardham Ar:病原体简介:Phytophthora cinnamomi..莫尔植物途径。2005,6:589-604。10.1111 / J.1364-3703.2005.00308.x。
- 5。
亚磷酸酯和甲霜甲酰基可使澳洲坚果树衰老Phytophthora cinnamomi..作物科。2013,53:29-36。
- 6。
Scanu BB,Linaldeddu Bt,Franceschini A,Anselmi N,Vannini A,VANNNIO A,vettraino AM:发生Phytophthora cinnamomi.在意大利的软木橡树林。森林豪索尔。2013,43:340-343。10.1111 / EFP.12039。
- 7。
Guest D, Grant B:膦酸盐作为抗真菌剂的复合作用。中国科学(d辑:地球科学),1998,16(2):429 - 434。10.1111 / j.1469 - 185 x.1991.tb01139.x。
- 8。
亚磷酸酯作为一种杀菌剂防治植物土传病害的前景Phytophthora cinnamomi.在自然生态系统。植物学报。2001,30(2):133-139。10.1071 / AP01012。
- 9。
植物抗病和防御中的激素串扰:不仅仅是茉莉酸-水杨酸拮抗。植物病理学杂志。2011,49(26):317-343。
- 10.
Pozo MJ, Van Loon LC, Pieterse CMJ:植物-微生物相互作用中的茉莉酸信号。植物生长规律学报,2005,23(3):211-222。
- 11.
关键词:植物生长素,生长调节,逆境适应拟南芥.J Biol Chem。2007,282:10036-10046。10.1074 / JBC.M610524200。
- 12.
风扇J,Hill L,Crooks C,Dorerner P,Lamb C:脱落酸在调节不同植物 - 病原体相互作用方面具有关键作用。植物理性。2009,150:1750-1761。10.1104 / pp.109.137943。
- 13。
De Torres ZM,Bennett MH,Truman WH,Grant Mr:水杨酸和脱落酸之间的拮抗作用反映了早期的宿主 - 病原体冲突和模具植物防御反应。工厂J. 2009,59:375-386。10.1111 / J.1365-313x.2009.03875.x。
- 14。
Robert-Seilaniantz A,Maclane D,Jikumaru Y,Hill L,Yamaguchi S:MicroRNA mir393将次级代谢物生物合成重定向离Camalexin和氨基糖苷。工厂J.2011,67:218-231。10.1111 / J.1365-313x.2011.04591.x。
- 15.
李天明,蔡鹏飞,施玉涛,谢福:亚磷酸对磷肥饥饿反应的影响Ulva Lactuca(石莼目,叶绿藻).J phycol。2005,41:975-982。10.1111 / J.1529-8817.2005.00119.x。
- 16。
Ticconi Ca,德拉特里加州,Lahner B,Salt de,Abel S:拟南芥pdr2揭示了根本发展中的磷敏感检查点。工厂J. 2004,37:801-814。10.1111 / J.1365-313x.2004.02005.x。
- 17。
Li W- f, Perry PJ, Prafulla NN, Schmidt W:泛素特异性蛋白酶14 (UBP14)参与根对磷酸盐缺乏的反应拟南芥.acta botanica sinica, 2010, 32(1): 1 - 4。10.1093 / mp / ssp086。
- 18。
方Z,Shaob C,Menga Y,Wua P,Chen M:磷光标志拟南芥和奥雅萨苜蓿.植物SCI。2009,176(2):170-180。10.1016 / J.PLANTSCI.2008.09.007。
- 19。
Rietz S,Dermendjiev G,Oppermannb E,TafesseB FG,Effendib Y,Holkb A,Parkera Je,Teigec M,Schererb GFE:角色拟南芥与毒素的磷脂仿酶A中的磷脂仿酶A与毒素反应和磷酸盐缺乏有关。莫尔植物。2010,3(3):524-538。10.1093 / MP / SSP109。
- 20.
Lo´pez-Bucio J, Herna´ndez-Abreu E, Sa´nchez-Caldero n L, Nieto-Jacobo MF, Simpson J, Herrera-Estrella L:磷酸盐可获得性改变结构并导致激素敏感性的变化拟南芥根系。植物生理学报。2002,29(4):449 - 454。10.1104 / pp.010934。
- 21.
al-ghazi y,muller b,pinloche s,tranbarger tj,nacry p,rossignol m,tardieu f,doumas p:时间响应拟南芥磷酸盐饥饿的根系结构:养肝信号传导参与的证据。植物细胞环境。2003,26:1053-1066。10.1046 / J.1365-3040.2003.01030.x。
- 22.
Nacry P,Canivenc GV,Muller B,Azmi A,Van Onckelen H,Rossignol M,Doumas P:Auxin再分布在根系系统架构响应中的作用,以磷酸盐饥饿拟南芥.植物营养与肥料学报。2005,32(4):457 - 461。10.1104 / pp.105.060061。
- 23.
Jain A,Poling Md,Karthikeyan As,Blakeslee JJ,Peer Wa,Titapiwatanakun B,Murphy As,Raghothama kg:蔗糖和养肝症对局部磷酸盐缺乏诱导的根系结构不同性状调制的差异影响拟南芥.植物营养与肥料学报。2007,32(4):451 - 457。10.1104 / pp.106.092130。
- 24。
WOWARD AW,BARTEL B:AUXIN:监管,行动和互动。Ann Bot。2005,95:707-735。10.1093 / AOB / MCI083。
- 25。
Perez-Torres C-A, Lopez-Bucio J, Cruz-Ramırez A, Ibarra-Laclette E, Dharmasiri S, Estelle M, Herrera-Estrella L:磷酸盐的有效性改变侧根的发育拟南芥通过调节涉及TiR1毒素受体的机制的养蛋白灵敏度。植物细胞。2008,20:3258-3272。10.1105 / TPC.108.058719。
- 26。
Yu H, Moss BL, Jang SS, Prigge M, Klavins E, Nemhauser JL, Estelle M: TIR1生长素受体的突变增加了生长素/吲哚-3-乙酸蛋白的亲和力,导致生长素超敏反应。植物营养与肥料学报,2013,32(4):429 - 434。10.1104 / pp.113.215582。
- 27。
生长素结合蛋白1,植物生长素第二受体:双受体概念在植物信号转导中的意义是什么?中国生物医学工程学报。2011,62(10):3339-3357。10.1093 / jxb / err033。
- 28。
泛素26S蛋白酶体蛋白水解途径。植物营养与肥料学报,2004,32(5):591 - 598。10.1146 / annurev.arplant.55.031903.141801。
- 29。
奥斯汀MJ,Muskett P,Kahn K,Feys BJ,Jones JDG,Parker Je:监管角色SGT1.在早期的R基因介导的植物防御。科学。2077-2080,2002:295-
- 30。
灰色WM,Muskett Pr,Chuang H-W,Parker Je:拟南芥SCF需要SGT1bTIR1- 介导的植物响应。植物细胞。2003,15:1310-1319。10.1105 / TPC.010884。
- 31.
tor m,gordon p,cuzick a,eulgem t,sinapidou e,mert-türkf,can c,dangl jl,holub eb:拟南芥SGT1b是几种霜霉病抗性基因所赋予的防御信号所必需的。acta botanica sinica(云南植物研究),2002,14(4):593 - 598。10.1105 / tpc.001123。
- 32.
多德的PN, Schwechheimer C:防御信号的崩溃。植物学报。2002,14(4):514 - 514。
- 33.
Azevedo C, Sadanandom A, Kitagawa K, Freialdenhoven S, Shirasu K, Schulze-Lefert P: RAR1相互作用体SGT1B,是一种重要成分R基因触发抗病性。科学。2073-2076,2002:295-
- 34.
许维海麻,邓晓伟:多泛素连接酶介导的过程需要COP9信号体和AXR1的功能。acta botanica sinica(云南植物学报). 2002,14(4):553- 563。10.1105 / tpc.003434。
- 35.
Llorente F,Muskett P,Sanchez-Vallet A,Lopez G,Ramos B,Sanchez-RodrıguezC,Jorda L,Parker J,Molina A:抑制植金响应路径的增加拟南芥对病症真菌的易感性。莫尔植物。2008,1(3):496-509。10.1093 / MP / SSN025。
- 36。
Lookes Je,Wright Ml,Cahill DM:阐明诱导的防御反应和信号通路拟南芥在挑战之后Phytophthora cinnamomi..physiol mol植物疗法。2008,72:151-161。10.1016 / J.PMPP2008.08.005。
- 37。
Eshraghi L,Aryamanesh N,Anderson JP,Shearer B,McComb Ja,Hardy Gesj,O'Brien PA:用于植物植物植物病原体的Planta定量准确的定量PCR测定Phytophthora cinnamomi..植物营养与肥料学报。2011,31(4):429 - 434。10.1007 / s10658 - 011 - 9819 - x。
- 38。
在维管植物和单细胞藻类中,MYB转录因子参与了磷酸盐饥饿信号的传递。基因工程学报,2001,15(4):489 - 494。10.1101 / gad.204401。
- 39。
关键词:小分子rna,应激调控,分子生物学拟南芥.植物细胞环境。2001-2019,2004:16-
- 40.
acta botanica sinica(云南植物研究中心);acta botanica sinica(云南植物研究中心);中国生物医学工程学报,2004,33(5):514 - 514。10.1093 / jxb / erh009。
- 41.
Rouached H,Secco D,ARPAT B,Poirier Y:转录因子PHR1在磷酸盐饥饿时在调节硫酸盐脱落助焊剂中起关键作用拟南芥.BMC植物BIOL。2011,11:1-19。10.1186 / 1471-2229-11-1。
- 42.
Rizot C,Wang Y,Poirier Y:ATPHO1家族三个成员的表达分析显示磷酸盐缺乏症中涉及的信号通路与对蟾蜍素,细胞蛋白和脱钙酸的反应之间的差异相互作用。Planta。2008,227:1025-1036。10.1007 / s00425-007-0677-x。
- 43.
Chiou TJ: microrna在感知营养胁迫中的作用。植物学报。2007,30(3):323-332。10.1111 / j.1365-3040.2007.01643.x。
- 44.
Miura K, Rus A, Sharkhuu A, Yokoi S, Karthikeyan AS, Raghothama KG, Baek D, Koo YD, Jin JB, Bressan RA, Yun D- j, Hasegawa PM拟南芥SUMO E3连接酶SIZ1控制磷酸盐缺乏反应。美国国家科学院学报。[j] .环境科学学报,2003,21(4):457 - 461。10.1073 / pnas.0500778102。
- 45.
灰色wm,kepinski s,rouse d,Leyser o,Estelle M:助生素调节SCFTIR1- Aux / IAA蛋白的依赖性降解。自然。2001,414:271-276。10.1038 / 35104500。
- 46.
F-box蛋白TIR1是一种生长素受体。自然资源学报。2005,435:441-445。10.1038 / nature03543。
- 47.
Dharmasiri N, Dharmasiri S, Weijers D, Lechner E, Yamada M, Hobbie L, Ehrismann JS, Jurgens G, Estelle M:植物发育是由植物生长素受体F box蛋白家族调控的。开发细胞,2005,9:109-119。10.1016 / j.devcel.2005.05.014。
- 48。
Kepinski S,Leyser O:拟南芥F-box蛋白TIR1是生长素受体。自然资源学报。2005,435:446-451。10.1038 / nature03542。
- 49。
拉莫斯JA,Zenser N,Leyser O,Callis J:毒素/吲哚酸蛋白的快速降解需要域II的保守氨基酸,并且是蛋白酶体的依赖性。植物细胞。2001,13:2349-2360。
- 50。
FU HY,Toelling JH,Arendt CS:20S蛋白酶体基因家族的分子组织拟南芥.基因工程学报。1998,19(4):487 - 492。
- 51。
Smalle J,Kurepa J,Yang Pz:26s蛋白酶体亚基的抗脂肪作用RPN10在拟南芥生长和发育支持在脱钙酸信号中的基质特异性功能。植物细胞。2003,15:965-980。10.1105 / TPC.009217。
- 52。
植物抗性的防御信号通路与磷酸盐介导的抗性调控有关Phytophthora cinnamomi..中国农业科学,2014,32:342-356。10.1007 / s11105 - 013 - 0645 - 5。
- 53。
Eshraghi L,Anderson J,Aryamanesh N,Shearer B,McComb Ja,Hardy Gesj,O'Brien PA:磷矿灌注防御反应和增强的防御基因表达拟南芥感染Phytophthora cinnamomi..植物病理学杂志。2011,60:1086-1095。10.1111 / j.1365-3059.2011.02471.x。
- 54。
亚磷酸酯对磷素饥饿反应的影响拟南芥.植物营养与肥料学报。2001,27(3):963-972。10.1104 / pp.010396。
- 55.
Thao HTB,Yamakawa T:亚磷酸酯(磷酸):杀菌剂,肥料或生物刺激器?土壤SCI植物NUTR。2009,55:228-234。10.1111 / J.1747-0765.2009.00365.x。
- 56.
Nilsson L, Lundmark M, Jensen PE, Nielsen TH: The拟南芥转录因子Phr1.是适应强光和维持正常光合作用的关键。植物营养学报。2012,32(4):591 - 598。10.1111 / j.1399-3054.2011.01520.x。
- 57.
Delhaize E,Randall PJ:磷酸盐蓄能器突变体的表征拟南芥.植物理性。1995,107:207-213。
- 58.
Poirier Y, Thoma S, Somerville C, Schiefelbein J:一个突变体拟南芥缺乏磷酸盐的木质荷荷载荷。植物理性。1991,97:1087-1093。10.1104 / pp.97.3.1087。
- 59.
植物生长素对植物生长发育的影响。生物医学工程学报,2009,35(4):591 - 598。10.1016 / j.cell.2009.03.001。
- 60.
Benjamins R,Scheres B:植物征:植物开发中的循环之星。Annu Rev植物Biol。2008,59:443-465。10.1146 / annurev.arplant.58.032806.103805。
- 61.
叶1与生长素活性的不对称聚合抑制brevipedicellus.表达促进叶片发展拟南芥.发展。2006,133:3955-3961。10.1242 / dev.02545。
- 62.
Petricka JJ,Benfey PN:根层:发展模式复杂调节。CurrOpin Genet Dev。2008,18:354-361。10.1016 / J.GDE.2008.05.001。
- 63.
生长素在植物病害发育中的作用。植物病理学杂志。1993,31:253-273。10.1146 / annurev.py.31.090193.001345。
- 64.
生长素反应基因表达:基因、启动子和调控因子。植物生态学报。2002,49(4):497 - 503。10.1023 /: 1015207114117。
- 65.
Ueda M,Matsui K,Ishiguro S:rapidopsis rpt2a.26S蛋白酶体亚基的编码是根分生组织维持的各个方面所必需的,并与它的同源物冗余地调节配子发生,RPT2B..植物细胞生理。2011,52:1628-1640。10.1093 / PCP / PCR093。
- 66.
Ueda M,Matsui K,Ishiguro S,Sano R,Wada T,Paponov I,Palme K,Okada K:The停止了根基因编码的26S蛋白酶体亚基RPT2a是维持机体健康的关键拟南芥营商。发展。2004,131:2101-2111。10.1242 / dev.01096。
- 67.
Gallois JL,Guyon-Debast A,LeCureuil A,Vezon D,Carpentier V,Bonhomme S,Guerche P:The拟南芥蛋白酶体RPT5亚基对于配子体发育至关重要,并显示依赖依赖性冗余。植物细胞。2009,21:442-459。10.1105 / TPC.108.062372。
- 68.
Sakamoto T, Kamiya T, Sako K:拟南芥26 s蛋白酶体单元rpt2a.和RPT5a对锌缺乏耐受性至关重要生物工程学报,2011,34(5):561-567。10.1271 / bbb.100794。
- 69.
Coffey MD,Joseph MC:磷酸和Fosetyl-Al对生命周期的影响Phytophthora cinnamomi.和疫霉citricola.植物病理学杂志。1998,25(9):1042-1046。10.1094 /发朵- 75 - 1042。
- 70.
杰克逊TJ,Burgess T,Colquhoun I,Hardy Gesj:杀菌剂磷矿的作用桉树marginata接种Phytophthora cinnamomi..植物别墅。2000,49:147-154。10.1046 / J.1365-3059.2000.00422.x。
- 71.
膦酸钾诱导的防御反应Phytophthora Palmivora.- 挑战拟南芥.植物营养与肥料学报。2006,27(5):441 - 446。
- 72.
Gunning TK, Conlan XA, Parker RM, Dyson GA, Adams MJ, Barnett NW, Cahill DM:接种蓝平生的次级代谢物图谱Phytophthora cinnamomi.基亚后治疗。植物生态学报,2013,40(11):1089-1097。10.1071 / FP13023。
- 73.
佛罗伦西亚Machinandiaga M,Candela Lobato M,Laura Feldman M,Raul Daleo G,Balbina Andreu A:磷矿钾原始的防御反应对植物对抗植物紫杉醇的反应。J植物理性。2012,169(14):1417-1424。10.1016 / J.JPLPH.2012.05.005。
- 74。
Bari R,Pant BD,STITT M,SCEIBLE WR:PHO2,MicroRNA399和PHR1在植物中定义磷酸态信号通路。植物理性。2006,141(3):988-999。10.1104 / pp.106.079707。
- 75。
Carswell MC, Grant BR, Theodorou M, Harris J, Niere J, Plaxton W:杀菌剂膦酸盐破坏了磷素饥饿反应芸苔幼苗。植物理性。1996,110:105-110。
- 76。
Carswell M,Grant B,Plaxton W:通过杀菌剂膦酸盐油籽油菜悬浮细胞的磷酸盐饥饿响应的破坏。Planta。1997年,203:67-74。10.1007 / S00050166。
- 77。
Linkohr BI, Williamson LC, Fitter AH, Ottoline Leyser HM:硝酸盐和磷酸盐的有效性和分配对根系结构有不同的影响拟南芥.植物学报,2002,29(6):751-760。10.1046 / j.1365 - 313 x.2002.01251.x。
- 78。
Williamson L,Ribrioux SP,Fitter Ah,Leyser HM:磷酸盐可用性调节根系架构拟南芥.植物理性。2001,126:875-882。10.1104 / pp.126.2.875。
- 79.
Bates Tr,Lynch JP:刺激根发伸长率拟南芥低磷的可用性。植物细胞环境。1996,19:529-538。10.1111 / J.1365-3040.1996.TB00386.X。
- 80.
Gilbert Ga,Knight JD,Vance CP,Allan DL:磷缺乏羽扇豆的蛋白质根系被养肝和膦酸模拟。Ann Bot。2000,85:921-928。10.1006 / ANBO.2000.1133。
- 81.
在无菌培养中控制游动孢子产生的一些条件Phytophthora cinnamomi.兰德。植物学报,1979,27:103-115。10.1071 / BT9790103。
- 82.
大豆根细胞悬浮培养的营养需求。细胞生物学杂志,1998,21(3):441 - 446。10.1016 / 0014 - 4827(68) 90403 - 5。
- 83.
Hoagland Dr,Arnon Di:不含土壤的种植植物的水培养方法。加州AGR EXP STAT CIRC。1938,347:461-
- 84.
Wiszniewski A,周W,Smith S,Bussell J:识别两个拟南芥编码过氧异相体氧化还原酶样蛋白和酰基-CoA合成酶样蛋白的基因,该丙基辅助酶应反应对促毒素所需的蛋白质。植物mol biol。2009,69(5):503-515。10.1007 / s11103-008-9431-4。
- 85.
Tai TH, Dahlbeck D, Clark ET, Gajiwala P, Pasion R, Whalen MC, Stall RE, Staskawicz BJ:表达Bs2辣椒基因赋予番茄中细菌斑病的抗性。美国国家科学院学报。1999,96(24):14153-14158。10.1073 / pnas.96.24.14153。
- 86.
Laby RJ,Kincaid Ms,Kim D,Gibson Si:the拟南芥糖不敏感突变体SIS4和SIS5在脱落酸的合成和反应中有缺陷。植物学报,2000,23(5):587-596。10.1046 / j.1365 - 313 x.2000.00833.x。
- 87.
Gaude N,Nakamura Y,Cheible WR:磷脂酶C5(NPC5)参与叶片叶片磷酸盐限制期间的半乳糖累积拟南芥.工厂J. 2008,56:28-39。10.1111 / J.1365-313x.2008.03582.x。
- 88.
汉堡D,Rezzonico E,Petetot JMC,Somerville C,Poirier Y:识别和表征拟南芥pho1.参与磷酸盐加载到木质的基因。植物细胞。2002,14(4):889-902。10.1105 / TPC.000745。
- 89.
昂柯,林思,吴创,黄日东,苏春林,邱天俊:pho2是由MicroRNA399靶基因的无意义突变引起的。植物营养与肥料学报。2006,31(3):441 - 446。10.1104 / pp.106.078063。
- 90。
陈志强,陈志强:TIR1泛素连接酶感知生长素的机制。自然资源学报。2007,446:640-645。10.1038 / nature05731。
- 91。
Sonoda Y, Sako K, Maki Y:叶片器官大小的调节rapidopsis rpt2a.19 s蛋白酶体亚基。植物学报,2009,60:68-78。10.1111 / j.1365 - 313 x.2009.03932.x。
- 92。
林玉玲,宋淑玲,蔡洪林:蛋白酶体缺陷而非底物识别功能是导致蛋白质表型缺失的原因拟南芥蛋白酶体亚基RPN10.acta botanica sinica, 2011, 32(6): 754- 754。10.1105 / tpc.111.086702。
致谢
我们感谢澳大利亚英联邦政府提供国际研究生研究奖学金(IPRS)和默多克大学研究奖学金(Murs)。我们还感谢Abrc(哥伦布,哦)为本研究中测试的大多数突变线提供。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
Le进行了实验设计,疾病评估,基因表达研究,克隆,转化,数据分析,并起草了手稿。JA和NA参与了基因表达实验,疾病筛查评估的设计,并参与了数据的解释并修改了稿件。JM和BS参与了疾病评估测定设计并修改了手稿。GH协调这项研究并参与疾病评估的解释,并批判性修改稿件。所有作者阅读并认可的终稿。
电子补充材料
12870_2013_1486_moesm1_esm.docx.
附加文件1:表S1:用于定量实时逆转录聚合酶链反应(QRT-PCR)实验的基因特异性引物对的序列。(DOCX 15 KB)
作者的原始提交的图像文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上不受限制地使用、分发和复制,但须注明原作的出处。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Eshraghi, L., Anderson, J.P, Aryamanesh, N.。et al。生长素反应途径的抑制增强了对Phytophthora cinnamomi.虽然亚磷酸盐介导的抗性刺激了蟾蜍素信号传导途径。BMC植物BIOL.14,68(2014)。https://doi.org/10.1186/1471-2229-14-68
收到了:
接受:
发表:
关键字
- 脱盐酸
- 吲哚-3-乙酸(IAA)
- 磷酸盐饥饿反应(PSR)
- 三碘苯甲酸
- 泛素蛋白酶体途径(UPP)