摘要
背景
无头大白菜的基因组(芸苔属植物拉伯ssp。对)、大白菜(芸苔属植物拉伯ssp。学报)和它们的近亲拟南芥为研究十字花科植物的进化和遗传改良提供了重要资源。自然生长条件给这些植物带来了各种生理挑战,它们有一整套基因来确保适应性和正常生长。我们通过研究植物在自然环境中生长的适应性和发育控制基因的差异表达,探讨其表达的潜在机制。
结果
利用数字基因表达标签分析,我们构建了一个表达谱来识别自然生长条件下重要农艺性状的相关基因。在三个不抽头的大白菜品种中,我们发现数千个基因在五个发育阶段表现出显著的表达水平差异。通过对比分析,我们发现了几个与晚开花、耐寒、自交不亲和和叶片颜色相关的候选基因。采用实时荧光定量PCR技术鉴定了2个耐寒相关基因。
结论
我们鉴定了大量与无头大白菜重要农艺性状相关的基因。本研究为分子辅助育种提供了丰富的资源。该分析的原始数据和详细结果可在网站上获得http://nhccdata.njau.edu.cn.
背景
芸苔属植物拉伯L.植物具有丰富的形态和遗传多样性,包括人类在世界范围内大规模种植的许多植物亚种。农业作物的例子包括萝卜、芥菜和大白菜。无头大白菜(芸苔属植物拉伯ssp。对)的五个品种,是研究表型多样性的遗传学和机制的极好模型。特别有趣的是它的开花和自交不亲和的特性。一般来说,高等植物从营养生长到开花的转变是个体发育的关键,决定了其繁殖的时机和质量。花诱导已成为近年来研究的热点芸苔属植物蔬菜(1- - - - - -3.],而无头大白菜在这方面是一个重要的工具。
分子生物学技术的最新进展表明,花的诱导是通过长日、自主、春化和赤霉素依赖的遗传途径调控的[4- - - - - -6].早花和晚花突变体已在模式植物中鉴定出来拟南芥许多控制开花的关键基因也在其他植物中被分离出来,包括方法,LFY,英国《金融时报》,SOC1[6- - - - - -8].然而,关于无头大白菜开花或调控开花的基因的报道很少。
自交不亲和是一种防止近亲自花授粉和近交的遗传机制。促进了物种的分化;任何在种群中罕见的等位基因,如果存在于不能自我受精的植物中,都有优势。在被子植物中,雌蕊对花粉的化学识别阻止了自花受精,这依赖于自花不育(年代)-等位基因,并已独立进化至少三次[9].然而,从异交到自交的转变是高等植物在自然选择下功能丧失的一种常见的进化趋势年代-花粉或柱头中的等位基因[10].因此,植物自交不亲和系统是理解S位点变异的一个很好的模型。异交和自交以及频率依赖选择之间的转换导致许多不同不亲和类型的等位基因的长期维持[11],因此等位基因在不同种群的物种中广泛分布[9,12].
在无头大白菜生产中,自交不亲和系统被用于育种,也使该植物成为研究生殖生物学和平衡选择的模式系统[13].随着新一代高通量测序技术的发展,许多物种的表达谱得到了广泛的研究。此外,数字基因表达标签分析已被用于研究基因表达的变化[14,15],给出了在生物过程中发生的mRNA表达变化的全面快照。表达水平可以通过检测到的标签数量来计算,这些信息可以促进我们对植物遗传和发育机制的理解。
到目前为止,还没有关于无头大白菜表达谱的报道。为了在自然环境下鉴定不同不抽头大白菜品种间的差异表达基因(DEGs),我们对非对照条件下生长的大白菜进行了表达谱分析。在中国生产的五种无头白菜中,大约80%是小白菜(也称为福菜)。因此,我们选择了三个白菜种质(NHCC001、NHCC002和NHCC004)来研究在五个重要发育阶段的表达谱差异。相对于NHCC001和NHCC002, NHCC004的螺栓和花比较晚,而NHCC002是唯一一个自不亲和的。NHCC002的叶片颜色比NHCC001和NHCC004的叶片颜色浅。我们系统全面地评价了这些种质的表达谱,鉴定了5个发育阶段的deg,分析了它们的表达模式,并鉴定了与重要农艺性状相关的候选基因。
结果与讨论
无头大白菜的表达谱分析
利用高通量测序技术,研究了三个非抽穗型大白菜品种(NHCC001、NHCC002和NHCC004)在五个发育阶段(五叶、莲座、成体、抽苔和开花)的基因表达模式。总共对5545万份原始标签进行了测序。过滤后,我们分别获得了大约1747、1797和1777万次对NHCC001、NHCC002和NHCC004的清洁标签的读取,所有五个发育阶段加在一起(附加文件)1:表S1)。在这些清洁标签中,NHCC001、NHCC002和NHCC004中分别有73.61%(1285万个)、69.73%(1253万个)和68.18%(1212万个)的reads可以映射到由NHCC001草案基因组构建的非抽穗大白菜基因,分别有63.00%(1100万个)、60.37%(1084万个)和57.98%(1030万个)的reads可以映射到唯一基因(表2)1).
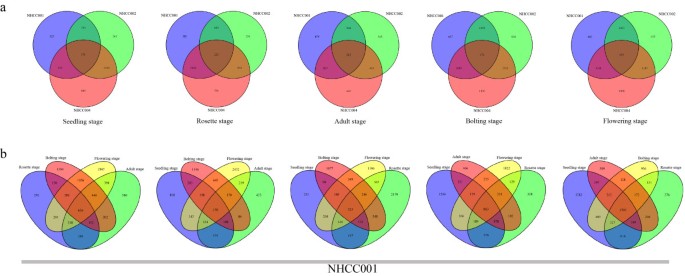
在3个不抽头大白菜品系的5个发育阶段共检测到29 101个基因2:图S1)。在NHCC001、NHCC002和NHCC004中分别有15 251、13 316和5869个基因在5个发育阶段表达。我们还研究了不同种质在各阶段的基因表达情况。3个种质在叶片、莲座、成虫、抽苔和花期共表达基因分别为13 546、15 281、15 029、16 333和12 704个2:图S2)。
无头大白菜中DEGs的鉴定
结果表明,在5个发育阶段,3个种质间共有15 830个独特基因存在差异表达1:表S2)。每一遗传或发育阶段的deg数量以维恩图和表格形式显示(图1,附加文件2:图S3,附加文件1:表S3,表S4)。为了深入了解deg,我们进行了卡方检验P值被纠正使用错误发现率(附加文件1:表S5)。上调和下调基因在散点图中显示(附加文件2:图S4)。
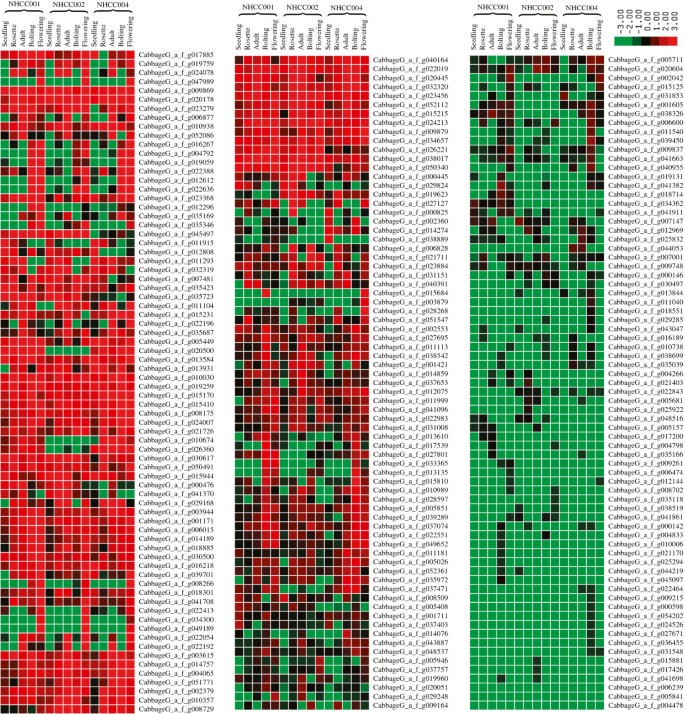
我们使用Cluster程序(http://bonsai.hgc.jp/~mdehoon/software/cluster/software.htm)来识别基因表达谱中具有共同特征和相似表达水平的亚群。我们假设聚集在一组的DEGs可能具有相似的功能,或参与相同的代谢过程。在我们的分析中,聚类是根据DEG表达值绘制的。在Cluster中,表达水平相近的deg被聚在一起。利用这些簇,我们可以根据同一簇中的已知基因推断新鉴定基因的功能,如开花和自交不亲和候选基因簇(图2,附加文件2:图S5)。
DEGs的功能注释及通路分析
使用基因本体论(GO)数据库获得与每个deg相关的细胞成分、分子功能和生物过程。例如,在苗期,NHCC001中与抗氧化活性、翻译调节活性和繁殖相关的基因比NHCC002中更多。然而,NHCC002中辅助转运基因数量多于NHCC001(补充文件)2:图S6)。基于同源群聚类(Clusters of orthologous Groups, COG)数据库,将属于同一同源簇的基因归为一组。以NHCC001和NHCC002苗期的DEG为例,聚类结果显示,大多数DEG基因属于一般功能类,其次是翻译、核糖体结构和生物发生相关基因(附加文件)2:图S7)。进行了京都基因和基因组百科(KEGG)通路分析,以阐明DEGs的能量代谢、信号转导和生物系统。我们发现一些deg参与了植物生长发育的几个重要途径,如开花基因和叶绿素基因途径,详细描述如下。
花期基因分析
我们发现了近150个基因,这些基因从成虫到抽苔阶段有增加的趋势,对应于从营养生长到生殖生长的变化。这些基因主要参与:转录调控途径,如rna结合蛋白;蛋白质生物合成,如核糖体蛋白L1/L13/S7;泛素信号通路,如泛素蛋白、锌指(c3hc4型环指)、丝氨酸/苏氨酸蛋白激酶、富甘氨酸蛋白GRP-3;花形态发生(MADS-box)。相比之下,近220个基因从成虫期到抽苔期呈下降趋势。这些基因主要参与谷氨酰胺代谢(如糖基转移酶家族14 [GT14]和糖磷酸渗透酶);蛋白磷酸酶途径(如丝氨酸/苏氨酸蛋白激酶、丝氨酸/苏氨酸蛋白磷酸酶);转录调控(如rna结合蛋白、meprin和TRAF同源结构域蛋白);蛋白质生物合成(如核糖体蛋白L1/L10/L2/L4/L5/S10/L21E/S12/S3AE和锌指蛋白); and some transcription factors (such as MAF1 [MADS AFFECTING FLOWERING 1], CBF2 [C-REPEAT/DRE BINDING FACTOR 2] and TINY [a member of the DREB subfamily A-4 of ERF/AP2 transcription factor family].
MAF1被认为是一种潜在的开花抑制剂,因为它在营养阶段(叶、莲座丛和成虫)特异性表达。这一结果与Ratcliffe等人的结果一致。[16和He等人。[17].CBF2而且小在抽苔期很少表达,在开花期不表达。
Seo等人。[18]发现冷诱导基因的过表达CBFs可增加开花位点C的表达(方法的上游负调节器SOC1,从而推迟开花。此外,低温可诱导CBFs的表达[19].过度表达CBF2基因也导致抗冻能力增强拟南芥[20.,21].由于冷反应与开花之间存在串扰,我们假设降低了表达CBF2与营养生长向生殖生长的转变有关。
我们还发现了一些与NHCC004晚开花特异相关的基因。一个例子是FLM(开花位点m;CabbageG_a_f_g029765,与Bra024350),是一种MADS-box转录因子,是开花的负调控因子[22]在NHCC004的抽苔期和开花期表达,而在NHCC001或NHCC002中不表达2:图S8a)。qRT-PCR结果与此表达趋势一致(附加文件2:图S8b)。这表明FLM可能是NHCC004开花晚的原因。
赤霉素不敏感基因(CabbageG_a_f_g018551)在NHCC004的栓栓阶段也发现了,但在NHCC001或NHCC002的任何阶段都没有检测到(附加文件2:图S8c)。该基因的qRT-PCR结果显示,与NHCC004相比,NHCC001和NHCC002在抽苔期的表达水平较低(附加文件2:图S8d)。许多研究表明赤霉素是开花所必需的拟南芥在短暂的白天[23,24].赤霉素不敏感基因在NHCC004中的表达增加,赤霉素促进开花的作用减弱。因此,开花抑制基因的高表达可能是NHCC004开花延迟的原因之一。
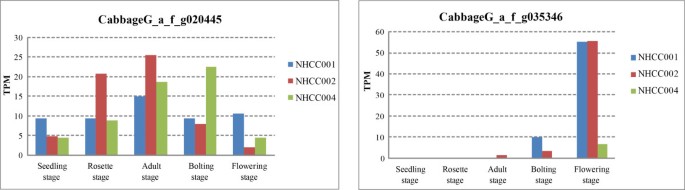
的英国《金融时报》开花位点T基因(CabbageG_a_f_g035346,与Bra004117),以促进开花[25,26],在NHCC004中仅在花期表达,而在NHCC001和NHCC002中则在抽苔期和花期表达3.).在开花的昼夜节律过程中,英国《金融时报》被消极地调节ELF3[27].我们的表情分析发现ELF3基因(CabbageG_a_f_g020445)均先升高后降低。的表达式ELF3在NHCC001和NHCC002的成虫期和NHCC004的抽苔期达到峰值。同源基因,ELF4(CabbageG_a_f_g013931),ELF6(CabbageG_a_f_g052536),显示了同样的趋势(附加文件1:表S2)。这些结果表明,开花基因的延迟表达可能进一步解释了NHCC004的晚开花。
花期的特定基因可能与花的发育和授粉过程有关。我们的研究结果表明,一些基因的表达水平,如CabbageG_a_f_g015439而且CabbageG_a_f_g018658,在花期均显著最高。CabbageG_a_f_g015439该基因编码ARK3蛋白,与SLG (S座糖蛋白)同源,参与自交花粉的识别[28,29].CabbageG_a_f_g018658该基因编码AGL6 (agamus -like MADS-box protein 6),并作为DNA结合和转录因子发挥作用。MADS-box基因家族成员在花发育中起着重要作用,并参与确定花发育早期的分生组织和花发育后期的花器官原基的身份[30.].
耐寒基因分析
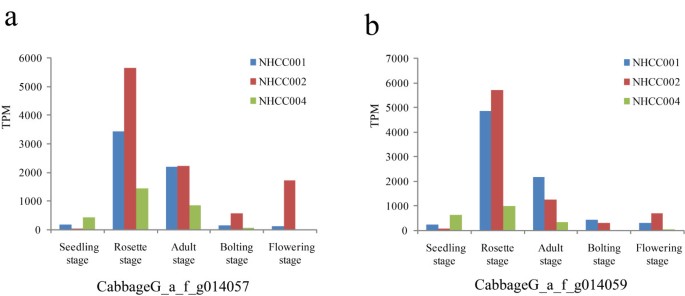
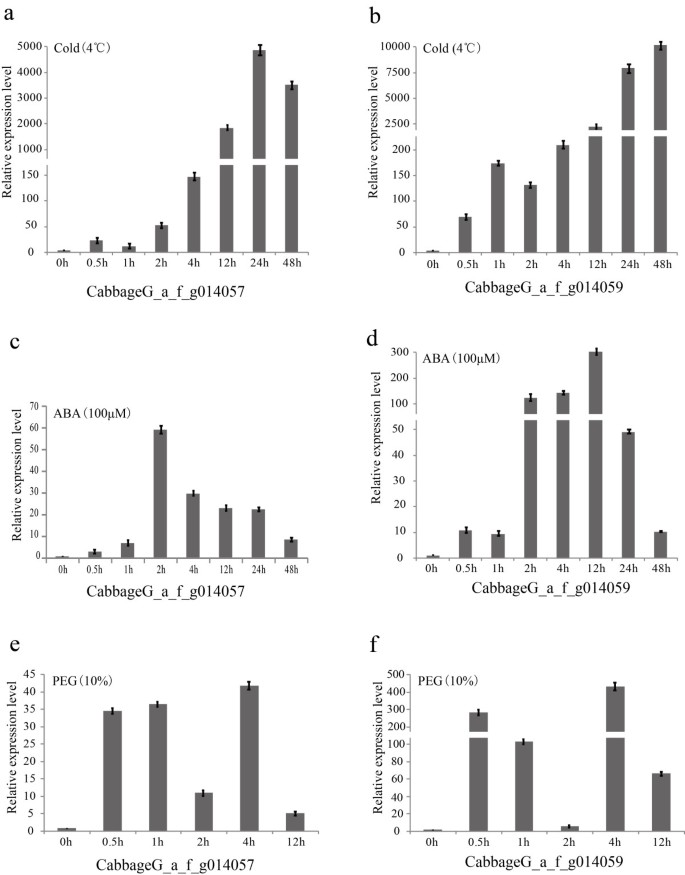
从表达谱分析中,我们发现两个冷调节基因(CabbageG_a_f_g014059而且CabbageG_a_f_g014057,与Bra000265而且Bra000263结果表明,在莲座期(每百万转录本[TPM] > 4000)的表达量高于其他4个时期(图4).
南京秋冬季气温波动较大。例如,2009年,气温在5天内(10月15日至10月20日)从10°C降至0°C。这些外部温度的剧烈变化可能是冷调节基因高表达的原因。为了验证这一推论,我们使用实时荧光定量PCR研究了这两个基因的表达水平(图5).结果表明,4℃处理12 h后,相对表达量为>1000。此外,ABA和PEG处理也改变了其相对表达量。一般来说,低温、PEG和ABA相互作用激活胁迫基因的表达,大多数冷相关基因的表达也受到PEG或ABA处理的影响。因此,我们认为这些基因的高表达与无头大白菜的抗寒性密切相关。
自交不亲和基因分析
三个基因,CabbageG_a_f_g006792,CabbageG_a_f_g011856,CabbageG_a_f_g039867,在所有五个阶段均有表达,仅在NHCC002中存在(附加文件2:图S9)。这些基因分别编码丝氨酸/苏氨酸蛋白激酶、NAC结构域含蛋白82和动力蛋白轻链1型家族蛋白。其中,CabbageG_a_f_g006792而且CabbageG_a_f_g011856与营养期相比,抽苔期和花期含量显著降低。然而,CabbageG_a_f_g039867抽穗期转录量增加,开花期转录量下降。在自花授粉过程中,s位点受体激酶(SRK)和m位点蛋白激酶(MLPK)等丝氨酸/苏氨酸蛋白激酶参与了自交不亲和信号通路的识别和自磷酸化[31- - - - - -33].因此,表达水平的变化CabbageG_a_f_g006792可影响丝氨酸/苏氨酸蛋白激酶的活化,从而影响自交花粉的识别和排斥。NAC结构域蛋白是植物特异性转录因子,参与调控植物的花和胚发育等多种发育过程[34- - - - - -36].因此,这些特异性表达的基因可能与NHCC002的自交不亲和有关。
我们还发现CabbageG_a_f_g031080NHCC001和NHCC004在各阶段均有较高的转录本,而NHCC002在抽苔期和开花期表达量较低(附加文件2:图S9)。该基因编码核糖体蛋白L13,它参与蛋白质的组装。核糖体蛋白L13的下调可能与NHCC002自花花粉发育受到抑制有关。与NHCC001和NHCC004相比,NHCC002的46个基因即使在开花期间也表现出较低的转录水平,TPM为零。
有趣的是,一些基因编码了囊泡外套复合物和ATEXO70H7,这与分泌蛋白运输和极化胞吐有关[37,38].Exo70A1参与花粉管尖的生长,已被确定为花粉的负调控因子芸苔属植物自交不亲和反应[39,40].我们发现,与加入NHCC002相比,在NHCC001和NHCC004中囊泡外套复合物和ATEXO70H7的表达水平更高,因为这些蛋白在开花期的表达水平为零。囊泡涂层复合物和ATEXO70H7的低丰度提示它们在NHCC002的自不亲和反应中可能具有类似负调控因子的功能。
叶片颜色基因分析
我们分析了与叶片颜色相关的基因。这些基因在叶绿素生物合成、叶绿体结构和植物发育中起着重要的控制作用。此外,它们可能通过调节光合作用来影响作物产量。因此,鉴定叶色相关基因,揭示叶色性状的遗传基础,对提高作物产量具有重要意义。使用便携式叶绿素仪(SPAD-502Plus,柯尼卡美能达)测量叶片的叶绿素含量。测定结果表明,NHCC001和NHCC002的叶绿素指数在莲座期差异显著。通过对这两个品系叶绿素基因(KO00860)通路相关基因的分析,我们发现NHCC002的浅色叶片很可能是由于叶绿素合成减少,可能是叶绿素酶活性降低所致[41,42].
的CabbageG_a_f_g026085在NHCC002中,编码叶绿体蛋白荧光的基因也表达较低。此外,qRT-PCR显示了与表达谱相同的表达模式(附加文件2:图S10)。它参与叶绿素生物合成的调节,可能是叶绿体中四吡咯生物合成的负调节因子[43,44].这一结果表明CabbageG_a_f_g026085也可能是与无头大白菜叶绿素生物合成相关的候选基因。
在基因组共线块之间b·拉伯而且答:芥
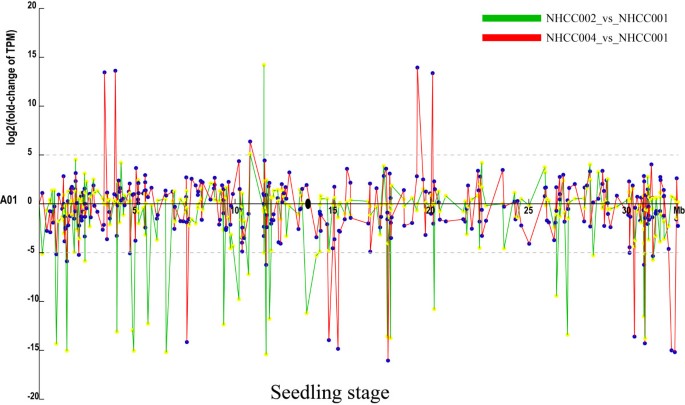
在我们的表达谱中,有29 101个基因被表达,其中28 638个(98.4%)表达基因被定位到10条染色体上。在这些表达基因中,15 830个(54.4%)被鉴定为不同种质或发育阶段的基因,15 567个(98.3%)位于10条染色体上。为了更直观地显示DEGs的上调和下调,我们用调控信息标记了每条染色体上的DEGs(图6,附加文件2:图S11)。
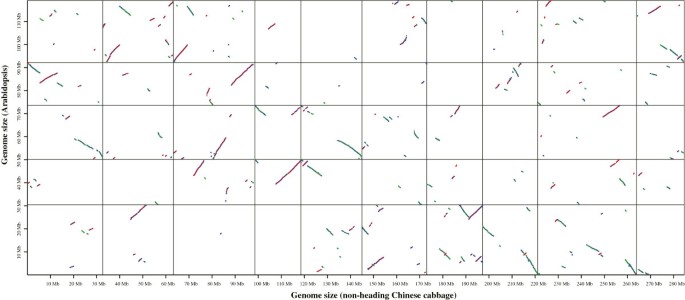
在非抽头大白菜和非抽头大白菜基因组间共线区块共581个拟南芥.剔除包含10个基因以下的共线基因块后,共线基因块总数为369个(63.5%)。在15830个deg中,近一半(7504个,47.4%)位于共线块中(图7).在不抽穗大白菜和抽穗大白菜中共线块共710块。去除含有10个以下基因的共线基因块412个(58.0%)。共线区共鉴定了23.1%(3652个)的deg(附加文件)2:图S12)。
为了进一步描述不抽头大白菜、抽头大白菜和拟南芥我们对其中的同源基因和同源基因进行了分析。非抽头大白菜、抽头大白菜和抽头大白菜的全基因组副同源基因对分别为31 322、20 770和23 171对拟南芥,分别。在直系基因方面,不抽穗大白菜与非抽穗大白菜的同源基因对共有46 716对拟南芥而不抽头大白菜与抽头大白菜的基因对数为64 975对。此外,我们还研究了不抽头大白菜中存在差异表达的副同源基因的数量,发现4092个(25.8%)基因在不抽头大白菜中存在副同源基因(附加文件)1:表S6)。在这些基因中,1960个只有一个旁基。117 DEGs的平行谱数为> - 10,16 DEGs的平行谱数为> - 50。
大多数具有>50个平行序列的基因属于非长端重复逆转录因子逆转录酶。我们使用Pfam程序(http://pfam.sanger.ac.uk/) [45]鉴定出属于9183个deg的3840个平行谱。在这些平行序列中,大多数编码的蛋白是富亮氨酸重复序列蛋白、蛋白激酶结构域蛋白、WD结构域和g - β重复序列(附加文件)2:图S13)。
我们还分析了不抽穗大白菜与抽穗大白菜的同源基因对,共鉴定出13 932个同源基因。其中9012个基因在抽穗大白菜中有1个直系同源体,314个基因在抽穗大白菜中有>10个直系同源体,1个基因(CabbageG_a_f_g017292)有54名骨科医生对大白菜进行抽头。而非抽穗大白菜和非抽穗大白菜的直系配型数为11 512个(72.7%)拟南芥(附加文件1:表S7), 7368个基因中只有一个同源基因拟南芥,当矫正医师数为> ~ 10时,减少至199例。有趣的是,同样的基因(CabbageG_a_f_g017292)也有相对较高数量的orthortho(即56)拟南芥.同样的基因在无头白菜中也有37个平行同源基因。虽然该基因拷贝数变异高的原因尚不清楚,但我们推断它可能影响植物生长。因此,我们对其功能进行了标注,发现它是一种抗病蛋白(TIR-NBS-LRR类)。
结论
在我们的分析中,我们发现了许多与重要农业性状相关的deg。通过比较品种和发育阶段,我们发现了许多与开花时间、自交不亲和性、耐寒性和叶片颜色相关的基因。虽然其他大部分基因的功能尚不清楚,但本研究将有助于我们进一步了解这些基因的表达模式和对不抽头大白菜或其他十字花科蔬菜的遗传改良,以及基础生物学研究。特别是,阐明与开花有关的调控网络将有助于晚花新品种的培育,从而为育种提供丰富的资源。这项对不抽头大白菜表达谱的详细分析首次全面回顾了五个发育阶段的表达模式,并揭示了许多可能构成不抽头大白菜形态和遗传多态性基础的候选基因。
材料与方法
样品制备
用于表达谱的无头大白菜品系NHCC001、NHCC002和NHCC004在田间非控制环境下栽培。RNA是在植物的五个重要发育阶段提取的:幼苗、莲座、成虫、抽苔和开花。在前三个阶段,从叶片中提取用于表达谱的RNA。抽苔期的RNA是从等量的叶子和芽中提取的,而在开花期间,叶子和花被用来提取RNA。所有RNA都按照RNeasy植物迷你试剂盒(Qiagen)的制造商说明进行提取。
数字基因表达标记分析
与之前的报告一样,使用数字基因表达标签分析方法获得了这三个种质在五个发育阶段的基因表达水平[15].一个唯一标记序列被检测到的次数代表了相应转录本在组织中的定量表达。
领结计划(http://bowtie-bio.sourceforge.net/index.shtml)用于将测序结果映射到不打头的大白菜基因组[46].最后,将优质清洁标签与不抽头大白菜基因组序列进行比较,并将各基因的表达量量化为TPM [47].
为了评估mRNA的表达特征,我们分析了每个鉴定基因的TPM。高表达基因(定义为TPM > 100)占所有基因总表达标签>的50%(附加文件)2:图S14a)。TPM < 10的基因数量占所有基因的55%,而TPM > 80的基因数量仅占所有基因的10%(附加文件2:图S14b)。对其他两个样本的统计分析显示了类似的模式,说明大多数基因表达水平较低,只有少数基因表达水平较高,占了大多数标签读取量。这符合mRNA表达的异质性和冗余性特征。
我们还对测序数据进行了饱和度分析。数据显示,一个基因的测序标签越多,它就越有可能在一定范围内表达。当标签数量达到一个阈值时,表达的基因数量接近饱和。我们的分析表明,当标签数为> 300万时,表达基因的数量接近饱和(附加文件2:图S14c)。在我们的研究中,NHCC004莲座期获得的最低标签数为340万个。因此,我们的测序reads在所有样本阶段都已达到饱和,确保在我们的研究中检测到植物生长发育过程中的大部分表达基因。
deg的鉴定
deg的鉴定主要如前所述[48].用IDEG6软件鉴定表达基因[49],并采用一般卡方检验来检验假设。错误发现率被用来纠正P值(50],并计算其折叠变化,以鉴定差异表达基因。为避免高通量测序的潜在噪声信号,采用绝对折叠变化≥2.0和错误发现率<0.01来定义deg,包括上调和下调基因。通过Perl脚本绘制的散点图,比较和可视化了三种获取的五个阶段基因的差异表达水平,并使用Cluster程序中的热图函数显示其表达模式(http://bonsai.hgc.jp/~mdehoon/software/cluster/software.htm),并使用Tree View软件(http://jtreeview.sourceforge.net/) [51].利用Cytoscape软件(http://www.cytoscape.org/)根据基因的表达水平[52].使用R软件包中的维恩图函数绘制特异性和常见deg的数量[53].
植物材料、生长条件和胁迫处理
为了验证这两个候选冷相关基因,采用非抽穗型大白菜品种“苏州青”(NHCC001)进行实时荧光定量PCR。种子在含有蛭石土(3:1)混合物的花盆中生长,在受控环境的生长室中生长16/8小时,25/20°C,昼夜,相对湿度为55-60%。在莲座期,移栽到温度为4℃、光照强度和日照长度与冷处理相同的生长箱中。分别在冷处理后0、0.5、1、2、4、12、24、48 h采集叶片样品。在驯化的同时,在pH为6.5的塑料容器中,将部分植物在1/2 Hoagland的溶液中培养。驯化5天后,分别在100 μМ脱落酸、10%聚乙二醇或不处理中培养。在这些处理后0、0.5、1、2、4、12、24和48小时收集叶片样本,然后在液氮中冷冻并保存在−70°C下,直到进一步分析。
RNA分离及实时荧光定量PCR分析
按照制造商的说明,使用RNA试剂盒(Tiangen, China)从叶片中分离总RNA。使用Prime Script RT试剂盒(TaKaRa, Japan)将RNA逆转录为cDNA。肌动蛋白基因(AF111812)作为内控,规范不同样本间靶基因的表达水平[54].根据目的基因序列,利用Primer 5.0软件设计特异性引物(附加文件1:表S8)。实时荧光定量PCR检测采用3个生物重复和3个技术重复。每个反应均在20 μ l的反应混合物中进行,该混合物含有稀释的cDNA作为模板,SYBR Premix Ex Taq (2×) (TaKaRa,日本)和基因特异性引物。采用MyiQ单色实时PCR检测系统(Bio-rad, Hercules, CA)进行实时定量PCR,循环曲线如下:94℃30 s,然后94℃10 s, 58℃30 s, 40个循环,然后生成熔解曲线(65℃10 s, 61个循环),检查特异性扩增。采用相对定量方法对基因的相对表达量进行分析。RNA水平相对于肌动蛋白基因表达(AF111812)为2——ΔΔCT,其中Ct为周期阈值,根据以往研究[55].
功能注释和通路分析
通过检索蛋白质数据库Iprscan (http://www.ebi.ac.uk/Tools/pfa/iprscan/), UniProtKB (http://www.ebi.ac.uk/uniprot/) [56], TrEMBL (http://www.ebi.ac.uk/uniprot/TrEMBLstats/) [57,去(http://www.geneontology.org/) [58],及KEGG (http://www.genome.jp/kegg/) [59],并使用Perl脚本集成从这五个蛋白质数据库中获得的注释。此外,利用COG (http://www.ncbi.nlm.nih.gov/COG/) [60]和GO数据库。COG数据库代表了主要的系统发育谱系,每个COG由来自至少3个谱系的单个蛋白质或类群组成。
在草图基因组上绘制差异表达基因
使用Perl脚本可视化了所有预测基因、表达基因和差异表达基因在染色体上的分布,并用不同颜色的线表示每个基因数据集。用OrthoMCL软件鉴定同源和副同源基因(http://www.orthomcl.org/cgi-bin/OrthoMclWeb.cgi) [61],并且使用Perl脚本计算这些基因的拷贝数。采用McScan (MATCH_SCORE: 40, MATCH_SIZE: 5, GAP_SCORE:-2, EXTENSION_DIST: 40, E_VALUE: 1e-05;http://chibba.agtec.uga.edu/duplication/mcscan/) [62].所有对所有BLASTP的比较为蛋白质聚类提供了e值和成对的基因信息。通过识别基因簇来延长成对片段。用该方法构建了不抽头大白菜与抽头大白菜和抽头大白菜的基因组同步块拟南芥.此外,我们筛选了具有<10个基因的共线块,以获得改进的共线分析。最后,根据物理位置标记位于共线块中的deg,并使用Perl脚本绘制共线块与标记的deg。
参考文献
- 1.
Koornneef M, Alonso-Blanco C, Blankestijn-de Vries H, Hanhart CJ, Peeters AJM:晚开花突变体的遗传相互作用拟南芥.中国生物医学工程学报,1998,14(2):885-892。
- 2.
Araki T, Kobayashi Y, Kaya H, Iwabuchi M:开花时间基因FT及其对开花的调控拟南芥.植物保护学报,2004,27(1):1 - 7。
- 3.
Putterill J, Laurie R, Macknight R:开花时间的基因控制。生物学报,2004,26(4):363-373。10.1002 / bies.20021。
- 4.
Onouchi H, Igeno MI, Perilleux C, Graves K, Coupland G:过表达CONSTANS的植物突变显示了新的相互作用拟南芥花期基因。植物学报,2000,12(6):885-900。
- 5.
Samach A, Onouchi H, Gold SE, Ditta GS, Schwarz-Sommer Z, Yanofsky MF, Coupland G: CONSTANS靶基因在水稻生殖发育中的作用拟南芥.科学通报,2000,29(4):516 - 516。10.1126 / science.288.5471.1613。
- 6.
王志军,黄建强,黄玉军,陈芳芳,郑保生:山核桃FLORICAULA/叶状叶基因同源物的克隆与鉴定。植物分子生物学学报,2012,30(3):794-805。10.1007 / s11105 - 011 - 0389 - z。
- 7.
Mouradov A, Cremer F, Coupland G:开花时间的控制:相互作用途径作为多样性的基础。植物学报,2002,14:S111-S130。
- 8.
金世永,朴博思,权世杰,金俊,林mh, Park YD, Kim DY, Suh SC, Jin YM, Ahn JH, Lee YH:植物的延迟开花时间拟南芥而且芸苔属植物拉伯通过从大白菜中分离开花位点C (FLC)同源物的过表达(芸苔属植物拉伯l . ssp学报).植物细胞学报,2007,26(3):327-336。10.1007 / s00299 - 006 - 0243 - 1。
- 9.
李文杰,李志刚,李志刚。植物自交不亲和系统的分子进化研究。植物保护学报,2005,38(1):457 - 457。10.1111 / j.1469-8137.2005.01443.x。
- 10.
Busch JW, Schoen DJ:当配偶受到限制时,自我不相容的进化。植物科学进展,2008,13(3):128-136。10.1016 / j.tplants.2008.01.002。
- 11.
vkemans X, Slatkin M:配子体自交不亲和位点的基因和等位基因谱系。中国生物医学工程学报,1994,37(4):357 - 357。
- 12.
平衡选择下种群结构对基因的影响。进化,2001,55(8):1532-1541。
- 13.
Goubet PM, Berges H, Bellec A, Prat E, Helmstetter N, Mangenot S, Gallina S, Holl AC, Fobis-Loisy I, Vekemans X, Castric V:植物显性和隐性自交不亲和单倍型分子进化模式的比较拟南芥.公共科学学报,2012,8 (3):e1002495-10.1371/journal.pgen.1002495。
- 14.
冯玲,刘辉,刘颖,陆震,郭刚,郭松,郑辉,高勇,程松,王杰,张凯,张勇:深度测序和安杰微阵列技术在基因表达谱研究中的应用。Mol生物技术,2010,45(2):101-110。10.1007 / s12033 - 010 - 9249 - 6。
- 15.
王震,董东,茹斌,杨瑞林,韩宁,郭涛,张松:蝙蝠指部数字基因表达标记分析为翅膀形成提供了强有力的候选基因。中国生物医学工程学报,2010,11:619-10.1186/1471-2164-11-619。
- 16.
李志刚,李志刚,李志刚:植物开花过程的调控拟南芥FLC的同系物。中国农业科学,2001,26(1):1 - 2。10.1104 / pp.126.1.122。
- 17.
He C, Sommer H, Grosardt B, Huijser P, Saedler H: PFMAGO,一种MAGO nash样因子,与来自Physalis floridana的mads域蛋白MPF2相互作用。Mol生物学报,2007,24(5):1229-1241。10.1093 / molbev / msm041。
- 18.
徐娥,李浩,田俊,朴华,金俊,卢玉生,李i:冷反应与开花的相互作用拟南芥是通过开花时间基因SOC1及其上游负调控因子FLC介导的。植物学报,2009,21(10):3185-3197。10.1105 / tpc.108.063883。
- 19.
张志刚,郭志刚,郭志刚,马志刚:低温诱导的研究进展拟南芥CBF基因包括多个ICE (CBF表达诱导子)启动子元件和一个低温脱敏的冷调节电路。植物营养学报,2003,26(2):344 - 344。10.1104 / pp.103.027169。
- 20.
胡萍,麦提涛:一种非参数均值方差平滑评估方法拟南芥冷应激转录调节因子CBF2过表达芯片数据。公共科学学报,2011,6 (5):e19640-10.1371/journal.pone.0019640。
- 21.
Sharabi-Schwager M, Lers A, Samach A, Guy CL, Porat R: CBF2转录激活子在拟南芥中的过表达延缓叶片衰老,延长植株寿命。实验学报,2010,61(1):261-273。10.1093 / jxb / erp300。
- 22.
研究了一种抑制开花的MADS-box基因的鉴定。植物学报,2001,26(2):229-236。10.1046 / j.1365 - 313 x.2001.01024.x。
- 23.
Moon J, Suh SS, Lee H, Choi KR, Hong CB, Paek NC, Kim SG, Lee I: SOC1 mms -box基因整合春化和赤霉素信号于开花拟南芥.植物学报,2003,35(5):613-623。10.1046 / j.1365 - 313 x.2003.01833.x。
- 24.
Wilson RN, Heckman JW, Somerville CR:赤霉素是植物开花所必需的拟南芥在短暂的日子。中国农业科学,2004,27(1):1 - 5。10.1104 / pp.100.1.403。
- 25.
Lopez-Vernaza M, Yang S, Muller R, Thorpe F, de Leau E, Goodrich J: SEPALLATA3、FT和FLC基因作为多梳子群基因CURLY LEAF靶基因的拮抗作用。公共科学学报,2012,7 (2):e30715-10.1371/journal.pone.0030715。
- 26.
Kobayashi Y, Weigel D:继续向上,是时候改变了——移动信号控制光周期依赖的开花。基因开发,2007,21(19):2371-2384。10.1101 / gad.1589007。
- 27.
木下T,小野N, Hayashi Y, Morimoto S,中村S, Soda M, Kato Y, Ohnishi M,中野T, Inoue S, Shimazaki K:开花位点T调控气孔开放。动物学报,2011,21(14):1232-1238。10.1016 / j.cub.2011.06.025。
- 28.
Scutt CP, Gates PJ, Gatehouse JA, Boulter D, Croy RR:一种编码s位点特异性糖蛋白的cDNA芸苔属植物oleracea含有S5自交不亲和等位基因的植物。生物化学学报,2000,20(3):489 - 497。10.1007 / BF00391746。
- 29.
Delorme V, Giranton JL, Hatzfeld Y, Friry A, Heizmann P, Ariza MJ, Dumas C, Gaude T, Cock JM:芸苔属S3单倍型S位点基因SLG和SRK的鉴定:S位点受体激酶基因编码的膜定位蛋白的鉴定。植物学报,2004,27(3):344 - 344。10.1046 / j.1365 - 313 x.1995.7030429.x。
- 30.
Rounsley SD, Ditta GS, Yanofsky MF: MADS盒基因在中国的不同作用拟南芥发展。中国生物医学工程学报,2004,27(4):457 - 457。
- 31.
Giranton JL, Dumas C, Cock JM, Gaude T:芸苔属植物整体膜s位点受体激酶在膜性环境中具有丝氨酸/苏氨酸激酶活性,并在植物中自发形成低聚物。自然科学进展,2000,29(3):379 - 379。10.1073 / pnas.97.7.3759。
- 32.
Cabrillac D, Cock JM, Dumas C, Gaude T: s位点受体激酶被硫氧还蛋白抑制,被花粉外套蛋白激活。自然科学,2001,41(1):1 - 3。10.1038 / 35065626。
- 33.
Murase K, Shiba H, Iwano M, Che FS, Watanabe M, Isogai A, Takayama S:一种参与芸苔属自交不亲和信号传导的膜锚蛋白激酶。科学通报,2004,29(6):528 - 528。10.1126 / science.1093586。
- 34.
Sablowski RW, Meyerowitz EM: APICAL MERISTEM的同源物是花同源基因APETALA3/PISTILLATA的直接靶标。中国生物医学工程学报,1998,32(1):344 - 344。10.1016 / s0092 - 8674(00) 80902 - 2。
- 35.
杜华,谢特峰,金秀云,汤丽娟:拟南芥NAC结构域超家族成员AtNAM的分子特征。植物分子生物学,2002,50(2):237-248。10.1023 /: 1016028530943。
- 36.
孙丽娟,孙丽娟,王丽娟,王丽娟,王丽娟。水稻NAC转录因子家族的基因组分析。中国生物医学工程学报,2010,32(1):344 - 344。
- 37.
施普林格S, Schekman R:内质网对COPII囊泡外套复合体成核高尔基囊泡SNAREs。科学通报,1998,29(3):344 - 344。
- 38.
Li S, van Os GM, Ren S, Yu D, Ketelaar T, Emons AM, Liu CM: EXO70基因在植物中的表达及功能分析拟南芥提示它们在调节细胞类型特异性胞吐中的作用。中国生物医学工程学报,2010,34(4):379 - 379。10.1104 / pp.110.164178。
- 39.
Hala M, Cole R, Synek L, Drdova E, Pecenkova T, Nordheim A, Lamkemeyer T, Madlung J, Hochholdinger F, Fowler JE, Zarsky V:植物胞外囊复合体在植物细胞生长中的作用拟南芥和烟草。植物学报,2008,20(5):1330-1345。10.1105 / tpc.108.059105。
- 40.
Samuel MA, Chong YT, Haasen KE, aldia - brydges MG, Stone SL, Goring DR:芸苔属植物对亲和和自交不亲和花粉反应的细胞通路调控拟南芥柱头在Exo70A1相交,Exo70A1被认为是外囊复合体的组成部分。植物细胞学报,2009,21(9):2655-2671。10.1105 / tpc.109.069740。
- 41.
杨晓涛,张志强,Joyce D,黄晓明,徐丽丽,庞晓强:香蕉和芭蕉高温成熟过程中叶绿素降解特征。食品化学,2009,114(2):383-390。10.1016 / j.foodchem.2008.06.006。
- 42.
陈凯,张峰,阚杰:绿花椒(Zanthoxylum schinifolium Zucc.)缓慢干燥过程中叶绿素分解特征。中国食品科学,2012,26(6):457 - 457。10.1007 / s00217 - 012 - 1718 - 7。
- 43.
Meskauskiene R, Nater M, Goslings D, Kessler F, op den Camp R, Apel K: FLU:一种叶绿素生物合成的负调控因子拟南芥.美国国家科学研究院。2001, 32(2): 357 - 357。10.1073 / pnas.221252798。
- 44.
Kleffmann T, Russenberger D, von Zychlinski A, Christopher W, Sjolander K, Gruissem W, Baginsky S拟南芥叶绿体蛋白质组揭示了途径丰富和新的蛋白质功能。动物学报,2004,14(5):354-362。10.1016 / j.cub.2004.02.039。
- 45.
Punta M, Coggill PC, Eberhardt RY, Mistry J, Tate J, Boursnell C, Pang N, Forslund K, Ceric G, Clements J, Heger A, Holm L, Sonnhammer EL, Eddy SR, Bateman A, Finn RD: Pfam蛋白家族数据库。核酸决议2012,40(数据库issue): D290-301。
- 46.
Langmead B, Trapnell C, Pop M, Salzberg SL:人类基因组短DNA序列的超快和内存高效对齐。基因组生物学,2009,10 (3):R25-10.1186/gb-2009-10-3 r25。
- 47.
陈玉春,肖德昌,林卫东,胡春明,黄培平,何建民:跨物种数字差分显示分析数据库ZooDDD。生物信息学,2006,22(17):2180-2182。10.1093 /生物信息学/ btl358。
- 48.
Audic S, Claverie JM:数字基因表达谱的意义。中国生物医学工程学报,1997,7(10):986-995。
- 49.
Romualdi C, Bortoluzzi S, D 'Alessi F, Danieli GA: IDEG6:多标记采样实验中差异表达基因检测的网络工具。中国生物医学工程学报,2003,12(2):159-162。
- 50.
王晓明,王晓明,王晓明,王晓明。行为遗传学研究中错误发现率的控制。中国脑科学,2004,27(1):1 - 4。
- 51.
Saldanha AJ: Java treeview可扩展的微阵列数据可视化。生物信息学,2004,20(17):3246-3248。10.1093 /生物信息学/ bth349。
- 52.
Cline MS, Smoot M, Cerami E, Kuchinsky A, Landys N, Workman C, Christmas R, Avila-Campilo I, Creech M, Gross B, Hanspers K, Isserlin R, Kelley R, Killcoyne S, Lotia S, Maere S, Morris J, Ono K, Pavlovic V, Pico AR, Vailaya A, Wang PL, Adler A, Conklin BR, Hood L, Kuiper M, Sander C, Schmulevich I, Schwikowski B, Warner GJ,等:利用Cytoscape集成生物网络和基因表达数据。应用物理学报,2007,26(3):389 - 397。10.1038 / nprot.2007.324。
- 53.
陈海涛,陈海涛。基于维恩图和欧拉图的生物信息学研究。2011,12:35-10.1186/1471-2105-12-35。
- 54.
肖东,张新文,赵俊杰,Bonnema G,侯晓玲:非抽头大白菜实时定量PCR归一化内参基因的验证。植物学报,2012,39(4):342-350。10.1071 / FP11246。
- 55.
Pfaffl MW:一种新的实时RT-PCR相对定量数学模型。中国生物工程学报,2001,29 (9):e45-10.1093/nar/29.9.e45。
- 56.
Schneider M, Consortium TU, Poux S:植物蛋白质组学研究混乱中的UniProtKB。植物科学进展,2012,30 (3):342 -
- 57.
O 'Donovan C, Martin MJ, Gattiker A, Gasteiger E, Bairoch A, Apweiler R:优质蛋白质知识资源:SWISS-PROT和TrEMBL。生物工程学报,2002,3(3):275-284。10.1093 /龙头/ 3.3.275。
- 58.
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT, Harris MA, Hill DP, Issel-Tarver L, Kasarskis A, Lewis S, Matese JC, Richardson JE, Ringwald M, Rubin GM, Sherlock G, Consortium GO:基因本体论:生物学统一的工具。基因本体联盟。植物学报,2000,25(1):25-29。10.1038/75556。
- 59.
Tanabe M, Kanehisa M:使用KEGG数据库资源。生物信息学学报,2012,1:1-12。
- 60.
Tatusov RL, Koonin EV, Lipman DJ:蛋白质家族的基因组视角。科学通报,1997,27(4):344 - 344。10.1126 / science.278.5338.631。
- 61.
李丽玲,李志强,李志强,李志强,等。真核生物基因组正正交基团的鉴定。基因组学报,2003,13(9):2178-2189。10.1101 / gr.1224503。
- 62.
唐海华,王晓霞,王晓明,王晓明,王晓明,王晓霞:植物基因组共线性与共线性研究。科学通报,2008,32(4):344 - 344。10.1126 / science.1153917。
确认
国家重点基础研究计划项目(973计划:2012CB113900)、国家自然科学基金项目(31330067)、国家高技术研究与发展计划项目(863计划,2012AA100101)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
该研究由XS和XH构思。XH和XS收集了无头白菜的数据集。XS对数据分析、生物信息学分析和手稿准备做出了贡献。XS和YL参与了稿件的撰写。所有作者都对修改手稿做出了贡献。所有作者都阅读并批准了最终的手稿。
宋晓明、李颖对这项工作做出了同样的贡献。
电子辅助材料
表S2。
附加文件1:表S1: 3个无头大白菜品系5个发育阶段的表达谱数据。三种无头大白菜(TPM)五个发育阶段的表达值。表S3。不同发育阶段中不同表达基因的数量。表S4。同一发育阶段三个品系间差异表达基因。表S5。苗期NHCC001与NHCC002差异表达基因的统计分析表S6。无头大白菜差异表达基因中副同源基因的数量。表S7。与不抽头大白菜比较差异表达基因的同源基因数拟南芥和大白菜。表S8。引物序列用于实时荧光定量PCR扩增肌动蛋白和两个耐寒基因。(xls6mb)
一)
附加文件2:图S1:每个发育阶段表达基因的数量。NHCC001;b)NHCC002;c)NHCC004。图S2。3个品系各发育阶段的表达基因数。一)幼苗;b)玫瑰;c)成年人;d)锚杆支护;e)开花。图S3。NHCC002和NHCC004五个发育阶段差异表达基因的数量。图S4。苗期各种质间基因表达有差异上调或下调。红点代表上调基因,绿点代表下调基因。图S5。TPM中自交不亲和候选基因的聚类图。图S6。差异表达基因的GO注释。图S7。差异表达基因的COG。图S8。两个候选开花基因的表达水平。a, c)每百万的转录,通过表达谱;而且(b, d)qRT-PCR检测相对表达量。图S9。从无头大白菜差异表达基因中鉴定出自交不亲和基因。图S10。无头大白菜叶绿素相关基因的表达水平及途径。图S11。各阶段3个种质间差异表达基因在染色体上的折叠变化。(即,在染色体1上为莲座、成虫、抽苔和花期。)图S12。不抽头大白菜与抽头大白菜全基因组共线块。Syntenic block由红点或绿点组成,分别代表在相同或相反方向上的任何两条染色体上的最佳命中。蓝点表示共线块中存在的差异表达基因。图向。属于副同源基因和其他差异表达基因的差异表达基因的Pfam域注释。图S14系列。表达谱数据的统计分析。一)TPM分布图;b)各TPM区间基因数统计图;c)序贯饱和度分析图。(rar 9mb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
宋,X,李,Y,刘,T。et al。大白菜农艺性状相关基因的表达谱分析。BMC植物生物学14日,71(2014)。https://doi.org/10.1186/1471-2229-14-71
收到了:
接受:
发表:
关键字
- 无头大白菜
- 表达谱
- 差异表达基因
- 蛋白质功能注释
- 染色体分布
- 农艺性状