摘要
背景
生物来源的土壤添加剂的生产和使用是肥料工业中增长最快的部门之一。这些产品已被证明可以提高作物产量,同时减少对农田的肥料投入和养分损失。人们对驱动初级生产力和土壤过程变化的机制知之甚少,对与使用微生物产品相关的次级生产力变化知之甚少。在这里,我们通过监测苯丙烷(PP)途径的变化来研究生物来源的土壤添加剂的次生代谢反应拟南芥.
结果
本研究旨在测试其中一种产品(Soil Builder™-AF, SB)在不同时间施用后对次生代谢的影响。SB的一次性(TI)应用拟南芥与同一产品的多次(TII)应用相比,增加了类黄酮的积累。质谱法鉴定出黄酮醇、花青素等14种酚类化合物。TI处理的主要化合物山奈酚-3,7- o -双α- l-鼠李糖苷和槲皮素3,7-地李糖苷分别比对照增加了3倍和4倍。花青素含量最高的是3-鼠李糖苷,与对照和TII相比,TI处理的花青素含量分别增加了3倍和2倍。同时,在PP途径中编码关键酶的基因的表达苯丙氨酸解氨酶,肉桂酸4-羟化酶,查尔酮合成酶,黄酮-3 ' - o -羟化酶,黄酮醇合成酶而且dihydroflavonol-4-reductase)和调控基因(花青素色素的产生2,Myb12, myb113, myb114, egl3,而且TT8)在两种处理(TI和TII)中均上调。此外,TI和TII诱导木质素通路基因的表达(羟基肉桂酰转移酶,咖啡酰辅酶a o -甲基转移酶,肉桂醇脱氢酶,肉桂酰辅酶a还原酶NAC次级壁相关结构域蛋白1,MYB58而且MYB63导致与对照相比木质素含量增加。
结论
这些结果表明,微生物基土壤添加剂的添加对苯丙烷途径基因调控及其次生代谢产物的产生有明显影响。这些发现为研究微生物基土壤添加剂的作用模式开辟了一条道路,这些添加剂可能有助于食品、饲料、燃料和纤维的可持续生产。
背景
21世纪的主要挑战之一圣Century致力于可持续生产具有更高功能和营养价值的食品、燃料和纤维作物(如类黄酮和花青素),以满足日益增长的全球人口需求[1,2].要满足这一需求,就必须发展更可持续的替代方法,以对生态系统影响最小的方式生产和提高增值农产品。目前的农业做法在很大程度上是基于使用化肥和合成农药来改善作物生长和产量。然而,我们对这些肥料的依赖和过度使用导致了土壤、地面和地表水的污染。更注重健康的消费者对更健康和营养更密集的食品的需求不断增加,环境意识不断提高,导致人们对生态友好的可持续农业耕作系统的兴趣增加,并迅速向其转变。
这种新的可持续生产系统的一个组成部分是使用含有潜在有益微生物菌株及其代谢产物的微生物基肥料(即生物刺激素),其中许多在调节根际以提高植物生长和养分利用效率方面具有重要作用[3.,4].自20世纪70年代以来,我们已经认识到专门化植物生长促进根瘤菌(PGPR)对植物生长的潜在好处[5].有许多关于PGPR对植物防御、健康和生长、病原体抗性、耐盐性和营养吸收的改善的报道[6,7这可能会导致新的农业应用的发展。尽管有这些优势,微生物产品的使用还没有在更大的范围内有效地利用来提高植物产量,更不用说作为一种手段来选择性地增强作物中有益的次级代谢产物的基因表达和生产。
苯丙类化合物是一大类多酚类化合物,其中包括一类重要的次生代谢产物,如植物中的类黄酮、花青素和木质素[8].苯丙类化合物在花卉着色、吸引传粉者、保护免受紫外线(UV)照射、作为植物和微生物之间的信号分子以及作为抗氧化剂方面具有重要功能[9].此外,当人类食用苯丙类化合物时,苯丙类化合物提供了无数的健康益处[10,11].通过代谢工程对黄酮醇的生物合成和PP途径进行了许多研究,这些研究针对重要的农艺性状,如观赏植物的新颜色和颜色图案的产生[8,12].许多苯丙类化合物是植物与微生物共生的诱导剂[13],而另一些则表现出广谱抗菌活性,因此被认为有助于植物对抗微生物疾病[14].此外,一些研究还研究了土壤微生物与植物根系之间的相互作用是如何调节PP和防御相关途径的[15- - - - - -18].参与PP通路的基因如查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、类黄酮3 ' -羟化酶(F3'H)和黄酮醇合成酶1(FLS1)在次生代谢产物的产生中起重要作用,而二氢黄酮醇4-还原酶而且白花青素双加氧酶参与有色花青素的产生(附加文件1).在生产后,这些产物在一个复杂的过程中通过糖基化、酰基化和甲基化进一步修饰,从而改变它们的稳定性、溶解度或定位,从而改变共轭分子的生物学特性[19].
调控这些结构基因表达的转录因子已经在植物物种中得到了很好的表征,包括拟南芥[20.].MYB11 MYB12,而且MYB111编码三个函数冗余MYBS调控几个“早期”类黄酮生物合成基因的表达[21].另一方面,tf,比如Pap1, pap2, gl3, tt8而且TTG1的组成部分是MYB / bHLH /世界发展报告》(MBW)转录复合物介导“晚期”花青素生物合成基因[21,22].木质素生物合成途径特征明确,在植物生长发育、增加细胞壁完整性、促进水分运输和抵御病原体等方面发挥着重要作用[23- - - - - -25].参与木质素生物合成的基因主要在转录水平和木质素特异性转录因子上受到调控MYB58, MYB63而且SND1可诱导木质素合成的生物合成途径[26,27].
迄今为止,很少有研究旨在了解微生物产物对植物次生代谢的影响,因此很难评估潜在的功能关系。了解苯丙醇代谢如何随着微生物或微生物产品的变化而变化,将有助于提高我们对植物生物学的基本理解,并将有助于开发旨在提高作物产量和质量的天然产品。产品组成初步分析表明,该产品由PGPR相关细菌组成,使用该产品可促进植物生长[28,29].我们假设,已知的微生物基产品可以促进植物生长和养分吸收,可以诱导PP途径和木质素途径拟南芥。因此,本研究旨在评估施药及施药时机(单次和多次)对PP通路的影响拟南芥.本研究采用实时荧光定量PCR (qRT-PCR)技术对黄酮类化合物和木质素通路基因进行转录谱分析,采用高效液相色谱(HPLC)和液相色谱-电喷雾电离-四极杆飞行时间-质谱(LC/ESI-Q-TOFMS/MS)检测黄酮类化合物含量。结果表明,微生物产物的施用诱导了PP通路,不同施用时间的响应不同。在这两种情况下,微生物产物的应用诱导了黄酮类化合物和木质素的含量拟南芥叶片与未处理的对照组相比。
结果
代谢物组成
通过HPLC-QTOF-MS/MS分析,鉴定出14种黄酮类化合物拟南芥(数据1而且2),包括9种黄酮醇:山奈酚-3,7- o -双α - l-鼠李糖苷(F1),山奈酚-3- o - α - l-鼠李糖苷(1-2)- β -d -吡喃葡萄糖苷-7- o - α - l-鼠李糖苷(F2),山奈酚-鼠李糖苷(F3),山奈酚-鼠李糖苷(F4),山奈酚-鼠李糖苷(F5),水解形式的山奈酚(F6),槲皮素3,7-二李糖苷(F7),芹菜素7-(2",3"-二乙酰葡萄糖苷),(F8)和五甲氧基二羟基黄酮(F9);以及五种具有代表性的花青素(花青素3-鼠李糖苷(A1),(花青素3-(6-丙二酰葡萄糖苷)-7,3”-二-(6-阿威酰葡萄糖苷)(A2),花青素3-(6"-咖啡因-2"-sinapylsambubioside)-5-(6-丙二酰葡萄糖苷)(A3),以及花青素3-(g2 -葡萄糖苷)的两个异构体(A4和A5)(表1).大多数的拟南芥在这项研究中,黄酮类化合物被发现为花青素、糖基化山奈酚和鼠李糖基化,这与先前发表的研究结果一致[30.- - - - - -33].
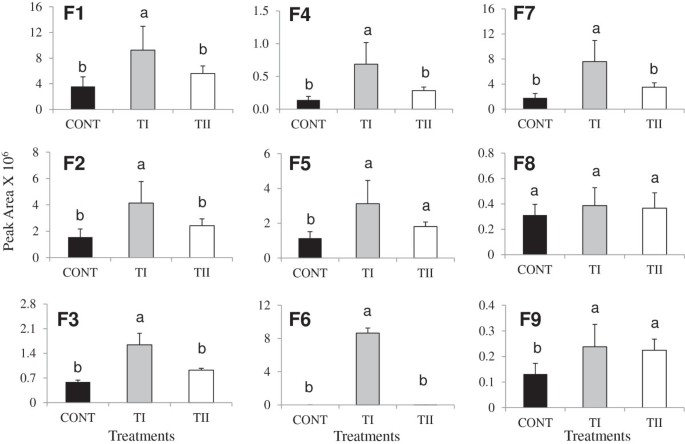
黄酮醇苷的检测概况拟南芥使用SoilBuilder™-AF (SB)处理一次(TI)和多次(TII)。山奈酚-3,7- o -双α - l-鼠李糖苷(F1),山奈酚-3- o - α - l-鼠李糖苷(1-2)- β -d -吡喃葡萄糖苷-7- o - α - l-鼠李糖苷(F2),山奈酚-鼠李糖苷(F3),山奈酚-鼠李糖苷(F4),山奈酚-鼠李糖苷(F5),水解山奈酚(F6),槲皮素3,7-地李糖苷(F7),芹菜素7-(2",3"-二乙酰葡萄糖苷)(F8)和五甲氧基二羟基黄酮(F9)。柱状图表示每个采样时间点三个生物重复的标准误差。根据拟合最小二乘(FLS)检验,不同横条上不同字母与对照有显著差异,P≤0.05。CONT(黑色条)为未处理的植株,TI(阴影)和TII(白色)分别为仅处理过一次和多次的微生物产物。
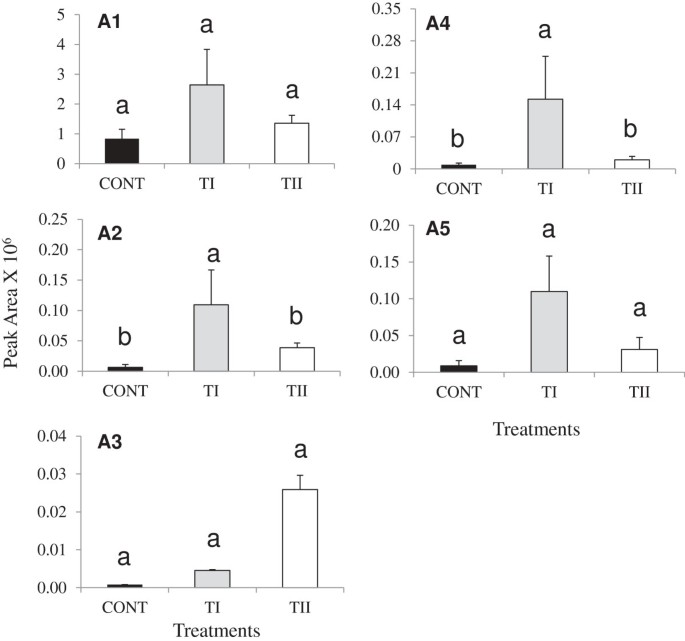
花青素苷的检测概况拟南芥用SB治疗一次(TI)和多次(TII)。花青素-鼠李糖苷(A1),花青素3-(6-丙二酰葡萄糖苷)-7,3 ' -二-(6-阿威基葡萄糖苷)(A2),花青素3-(6"-咖啡因-2"-sinapylsambubioside)-5-(6-丙二酰葡萄糖苷)(A3)和花青素3-(2g -葡萄糖苷)(A4)和花青素3-(2g -葡萄糖苷)(A5)。柱状图表示每个采样时间点三个生物重复的标准误差。重要级别识别参见图1.
黄酮类化合物的生物合成发生了显著变化,这取决于处理和应用时间,除了F8(图8)1而且2).与对照相比,一次性施用产品(TI)可诱导F1、F2、F3、F4、F5、F6、F7、F8和F9的峰面积(图1).与对照组相比,TII处理中F1、F2、F3、F4、F5、F7、F8和F9的峰值面积水平也有所增加,但幅度较小1).TI处理与TII处理相比,TI处理增加了F1、F2、F3、F4、F5、F6、F7、F8、F9的峰面积。化合物山奈酚,F6,在Rt11.43检测到(F6;m / z, 286.04),显著高于对照组和TII处理。芹菜素(一种含黄酮的化合物,F8)的峰面积随处理变化不大,但在TI和TII处理中F9的峰面积均显著增加,而F9的峰面积水平在处理间无显著差异。与对照相比,TI和TII处理的植物中五种花青素衍生物(A1-A5)均有所增加(图2).与TII和对照组相比,TI诱导A2和A4水平显著升高(图2).与TII处理相比,TI处理提高了A1、A2、A4和A5)的水平。然而,与TI相比,TII治疗增加了A3水平。
黄酮生物合成基因的表达拟南芥叶子
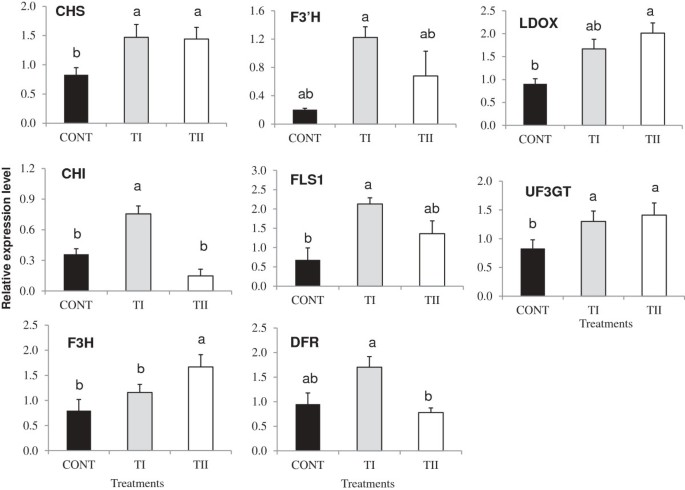
为了了解微生物产品应用时机(TI和TII)对类黄酮途径的影响,编码关键PP途径酶的基因表达Pal1 pal2 pal3 pal4 c4h chs chi f3h f3'h fls1 dfr ldox而且UF3GT的分析拟南芥qPCR检测叶片(图3.而且4).两种处理(TI和TII)均未诱导表达Pal1 pal2 pal3而且PAL4显著(P≥0.05)3.).的表达Chs fls1 ldox而且UF3GT与对照相比,两种处理均诱导了两倍,而TI和TII处理增加了F3'H分别是对照组的8倍和4倍(图4).的表达气大幅增加(P≤与对照组和TII处理相比,TI含量均为0.05)气与对照相比,TII处理植株的表达没有显著变化。的表达F3H大幅增加(P≤与对照组和TI处理相比,TII显著降低0.05)F3H与对照相比,TI处理植株的表达没有显著变化。TI处理增加了DFR由对照的一倍和无变化的DFR与对照组相比,TII处理的植株中有表达。酰基化基因(At1g03495, At1g03940而且At3g29590)、糖基化基因(UGT75C1而且UGT78D3),销售税而且UDP-鼠李糖合酶基因(RHM1 RHM2,而且RHM3)在大多数情况下,TI和TII处理的植物比对照组增加(见附加文件)2A, B和C)。
黄酮通路调控基因的表达谱拟南芥叶子
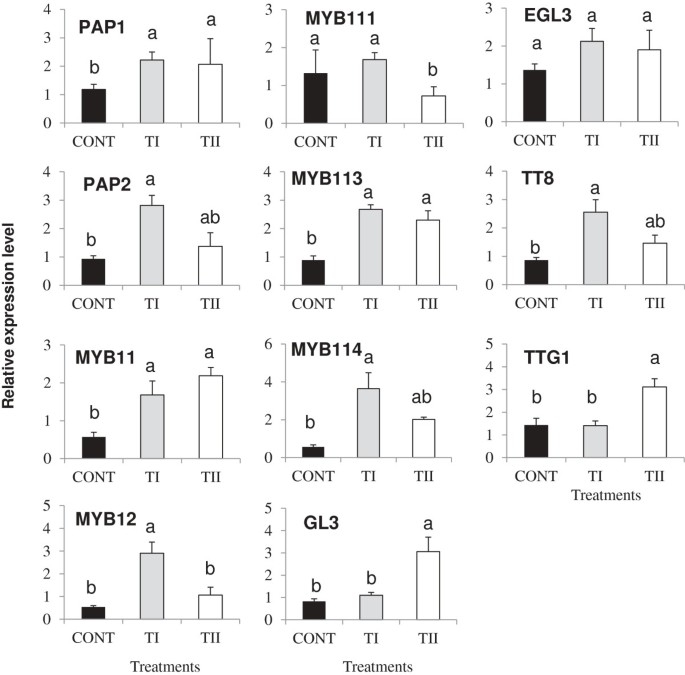
为了研究叶片中黄酮类生物合成基因的诱导表达是否伴随着调控基因的表达,我们分析了Pap1, pap2, myb11, myb12, myb111, myb113, myb114, gl3, egl3, tt8而且TTG1在树叶里拟南芥用TI和TII处理(图5).与对照相比,TI和TII处理的植株均诱导了大部分调控基因的表达。表达水平PAP1而且PAP2与对照相比,TI和TII处理的植株均有所增加;对我来说更是如此PAP2在TI处理过的植物中,其数量增加了3倍。的表达Myb11, myb12, myb113而且MYB114与对照组相比,TI和TII处理的植株均有所增加。的表达MYB12而且MYB114与TII处理相比,TI处理的诱导程度最大。的表达MYB11而且MYB113与对照组相比,TI和TII处理的植物都有诱导。相反,MYB111在TII处理中表达被抑制,而TI处理仅略有上调。治疗效果GL3而且TTG1TI和对照组的表达水平相似,但两种基因的表达均显著增加(P≤0.05)。的表达EGL3与对照组相比,TI和TII处理的植株均没有变化。的表达水平明显升高TT8与对照组相比,TI处理的植株有显著差异。
木质素生物合成
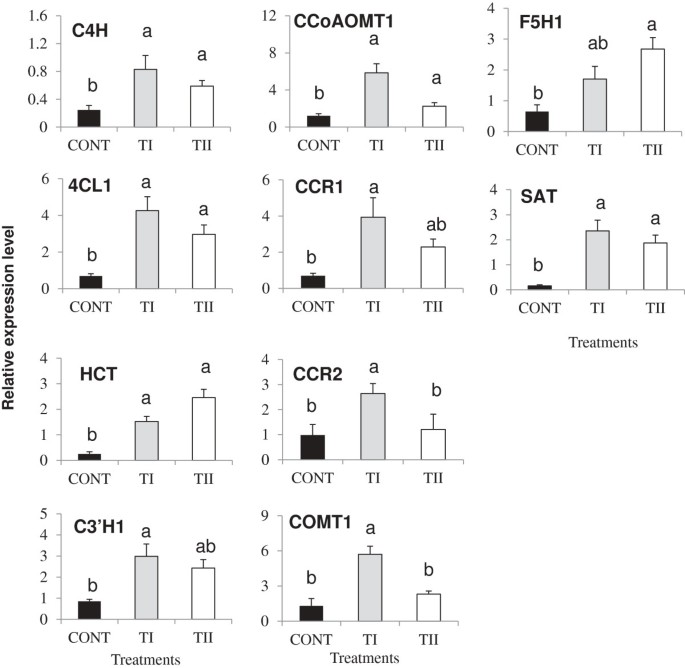
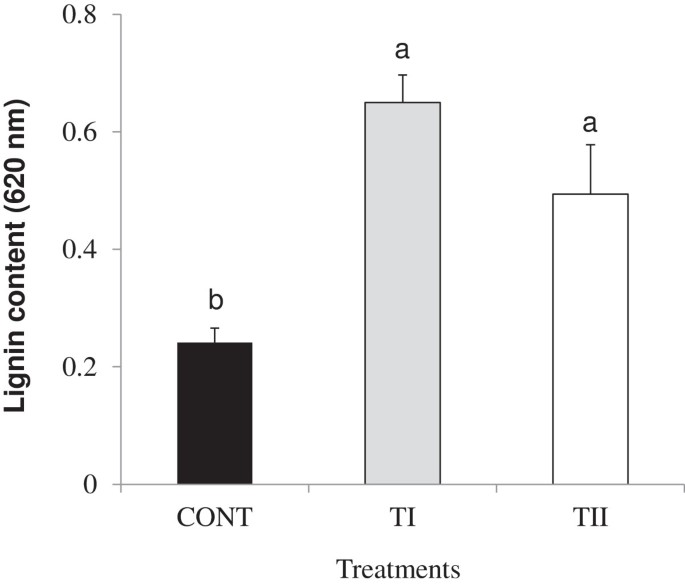
为了进一步了解微生物处理(TI和TII)的应用,我们分析了所有参与木质化途径的基因(20)的表达(图3.,6,7和附加文件3.).对成绩单的积累C4H 4 cl1,C3'H1, CCoAOMT1, CCR1, CCR2, COMT1, CAD1, CAD3, CAD4, CAD5, CAD7, CAD8而且坐显著诱导(P≤0.05)。表达水平HCT,F5H1,而且坐显著增加(P≤0.05)。无显著性(P≥0.05)表达水平的差异C3'h1, ccr1, ccr2,而且COMT1在对照组和TII处理株之间观察。我们发现表达水平Ccr2 cad1 cad5 cad7而且cad 8显著增加(P≤0.05)。的表达LAC4,LAC17,以及它们的调节基因(SND1 MYB58,而且MYB63)大幅增加(P≤与对照组相比,TI和TII处理的植物均表现为0.05)4),以及与significant (P≤与TII处理植株相比,TI的表达水平为0.05)。重要的(P≤0.05)与对照相比,TI和TII处理的植株木质素积累显著。
微生物产物SB处理一次(TI)和多次(TII)对木质素含量的影响拟南芥.柱状图表示每个采样时间点三个生物重复的标准误差。重要级别识别参见图1.
讨论
类黄酮通路基因表达及代谢物组成
我们的研究为微生物产品(TI和TII)的应用提供了证据拟南芥植物增加了类黄酮的积累,而TI导致代谢产物的积累比TII处理的植物更多。这种增强伴随着类黄酮生物合成途径中大多数基因表达的增加。这在TI处理的植株中尤其明显,但在TII处理的植株中也有表达水平升高。山奈酚、槲皮素和花青素衍生物的合成很大程度上依赖于二氢山奈酚。与此同时,F3'H而且FLS1对于引导前体的二氢槲皮素/二氢山奈酚,形成槲皮素或山奈酚分支至关重要。的提高F3'H而且FLS1与TII处理的植株相比,TI处理中黄酮醇苷的含量大多有所增加拟南芥叶子(图1).而在TII处理的植株中,大多数黄酮醇苷的含量较TI显著降低,这也与下调F3'H而且FLS1在TII处理的植物中观察到。这种差异可能是由于特定底物的可变性,使得生物合成途径不同,从而产生不同的产物。因此,含山萘酚黄酮醇的增加主要与F1的积累有关,与F2、F3、F4、F5、F7、F9相比,F1的积累增加了2倍。
lc - mms分析发现酸水解样品中一种化合物(F6)的分子质量(m / z,286.0)苷元山奈酚。与诱导表达一致DFR, LDOX而且UF3GT在TI和TII处理的植株中,我们观察到叶片中花青素(A1, A2, A3, A4和A5)的含量显著增加拟南芥与对照组相比(图2).在TI处理的植株中,A1、A2、A4和A5的影响最为显著,与TII处理相比,它们的积累量更高。相比之下,TII处理植株的A3积累量高于对照。在积累的花青素中,咖啡基、阿魏酰基、辛纳酰基和丙二酰基的存在与花青素酰基转移酶的诱导表达平行坐在本研究中[34].这些化合物的积累可以在一定程度上增加对生物和非生物压力的防御。例如,在叶毛中的酰化黄酮醇苷的存在Quercus冬青属植物增强了植物抵御UV-B辐射伤害的能力[35].在另一个例子中,芦丁对真菌表现出显著的抗真菌活性Cylindrocar pondestructans,疫霉megasperma,大丽轮枝菌属攻击橄榄树(齐墩果欧洲公司).因此,芦丁被认为在植物防御中起着重要作用[36].在我们的研究中,大量糖化山萘酚衍生物的形成和只有少量的糖基化花青素得到了早期报道的证实[37,38].
几个GTS,参与糖基化过程和诱导表达UGT75C1而且UGT78D3[30.,38的表达是一致的FLS1,F3'H,TI和TII处理植物中糖基化黄酮醇化合物的生物合成。鼠李糖基化是黄酮醇和负责生物合成的基因的主要糖基化过程,在供应中至关重要UDP-鼠李糖用于黄酮醇生物合成。增强表达RHM1, RHM2而且RHM3在TI和TII处理的植物中,表明它们可能在Rha残基的形成和黄酮类化合物的鼠李糖基化中起作用。我们的lc - mms数据也表明,在微生物处理的植物中,黄酮醇主要以鼠李糖基化形式积累。鼠李糖基化基因的诱导表达在拟南芥[31],证实了之前的结果,表明它参与了TI和TII处理的植物中黄酮醇的鼠李糖基化。诱导表达RHM1 RHM2,而且RHM3在我们的研究中,可能是由于底物可用性的竞争,或PP途径不同分支中通量流动的变化,这一现象已在拟南芥[39,40].这些结果表明,黄酮类化合物的积累存在显著变化,这表明,通过改变微生物制剂的施用时间,黄酮类化合物的积累可能受到控制。
类黄酮通路基因的转录调控
类黄酮生物合成结构基因的转录调控由调控基因控制,这提供了额外的控制水平。几个MYB / bHLH / WD重复(MBW)家族基因在黄酮类化合物生物合成调控中的作用拟南芥.其中,PAP1是类黄酮/花青素生物合成途径的主要调节因子[41].我们的结果表明,诱导表达PAP1它的近亲,PAP2,在TI和TII处理的植物中都有强烈的诱导作用,调节着类黄酮的生物合成。有趣的是,PAP2与对照组相比,TI处理的植株表达量增加PAP1.因此,建议……是合理的PAP2表达稳定,可控制类黄酮的生物合成。
还有其他几个基因编码MYB而且bHLH转录因子(TF)已知参与调节黄酮类化合物的生物合成拟南芥叶子。因此,的表达式Myb11, myb12, myb111, myb113, myb114, gl3, egl3, tt8而且TTG1进行了分析。TT8与PAP1 / PAP2[42的提高PAP1 / PAP2而且TT8基因似乎是TI处理植物中花青素生产的花青素结构基因激活所必需的。密切相关的MYB11, MYB12,MYB111TFs是黄酮醇的特异性调节因子,影响黄酮醇在不同部位的积累拟南芥通过调节几种基因对幼苗类黄酮进行生物合成,如Chs, chi, f3'h,而且FLS1[21].与上调相一致PAP1而且PAP2,诱导表达Myb11, myb12, myb113而且MYB114与TII处理相比,TI处理的单株黄酮醇生物合成含量增加。然而,诱导表达PAP1, MYB11而且MYB113基因与基因表达的降低相一致Pap2 myb12 myb111而且MYB114在TII处理的植物中,表明植物间存在平衡MYB本研究中控制类黄酮生物合成的基因成员。在TII处理的植株中,tf和调控基因的可变调控可能导致黄酮醇和花青素含量较低,而F8、F9和A3含量较高。
有趣的是,与TI处理的植物相比,TII中A3的数量显著增加,这可能是由于诱导调控基因的表达GL3而且TTG1,和花青素生物合成基因LDOX而且UF3GT.以前的研究表明ttg1打乱了花青素晚期生物合成基因的表达等DFR而且LDOX,而“早期”花青素生物合成基因(CHS、气而且F3H)在同一突变体中不受影响[22,43,44].我们的研究结果表明,在TI和TII处理的植物中,参与黄酮类化合物生物合成的基因表达不同,这解释了为什么一些黄酮类化合物的产量比对照组高得多。这清楚地表明,这些密切相关的黄酮类化合物的生物合成与植物接受基于微生物的土壤添加剂之间存在某种相关性。然而,还需要进一步的工作来了解这些变化是由于产品中的微生物或代谢物,还是两者的相互作用,以及它们是直接作用于植物还是通过介导植物与周围土壤的相互作用间接作用于植物。
木质素积累过程中转录因子的表达
PP途径的一个分支通过木质素途径基因的协调转录负责木质素的合成(C4H, 4CL1, C3'H1, CCoAOMT1, CCR1, CCR2, COMT1, CAD1, CAD3, CAD5, CAD7, CAD8而且坐) [45- - - - - -49].TI强烈诱导的表达C4H, 4CL1, HCT, C3'H1, CCoAOMT1, CCR1, CCR2, COMT1, CAD1, CAD3, CAD5, CAD7, CAD8而且坐,而TII对木质素生物合成基因的诱导相对较低,除HCT而且F5H1,其在TII中的表达水平高于TI处理的植株(图6和附加文件3.).4 cl1, C4H而且HCT已被证明与木质化有关[50- - - - - -52];此外,表达水平的增加4 cl1, C4H而且HCT在TI和TII处理植物中,可能与木质化过程有关。CCoAOMT1而且COMT1TI和TII处理植株均诱导表达。CCoAOMT1编码一种参与单木酚生物合成的酶,通过催化咖啡因辅酶a酯的甲基化。此外,在TI处理的植物中,上调CCoAOMT1而且COMT1显著高于TII处理的植株。过度的PAP1(一种积极的花青素生物合成调节剂)拟南芥显示愈创木酰和丁香基单体数量的增加与木质素积累的增加有关[24].在葡萄,VvMYB5a调节葡萄花青素和原花青素的生物合成,也影响木质素的生物合成。过度的VvMYB5a在烟草行业中CCoAOMT1基因表达,导致花药壁木质化降低和延迟开裂[53].有人还指出C4H而且COMT1基因受木质素特异性调控MYB转录因子MYB58在拟南芥[54,55].
两者之间CCR等基因,CCR1整体表达水平高于CCR2TI和TII处理的植株,只有TI处理的植株有较大的增殖CCR1表达与控制的比较。上调的CCR表达与木质素形成的增加有关拟南芥[56].九个计算机辅助设计基因已在拟南芥[48].结果表明,6个成员的计算机辅助设计家族基因(Cad1 cad3 cad4 cad5 cad7而且cad 8)积累在不同的水平,与Cad1 cad3 cad7而且cad 8与TII处理的植物相比,TI处理的植物中表达更高(附加文件)3.).cad 4而且cad 5已被证明在木质化中起主要作用[57].我们观察到cad 4而且cad 5与对照组相比,TI和TII处理的植株均诱导了相同程度的表达。角色cad 1木化作用在植物的幼茎、花和角果中均有表现拟南芥[58].cad 3在下胚轴二次生长中检测到表达答:芥[59].的表达水平增加了几倍cad 7而且cad 8TI处理植株较TII处理植株显著;但与对照相比,TII处理的植株表达量有所增加。诱导表达水平越高cad 7相比cad 8在植物和花中也有发现拟南芥[58].因此,不同的成员CCR而且计算机辅助设计在用微生物源性产物处理的植物中,木质素生物合成中家族基因的诱导似乎不同。这些基因在本研究中的诱导表达表明它们可能有助于木质素的生物合成。At2g23000,花青素色素转移酶(坐),在苹果酸sinapoylapple ate的合成中起作用[60的表达水平的增加坐在TI和TII处理的植物中也注意到了。
这两个CCR而且计算机辅助设计是木质素生物合成的关键,转移到细胞壁,并被漆酶聚合[61,62].漆酶的上调(LAC4而且LAC17)伴随着TI和TII处理植物中几个tf的上调,这些tf负责控制木质素的生物合成(附加文件)4).研究表明LAC4在维管束和束间纤维中表达;和,LAC17有助于束间纤维的木质化[63].次级壁相关NAC结构域蛋白1 (SND1),是调控次生细胞壁生物合成发育过程的关键转录激活因子[64],与对照组相比,TI和TII处理过的植物都有诱导4).MYB58而且MYB63已被认为是木质素生物合成的特定激活剂[55].这些基因在TI和TII处理的植物中诱导表达(附加文件)4)表明它们积极参与了木质化过程。
结论
本研究表明,应用于生长植物土壤中的微生物产物支持了我们的假设,并导致了PP途径的诱导和代谢产物生物合成的增加。一次性应用微生物产品(TI)产生的代谢物比多次应用(TII)多。TI比TII的代谢产物生物合成更高,可能是因为TI和TII都含有微生物产物,而TII比TI多应用几倍可能间接抑制了代谢物生物合成或将代谢物转移到其他代谢途径。然而,与对照相比,无论何时,处理过的植物中总黄酮积累都更高。TI和TII处理植株黄酮醇和花青素积累的差异可以用结构基因和调控基因转录本积累的差异来解释拟南芥.这是首次研究表明微生物产物在激活植物叶片PP通路中起重要作用的研究之一拟南芥.这些结果表明,负责增强代谢物的机制可能与产品中的微生物或代谢物有关,或者两者的相互作用。需要创新的方法,如焦磷酸测序鉴定特定微生物群,代谢组学分析鉴定产品中可能的生物活性代谢物,以评估本研究中观察到的转录级联激活的原因。
方法
微生物制剂来源
Soil Builder™-AF, SB (Advanced Microbial Solutions, Pilot point, TX, USA)是一种专门为农业开发的生化肥料催化剂,含有来自由大型和多样化微生物群落组成的生物反应器系统的细菌产品。利用基于16S rRNA的基因分析评估了SB的微生物群落组成,通常由芽孢杆菌、放线菌和变形菌组成。以前的工作也报道SB由芽孢杆菌、放线菌、蓝藻、藻类、原生动物和微生物副产物组成[65]包括在微生物群落厌氧发酵过程中产生的微生物代谢物[66].该产品的基本化学成分由肯塔基大学土壤测试实验室按照标准协议确定(附加文件)5).
生长条件和处理程序
的种子拟南芥ecotype Columbia-0经消毒后,播种于含1× Murashige和Skoog培养基(pH 5.7)的0.7%琼脂固体平板上。培养皿在4℃黑暗环境中孵育2-3天后转移至22℃生长室,光照周期为16 h,暗周期为8 h,光合光子通量密度为100 μmol m-2年代-1,相对湿度为65-70%,生长两周。两周后,70棵幼苗被转移到6英寸的装有肥料(PRO-MIX)的花盆中®BX, Quakertown, PA, USA),以随机完全块设计排列在生长室中,并让其适应7-10天。植株按照制造商推荐的6× 16ml /L浓缩SB 100 ml的施用量进行处理。对于TI,单个植株仅在1上使用产品处理圣与1的相同解并行圣每天和每3天理查德·道金斯TII的一天。对照植物每3年用同样的水处理理查德·道金斯的一天。每组处理包括对照在内有18-20株。第14天,从每组5-6株中随机选取具有代表性的生物重复(R1、R2和R3)。第14天采集叶子(对照和处理),称重,立即在液氮中冷冻,保存在-80°C,直到RNA提取。
RNA提取、cDNA合成及实时定量PCR (qPCR)
按照制造商的说明,使用TRI-ZOL方法从三个生物重复中提取总RNA。cDNA的合成和qPCR分析采用[67].转录水平拟南芥在每个生物重复的三个重复中,使用SYBR Green (Applied Biosystem)在应用生物系统StepOnePlus™实时PCR系统中按照制造商手册进行qPCR检测。通过将每个基因的PCR阈值循环数归一化,确定相对mRNA水平EF-1α、ACTIN为内参基因,根据GeneEx软件(http://www.multid.se/order/bioeps.php;),数据为3个重复的平均值。本研究中使用的引物序列从文献中检索并用于扩增基因特异性序列(附加文件)6[24,25,27,31,48,68- - - - - -77].
识别和量化类黄酮和花青素LC-ESI-QTOF-MS/MS法
代谢物分析按照Lea等人(2007)的描述进行,并进行了一些修改。从三种生物中提取约100 mg冷冻叶片,在液氮下均质,并转移到2 mL Eppendorf管中,其中添加1 mL甲醇。酚类物质在室温黑暗条件下提取18小时,并在14000 rpm下离心15分钟。提取物通过无菌Syr过滤器(25 mm, 0.20 μm)通过无菌注射器(microl Analytical Supplies, Inc)过滤。在样品中加入30 μl的3n HCL进行酸水解,然后在70°C的水浴中加热hr。在运行分析之前,我们在样品的提取物中测试了机器的准确性,并且我们注入了黄酮类化合物的混合物,以确保黄酮类化合物在lc - mms方法中起作用,其中包括:芹菜素-7-葡萄糖苷,甘草皂苷,geninstein,槲皮素,芹菜素和表儿茶素。对叶片提取物中的代谢物(类黄酮和花青素)进行分析,采用LC系统,泵型1200,6530A (Agilent Technologies, CA, USA)四极飞行时间(Q-TOF)质谱仪,配备Agilent射流电喷雾电离(ESI)离子源。ESI源使用单独的雾化器连续引入参考质量化合物:121.050873,922.009798(正离子模式)。使用Acquity BEH Shield RP-18分析柱(1.7 μm 2.1×150 mm, Waters Corporation, Milford, CT)在40°C下分离5微升样品提取物。溶剂A的流动相为水/甲酸(99.9:0.1,v/v)和乙腈/甲酸(99.9:0.1,v/v),溶剂A:B为95:5。以下梯度二元泵1使用的总分析时间21分钟和0.25毫升/分钟的流量:5%到25%的流动相B / 2分钟然后25%到65%移动阶段B 2.0到10.5分钟,然后到99%移动阶段B 10.5到12.5分钟,然后保持在99%流动相为12.5到14分钟紧随其后5% B从14到15.5分钟,然后保持在5% 15.5 - 17分钟。
质谱分析条件为:量程、起始(100 amu)、停止(1700 amu)、扫描时间(4.0 s);加热气体温度350℃;气体流量(l/min), 8.0;雾化气体,35psi;鞘气温350;鞘气流量11.0;VCap 3000;喷嘴电压(V) 1000。破碎器电压为120 V, skimmer1 65 VandoctopoleRFPeak 750,每个化合物的碰撞能量优化为20 eV。为确认黄酮类化合物的性质,质谱联用(m / z)的碎片模式与先前发表的报告进行比较[41]并通过精确的质量Q-TOF分析证实。在缺乏真实标准品的情况下,采用峰面积法对黄酮类化合物进行定量。MSMS谱与已知化合物的LC ESI-Q-TOF- MS/MS谱进行了比较,这些化合物来自包含所有类黄酮MS/MS谱的ReSpect数据库(Kazuki Saito教授,JP出版)和Metlin(安捷伦MS/MS谱库)。结果报告为三个重复的平均值。
木质素测量
木质素定量测定依据[78].叶片在N液中均质2.将粉末转移到管中,悬浮在1.5 ml甲醇中,大力搅拌1小时。将匀浆以14000转/分离心15分钟,用1.5 ml以下溶剂涡流洗涤15分钟:(i)甲醇两次;(ii) 1 M NaCl;(iii) 1% SDS;(iv)水两次;(v) CHCl3./ CH3.哦(1:1);叔丁基甲基醚。最后的颗粒冻干一夜,取10毫克用于以下试验。用1ml 2 M HCl和0.2 ml巯基乙酸在95°C下处理该粉末4小时。混合物冷却,离心10分钟。颗粒是用水洗3次,并溶解在1毫升的0.5 M氢氧化钠和暂停大力动摇了一夜之间在4°C提取木质素衍生品(LTGAs)、巯基乙酸和离心10分钟。上层清液收集在一个新鲜的管,和颗粒混合0.5毫升的0.5 M氢氧化钠1 h。离心后,浮在表面的结合上一个,用0.3 M浓HCl酸化,在4°C下沉淀LTGAs 4 h。混合物离心,在4°C下保存过夜。LTGA颗粒溶解于1.5 ml 0。用分光光度计在280 nm处测定M NaOH的吸收。结果报告为三个重复的平均值。
统计分析
定量qRT-PCR数据采用GenEx软件(MultiD分析)和JPM9 (SAS Institute Inc, Cary, NC, USA)进行统计分析。柱状图表示每个采样时间点三个生物重复的标准误差。根据拟合最小二乘(FLS)检验,不同横条上不同字母与对照有显著差异,P≤0.05。CONT(黑色条)为未处理的植株,TI(阴影)和TII(白色)分别为仅处理过一次和多次的微生物产物。
缩写
- 4 cl1:
-
4-coumarate:辅酶a ligase1
- C3'H1p:
-
-coumarate 3-hydroxylase1
- C4H:
-
肉桂酸4-hydroxylase
- 计算机辅助设计:
-
肉桂醇脱氢酶
- CCoAOMTCaffeoyl-CoAO:
-
甲基转移酶
- COMT1咖啡酸O:
-
-methyltransferase1
- HCT:
-
HydroxycinnamoylCoA: shikimate / quinatehydroxycinnamyltransferase
- CCoAOMT1咖啡基辅酶a3 -O:
-
甲基转移酶1
- CCR1:
-
肉桂酰辅酶a还原酶1
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 朋友:
-
苯丙氨酸ammonia-lyase
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- 0UF3GT:
-
UDP-glucose: flavonoid-3-O-glucosyltransferase
- F3H:
-
黄烷酮3-hydroxylase
- F3'H:
-
Flavonoid-3”-O-hydroxylase
- DFR:
-
Dihydroflavonol-4-reductase
- LDOX:
-
Leucoanthocyanidin加双氧酶
- UDP-GST:
-
UDP-glucoronosyl / UDP-glucosyltransferase
- 销售税:
-
谷胱甘肽S-transferase
- FLS1:
-
黄酮醇synthase1
- Pap1 & 2:
-
花青素色素1和2的生产
- EGL3:
-
glabra3增强剂
- GL3:
-
无毛3
- 3 glct类黄酮3 -O:
-
葡糖基转移酶
- 3小红帽黄酮醇3 -O:
-
-rhamnosyltransferase
- 7 glct黄酮醇7 -O:
-
葡糖基转移酶
- 5 glct花青素5 -O:
-
葡糖基转移酶
- PGPR:
-
促进植物生长的根瘤菌
- 某人:
-
土壤Builder™房颤。
参考文献
- 1.
Green RE, Cornell SJ, Scharlemann JPW, Balmford A:农业与野生自然的命运。科学通报,2005,37(4):357 - 357。10.1126 / science.1106049。
- 2.
德弗里斯R,罗森茨威格C:热带地区可持续土地利用的全景观方法。自然科学进展,2010,37(2):379 - 379。10.1073 / pnas.1011163107。
- 3.
巴瑞亚JM,波佐MJ, Azcon R, Azcon- aguilar C:根际微生物协同作用。应用物理学报,2005,26(3):344 - 344。10.1093 / jxb / eri197。
- 4.
Morgan JA, bend GD, White PJ:根际植物-微生物相互作用的生物学成本和收益。应用物理学报,2005,26(4):344 - 344。10.1093 / jxb / eri205。
- 5.
Adesemoye AO, Torbert HA, Kloepper JW:促进植物生长的根瘤菌可以降低化肥的施用量。微生物学报,2009,58(4):921-929。10.1007 / s00248 - 009 - 9531 - y。
- 6.
Morrissey JP, Dow JM, Mark GL, O 'Gara F:微生物是解决世界粮食生产问题的根源吗?生态环境学报,2004,5(10):922-926。10.1038 / sj.embor.7400263。
- 7.
杜德IC, Perez-Alfocea F:微生物改良作物盐胁迫。实验物理学报,2012,63(9):3415-3428。10.1093 / jxb / ers033。
- 8.
Ververidis F, Trantas E, Douglas C, Vollmer G, Kretzschmar G, Panopoulos N:黄酮类化合物和其他苯丙类衍生天然产物的生物技术。第一部分:化学多样性,对植物生物学和人类健康的影响。生物技术学报,2007,2(10):1214-1234。10.1002 / biot.200700084。
- 9.
Kutchan TM:在天然产物生物合成中细胞内和细胞间易位的作用。植物学报,2005,8(3):292-300。10.1016 / j.pbi.2005.03.009。
- 10.
García-Mediavilla V, Crespo I, Collado PS, Esteller A, Sánchez-Campos S, Tuñón MJ, González-Gallego J:抗炎黄酮槲皮素和山奈酚抑制诱导型一氧化氮合酶、环氧合酶-2和反应性c蛋白,下调核因子kappaB通路。中国药物学杂志,2007,27(3):344 - 344。
- 11.
宋PH,黄FC, Do YY,黄pl:香叶醇10-羟化酶的功能表达及其在萜类和苯丙类生物合成中的双重功能。农业食品化学,2011,59(9):4637-4643。10.1021 / jf200259n。
- 12.
Ruiz-López N, Sayanova O, Napier JA, Haslam RP: ω -3长链多不饱和脂肪酸生物合成途径在转基因植物中的代谢工程。应用物理学报,2012,29(3):344 - 344。10.1093 / jxb / err454。
- 13.
马志刚,李志刚,李志刚。酚酸在植物-微生物共生中的信号分子作用。植物信号行为学学报,2010,5(4):359-368。10.4161 / psb.5.4.10871。
- 14.
Dixon RA:天然产品和植物抗病性。自然科学学报,2001,29(4):344 - 344。10.1038 / 35081178。
- 15.
Jetiyanon K:芽孢杆菌菌株(IN937a和IN937b)混合处理植物对不同病原体的防御相关酶反应。生物防治,2007,42(2):178-185。10.1016 / j.biocontrol.2007.05.008。
- 16.
Jain A, Singh S, Kumar Sarma B, Bahadur Singh H:微生物联合介导的豌豆防御网络重编程增强对菌核病的耐受性。中国生物医学工程学报,2012,29(3):344 - 344。10.1111 / j.1365-2672.2011.05220.x。
- 17.
Singh A, Sarma BK, Upadhyay RS, Singh HB:兼容根际微生物通过增强抗氧化和苯丙烷活性介导鹰嘴豆生物胁迫缓解。中国微生物学通报,2013,29(1):344 - 344。10.1016 / j.micres.2012.07.001。
- 18.
黄酮类化合物在拟南芥囊线虫侵染中的作用。线虫学报,2007,9:671-677。10.1163 / 156854107782024875。
- 19.
Winkel-Shirley B:类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物营养学报,2001,26(2):379 - 379。10.1104 / pp.126.2.485。
- 20.
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L:拟南芥MYB转录因子。植物科学进展,2010,15(10):573-581。10.1016 / j.tplants.2010.06.005。
- 21.
strke R, Ishihara H, Barsch GHA, Mehrtens F, Niehaus K, Weisshaar B: r2a3 - myb转录因子差异调控拟南芥幼苗不同部位黄酮醇积累植物学报,2007,30(4):366 - 366。10.1111 / j.1365 - 313 x.2007.03078.x。
- 22.
赵敏,李志刚,李志刚,李志刚:拟南芥TTG1/bHLH/Myb转录复合体对花青素合成途径的调控。植物学报,2008,32(5):344 - 344。10.1111 / j.1365 - 313 x.2007.03373.x。
- 23.
王晓燕,王晓燕,王晓燕,王晓燕:木质化在植物防御中的作用。植物信号行为学报,2009,4(2):158-159。10.4161 / psb.4.2.7688。
- 24.
Bhargava A, Mansfield SD, Hall HC, Douglas CJ, Ellis BE: MYB75在拟南芥花序茎次生细胞壁形成调控中的作用。植物学报,2010,34(3):344 - 344。10.1104 / pp.110.162735。
- 25.
张志刚,张志刚,张志刚,张志刚。拟南芥翻译延伸因子eEF-1Bβ1在拟南芥细胞壁生物合成和植物发育中的作用。公共科学学报,2012,7 (1):e30425-10.1371/journal.pone.0030425。
- 26.
钟瑞,Demura T,叶志华:拟南芥NAC结构域转录因子SND1在纤维次生壁合成中的调控作用植物细胞学报,2006,18(11):3158-3170。10.1105 / tpc.106.047399。
- 27.
钟荣,李超,周娟,叶志华:拟南芥次生细胞壁生物合成调控的转录因子。植物细胞学报,2008,20(10):2763-2782。10.1105 / tpc.108.061325。
- 28.
李志强,李志强。植物-微生物相互作用对提高肥料利用效率的影响。中国生物医学工程学报,2009,29(1):1-12。10.1007 / s00253 - 009 - 2196 - 0。
- 29.
Calvo P, Watts DB, Ames RN, Kloepper JW, Torbert HA:微生物基接种剂对含有尿素肥料的培养土壤介质中氧化亚氮排放的影响。环境质量学报,2013,42(3):704-712。10.2134 / jeq2012.0300。
- 30.
Bloor SJ, Abrahams S:拟南芥主要花青素的结构。中国农业科学,2002,29(4):344 - 344。10.1016 / s0031 - 9422(01) 00460 - 5。
- 31.
Yonekura-Sakakibara K, Tohge T, Matsuda F, Nakabayashi R, Takayama H, Niida R, Watanabe-Takahashi A, Inoue, Saito K:拟南芥黄酮醇综合分析和转录组共表达分析导致基因代谢产物相关性解码。植物细胞学报,2008,20(8):2160-2176。10.1105 / tpc.108.058040。
- 32.
Pourcel L, Irani NG, Lu Y, Riedl K, Schwartz S, Grotewold E:拟南芥花青素液泡包体的形成及其对色素隔离的影响。分子植物。2010, 3(1): 78-90。10.1093 / mp / ssp071。
- 33.
Routaboul J-M, Dubos C, Beck G, Marquis C, Bidzinski P, Loudet O, Lepiniec L:拟南芥黄酮类化合物的代谢产物分析和自然变异的定量遗传学。实验学报,2012,63(10):3749-3764。10.1093 / jxb / ers067。
- 34.
D 'Auria JC:植物中的酰基转移酶:BAHD的好时机。植物学报,2006,9(3):331-340。10.1016 / j.pbi.2006.03.016。
- 35.
Skaltsa H, Verykokidou E, Harvala C, Karabourniotis G, Manetasi Y:冬栎叶毛UV-B保护电位及类黄酮含量。植物化学,1994,37(4):987-990。10.1016 / s0031 - 9422 (00) 89514 - x。
- 36.
Báidez AG, Gómez P, Del Río JA, Ortuño A:与大黄萎病(Verticillium dahliae Kleb)感染过程相关的油橄榄(Olea europaea L.)植物木质部功能异常。酚类化合物在植物防御机制中的作用。农用食品化学,2007,55(9):3373-3377。10.1021 / jf063166d。
- 37.
Yonekura-Sakakibara K, Tohge T, Niida R, Saito K:拟南芥黄酮醇7- o -鼠李糖基转移酶基因的鉴定及转录组共表达分析和逆向遗传分析。中国生物医学工程学报,2007,28(4):344 - 344。10.1074 / jbc.M611498200。
- 38.
Matsuda F, Yonekura-Sakakibara K, Niida R, Kuromori T, Shinozaki K, Saito K:基于MS/MS谱标记的植物次生代谢产物非靶向谱的注释。植物学报,2009,27(3):344 - 344。10.1111 / j.1365 - 313 x.2008.03705.x。
- 39.
贝索,霍夫曼,乔佛罗,拉皮埃尔C,波莱B, Legrand M:木质素合成抑制拟南芥黄酮积累对植物生长素运输和生长的影响。植物细胞学报,2007,19(1):148-162。10.1105 / tpc.106.044495。
- 40.
彭敏,杨锐,顾红,毕艳梅,罗斯坦SJ:拟南芥对氮限制的适应涉及NLA基因控制的花青素合成诱导。实验学报,2008,59(11):2933-2944。10.1093 / jxb / ern148。
- 41.
Tohge T, Nishiyama Y, Hirai MY, Yano M, Nakajima J, Awazuhara M, Inoue E, Takahashi H, Goodenowe DB, Kitayama M, Noji M, Saito K:过表达MYB转录因子的拟南芥代谢组和转录组综合分析的功能基因组学。植物学报,2005,42(2):218-235。10.1111 / j.1365 - 313 x.2005.02371.x。
- 42.
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF:拟南芥MYB转录因子与R/B样BHLH蛋白相互作用的综合鉴定。植物学报,2004,40(1):22-34。10.1111 / j.1365 - 313 x.2004.02183.x。
- 43.
Pelletier MK, Shirley BW:拟南芥幼苗黄酮3-羟基化酶的分析(与查尔酮合成酶和查尔酮异构酶的协调调控)。中国农业科学,2004,26(1):1 - 5。10.1104 / pp.111.1.339。
- 44.
Pelletier MK, Murrell JR, Shirley BW:拟南芥黄酮醇合成酶和亮色花青素双加氧酶基因的表征(“早”和“晚”基因差异调控的进一步证据)。中国农业科学,2004,27(4):457 - 457。10.1104 / pp.113.4.1437。
- 45.
Vanholme R, Storme V, Vanholme B, Sundin L, Christensen JH, Goeminne G, Halpin C, Rohde A, Morreel K, Boerjan W:拟南芥木质素生物合成扰动响应的系统生物学研究。植物细胞学报,2012,24(9):3506-3529。10.1105 / tpc.112.102574。
- 46.
Sibout R、Eudes A、Pollet B、Goujon T、Mila I、Granier F、Seguin A、Lapierre C、Jouanin L:拟南芥肉桂醇脱氢酶2个同源基因的表达谱。相应突变体的分离和鉴定。植物科学进展,2003,26(2):344 - 344。10.1104 / pp.103.021048。
- 47.
Sibout R, Baucher M, Gatineau M, Van Doorsselaere J, Mila I, Pollet B, Maba B, Pilate G, Lapieffe C, Boerjan W, Jouanin L:阿魏酸-5-羟化酶/针叶树醛5-羟化酶cDNA的表达增加了拟南芥S木质素的沉积。植物化学学报,2002,40(12):1087-1096。10.1016 / s0981 - 9428(02) 01474 - 2。
- 48.
Sibout R、Eudes A、Mouille G、Pollet B、Lapierre C、Jouanin L、Seguin A:肉桂醇脱氢酶C和-D是拟南芥花茎木质素生物合成的主要基因。植物细胞学报,2005,17(7):2059-2076。10.1105 / tpc.105.030767。
- 49.
李志刚,李志刚,李志刚,李志刚。拟南芥木质化工具箱的研究进展。植物营养学报,2003,26(3):344 - 344。10.1104 / pp.103.026484。
- 50.
吕松,周勇,李玲,蒋维林:杨树肉桂酸4-羟化酶基因的研究进展。植物生理学报,2006,47(7):905-914。10.1093 /卡式肺囊虫肺炎/ pcj063。
- 51.
李D,梅耶尔K, Chapple C,道格拉斯CJ:反义抑制拟南芥4-香豆酸辅酶A连接酶活性导致木质素亚基组成改变。植物细胞学报,1997,9(11):1985-1998。
- 52.
Hoffmann L, Besseau S, Geoffroy P, Ritzenthaler C, Meyer D, Lapierre C, Pollet B, Legrand M:羟肉桂酰辅酶A的沉默影响苯丙烷生物合成。植物细胞学报,2004,16(6):1446-1465。10.1105 / tpc.020297。
- 53.
Deluc L, Barrieu F, Marchive C, Lauvergeat V, Decendit A, Richard T, Carde J, Merillon J, Hamdi S:调控苯丙类途径的葡萄R2R3-MYB转录因子的鉴定。植物营养学报,2006,40(2):379 - 379。10.1104 / pp.105.067231。
- 54.
赵强,Dixon RA:木质素生物合成的转录网络:比我们想象的更复杂?植物动态,2011,16(4):227-233。10.1016 / j.tplants.2010.12.005。
- 55.
周建林,李春春,钟仁青,叶志华:拟南芥木质素生物合成途径在次生细胞壁形成过程中的转录激活因子MYB58和MYB63植物学报,2009,21(1):248-266。10.1105 / tpc.108.063321。
- 56.
Derikvand MM, Sierra JB, Ruel K, Pollet B, Do CT, Thevenin J, Buffard D, Jouanin L, Lapierre C:肉桂酰辅酶a还原酶1缺乏拟南芥突变体苯丙类途径重定向到苹果酸阿魏酸。植物学报,2008,27(5):344 - 344。10.1007 / s00425 - 007 - 0669 - x。
- 57.
Tronchet M, Balague C, Kroj T, Jouanin L, Roby D:肉桂醇脱氢酶-C和D是木质素生物合成中的关键酶,在拟南芥的抗病性中起重要作用。植物病理学杂志,2010,11(1):83-92。10.1111 / j.1364-3703.2009.00578.x。
- 58.
Eudes A, Pollet B, Sibout R, Do C- t, Séguin A, Lapierre C, Jouanin L: AtCAD 1在拟南芥伸长茎木质化过程中的作用。植物学报,2006,25(1):1 -3。10.1007 / s00425 - 006 - 0326 - 9。
- 59.
吴珊珊,朴珊珊,韩k - h:拟南芥次生生长的转录调控。应用物理学报,2003,29(3):379 - 379。10.1093 / jxb / erg304。
- 60.
Yonekura-Sakakibara K, Fukushima A, Nakabayashi R, Hanada K, Matsuda F, Sugawara S, Inoue, Kuromori T, Ito T, Shinozaki K, Wangwattana B, Yamazaki M, Saito K:拟南芥中参与花青素修饰的两种糖基转移酶的转录组独立成分分析。植物学报,2012,29(3):344 - 344。10.1111 / j.1365 - 313 x.2011.04779.x。
- 61.
杨晓明,杨晓明,杨晓明:植物漆酶与木质素形成的关系。植物营养学报,2002,26(3):344 - 344。10.1034 / j.1399-3054.2002.1160301.x。
- 62.
Ranocha P, Chabannes M, Chamayou S, Danoun S, Jauneau A, Boudet A-M, Goffner D:漆酶下调导致杨树酚类代谢和细胞壁结构改变。植物营养学报,2002,26(1):1 - 5。10.1104 / pp.010988。
- 63.
Berthet S, Demont-Caulet N, Pollet B, Bidzinski P, Cezard L, Le Bris P, Borrega N, Herve J, Blondet E, Balzergue S, Lapierre C, Jouanin L: LACCASE4和17的破坏导致拟南芥茎木化的组织特异性改变。植物细胞学报,2011,23(3):1124-1137。10.1105 / tpc.110.082792。
- 64.
钟锐,李超,叶志华:拟南芥次级壁NAC主开关直接靶点的全局分析。分子植物学报,2010,3(6):1087-1103。10.1093 / mp / ssq062。
- 65.
Yildirim E, Taylor AG, Spittler TD:盐胁迫下生物处理对南瓜生长的改善作用。Sci Hortic-Amsterdam。2006, 31(1): 1-6。10.1016 / j.scienta.2006.08.003。
- 66.
杨建平,李志强,陈志强,陈志强,陈志强。根际细菌对根结线虫的抑制作用。生物防治,2008,47(1):55-59。10.1016 / j.biocontrol.2008.07.008。
- 67.
王勇,陈珊珊,王艳,于欧,邱伟:诺顿葡萄果实皮发育的转录调控与类黄酮生物合成模式。植物学报,2010,11 (1):7-
- 68.
Kleindt CK, Stracke R, Mehrtens F, Weisshaar B:拟南芥(Arabidopsis thaliana siilique)类黄酮生物合成基因在种子发育过程中的表达分析,重点研究原花青素生物合成途径。BMC研究笔记。2010, 3: 255-10.1186/1756-0500-3-255。
- 69.
Mehrtens F, Kranz H, Bednarek P, Weisshaar B:拟南芥转录因子MYB12是苯丙醇生物合成的黄酮醇特异性调节因子。中国生物医学工程学报,2005,29(2):344 - 344。10.1104 / pp.104.058032。
- 70.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。拟南芥花青素合成途径的研究进展。植物科学进展,2006,30(2):344 - 344。10.1104 / pp.105.072579。
- 71.
Luo J, Nishiyama Y, Fuell C, Taguchi G, Elliott K, Hill L, Tanaka Y, Kitayama M, Yamazaki M, Bailey P, Parr A, Michael AJ, Saito K, Martin C:拟南芥花青素酰基转移酶BAHD家族的趋同进化:拟南芥花青素酰基转移酶的鉴定和鉴定。植物学报,2007,30(4):366 - 366。10.1111 / j.1365 - 313 x.2007.03079.x。
- 72.
Velten J, Cakir C, E的梦想,陈J, Cazzonelli CI:在烟草植物转基因沉默和Transgene-Derived siRNA生产纯合子的介绍<斜体> AtMYB90 < /斜体>构造。公共科学学报,2012,7 (2):e30141-10.1371/journal.pone.0030141。
- 73.
郭建勇,Felippes FF,刘春杰,Weigel D,王金文:mir156靶向SPL转录因子对拟南芥花青素生物合成的负性调控。植物细胞学报,2011,23(4):1512-1522。10.1105 / tpc.111.084525。
- 74.
戚涛,宋松,任强,吴东,黄红,陈艳,范敏,彭伟,任超,谢东:拟南芥茉莉酸- zimm -结构域蛋白与bd - repeat /bHLH/MYB复合物相互作用调控茉莉酸介导的花青素积累和毛状体形成。植物细胞学报,2011,23(5):1795-1814。10.1105 / tpc.111.083261。
- 75.
孙志刚,李志刚,李志刚,李志刚。拟南芥木质部细胞转分化抑制ATE基因的研究进展。植物营养学报,2005,37(1):344 - 344。10.1104 / pp.104.055145。
- 76.
Minic Z, Jamet E, San-Clemente H, Pelletier S, Renou J-P, Rihouey C, Okinyo D, Proux C, Lerouge P, Jouanin L:拟南芥发育茎的转录组分析:细胞壁基因的特写。植物学报,2009,9(1):6-10.1186/1471-2229-9-6。
- 77.
黄建林,顾敏,赖志斌,范宝峰,石凯,周永华,余建青,陈志新:拟南芥PAL基因家族在植物生长发育及环境胁迫响应中的功能分析。中国生物医学工程学报,2010,29(4):357 - 357。10.1104 / pp.110.157370。
- 78.
林志刚,李志刚,李志刚。诱导胁迫对云杉木质素结构的影响。植物营养学报,2003,26(3):357 - 357。
确认
这项工作得到了美国肯塔基州列克星敦市肯塔基大学植物与土壤科学系根际科学高级微生物解决方案实验室的支持。我们要感谢加州大学戴维斯分校基因组中心的LC-MSMS数据收集和分析。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
M.B.A.构思、设计实验、采集样本、进行总RNA提取、RNA质量、qRT-PCR、数据分析、qRT-PCR产物测序、代谢物分析、制作图表、撰写初稿、定稿。DJM构思、设计了实验,并参与了手稿编辑工作。两位作者都阅读并批准了最终的手稿。
电子辅助材料
类黄酮生物合成途径,导致花青素和黄酮醇的生产
附加文件1:拟南芥;几种转录因子(MYB, bHLH和WD-40)沿可能参与结构基因转录调控的分支显示。转录因子为黑盒子,结构基因为红色,中间产物为蓝色。(doc 153kb)
12870 _2013_1489_moesm6_esm.doc
附加文件6:用于qRT-PCR分析的引物和扩增片段的预期大小。从公共数据库的接入编号如下。(doc 80kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。
关于本文
引用本文
Ali, m.b., McNear, D.H.诱导苯丙素通路基因的转录谱分析增加了黄酮类化合物和木质素含量拟南芥叶片对微生物产物的反应。BMC植物生物学14,84(2014)。https://doi.org/10.1186/1471-2229-14-84
收到了:
接受:
发表:
关键字
- 拟南芥
- 代谢物
- 微生物
- 转录分析
- 促进植物生长的根瘤菌
- 土壤建设者