摘要
背景
黄萎病longisporum是一种土壤传维管病原体,侵染十字花科宿主,如油菜。数量抗病(QDR)是主要的防治手段,但目前对其分子基础知之甚少。利用新克隆(Bur×L呃)重组自交系(RIL)人口拟南芥.通过对确定的突变体和近等基因系(NILs)的植物激素测定和分析,确定了不同抗性QTL的基因和信号通路。
结果
抗性QTL诉longisporum由真菌引起的发育不良,全身定植诉longisporum- 鉴定出萎缩。衰退阻力QTL由父母两人贡献。最强劲的稳定性QTL显示出与之相同erecta..一个功能erecta.途径,存在于Bur,给予部分抵抗诉longisporum全身的发育不良。Bur在冬季表现出严重的发育不良易感性。3个矮化抗性QTL呃来源,两个与壁相关激酶样的共定位(姿态)-基因,在冬季被检测。此外,Bur对水杨酸(SA)的诱导作用更强诉longisporum比我呃.全身定植是独立于发育不良而控制的。的vec1染色体2上的QTL对系统定植的影响最强。相同的染色体区域控制脱离酸(ABA)和茉莉酸(JA)的响应诉longisporum:殖民化易感L的ABA水平较高呃比在殖民化的抗性之后诉longisporum感染。在感染后,JA在Bur中受到了下调,但不在L中呃.这些差异也在NILs中表现出来,仅在包含的区域有所变化vec1.所有植物激素反应都被证明与...无关erecta..
结论
信号传导系统,迄今为止在QDR中的未知作用答:芥对诉longisporum确认:erecta.介导的抵抗诉longisporum全身的发育不良。独立的erecta.,发晕是以光依赖的方式引起的,可以通过SA和SA的可能参加姿态基因。ABA和JA表现出与真菌系统定殖相对应的基因型特异性反应。了解表型变异的生物学基础答:芥关于诉longisporum抗性将为十字花科作物实现持久抗性提供新的途径。
背景
数量抗病(QDR)是一种复杂的现象,涉及多种分子机制[1,2].它通常是一种可持续的抵抗抵抗形式,依赖于多种基因和效果,该效果不能通过病原体适应容易地克服。黄萎病longisporum是一种新近进化起源的土传维管病原体,寄主范围以十字花科植物为中心[3.].QDR是迄今为止所描述的对抗这种病原体的唯一形式。诉longisporum对油菜造成重大且日益严重的产量损失[4- - - - - -7].真菌通过根进入寄主,在开花开始时,系统地在木质部内扩散,从而殖民整个植物[5,8,9].诉longisporum诱发早期衰老[6,10]并沉淀衰老组织以形成持续在土壤中的微克洛蒂11].由于疾病难以控制,因此宿主植物中的耐久性是非常理想的。
定量抗性诉longisporum已被描述为各种芸苔属植物物种(12- - - - - -15(Konietzki和Diederichsen未发表)答:芥指标(8,10,16,17].在某些情况下,已经鉴定出了控制抗性性状的QTL,如鲜重[16],氯化[10,16]、全身定植、发育迟缓和腋窝分枝[8]或疾病进展曲线下的区域芸苔属植物物种(15(Konietzki和Diederichsen未发表)。然而,潜在的基因和调控过程很少被确定。次级代谢在抵抗中起作用:一种抵抗系B. Napus.在受侵染时下胚轴木质部产生的酚类物质比易感品系多[18].事实上,苯丙类化合物含量的QTL与抗性QTL共定位B. Napus.[19],可溶性苯丙素在其中起作用答:芥防御诉longisporum[20.].RFO1.已经被证明可以调解抵抗诉longisporum- 诱导鲜体重减轻答:芥[16,并编码一种壁相关激酶样蛋白(WAKL),这种蛋白赋予了抗尖孢镰刀菌[21].
最近的研究揭示了宿主对宿主的不同流程诉longisporum在分子水平上:乙烯信号要么起保护作用,要么起有害作用,这取决于所涉及的信号成分[16,22].诉longisporum感染引起的XYLEM中的水杨酸(SA)升高芸苔属植物射击[23].先前的研究表明茉莉酸(JA)信号在宿主-病原体相互作用中不起作用[10,23],但JA受体COI1以JA独立但未知的方式促进疾病[24].然而,吲哚硫代葡萄糖苷和卡马毒素的相互作用已被证明参与了早期防御诉longisporum在答:芥根(25],活性氧在疾病后期阶段的防御中发挥作用[26].此外,核局部化ahl19基因作为一个积极的调节防御诉longisporum和其他轮枝菌属物种答:芥[27].诱导了几种质外体酶诉longisporum在芸苔属植物并且可能在防守中发挥作用[28].宿主对病原体的反应涉及束鞘细胞在血管相关NAC结构域7转录因子的控制下将束鞘细胞变成功能性木质素元素[29].
但是,关于这些过程如何与QDR有关的知之甚少。目前尚不清楚抵抗QTL是否在监管系统内代表基因,这些系统在主机 - 病原体交互中运行,或者是否构成新组件,增加了危险系统的复杂性。此外,已知的防御信号传导途径在天然抵抗力中的作用诉longisporum到目前为止,人们对它的了解还很有限。
本研究旨在识别基因和信号通路,解释QDR的差异诉longisporum在答:芥.QTL用于使用新的相关电阻性状(Bur×L.呃)已识别重组近交系数(RIL)人口。它显示出来的erecta.基因对应于强烈的QTL介导抗炎性和功能性erecta.信号通路介导的抵抗诉longisporum全身的发育不良。研究结果表明,ABA、ABA和JA的含量与ABA、ABA和JA的含量有关诉longisporumABA和JA含量的变化也受到QTL的控制,QTL也对真菌的系统定植产生了抗性。
方法
材料
答:芥Ecotypes Bur-0,Col-0和L.呃-0最初来自法兰克福拟南芥信息服务(AIS) [30.]并保持内部。所有其他答:芥基因型从诺丁汉拟南芥种群中心(NASC)获得。ER-105.,ER-108,ER-111,ER-118.都被认为是强有力的erecta.突变体,虽然ER-116.代表一个弱erecta.突变体[31,32].agb1-1的β亚基缺陷,作为一个信号部件的下游作用的突变体被包括erecta.[31].的诉longisporum分离' 43 ' (V43) [33用于接种试验。
一代(Bur×L呃RIL群体和近等基因系(NILs)
从生态型bur0(♀)与L之间的F1中,共获得189条ssr引物呃0(♂)。189个F2植株通过单种子遗传至F6代。所有植株在20℃长日照条件下(16 h光照/8 h黑暗)在温室盆栽中生长,盆栽直径为5 cm。共对94株F6进行基因分型和表型分析。有关RIL种群的信息将提交到拟南芥信息资源(TAIR)数据库[34, F6基因型植株F7的大体积后代的F8种子将通过答:芥股票中心拟南芥生物资源中心(ABRC)和NASC。
RIL21在2号染色体上的标记EH2-4和nga361均为杂合子,其他标记位点均为纯合子。从RIL21后代中选择NIL5作为可变区Bur等位基因的纯合子,NIL9作为L等位基因的纯合子呃等位基因。
标记开发和分析
利用73个多态性标记对ril进行基因分型呃.其中SSR (simple sequence repeat, SSR)标记39个,SCAR (sequence characteristic, SCAR)标记21个呃在单核苷酸多态性(SNPs)基础上开发了12个cleaved amplified polymorphsequence (CAPS)标记;见附加文件1).的erecta.突变被用作形态学标记,而CAPS标记(BLC2-1)也被用于区分Bur和L呃等位基因erecta..此前已发表51个标记[8,34,35],设计22个新标记,以增加主要QTL区域的标记密度(附加文件1).Bur和L .的长度多态性呃使用多个SNP查询工具(MSQT)数据库进行识别[36].SNP通过TAIR的SEQVIEWER工具提供[37,38]用于CAPS标记物设计。Webcutter 2.0 [39用于识别SNPS位点处的差分限制性位点。基于TAIR提供的序列信息设计了引物。
接种实验
接种试验是在温室或生长室(德国莫比莱克的Grobank)进行的,在长日条件下(16 h光照/8 h黑暗)的土壤上进行的,如前所述[8].在20 × 30厘米的托盘中种植了30株植物。将相同处理和基因型的植株按15株(1/2盘)或30株(1盘)分批排列。随机分组重复。在实验期间,植物开花并一直生长到第一批角果变黄。对相同的94个品系进行了两个RIL群体表型分析实验(见表)1,实验1和2)erecta.对突变体进行了两次温室试验1试验3和试验5),并对3个试验的植物激素含量进行了分析(表3)1试验4、试验5和试验6)呃(表1试验4),在3个不同的发育阶段采收呃在31 dpi的接种(DPI)和Bur后20天。在L中的27 dpi分析II阶段(中到后开花阶段)呃在Bur中的38 DPI。在L 31 DPI分析III阶段(Silique成熟的发作)呃并在Bur中的48 DPI。
表型分析
通过不同的参数记录特质(表1).发育阻力测量为“表现高度”(平均高度)接种过的/平均身高控制× 100)和“性能鲜重”(平均FW)接种过的/意味着弗兰克-威廉姆斯控制×100)。这些性能参数弥补了株高和鲜重的差异erecta.在角果成熟开始时,当枝条脱落时,测定下胚轴和最长枝条的顶端之间的高度。在角果成熟开始时,系统定植在主茎的顶端。如前所述,为了确定每个重复的定殖植株的百分比,每个接种植株的一个片段被放置在麦芽琼脂平板上[8],并按15-30株分批计算定殖段百分率。为了通过qPCR检测真菌DNA,从用于电镀和液氮休克冷冻的片段中切取100 mg的芽材料。qPCR使用轮枝菌属如上所述进行特异性引物[40].通过计数黄、绿莲座叶的数量来测定萎黄。用三个不同的参数来量化该性状:接种植株中黄色莲座叶的数量是黄化最直接的衡量指标。此外,还计算了黄叶占莲座总叶数的百分比,以表达叶片褪绿程度对莲座的影响。作为第三个参数,给出了同一株系接种和模拟接种植株黄叶的差异,从而考虑了自然衰老。两组RIL实验的褪绿情况(实验1和实验2,表1在17 dpi时,对照植株仍然表现出很少或没有衰老相关的褪绿病,而对照植株则表现出了与衰老相关的褪绿病诉longisporum接种的植株叶片呈褪绿。为了确定黄变的时间进程,采用模拟接种和接种L呃在生长室内试验(试验7,表1).子叶不包括在内。
HPLC-ESI-MS/MS测定植物激素
从15-30株相同处理的植株中采集茎上半部分约6厘米处的样本,并汇集在一个样本中。原料在收获后直接在液氮中冲击冷冻,然后在球磨机中冻干并研磨成细粉。将50-100 mg(干重)放入2.0 ml试管中,根据修改后的方案用于植物激素提取[23].一个mL萃取溶剂(20%丙酮,79%H.20和1%ch3.COOH和2 ng的氘化内标d6 -水杨酸,Sigma-Aldrich Co.)加入到每个样品中。提取在4°C旋转振动筛(160转/分)上进行45分钟。随后,每个样本飙升1.0毫升乙醚(迪),涡流不久,和动摇(160 rpm, 4°C)额外的30分钟。样品在8500 g离心5分钟。上迪被转移到一个新的阶段1.5毫升管,剩下的水相是re-extracted 1.0毫升迪和前面的步骤一样。将两个DEE馏分混合,30℃真空干燥,在200 μl高效液相色谱(HPLC)溶剂(1:1 H)中重新溶解2O:含7 mM CH的甲醇3.COOH), 8500 g再次离心5分钟,转移(180 μl)到HPLC锥形瓶(200 μl内容积,德国WICOM)。
提取样品(10 μl)注入高效液相色谱,40℃洗脱,流速0.2 ml/min-1.采用Kinetex®C18色谱柱(100 mm × 2.10 mm,粒径为2.6 μm)进行色谱分析,并配备从Phenomex公司(Aschaffenburg, Germany)购买的C18保护柱。洗脱程序为:80%溶剂A(水:乙腈95:5),含7 mM CH3.COOH和20%溶剂B(甲醇含7 mM乙酸)作用40 s;斜坡到98% B在50秒;保持2分钟20秒,然后再平衡至20% B。
植物激素在三重四极质谱仪(LC12000)的多反应监测模式(MRM)中检测,该质谱仪配有电喷雾界面,使用的设置如[41].使用以下大规模转变(碰撞能量:Ce):SA 136.8 / 93.0(CE 14.5 EV);D6-SA 140.9 / 97.0(18.5 EV),JA 208.9 / 59.0(9.5 EV)和ABA 262.8 / 153.0(8.0eV)。将未标记标准的峰面积与氘标记标准的峰面积的比例的校准曲线用于定量SA。用纯标准获得的外部校准曲线量化其他植物激素。
图谱构建及QTL分析
利用JoinMap检测连锁群和等位基因频率对分离畸变进行检测[42].利用MapManager QTX 20b构建图谱并进行QTL分析[43使用Haldane映射函数。简单区间作图,每1 cm步扫描基因组。MapManager QTX给出LRS(似然比统计)值来评估假阳性的概率,其中LRS = 4.6 × LOD(概率的可能性)[44].LRS显著性阈值为37%(提示)、95%(显著)和99.9%(高度显著)全基因组置信度水平,通过10,000个排列试验确定。通过bootstrap试验计算原始数据集的多个重采样数据集的QTL位置,确定QTL的置信区间。利用MapManager QTX 20b的“交互作用”功能搜索上位性交互作用,检测可能存在交互作用的标记对。标记对总效果的置信标准设置为p = 10-5.MAPQTL®6[45[还用于在QTL分析中包括在QTL分析中包括协变量和辅因子的映射。最初根据间隔位置处的峰位置指定辅助因子,并通过使用MAPQTL®6的“自动辅子选择”工具来倒退消除选择。使用MapChart进行映射[46].
统计数据
所有接种试验都是每个基因型和处理批次至少15株。大多数接种试验是在6 ~ 10个批次重复上进行的。部分参数,如植物激素含量、生长性能参数或定殖芽节百分比,是按批次计算的,而部分褪绿参数则是按单株计算的。在RIL接种试验中,每个基因型只接种一批15-30株,可同时检测96个基因型。为了验证结果,我们重复了整个实验。见表1参阅单厂和批复制的概述。如结果部分所示,所有的统计分析均使用SPSS 20进行[47].
结果
QTL控制抗性特征诉longisporum在(bur×l呃)瑞来斯的人口
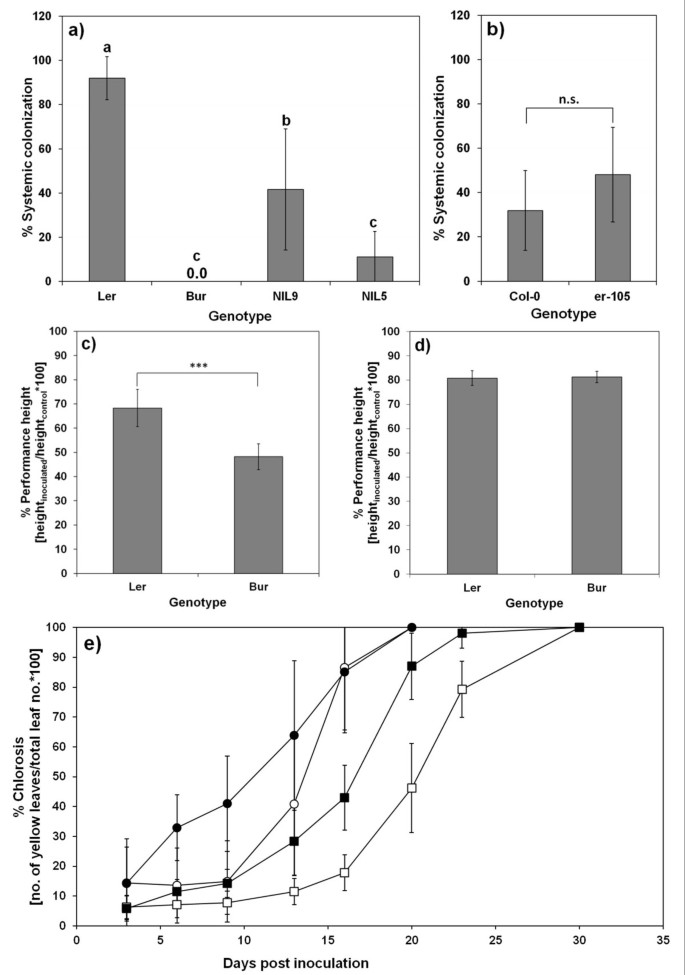
父母的ecotypes bur和l呃不同的重要抗性性状诉longisporum(图1).l呃对病原菌的系统性定植敏感,而Bur则表现出高度的抗性(图1但是,更容易受到诉longisporum-诱导的发育不良比L呃.这一表型在夏季温室强光条件下受到抑制(图)1C,D)。诉longisporum促进黄变呃和Bur相比,模拟接种的对照组。自然和诉longisporum诱导的氯化在早期开花的生态型L中发生得多呃比晚开花生态型的Bur(图1e)。
表型特征不同答:芥基因型。a、b)系统殖民化一种)l呃, Bur和两个NILs在vec1区域(实验6;单向ANOVA和HOC Tukey Test,P <0.05,n = 6-7),和b)两种基因型只在erecta.函数(实验5,t-test, p < 0.05, n = 6)。光盘)抵抗力诉longisporum-诱导发育迟缓表现为表现高度c)冬季实验(实验1,t-test, p < 0.05, n = 6)d)在春季进行的一个实验(实验2,t-test, p < 0.05, n = 6)。e)叶柄中萎黄莲座叶的比例(正方形)和L呃(圈)诉longisporum-在生长室实验过程中接种(封闭符号)和模拟接种(开放符号)。竖条表示标准差。生态类型和处理与6 dpi差异显著(p < 0.05;t以及;L的n = 41呃mock, n = 38代表Ler诉longisporum,n = 60对于bur模拟,n = 58毛诉longisporum).
QTL控制诉longisporum抗性性状在一个新的(Bur×L呃瑞来斯的人口。利用拟南芥基因组计划(Arabidopsis Genome Initiative, AGI)参考地图上每个标记的已知位置,计算出遗传图谱并生成物理图谱[48](附加文件2).在遗传图谱中,染色体以连锁群的形式存在,LOD评分从4(染色体1)到10(染色体4)不等,各染色体上的遗传标记顺序与物理图谱相同。全图大小为407.3 cM,标记间距平均为5.7 cM,标记间最大距离为17.6 cM。F6杂合子标记的比例为3.65%,与预测值3.125%基本一致。
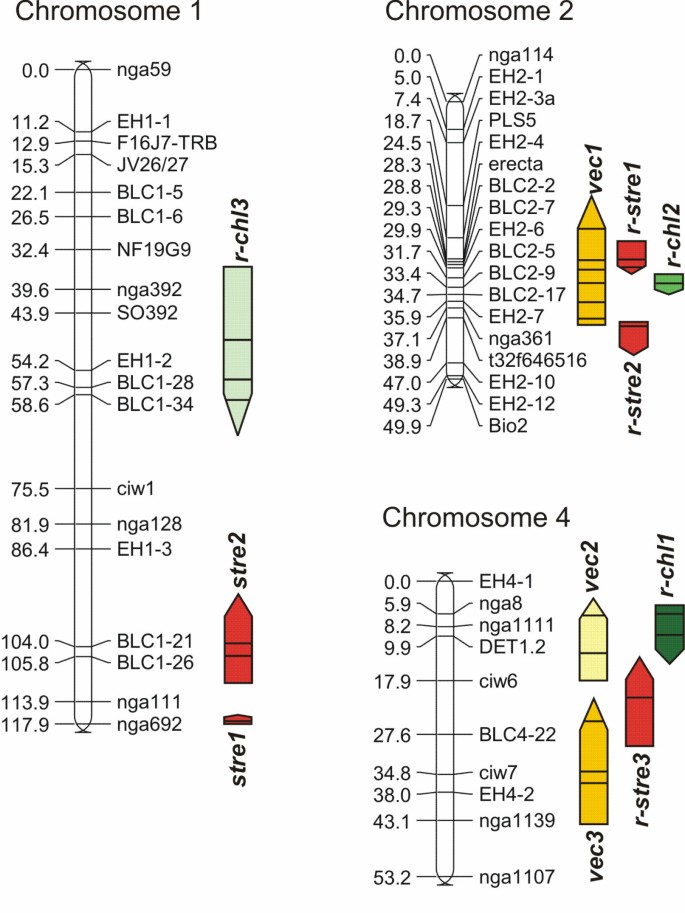
3个抗性性状均检测到QTL(图)2额外的文件3.).QTL控制轮枝菌属c喝酒(vec)在第2和4号染色体上检测到,QTL为圣违规再保险sistance(压力和r-stre)的QTL定位,为抗性的QTL定位诉longisporum全身的的背影orosis(r-chl)还在染色体1,2和4上。根据先前使用的命名法命名QTL [8].在RIL群体中唯一发现的QTL前缀为“r-”,表明其来源于RIL作图。所有表征性状的参数均呈正态分布或多模态分布,这两种分布都可能发生在多个QTL控制的性状中4).
QTL的定位诉longisporum相关的特质答:芥(大果×L呃瑞来斯的人口。白色条形代表染色体,在cM中有标记位置。彩色条划分QTL的置信区间如下:浅黄色:系统定植,%定植芽段,exp. 1。暗黄色:系统定植,%定植射击片段,经验2。红色:阻碍抗性,性能高度,exp. 1。深绿色:褪绿,黄色叶片数量,exp. 1。中绿色:褪绿,%黄色叶片,exp. 1。浅绿色:黄化,假接种和假接种之间黄色叶片的差异诉longisporum-接种植物,exp. 1。条形图中的黑线表示LRS峰值位置。向上的箭头表示父系生态型(L呃)是增加等位基因的起源;向下的箭头表示Bur是增加等位基因的来源。图1显示了来自最具代表性数据集的QTL。QTL名称写在条形图的旁边。有关重现性和进一步的QTL信息,请参阅附加文件3..
所有vecQTL控制系统性殖民根据参数和接种实验组成的阵列包括几个LRS峰值(图2额外的文件3.).在两种参数(电镀试验和qPCR)和接种试验中,峰的映射位置都是可重复的(附加文件)3.).vec1根据参数和实验,可以解释高达19.3%的性状变异,vec2高达15%和vec3高达17.3%(附加文件3.).的vec1QTL在2号染色体上~ 3个megabase片段的NILs中可以被确认vec1.与L NIL9呃可变区域的等位基因比NIL5的Bur等位基因对系统定植更敏感(图)1一个)。vec增加定殖程度的等位基因为L呃来源。因此,定殖抗性完全由各自QTL的Bur等位基因决定。定植QTL和发育QTL在第4染色体上的共定位(附加文件)3.)表明了发育对系统定植的影响,尽管所有的评估都是在确定的发育阶段进行的。利用MapQTL进行区间作图或多重QTL作图(MQM)时,发育参数作为协变量。用发展参数作为协变量vec4号染色体QTL消失vec1在染色体2上仍然是唯一显示对这种抗性性状有显著影响的染色体区域。2号染色体QTL区段的辅助因子选择和所选辅助因子在MQM中的应用,将控制系统定植程度的QTL区段限定在EH2-6、BLC2-2和之间的一个片段上erecta.,跨度约1.6厘米。
QTL的定位发育不良只能用参数“性能高度”而无法检测到电阻,而不是“性能鲜重”。在接种实验中检测到染色体2上的QT1;染色体1和4上的QT1仅在实验1中检测,在冬季进行。stre2.与标记BLC1-26共同定位,位于Wakl9基因,解释了22.9%的性状变异。stre1.,解释16.8%的方差,也位于A附近姿态基因(Wakl22./rfo1).r-stre1附近的标志erecta.在第2条染色体上解释了试验1中约30%的性状变异(图2额外的文件3.).染色体2上QTL的稳定阻力等位基因是Bur原点,而染色体1和4上的稳定性抗刺激性QTL由L贡献呃.两个亲本都贡献了发育抗性QTL,这解释了该性状的强越位分离(附加文件)4).在系统定植程度上,发育对发育不良程度有明显影响。将发育性状作为共变量作图,通过消除QTL,减少了控制该性状的QTL数量r-stre3在第4号染色体上,在实验1中检测到。
重要的QTL萎黄病参数(r-chl.)仅在实验1中检测到(图1)2额外的文件3.).R-CHL1.4号染色体上的QTL解释了高达29.3%的性状变异。R-CHL2.在染色体2上解释了11.7%和R-CHL3.在1号染色体上高达14.8%。令人惊讶的是,所有抗黄化的等位基因均为L呃来源。2个加速油菜开花时间的QTL呃产地在同一地区(dt₁和dt2,请参阅附加文件3.).一般来说,花期的推迟与衰老的推迟有关。此外,使用发育性状作为协变量没有影响R-CHL1.4号染色体上。这两个事实都有力地证明了QTL已经被定位为特异性的诉longisporum而非调控发育的QTL。
在测试之间无法再现标记基因座之间的认证相互作用。关于在实验1中由电镀测定确定的定植数据,检测到染色体4上的染色体2和NGA1111上的标记物基因座BLC2-7之间的显着相互作用。两个基因座都在置信区间内vec1和vec2,分别。综上所述,两亲本的QTL均控制不同的抗性性状诉longisporum在(bur×l呃瑞来斯的人口。
诉longisporum-诱导的发育迟缓受ERECTA信号控制
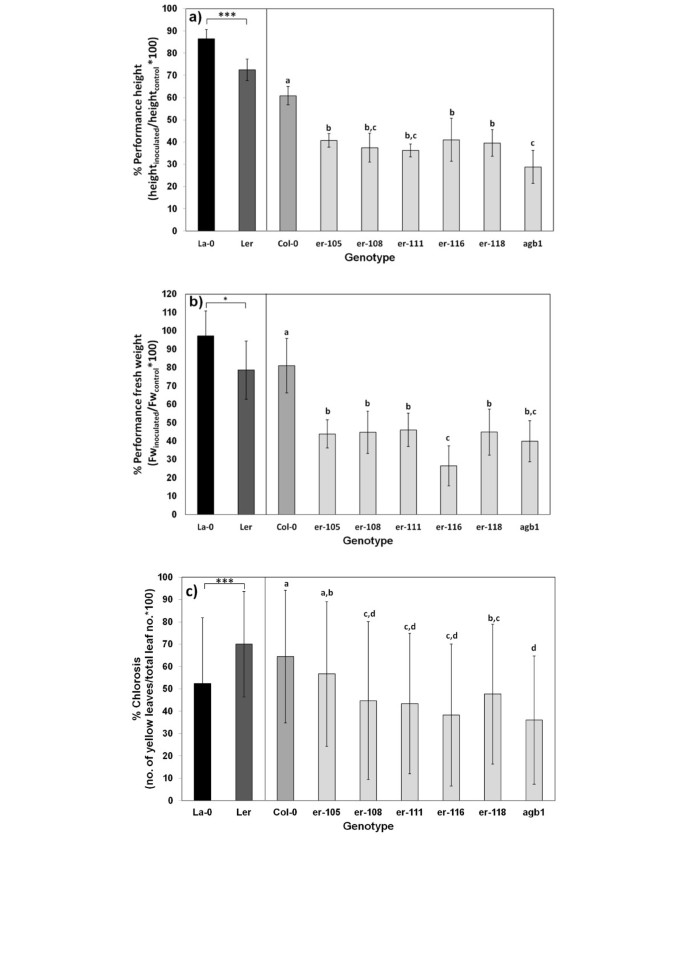
发育不良抗性强的QTLr-stre1与形态学标记共同定位erecta。erecta.在植物发育和QDR中具有多种功能的类受体激酶的编码[49].L呃被扰乱了[32],虽然Bur包含功能性erecta.等位基因。进行接种实验erecta.突变体及其各自的WT生态型具有功能erecta.研究等位基因是否具有功能性erecta.途径增加阻力。l呃与La-0生态型比较。将Col-0与erecta.Col-0背景中的突变体。的agb1-1突变体在异统G蛋白的β-亚基中有缺陷的COL-0背景中的突变体含有代表另一个组分erecta.信号通路[31].所有erecta.突变体和突变体agb1-1突变体明显发育不良诉longisporum与WT相比,所有突变体的“性能高度”和“性能鲜重”参数均降低(图5)3.a,b)。弱者ER-116.突变体并不比强突变体表现更好。的发育表型ER-116.,然而,却明显减弱:对照组的平均身高为22.3厘米,而强壮组的平均身高为16.5厘米erecta.突变体。一个功能erecta.在两个背景中的任何一个背景下都没有显着贡献殖民化抗性(图1b,额外的文件5)尽管QTL的强大殖民地化vec1它被定位在erecta..因为氯化钠的一个QTL(R-CHL2.)本地化了erecta.区域内,调查是否有损失erecta.萎黄病影响函数。Col-0的褪绿程度高于erecta.背景为col0的突变体(图3.C),提示有促进褪绿作用erecta..然而,影响erecta.在La-0/L是相反的吗呃: La-0的褪绿率低于L呃(图3.c).因此,一种特定的背景效应erecta.必须假定为褪绿。
它被证明了erecta.底层稳定阻力QTLr-stre1以及一种功能性的ERECTA信号通路介导的发育迟缓抗性答:芥.
SA和弱光与诉longisporum全身的发育不良
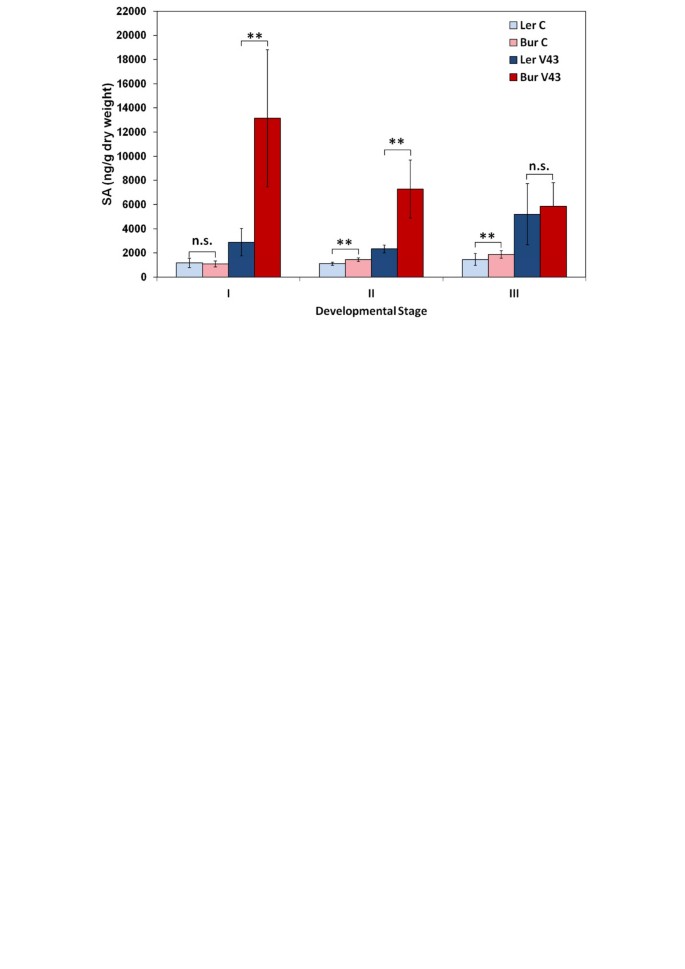
SA含量增加答:芥感染后茎诉longisporum在两个bur和l呃(图4).在早期开花的阶段中,SA水平大幅增加,而SA在L中显示出轻度但显着增加呃随着开花的推进(图4).SA过度诱导与vec1也与erecta.,如NILs和erecta.突变体(附加文件6和7).此外,Burs表现出高的敏感性诉longisporum- 在冬季实验中感到衰退(图1c).这种与季节相关的易感性可能与QTL的Bur等位基因有关stre1.,stre2.和r-stre3,前两个与姿态基因。温室实验总是在温度在20 - 25°C之间的长日照条件下进行。而环境光的强度、剂量和光谱组成是影响春夏冬季实验的主要因素,仅人工光照的量子通量密度在80 ~ 100 μmol*s之间-1*米-2,而额外的自然日光在200到400μmol* s之间提供-1*米-2.
推测是SA诱导和弱光引起的诉longisporum-诱导的发育迟缓由季节性影响的QTL介导stre1.,stre2.和r-stre3(见讨论)。
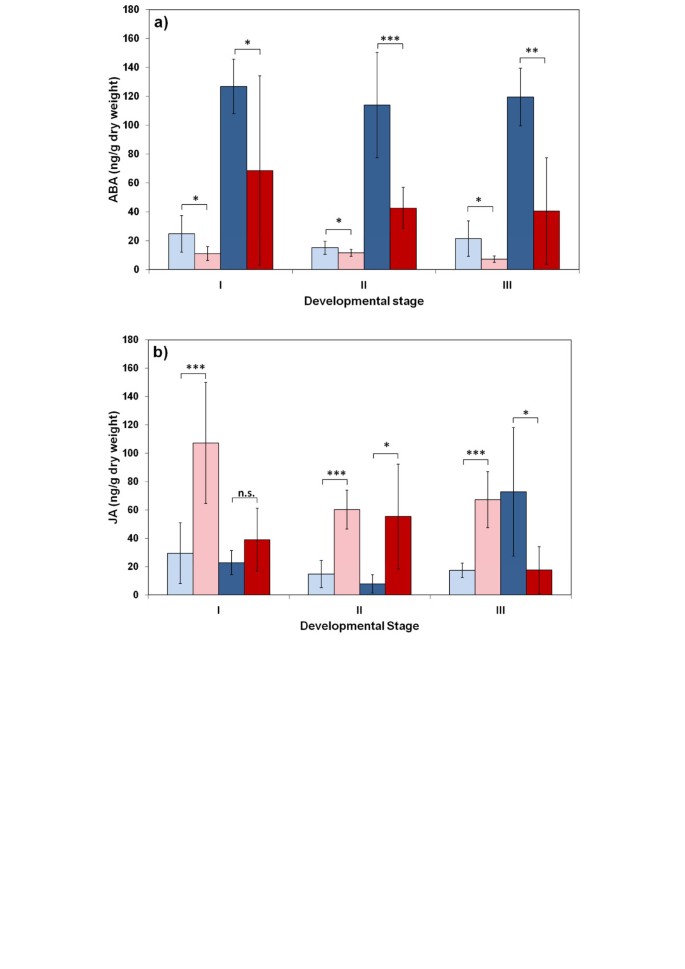
ABA和JA对诉longisporum感染被控制在vec1
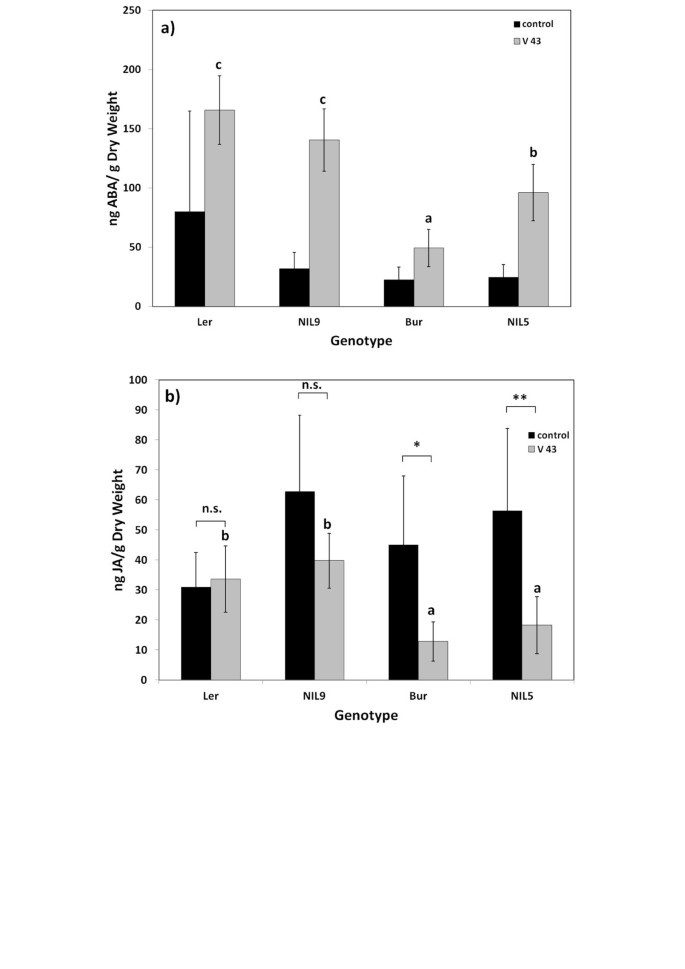
钻和L呃他们的aba和ja回应不同诉longisporum:苜蓿中ABA含量较高呃比在感染时的Bur(图5和6).JA水平的变化在l相反呃在成熟阶段和伯毛:j中的ja水平呃与模拟接种植株相比,受感染植株的Bur中的JA水平下降(图)5和6).成熟期NILs中ABA和JA含量的分析表明,这种差异与基因组区含ABA和JA有关vec1和erecta.在染色体2上(图6).NIL9为L呃结果表明,突变区ABA诱导较强,JA没有降低,这与L呃.在可变区带有Bur等位基因的NIL5显示了两种植物激素的反应,这两种激素都与Bur相似:受感染植株的ABA增加较弱,JA减少(图)6).其特有的激素反应模式与L呃和NIL9,以及Bur和NIL5的低定殖率(图1a).没有效果erecta.ABA和JA水平诉longisporum-被感染的植物被发现时erecta./ WT对ABA和JA内容进行了比较(附加文件7).ABA和JA信号通路是控制系统定植的候选途径诉longisporum在答:芥.
讨论
在理解分子间的相互作用方面已经取得了相当大的进展诉longisporum与十字花科寄主的分子水平。许多基因和途径已被证明与此有关,显示出其巨大的复杂性。本研究旨在进一步解开这一复杂的遗传网络,并识别有助于定量抗性的遗传变异的新组分诉longisporum.
我们的研究结果证实了不同抗性性状是由不同途径控制的,并且可以独立遗传的观点。表现出高度定殖抗性的植物可能仍然易受发育不良的影响。没有单一的主机制控制QDR答:芥.然而,通过组合一些明确的QTL可以实现更高的电阻水平。阐明了抗性生理基础的一些组分。
定殖抗性和发育抗性的表型变异被分配到特定的QTL中,这些QTL之前已经部分检测到,但在RIL群体中以更高的分辨率进行了定位。vec1,vec2和vec3被发现控制了系统的殖民化诉longisporum来自同一亲本的F2/F3群体[8]并且可以在本研究中复制。RIL映射显示出高度复杂的复杂性vecQTL。多重的,可重复的LRS峰位表明有一个以上的基因参与了这种效应的复杂位点。隐藏在vecQTL目前还不清楚,但最近的研究结果强烈表明,参与苯丙素通路的基因可能是QTL的基础vec3[20.]:基因cad 5,cad 8和ugt84a3,编码肉桂醇脱氢酶和UDP-糖基转移酶,全部位于染色体4上靠近vec3.可溶性苯丙素已被证明在防御诉longisporum[20.].可以证明可能对抵抗的影响。植物上部的全身定植开始于开花的开始答:芥和芸苔属植物spp。8,9].诱导或促进开花的直接或间接信号可能影响植物的发育诉longisporum同样,例如,通过刺激可移动分生孢子的形成或指导真菌菌丝的生长。损失vec2和vec3利用发育作为协变量的QTL分析表明,即使所有植株处于相同的表型发育阶段,其生理基础上的发育差异仍足以引起这些QTL的检测。发育方面的影响也在发育迟缓中发挥了作用。4号染色体上的抗发育QTL,r-stre3,类似于vec2和vec3,当开发作为MQM映射中的协变量使用时就消失了。
染色体上的稳定抗性QTL 1(stre1.和stre2.4(r-stre3)依靠本赛季:他们在冬季仅受到震惊的影响,这与现有观察一致stre1.和stre2.[8].尽管温室互补灯光,但发展的发展答:芥冬季延长(试验1),发育差异更明显。由于夏季更多的自然光照,光强和/或质量的差异很可能引起这些反应。1号染色体上最强的QTL,stre2.,与Wakl9基因,编码壁相关激酶(Wak) - 麦克芹蛋白[50].一个候选人stre1.在染色体1的底部是RFO1.(Wakl22.),编码另一种类似wak的蛋白质,这种蛋白质已经被证明在wak中起作用诉longisporum电阻(16].自诉longisporum主要在Applast中与宿主植物相互作用[51],通过细胞壁相关蛋白对发病性相关分子的感知可能是至关重要的,并且已显示WAK蛋白来介导这种观察[52].有趣的是,一些瓦克已经显示出基因被SA诱导[53].SA诱导姿态基因尚未显示,但它将与在Bur中检测到的早期和强SA诱导很好地对应。SA水平的增加已经被观察到会导致生长迟缓,而且是没有疾病的[54].SA的发育不良效应已被证明在强光条件下可部分恢复[55].高水平的SA和光照差异的综合效应可以解释明显的轮枝菌属-诱导的发育不良stre1.和stre2.冬季毛叶起源等位基因。在Xylem Sap中也发现了高水平的Sa及其葡萄糖苷诉longisporum-已感染B. Napus.与发育不良程度和病原体DNA数量相关[23].发育不良是温室或生长室试验中常见的症状诉longisporum在莲座期已经发生,但在受感染的田间作物中从未见过。光照强度和质量是大田和温室的主要区别。这表明,诉longisporum在实验条件下,高SA水平与人工光照的结合也在一定程度上决定了发育不良的发生。
QTL控制氯化肌似乎受到控制发展基因的影响。在文献中报道了相反的[10:一个延缓抗性发育和介导抗性的QTL轮枝菌属诱导氯化,Vet1,已被确定在答:芥生态型C24。有趣的是,这R-CHL1.4号染色体上的QTL与Vet1.将若干基因的附近邻近在该地区进行过渡到开花(星期五,哭1/hy, det1, ted1)使对这些结果的解释复杂化。
在本研究中,erecta.已被证明是衰退阻力QTLr-stre1在2号染色体上,这解释了观察到的大部分性状变异。受体样激酶(RLKs)通常参与控制发育过程或介导疾病抗性反应[56].唯一的轮枝菌属目前已经鉴定出抗性基因,Ve1,亦属香港九龙文娱艺术区家族[57,58并已被证明能识别真菌效应物[59].富含亮氨酸重复受体样Ser/Thr激酶ERECTA是一个信号分子的例子,控制发育过程和QDR答:芥[49].erecta.突变体显示出器官发育的改变,导致紧凑的生长[32,60].细胞增殖[61]和气孔模式[62也被证明是由erecta..另外,据报告了几种电阻性状受到控制erecta.在不同的病理系统中:细菌病原体的生长Ralstonia solanacearum.被抑制,枯萎症状减轻答:芥植物有功能erecta.基因相比,erecta.突变体(63].坏死性真菌感染Plectosphaerella cucumerina导致更多的黄化和坏死erecta.与各自的WT加入相比较的突变[64].增强的易感性erecta.突变体,导致扩大的叶片病变,也被报道为卵菌感染腐霉属irregulare[65].这些结果说明了ERECTA、development和QDR之间的密切联系。因此,对于疾病抗性的改变是发育变化的结果还是ERECTA信号的直接影响,并不总是很清楚。研究ERECTA通路的其他信号成分可以阐明这个问题。植物有缺陷agb1.在形态上不同于erecta.突变体(31]但在相同的信号通路中缺陷。在本研究中,agb1-1变种人至少同样容易受到诉longisporum-诱导发育不良erecta.突变体。这支持了一种观点,即功能性的ERECTA途径减轻了发育不良的影响诉longisporum无关的感染与其对形态的影响。
对系统性定植的抵抗并没有因为功能性而增强erecta.与L呃.这是强有力的证据表明erecta.,虽然它位于vec1,不参与调解对系统性殖民化的抵抗诉longisporum.趋势较强的殖民化erecta.在中度敏感的Col-0背景中的突变体与WT相比,从来没有显著性差异,这被解释为是由于植物株高降低造成的间接影响erecta。诉longisporum可以更容易地伸出较短拍摄的顶点。这一观点是由长茎的事实证实agb1-1突变体殖民非常差,从而表现得非常不同erecta.突变体,尽管AGB1和Electa都在相同的信号通路中起作用。
总而言之,erecta.已被证明是一种自然遗传变异的数量抗性的来源,不仅仅是对诉longisporum.到目前为止,对等位变异的了解还不多erecta.超出功能完全丧失的水平及其在自然遗传中对疾病抵抗力的后果。全面分析erecta.因此,其结构和监管可变性及其在十字花植物植物中的同源物将是理想的。
ABA和JA的含量以基因型特异性的方式不同,并与真菌定殖速率相关。目前还不知道是否诉longisporum自身产生ABA,这可以解释在大量定殖的植物中ABA含量高的原因。在B. Napus.然而,诉longisporum侵染不增加木质部汁液中的ABA水平[23].在这两项研究中,取样并不完全具有可比性,因为取样的是茎的不同部分和茎中的样品B. Napus.都是在发育早期拍摄的。的结果B. Napus.使得不同的ABA水平更有可能取决于宿主基因型而不是真菌生物量。
ABA信号转导的作用诉longisporum电阻是复杂的。的ABA-deficientaba2-1突变体非常敏感诉longisporum-诱导的发育迟缓,但其他ABA信号突变体未受影响,这表明在观察到的反应中涉及到ABA2的一种特殊功能,一般情况下不需要ABA [16].从ABA在发育和疾病中的许多功能,可以假设不同的影响轮枝菌属疾病。ABA已被证明以各种方式影响植物防御反应[66].在大多数情况下,ABA由于抑制SA的合成而增加了对病原体的敏感性[67]和/或茉莉酸-乙烯信号的拮抗[68].然而,ABA也可以刺激JA的生物合成,增加抗性[65].ABA在种子发育过程中具有重要作用,如在细胞增大过程中触发储存分子的获取[69].ABA在诱导衰老中起重要作用[70].主要的影响诉longisporum在B. Napus.在田间是早熟的诱导,这可以通过褪绿的茎识别,这导致种子变小。ABA水平的增加可能支持移动养分的偏差,以促进真菌生物量的增长。此外,有可能堵塞的血管后诉longisporum-侵染导致ABA水平升高,这是干旱胁迫的结果。然而,最近的研究表明诉longisporum感染甚至可以增加寄主的耐旱性作为结果新创木质部的形成(29].研究敏感和抗性基因型木质部转分化可以明确木质部形成与抗性的关系。
感染后JA含量下降诉longisporum和含有Bur等位基因的NILvec1.Plant-pathogenic轮枝菌属种被认为是在感染后期具有坏死营养阶段的半生物营养体。对坏死营养病原体的防御反应通常由JA诱导[71].因此,缺乏ja的番茄植株更容易受到黄萎病dahliae多于野生植物[72].然而,在本研究中,抗定殖生态型Bur在感染后JA水平下降。因为JA也参与了答:芥叶衰老(73],诉longisporum可能受益于JA和ABA诱导的衰老过程,这将提示用真菌刺激激素生产。衰老样方法的改变也被假设到下降的增加的抗性答:芥JA-受体突变体coi1对诉longisporum殖民化[24];但是,这种疾病促进效果COI1.已被证明是无关的。这些结果证明,通过串扰的植物激素信号传导途径进行微调反应是每个疾病系统的高度个体[74].此外,还应考虑病原菌可能为了自身利益而操纵宿主的激素状态。
结论
植物激素的信号传递过程已经被证明是受等位基因变异的影响,并在QDR的基础上诉longisporum在自然答:芥加入。已显示Edecta,SA,ABA和JA信令调解生态型特定响应答:芥来诉longisporum感染。ABA和JA含量的生态型特异性差异是由2号染色体上相同的基因组区域介导的,该区域也控制着系统定殖诉longisporum.该区域包含控制系统定殖的主要QTL,vec1,也erecta..殖民化抵抗被证明是独立于erecta.,该地区应含有控制真菌定植程度的其他基因。这种类型的抗性可能取决于ABA和JA信号,因为两种含量与这些激素含量不同,以与促进多态区域中各等位基因的父母线相同的方式。持续研究差异基因表达取决于vec1应该让人们对导致殖民抵抗的防御反应有一个更全面的了解。此外,通过结合QTL区段的图位限制和表达分析,克隆控制该反应的基因是可行的。结果表明,不同的抗性性状在生理上是相互独立控制的,但在遗传上仍然是相互联系的。了解表型变异的生物学基础答:芥关于诉longisporum抗性将为十字花科作物实现持久抗性提供新的途径。
参考文献
- 1.
Poland Ja,Balint-Kurti PJ,Wisser RJ,普尔顿州普尔顿RJ:灰色浅蓝色:抗性抗病症的世界。趋势植物SCI。2008,14:21-29。
- 2.
St.clair D:育种中定量抗病和定量抗性基因座。Annu Rev phytopathol。2010,48:247-268。10.1146 / annurev-phyto-080508-081904。
- 3.
Inderbitzin P, Davis R, Bostock R, Subbarao K:子囊菌黄萎病longisporum是一种杂种植物病原体,寄主范围扩大。公共科学图书馆。2011,6:e18260-10.1371/journal. pon. 0018260。
- 4.
Dixelius C,Happstadius I,Berg G:Verticillium Wilt上芸苔属植物油料作物——瑞典人的观点。植物营养与肥料学报,2005,22(6):741 - 746。
- 5.
Dunker S,KeuneCke H,Steinbach P,Von Tiedemann A:影响黄萎病longisporum冬油菜产量和形态的研究(芸苔栗鸟)与植物中的系统蔓延有关。J植物疗法。2008,156:698-707。10.1111 / J.1439-0434.2008.01429.x。
- 6.
Gladers P:Verticillium Wilt的相关性(黄萎病longisporum)英国冬季的油菜籽。hga Research Rev. 2009, 72: 1-39。
- 7.
Krüger: Untersuchungen zur Verbreitung von黄萎病dahliaekleb。und anderen krankheits- und Schaderregern Bei Raps在der Bundesrepullik deutschland。Nachrichtenbl Deutsch Pflanzenschutzd。1989,41:49-56。
- 8.
E . Häffner, E . Karlovsky, E . Diederichsen:遗传和环境控制轮枝菌属综合征拟南芥.BMC植物BIOL。2010,10:235-10.1186 / 1471-2229-10-235。
- 9.
周玲,胡强,约翰逊A,迪克西利乌斯C:黄萎病longisporum和诉dahliae:感染和疾病芸苔栗鸟.植物病理学杂志。2006,55:137-144。10.1111 / j.1365-3059.2005.01311.x。
- 10.
Veronese P, Narasimhan ML, Stevenson RA, Zhu J-K, Weller SC, Subbarao KV, Bressan RA:基因座控制的鉴定轮枝菌属疾病症状反应拟南芥.植物学报,2003,35:574-587。10.1046 / j.1365 - 313 x.2003.01830.x。
- 11.
Johansson A,Goud J-KC,Dixelius C:工厂主机范围黄萎病longisporum瑞典土壤微菌核密度。acta botanica sinica(云南植物学报),2006,34(4):457 - 461。10.1007 / s10658 - 005 - 2333 - 2。
- 12.
王志强,王志强,王志强,等:花椰菜对不同抗性品种的抗性鉴定黄萎病longisporum使用不同的接种方法。植物病虫害学报,2005,29(6):531 - 534。10.1111 / j.1439-0434.2005.00965.x。
- 13.
B, Dixelius C:鉴定芸苔属植物oleracea黄萎病抗性改良种质。植物育种。2003,122:30-34。10.1046 / j.1439-0523.2003.00774.x。
- 14.
Rygulla W, Snowdon RJ, Eynck C, Koopmann B, Tiedemann A, Lühs W, Friedt W:拓宽遗传基础黄萎病longisporum抵抗芸苔栗鸟通过种间杂交。植物病理学杂志。2007,19(4):491 - 497。10.1094 /发朵- 97 - 11 - 1391。
- 15.
陈东:水稻抗病性的数量性状位点鉴定黄萎病longisporum在油菜籽(芸苔栗鸟).植物病理学杂志,2008,29(4):457 - 461。10.1094 /发朵- 98 - 2 - 0215。
- 16.
Johansson A, Staal J, Dixelius C:早期的回应拟南芥-黄萎病longisporum病理系统依赖于NDR1, JA-和et相关信号通过胞质NPR1和RFO1。植物营养与肥料学报,2006,19:958-969。10.1094 / mpmi - 19 - 0958。
- 17.
Steventon La,Okori P,Dixelius C:调查易感性拟南芥分离两种物种轮枝菌属.acta botanica sinica(云南植物研究),2001,31(4):531 - 534。10.1046 / j.1439-0434.2001.00643.x。
- 18.
Eynck C, Koopmann B, Karlovsky P, von Tiedemann黄萎病longisporum.植物病理学杂志,2009,33(4):513 - 514。10.1094 /发朵- 99 7 - 0802。
- 19.
Obermeier C, Hossain M, Snowdon R, Knüfer J, von Tiedemann A, Friedt W:与抗性相关的苯丙类代谢产物的遗传分析黄萎病longisporum在芸苔栗鸟.生物学报。2013,31:347-361。10.1007 / s11032 - 012 - 9794 - 8。
- 20。
Königs,Feussner K,Kaever A,Landesfeind M,Thurow C,Karlovsky P,Gatz C,Polle A,Feussner I:可溶性苯丙醇蛋白参与拟南芥的防御反应黄萎病longisporum.2014年新植醇。http://onlinelibrary.wiley.com/doi/10.1111/nph.12709/full,
- 21。
Diener AC, Ausubel FM:对镰刀菌1的抗性是一个显性的拟南芥抗病基因,不是小种特异性的。中国生物医学工程学报。10.1534 / genetics.105.042218。
- 22。
Pantelides IS, Tjamos SE, Paplomatas EJ:乙烯感知ETR1需要在拟南芥感染黄萎病dahliae.植物营养学报。2010,11:191-202。10.1111 / j.1364-3703.2009.00592.x。
- 23。
杨志强,李志强,李志强,等。木质部液中水杨酸和水杨酸苷的含量及其与木质部液中水杨酸的关系芸苔栗鸟感染了黄萎病longisporum.植物保护学报,2009,33(4):531 - 534。10.1007 / s10265 - 009 - 0237 - 5。
- 24。
Ralhan A,SchöttleS,Thurow C,Oive T,Feussner I,Polle A,Gatz C:血管病原体黄萎病longisporum需要茉莉酸无关的COI1功能,以引发拟南芥射击疾病症状。植物理性。2012,159:1192-1203。10.1104 / pp.112.198598。
- 25。
在拟南芥中,色氨酸衍生的次生代谢物的转录激活和生产有助于抵抗真菌维管病原体黄萎病longisporum.植物学报。2012,5:1389-1402。10.1093 / mp / sss044。
- 26。
Singh S,Braus-Stomeyer S,Timpner C,Valerius O,Von Tiedemann A,Karlovsky P,Druebert C,纸杆A,Braus G:植物主持人芸苔栗鸟在病原体中诱导黄萎病longisporum功能性过氧化氢酶过氧化物酶的表达,这是疾病晚期所必需的。植物营养与肥料学报,2012,29(6):759 - 762。10.1094 / mpmi - 08 - 11 - 0217。
- 27。
yadea K, Hanemian M, Smit P, Hiemstra J, Pereira A, Marco Y, Thomma BP: The拟南芥dna结合蛋白AHL19介导黄萎病抗性。植物营养与肥料学报,2011,24(4):591 - 598。10.1094 / mpmi - 04 - 11 - 0090。
- 28。
油菜质外体蛋白组的防御反应(芸苔栗鸟var。n)减弱黄萎病longisporum生长但不是疾病症状。BMC植物BIOL。2008,8:129-10.1186 / 1471-2229-8-129。
- 29。
Reusche M, Thole K, Janz D, Truskina J, Rindfleisch S, Drübert C, Polle A, Lipka V, Teichmann T:轮枝菌属感染触发血管相关的NAC Domain7-依赖De Novo Xylem形成并增强耐旱性拟南芥.acta botanica sinica, 2017, 36(4): 497 - 503。10.1105 / tpc.112.103374。
- 30.
Kranz AR,Kirchheim B:遗传资源拟南芥.Arabidopsis通知服务新闻。1985年,24:1-368。
- 31.
Lease Ka,Wen J,Li J,Doke JT,Liscurn E,Walker JC:一个突变体拟南芥异质性g蛋白β亚基影响叶、花和果实的发育。acta botanica sinica(云南植物学报). 2001,13(4):457 - 461。
- 32.
Torii KU, Mitsukawa N, Oosumi T, Matsuura Y, Yokoyama R, Whittier RF, Komeda Y:日本拟南芥erecta基因编码一个假定的受体蛋白激酶与细胞外富含亮氨酸重复。植物学报。1996,8:735-746。
- 33.
黄志强,王志强,王志强,等黄萎病dahliae和---关联黄萎病longisporum.植物病虫害学报,2002,21(4):429 - 434。10.1046 / j.1439-0434.2002.00730.x。
- 34.
拟南芥信息资源(TAIR)。[http://www.arabidopsis.org]
- 35.
O 'Neill CM, Morgan C, Kirby J, Tschoep H, Deng PX, Brennan M, Rosas U, Fraser F, Hall C, Gill S, Bancroft I: 6个重组自交系的数量性状研究拟南芥.Al Appl Genet。2008,116:623-634。10.1007 / s00122-007-0696-9。
- 36.
wthmann N, Fitz J, Weigel D: MSQT用于从多个DNA比对中选择SNP检测。生物信息学。2007,23:2784-2787。10.1093 /生物信息学/ btm428。
- 37.
Nordborg M,胡锦涛TT, Ishino Y,雅J, Toomajian C,郑H,赞美上帝E,花茎甘蓝P,格莱斯顿J, Goyal R, Jakobsson M,金正日年代,Morozov Y, Padhukasahasram B,与V,罗森博格NA,沙C,墙JD,王J, K, Kalbfleisch T,舒尔茨V, Kreitman M, Bergelson J:多态性的模式拟南芥.公共科学图书馆,2005,3:1289-1299。
- 38.
奥塞兹基S,Schneeberger K,Clark RM,Lanz C,Warthmann N,Weigel D:测序自然菌株拟南芥较短的读取。基因组学报。2008,18:2024-2033。10.1101 / gr.080200.108。
- 39.
Webcutter 2.0。[http://rna.lundberg.gu.se/cutter2/]
- 40.
Brandfass C,Karlovsky P:基于CTAB的DNA提取和实时PCR测定Fusarium Culmorum.和f . graminearum在植物材料中的DNA,减少取样误差。国家自然科学基金,2008 - 01。10.3390 / ijms9112306。
- 41.
Splivallo R,Fischer U,Gobel C,Feussner I,Karlovsky P:松露通过生产养肝和乙烯生产植物根部形态发生。植物理性。2009年,150:2018-2029。10.1104 / pp.109.141325。
- 42.
Van Ooijen J,Voorrips R:JoinMap 4.0版:用于计算遗传联系地图的软件。Wagieningen,荷兰:植物研究2008年。
- 43。
Manly KF, Cudmore RH, Meer JM: Map Manager QTX,用于基因图谱绘制的跨平台软件。《哺乳动物基因组》,2001,12:930-932。10.1007 / s00335 - 001 - 1016 - 3。
- 44。
作物改良中的标记、数量性状位点(QTL)定位和标记辅助选择:基本概念。中国科学:地球科学。10.1007 / s10681 - 005 - 1681 - 5。
- 45。
van Ooijen J: MapQTL R 6,用于绘制二倍体物种实验居群数量性状位点的软件。编辑:Kyazma BV。荷兰:瓦赫宁根,2009。
- 46。
voorrips re:mapchart 2.2。[http://www.wageningenur.nl/en/show/Mapchart.htm]
- 47。
IBM公司:SPSS统计纽约阿蒙克:IBM公司2011。
- 48。
拟南芥基因组倡议(AGI):分析开花植物的基因组序列拟南芥.自然科学。2000,408:796-815。10.1038 / 35048692。
- 49。
van Zanten M, Snoek LB, Proveniers MCG, pepeters AJM: ERECTA的许多功能。植物科学进展。2009,14:214-218。10.1016 / j.tplants.2009.01.010。
- 50。
Verica Ja,He Z-H:细胞壁相关激酶(Wak)和Wak样激酶基因家族。植物理性。2002,129:455-459。10.1104 / pp.011028。
- 51。
Floerl S, Majcherczyk A, Possienke M, Feussner K, Tappe H, Gatz C, Feussner I, Kües U, Polle A:黄萎病longisporum影响叶质外体蛋白质组、代谢组和细胞壁特性拟南芥.公共科学图书馆。2012,7:e31435-10.1371/journal. pon. 0031435。
- 52.
Brutus A,Sicilia F,Macone A,Cervone F,Delorenzo G:域交换方法揭示了植物壁相关激酶1(Wak1)作为Oligogalactulonides的受体的作用。PROC NATL ACAD SCI。2010,107:9452-9457。10.1073 / PNA.1000675107。
- 53.
He Z-H, Cheeseman I, He D, Kohorn BD:一组5个壁相关受体激酶基因,瓦克1-5,表达在特定的器官中拟南芥.植物营养与肥料学报。1999,39(3):489 - 498。10.1023 /: 1006197318246。
- 54.
水杨酸在植物生长发育中的作用。实验机器人。2011,62:3321-3338。10.1093 / jxb / err031。
- 55.
Mateo A, Funck D, Mühlenbock P, Kular B, Mullineaux PM, Karpinski S:控制水杨酸水平是最佳光合作用和氧化还原稳态所必需的。中国生物医学工程学报,2006,27(6):591 - 598。10.1093 / jxb / erj196。
- 56.
Shiu Sh,Bleecker Ab:植物受体样激酶基因家族:多样性,功能和信号。sci stke。2001,113:Re22-
- 57.
黄萎病抗性的遗传分析[J] .浙江农业学报,2017,29(4):429 - 434。植物生理学报。2009,30(4):591 - 598。10.1104 / pp.109.136762。
- 58.
Kawchuk LM,Hachey J,Lynch Dr,Kuksar F,Van Rooijen G,Water Cr,Robertson A,Kokko E,Byers R,Howard RJ,Fischer R,PrüferJ:番茄ve抗病基因编码细胞表面样受体。中国科学(d辑:地球科学),2001,19(6):591 - 598。10.1073 / pnas.091114198。
- 59.
de Jonge R, van Esse HP, Maruthachalam K, Bolton MD, Santhanam P, Saber MK, Zhang Z, Usami T, Lievens B, Subbarao KV, Thomma BP:番茄免疫受体Ve1识别基因组和RNA测序发现的多种真菌病原体的效应体。中国科学(d辑:地球科学),2012,32(6):591 - 598。10.1073 / pnas.1119623109。
- 60.
Rédeig:拟南芥的超级突变体。遗传学。1962,47:443-460。
- 61.
三种erecta家族受体样激酶的协同作用拟南芥通过促进细胞增殖的器官生长和花卉开发。发展。2004,131:1491-1501。10.1242 / dev.01028。
- 62.
王志强,王志强,王志强,等:受体激酶协同作用下的气孔模式和分化。中国科学:地球科学。10.1126 / science.1109710。
- 63.
Godiard L,Sauviac L,Torii Ku,Grenon O,Mangin B,Grimsley NH,Marco Y:Eerecta,LRR受体样激酶蛋白控制发育的抗性影响细菌枯萎病。工厂J. 2003,66:353-365。10.1046 / J.1365-313x.2003.01877.x。
- 64.
Llorente F, Alonso-Blanco C, Sánchez-Rodriguez C, Jorda L, Molina A: ERECTA receptor-like kinase and heteroomeric G protein from拟南芥对坏死性真菌的抗性是必需的Plectosphaerella cucumerina.植物学报,2005,43:165-180。10.1111 / j.1365 - 313 x.2005.02440.x。
- 65.
Adie B,Pérez-PérezJ,Pérez-PérezM,Godoy M,Sánchez-Serrano J-J-J,Schmelz E,Solano R:ABA是对影响JA生物合成的病原体的植物抵抗力和防御激活的必要信号拟南芥.植物细胞。2007,19:1665-1681。10.1105 / TPC.106.048041。
- 66.
引用本文:王志强,王志强,王志强。ABA对植物病原防御的调控作用。植物营养与肥料学报,2008,21(4):429 - 434。10.1094 / mpmi - 21 - 6 - 0709。
- 67.
摘要:脱落酸测定番茄的基本易感性葡萄孢菌并抑制水杨酸依赖的信号机制。植物营养与肥料学报。2002,28(4):491- 498。10.1104 / pp.010605。
- 68。
Anderson JP,Badruzsaufari E,Schenk PM,Anyners JM,Desmond OJ,Ehlert C,Maclane DJ,Ebert Pr,Kazan K:脱离酸和己酸酯 - 乙烯信号通路之间的拮抗相互作用调节防御基因表达和抗病性拟南芥.植物细胞。2004,16:3460-3479。10.1105 / TPC.104.025833。
- 69。
ABA和糖的相互作用调节发育:人群中的相声或声音?植物生态学报。2001,5:26-32。10.1016 / s1367 - 5931(00) 00167 - 8。
- 70.
瑞吉,景河,邓·赫尔·赫尔·苏格尔·斯旺普尔(Dijkwel PP):叶片衰老的发育和激素控制。植物中的衰老过程。由:Gan S. 2007,牛津英国:Blackwell Publishing,145-170。
- 71.
Glazebrook J:对比生物营养和坏死营养病原体的防御机制。植物病理学杂志。2005,43:205-227。10.1146 / annurev.phyto.43.040204.135923。
- 72。
在植物对不同生活方式的不同病原体的敏感性中,茉莉酸反应的作用。植物营养与肥料学报。2004,29(4):531 - 534。10.1104 / pp.104.041566。
- 73。
何玉华,何玉华,何玉华。茉莉酸在拟南芥叶片衰老过程中的作用。植物生理学报。2002,28(6):876-884。10.1104 / pp.010843。
- 74。
植物免疫的小分子激素网络研究。生物化学学报。2009,5:308-316。10.1038 / nchembio.164。
致谢
我们非常感谢德国德国德国德国·布隆斯的金融支持(DFG)(DI1501 / 1-1,DI 1502 / 3-1和KA 1209 / 8-1赠款)和Norddeutsche Pflanzenzucht(NPZ),德国。我们感谢ThomasSchmülling托管和支持这个项目,并感谢Claudia Delbrofer,Katharina Fraunhofer,AnikaKrüger,Christiane Manthey,以及Heike Rollwage,提供了优秀的技术支持。Karen Zeise,德国柏林,德国康复地承认提供真菌菌株。
作者信息
隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称没有相互竞争的利益。
作者的贡献
EH策划了所有的植物实验,监督了实验3,进行了所有其他的植物实验,分析了数据,起草了手稿。PK提供了真菌生物量的qPCR数据,并帮助起草了手稿。RS提供了植物激素含量的所有数据,并帮助手稿的起草。AT进行了实验3,收集数据并帮助他们进行分析。ED参与了本研究的构思、设计和协调,参与了QTL分析,并帮助起草了论文手稿。所有作者阅读并批准了最终的手稿。
电子辅料
标记信息。
附加文件1:列出所有用于基因分型的标记(Bur×L呃瑞来斯的人口。它由两个表组成。表S1是所有使用的标记,它们的类型,染色体位置和它们的来源的概述。在表S2,列出所有新标记的技术信息。这包括引物信息、引物熔化温度、多态性信息和PCR方案。(PDF 21 KB)
遗传和物理地图。
附加文件2:显示遗传地图和(Bur×L的物理图)呃瑞来斯的人口。遗传图显示CM中所有染色体的标记距离,物理图显示根据AGI地图的千碱基(KB)中标记的位置[48].(PDF 530 KB)
QTL信息。
附加文件3:列出了在本研究中检测到的所有QTL (Bur×L呃)在两个单独的实验中的rils。在表中列出了对具有不同参数检测到的胰腺炎的QTL全身定植,静置抗性和对氯中衰退的抗性。为每个QTL给出了染色体位置,LRS峰值位置,LOD评分,添加剂组分,说明的特征方差和等位基因手段。(PDF 61 KB)
表型数据的频率分布。
附加文件4:显示QTL定位中使用的表型数据的频率分布直方图。柱状图显示的参数“%殖民拍摄片段”,“pg轮枝菌属“DNA/mg鲜重”、“表现高度”、“平均黄叶数”诉longisporum- 植物的植物“,”与总玫瑰花叶数有关的黄色叶片的平均数量“,与接种和拟型植物的黄色叶片的平均差异”。(PDF 76 KB)
系统殖民化
额外的文件5:erecta.信号突变体和相应的wt系。包含一个条形图可视化的系统殖民化erecta.突变体,agb1-1突变体和相应的WT基因型。它提供了证据erecta.不参与介导对系统定植的抗性诉longisporum.(PDF 214 KB)
sa内容在bur,l
附加文件6:呃和nils。包含一个条形图,在Bur, L中显示SA的内容呃和两个不同的NILsvec1地区。数据提供了证据表明,SA超导,即BAR的特征,与BAR的特征无关vec1轨迹。(PDF 329 KB)
作者为图像提交的原始文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上不受限制地使用、分发和复制,但须注明原作的出处。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Häffner, E., Karlovsky, P., Splivallo, R.。et al。直立树、水杨酸、脱落酸和茉莉酸调节抗病数量拟南芥来黄萎病longisporum.BMC植物杂志14日,85(2014)。https://doi.org/10.1186/1471-2229-14-85
收到了:
接受:
发表:
关键字
- 拟南芥
- 黄萎病longisporum
- 版的《四年防务评估》
- RIL.
- 零
- QTL.
- erecta.
- 阿坝
- 晶澳
- SA