摘要
背景
热带植物Ficus microcarpa.l . f .简历。金叶(GL)是一种高光敏感的热带无花果树,太阳叶是黄色和遮阳叶是绿色的。我们将光合活动的响应与GL及其野生型强光进行了比较到强光(WT,Ficus microcarpa.l f)。
结果
最大光系统II (PSII)效率的野外测量(Fv/F米),表明光合活性在白天受到严重的光抑制(Fv/F米= 0.46),并于当晚恢复(Fv/F米= 0.76)。相比之下,WT没有显示出任何实质性的变化Fv/F米值(在0.82和0.78之间)。CO的光依赖性2GL的离体遮荫叶同化速率与野生型相似,表明两者的光合性能没有显著差异。光抑制的几个指标,包括PSII反应中心蛋白(D1)含量下降,Fv/F米价值,阿2进化和有限公司2结果表明,GL比WT更容易受到光抑制一个荧光显示GL的非光化学猝灭能力低于WT。
结论
我们认为GL的光合机构比WT的光合机构更容易受到光抑制。
背景
叶片暴露在强光下有时会导致光合效率降低,这种现象称为光抑制[1- - - - - -3.].植物对光抑制的敏感性取决于物种和生长的光环境[4].通常,遮阳植物或低光生长的植物比太阳植物或高光生长的植物更容易易受光燃烧的植物[4].由于光抑制有可能降低生产力和植物生长,避免光抑制对植物在自然生境中的适应和生存至关重要[2,5,6].
目前,人们普遍认为,光抑制机制中涉及到由光照产生的有害活性氧[7].Singlet-excited氧(1O2)可以通过o的相互作用产生2与三重激发叶绿素(3.在PSII反应中心形成[8].超氧化物自由基(O2-)是由梅勒反应通过电子转移到O而不可避免地产生的2在光系统i2-导致过氧化氢(H2O2)和H2O2过渡金属离子生成羟基自由基(•OH),羟基自由基是ROS中活性最强的自由基[7].这些ROS可以氧化叶绿体中的分子,包括PSII反应中心的D1蛋白[9和卡尔文-本森循环中的硫醇酶[10,11抑制光合作用的部分反应,最终导致光抑制。最近,ROS也被证明通过抑制光抑制新创PSII D1蛋白的合成对从光抑制中恢复至关重要[12].
为了保护光合机制免受ros介导的光抑制,叶绿体在20 ~ 300mm的基质中含有大量的抗坏血酸[13].在基质中,抗坏血酸酯有助于抑制光推率-H的积累2O2通过充当抗坏血酸过氧化物酶(APX)的电子供体来解毒H2O2到H2O (14].抗坏血鬼也可以参与解毒1O2阿,2-•通过非酶还原OH [13].在这些反应中,抗坏血酸被一价氧化成单脱氢抗坏血酸(MDA)。为了维持叶绿体中抗坏血酸的浓度,在光照下,MDA应迅速再生为抗坏血酸。在单脱氢抗坏血酸还原酶(MDAR)催化下,NAD(P)H可将MDA还原为抗坏血酸[15]或直接通过还原的铁氧还蛋白[16].MDA,一种有机自由基,可以在没有MDA的情况下在没有MDA的情况下产生抗坏血酸和脱氢血吸收剂(DHA)。谷胱甘肽可以通过以慢速速率或酶反应以更高的速率进行谷胱甘肽来减少[17].脱氢抗坏血酸还原酶(DHAR, EC 1.8.5.1)被认为参与了叶绿体中DHA的酶还原[17].然而,直到现在,还是直接的在活的有机体内目前还没有证据表明DHAR的生理意义。
我们之前报道过树叶Ficus microcarpa.l . f .简历。金叶(GL),一种热带无花果树,缺乏耐热DHAR活性[18].在GL,冠层太阳叶,总是暴露在阳光下,显示出特色黄色,而那些野生型(WT,Ficus microcarpa.即使在阳光直射下也会呈现正常的绿色。GL产生黄叶的机制尚不清楚。在大麦中,有报道说叶片与CO一起培养2-富集的空气由于光合作用受到光抑制而呈现黄色[19,20.,这一现象显然与GL中观察到的现象相似。我们假设GL具有不完全的光合作用机制,易受光抑制。本研究的目的是直接检验假设。本研究中显示的并排比较表明,GL比WT更容易受到光合作用的光抑制。
结果
光抑制作用
GL是热带无花果树的一个品种Ficus microcarpa.原产于亚洲和大洋洲的亚热带/热带地区。GL的一个显著特征是它的黄叶含有大量的类黄酮,而叶绿素和类胡萝卜素的含量则可以忽略不计[21].黄叶中光合色素含量的降低可以通过遮光来增加。因此,在遮荫条件下,GL呈现出正常的绿叶,在形态上无法与WT的叶子区分开来(图。1).我们认为GL对光抑制的高度敏感性可以解释这一现象[21].然而,没有直接证据表明GL对光抑制的敏感性。
数字2显示最高公共服务一级效率的日变化(Fv/F米)在田野里生长从树冠上收集的太阳叶片。GL(黄色)太阳叶片叶绿素含量为0.05 g m-2WT(绿色)为0.44 g m-2.GL和WT之间没有显着差异Fv/F米清晨(早上6点)测量的值。的价值Fv/F米血糖由上午6时的0.77下降至下午2时的0.46,随后恢复至晚上6时的0.74。与GL相比,Fv/F米WT的值在一天中几乎是恒定的。采自树内的GL(绿色)遮荫叶,其叶绿素含量无明显下降Fv/F米值(未显示数据)。这些在野外条件下获得的数据表明,GL对强光非常敏感。
光合性能
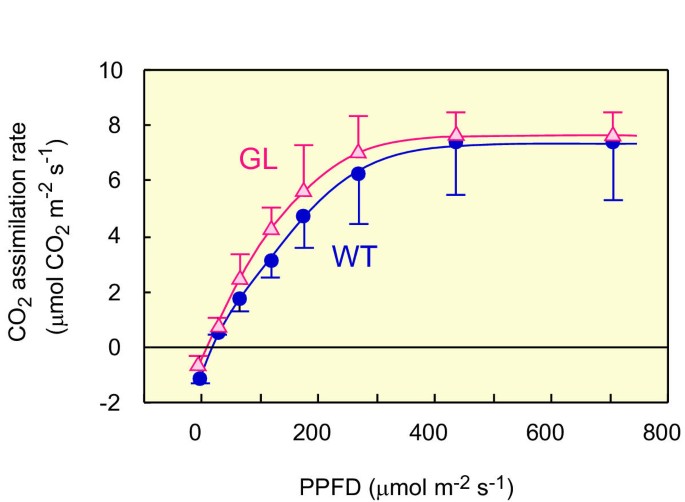
我们比较了GL和WT的光合性能,确认GL的基本光合机制是正常的。GL和WT的阴叶都是绿色的,用于这个目的。数字3.显示了CO的光响应曲线2离体遮荫叶同化速率(以表面积计算)。GL(绿色)遮荫叶片的叶绿素含量为0.58 g Chl m-2WT(绿色)为0.70 g Chl m-2.GL与WT的光响应曲线非常相似,CO的最大活性没有显著差异2它们之间的同化。这些结果清楚地表明,GL的光合能力与WT几乎相同,表明GL的光合机制在功能上没有缺陷。
金叶遮荫叶的光抑制
数字4表明强光对几种光抑制指标的影响:D1蛋白含量、Fv/F米啊,值2演化速率和CO2同化率。在高光照射前,WT和GL遮荫叶D1蛋白含量在蛋白质基础上没有显著差异(图2)。4A),Fv/F米值(图。4C).GL表现为D1蛋白含量显著降低Fv/F米在高光照明下的值(图。4, 4 b, c).与PSII活性指标类似,净光合活性指标(即O2进化和有限公司2同化率)在强光照射下也降低(图。4 d, e).与GL中观察到的这些反应相反,WT仅显示D1蛋白含量略有下降Fv/F米值(图。4, 4 b, c).O.2进化和有限公司2WT的同化率即使在强光条件下也没有变化(图)。4 d, e).
强光诱导的GL光抑制由几个参数评估。遮荫叶片在2300 μmol m-2年代-1中光(1000 μmol m .-2年代-1)。示意图显示了光合作用的轮廓,包括类囊体膜中的电子传递过程。填满圆圈的字母(A-D),与面板A-D对应,代表照片合成参数可以测量的位置。一个,叶提取物中含有的D1蛋白的免疫印迹。B,退化的在活的有机体内强光诱导D1蛋白。每个点用凝胶上的相对密度绘制,如图a所示。C,的衰落Fv/F米由标签。注意,所显示的时间表示总照明时间。D,强光对O2从完整的离体叶片进化而来。戊强光对CO活性的抑制2完整离体叶的同化作用。在不同的叶子(a, B, D)或叶子(C, E)中分别测量点。(•,蓝色),WT;(红色),ΔGL。
降低了金叶的NPQ能力
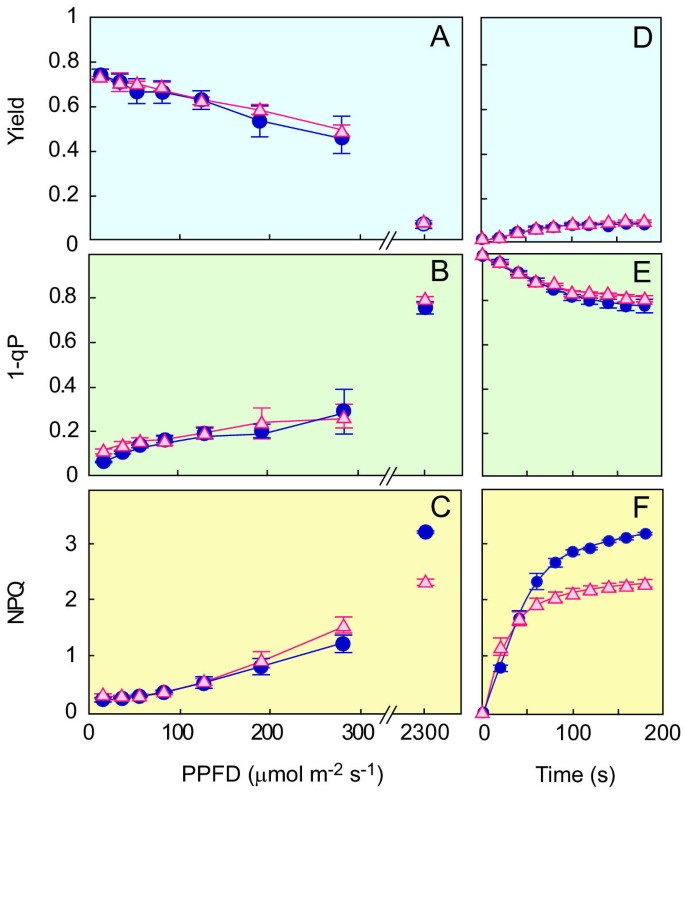
当植物暴露在超过光合作用能力的强光下时,过量吸收的光能可以安全地以热的形式消散[22].这种能量耗散可以用PAM叶绿素的NPQ来测量一个荧光分析。NPQ包括作为热量耗散指标的PSII的量子产额、PSII的光失活以及由于状态转变导致的光子在PSII和PSI之间的接受分布。已知,态转变可由Q的氧化还原态控制一个[23,可以用1-qP来测量。数字5表明,GL和WT的产量和1-QP值之间没有显着差异。此外,电子传输速率(ETR)的测量结果表明,GL和WT之间PSII光灭绝的灵敏度没有差异(数据未示出)。然而,与WT相比,GL显示出较低水平的NPQ(图。5 c, 5 f).这些结果表明,GL的低NPQ可能与散热机制的功能障碍有关。
讨论
本研究表明,在强光条件下,GL的光合活性对光抑制非常敏感。2,4).在700 μmol m以下,GL和WT的光合效率基本没有差异-2年代-1(图。3.),但在2300 μmol m时GL的NPQ低于WT-2年代-1(图。5 c, 5 f).据报道npq1突变体拟南芥表现出对光抑制的敏感性增加,但在短期光合作用中不受影响2进化和有限公司2同化(24,25].对于NPQ的操作,已知PSII的光收获络合物中的特殊Xhortophyll颜料具有关键角色[26].植物中NPQ的程度与玉米黄质和蒽黄质水平密切相关,玉米黄质和蒽黄质是由紫黄质通过位于类囊体膜腔侧的紫黄质深氧化酶(VDE)形成的[22].在过度光照条件下,当类囊体腔内酸化达到临界阈值时,VDE被激活并通过蒽黄质将紫黄质转化为玉米黄质[27].VDE的活性也受腔内抗坏血酸盐浓度的调节,因为VDE只能利用抗坏血酸盐作为还原剂[28].已有研究表明,抗坏血酸盐可用性的降低严重影响VDE活性在活的有机体内[28].由于类囊体膜对抗坏血酸没有任何主动转运机制,基质中抗坏血酸的浓度通过被动扩散机制决定了腔内的转运[29].在拟南芥,它已经清楚地证明了NPQ性能在活的有机体内通过引起抗坏血酸缺乏的突变减少[13].我们以前报道过,在田间条件下,GL的抗坏血酸含量在白天有几次下降[30.].因此,有理由认为抗坏血酸含量的降低可能是GL中NPQ功能障碍的原因之一。
在抗氧化酶中,我们已经证明GL缺乏热稳定性DHAR活性[18].植物细胞具有几种具有DHAR活性的酶:硫氧还蛋白[31.], glutaredoxin [32.]和二硫异构酶[33.].最近,两种不同的叶绿体蛋白质从菠菜中分离出Dhar活性;一个是Kunitz-Type胰蛋白酶抑制剂[31.],另一种是特定的DHAR [34.].因为两种叶绿体DHAR比非叶绿体DHAR表现出更高的热稳定活性[31.,34.]但是,虽然不可用分子信息,GL可能缺乏叶片Dhar(s)。事实上,在不含叶绿体的非水果的非水性器官中不能检测热稳定的活性,不包括叶绿体[18].虽然叶绿体DHAR(s)被认为在抗坏血酸再生系统中起作用,以维持叶绿体中的抗坏血酸浓度[7], DHAR在叶绿体中的生理意义仍有争议[35.- - - - - -38.].由于基质MDAR的活性很高,因此在MDA与DHA和抗坏血酸盐的自发性歧化可能不会发生在活的有机体内的情况。因此,有一种观点认为DHAR可能是抗坏血酸-谷胱甘肽循环中不可缺少的,以保护叶绿体免受强光胁迫[36.].然而,在叶绿体中存在另一个位置,其中基质酶不能直接再生抗坏血酸,即腔空间。
在腔内,抗坏血酸被叶黄素、α-tochopherol和PSII氧化产生DHA,所有这些反应在强光条件下都能促进[13,35.].因此,基质DHAR对于减少腔侧DHA的产生至关重要。在这种情况下,叶绿体DHAR在光保护机制中必须是不可或缺的,特别是当叶片暴露在强光胁迫条件下。这与之前的报道一致A. Thaliana.在强光条件下增加[39.].因此,我们认为,由于缺乏DHAR活性,我们认为GL的抗坏热物可用性降低,这最终导致NPQ的性能降低(图。5 c, 5 f).抗坏血酸不仅通过NPQ参与光保护还主要通过清除ROS [7].值得注意的是,GL对光抑制的高敏感性也可以解释为清除ROS能力低,这可能导致叶绿体靶分子的光损伤[7抑制D1新创合成(12].
黄叶产生的机理仍不清楚。GL的太阳叶含有少量的叶绿素和类胡萝卜素,但阴叶的叶绿素和类胡萝卜素含量与WT相当,这意味着GL中黄叶的表现与强光的长期辐照有关[21].在强光下,GL叶片表现出明显的光抑制症状。2,4).有人提出,长期的光抑制(或慢性光抑制)可以引导照片合成颜料如叶绿素和类胡萝卜素的光漂白[3.].这npq1拟南芥据报道,在NPQ中部分有缺陷的突变体显示在高光条件下的叶绿素的光漂白[40[显然与GL中观察到的现象。它是合理的,可享受漂亮的突出叶片生产机制的早期阶段。与草本植物不同,叶黄变黄现象不会引起衰老或细胞死亡[21].研究表明,在叶子中积累的类黄酮可以通过补充抗坏血酸-谷胱甘肽循环来保护组织免受氧化损伤[15,41.,42.].除了具有清除ROS的功能外,黄酮类化合物长期以来一直被认为是有效的防晒霜色素,特别是对紫外线辐射[43.].GL中的类黄酮颜料增加可能发挥作用,包括ROS清除功能,UV保护和阴凉的光衰减。光抑制敏感性的机制,特别是GL叶中的高耐光性仍然澄清。虽然很难将分子生物学技术应用于GL,但我们认为热带树可以为检查高光环境中生存的重要决定因素提供独特的机会。
材料和方法
植物材料
植物材料Ficus microcarpa.l . f .简历。金叶(GL)和Ficus microcarpa.L. f. (WT)生长在日本冲绳岛(26'15"N, 127'45"E)琉球大学的校园。研究期间为1999-2000年3月至6月。植物冠层的光合成光子通量约为2500 μmol m-2年代-1在阳光充足的条件下。野生型和GL型PPFD的生长条件无显著差异-2年代-1作为最大的收获,作为遮荫叶用于实验室实验。为了避免叶片干旱,在整个测量过程中,叶柄一直保持在蒸馏水中。将离体叶片置于1000 μmol m光照下激活光合活性-2年代-1实验前30分钟。
照明的叶子
用三个卤素块(400 W)发出的白光照射叶片。在光照期间,用电风扇或恒温控制水浴将叶片温度保持在30°C。通过在光源前放置金属丝屏来获得不同的光强度。
叶绿素荧光测量
在大气条件下(Heinz Walz, Effeltrich, Germany)用PAM-2000叶绿素荧光计系统测量叶绿素荧光。暗适应15 min后,最低荧光值(Fo)是由微弱的红光确定的。适应黑暗的叶片的最大荧光(F米在随后的饱和白光脉冲(8000 μmol m .-2年代-1最大荧光值(F米’)和稳态荧光(Fs)在随后的饱和白光脉冲(8000 μmol m .-2年代-1, 0.4 s)确定NPQ (F米-F米') /F米”),收益率PSII [(Fm - f) / Fm)和qP (Fm - f) / Fm的fo) (44.,45.].采用650 nm的发光二极管(LED)配以PAM-2000作为光化光源对叶片进行光照。
气体交换量
有限公司2同化作用是由CO的差异决定的2同化室进口和出口之间的浓度与CO2气体分析仪(li - 6251;LiCor, Inc.,林肯,内布拉斯加州2和21%啊2[46.].测量有限公司2在2300 μmol m光照下进行同化试验-2年代-1,但光响应曲线测量除外。大约25厘米2叶子用于实验。腔室中的空气迅速搅拌以保持有效的高边界层电导2扩散。O2演化采用气相walker型氧电极系统(LD-1模型;Hansatech, Norfolk, U.K.)含5% CO2和21%啊2[47.].测量O.2进化在4厘米处进行2在600 μmol m的光照下,叶盘的叶绿素含量增加-2年代-1.
D1蛋白含量测定
叶片(0.5 g)在含有50 mM磷酸钾(pH 7.0)、5 mM苯甲基磺酰氟和5% (w/v)聚乙烯聚吡咯烷酮的研磨介质中,在0°C下均质30 s。匀浆(4ml)与4ml含5% (w/v) SDS的125 mM Tris (pH 6.8)混合,然后在80°C孵育3min以溶解蛋白。将样品冷却至室温后,1500 × g离心30 s去除团聚体。上清液(800 μl)与等量含0.4 M蔗糖、8 M尿素、5 mM EDTA和5% (w/v) 2-巯基乙醇的溶液混合。
SDS-PAGE是根据以前报道的方法进行的[48.].采用含6.0 M尿素的聚丙烯酰胺凝胶作为堆积凝胶(4.5%)和分离凝胶(13%)。在每个通道上装载含有8 μg蛋白质的样品。使用针对D1蛋白的特异性多克隆抗体进行免疫印迹分析[48.].用NIH图像系统1.61(NIH,USA)测定蛋白质带的强度。
缩写
- APX型:
-
抗坏血酸盐过氧化物酶
- 1排名:
-
单线时兴奋剂叶绿素
- 3.排名:
-
三联体兴奋叶绿素
- DHA:
-
dehydroascorbate
- 达:
-
dehydroascorbate还原酶
- D1:
-
光系统II的反应中心形成蛋白
- Fv/F米:
-
变量与最大叶绿素的比例一个荧光
- GL:
-
金色的树叶
- MDA:
-
monodehydroascorbate
- MDAR:
-
monodehydroascorbate还原酶
- NPQ:
-
nonphotochemical淬火
- •哦:
-
羟基自由基
- 1O2:
-
单线态兴奋啊2
- O2-:
-
超氧化物自由基
- PPFD:
-
光合光子通量密度
- ROS:
-
活性氧
- WT:
-
野生型。
参考
- 1.
Demming-Adams B, Adams WW:植物对强光胁迫的光保护和其他反应。植物营养与肥料学报。1992,26(4):591 - 598。10.1146 / annurev.arplant.43.1.599。
- 2.
陈志强,陈志强,陈志强,等:植物光合作用的光抑制作用。植物营养与肥料学报,1994,19(4):593 - 598。10.1146 / annurev.arplant.45.1.633。
- 3。
Powers Sb:可见光诱导的光合作用的肤色。ANN Rev植物理遗。1984,35:15-44。10.1146 / annurev.arplant.35.1.15。
- 4。
Osmond CB:什么是光抑制?通过比较阴生植物和阳生植物,我们得到了一些见解。在:光合作用的光抑制:从分子机制到田间。编辑:Baker NR, Bowyer JR., 1994,牛津,BIOS科学出版社,1-24。
- 5。
Ball MC:光抑制在低温育苗过程中的作用。在:光合作用的光抑制:从分子机制到田间。编辑:Baker NR, Bowyer JR., 1994,牛津,BIOS科学出版社,365-376。
- 6。
李志刚,李志刚,李志刚:利用叶绿素荧光技术研究四种不同树种的温度响应和光抑制。植物营养学报。2000,19(4):457 - 461。10.1034 / j.1399-3054.2000.100309.x10.1034 / j.1399-3054.2000.100309.x。
- 7.
Asada K:叶绿体中的水循环:活性氧的清除和过量光子的消散。植物营养与肥料学报,2003,21(4):457 - 461。10.1146 / annurev.arplant.50.1.601。
- 8.
Macpherson AN,Telfer A,Barber J,Truscott TG:直接检测来自隔离的照相II反应中心的单线氧。Biochim Biophys Acta。1993,1143:301-309。10.1016 / 0005-2728(93)90201-p。
- 9.
Yamamoto Y:光系统的质量控制II。植物生理学报。2001,42(4):431 - 434。10.1093 /卡式肺囊虫肺炎/ pce022。
- 10.
过氧化氢对分离完整叶绿体卡尔文循环的可逆抑制和氧化戊糖磷酸循环的激活。植物学报。1979,145:377-382。
- 11.
Tanaka K, Otsubo T, Kondo N:过氧化氢参与SO中Calvin-cycle SH酶的失活2-fumgated菠菜叶子。植物营养与肥料学报。
- 12.
nhiyama Y, Yamamoto H, Allakhverdiev SI, Inaba M, Yokota A, Murata N:氧化应激抑制光损伤对光合机制的修复。国家自然科学基金项目,2001,20(1):1 - 7。10.1093 / emboj / 20.20.5587。
- 13。
Smirnoff N:抗坏血酸的生物合成和光保护功能。王志强,王志强。10.1098 / rstb.2000.0706。
- 14。
Asada K:抗坏血酸过氧化物酶——植物中的一种过氧化氢清除酶。植物学报。1992,85:235-241。10.1034 / j.1399-3054.1992.850216.x10.1034 / j.1399-3054.1992.850216.x。
- 15.
Sakihama Y,Mano J,Sano S,Asada K,Yamasaki H:通过单羟基胱山酯还原酶介导的苯氧基自由基的减少。Biochem Biophys Res Communce。2000,279:949-954。10.1006 / BBRC.2000.4053。
- 16。
菠菜类囊体中单脱氢抗坏血酸自由基的铁氧脱氧蛋白依赖的光还原。植物生理学报。1994,35(5):539-549。
- 17.
Hossain MA, Asada K:菠菜脱氢抗坏血酸还原酶的纯化及其作为硫醇酶的特性。植物营养与肥料学报,2003,21(4):417 - 422。
- 18.
Yamasaki H, Takahashi S, Heshiki R:热带无花果Ficus microcarpa.l . f .简历。金叶缺乏热稳定性脱氢抗坏血酸还原酶活性。植物生理学报。1999,40(4):489 - 494。
- 19.
大麦初生叶黄变和光合作用下降对大气CO的响应2丰富。physiol植物。1998,103:193-200。10.1034 / J.1399-3054.1998.1030206.X10.1034 / J.1399-3054.1998.1030206.x。
- 20.
SICEL RC:通过在升高二氧化碳的生长期间,通过大麦原发性叶片变黄来降低光照-II活性。int j植物sci。1999,160:849-854。10.1086 / 314182。
- 21.
山崎H, Heshiki R, Ikehara N:强光诱导的叶子金黄Ficus microcarpa.林志刚,黄志刚,黄志刚,等。热带无花果属植物的研究进展。植物营养与肥料学报,1998,18(4):427 - 434。
- 22.
高等植物叶绿体和叶片中依赖叶黄素周期的光保护机制。植物科学学报。1997,19(3):423 - 427。10.1034 / j.1399-3054.1997.990127.x10.1034 / j.1399-3054.1997.990127.x。
- 23.
叶绿素荧光和光合作用:基础知识。植物营养与肥料学报,2001,21(4):513 - 514。10.1146 / annurev.arplant.42.1.313。
- 24.
Niyogi KK, Grossman AR, Bjorkman O:拟南芥突变体定义了叶黄素循环在光合作用能量转换调节中的核心作用。acta botanica sinica(云南植物研究),1998,10:1121-1134。10.1105 / tpc.10.7.1121。
- 25。
Havaux M, Niyogi KK:紫黄素循环通过多种机制保护植物免受光氧化损伤。美国国家科学院学报。1999年,96:8762 - 8767。10.1073 / pnas.96.15.8762。
- 26。
Gilmore AM:在光系统II中依赖叶黄素循环的非光化学猝灭:从拟南芥缺乏紫黄质深氧化酶活性和/或叶黄素突变体获得的机制见解。照片合成技术2001,67:89-101。10.1023 /: 1010657000548。
- 27。
Gilmore AM, Yamasaki H: 9-氨基吖啶和二布卡因表现出竞争相互作用和复杂的抑制作用,干扰Δ pH值的测量和依赖叶黄素循环的光系统II的能量耗散。照片合成技术,1998,57:159-174。10.1023 /: 1006065931183。
- 28。
Bratt CE, Arvidsson P-O, Carlsson M, Åkerlund H-E: pH和抗坏血酸浓度对紫黄质去环氧化酶活性的调节。照片合成技术,1995,45:169-175。
- 29.
Foyer CH, leandais M:抗坏血酸和葡萄糖通过豌豆叶叶肉细胞类囊体、叶绿体和质膜的相对转运率的比较。植物营养与肥料学报,1996,19(4):491 - 498。
- 30.
抗坏血酸再生系统对叶绿体耐强光性的生理意义。在:光合作用:从光到生物圈。编辑:Mathis P. 1995, Dordrecht, Kluwer Academic, 291-294。
- 31.
Trümper S, Follmann H, Häberlein I:一种新的脱氢抗坏血酸还原酶,来自菠菜叶绿体与植物胰蛋白酶抑制剂同源。FEBS Lett. 1994, 352: 159-162。10.1016 / 0014 - 5793(94) 00947 - 3。
- 32.
Sha S, Minakuchi K, Higaki N, Sato K, Ohtsuki K, Kurata A, Yoshikawa H, Kotaru M, Masumura T, Ichihara K, Tanaka K:水稻中谷氨酸还蛋白(thioltransferase)的纯化和表征(栽培稻l .)。中国生物医学工程学报。
- 33.
许丹萍:脱氢抗坏血酸还原。生物能源学报,1994,26:369-77。
- 34.
3 .叶中叶绿体脱氢抗坏血酸还原酶的研究。植物营养与肥料学报。2000,19(4):441 - 446。10.1093 /卡式肺囊虫肺炎/ pcd035。
- 35.
抗坏血酸脱氢还原酶对类囊体管腔内抗坏血酸的保护作用。照片合辑,1997,53:197-204。10.1023 /: 1005832022204。
- 36.
脱氢抗坏血酸和脱氢抗坏血酸还原酶是植物氧化应激的幻像指标。FEBS Lett. 1997, 414: 567-570。10.1016 / s0014 - 5793(97) 01074 - 0。
- 37.
Morell S, Follmann H, De Tullio M, Häberlein I:脱氢抗坏血酸还原:残体。FEBS Lett. 1998, 425: 530-531。10.1016 / s0014 - 5793(98) 00282 - 8。
- 38。
Foyer CH, Mullineaux PM:脱氢抗坏血酸盐和脱氢抗坏血酸还原酶在植物组织中的存在。FEBS Lett. 1998, 425: 528-529。10.1016 / s0014 - 5793(98) 00281 - 6。
- 39。
KUBO A,AONO M,Nakajima N,Saji H,Tanaka K,Kondo N:抗氧化酶活性对不同环境胁迫的差异反应拟南芥。植物保护学报,1999,13(4):427 - 434。
- 40.
李志刚,李志刚,李志刚,等:水稻光合器官的光害及其对叶片发育阶段的影响npq1拟南芥突变体缺乏叶黄素循环酶毒素脱氧蛋白脱氧酶。植物理性。2000,124:273-284。10.1104 / pp.124.1.273。
- 41.
山崎H, Sakihama Y, Ikehara N:类黄酮-过氧化物酶反应作为植物细胞对H的解毒机制2O2.植物营养与肥料学报。1997,19(4):457 - 461。
- 42.
山崎H:颜色的作用。植物科学进展,1997,2:7-8。10.1016 / s1360 - 1385 (97) 82729 - x。
- 43.
植物黄酮类化合物在与微生物相互作用中的作用:从保护病原体到调节互惠共生。见:植物生理学的最新研究进展。编辑:Pandalai SG。2001年,特里凡得琅,研究路标,157-173。
- 44.
SchreiBer U:用一种新型的高频调制叶绿素荧光计检测快速感应动力学。Photosynth Res。1986,9:261-272。
- 45.
光合作用电子传递量子产额与叶绿素荧光猝灭的关系。中国生物化学学报,1999,30(4):457 - 461。
- 46.
Agata W, Kawamitsu Y, Hakoyama S, Shima S:一种基于调节蒸气压差的叶片气体交换测量系统。照片合成技术,1986,9:345-357。
- 47.
Kawamitsu Y, Boyer JS:褐藻中潮汐间的光合作用和碳储存,岩藻vesiculosus L。海洋生物学。1999,133:361-369。10.1007 / S002270050475。
- 48.
光系统II中叶绿素结合蛋白CP43的降解。生物化学。1995,34:9038-9045。
致谢
我们非常感谢琉球大学的M. F. Cohen博士对手稿的批判性阅读。这项工作得到了日本HY科学促进协会科学研究补助金(B)和(C)的支持。
作者信息
从属关系
相应的作者
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
Takahashi, S, Tamashiro, A, Sakihama, Y。et al。热带植物光合作用对光抑制的高度敏感性Ficus microcarpa.l . f .简历。金色的叶子。BMC植物BIOL.2,2(2002)。https://doi.org/10.1186/1471-2229-2-2
收到了:
接受:
发表:
关键字
- 黄质
- PSII反应中心
- 光响应曲线
- Antheraxanthin
- DHAR活动