抽象的
背景
苔藓Physcomitrella金属盘是植物生物学和功能基因组分析的有吸引力的模型系统。它分享了具有更高植物的许多生物学特征,但具有高效同源重组系统的独特优势,其核DNA。这允许精确的遗传操作和靶向敲除研究基因功能,这是由于在任何更高的植物中不常规可能常规的靶向重组事件频率的方法。
结果
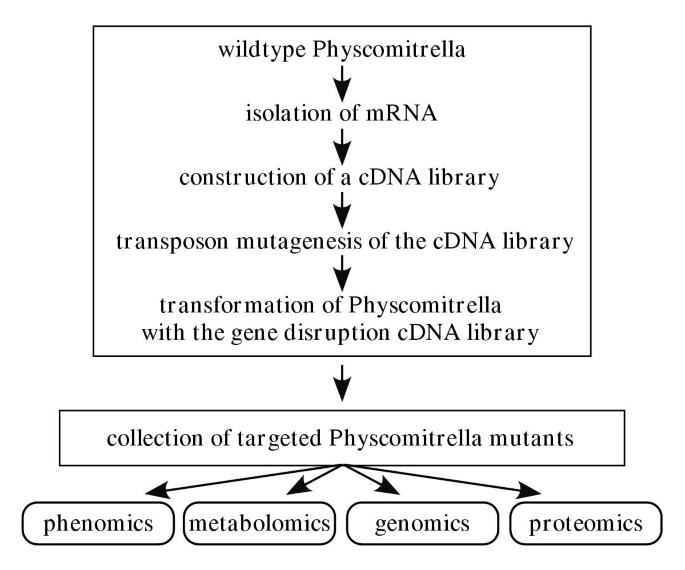
作为大规模开展该植物基因/功能相关性研究的重要前提,我们正在建立一套Physcomitrella金属盘在大多数表达基因中具有插入突变的转化子。对低冗余苔藓cDNA文库进行诱变大肠杆菌用转置子Tn的导数1000.然后使用得到的基因破坏文库转化Physcomatrella。预期诱变CDNA与基因组编码序列的同源重组预期优先靶向表达基因的插入事件。通过在苔藓的生命周期中的单倍石化学型状态的优势,使转化体的直接表型分析成为可能。在到目前为止分析的前16,203种转移体中,我们观察到2636株植物(= 16.2%)与各种发育,形态和生理特性不同的野生型不同。
结论
表型的偏差和宽范围的转化体中观察到的异常的高比例表明,诱变通过基因破坏文库转化是建立一个高度多样化的群体的有用策略Physcomitrella金属盘功能基因组分析的突变体。
背景
鉴定给定基因的功能的最具信息丰富的方法是基因的精确失活或功能改变,然后分析该操纵引起的表型变化。基于具有改变或废除基因函数的靶向构建体与其同源内源基因之间的同源重组的基因靶向已经是原基,下核苷酸和小鼠基因功能分析的高度成功方法。不幸的是,在更高的植物中,这种方法受到10的非常低的比例限制-3到10.-5目标相对于非法重组事件。虽然已经描述了一些进入的靶向结构及其同源基因组序列之间的同源重组事件,同源重组仍然非常低效,因此基因靶向在高等植物中不经常可能[1那2].相反,通过同源重组的基因靶向在苔藓中发生的频率很高Physcomitrella金属盘[3.那4.].在第一次演示染色体序列与转化引入的同源DNA之间的高频重组5.[成功地使用Physcomitrella靶向的基因来研究几种基因的功能,通过创造功能敲除[6.-9.].同源重组提供的高特异性甚至允许多基因家族单个成员的特异性靶向[10].
便于其遗传操作,连同一个高度保守的形态特征,生化途径和之间的信号转导机制的Physcomitrella金属盘和更高的植物[11-14]使苔藓成为植物功能基因组学的重要模型系统。促进植物基因功能的大规模研究Physcomitrella金属盘作为模式生物,我们正在开发立碗藓植物与影响各种各样的发育,形态和生理特征插入突变的集合。变换用携带的同源序列与基因组典型地导致高10倍的转化频率的构建体,然后使用非同源构建体,以及这些转化体中高比例示出了集成的构建体的同源基因组基因座[3.那12].我们认为,与随机突变策略相比[15] - 靶向表达基因的插入突变将增加展示改变性能的转化体的比例,并将降低待筛选的转化体的总数,以找到表型的特定变化。因此,我们开发了一种高效的转座子型梭菌诱变系统,用于莫斯cDNA文库,并使用标记的插入诱变的cDNA克隆池n调控的nptII选择盒式磁带,用于改造Physcometella植物(图。1).
结果与讨论
互补脱氧核糖核酸库
为了建立一个代表在分化开始前营养生长期间表达的大多数基因的PhyscomatraLla cDNA文库,从液体培养的不同时间段培养的Protonemata中提取RNA,并在标准化后建立质粒载体的cDNA文库以减少冗余[16].对57,000条EST序列进行大规模DNA测序和聚类,得到12,000个不重叠的序列簇,所使用的cDNA文库显示出较低的克隆冗余度。对这些contigs序列进行序列分析,并结合大量来自其他生长阶段和组织的EST序列,推测苔藓的编码序列总数Physcomitrella金属盘和开花植物拟南芥是类似的(rensing等,提交),尽管苔藓的三倍较大的基因组大小[12].
基因破坏图书馆
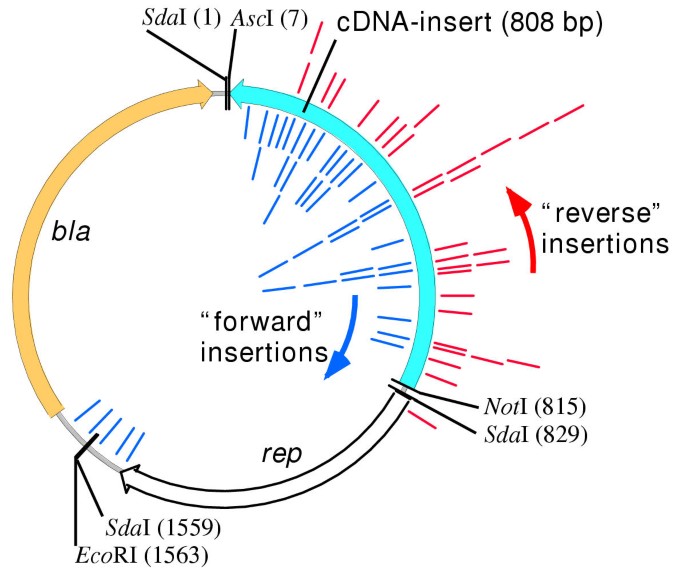
为了建立带有插入突变的cDNA克隆的基因破坏文库,对cDNA克隆进行穿梭突变大肠杆菌.首先,将扩增原丝体文库的归一化cDNA库亚克隆到最小载体pUCMinIV中(图1)。2).这个质粒是一个1.7 kb的pUC19的衍生物,我们删除了大多数非必需的DNA序列,以去除载体序列中的插入靶标。与目标cdna合并的最小载体被引入供体大肠杆菌携带可诱导转座酶基因的菌株(tnpA)和转座子Tn衍生物的共轭质粒1000.这种迷你转座子携带经修饰的n-Promoter驱动nptII在Tn边界重复序列之间表达抗抗生素G418基因的盒体,作为可选择的植物标记基因1000转职所需的费用[17].通过IPTG导致转座酶活性的诱导导致转置和结合在共轭质粒和cDNA克隆之间的结合物的形成。通过缀合物转移到过表达的受体菌株中的缀合物的分辨率实现tnpRreativase基因,导致携带cDNA的最小载体的拷贝的释放,其插入mini-tn1000::nptII.将这些质粒分离并重新变成大肠杆菌.来自该基因破坏文库的个体克隆的分析,以及使用定义的cDNA克隆靶的模型实验表明,在大多数所得标记的质粒中,转座子已插入摩西cDNA中,没有表观偏好靶序列或插入取向(无花果。2).
转型
由转座子诱变的CDNA制备的质粒DNA的池用于大规模的PEG介导的半连续生物反应器培养物中生长的苔藓原生质体的转化[6.那18那19].转化前,质粒DNA被一种罕见的限制性内切酶消化线性化,SDA.I,它在cDNA插入外的最小载体上切割(图。2).原生质体的再生在补充的Knop培养基上进行2周,无需选择,然后进行两个循环的G418选择,以消除不稳定的转化体[20.].98%以上的存活植株是稳定的转化体nptII用于cDNA中断的选择盒,通过PCR检测证明nptII编码序列或第三选择步骤[21].通过流式细胞术检查所有转化体的细胞DNA含量[18];(的16203 1242)测试的转化体7.7%为多倍体。目前,我们已经生产超过22000个苔转化;目前的产能约为每月3000个新的转化。这将使我们能够建立一个大的集合与基因破坏的文库构建转化立碗藓植物;我们的目标是,以获得携带突变的大多数表示苔藓基因植物的集合。
生理上的突变体
为了测试在用基因破坏文库转化后在苔藓植物中诱导的生理改变,我们寻找改变转化体中诱导的营养要求(图。3.).再生植株中有7.2%(16203株中有1163株)在最低培养基上生长迟缓,而在含有补充物的同一培养基上生长正常(见材料),而野生植株在两种培养基上生长良好。这表明在最小培养基上生长缓慢的转化子存在代谢缺陷,可以通过在培养基中提供代谢物来挽救。16203株转化子中有508株(3.1%)在最低培养基和补充培养基上生长迟缓。这些植物可能需要在我们补充的培养基中不存在的物质,或者它们可能在其他方面有缺陷。不同的营养突变体Physcomitrella金属盘,例如由突变孢子引起的[22]之前已经描述过。
形态突变体
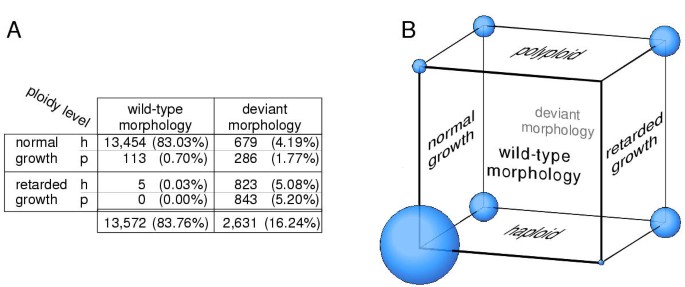
为了筛选形态和发育突变,再生后的转化体在补充Knop培养基的再生和选择后进行显微镜,然后在最小的Knop培养基上进行8周。在这些条件下,最初通过再生野生型原生质体形成的丝状结构(原型肿块)经历了发育开关。它形成三面向顶级的顶端芽,并分化为环状茎,传染症(图。4A),最终将携带性器官。基因破坏文库转化体16.2%(2,631/16,203)在观察到的一个或多个特征中显示出形态偏差:苔藓植物的结构和颜色,通过传染患者的植物覆盖,叶子的形状和细胞排列的均匀性在叶子里(表1).在350株被分析的野生型植物中没有观察到这种偏差,在400株由原生质体模拟转化而成的植物中,不到1%的植物在没有抗生素的情况下获得了再生。图中显示了在基因破坏文库转化子中观察到的变异表型的例子。4B.到4E.除了上面描述的类的表型,我们观察到其他发育异常,如长出的叶表面上形成,形成螺纹状的叶尖附属物,和深色扇区的叶片上的数量增加。因此,形态和发育改变的宽光谱与基因破坏文库转化苔藓植物上观察到。另外,我们测定每个转化体的三个参数之间 - 的生长需求,形态和倍性水平 - 似乎没有成为严格相关性,我们发现特征的各种组合(图5.).
基因破坏文库转化体中诱导的偏离表型。在最小Knop培养基上培养小Physcomitrella野生型和转化型植株,诱导配子体的分化和发育。对于每个工厂,一个概述(上一行,比例尺对应1毫米)和一个特写(下一行,比例尺等于0.5毫米)显示。一种单倍体野生型苔藓植物,完全被叶状配子体和野生型叶片的特写。B,转化体BC22189受分化影响,主要由丝状原丝体组成,配子载体数量减少,但叶片形态正常(单倍体)。C,转化体BC11280表现出生长迟缓、配子体数量减少和叶片形态改变(“drehzipfel”表型;扭曲的叶尖,单倍体)。D,突变体BC1015显示生长习性改变(“wasserpest”表型,类似于水草伊乐藻属植物)和叶片形态改变(多倍体)。E,转化体BC22288生长迟缓,叶片狭长(多倍体)。
Physcomitrella敲除图书馆转化体中观察到的特征组合。A,16,203的Physcomprella植物,由基因敲除文库进行转化进行,用于形态偏差,延迟生长在最小培养基和倍增性水平[18].表中列出了八种可能的属性组合的绝对数字和相对百分比。B,观察到的属性组合的图形表示。每个变换峰的三个特征用一个立方体的三个维度来表示。立方体角落的球体表示八种可能的特征组合;它们的体积与每一类所观察到的变压器的数量成正比。
分子分析
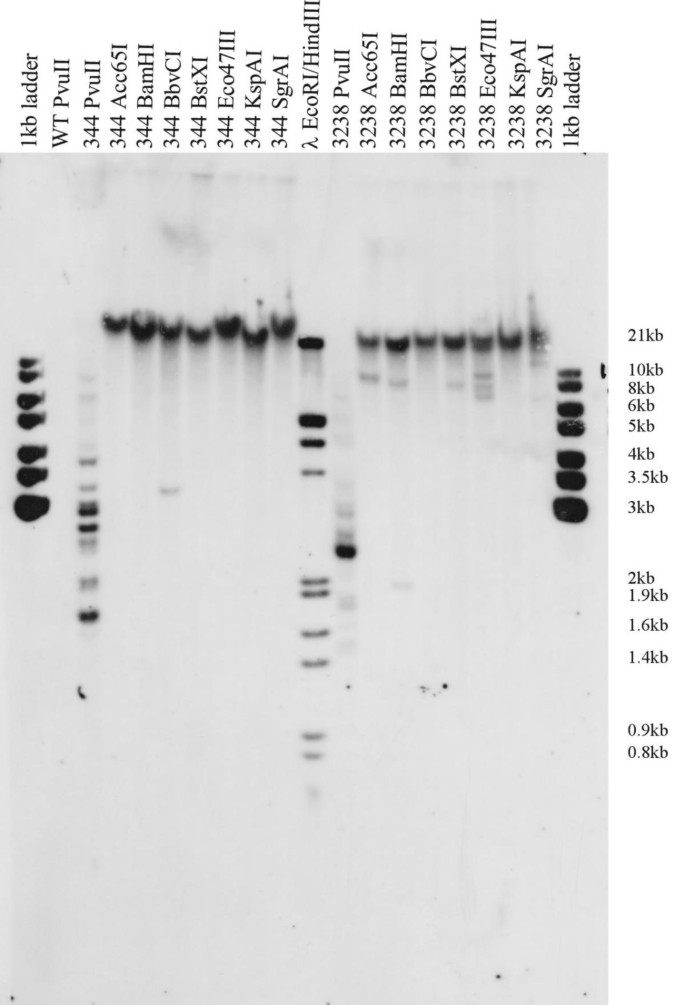
用于分子分析,从随机选择的转化体中分离基因组DNA,并在南方印迹实验中分析。为了获得整合在转化的苔藓植物中的基因破坏构建体的数量的估计,将这种DNA消化了PVU二、它具有单一的识别位点内nptII编码序列。这导致两个片段的形成通过检测nptII为每个选择盒的每个拷贝的探头。这些片段的长度取决于相邻序列,其可以衍生自基因组序列或由转化DNA贡献的cDNA。在55种转化体的南部墨水上,检测到19.3±3.6(平均值±d。)带,表明平均插入数约为10nptII-Crasettes每种转化体(数据未显示)。为了区分不同基因组位置的独立集成事件和相同基因座的共同集成,用几种限制酶消化了16种转化体的基因组DNA,这些酶经常切割基因组真菌性能DNA,但不会在其中切割nptII在转化DNA所携带的cDNA序列中很少出现(图。6.).通过凝胶电泳后溴化乙锭染色判断,大部分基因组DNA被这些酶切成1 ~ 15 kb的片段。然而,大多数检测到的片段在杂交后与破坏构造特异性nptII-probe的大小超过20 KB;只有少数的nptII-杂交带观察到。用相同的DNA进行消化PVUII,其中削减了nptII选择盒式磁带,结果有好几个nptII-杂交片段大小较小,范围在1 ~ 10 kb(图2)。6.).这表明大多数转化的DNA分子在很少的基因组位点上相互紧密地协同整合,而不干涉基因组序列。PCR扩增转基因序列nptII插入使用nptII- 所得产物的预期和序列分析证实了近距离附近的不同基因破坏构建体的串联积分(数据未示出)。已经观察到在Physcomatrella中转化DNA分子的类似积分模式[5.那15].
结论
综上所述,我们通过基于cDNA的基因破坏文库转化方法建立的小Physcomitrella转化子的收集显示出高度的表型多样性。形态或发育特征发生改变的植物比例(16.2%)超过了以前描述的利用苔藓DNA基因组克隆的穿梭突变策略(3.9%)[15].这种差异可能是由于在cDNA诱变方法后,苔藓表达的基因受到同源重组的优先破坏。在我们收集的苔藓转化体中,表型改变的频率也大大高于已证实的拟南芥敲除突变体的不到2%的报道[23],它可能归因于Physcomitrella的较低程度的基因冗余(Rensing等,提交)。通过插入来自我们突变收集的植物中的基因破坏文库构建体标记的少量基因组基因座应允许在具有改变的表型中,在转化体中恢复恢复和对转化体影响的苔原基因分析。实际上,我们已经重新分离出周围的基因组序列nptII-插入位点,例如基于pcr的方法。其中一些序列中内含子的存在表明,这些序列来源于转基因序列通过同源重组插入的基因组靶位点(数据未显示)。因此,我们期望在这里建立的苔藓突变体集合将有助于识别植物中以前未知的新基因[7.那12并能快速连接DNA序列和功能信息。考虑到苔藓和高等植物之间高度的遗传和生理保护,该基因破坏文库的收集不仅将是研究小Physcomitrella基因功能的有价值的工具,而且将为植物功能基因组学研究提供有价值的工具。
材料和方法
转座子突变
质粒结构和微生物技术遵循标准程序[24那25]详细描述于专利WO 01/38509中,可以在下面获得http://ep.espacenet.com欧洲专利局或我们的要求。简单地说,Physcomitrella金属盘亚克隆到minimalised矢量pUCMinIV(编码氨苄青霉素抗性)的cDNA文库转化到供体大肠杆菌应变R2117。该菌株携带质粒编码的IPTG可诱导的转座酶基因(tnpA),以及包含来自质粒R388 [转印区域接合质粒26],氯霉素抗性标志物和an启动子-nptII-n终结者表达式磁带侧翼被转座子tn1000转位所需的边界重复序列[17].这nptII盒子来自pbin19 [27].提高后续植物选择的效率,存在的点突变nptII编码序列[28]被还原为野生型序列。将耐氨苄西林的R2117供体转化株与苔藓cDNA克隆合并,用IPTG诱导转座酶活性,并在IPTG存在下与R1037受体细胞共培养。大肠杆菌菌株R1037携带iptg诱导物tnpR分子酶基因和链霉素抗性基因座,两者在染色体上编码。TN.1000在供体的转位导致共轭质粒和苔藓cDNA克隆之间形成共整合,然后可以通过接合转移到受体,并发生分离。通过同时对氨苄青霉素和链霉素产生抗性,选择突变苔藓cDNA克隆的受体细胞,利用汇集细胞制备的质粒DNA进行转化p .金属盘.
植物生长条件、培养基和转化
Physcomitrella金属盘(Hedw)。b.s.g在液体或改良Knop固体培养基中培养,如前所述[29].为了分离原生质体,原丝体在半连续生物反应器中添加2.5 mM酒石酸铵[18那19].转换(6.3 × 105.细胞和50 μg线性化质粒DNA。转化后的植株在Knop培养基中添加ms -微量元素[30.), 4 mg / l肌醇,2.8 mg / l氯化胆碱,1 mg / l烟酸,0.5 mg / l thiamine-HCl 0.25 mg / l,吡哆醇0.01 mg / l生物素,0.25 mg / l p-aminobenzoic酸、1.9 mg / l Ca-D-pantothenate 0.015 mg / l核黄素,6.76 mg / l腺嘌呤,3.84 mg / l Na-palmitinic酸,250 mg / l蛋白胨,920 mg / l ammoniumtartrate 50 g / l葡萄糖,以促进代谢突变体的存活。通过第一步筛选25 μg/ml G418 2周,非选择性释放2周,再进行2周G418筛选,鉴定出稳定的转化子。
分子分析
用PCR方法证实G418抗性苔藓转化子中存在转基因nptII特定的引物,或如所述的第三个选择步骤[21].Southern blot分析:用改良CTAB法分离1 μg基因组DNA [31.用来自MBI Fermentas或新英格兰生物Biolabs购买的20份U型限制酶消化了5-6小时。在0.7%琼脂糖凝胶上电泳后,将DNA转移到带正电荷的尼龙膜(Roche)上。碎片携带nptII-序列通过杂交和阻断溶液以及罗氏的anti -地高辛- ap结合物和Promega的CDP-Star检测。的DIG-labellednptII探针采用罗氏(Roche)和罗氏(Roche)的随机引物标记混合物,通过PCR生成Taq.从Promega聚合酶。
材料和突变植株的可用性
在本通信中描述的材料,单株植物线以及具有相似性与定义的感兴趣基因相似的Physcomatrella Est克隆的序列信息将在完成与巴斯夫植物科学GmbH和Freiburg University的适当的材料转移协议后进行非营利性研究.此外,鼓励对具有相似性与定义的兴趣基因相似的Physcomitella EST克隆的序列信息查询。请求应向相应的作者(RR)。
参考
- 1.
引用本文:王志强,王志强,王志强:植物基因组同源重组的研究进展。医学杂志。化学学报。1999,38:749-758。
- 2.
植物同源重组的基因替换。植物营养与肥料学报,2002,32(4):513 - 514。10.1023 /: 1013761821763。
- 3.
Schaefer DG:靶向基因Physcomitrella金属盘.Curr。拍摄。植物BIOL。2001,4:143-150。10.1016 / s1369-5266(00)00150-3。
- 4。
Reski R:Physcomitrella和拟南芥:反向遗传学的大卫和歌利亚。植物科学进展。1998,3:209-210。10.1016 / s1360 - 1385(98) 01257 - 6。
- 5。
高效基因靶向苔藓Physcomitrella金属盘.植物学报1997,11:1195-1206。10.1046 / j.1365 - 313 x.1997.11061195.x。
- 6。
Strepp R,Scholz S,Kruse S,Speth V,Reski R:植物核基因敲除揭示了血管细胞分裂蛋白FTSZ的同源物,祖先微管蛋白的体积分裂中的作用。Proc。Natl。阿卡。SCI。美国。1998,95:4368-4373。10.1073 / pnas.95.8.4368。
- 7。
Girke T,Schmidt H,ZähringerU,Reski R,Heinz E:通过靶向基因破坏鉴定新型D6-酰基除去饱血酶Physcomitrella金属盘.植物杂志1998年,15:39-48。10.1046 / j.1365-313X.1998.00178.x。
- 8。
26S蛋白酶体的多泛素链结合亚基MCB1 (RPN10)在细胞发育过程中起重要作用Physcomitrella金属盘.acta botanica sinica(云南植物学报). 1999,11:1457-1472。10.1105 / tpc.11.8.1457。
- 9。
Imaizumi T,Kadota A,Hasebe M,Wada M:加密光信号控制开发,抑制苔藓Physcomitrella的植物素敏感性。植物细胞。2002,14:373-386。10.1105 / TPC.010388。
- 10.
Hofmann啊,密码子AC,Ivascu C,Russo Ve,骑士C,Cove D,Schaefer DG,ChakhParonian M,Zryd JP:特定成员出租车多基因家族在苔藓中可以被有效地定位和破坏Physcomitrella金属盘.摩尔。Gen. Genet。1999年,261:92-99。10.1007 / s004380050945。
- 11.
苔藓的发育、遗传学和分子生物学。机器人。Acta physica sinica, 1998, 31(1): 1-15。
- 12.
小Physcomitrella的分子遗传学。植物学报。1999,29(4):421 - 427。10.1007 / s004250050563。
- 13.
木头AJ,Oliver MJ,Cove DJ:苔藓植物作为模型系统。布莱尔。2000,103:128-133。
- 14。
Schaefer DG, Zryd JP:苔藓Physcomitrella金属盘,不时地。植物营养与肥料学报。2001,27(4):434 - 438。10.1104 / pp.127.4.1430。
- 15.
Nishiyama T,Hiwatashi Y,Sakakibara I,Kato M,Hasebe M:标记诱变和苔藓的基因陷阱,Physcomitrella金属盘通过穿梭诱变。DNA Res。2000,7:9-17。
- 16。
KO MS:通过重新分配短双链CDNA的“均衡的cDNA文库”。Nucl。酸res。1990,18:5705-5711。
- 17。
Sherratt DJ: Tn3和相关的转座因子:位点特异性重组和转座。:移动的DNA。编辑:DE Berg, MM Howe。华盛顿特区:美国微生物学会;1989:163-184。
- 18。
王志强,王志强,王志强:一种半连续生物反应器的建立Physcomitrella金属盘大量生产原生质体。Acta photonica sinica, 2001,40(4): 441 - 446。
- 19。
霍厄A,Reski R:苔藓的生物反应器培养的优化Physcomitrella金属盘大量生产原生质体。植物SCI。2002年。
- 20.
Ashton NW,Champagne CEM,Weiler T,Verkoczy LK:苔藓植物Physcomitrella金属盘复制全躯质转基因元素。新植物。2000,146:391-402。10.1046 / J.1469-8137.2000.00671.x。
- 21.
王志强,王志强,王志强:转基因小碗藓植物的高通量pcr筛选。植物摩尔。生物。国会议员,2002,20:43-47。
- 22.
苔藓中营养缺陷和类似物抗性突变体的分离和初步特征Physcomitrella金属盘.摩尔。Gen. Genet。1977年,154:87-95。
- 23.
Bouche N,Bouchez D:Arabidopsis Gene淘汰:想要的表型。Curr。拍摄。植物BIOL。2001,4:111-117。10.1016 / s1369-5266(00)00145-x。
- 24.
Sambrook J,Russell D:分子克隆:实验室手册(第三版)。冷泉港,纽约:冷泉港实验室出版社;2001年
- 25.
米勒JH:细菌遗传学的短程。冷泉港,N. Y.:寒春港实验室出版社;1992年
- 26。
IncW质粒R388的物理和遗传图谱。质粒。1988,20:155-157。
- 27。
Bevan M:植物转化的二元农杆菌载体。Nucl。酸res。1984,12:8711-8721。
- 28。
Yenofsky R1,Fine M,Powell JW:突变体新霉素磷酸转移酶II基因降低了转化体对抗生素选择压力的抗性。Proc。Natl。阿卡。SCI。美国。1990,87:3435-3439。
- 29。
Reski R,阿贝尔WO:出芽对苔藓的chloronemata和caulonemata的诱导,Physcomitrella金属盘,使用isopentenyladenine。植物学报。1985,165:354-358。
- 30.
Murashige T,Skoog F:一种修正媒介,用于快速生长和烟草组织培养的生物测量。physiol。植物。1962,15:473-497。
- 31.
Reski R,Wehe M,Hadeler B,Marienfeld JR,Abel WO:细胞肝素和光质质量在Moss Physcomatrella的叶绿体突变体PC22中的分子水平相互作用。J.植物物理。1991,138:236-243。
致谢
我们感谢Josef Honerkamp(Freiburg)教授有助于讨论数据分析,Vertis Biotechnologie(Bergmoos,德国Bergmoos,德国)的数据分析讨论,用于克隆cDNA图书馆。我们的技术人员的专家协助非常感谢。这是弗赖堡大学和巴斯夫植物科学GmbH之间的联合项目。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
作者1(TE)开发的克隆转基因插入位点的策略。作者2(JG)优化和适于高通量生产转座子诱变过程。作者3(MCG)构造最小的克隆载体,并参与cDNA文库生产。作者4(AH)设置和协调的高通量转化和突变体的生产。作者5(11H)做诱变cDNA文库和转基因插入位点的分子分析。作者6(JML)正在提交作者此通信,由原稿和数据,并有助于苔转化体的分子分析。作者7(SAR)是负责cDNA序列的生物信息学分析。作者8(KS)做转化的分子特征和Southern印迹分析。作者9(JS)负责的表型文档,代谢屏幕和突变体的低温保存。作者10(GS)是负责通过流式细胞术和转基因的PCR的检测转化体的质量控制。 Author 11 (SZ) developed vectors and the basic methodology for transposon mutagenesis of cDNA clones. Author 12 (ED) is scientific co-ordinator at BASF Plant Science GmbH for the research collaboration with Freiburg University. Author 13 (BR) devised the transposon mutagenesis strategy for the cDNA library and supervised the development of the method. Author 14 (RR) conceived of and leads the Physcomitrella functional genomics project at Freiburg University; he is corresponding author. All authors read and approved the final manuscript.
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
Egener,T.,Granado,J.,Guitton,MC。et al。高频率的表型偏差Physcomitrella金属盘用基因破坏文库转化的植物。BMC植物BIOL.2,6(2002)。https://doi.org/10.1186/1471-2229-2-6
收到了:
公认:
发表:
关键字
- 同源重组
- 接合质粒
- 酒石酸铵
- tnpA
- 植物功能基因组