摘要
背景
硬红色冬小麦(HRWW;小麦属植物aestivmL.)从美国北部大平原选择基因型植物有曝光后较少的组织水来冷却秋季气温比南部大平原植物。人们普遍认为,相比于南部品种北部缩小组织水含量是由于阻抗水吸收由北方植物作为低秋温度的结果。我们假设,如果低温阻碍水的吸收,然后土壤水分少将由除去北部比南部的选择品种。这一假设通过在2°至其叶子含水量关系进行比较的北部(FR)的植物水的吸收和南部(FS)品种下测试。
结果
在2°C的叶子水含量,FR植物的含水量比FS植物的含水量更快地减少,类似于秋季的现场结果。在6周期间,FR植物的叶子含水量下降20%至25%的预处理值,而FS植物仅为5至10%。植物水吸收约60克2o·g fdw-1由FS植物,而FR植物维持植物水吸收超过100克H.2o·g fdw-1在2°C下的6周内。在其他4个北方基因型抗冻性相同的情况下,植株叶片水分含量和水分吸收变化与FR植株相似。
结论
在这些北方选择的HRWW品种叶子水含量降低由于植物水吸收的阻抗而导致。
背景
在美国北部大平原,站在硬红冬小麦品种内(HRWW的密度;小麦L.)在春天变化,取决于冬季的严重程度。一般来说,与南方的南方的品种相比,北方选择有最大的维护展台[1].然而,当植物接受足够的冷感应品种间这种区别只是发生。这在秋季定植后[自然发生2].它也可以在实验室中在接近冰点的温度下进行4至6周[3.].肯尼菲克和斯旺森[4.]将这种诱导间隔描述为“冷适应”。
几个生理生化变化期间和冷驯化后植物区分基因型[5.-10.].基因型之间的一个区别是,在凉爽的秋季,某些基因型的组织含水量下降得比其他基因型快[11.-13.].马丁11.]的研究结果表明,在深秋,北方选种的组织水含量比那些冬季冰冻条件不那么严重的南方选种的组织水含量少。Nass [14.]观察到冬小麦和黑麦植株水分含量有相似的差异(Secale cerealel .)品种。
的组织水含量响应于低温的减少是通过根据信是由于水吸收的阻抗[15.].在植物从温暖的温度转移到较冷的温度后不久,根系的水力导度就会降低。博尔格et al。[16.]在棉花后几个小时内观察到这种效果(陆地棉L.)植物从30至18℃转移。同样,马龙[17.]在将植物转移到22至8℃的几分钟内观察到春小麦根的液压传导的降低。然而,我们的研究重点介绍了持续的冷置适应期的影响,因为在晚秋季而不是由于瞬态温度变化而发生的变化。
低温对北方选育品种水分下降的影响可能是:1)抑制了植株的水分吸收,或2)植株的水分损失超过了吸收。如果如Limin和Fowler所建议的那样,秋季温度阻碍了水分吸收,导致北方HRWW植物组织水分含量的更大减少[15.[那么我们假设通过南部品种,从2°C的北方选择,从2°C的土壤中除去较少的水。通过将叶子水含量和植物水摄取在2℃和光合光子通量密度(PPFD)或附近的光合补偿中或在光补偿中进行测试,通过比较叶子水含量和植物水吸收来测试该假设。
结果与讨论
2°C处理缺乏光合作用净增益的证据
在4 μmol m-2S.-1FR和FS植物在2°C和2°C条件下6周后都保持健康的绿色,当重新水化并回到25°C时恢复生长。当将每个品种(和每个处理间隔)的6株植株的平均叶片干重(FDW)绘制在2°C下0、2、4或6周的持续时间上时,代表每个品种叶片干重变化率的斜率与0没有显著差异(数据未显示)。得出的结论是植物在光补偿区附近或处于光补偿区。
FR和FS植物叶片含水量在2°C下降的证据
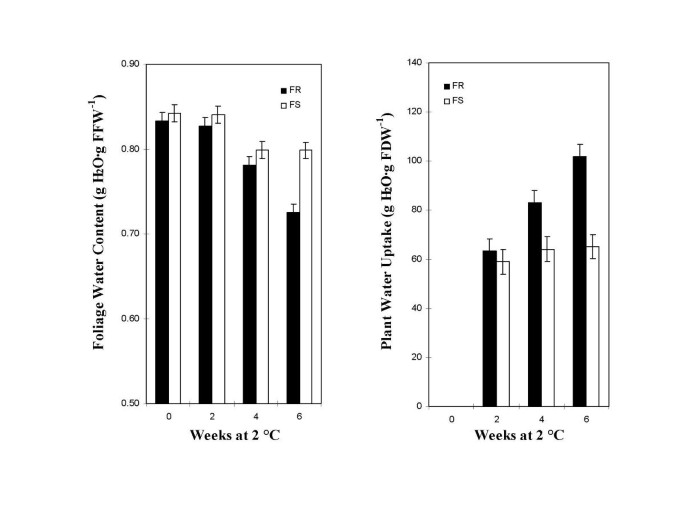
为了评估实验室系统与报告的现场结果的关系,在2°C下5周后,测定了FR和FS植物叶片水分含量的变化。叶片含水量降低至0.77 g H2O·G FFW-1相比于0.63 g H2O·G FFW-1在FR植物。这反映了FR植物叶片水分含量的较大降低,因为每个植物的起始量为0.85 g H2O·G FFW-1.因此,即使与植物水分状况此的近似测量值在FR和FS的叶子含水量差后2℃曝光证实。
进一步的试验是为了确定在我们的实验室条件下维持的植物叶片含水量下降的程度。叶片含水量值由叶片湿重和干重值测定,如方法所述。在80°C下干燥48小时,确保了样品的完全干燥,从而准确测定叶片干重。FR和FS植物叶片含水量在2℃下4周后也出现了类似的下降(图2)。1A).但在6周后,FR植物叶片水分含量降低了14%,而FS植物仅降低了5.8%。因此FR植物叶片含水量的差异降低与Martin在田间观察到的北方和南方选择HRWW基因型的差异相当[11.]和纳斯[14.在深秋。
从2℃的冰冻抗性(FR)和冻结易感(FS)小麦品种的植物的叶子含水量(FWC)和冻易感(FS)小麦品种。将五天幼苗移植一个气缸-1中,每个汽缸含有161克ODS并保持在约一个Ψm-0.002 MPa,在25°C条件下温室植物生长23 ~ 25 d。2°C暴露前调整基质电位至-0.004 MPa,不再加水。将植株转移到2°C的容器中,间隔时间可达6周。平均叶片含水量/叶片鲜重(g H2O·G FFW-1)或每次处理的FWC均取自三个试验中的三个植物。每条竖线表示平均值的标准误差。B.植物累积吸水量/叶片干重(g H)2o·g fdw-1)或PWU从Fig.中描述的相同FR和FS小麦植株中测定。1A.PWU计算为每2°C处理间隔期间,从每个圆柱体中除去的总水分与蒸发的总水分之间的重量差。将PWU标准化为植物的FDW。3个试验中,每个处理的平均PWU来自3个植物。每条竖线表示平均值的标准误差。
FR和FS植物在2°C下水分吸收差异的证据
确定了在2°C和低光强下FR和FS植物叶片水分含量的差异,如田间生长的植物,我们继续用重量法测量植物从土壤中吸收的水分。植物土壤系统的设计是为了测量植物的水分吸收,使水分通过蒸发流失的可能性最小化。因此,系统重量的减少只能归因于植物从土壤中除去水分或植物吸收水分。在2°C下测定2,4,6周后的植物平均吸水量(图2)。1B.).2周后FR和FS无显著差异,64 g H2o·g fdw-158 g H2o·g fdw-1,分别。此后,FS植物的吸水量基本保持不变,FR植物的吸水量增加到102 g H2O, 6周结束时(图。1B.).综上所述,FR和FS植物在2°C条件下都能吸收水分。但在整个6周内,FR植物的吸水量大于FS植物。在5周的研究中,FR和FS植物的水分吸收也得到了类似的结果。
最大植物水吸收由FR植物的检测在2℃
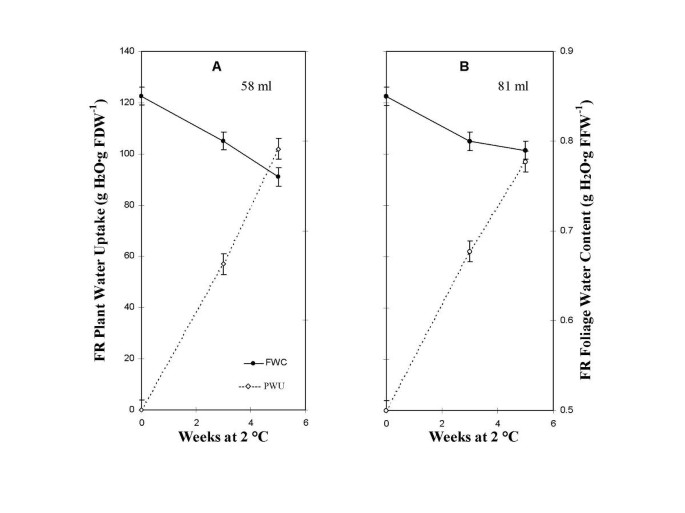
以上发现具有较大的植物水吸收的植物具有显着降低的叶子水含量,而不是FS植物可以反映FR植物的叶子水的更快损失,或者由于其植物水的快速速率而限制了FR可用的土壤水。为了测试后者,通过增加初始土壤含水量来测量FR植物水吸收。初始水量从50毫升汽缸增加-1(图1)至58 mL(图2)2A)或81毫升(图。2B.),在保持土壤基质势不变的同时,增加柱体尺寸和土壤质量。
植物吸水率由2°C下植物吸水率随工作周时间的斜率计算得出。从58ml供应的速率为20.3 g H2O·周-1(无花果。2A),而19.5 g H2O·周-1从81毫升供应(图。2B.).坡地间的相似性表明58 mL足以维持FR植物的最大吸水量。然而,更多的水的可用性最初从81毫升供应导致植物叶含水量减少,接近最初提供58毫升。因此,我们提供的证据表明,土壤水分不足5周期间没有FR叶含水量下降的原因。
北方HRWW基因型在2℃条件下的叶片含水量和植株吸水率
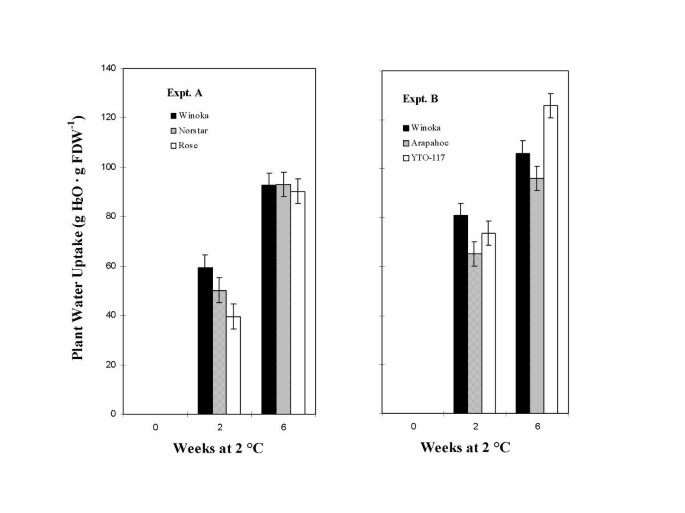
为了确定叶片含水量降低与植株吸水率之间的关系是否在其他北方选育的HRWW基因型中普遍存在,研究了另外4个HRWW品种。这些品种与FR一起具有优良的冻存记录,并作为北方大平原大田试验的标准[18.那19.].叶子的水含量的变化示于图中描绘。3A&3B..结果表明,Winoka、Norstar和Rose的叶片含水量在2周后与2°C暴露前相同。3A).6周后,Winoka、Norstar和Rose叶片含水量均下降,分别为0.63、0.62、0.64 g H2O·G FFW-1分别与0周值为0.82g h相比2O·G FFW-1.
比较了Winoka、Arapahoe和YTO-117三种植物叶片水分含量。3B.).与0.81 g H相比,2周后所有值均略有下降2O·G FFW-1在2°C暴露前(图3B.).而在2℃下6周后,Winoka、Arapahoe和YTO-117植株叶片含水量分别下降至0.60、0.55和0.64 g H2O·G FFW-1分别比初始的0.81 g H有所提高2O·G FFW-1(无花果。3B.).之后在图6周为Winoka甲稍大叶子水分值。3A与图相比。3B.说明实验B暴露2°C时相对湿度较低。
由此可见,在2℃条件下,这4个基因型的叶片含水量下降幅度与FR (Winoka)相似。作为一个组,叶片含水量在6周后显著降低。
植物水吸收结果如图1所示。4&4 b.Winoka,Norstar和玫瑰植物的浇水是图4.后以2℃2周,水吸收由玫瑰滞后稍微落后Winoka和北泰。然而后6周的水吸收由Norstar公司和Rose分别等于Winoka,所有明显增加相比植物的水吸收在2周(图值。4).比较了Winoka、Arapahoe和YTO-117对植物水分吸收的影响。4 b).2周后,这些基因型的水分吸收量相似,根据Winoka的反应,它们的水分吸收略大于Expt. A。6周后,植物吸收水分的模式也更大,尽管变化更大(图。4 b).
在本研究中使用的实验室条件下,在2℃下将叶子含水量降低的结果与福勒和卡莱的结果相似[20.],nass [14.马丁[11.].他们的研究在田间种植植物上进行,并在秋季期间显示了组织含水量。福等[13.]也表明,在田间或环境室内冷驯化过程中,组织含水量降低。在我们的研究中,叶片含水量的降低与植物水分吸收的增加相关(图。3.&4.).
基于气孔在冷驯化期间开放的假设,我们认为在2℃时FR植物比FS植物有更有效的水分运动。FR和FS植物之间的渗透电位差解释了这一现象。DeNoma等[19.发现,在田间较低的非冰冻温度下,抗冻品种的树冠渗透势较敏感品种下降更大。我们在叶片组织中也得到了类似的渗透势结果(数据未显示)。
结论
从这个有限的调查开始,我们已经证明,在我们的实验室条件下适应时,HRWW的FR基因型会降低叶子含水量。我们还表明,植物水摄取随时间在2°C时增加。我们得出结论,延长适应期间北方选定的HRWW基因型的叶子水含量降低了不是由于Limin和Fowler提出的根液压导致的损害[15.].相反,组织缺水是由于在这个温度下吸收的水分不足以补充树叶失去的水分。
我们的结果表明,北方选择的基因型叶片水分含量的下降是由于在2℃下气孔导度的提高。气孔孔径的控制比较复杂。在这些实验条件下,我们排除了光合作用的影响,因为在冷驯化期间,光照强度没有达到导致叶片干重增加的水平[21.].
威尔默和弗里克[22.]报道了植物的气孔在低温下可能会关闭或打开,这取决于植物的基因型和种类。也有报道称,蓝光在低光照下特别有效,因为普遍认为低阈值响应。此外,保卫细胞的蓝光反应与叶绿体驱动的CO变化无关2这也会导致气孔打开[22.].因此,在4μmolm的辐照度下-2S.-1在2°C暴露期间,北方HRWW品种的叶子含水量降低可能是由于蓝光而不是光合反应产生的气孔导度。
方法
植物材料
在美国大平原种植的两个HRWW品种是调查的主要基因型:在南达科他州发布的“Winoka”[23.和在德克萨斯州发行的TAM W-101 [24.].据南达科他州实验站的记录,Winoka(北方选择的)通常具有比更大的立场生存排名TAM W-101在北部大平原(南部选择)25.].因此,Winoka被指定为抗冻(FR), TAM W-101被指定为抗冻(FS),这是之前报道的HRWW品种“抗冻”术语的修改[26.那27.那2].还评估了四种额外的北方选定品种的水状况:'Norstar'[28.),“玫瑰”(29.gecc],”瑞银”(30.还有1956年选自蒙大拿州的实验性台词《YTO-117》(YTO-117,詹姆斯·伯格(James Berg)著,《个人沟通》(personal communication))。
土壤混合与土壤水分(SW)调整
土壤混合物分别由2:1:1体积的淤泥壤土(维也纳细壤聚的UDIC haploboroll),沙子和泥炭组成,下文分别描述为土壤。在80℃下干燥48小时后测定烘箱干燥土壤(ODS)质量。土壤的堆积密度为1.13±0.01千克L.-1最大水持量为0.50±0.01千克千克-1在土壤基质势(Ψm)零。最初调节土壤水以在混合过程中和之后保持均匀的颗粒分布。通过张力表和压力板程序评估土壤原理电位[31.,土壤水分值在0.10 ~ 0.50 kg H之间2o·kg ods-1.Van Genuchten函数[32.]用来绘制数据图。每个样本的平均土壤水分值转换为Ψm使用这个绘图。
植物生长容器
植物在丁酸盐圆筒中生长,尺寸为3.8×19或4.4×19cm(直径×高度)。用具有两个狭缝的聚乙烯帽关闭每个圆柱的底部,插入1.3×23cm(宽度×长度)芯的末端插入了吸收纸的末端。这些端部延伸到气缸中并辅助土壤水分布。
洗涤干砂(30±0.3克)加入到每个气缸。接着,约160g ODS相当于加入到3.8×19厘米的园柱体,或约225克ODS 4.4×19厘米的园柱体。ODS质量用于计算水所需以获得所需的Ψm每个实验。
种子发芽和移栽幼苗
船长处理的种子在25°C无光下发芽,在吸附纸上用10-4中号氯化钙2.将种子萌发的用品高压灭菌,用10%的商业漂白剂处理,或浸入70%乙醇中。在开始发芽后,幼苗移植到土壤5d,每个圆柱体。
植物的生长
利用提供150 μmol m光合光子通量(PPFD)的低压钠蒸汽灯补光至少能维持14 h的光周期-2S.-1.植物在温室中生长大约23±2 d,取决于最佳太阳辐射3 d的确切间隔之前至2℃曝光(这确保足够photosyntate维持冷驯化期间健康的植物)。相对日常辐射光源相比,6月21日收到的充满阳光圣,那就是团结。在2°C处理前的最后3 d,当接收到的辐射能小于0.80相对单位时,被丢弃。每天监测温室内30.5厘米的辐射事故2太阳能板。气温维持在21 - 26°C之间。
之前,期间2℃曝光最后的5 d植物生长的,在所有植物容器土壤每日调节至所需的Ψm与水。在2°C前,植株处于4- 5叶生长期。
植物暴露在2°C
冷驯化是在设置为2°C±1.5的室内完成的。根据湿/干球测量结果计算,白天的平均相对湿度为69%±4%,夜间为84%±5%。诺贝尔(33.报道了8 ~ 16 μmol m的PPFD光补偿-2S.-1用350微摩尔CO2摩尔-1在20°C。在2℃时,PPFD为4 μmol m-2S.-1(在冠层高度)在本研究中使用,在11.5h光周期期间从冷白荧光灯供应。这是灰色等人报道的最低辐照度下降10倍。[21.].根据制造商的规格,荧光灯的光谱包括370和450 nm波段。
在2°C时测量植物水吸收(PWU)
在将幼苗转移到2°C之前,取下每个圆柱体外的灯芯。为了进一步减少蒸发损失,将parfilm (Am Natl Can)紧密包裹在每个圆柱体的顶部和植株的秆上。蒸发土壤水分(ESW)由类似包裹的圆柱体估算,但在2°C暴露前去除茎密封上方的叶片。
在指定时间(T)期间从圆筒中除去的土壤水量由两者组成(PWU)T.)和ESWT..这个词(ESW0.- ESWT.)为t = 0到试验间隔t之间无叶圆柱蒸发水分的量0.)和最终土壤含水量(SWT.)在放置在2℃时,从沿着秆密封上方移除的圆柱体的气瓶中的重食。SW之间的差异0.和西南T.反映了植物占用的水量(PWU)。
因此,
PWUT.= (SW0.——西南T.) - (ESW0.- ESWT.),
在每个实验中,至少两个对照柱体(包含无叶植物)随机间隔在植物之间,从中获得平均ESWT.计算出来。
PWU以每株叶片干重(FDW)为标准。初步试验将FDW与每个FR和FS品种的6株植株的总叶面积进行了比较,面积由Delta-T图像分析系统(Dynamax Corp)确定。叶面积与FDW相关,FR和FS植物的相对PWU表达为g H2o·g fdw-1.
叶含水量
在每个2°C处理间隔结束时,在离土壤表面2 cm的地方切除每株植株的叶片。叶片含水量(FWC)由叶片鲜重(FFW)和叶片干重(FDW)测定,公式为FWC = (FFW - FDW)·FFW-1.
FDW在80℃下干燥叶子48小时后测定。FWC表示为G H2O·G FFW-1.
参考资料
- 1。
三文鱼SC:平原硬红冬小麦改良。见:《技术通讯》第1192期,华盛顿特区:政府印刷办公室。1959,1-117。
- 2。
Worzella WW, Cutler GH:影响冬小麦抗寒性的因素。美国农学学会学报。1941,33:221-230。
- 3。
安卓JE:由于受硬化和硬化温度的持续时间发芽小麦的抗寒性。加拿大杂志植物科学。1960年,40:94-103。
- 4.
Kenefick DG, Swanson CR:冷驯化冬大麦线粒体活性。作物科学。1963,3:202-205。
- 5.
Guy CL:冷适应和冰冻胁迫耐受性:蛋白质代谢的作用。植物生理与分子生物学进展。
- 6.
科斯特KL,林奇DV:彪马黑麦的冷驯化过程中溶质积累和区域化。植物生理学。1992年,98:108-113。
- 7.
马休斯,马邓恩:植物适应低温的分子生物学。中国生物医学工程学报,1996,26(4):451 - 457。
- 8.
Grossi M, Giorni E, Rizza F, Stanca AM, Cattivelli L:野生大麦和栽培大麦在不同光照和温度条件下,一个冷调节基因家族的表达模式存在差异。植物生态学报。1998,28(4):461 - 469。10.1023 /: 1006079916917。
- 9.
植物冷驯化:抗冻基因及其调控机制。植物营养与肥料学报。1999,19(5):531 - 534。10.1146 / annurev.arplant.50.1.571。
- 10。
在拟南芥冷驯化过程中光合碳代谢的改变:斯蒂特男,快点五:植物四季皆宜。CURR OPIN植物生物学。2002年,3:199-206。10.1016 / S1369-5266(02)00258-3。
- 11.
马丁JH:小麦冬季耐寒性的比较研究。作者:王莹,农业研究CHINESE。1927年,35:493-535。
- 12.
陈培培,古斯塔夫吕:水对冬季谷物耐寒性的作用。植物抗寒性与冰冻胁迫:机理与作物意义。作者:李丕生,酒井A. 1978,学术出版社,纽约,165-173。
- 13。
傅平,韦伦RW,吴光华,Robertson AJ, Gusta L:冷驯化过程中春冬季谷物脱氢酶基因表达和叶片水势的差异。acta botanica sinica(云南植物学报). 1999,29(4):593 - 598。
- 14。
加拿大大西洋地区冬小麦和秋黑麦植株水分含量与抗冬性的关系。acta botanica sinica(云南植物学报),2003,31(6):643 - 648。
- 15.
李敏,李志伟,李志伟,等:1985不同温度条件下冬小麦组织各节段抗寒性的研究。作物科学,1998,25:838-843。
- 16.
Bolger TP,普通博士,McMichael BL:温度效应棉根液压电导。环境与实验植物学杂志。1992,32:49-54。10.1016 / 0098-8472(92)90029-2。
- 17.
小麦根系冷却对叶片生长的快速抑制:动力学和机理。acta botanica sinica(云南植物学报). 1993,44(6):653 - 658。
- 18.
泰勒GA:蒙大拿州冬小麦育种和生产。见:冬小麦生产的新领域,加拿大西部冬小麦会议论文集。编辑:DB Fowler, LV Gusta, AE Slinkard, BA Hobin. 1983,萨斯喀彻温大学印刷服务,萨斯卡通,加拿大,102-119。
- 19.
Denoma TJ,Taylor Ga,Ferguson H:冬季燕麦冠的渗透潜力,用于比较冬季古老的品种。农艺学期刊。1989,81:159-163。
- 20.
王志强,王志强,王志强:玉米籽粒生长发育与耐冷性的关系。作物科学。1979,19:915-922。
- 21.
灰色GA,肖LP,Sarhan楼魂儿NPA:冷驯化和耐寒性:光线和温度的复杂的相互作用。植物生理学。1997年,114:467-474。
- 22。
Willmer C,Fricker M:对环境因素的气孔响应。在:气孔:植物功能生物学中的主题。编辑:Black M,Charlwood B. 1996,伦敦:Chapman&Hall,126-191。2
- 23。
Wells DG, Lay CL, Buchenau GW, Johnson VA, Finney KF: Winoka小麦注册。作物科学,1999,9:526。
- 24。
Porter KB:TAM W-101小麦的注册。作物科学。1974,14:608。
- 25。
小麦低温特异基因tacr7的cDNA结构和表达模式。植物营养与肥料学报。1997,34(4):457 - 461。10.1023 /: 1005852703506。
- 26。
Klages KH:土壤含水量与小麦幼苗耐低温性的关系。中国农学杂志,1996,18:184-193。
- 27.
Weibel Ro,Quisenberry Ks:现场与控制冻结作为冬小麦品种的抗寒抗性。影响冬小麦耐寒性的因素。美国农艺学会杂志。1941,33:336-341。
- 28.
授予MN: Norstar小麦登记。作物科学,2000,20:552。
- 29.
Wells DG,Bonnemann JJ,Gardner Ws,Finney Kf,Geise Ha,Styymiest Ce:Rose小麦的登记。作物科学。1982年,22:1265。
- 30.
Baenziger PS,Schmidt JW,Peterson CJ,Johnson Va,Markn PJ,Drier AF,Mcvey DV,Hatchett JH:Arapahoe小麦的注册。作物科学。1989年,29:832。
- 31.
Klute A:保水:实验室方法。见:土壤分析方法,第1部分:物理矿物学方法。编辑:Klute A. ASA特别出版物编号9。麦迪逊:ASA, CSSA, SSSA, 635-662。
- 32.
Van Genuchten Mth:一种用于预测不饱和土水力导电性的闭合形式方程。美国土壤科学学会。1980,44:892-8。
- 33.
诺贝尔PS:物理化学和环境植物生理学。圣地亚哥:学术出版社。1991,393-472。
确认
作者非常感谢T.E.舒马赫为土保水的测量和技术咨询。我们要感谢露辛达·奥尔森为协助起草的手稿。种子储备慷慨BE达雷尔韦森贝格和工作人员,全国小杂粮种质资源设施,阿伯丁,ID,83210.从南达科他州小麦委员会这项研究的部分资金表示感谢提供。南达科他州进出口。测站。期刊文章3192。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
所有作者同等贡献。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
Kenefick,D.G.,Koepke,J.A.&Sutton,F.植物用水充满了红色冬小麦(小麦在2°C和弱光强度下的基因型。BMC植物杂志2,8(2002)。https://doi.org/10.1186/1471-22229-2-8
收到了:
接受:
发表:
关键字
- 光合光子磁通密度
- 冷适应
- 北部平原
- 土壤基质势
- 组织含水量