摘要
背景
局部感染坏死性病原体可诱导整个植物对继发攻击免疫。致病相关基因与这种系统性获得性抗性反应平行诱导,并被认为是共同调控的。共调控假说已被拟南芥的诱导所挑战PR-1但不是系统性的获得性抗性npr1突变植物响应两携带毒力基因的avrRpt2.然而,实验NDR1.突变植物揭示了无毒基因之间的主要差异。的NDR1-1.突变可预防过敏细胞死亡,全身获得性阻力和PR-1由携带细菌引起的诱导avrRpt2.这种突变并不能阻止这些对携带细菌的反应AVRB..
结果
系统获得性耐药,PR-1诱导和PR-5归纳评估比较npr1-2和NDR1-1.突变体植物,双突变体植物,野生型植物。4个株系均表现出系统获得性抗性两细菌携带AVRB..PR-1在对任一菌株的反应中,任一单一突变体的诱导部分受损,但在对任一菌株的反应中,仅在双突变体中完全受损avrRpt2.PR-5响应于无毒性基因,任何突变体都没有完全受损。
结论
两条途径加剧,而不是义务等级时尚,以诱导全身获得的阻力,PR-1和PR-5.其中一个途径是NPR1依赖于与超敏感细胞死亡相关的信号另一个途径依赖于水杨酸的积累并通过NPR1.至少有另外两种途径也有助于PR-5归纳。
背景
在对坏死病原体局部感染的反应中,植物对二次感染表现出整体增强的免疫力(系统获得性抗性或SAR) [1].一组被称为致病相关的特征基因(PR.)与SAR诱导平行在局部和远端组织中诱导[2].已经显示出水杨酸(SA)的积累是为了诱导SAR [3.].
拟南芥的NDR1-1.突变体的SAR和PR-1基因表达对感染的反应两携带无毒性的细菌(avr的)基因avrRpt2[4].这种突变体也不能对这些细菌表现出超敏反应(HR) [5,6]除非接种量非常高[7].HR是一个宏观的叶子坍塌。HR发生在对感染无毒细菌的反应中,其接种量导致很大比例的叶细胞经历程序性细胞死亡(PCD) [8].与结果相反avrRpt2, p .两携带无流动基因的细菌AVRB.,avrRpm1,avrPphB或AVRRPS4.引出一个夸大的人力资源相对于野生型的哥伦比亚父母[5,7].在一项研究中,细菌携带AVRB.被选为这个班级的代表成员,与之形成进一步对比的是avrRpt2,这些细菌能够引出SAR和PR-1上的感应NDR1-1.突变体植物(4].
然而,诱导SA积累NDR1-1.突变的植物在早期的时间点受到损害,对携带这两种细菌的反应程度相似avr的基因(4].这些结果表明,至少两个途径控制SAR和PR-1基因的表达。一种途径直接依赖于SA的积累。第二条途径不直接依赖于SA水平。引出HR的能力和引出SAR的能力之间的相关性PR-1诱导得出第二种途径是由与超敏感细胞死亡相关的信号引起的模型。尽管在接种后的最初12小时内SA的积累严重受损NDR1.植物,细菌携带AVRB.仍然可以诱导PR.基因表达与SAR的关系与hr相关途径有关。细菌携带avrRpt2不能因为这两个途径受到损害NDR1.突变。本研究无法解决关于单独的HR相关途径是否足以诱导SAR和PR-1因为SA的积累确实发生在反应的后期。
据报道,合成孔径雷达的诱导依赖于NPR1基因(9- - - - - -11.].在这些研究中,既不是SA / SA类似物也不能够诱导SARnpr1突变体植物。本实验测定的合成孔径雷达生物诱导剂为p .两细菌携带avrRpt2.相比NDR1.植物,npr1植物确实显示了人力资源的响应p .两携带avrRpt2(数据没有显示)。这些结果表明,hr相关途径不足以诱导SARNPR1-依赖的sa相关通路(但见下文,为什么这个结论是不正确的)。
与SAR诱导相比,PR-1被证明是由无毒细菌引起的npr1突变体(11.].然而,它在程度和延迟上有所减少。如果npr1突变体确实完全在SAR诱导中完全阻塞,然后通往途径PR-1归纳法不可能与导致SAR的归纳法相同NDR1.突变植物,HR“触发”响应avrRpt2/RPS2组合的反应比那要弱AVRB./RPM1[4].较弱的“触发”导致在HR早期接受PCD的个体细胞的概率较低,在由增加的SA水平造成的增强之前[4,12.].信号引起的avrRpt2在许多方面明显不同于由他人指导avr的基因。携带细菌的使用AVRB.将允许更严格的测试是否NPR1-依赖途径对合成孔径雷达信号的诱导至关重要。
澄清管辖SAR和PR.基因诱导,我们构建了一个NDR1./npr1双突变体。将该株系与野生型哥伦比亚拟南芥和两种单突变株系进行比较,表明该株系具有生物诱导的能力PR.基因的表达。我们得出SAR,PR-1诱导和PR-5诱导是由我们之前描述的两条途径平行调控的[4,但这些途径的作用是附加的,而不是强制性的协同作用。此外,其他途径也有助于PR-5归纳。
结果
DC3000•诱导系统获得性抗性AVRB.
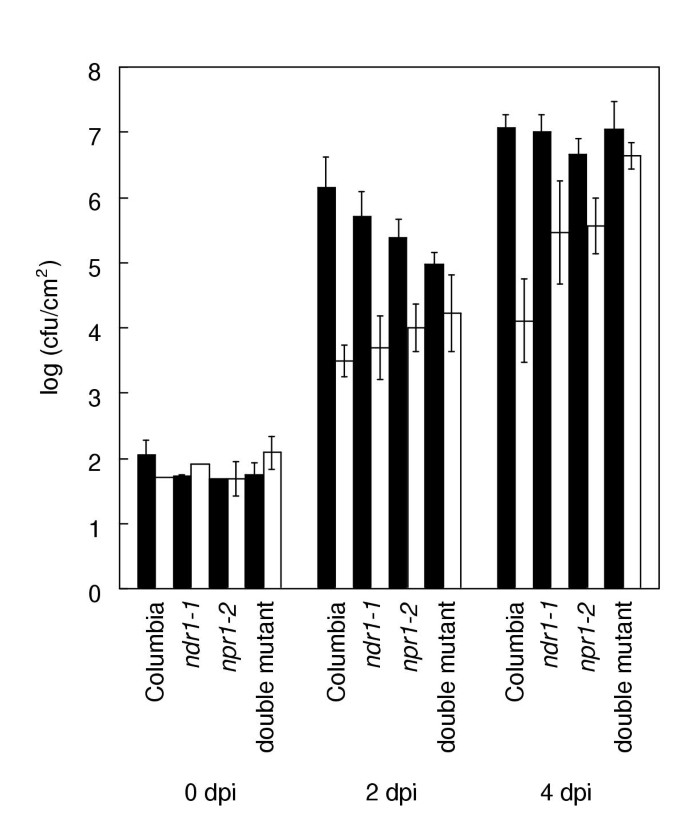
如果NPR1是特区政府所必需的[9],npr1突变体植物不应能经受SAR的响应p .两pv。番茄DC3000(以下简称DC3000)携带AVRB..或者,如果HR相关信号导致SAR独立于NPR1, DC3000•AVRB.也许能引出SARnpr1植物。实验结果如图所示1.在哥伦比亚,预先接种DC3000•的野生型植株中,毒性细菌的生长减少了3个数量级AVRB..SAR也被显示NDR1-1.突变体植物。这些结果与先前发表的结果相当4].清晰的SAR也显示npr1-2突变体。SAR响应具有统计学意义(学生的t测试中,P<0.05)在该实验中的所有三条线和复制实验中。该测定对定量线路之间的SAR差异不够敏感。但是,很明显,所有三条线都表现出SAR。由于突变线两种突变线都是无效的等位基因(以前建立的NDR1-1.[6并在下面为之争论npr1-2)的假设NPR1是必需的,因此被拒绝。
为了测试这些突变体之间的外观关系,构建双突变体(参见方法)。还测试了双突变体的SAR响应DC3000•AVRB.(图1).有统计学意义的SAR出现在两天时间点,但没有在四天时间点(学生的t测试中,P< 0.05)。在重复实验中,SAR仅在4天时间点有统计学意义。因此,两种突变的结合足以消除大多数SAR反应。残差SAR可能是由于HR相关信号,双突变体对DC3000•显示HRAVRB..宏观的HR表型被夸大了,就像NDR1-1.单突变体(数据未显示)。
诱导PR-1基因表达响应DC3000•AVRB.和DC3000•avrRpt2
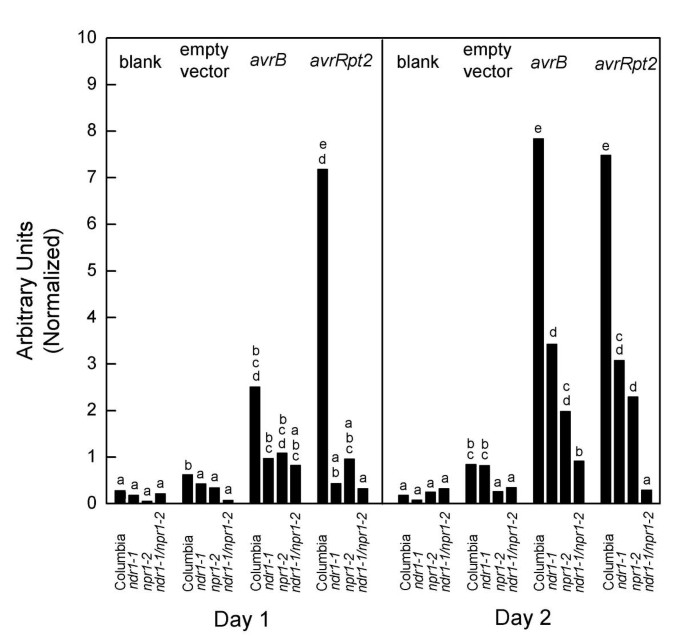
我们之前讨论过这个问题PR-1基因表达由两种不同的途径控制[4].一条途径由SA积累产生,依赖于NPR1基因产物。第二种途径来自于与HR相关的信号NPR1独立。的ndr1-1 / npr1-2用双突变体进一步验证这一假设。
对双突变体、每个单突变体和哥伦比亚野生型植株进行1 × 10侵染6细菌ml.-1.在这种水平的接种级别,大多数叶细胞没有接受PCD(数据未显示)。因此没有看到宏观组织塌陷,允许PR-1用Northern印迹法对基因表达进行定量。数据显示在图中2.哥伦比亚野生型拟南芥表现出高水平的PR-1响应DC3000的诱导•AVRB.或DC3000•avrRpt2.的水平PR-1与哥伦比亚相比,任何一个突变株对任一菌株的诱导都大大降低。然而,两个单突变体仍然显示出来PR-1在2天时间点诱导对任一菌株均有反应。的水平PR-1双突变体对DC3000•的响应avrRpt2与响应DC3000的响应而显着不同,没有显着差异•空向量或MgCl2空白(学生的t测试中,P> 0.05)。在本实验中,当没有PCD和NPR1活性被突变阻断时,没有诱导PR-1导致。相比之下,DC3000•AVRB.确实引起了非常重要的PR-1感应(学生的t测试中,P与DC3000•空向量或空白相比< 0.01)。由于NPR1活性被突变阻断,pcd相关信号可能解释了残留PR-1归纳。这些结果证实了最初的模型,即两种途径PR-1诱导是添加剂。
响应DC3000的PR-5基因表达诱导•AVRB.和DC3000•avrRpt2
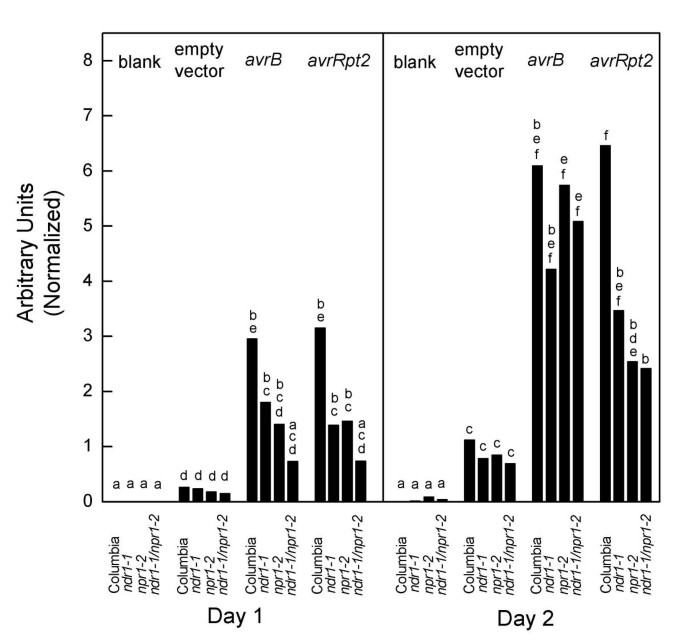
以添加剂时尚作用的两个假设途径足以解释SAR的细菌诱导PR-1基因的表达。接下来进行实验,将模型扩展到控制PR-5归纳。DC3000•avrRpt2或DC3000•AVRB.被接种到ndr1-1 / npr1-2双突变植物,单突变体或哥伦比亚野生型植物。PR-5通过北方印迹定量基因表达。数据显示在图中3..在一天的时间点,双突变体表现出明显的损伤PR-5相对于野生型响应于无毒的细菌菌株(学生)的诱导(学生t测试中,P< 0.05)。然而,在两天的时间点,只有DC3000•的损伤avrRpt2在这个水平上具有统计学意义。如果将统计学显著性差异的标准放宽到P < 0.1,则显示相同的定性图片PR-1单突变体与哥伦比亚野生型的比较。哥伦比亚植物在这一显著性水平上与NDR1-1.或npr1-2诱导的植物PR-5响应DC3000avrRpt2在两个时间点。这些结果与PR-5诱导来自hr相关途径和SA/NPR1端依赖途径。然而,PR-5在DC3000•实验中,尽管两条通路都被阻断,但基因仍然表达avrRpt2还有双突变体。这一结果与我们所看到的非常不同PR-1显然,我们所描述的这两种途径并不能构成导致PR-5基因的表达。
感应的PR-5基因表达实验步骤和数据分析采用相同的方法PR-1基因表达实验(图2).
讨论
PR.基因被认为与SAR密切相关,因为它们与SAR共同调控[13.,14.]而且因为很多PR.基因产物已被证明具有抗菌活性[2].完全损害npr1感应合成孔径雷达的植物[9]与部分损伤形成鲜明对比PR-1感应(11.对…作出反应p .两携带avrRpt2挑战共调控的假设。然而,avrRpt2与其他特征明显不同P.Syringae AVR.引发的反应中的基因NDR1.突变体植物(4,5,7].对共同监管假说的明显挑战,可能是因为选择了一个非典型案例avr的基因。因此,SAR和PR.基因表达的npr1突变植物对第二次的反应被评估avr的基因(AVRB.).得到了明显不同的结果。突变体npr1植物在合成孔径雷达的诱导下并没有完全受损,PR-1基因表达或PR-5基因表达对p .两携带AVRB..这些结果与协同调节假说一致。明显的NPR1- 响应细菌携带的SAR诱导依赖性avrRpt2很可能是量化的,而不是定性。
对这些结果的另一种可能解释是突变基因产物在所使用的植物系中的残留功能。的NDR1-1.突变体是一种明确的零突变体,因为一个缺失删除了大部分编码区域和近端启动子区域[6].然而,没有一个特征npr1突变体有很大的缺失[15.,16.].因此,在基因表达或真菌抗性分析中,试图定义等位基因序列依赖于与这些突变相关的剩余功能水平[15.,16.].然而,导致这些输出信号的复杂性使这些表型的分析复杂化。一个“空”突变体仍然可能表现出不需要相应基因产物的途径引起的基因表达或抗病能力。
所需要的是一种分析,在这种分析中,输出仅仅是由于一个NPR1端依赖途径。图中提出的实验2提供了此类数据。组合npr1-2与NDR1-1.在双突变体中阻止了avrRpt2-在使用的条件下引出HR。在此条件下,DC3000•avrRpt2未能引出任何PR-1基因表达(水平与接种MgCl在统计学上没有区别2空白)。在双突变体(Zhang, Gutsche and Shapiro, manuscript in preparation)中SA积累的损伤类似于NDR1.单突变体(4在发病前的早期时间点NPR1-依赖于SA积累的负反馈[10.,11.].然而,在本文报道的SAR和PR基因表达实验中,SA的积累可能发生在时间点。
该分析仅依赖于NPR1功能。完全缺乏PR-1归纳支持我们的争论npr1-2确实是零突变体或可能是严重的戊瓣。发布的数据进一步支持此争用表明npr1-2在双杂交试验中,等位基因未能与假定的目标TGA转录因子基因相互作用[17.或在…在活的有机体内,报告基因分析[18.].的治疗npr1-2外源性SA的幼苗不能诱导增加PR-1在某些实验条件下的基因表达[19.尽管并非在所有情况下[15.].因此,这里提出的结果是由使用的突变系中残留的基因产物功能引起的潜在替代解释是不正确的。
SAR和PR.基因表达的共同调控也受到了实验的挑战eds5和sid2突变体(20.].这些突变体与SA的生物合成有关。他们在PR-1对细菌的诱导反应与NDR1.植物,但是在损害的情况下边缘PR-2或PR-5归纳。与这里提出的结果进行直接比较需要解决一个可能影响该研究的解释的问题。在这个研究中,PR.基因表达从已感染1×10感染的叶子的未感染部分定量8毫克-1DC3000•avrRpt2.这一水平的接种量足以导致对DC3000•空载体产生“假阳性”虚假hr样反应[5].实际上,当sid2用2×10接种突变植物7毫克-1DC3000•avrRpt2,未见HR(数据未显示)。
引用的研究中使用的高水平接种剂只能在不引起“假阳性”HRs的情况下使用,如果不是拟南芥病原体的细菌菌株被用于传递avr基因产品[5,7].当sid21 × 10接种植株8毫克-1非病原体菌株(p .两pv。glycinea比赛5)携带avrRpt2,见hr(数据未显示)。两种菌株背景的结果相同,说明引物的结果具有相似性sid2在高水平细菌接种的条件下,突变植株克服了突变的一些影响。的NDR1-1.在高接种量下也能克服突变。然而,这个水平NDR1-1.表型被克服高于sid21×10的表型9毫克-1一种非暴力应变携带avrRpt2需要产生可复制的HRsNDR1-1.植物(7].
显然,对结果的解释与PR-5归纳法在很大程度上取决于实验设计。相对未受损伤的PR-2和PR-5感应的sid2植物可能暗示hr相关信号在数量上比sa相关信号更重要。同样的两条路径被用来解释SAR和PR-1归纳可能会占PR-2和PR-5如果这个假设是正确的。
然而,本文给出的结果有力地证明PR-5诱导确实与SAR或有不同的调节PR-1归纳。这两种途径被确定为对PR-1和合成孔径雷达的诱导被证明有助于PR-5归纳。然而,重要的PR-5双突变体对DC3000•的反应发生了诱导avrRpt2(图3.).DC3000•avrRpt2在哥伦比亚或npr1-2植物,但不是在NDR1-1.植物或双突变植物(数据未显示)。因此,这些结果不能用hr相关信号或sa相关信号来解释,NPR1端依赖信号。肯定有其他的途径PR-5归纳。这一结论与原文的解释是一致的PR.基因表达数据eds5和sid2突变体,PR-1和PR-5被调节不同[20.].
数据显示在图中2和3.建议必须至少有两种额外的途径贡献PR-5归纳。DC3000•空向量没有引起重大PR-1在任意时间点(学生的t测试中,P> 0.05)。然而,类似的实验PR-5归纳法给出了相反的结果。此外,在这两个时间点PR-5用DC3000感染引发的诱导•空载体在类似的范围内,无论等位基因状态如何NDR1或NPR1位点(无统计学显著差异,学生的t测试中,P> 0.05)。这些细菌引发了PR-5基因表达尽管缺乏功能avr的PCD的缺失,以及两者的突变NPR1和NDR1基因。即使是大肠杆菌已被证明诱导植物防御相关的基因表达[21.,细菌可以通过许多不同的信号通路引起植物基因表达的变化,这并不奇怪。事实上,细菌的保守特性可以通过不同于基因对基因抗病相关途径的途径作为基因表达的诱导子[22.].
然而,另一个途径导致PR-5源自源自的基因表达avrRpt2功能也必须存在。DC3000•avrRpt2没有统计学意义的诱导PR-1在任何一个时间点(学生的t测试中,P> 0.05)。然而,明确的归纳PR-5在类似的实验中得到了证实。的水平PR-5对DC3000•空载体(学生的t测试中,P< 0.05)。由于双突变体对该菌株引起的疾病敏感(数据未显示),可能该残留基因的诱导是由于毒力功能avrRpt2[23.].突变体npr1植物先前被证明在诱导中受损PR-1但不是PR-5以对付致命细菌病原体[19.].
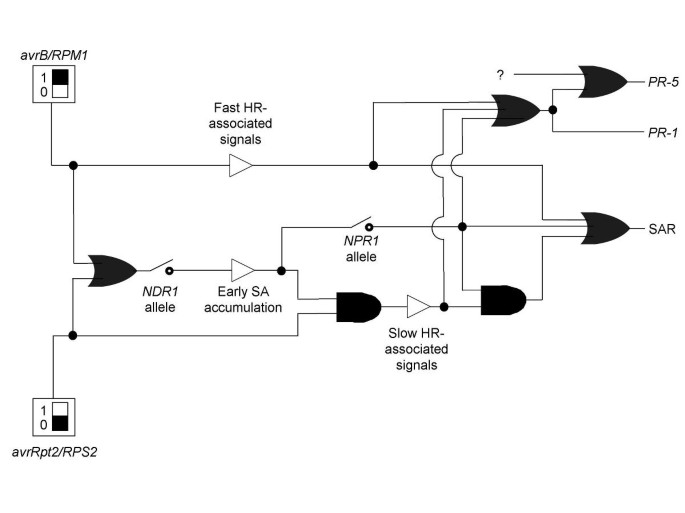
这些细节呈现在用于诱导SAR的信令网络的模型中,PR-1基因表达和PR-5基因表达由无毒p .两细菌(图4).我们使用了最近为植物信号转导网络提出的一种表示方案,该方案基于工程和计算机科学中使用的布尔形式[24.].显示的两个“发电机”中的任何一个都可以引起信令。一台发电机是携带功能性的植物感染RPS2等位基因携带细菌avrRpt2.第二发电机是携带功能性的植物感染RPM1等位基因携带细菌AVRB..一个“或”门被用来表明两种诱导信号都导致了SA的积累。的NDR1等位基因状态用“开关”表示。的NDR1-1.等位基因被描绘成一个类似于电子开关的接触是在一个开放的位置,损害早期SA积累。
信令网络的布尔表示用于表示等位基因状态的二进制开关NPR1和NDR1轨迹根据工程文本中的标准描述进行渲染。根据Genoud, Trevino Santa Cruz和Métraux [24.].信号发生器被渲染为矩形,其中的黑盒子设置为1或0。“或”门表示任意一个输入足以给出指定的输出,呈现为左侧凹的弹珠形状。“和”门表示两个输入都需要给出指定的输出,呈现为左侧平坦的子弹形状。作为下游事件的输入的信号输出被呈现为开放三角形。路径中的分支用填充的圆圈表示,以表明与电路图中的接触点的相似之处。
HR的反应会更慢avrRpt2而不是回应AVRB.[4,25.,26.].然而,已经提出了证据,HRS之间的差异不仅仅是动力学的差异[27.].这样,avrRpt2引起了人力资源和AVRB.-诱导的HR被描绘成两个独立的组成部分。在标准条件下,NDR1-1.突变植物没有表现出avrRpt2引起人力资源。一个“和”门被用来表示两者感染携带细菌avrRpt2并且需要早期积累SA来表达特征,“慢的人力资源”。相比之下,NDR1-1.突变植株确实表现出携带细菌的HRAVRB..一条不通过门连接到SA积累的直线就会导致“快速hr相关信号”。
SAR由具有三个可能输入的“或”门控。作为DC3000•AVRB.引起了SAR在NDR1-1./npr1-2双突变体,这些基因产物都不是SAR诱导必不可少的。早期的SA积累也不可能是必不可少的,因为这是显着损害的NDR1-1.突变。但是,特征AVRB.- 在双突变体中发生了“快速HR”。这样,从“快速HR相关信号”中导出的直线是此“或”门的输入之一。另一个输入是“和”门。要求此门的证据是DC3000引发的SAR•avrRpt2被一个npr1突变(9]或者NDR1.突变(4].我们得出结论avrRpt2-诱发的“慢HR”只有结合才能促进SARNPR1-依赖的早期sa诱导信号,需要“和”门。最后的输入是由sa引起的,NPR1单独作用的依赖信号[10.].
PR-1感应也通过一个“或”门与三个可选输入。单独的“快速人力资源”(本研究),单独的“慢人力资源”[11.]或Sa-lijited,NPR1端依赖信号(9- - - - - -11.每一个人都足以给予PR-1归纳。感应的PR-5基因表达也可以通过这三个输入中的任何一种独立作用。但是,我们(这项研究)和其他人[19.,20.已经有证据表明其他途径也会导致PR-5归纳。这样,PR-5由“或”门控。一个输入是来自“或”门的分支点PR-1归纳。第二个输入显示为问号。本文已经提出了证据,即该第二输入代表至少两个途径。然而,这些途径的细节是不知道的,因此不被描绘。
没有尝试代表图中信号传导事件的动力学4.布尔形式主义可以通过使用门控延迟来合并动力学信息。基于微分方程的动力学建模是捕获丰富的信号网络动态的另一种方法[28.,29.].由于时间分辨数据集可用,并且反馈循环删除,可能需要使用这些方法来理解系统动态和控制[30.].然而,作者同意Genoud et. al.(2001)在该工作和图中使用的方案4本文对信令网络拓扑结构的描述具有一定的优势。这种形式允许通过使用“或”和“和”门,将附加信号与强制性协同信号相互作用明确区分开来。
结论
总之,两个途径的添加剂效应解释了最多的诱导SAR和PR-1检测了无毒细菌的基因表达。其中一条通路来自与超敏感细胞死亡相关的信号NPR1独立。另一个途径来自于SA的积累和信号通过NPR1.相比之下,PR-5由无毒细菌诱导涉及至少两个额外的途径,也以一种加性的方式起作用。
方法
细菌和植物生长
两是根据已发表的方法培养的[31.].如前所述,拟南芥在HTPC步入式室(Conviron, Winnipeg, MN)或MTR-30 reach-in室(Conviron, Winnipeg, MN)中生长[4].哥伦比亚,NDR1-1.和ndr1-1 / gl-1所使用的种子已在前面描述过[4,5].种子npr1-2和SID2-1Jane Glazebrook(Torrey Mesa Research Institute)和Christiane Nawrath(Friborg大学)博士慷慨地提供突变体。
隔离和验证ndr1-1 / npr1-2双突变线
的NDR1-1./npr1-2利用紫花苜蓿的花粉产生双突变体npr1-2使植物的花受精ndr1-1 / gl-1工厂。通过f的叶子的毛茸茸(非无毛)表型验证了十字架的成功1工厂。从5周龄的F2来自这十字架的后代npr1-2检测或培养的根从F3.种子NDR1-1.检测。
的NDR1-1.如前所述,通过Southern blotting检测到缺失[6].制作放射性标记的探针,一部分NDR1利用基因座扩增NDR1-1.基因组DNA作为模板。扩增中使用的引物如下:5'-TCCTAAGGTTTCGTTTTGGGTC-3'和5'-GGGACGGTTTCAATTCTGTGATAG-3'。所得的PCR产物纯化。使用Radprime DNA标记系统(Invitrogen,Carlsbad,Ca),该PCR产物随后用作标记反应中的模板DNA。
的npr1-2点突变[15.]采用CAPS (cleaved co-dominant amplified polymorphsequence)标记检测[32.].PCR所用引物为5'-CCTGATGTATCTGCTCT-3'和5'-GCTTAATGCAGATGGTG-3'。放大的产品被切割FSP.I得到一个330 bp的片段,如果是野生型则得到一个134 bp的片段(NPR1)使用DNA作为模板。FSP.我不会把扩增的DNA从npr1-2突变体植物。
系统获得性抗性试验
如前所述进行了SAR实验[4除了使用注射器手接种而不是真空渗透引入攻毒病原体。第0天和第4天和第2天和第4天分别对4个叶盘进行3次重复采样。误差柱代表数据均值的标准差。在给定的时间点上,平均值之间差异的显著性使用学生的值来确定t测试。的值P从一个读t表格一个重复的实验得出了类似的结果。按照业界的惯例[33.,两个重复实验之间的数据没有合并。
北方分析
对植物生长和接种进行了描述。在指定的时间点采集叶片组织样本。根据Nawrath和Métraux [20.].分光光度法测定RNA浓度。每条泳道使用25μg总RNA。基因特异性探针是由使用Radprime DNA标记系统(Invitrogen,Carlsbad,Ca)的凝胶纯化的DNA片段制成。用于制造探针以检测表达的模板DNAPR-1,PR-5和ROC1(嗜环素,用于RNA负载正常化)为PR-1和PR-5 cdna [14.] 和生态PCG22的ri片段[34.], 分别。与用作探针的基因对应的AGI编号分别为2G19990,AT1G75040和AT4G38740。使用标准程序进行Northern印迹[35.].定量使用风暴磷光成像仪(Amersham Biosciences, Sunnyvale, CA)。
参考
- 1。
Métraux J-P, Nawrath C, Genoud T:系统性获得性抗性。acta physica sinica, 2002, 32(4): 457 - 461。10.1023 /: 1015690702313。
- 2。
van Loon LC, van Strien EA:致病相关蛋白家族,它们的活性,以及PR-1型蛋白的比较分析。植物病理学杂志。1999,55:85-97。10.1006 / pmpp.1999.0213。
- 3.
Gaffney T, Friedrich L, Vernooij B, Negrotto D, Nye G, Uknes S, Ward E, Kessmann H, Ryals J:对水杨酸诱导系统获得性抗性的需求。中国科学:地球科学。
- 4.
张志强:《论中国文化的发展》NDR1在Arabidopsis中,在Avirulence基因定向信号传导和控制细胞死亡的信号和控制。植物理性。2001,127:1089-1101。10.1104 / pp.127.3.1089。
- 5.
Century KS,Holub EB,Staskawicz BJ:NDR1的轨迹拟南芥这是对细菌和真菌病原体抗性的疾病抵抗力所必需的。美国国家科学院学报。1995,92:6597-6601。
- 6.
Century KS, Shapiro AD, Repetti PP, Dahlbeck D, Holub E, Staskawicz BJ:NDR1拟南芥抗病所需的病原菌诱导成分。科学进展。1997,278:1963-1965。10.1126 / science.278.5345.1963。
- 7.
夏皮罗AD:利用拟南芥突变体描述抗病信号通路。acta botanica sinica(云南植物学报). 2000,22(4):427 - 434。
- 8.
植物对病原菌的超敏反应:一种抗性现象。明尼苏达州圣保罗:APS出版社。1994
- 9.
曹辉,董晓东:拟南芥系统获得性抗性诱导突变体的研究进展。植物学报。1994,6:1583-1592。10.1105 / tpc.6.11.1583。
- 10.
拟南芥信号转导突变体的研究进展。美国国家科学院学报。1995年,92:6602 - 6606。
- 11.
一个水杨酸不敏感突变体的特性研究(sai1) 的拟南芥利用sa诱导表达tms2基因的选择性筛选。植物生态学报,1997,10:69-78。
- 12.
Shirasu K, Nakajima H, Rajasekhar VK, Dixon RA, Lamb C:水杨酸增强一种激动剂依赖的增益控制,在防御机制激活中放大病原体信号。acta botanica sinica(云南植物研究),1997,9(4):457 - 461。10.1105 / tpc.9.2.261。
- 13。
Ward ER, Uknes SJ, Williams SC, Dincher SS, Wiederhold DL, Alexander DC, Ahl-Goy P, Métraux J-P, Ryals JA:协调基因活性对诱导系统性获得性抗性的反应。植物学报。1991,3:1085-1094。10.1105 / tpc.3.10.1085。
- 14.
作者介绍了拟南芥获得性抗性的研究进展。植物学报。1992,4:645-656。10.1105 / tpc.4.6.645。
- 15.
曹海涛,刘志强,董晓东:拟南芥的生长发育NPR1控制系统获得性抗性的基因编码一种含有锚蛋白重复序列的新蛋白。细胞。1997,88:57-63。
- 16.
Ryals J, Weymann K, Lawton K, Friedrich L, Ellis D, York-Steiner H, Johnson J, Delaney TP, Jesse T, Vos P, et al:拟南芥NIM1蛋白与哺乳动物转录因子抑制剂I-kappa-B具有同源性。acta botanica sinica(云南植物研究),1997,9(4):434 -439。10.1105 / tpc.9.3.425。
- 17.
张玉玲,范文辉,李旭,董晓楠:NPR1与水杨酸诱导所需序列结合的亮氨酸拉链蛋白转录因子的相互作用PR-1基因。美国国家科学院学报。1999年,96:6523 - 6528。10.1073 / pnas.96.11.6523。
- 18.
关键词:拟南芥,NPR1, TGA2,水杨酸,基因激活acta botanica sinica(云南植物学报),2002,14(4):489 - 494。10.1105 / tpc.001628。
- 19.
Glazebrook J,Rogers Ee,Ausubel FM:通过直接筛查分离具有增强的疾病易感性的拟南芥突变体。遗传学。1996,143:973-982。
- 20.
Nawrath C,MétrauxJP:拟南芥的水杨酸诱导缺陷型突变体突变突变体PR-2和PR-5,并在病原体接种后积累高水平的Camalexin。植物细胞。1999,11:1393-1404。10.1105 / TPC.11.8.1393。
- 21.
大豆防御反应的广义诱导与超敏反应的诱导无关。植物学报。1993,5:49-56。10.1105 / tpc.5.1.49。
- 22.
Asai T, Tena G, Plotnikova J, Willmann MR, Chiu W-L, Gomez-Gomez L, Boller T, Ausubel FM, Sheen J: MAP激酶信号级联在拟南芥先天免疫中的作用。自然学报,2002,415:977-983。10.1038 / 415977。
- 23。
陈志,Kloek AP, Boch J, Katagiri F, Kunkel BN: The两avrRpt2基因产物促进植物细胞内的病原体毒性。植物营养与肥料学报,2000,13(4):427 - 434。
- 24。
Genoud T,Tevino Santa Cruz MB,MétrauxJ-P:工厂信号网络的数字模拟。植物理性。2001,126:1430-1437。10.1104 / pp.126.4.1430。
- 25。
植物抗病基因介导的两种特异性病原识别事件的干扰。植物学报。1996,8:251-257。10.1105 / tpc.8.2.251。
- 26.
格兰特M,布朗I,亚当斯S,奈特M,安斯利A,曼斯菲尔德RPM1植物疾病抗性基因促进氧化突发和过敏细胞死亡所需的细胞溶质钙的快速和持续增加。工厂J. 2000,23:441-450。10.1046 / J.1365-313x.2000.00804.x。
- 27.
拟南芥抗性基因的克隆与表达分析RPS2和RPM1抗病基因。植物学报。1996,8:241-249。10.1105 / tpc.8.2.241。
- 28.
细胞信号传导的生物工程模型。生物工程学报,2000,2:31-53。10.1146 / annurev.bioeng.2.1.31。
- 29.
陈家强,陈家强,陈家强:酵母芽殖细胞周期分子模型的动力学分析。中国生物医学工程学报。2000,11:369- 369。
- 30.
Kitano H:系统生物学:简要概述。科学。2002,295:1662-1664。10.1126 / Science1069492。
- 31.
Whalen M Innes R, Bent A, Staskawicz B:鉴定两病原体的拟南芥和一个确定拟南芥和大豆毒力的细菌基因。植物学报。1991,3:49-59。10.1105 / tpc.3.1.49。
- 32.
利用共显性生态型特异性pcr标记定位拟南芥突变的方法。植物学报1993,4:403-410。10.1046 / j.1365 - 313 x.1993.04020403.x。
- 33.
植物病原细菌的高通量定量测定方法拟南芥.工厂J. 2001,28:475-481。10.1046 / J.1365-313x.2001.01136.x。
- 34.
关键词:嗜环蛋白基因家族拟南芥众所周知的环托蛋白蛋白的系统发育分析。植物mol biol。1997,35:873-892。10.1023 /答:1005930024796。
- 35。
Sambrook J,Russell DW:分子克隆:一个实验室手册。冷泉港。纽约:冷泉港实验室出版社,2001年第三次。
确认
我们感谢Jane Glazebrook博士(Torrey Mesa研究所)的种子npr1-2christane Nawrath博士(弗里堡大学)的种子SID2-1, Dr. Charles Gasser (University of California, Davis)获得pCG22, Dr. John Ryals (Paradigm Genetics)获得pCG22PR-1和PR-5Dr. Cao和Dr. Xinnian Dong (Duke University)为开发和建议CAPS标记用于检测npr1-2维卡斯·阿格拉瓦尔(Vikas Agrawal,特拉华大学)对信号布尔模型的建议。CZ部分是由特拉华大学农业与自然资源学院的博士前研究助理资助的。这是纸。1725年发表在特拉华农业实验站的期刊系列上。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
CZ孤立的NDR1-1./npr1-2Line的使用,建立了同源性的两个突变,进行了PR.基因表达研究,并有助于制备稿件。正如本研究的构思一样,进行了遗传交叉来制造ndr1-1 / npr1-2进行了SAR实验,建立了信号通路的布尔模型,为手稿的编写做出了贡献。两位作者都阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
两种途径的作用是一种附加的而不是强制性的协同方式,以诱导系统性获得性耐药性PR.基因的表达。BMC植物杂志2,9(2002)。https://doi.org/10.1186/1471-2229-2-9
收到了:
接受:
发表:
关键字
- 水杨酸
- 双突变体
- 过敏的反应
- 突变体植物
- 非病原性基因