摘要
背景
精氨酸和瓜氨酸作为氮的储存形式,但也参与生物合成和分解代谢途径。精氨酸、瓜氨酸和鸟氨酸的代谢主要分布在线粒体和细胞质之间。细胞溶胶和线粒体之间的中间物穿梭需要存在于线粒体内膜上的转运体。酵母含有鸟氨酸和精氨酸的线粒体转运蛋白Ort1p/Arg11p。Ort1p/Arg11p是线粒体载体家族(mitochondrial carrier family, MCF)的成员之一,是从线粒体输出鸟氨酸的重要载体。酵母arg11突变体,Ort1p/Arg11p缺失,在缺乏精氨酸的培养基上生长不良。
结果
核编码的高级表达拟南芥Ort1p/Arg11p的同源物(AtmBAC2)能够抑制生长缺陷arg11.RT-PCR分析表达式AtmBAC2在花中含量最高的所有组织中。启动子- gus融合在花(花粉)、角果维管系统和败育种子中优先表达。叶片脉管系统中有变化表达。在含NH的培养基上生长的幼苗在前两周内没有观察到启动子的诱导4没有3.,精氨酸或鸟氨酸作为唯一的氮源。
结论
在拟南芥中分离到AtmBAC2作为精氨酸的线粒体转运体。精氨酸在发育中的种子和幼苗子叶中缺乏表达,表明有其他转运体负责种子中精氨酸的储存和动员。
背景
在大多数生物体中,氨基酸代谢至少分布在两个室:细胞质和线粒体。此外,质体对植物的氨基酸代谢也有重要贡献[1].例如,在植物中,精氨酸、鸟氨酸和瓜氨酸的生物合成、转化和降解分布在线粒体、质体和胞质中[2].
在许多植物中,精氨酸作为一种主要的氮源储存在种子中拟南芥精氨酸占种子总氮的11% [2].在种子萌发期间,储存的精氨酸降解以转化为转运形式(例如谷氨酰胺或谷氨酸)。催化精氨酸降解的酶氨基酶和尿素的酶氨基酶在线粒体中局部化[3.].因此,精氨酸需要导入线粒体以使其动员。在生物合成过程中,通过线粒体膜的运输步骤也是必需的。在酵母中,精氨酸的前体鸟氨酸在线粒体中由从胞质中输入的谷氨酸合成。鸟氨酸在转化为精氨酸之前转移到胞质。此外,精氨酸需要进入线粒体,以允许线粒体蛋白质合成。鸟氨酸是精氨酸和脯氨酸代谢的中间体,也是尿氨酸瓜氨酸的中间体。在植物中,鸟氨酸也是多胺和生物碱生物合成的前体[4].因此,还需要在各种其他代谢途径中,需要精氨酸,鸟氨酸和瓜氨酸的运输。虽然在大鼠肝脏和心脏中描述了对瓜氨酸的线粒体和乳蛋白的渗透[5而在植物中则未见过。
因此,所有这些途径的代谢物交换和协调,必须在不同生物体的线粒体内膜上存在多个载体。在酵母基因组中,鉴定了35个线粒体载体家族成员;其中12个对底物特异性进行了表征[6].MCF蛋白具有类似的结构特征:相对较低的分子量约为30 kDa,三部结构(三个约100个氨基酸重复),每个重复由两个跨膜螺旋组成,由一个亲水性环分开。此外,被称为“线粒体能量标记”的共识序列[P-X-(DE)- x -(LIVAT)-(RK)- x -(LRH)-(LIVMFY)]存在于所有载体中,在每个重复的第一个螺旋的c端有一至三个副本[7].属于这个家族的大多数转运体起反转运体的作用。线粒体运输研究的结合[8,9和载体的重组大肠杆菌导致鉴定属于MCF家族的第一哺乳动物线粒体载体基因[10.].此后,在酵母和人类基因组中发现了编码各种预测运输系统的线粒体转运基因[11.- - - - - -14.].
拟南芥基因组含有至少48个MCF家族成员,7份3份线粒体能量转移签名,21份,两个副本和20个副本。到目前为止,只有很少的工厂MCF载体已经表征了[11.:腺嘌呤核苷酸转位子[15.,16.,解偶联蛋白[17.,18.],最近又有一种名为DTC的二羧酸-三羧酸酯载体[19.和琥珀酸转运体[20.].然而,尽管它们的重要性已经鉴定出氨基酸的假设植物线粒体转运蛋白,例如脯氨酸转运蛋白,用于隔间化脯氨酸代谢[21.,氨基丁酸分流的氨基丁酸转运体[22.,用于与过氧化物酶体进行光呼吸交换的谷氨酸/天冬氨酸转运体或用于精氨酸代谢的鸟氨酸/精氨酸载体,在分离的大豆线粒体中进行生物化学特征分析[3.].
一种酵母arg11鉴定了无法合成精氨酸的突变体[23.].通过互补,克隆出相应的基因arg 11.突变体,表明Arg11p是MCF的成员。根据突变体的氨基酸含量,推测ARG11p可能作为酵母的线粒体鸟氨酸转运体[24.].在表达后对Ort1p进行了表征大肠杆菌随后的重建。Ort1p / arg11p的主要功能是线粒体的鸟氨酸出口。ORT1P / ARG11P介导鸟氨酸,精氨酸和赖氨酸的电力抗ANTIPORT,效率较低,也造成鸟类/小时+反向运输(25.].因为一个arg11缺失突变体保留精氨酸/鸟氨酸载体活性,假设碱性氨基酸的第二转运体Bac1 [26.].利用与酵母基因的序列同源性来识别人类ORNT1转运体,并证明HHH综合征(高鸟氨酸血症-高氨血症-高柠檬氨酸尿症)是由于各自基因的缺陷[27.].在柑橘内血症的情况下,MCF家族的不同成员有缺陷[28.,即天冬氨酸/谷氨酸载体[29.].在脂质体重组中发现的另一种氨基酸载体是人谷氨酸转运体[14.].然而,在酵母中,尽管尝试广泛,但除了遗传研究中,氨基酸或其他代谢物的关键载体都没有鉴定出来arg11, acr1,dic1,即在许多氨基酸途径的所有代谢步骤中都发现了突变体,但在线粒体载体中未发现相应的突变体。由于酵母基因组包含大量的MCF蛋白,我们可以假设转运体具有重叠底物特异性,因此酵母可能能够补偿单个MCF基因的损失。
迄今为止,鉴定植物质膜转运体最有效的方法是酵母突变体的抑制克隆。由于在大多数情况下,线粒体转运体不包含可识别的靶向序列,酵母互补是否可能是鉴定植物同源物的合适工具仍然是开放的。在拟南芥基因组中搜索发现了一个与酵母Ort1p/Arg11p 32%相同的基因。拟南芥基因AtmBAC2,当在酵母中表达时,能够恢复酵母的生长arg11突变体在缺乏精氨酸的培养基上,表明AtmBAC2催化鸟氨酸从线粒体出口到胞质。RT-PCR分析和启动子- gus融合研究表达和调控AtmBAC2.在发育中的种子和幼苗子叶中缺乏表达,表明除了AtmBAC2之外,可能还有另一种转运体AtmBAC1[30.],参与储存和动员精氨酸。
结果与讨论
酵母的补充arg11由植物的cDNA突变
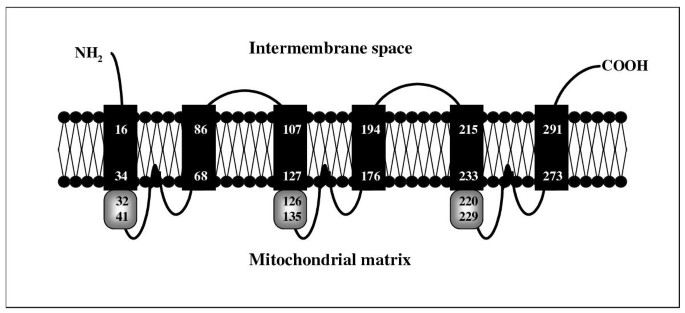
酵母突变体arg11是由于精氨酸代谢的一种中间体鸟氨酸的线粒体转运体缺失,导致精氨酸营养缓慢[24.].为了鉴定一个相应的拟南芥转运基因arg11酵母表达载体pFL61中的拟南芥cDNA文库转化酵母突变体[31.].大约106筛选转化子在缺乏精氨酸的培养基上生长。可能是由于缓养突变体的背景生长,没有基因能够补充酵母arg11突变被发现。因此,我们对来自的ORT1p/Arg11p序列进行同源性搜索酿酒酵母酿酒酵母拟南芥基因组和阿拉门农基因编码的预测蛋白质序列[32.整合膜蛋白数据库http://aramemnon.botanik.uni-koeln.de.位点At5g46800和At1g79900编码的两个推测蛋白AtmBAC1和AtmBAC2的相似性值最高。通过rt - pcr,AtmBAC2克隆了与基因座At1g79900对应的cDNA。AtmBAC2该蛋白编码296个氨基酸,计算分子量为32 kDa,与酵母ORT1p/Arg11p蛋白同源性为32%,相似性为52%。多肽(HMMTOP 2.0;http://www.enzim.hu/hmmtop/)预测六个推定的膜跨越域,与已知的MCF载体结构一致[33.].六个其他程序预测零(可溶)和五个跨膜跨度之间[32.].通常,在MCF载体的情况下的跨膜跨度的预测是有问题的,因为存在疏水结构域,然而,置于置力域在假设的临界值下方。因此,这些蛋白质将从数据库中缺失,仅依赖于膜蛋白预测。通过在第一,第三和第五跨膜结构域之后存在“线粒体能量转移符号”的存在结构预测。同源性搜索,疏水性分析和签名基质的存在的组合表明ATMBAC2包括线粒体载体家族的所有特征(图。1).与MCF家族的许多其他线粒体蛋白类似,AtmBAC2不包含可导入线粒体的预测靶向序列。
ATMBAC2的结构模型。使用TMHMM程序进行预测http://www.cbs.dtu.dk/services/TMHMM-2.0.六个疏水结构域被描绘为黑匣子,并且三个线粒体能量转移签名作为灰色盒子(给出氨基酸位置)。
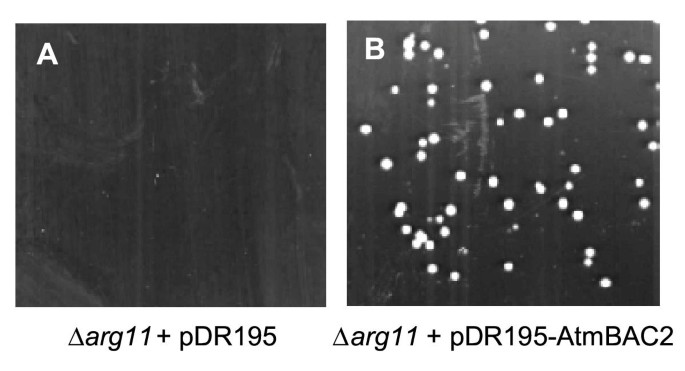
的AtmBAC2在酵母载体pF101中克隆cDNA,含有PGK启动子,和pDR195,与较强PMA1启动子片段。当从PMA1推动者,AtmBAC2能够有效补充酵母精氨酸缓慢发育(图。2).类似的实验使用相对较弱的PGK启动子仅显示较弱的互补,即与表达细胞相比的增长较慢AtmBAC2在PMA1启动子的控制下(数据未显示)。为了研究底物特异性,AtmBaC2融合到His-Tag,并且在酵母中的强PMA1启动子片段下表达融合蛋白。分离线粒体,AtmBac2纯化为32kDa多肽(数据未显示)。功能重构可用于详细描述AtmBac2的性质[12.].在一项平行研究中,Hoyoset al。[30.]鉴定出AtmBAC1,一种与鸟氨酸转运体密切相关的基因。AtmBAC1成功重组为人工蛋白脂质体,能够进行鸟氨酸/鸟氨酸交换以及多种氨基酸对精氨酸的交换。AtmBAC1表现出对精氨酸和赖氨酸亲和力最高的碱性氨基酸的偏好,但也转运组氨酸。因此,AtmBAC1类似于许多其他MCF转运体,是混杂的。这可能反映了转运体没有绑定口袋,但过滤和识别可能发生在孔内的易位途径。从进化的角度来看,低选择性可能是有利的,因为突变将允许快速适应代谢区隔的变化。然而,由于底物特异性的调节,单凭序列很难确定底物的生理功能。这种乱交也可以解释为什么到目前为止线粒体载体功能只有少数突变,例如。arg11在酵母或疾病相关HHH综合征。
到目前为止,描述线粒体转运体最有效的方法是候选基因方法。候选表达为大肠杆菌[19.[纯化蛋白质在脂质囊泡中重构,测定运输性质[34.].该方法是困难且艰苦的,没有适用于所有候选人的标准协议[12.].因此,一种替代方法被开发出来,允许通过抑制酵母突变体的营养缺陷或营养迟缓表型来鉴定线粒体载体。虽然没有证据表明线粒体的靶向序列AtmBAC2序列,并且关于酵母和植物线粒体进口核编码蛋白的信号很少,酵母进口机制能够识别植物线粒体蛋白并将它们靶向线粒体。通过这种方式,鉴定AtmBAC2和AtmBAC1[30.]作为鸟氨酸载体证实了酵母互补对候选基因功能分配的有效性。
MCF易位子的系统发育树
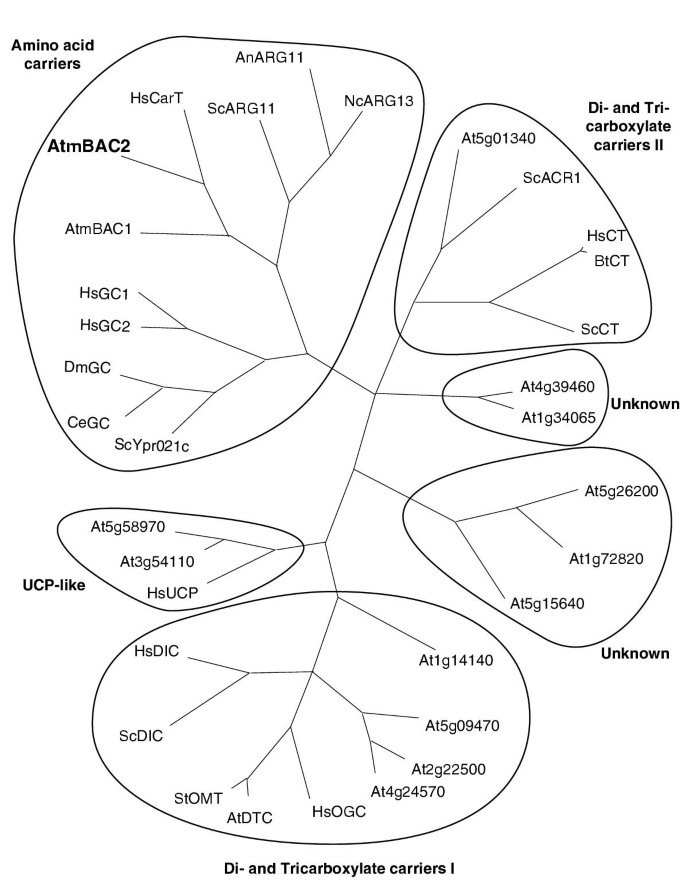
对运输商数据库的详细分析表明拟南芥MCF家族具有高度发散,并且完全取向仅显示出八个完全保守的残留物。由于相似性树枝分为两个主要的分支,并且具有少数单个和非常远的相关构件,因此用含氨基酸转运蛋白的亚组进行系统发育分析,其他几个拟南芥MCF成员和选定的真菌和哺乳动物成员落入同一分支机构(图。3.).这些选定的多肽可分为六大类:(i)氨基酸载体,(ii)二羧酸和三羧酸载体,(iii)解偶联蛋白(UCPs),以及(iv)至少两组功能尚未确定的载体(图。3.).在氨基酸载体中酿酒ORT1P / ARG11P和相关的运输器来自脉孢菌和aspergillus.与Arabidopsis AtmBac2和AtmBac1最密切相关,而谷氨酸和谷氨酸/诸如视野载体更加远离相关[14.,29.].没有其他拟南芥蛋白质落入这片思考。有趣的是,哺乳动物肉碱转运蛋白[35.]也属于氨基酸载体分支,与碱性氨基酸转运体关系更为密切。由于到目前为止没有证据表明肉碱在植物中运输,人们可以预测,这一分支的其他成员和那些属于未知转运体组的成员可能是线粒体中氨基酸运输功能中缺失的载体的候选。
AtmBAC2和其他线粒体载体的系统发育分析。比对局限于AtmBAC2氨基酸序列的11位和259位之间的保守结构域。采用PAUP 4b10进行最大简约分析,所有氨基酸性状未加权,空白为缺失性状。启发式树搜索使用1000个随机序列加法和随机序列分析的树平分-重连分支交换算法。完整的对齐是基于342个地点;306个具有系统发育信息。At5g01340 NP195754;ScACR1 CAA80973;HsCT, NP005975;BtCT P79110;ScCT NP009850; At4g39460, NP568060; At1g34065, NP564436; At5g26200, NP197992; At1g72820, NP565048; At5g15640, NP568317; At1g14140, NP172866; At5g09470, NP196509; At2g22500, NP179836; At4g24570, NP194188; HsOGC, NP003553; AtDTC, CAC84549; StOMT, X99853; ScDIC, AAB71336; HsDIC, NP036272; HsUCP, NP003346; At3g54110, NP190979; At5g58970, NP568894; ScYpr021c, NP015346; CeGC, NP497274; DmGC, AAF57048; HsGC1, CAD21007; HsGC2, CAD21008; AtmBAC1, NP568670; AtmBAC2, NP178108; HsCarT, O43772; ScARG11, CAA60862; AnARG11, AAD44763; NcARG13, AAF87777.
的表达模式AtmBAC2在拟南芥
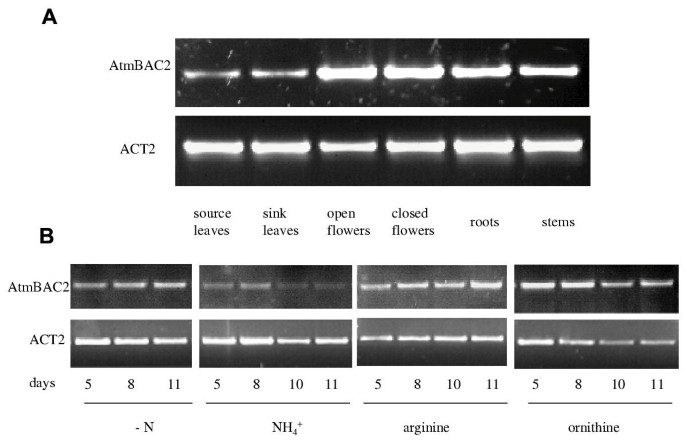
研究的表达模式AtmBAC2,从不同组织中提取总RNA拟南芥植物生长在土壤中。由于表达量过低,无法用RNA凝胶印迹法检测,故采用RT-PCR。AtmBAC2在所有组织中都有表达,其中花的转录水平最高(图)。4).探讨氮素源对番茄红素表达的潜在影响AtmBAC2,RT-PCR在从拟南芥幼苗上提取的mRNA上进行,在补充有不同无机和有机氮源NH的无氮MS培养基中4没有3.精氨酸或鸟氨酸。在不同的发育阶段收获材料。AtmBAC2与NH相比,在补充有精氨酸或鸟氨酸的培养基中表达4没有3.(图。4 b).在氮饥饿条件下也观察到表达的轻微增加(图。4 b).调节和表达模式与AtmBac2在精氨酸和鸟氨酸分解代谢的角质层的作用相容。
为了更详细地研究组织的特异性AtmBAC2启动子区分离。启动子片段长度为2 kb,长度为1.5 kb,与GUS进行转录融合。在这两种情况下,独立转化子的表达模式具有可比性。虽然在幼苗中无法检测到表达,但首先在3周龄的植株中检测到了GUS活性(图。5 a, b, c, d, 5 e).幼苗促进剂 - GUS分析和RT-PCR之间的差异可能是由于RT-PCR的敏感性,或者由于缺失的调节元件,例如:在内含子AtmBAC2.叶脉显示斑片状染色,在某些情况下在叶缘(图。5 f, 5 g).与RT-PCR一致,GUS组织化学分析显示花中表达水平升高,特别是在雄蕊和花瓣中(图2)。我5 h, 5)和发芽花粉(图。5 j,数据未显示)。此外,在主维管系统和败育的种子中有表达,但在发育中的种子中没有。5 k, 5 l, 5米).
线粒体膜内的碱性氨基酸转运体可能在幼苗发育和蛋白质动员(如种子萌发)过程中发挥作用。然而,在发育中的种子和发芽的幼苗中未发现表达,这可能是一种不同的载体AtmBAC1,可能负责这些过程[30.].脯氨酸是花粉中最丰富的氨基酸[36.].因此,可以将AtmBac2在花粉中的表达作为暗示精氨酸可以用作脯氨酸生物合成的前体,因为氨基酶局部化在线粒体中,因此精氨酸必须溶于线粒体中。或者,表达模式也可以与其他代谢途径相关,因为鸟氨酸也可以用作多胺和生物碱生物合成的前体[4].
结论
在强启动子的控制下,候选基因的功能表达允许植物线粒体转运碱性氨基酸的鉴定。这种载体似乎有重叠,但不同的功能,如AtmBAC1在植物。这项研究还确定了植物线粒体中缺失的氨基酸运输系统的候选者。RNAi的研究淘汰赛突变体将使氨基酸生物合成的线粒体区隔的详细生理特征成为可能。研究还表明,除了质膜和液泡膜的53种潜在氨基酸转运体[37.,植物含有额外的细胞器分隔载体。
方法
酵母菌株
酵母菌株Y02386 [Matα;his3δ1;Leu2δ0;lys2Δ0;URA3Δ0;Yor130C :: Kanmx4]来自Euroscarf(德国法兰克福),缺失酵母基因ARG11,用于酵母互补。通过使用氨基酸和硫酸铵(Difco,Heidelberg,Germany)的酵母氮基碱建立了Y02386的选择性条件(Mg L.-1): 5000 (NH)4)2所以4, 20组氨酸,100亮氨酸,20蛋氨酸和2%葡萄糖,最终50尿嘧啶,如果是未转化酵母。阴性对照Y02386用空载体pDR195转化[38.].
克隆的AtmBAC2基因与酵母转化
AtmBAC2以拟南芥cDNA文库(生态型Landsberg;[31.),利用引物将预测的ORF从ATG延伸到stop: 5'- agcctcgagatggattttggccggagtttatg,包含aXhoI限制站点和5'-TTCGGATCCTCAATCTCCTGTGACAATTC,包含aBAM嗨限制站点。PCR产物受到限制Xho我和BAM并连接到酵母表达载体pDR195。得到的质粒被扩增进去大肠杆菌据吉茨说,DH5转移到了Y02386等.[39.].在加入号AC011717_10下,在Genbank中沉积cDNA和蛋白质序列。
植物材料和mRNA表达
拟南芥l . Heynh。生态型Col-0用于植物研究。在器官特异性研究中,除根取自MS琼脂平板培养的植物外,所有植物器官均取自温室土壤中生长的植物。对于不同氮源的表达研究,拟南芥种子放置在无菌无氮ms培养基上,其中10 mM的氮作为NH4没有3.精氨酸或鸟氨酸。分别在5、8、10和11天后收获植株,提取总RNA。在RT-PCR分析中,按照制造商的说明使用Retroscript (Ambion)将rna转化为cDNA。利用特异性引物,经25个PCR循环扩增得到267 bp的cDNA片段AtmBAC2(5 ' -GGACAAGAAAACCTCAGGACCAT 5 ' -GAATAGACACCGCAAGGCTACCT)。作为对照,一个377 bp的组成性表达的肌动蛋白2基因(AtACT2)同时扩增20个PCR循环[40].通过测序确认了扩增子的身份。
Promoter-GUS融合
启动子- gus融合有两个不同的长度(2020和1480 bp)AtmBAC2通过PCR扩增包括起始密码子的启动子区域拟南芥Heynh。,ecotype Col0 genomic DNA using the primers 5'-CTGACCTCTAGACCAGCTGGTGACAGCATCAG; 5'-CTGACCTCTAGAAAACTTGGGTTTGAACAGCC and 5'-CTGACCACCCGGGACCATACCAAGGATGGGATTGTAC. Forward primers contained aXBA.我限制性位点,反向底漆aSma我网站。PCR产物受到限制Sma我和XBA.在双载体pCB308中连接GUS基因[41.].农杆菌肿瘤术用所得质粒转化GV2260。拟南芥l . Heynh。,ecotype Col0, grown in soil in the greenhouse, was transformed by floral dipping [42.].转基因拟南芥植物被选择为BASTA抗性(Aventis作物科学,法兰克福)。
GUS活性的组织化学分析
转化的T2拟南芥在土壤中生长。在不同的发育阶段,收集植物或器官,并染色检测GUS活性。幼苗生长在固体MS板上。在转基因植物中进行了β-葡萄糖醛酸酶活性的组织化学分析,如Martin所述等.[43.].组织在37℃染色液中孵育18小时,染色液中含有(mM) 100磷酸钠(pH 7), 10 EDTA, 3 K4[Fe (CN)6), 0.5 K3.[Fe (CN)6]、1 5-溴-4-氯-3-吲哚基-β- d -葡萄糖醛酸(X-Gluc)和0.2% (v/v) Triton X-100。采用轻微真空,以促进基质的渗透。含叶绿素组织在70%的乙醇溶液中被清除。照片是用CCD相机(Visitron)拍摄的。
参考
- 1。
关键词:支链氨基酸转氨酶基因家族拟南芥编码质体和线粒体蛋白质。植物生理学报。2002,29(4):549 - 554。10.1104 / pp.001602。
- 2。
精氨酸酶在大豆胚胎发育中不起作用。植物生理学报。1999,19(4):427 - 434。10.1104 / pp.119.1.297。
- 3。
GoldraIJ A,Polacco JC:在大豆幼苗类豆蔻豆细胞中的Aginase精氨酸酶降解。Planta。2000,210:652-658。10.1007 / s004250050056。
- 4。
Shargool PD,Jain JC,McKay G:鸟氨酸生物合成和植物细胞中的精氨酸生物合成和降解。Phytochem。1988年,27:1571-1574。10.1016 / 0031-9422(88)80404-7。
- 5。
赌博JG,Lehninger AL:穿过线粒体膜的鸟苷和瓜氨酸的运输。J Biol Chem。1973,248:610-618。
- 6.
Belenkiy R, Haefele A, Eisen MB, Wohlrab H:酵母线粒体运输蛋白:新的序列和共识残基,共识残基与跨膜螺旋之间缺乏直接关系,运输蛋白基因的表达模式,以及与其他蛋白的相互作用。生物化学学报。2000,1467:207-218。10.1016 / s0005 - 2736(00) 00222 - 4。
- 7.
Palmieri F:线粒体载体蛋白。费用。1994年,346:48-54。10.1016 / 0014-5793(94)00329-7。
- 8.
Klingenberg M:线粒体代谢物运输。费用。1970,6:145-154。10.1016 / 0014-5793(70)80044-8。
- 9.
Klingenberg M:线粒体代谢物运输系统概述。方法酶。1979,56:245-252。
- 10。
来自牛线粒体的一种固有膜转运蛋白的丰富的细菌表达和重组。生物化学学报,2003,32(4):457 - 461。
- 11.
Laloi M:植物线粒体载体概述。中国生物医学工程学报。1999,19(4):531 - 534。10.1007 / s000180050484。
- 12.
Palmieri L,Hunswick MJ,Fiermonte G,Walker Je,Palmieri F:酵母线粒体载体:细菌表达,生物化学鉴定和代谢意义。j生物学生物师。2000,32:67-77。10.1023 /答:1005564429242。
- 13。
Porter RK:哺乳动物线粒体内膜阳离子和中性氨基酸载体。Biochim Biophys Acta。2000,1459:356-362。10.1016 / s0005-2728(00)00172-9。
- 14。
Fiermonte G, Palmieri L, Todisco S, Agrimi G, Palmieri F, Walker JE:线粒体谷氨酸转运体的鉴定。两种人类异构体的细菌表达、重建、功能特性和组织分布。中国生物化学杂志。2002,27(4):489 - 494。10.1074 / jbc.M201572200。
- 15.
马铃薯的ADP/ATP转运蛋白有一个很长的氨基末端延伸。王志强。
- 16。
赢得BM,Sarah CJ,Purdue Pe,Day CD,Leaver CJ:高等植物的腺嘌呤核苷酸易位剂被合成为在进口到线粒体后处理的大型前体。工厂J. 1992,2:763-773。10.1046 / J.1365-313x.1992.t01-15-00999.x。
- 17.
植物中解偶联线粒体蛋白的发现。生物工程学报,2001,21(5):457 - 461。10.1023 /: 1013652409337。
- 18.
Laloi M, Klein M, Riesmeier JW, Müller-Röber B, Fleury C, Bouillaud F, Ricquier D:植物冷诱导解偶联蛋白。自然科学进展。10.1038/38156。
- 19.
Picault N,Palmieri L,Pisano I,Hodges M,Palmieri F:鉴定植物线粒体中二羧酸二羧酸酯和三羧酸盐的新型转运蛋白。细菌表达,重构,功能表征和组织分布。J Biol Chem。2002,277:24204-24211。10.1074 / JBC.M202702200。
- 20.
Catoni E, Desimone M, Schumacher K, Hilpert M, Schneider A, Kunze R, Flügge UI, Frommer WB:拟南芥线粒体琥珀酸-富马酸转运体的鉴定。FEBS Lett. 2003, 534: 87-92。10.1016 / s0014 - 5793(02) 03782 - 1。
- 21.
Deuschle K, Funck D, Hellmann H, Däschner K, Binder S, Frommer WB:编码线粒体的核基因Δ1- 吡咯啉-5-羧酸脱氢酶及其在脯氨酸毒性保护中的潜在作用。工厂J. 2001,27:345-355。10.1046 / J.1365-313x.2001.01101.x。
- 22。
Breitkreuz Ke,Shelp BJ:从显影大豆子叶中的原生质体中的4-氨基丁酸酯分流的亚细胞分区。植物理性。1995,108:99-103。
- 23。
精氨酸生物合成的调控酿酒酵母酿酒酵母.argR的特异性-氨基酸生物合成的突变与一般控制。生物化学学报,2003,21(4):427 - 434。
- 24。
Crabeel M, Soetens O, De Rijcke M, Pratiwi R, Pankiewicz RARG11基因酿酒酵母酿酒酵母编码精氨酸生物合成所需的线粒体完整膜蛋白。中国生物医学工程学报,1996,21(3):421 - 427。10.1074 / jbc.271.40.25011。
- 25。
parmieri L, De Marco V, Iacobazzi V, Palmieri F, Runswick MJ, Walker JE:酵母ARG-11基因作为精氨酸生物合成的线粒体鸟氨酸载体的鉴定。FEBS Lett. 1997, 410: 447-451。10.1016 / s0014 - 5793(97) 00630 - 3。
- 26。
精氨酸和鸟氨酸的转运到分离的线粒体中酿酒酵母酿酒酵母.王志强,王志强。生物化学学报。1998,32(4):427 - 434。10.1046 / j.1432-1327.1998.2580702.x。
- 27。
Camacho Ja,Obie C,Biery B,Goodman Bk,Hu Ca,Hu Ca,Almashanu S,Steel G,Casey R,Lambert M,Mitchell Ga等:Hycthithina血症 - 超级亚乳蛋白 - 同性全核综合征是由编码线粒体鸟类的基因突变引起的运输车。NAT Genet。1999年,22:151-158。10.1038 / 9658。
- 28。
Kobayashi K,Sinasac DS,Iijima M,Boright AP,Begum L,Lee Jr,Yasuda T,Ikeda S,Hirano R,Terazono H等人:在成人 - 发作II型Citrullina血症中突变的基因编码推定的线粒体载体蛋白。NAT Genet。1999年,22:159-163。10.1038 / 9667。
- 29.
Palmieri L, Pardo B, Lasorsa FM, del Arco A, Kobayashi K, Iijima M, Runswick MJ, Walker JE, Saheki T, Satrustegui J, et al: Citrin和aralar1是Ca2+-刺激的天门冬氨酸/谷氨酸转运体。国家自然科学基金重点项目,2001,20:5060-5069。10.1093 / emboj / 20.18.5060。
- 30.
HOYOS ME,Palmieri L,Wertin T,Arrigoni R,Polacco JC,Palmieri F:鉴定基本氨基酸的线粒体转运蛋白拟南芥通过脂质体的功能重构和酵母的补体。植物j . 2003。
- 31.
minet m,dufour me,lacroute f:互补酿酒酵母酿酒酵母滋巢营养突变体拟南芥CDNA。工厂J. 1992,2:417-422。10.1046 / J.1365-313x.1992.t01-38-00999.x。
- 32.
Schwacke R,Schneider A,Van der Graaff E,Fischer K,Catoni E,Desimone M,Frommer WB,FlüggeU-I,Kunze R:Aramemnon,拟南芥组成膜蛋白的新型数据库。植物理性。2003,131:16-26。10.1104 / pp.011577。
- 33.
Kaplan Rs:线粒体阴离子输送蛋白的结构和功能。J Memb Biol。2001,179:165-183。10.1007 / S002320010046。
- 34。
Palmieri F, Indiveri C, Bisaccia F, Iacobazzi V:线粒体代谢物载体蛋白的纯化,重组和转运研究。方法酶法。1995,260:349-369。
- 35。
Indiveri C, Iacobazzi V, Giangregorio N, Palmieri F:线粒体肉碱载体蛋白:cDNA克隆、一级结构及与其他线粒体转运蛋白的比较。中国生物化学学报,1998,21(4):413 - 419。
- 36。
研究表明,LeProT1是番茄花粉中脯氨酸、甜菜碱和-氨基丁酸的转运蛋白。acta botanica sinica(云南植物学报). 1999,11:377-391。10.1105 / tpc.11.3.377。
- 37。
陈志强,陈志强,陈志强:氨基酸转运蛋白在植物、动物和真菌中的保护作用。生物化学进展,2002,27:139-147。10.1016 / s0968 - 0004(01) 02054 - 0。
- 38。
Rentsch D,Laloi M,Rouhara I,Schmelzer E,Delrot S,Frommer WB:NTR1编码高亲和力寡肽输送器拟南芥.费用。1995,370:264-268。10.1016 / 0014-5793(95)00853-2。
- 39。
Gietz D,ST Jean A,Woods Ra,Schiestl RH:改进了完整酵母细胞的高效变换方法。Nucl酸res。1992年,20:1425。
- 40.
YQ,McDowell JM,Huang S,McKinney EC,Chambliss S,Meagher RB:拟南芥Act2 / Act8 actin亚组在植物组织中的肌肉突出表达。工厂J. 1996,10:107-121。10.1046 / J.1365-313x.1996.10010107.x。
- 41.
Xiang C, Han P, Lutziger I, Wang K, Oliver DJ:植物转化的小型二元向量序列。植物生态学报,1999,19(4):593 - 598。10.1023 /: 1006201910593。
- 42.
花浸:一种农杆菌介导的植物转化的简化方法拟南芥.植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 43.
Martin T,WöhnerRV,Hummel S,Willmitzer L,Frommer WB:GUS记者系统作为研究植物基因表达的工具。在:GUS协议:使用GUS基因作为基因表达的记者。编辑:Gallagher SR。圣地亚哥:学术出版社,1992:23-43。
致谢
我们要感谢Rainer Schwacke,Köln,求助于识别MCF蛋白。这项工作得到了BundesministeriumFürBildungund Forschung在“Genomanalyse IM Biologischen System Pflanze - Gabi”框架内的支持,并通过KWS AG和SüdzuckerAG。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
EC,MD,RK,如和MH进行分子克隆和启动子GUS研究。DW进行了系统发育分析。KS和RK参加了该研究的设计。WBF和UIF构思了这项研究,并参与了其设计和协调。所有作者阅读并认可的终稿。
Elisabetta Catoni, Marcelo Desimone对这项工作做出了同样的贡献。
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
卡托尼,德西蒙,希尔伯特,M。et al。拟南芥线粒体精氨酸-鸟氨酸转位基因的核编码表达模式。BMC植物BIOL.3,1(2003)。https://doi.org/10.1186/1471-2229-3-1
收到了:
接受:
发表:
关键字
- 鸟氨酸
- 瓜氨酸
- 精氨酸酶
- 线粒体的转运体
- 精氨酸代谢