抽象的
背景
关于植物细胞内的小分子的贩运机制很少。是否仍然建立植物化学物质是否通过与蛋白质使用的途径运输,或者植物中代谢途径的扩增是否与新颖的贩运途径的演变有关。在本文中,我们通过P1转录因子利用玉米培养细胞中绿色和黄色自荧光化合物的诱导,以分别研究它们对细胞壁和液泡的靶向。
结果
我们研究了表达来自雌二醇诱导促进剂的玉米BMS细胞中绿色和黄色自荧光化合物的积累和亚细胞定位。我们确定黄色荧光化合物在类似AVIS的YFBS中积聚在液泡内。绿色荧光化合物最初在大球形GFB中的细胞质中累积。累积GFB的细胞还含有最初在ER中累积的电子致密结构,并且稍后似乎与等离子体膜一起熔断。在等离子体细胞的周质空间中也观察到类似GFB的结构。最终,在对细胞壁中积聚的绿色荧光在对Golgi扰动剂BFA和Monensin不敏感的过程中累积。
结论
我们的结果提示至少两种不同的运输途径,一到细胞壁和其他液泡,通过在玉米BMS细胞相同的转录因子诱导的不同的自体荧光的化合物的存在。这些隔室代表两个玉米细胞的特性的酚类化合物的积累的主要位点。绿色自发荧光化合物的分泌通过不涉及TGN,这表明它是从最蛋白质,多糖或外角质层蜡的分泌不同的路径进行。黄色自动荧光化合物积累在液泡区室,在那类似于AVI文件存在于许多细胞积聚花青素的结构。总之,我们的研究表明,自体荧光化合物的积累可以提供一个强大的工具来剖析植物化学物质的贩卖,必需的植物代谢的有效的工程知识。
背景
主要由于它们的固着生活方式的结果,植物积累了成千上万的特殊化合物(植物化学物质),主要来自次级代谢[1].这些植物化学物质通常在不同于它们累积的蜂窝隔间中合成[2].许多植物化学物质的分泌,或在一个组成的方式,或响应特定的生物或非生物胁迫条件。植物化学物质的分泌已被最好地描述为腺细胞[3.]并且对于根[4.].在某些情况下,分泌涉及特异性蛋白质,例如ABC转运蛋白[5.],负责例如在抗真菌萜类化合物中的分泌尼古利亚娜朱姆比菲洛伐比亚[6.].在其它情况下,囊泡参与植物化学物质的从合成的部位到细胞表面运输,如图所示为分泌类辣椒素香草酰胺在胎盘从红辣椒[7.],或高粱的栓皮细胞分泌表皮蜡[8.].然而,在大多数情况下,没有机制被提出,以解释小分子的运输,往往高度反应或毒性,细胞内,甚至细胞之间,如观察生物碱的生物合成C. Roseus.[9.].
与荧光标记蛋白的转运遵循的易于相反,通过与跟踪这些运动相关的困难,小分子从一个次蜂窝隔室移动到另一个子细胞室的途径的研究。使用免疫技术难以在细胞内观察细胞内,并且在达到最终目的地之后,无花鱼衍生的花青素如黄酮衍生的花青素,在这种情况下,在这种情况下,液泡或液泡样的室[10.].花青素颜料在中央液泡中积聚。与其他苯丙烷丙酮酸和黄酮类化合物的情况一样,可能在内质网(ER)的细胞质面上合成花青素[11.那12.].花青素对真空室的运输可能涉及专门的谷胱甘肽S.- 用作黄酮类载体蛋白的转移酶[13.那14.].最近,TT12来自拟南芥的基因被证明编码参与类黄酮的封存于种皮内皮的液泡转运蛋白的MATE的成员(多药和有毒化合物挤出)家族[15.].
我们利用通过黑墨西哥甜(BMS)的P1转录因子诱导的玉米细胞两种自动荧光化合物的文化积累[16.]开始探讨植物细胞内的小分子流量的可能机制。P1编码R2R3 MYB转录因子,调控玉米花器官中3-脱氧类黄酮的积累[17.].BMS细胞中P1的表达导致几种黄酮类化合物和苯基丙醇的积累[16.].表达p1的BMS细胞表现出一些形态变化,包括ER的扩张和电子密度结构的积累,这些结构似乎最初在ER中积累,然后迁移到细胞表面,与质膜融合[16.].表达p1的BMS细胞也分别积累了大量针对液泡和细胞壁的黄色和绿色自荧光化合物[16.].
在此,我们提供在表达P1之后积累绿色和黄色自荧光化合物的BMS细胞的详细表征。这些化合物分别在绿色和黄色荧光体(分别为GFB和YFB)中,分别靶向细胞壁和液泡。YFBS在类似于花氰酸真空夹杂物(AVIS)的结构中积聚在大型中心液泡中[18.].我们的研究表明,绿色自荧光化合物的分泌到细胞壁不受破坏的代理商trans-GOLGI网络(TGN)。我们的研究表明,这些自动荧光化合物代表了解剖植物植物化学的贩运方面的强大工具,并表明可能的新型分泌机制不涉及TGN网络。
结果
玉米BMS细胞中绿色和黄色自荧光体的积累
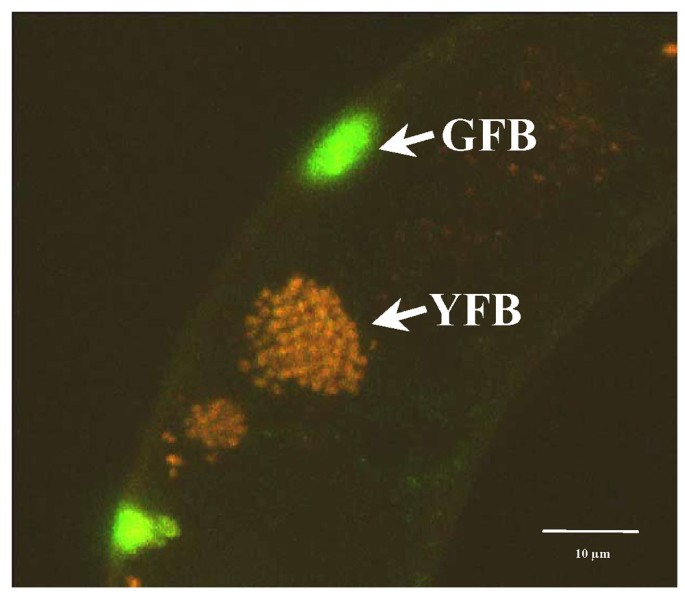
大尺寸的黑色墨西哥甜(BMS)玉米细胞提供了调查植物化程学的亚细胞贩运的良好机会。BMS细胞表达P1 R2R3 MYB转录因子Camv 35s.启动子(35s :: p1)分别累积靶向液泡和细胞壁的黄色和绿色的自动荧光化合物[16.].因为35S::P1细胞在培养过程中倾向于抑制P1转基因扩展繁殖后,我们研究了在表达BMS细胞中的黄色和绿色自荧光化合物的贩运和亚细胞定位P1来自雌二醇诱导型启动子(ERE :: P1,[19.])。到ERE :: P1 BMS细胞加入10μM雌二醇诱导绿色和黄色的自动荧光化合物,在相同的细胞往往共存(图的积累。1).
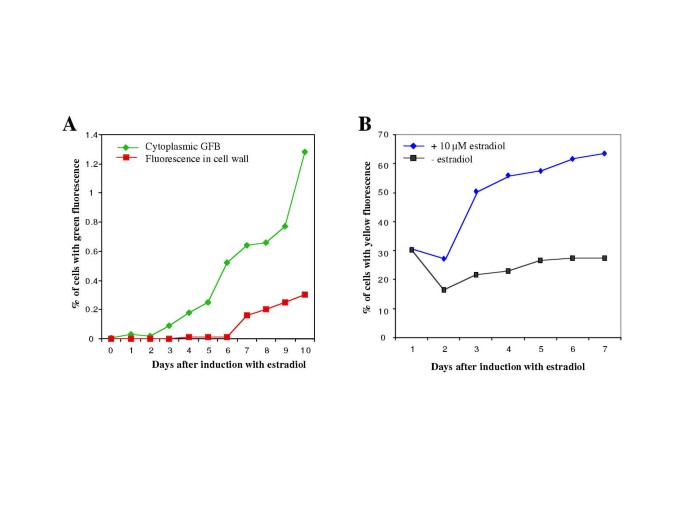
绿色自发荧光化合物的积累首先在ERE :: P1细胞加入雌二醇后2-3天的细胞质中(图观察到。2A).诱导后六至七天,细胞的一部分开始在细胞表面上显示绿色荧光。有趣的是,即使在雌二醇诱导后9-10天后,培养中的总细胞的2%只含有细胞质或细胞表面的绿色荧光化合物(图。2A).与绿色自动荧光相比,在未用雌二醇处理的细胞中经常发现黄色自动荧光化合物(图。2B.),但诱导P1表达增加积累这些化合物的细胞数量(图。2B.),以及在细胞中的黄色荧光的量。从诱导7天ERE :: P1 BMS细胞获得的甲醇提取物的荧光光谱性质进行了比较,那些不表达P1控制BMS细胞。在568nm处观察到最大荧光(在一个相当宽的峰,激励440 - 460纳米),用绿色和黄色荧光的用FITC过滤器的显微镜观察相一致[16.].
黄色荧光化合物聚集到中央液泡
黄色自动荧光化合物积累在离散结构(YFBs,黄色荧光体)(图1的形式的中央液泡。3A,3B).每个液泡的YFBs数量是可变的,有些液泡只有很少的YFBs(图)。3A),而其他人可以有50个或更多的YFBS(图。1).黄色荧光也可以在类似于囊泡的小体形式的细胞质中找到(图。1).因此,很容易推测细胞质是黄色自荧光化合物合成的起始位点,这些化合物通过囊泡状结构进入液泡。
YFBS在液泡中的积累是有趣的,并且类似于在许多红色和蓝色花朵的花瓣中经常发现的花氰酸血泡夹杂物(AVI)[18.].在ePifloorEcearcearcock下,YFB具有常规边界(图。3A,3B).然而,透射电子显微镜(TEM)显微照片显示出类似于YFB的尺寸的真空电子密集体,但是具有不规则的边界(图。3 c, d).虽然我们怀疑固定条件可能负责在TEM照片的边界不规则,我们不能断然从这些研究结果得出结论膜是否环绕空泡YFBs与否。
绿色荧光化合物到细胞壁的运输
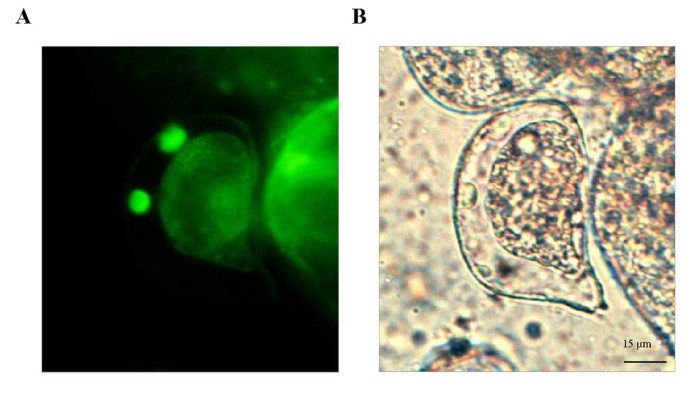
类似于黄色荧光化合物,绿色的自动荧光化合物最初以类似于囊泡的小体形式累积细胞质,其聚集成非常大的GFB(图。图4A,4B).在较长时间内,雌二醇诱导后,越来越多的细胞聚集在细胞壁附近(图)。4摄氏度),表明这些结构的迁移朝向细胞的外周。绿色荧光在细胞壁观察到(图4 d)表明这就是绿色自荧光化合物的最终归宿。与这些观察结果一致,雌二醇诱导ERE::P1细胞的原生质体在细胞质中积累GFBs,但细胞表面缺乏绿色荧光(未显示)。为了进一步研究绿色自荧光化合物在细胞表面的积累,我们利用了通常在BMS培养中出现的细胞质化细胞的罕见例子。当我们检测大量雌二醇诱导的ERE::P1 BMS细胞时,我们经常在质浆化细胞的周质间隙中发现类似GFBs的结构(图)。5、5 b).
GFBs的存在与er衍生的电子密度体的存在是一致的
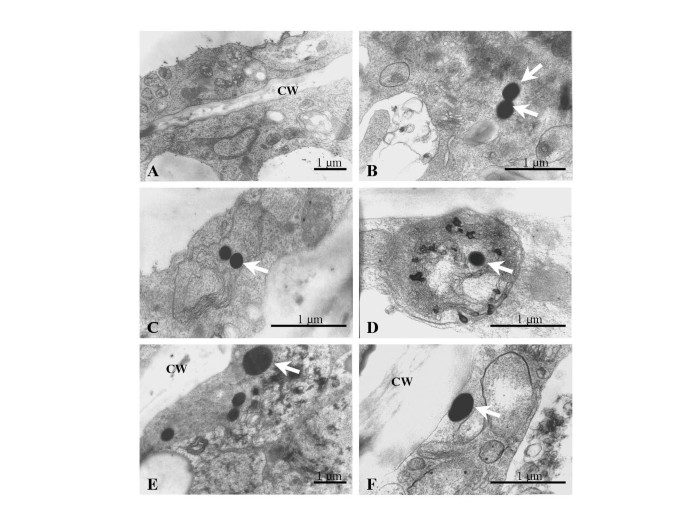
为了更好地确定GFB的来源和解剖学,将积聚这些体的细胞与来自雌二醇诱导4天的Mere :: P1 BMS悬浮培养物分离出来的细胞。通过透射电子显微镜(TEM)固定并检查细胞。绿色荧光细胞含有电子密集的球形(图1中用箭头表示。6.).这些电子密度小体,在不积累GFBs的细胞中没有,被发现与类似扩大的ER的结构密切相关(图。6摄氏度)BMS过度表达P1的特征,以及靠近质膜(图。6 e, 6 f).这些电子致密体的尺寸很少超过300nm(图。6.).之前在35S::P1细胞中也观察到类似的电子密度结构[16.].违背GFBs,这有时在周质空间观察到的,电子致密结构被发现保险丝与质膜[16.].
高尔基干扰剂对绿色荧光化合物分泌的影响
确定绿色自荧光化合物的分泌是否涉及高尔基体和transGOLGI网络(TGN),我们研究了GOLGI扰动剂相对于诱导的IRE :: P1细胞中存在的绿色自动荧光化合物的积累和分布的影响。Brefeldin A(BFA)通过促进GOLGI装置的拆卸来阻断蛋白质分泌[20.那21.].用BFA处理植物细胞会导致TGN完全丧失囊泡形成和er -高尔基杂交室的产生[22.].我们合理化,如果TGN参与绿色自动荧光化合物到细胞壁的分泌物,那么细胞壁多糖分泌的情况如此,就像分泌细胞壁多糖的情况一样[23.,表皮蜡[8.,则BFA处理可消除细胞壁荧光。
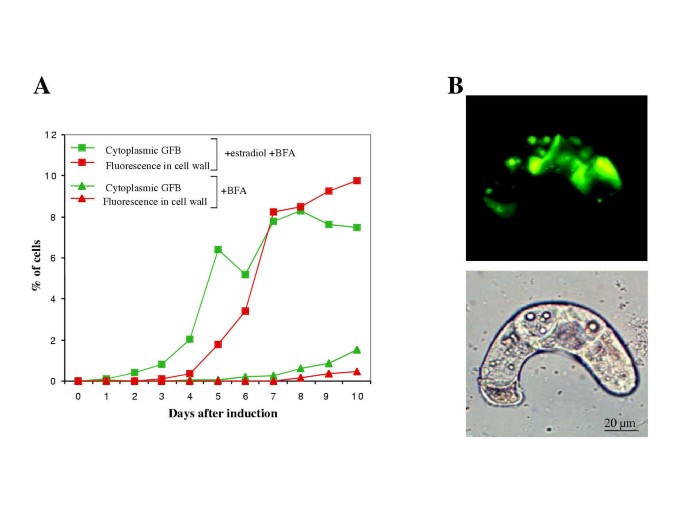
当同时用10 μM雌二醇和10 μg/ml BFA处理ERE::P1细胞时,我们观察到细胞质中积累GFBs的细胞数量显著增加(图。7一个).例如,在八天中,超过16%的雌二醇和BFA处理细胞累积的绿色荧光(图。7一个),相比之下,仅用雌二醇处理的细胞不到1%(图。2A).在诱导后2-4天的绿色荧光累积细胞增加并持续到第10天,此时细胞开始累积棕色色素沉着,提示细胞死亡(未显示)。然而,尖锐地,细胞壁中具有绿色荧光的细胞的数量比例地以延迟的方式比例增加到具有GFB的细胞数量(图。7一个).用仅为10μg/ mL的BFA(无雌二醇)的ERE :: P细胞导致绿色荧光累积细胞的非常低的诱导(图。7一个),这可能是因为在激素缺乏的情况下,P1的表达水平较低。除了细胞质和细胞壁荧光的增加外,用BFA处理的雌二醇诱导的细胞经常积累充满绿色荧光的异常膜结构(图。7 b).这些结构仅存在于用BFA处理的细胞中存在,并且在ERE :: P1细胞中从未观察过仅与雌二醇处理的细胞。这些结构可以对应于填充有绿色荧光化合物的ER隔室,其将进一步提示ER作为该化合物的初始积累的次数。或者,管状组织(图。7 b)可以对应于在延长暴露(5小时)至BFA后在烟草BY-2细胞中观察到的海绵状结构。22.].
为了确定绿色自动荧光化合物的分泌不需要TGN的完整性,我们用雌二醇和宫蛋白治疗IRE :: P1细胞,另一种具有不同的动作机制的TGN扰动剂比BFA有不同的动作机制[21.].治疗eRE :: P1细胞具有10μm雌二醇和10μm蒙霉蛋白,导致超过2天内的ORE :: P细胞的17%以上,在短短2天后累积绿色荧光,3天后高达30%,同时在具有仅为10μm的monensin(无雌二醇)的对照仅0.5%Is :: P1细胞在细胞壁(未示出)中含有绿色荧光化合物。然而,用宫蛋白治疗导致细胞死亡加速,使得不可能在更长的时间内研究该试剂的作用。与BFA不同,在治疗的五天内,具有细胞质GFB的细胞数量在2%上没有显着增加2%。该观察结果表明BFA和Monensin均增加细胞壁荧光;细胞质荧光的明显影响可以反映BFA和宫蛋白功能的不同机制。黄色荧光化合物的积累和真空定位不受BFA或Monensin(未示出)的处理的影响。
讨论
在这里,我们研究了绿色和黄色自荧光化合物在玉米BMS培养的细胞中的积累,作为潜在的标记跟踪植物小分子的亚细胞运输。更好地了解植物化学物质在植物细胞内部和细胞之间移动的过程是操纵植物代谢的中心。
我们发现,绿色和黄色的自荧光化合物针对不同的亚细胞室:绿色荧光化合物针对细胞壁,黄色荧光化合物针对液泡。细胞壁和液泡是酚类化合物积累的两个主要场所[2].Thus, establishing the pathways used by these fluorescent compounds to traffic to these two structures can significantly advance our understanding of how important phytochemicals derived from phenolic metabolism are transported to the cell wall (e.g. lignins, phlobaphene pigments) or the vacuole (e.g. anthocyanins, sinapoyl esters, condensed tannins).
黄色的自荧光化合物最初积聚在细胞质中的小泡中。在液泡中,YFBs中存在黄色荧光化合物。这些yfb与存在于许多细胞中积累高水平花青素的AVIs和花青素质体有惊人的相似之处[18.[表达C1和R调节器的BMS细胞[16.].我们还没有确定膜是否封闭这些化合物,这是一种与AVIS有争议的问题[18.].
绿色荧光化合物最初也在细胞质中积累。含有这些化合物的小泡状结构结合形成大的GFBs。GFBs似乎迁移到细胞表面,绿色荧光化合物被释放到细胞壁。GFBs的存在与透射电镜下明显的电子密度球形体的出现密切相关。类似于GFBs,这些球状结构可以在细胞表面发现,甚至融合到质膜。它们也存在于扩大后的内质网中,这表明内质网可能是它们最初的积累位点[16.].有趣的是,最近的一项研究拟南芥根确定了至少两种类黄酮生物合成酶,查尔酮合酶和查尔酮黄酮异构酶,定位于电子密度体,在尺寸和定位上类似于这里观察到的电子密度结构[24.].类似的囊泡样结构以前也观察到定位黄酮醇O.- 葡萄氨酰转移酶Chrysosplenium americanum细胞 [25.],而对于报春花kewensis'Chalcone合成酶[26.].这些发现不仅开发了类似于这里描述的电子密集体的细胞质结构的可能性不仅可以作为特异性植物化学物质的储存或运输,而且还参与其合成中的具体步骤,类似于对生物碱囊泡的发现[27.].
虽然诱人诱人的旨在推测在TEM和GFB中观察到的电子致密结构,但仅在P1表达的细胞中观察到,虽然是同样的,但它们的尺寸尖锐地不同。GFB的直径通常高达3μm,而球形电子 - 致密结构很少大于0.3μm的尺寸。我们不能排除大小差异是TEM研究样本固定的结果。或者,GFB和电子 - 密集体可以对应于通过P1的表达或通过P1调节化合物的积累诱导的不同结构。
之前的治疗:P1细胞与雌二醇和TGN令人不安的代理论坛或莫能菌素不会导致一个抑制细胞壁的绿色荧光的积累,因为这将会如果这些化合物的分泌途径类似于蛋白质,即通过TGN。相反,绿色荧光的积累在细胞壁中急剧增加。细胞壁中绿色荧光化合物的酶聚合或降解可以解释BFA或莫能菌素存在时细胞壁荧光的增加。该酶的分泌会被BFA和莫能菌素阻断,导致细胞壁绿色荧光增加。与此相反,BFA和莫能菌素并没有增加黄色荧光化合物在液泡中的积累,表明绿色荧光化合物和黄色荧光化合物分别通过不同的机制向细胞壁和液泡运输。
本文的结果表明,BMS细胞中存在不需要TGN的绿色荧光化合物的分泌途径。先前的结构分析表明存在分泌途径,包括ER与质膜的直接融合,或来自ER的囊泡,但似乎不涉及TGN [3.].表达P1的BMS细胞中存在的GFBS的性质是什么?根据我们目前的知识,我们不能排除GFB是蛋白质或结晶性质的正式可能性。实际上,我们已经通过从轻微裂解的原生质体中的差异离心,在YFBS保留其身份和荧光特性(未示出)的条件下,我们已经无法将这些尸体隔离。然而,在诱导的IRE :: P1 BMS细胞的周质空间中观察GFBS类似于培养中许多动物细胞的外虫物的分泌[28.].外泌体被认为来自晚期多囊室,如核内体或树突状细胞和一些造血细胞的分泌溶酶体[29.].GFBs可能来自内体或空泡腔室,这与观察到的对BFA和莫能菌素不敏感相一致,因为源自这些腔室的分泌途径可能是在药物引起的高尔基阻滞之后。或者,GFBs可能对应于ER的某些特殊领域,具有与质膜融合的能力。确定GFBs的身份以及在分泌其他代谢物的细胞中存在类似结构,将为植物将植物化学物质运输到细胞表面的机制提供基础信息。
结论
绿色和黄色的自荧光化合物是研究特殊化合物(植物化学物质)在植物细胞内从合成位点到最终积累的机制的潜在有力工具。虽然这些化合物的化学特性和合成位置仍有待确定,但很明显,在细胞内跟踪这些化合物的荧光特性的可能性将允许对它们积累的结构进行分离和生化表征。绿色荧光化合物的分泌显然是通过与蛋白质分泌不同的机制发生的。目前正在研究这是否涉及特殊的囊泡系统。建立植物化学物质亚细胞运输途径是植物代谢工程成功的关键。
方法
BMS细胞与雌二醇的治疗和高尔基干扰剂
BMS细胞生长并保持在先前描述的条件下[30.].新副培养的细胞用于治疗雌二醇和高尔基干扰剂。对于雌二醇的诱导,将25μl乙醇中的20mMβ-雌二醇17-丙酸盐(Sigma)的储备溶液加入到50ml BMS细胞培养悬浮液中。对于Golgi扰动剂的治疗,在乙醇中制备20mg / ml BFA(Sigma)和20mm的莫素(Sigma)的储备溶液。用BFA处理以10μg/ ml的终浓度为10μg/ ml,并且在10μm的莫素中进行。对于显微镜检查,处理后每24小时取出0.5-1毫升细胞培养物。
显微镜方法
用细胞培养基将BMS细胞稀释至100,000细胞/ml。表面荧光实验:将50 μl稀释的细胞载于载玻片上,载玻片为20 × 40 mm。用Zeiss Axiovert-100荧光显微镜与Bio-Rad MRC-1024成像系统耦合,使用适合FITC检测的蓝色滤光片对含有GFBs或YFBs的细胞进行计数和拍照。使用柯达35mm玻片(160 T)拍摄照片,每个样本至少观察到10000个活细胞。
电子显微镜
含有YFBs和GFBs细胞被拾起使用荧光显微镜下的微操纵器(MMO-203,NARISHIGE)。在2.5%戊二醛双注视和1%的OsO后4.,将细胞嵌入斑块的低粘度树脂中。超薄切片用超薄切片机(Reichert ULTRACUT E)制备。将该部分安装在涂有FormVar膜的100目镍网上,并用1%乙酸铀染色10分钟,0.3%柠檬酸盐5分钟。使用飞利浦301透射电子显微镜进行观察和摄影。
缩写
- AVI:
-
花青素空泡的夹杂物
- BFA:
-
布雷菲德菌素A
- BMS:
-
黑色的墨西哥甜
- ER:
-
内质网
- GFB:
-
绿色荧光体
- TEM:
-
传输电子显微镜
- TGN:
-
trans高尔基网络
- YFB:
-
黄色荧光体。
参考
- 1。
Verpoorte R:植物次生代谢。植物次生代谢的代谢工程。编辑:Verpoorte R, Alfermann AW。Kluwer学术出版社,2000:1-29。
- 2。
Grotewold E:植物化学物质的亚细胞贩卖。建议RES杰韦利植物生理学。2001年,2:31-48。
- 3。
KroneStedt-Robards E,Kronestedt Aw:腺细胞中的胞尿精。剑桥大学。新闻,U.K.1991。
- 4。
Walker Ts,Bais HP,Grotewold E,Vivanco JM:根出渗出和根际生物学。植物理性。2003,132:44-51。10.1104 / pp.102.019661。
- 5.
Theodoulou FL: Plant ABC transporters。生物化学学报。2000,1465:79-103。10.1016 / s0005 - 2736(00) 00132 - 2。
- 6.
Jasinski M,Stukkens Y,Degand H,Purnelle B,Marchand-Brynaert J,Boutry M:植物膜膜ATP结合盒式传送器参与抗真菌萜类分泌。植物细胞。2001,13:1095-1107。10.1105 / TPC.13.5.1095。
- 7.
Zamski E,Shoham O,Palevitch D,Levy A:刺辣椒和非辛辣椒中的冠状内霉素分泌细胞的超微结构(辣椒anuumL.)品种。BOT GAZ。1987,148:1-6。10.1086 / 337620。
- 8.
Jenks Ma,Rich PJ,Ashworth En:软木细胞参与在外部蜡丝的分泌中高粱二色的moench (l)。acta botanica sinica(云南植物科学学报),1994,29(6):514 -518。10.1086/297190。
- 9。
st . pierre B, Vazquez-Flota F, De Luca V:多细胞区隔Catharanthus roseus也叫生物碱生物合成预测通路中间体的细胞间易位。植物细胞。1999,11:887-900。10.1105 / TPC.11.5.887。
- 10.
Stafford HA:类黄酮新陈代谢。CRC Press,Inc,Boca Raton,美国1990。
- 11.
Hrazdina G,瓦格纳GJ:代谢途径酶的复合物:用于在膜相关酶复合物和苯丙类黄酮合成的证据。拱生物化学生物物理学。1985年,237:88-100。
- 12.
Winkel-Shirley B:苯丙烷丙烷和黄酮途径中酶复合物的证据。physiol植物。1999,107:142-149。10.1034 / J.1399-3054.1999.100119.x。
- 13。
Marrs KA, Alfenito MR, Lloyd AM, Walbot V:谷胱甘肽S.- 由玉米基因编码的真空转移涉及的转移酶青铜2.自然。1995年,375:397-400。10.1038 / 375397A0。
- 14。
Mueller La,Goodman Cd,Silady Ra,Walbot W:AN9,矮牵牛谷胱甘肽S.-转移酶,是一种类黄酮结合蛋白。植物生理学报。2000,23(4):451 - 457。10.1104 / pp.123.4.1561。
- 15.
Debeaujon我,佩特斯AJM,莱昂,Kloosterziel KM,Koornneef玛:透明TESTA12基因的拟南芥编码种皮内皮细胞液泡中类黄酮隔离所需的多药二级转运蛋白。acta botanica sinica(云南植物学报). 2001,13:853-871。10.1105 / tpc.13.4.853。
- 16.
Grotewold E,Chamberlain M,St Claire G,Swenson J,Siame Ba,Butler Lg,Snook M,Bowen B:通过异位表达转录因子的异位表达,玉米细胞中的工程二次新陈代谢。植物细胞。1998,10:721-740。10.1105 / TPC.10.5.721。
- 17.
Grotewold E,Drummond B,Bowen B,Peterson T:themy同源P.基因通过直接激活一种类黄酮生物合成基因子集对玉米花器官的磷酰苯胺色素沉着。细胞。1994年,76:543-553。
- 18.
Markham Kr,Gould Ks,Winefield CS,Mitchell Ka,Bloor Sj,Boase Mr:花氰酸血管血管夹杂物 - 它们在花环中的性质和意义。植物化学。2000,55:327-336。10.1016 / S0031-9422(00)00246-6。
- 19.
Bruce W,Forkerts O,Garnaat C,Crasta O,Roth B,Bowen B:由雌二醇可诱导转录因子CRC和P.植物细胞控制的玉米类黄酮途径基因的表达谱。2000,12:65-80。10.1105 / TPC.12.1.65。
- 20.
Klausner Rd,Donaldson Jg,Lippincott-Schwartz J:Brefeldin A:控制膜交通和细胞器结构的洞察。J细胞BIOL。1992,116:1071-1080。
- 21.
EG:高尔基干扰剂。中国生物医学工程学报。1998,19(6):531 - 534。10.1007 / s004180050256。
- 22.
ritzenthaler c,nebenfuhr a,movafeghi a,stussi-garaud c,behnia l,pimpl p,Staehelin la,罗宾逊dg:使用烟草亮黄色2细胞对植物细胞的Brefeldin a对表达的Golgi靶向绿色荧光的影响重新评估蛋白质和Copi抗血清。植物细胞。2002,14:237-261。10.1105 / TPC.010237。
- 23。
Driouich A, Faye L, Staehelin LA:植物高尔基体:复杂多糖和糖蛋白的工厂。生物化学学报。1993,18:210-214。10.1016 / 0968 - 0004 (93) 90191 - o。
- 24。
2 .王志强,王志强,王志强,等。拟南芥中类黄酮酶的研究进展。植物学报,2001,27:37-48。10.1046 / j.1365 - 313 x.2001.01073.x。
- 25。
Latchinian-Sadek L,Ibrahim RK:Flavonol戒指B特定O.- 氟辛瘤转移酶:纯化,生产多克隆抗体和免疫致橡胶化。拱生物化学生物物理学。1991,289:230-236。
- 26。
Schopker H,Kneisel男,Beerhues L,Robenek H,Wiermann R:在腺体苯丙氨酸氨 - 裂合酶和查耳酮合酶报春花kewensis(Wats, W)-免疫荧光和免疫金定位。植物学报。1995,196:712-719。
- 27。
植物生物碱的生物合成:生物化学、细胞生物学、分子调控和代谢工程应用。植物营养与肥料学报,2001,22(4):429 - 434。10.1146 / annurev.arplant.52.1.29。
- 28.
Thery C,Zitvogel L,Amigorena S:外来体:组合物,生物合成和功能。NAT Rev Immunol。2002年,2(8):569-579。
- 29.
常规溶酶体的调节分泌。细胞生物学杂志。2000,10:316-321。10.1016 / s0962 - 8924(00) 01794 - 3。
- 30.
代谢物分析作为功能基因组学工具。植物功能基因组学:方法与方案。编辑:Grotewold E. Humana出版社,新泽西州,2003,236:415-426。10.1385 / 1 - 59259 - 413 - 1:415。
致谢
我们感谢约翰·罗杰斯在这些研究开始时提出的建议,感谢丁彪和乔治·海涅对这份手稿的评论。我们感谢特洛伊·帕多克对荧光化合物的化学分析提供的帮助。国家自然科学基金资助项目(MCB-0130062)。信件应寄交例如
作者信息
从属关系
相应的作者
附加信息
作者的贡献
Y.L.开展ERE :: P1细胞的所有显微镜实验。你。调查BFA在BMS细胞中的TGN网络的影响。例如。参与了设计和项目监督并起草了手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
林,Y.,Irani,N.G。&Grotewold,E。利用玉米细胞中的自动荧光化合物探索的植物贩运亚细胞贩运。BMC植物杂志3,10(2003)。https://doi.org/10.1186/1471-2229-3-10
收到了:
公认:
发表:
关键词
- 蒙斯林
- 跨戈尔基网络
- 荧光化合物
- 黑色的墨西哥甜
- 黑色墨西哥甜细胞