摘要
背景
红色成熟的西红柿是由激素和发育信号,同时引起各种果实组织的成熟或分化控制许多生理变化的结果。这些生理变化会影响视觉,质地,风味和香气特点,使得水果更吸引潜在消费者对种子的传播。番茄果实成熟了,直到最近,一直缺乏严格的调查发育调控。我们以前指出在由TIGR基因番茄指数数据挖掘熟番茄果实上调的转录因子的存在。在我们的体外系统,绿番茄萼片在16至22培养℃,变成红色和溶胀等成熟番茄果实而那些在28℃下保持绿色。
结果
推定的发育基因在这里,我们进一步研究调控可能参与了番茄果实成熟和发展。利用分子生物学方法,我们已经确定在基因的多种转录物的相对丰度在体外萼片成熟和番茄果实果皮发育三个阶段。许多转录本在水果中表现出类似的表达RIN和PSY1而其他基因则表现出完全不同的表达。
结论
我们的调查结果证实了我们之前的一些数据库挖掘结果,并揭示了基因表达的差异,这可能是番茄品种变异的重要因素。我们提出了新的和有趣的基因信息,现在应该以更集中的方式进行研究。
背景
红色成熟(RR)西红柿,吸引人的眼球以及腭,是许多生理的结果来改变由激素,环境和发育信号控制,同时引起各种果实组织的成熟或分化。这些生理变化影响视觉,质地,风味和香气特点,使果品吸引更多的潜在消费者对种子的传播。一种激素线索,乙烯释放,在呼吸爆发的这个跃变型果实成熟过程中的发病活跃,已详细多年来审查[1,2].转基因番茄植株表达乙烯生物合成酶的反义基因,表明乙烯是番茄果实成熟所必需的[3.].然而,在血液乙烯突发之前必须发出信号乙烯诱导。因为1-氨基环丙烷-1-羧酸合成酶(ACC),在乙烯生物合成中诱导乙烯生物合成的酶,呈乙烯进化开始,似乎合理地认为其他因素控制成熟果实的早期发育阶段[4,5].E8.,一个功能未知的基因,在rin突变体,不表现出乙烯进化的跃变爆发[6].因此,在果实成熟过程中,至少有两个不受乙烯控制的基因得以表达。
番茄果实成熟的发育调控至今缺乏严谨的研究[1].转录因子在植物和动物发育的许多方面都至关重要,并参与植物对胁迫和环境线索的反应[7- - - - - -9].转录调节也被牵连在植物进化和自然变化的重要因素[10,11].玉米从大刍草进化而来,至少部分原因是调控区域的突变墨西哥类蜀黍branched1(TB1),负责分枝长度的基因。在该基因的调控区发现了核苷酸多态性,而不是在预测蛋白的编码区[11].番茄果实大小的变化被认为是由涉及数量性状位点的基因调控的变化引起的fw2.2,它包含一个开放的阅读框ORFX[12].ORFX更丰富的小的水果番茄,建议ORFX可能编码一个负的水果大小调节因子[12].水果的形状受到一种新型调控基因的影响,卵圆形的,这是由染色体走向卵圆形的数量性状位点(QTL)[13].这种基因的一个突变会导致番茄果实的形状从圆形变成梨形[13].一个转录因子,MADS-Box基因RIN,直接参与番茄果实成熟,另一个,番茄同源物拟南芥花organ-identity基因无性生殖的,标签1,在果实成熟和离体萼片在低温下成熟时上调[14,15].随着EST数据库中核苷酸序列信息的爆发式增长和微阵列分析等新技术的应用,对番茄果实成熟发育过程的深入研究应该成为可能。水稻和水稻的序列分析拟南芥蒂利亚纳基因组显示推测的转录因子的数量为>1500拟南芥在米饭中有类似的数字,可能是番茄[16- - - - - -19].事实上,最近对tiger番茄EST数据库的一项调查揭示了一些可能与成熟相关的转录因子[20.].
变化的大量番茄红素积累的成熟的番茄量品种间出现。的番茄红素含量一项调查报告的范围从0.21到一个非常令人惊讶的702.1微克/克FW [21].这种令人惊讶的高含量可能是从去除水果中所在的部分[22].VFNT樱桃(VC),小结实番茄,含有200微克/克FW番茄红素在成熟果实,而的Ailsa克雷格(AC),中结实番茄,含有约70.5微克/克FW番茄红素[23,24].在我们的VC萼片离体培养系统中,保持在16 ~ 22℃的绿色萼片膨胀成熟,产生番茄果实挥发物,积累番茄红素[23].保持在28°C的萼片保持绿色,不积累番茄红素。类胡萝卜素番茄红素形成成熟西红柿的红色,也是一种抗氧化剂,被认为有助于预防一些癌症,包括前列腺癌。为了确定哪些转录因子在番茄果实成熟和离体萼片成熟过程中起重要作用,我们研究了它们在两个不同番茄品种(VC和AC)的果实成熟过程中的调控作用,以及在16和28℃离体VC萼片培养过程中的调控作用。
结果与讨论
萼片形态发生期间的基因表达
VC番茄萼片培养在体外在16 - 22°C时,将它们的发育程序转换为成熟的果实[25].它们膨胀,降低叶绿素含量,产生乙烯,积累番茄红素,释放水果挥发物[23].RT-PCR结果见图。1表明在16°C或28°C离体培养的萼片中出现多种基因表达模式。本实验取第0天的绿色萼片,在16或28°C下培养。在培养2天后,萼片在两种温度下相似,在14天后保持绿色,但在两种温度下更肿胀。在24 d时,16°C的萼片开始积累番茄红素,呈黄橙色,而28°C的萼片仍呈绿色。八氢番茄红素合成酶1(PSY1)是一种类胡萝卜素生物合成酶,在番茄果实成熟过程中受到高度调控[26,27[这里用于表示在凉爽的温度处理的萼片中成熟的果实。二植物合成酶基因在番茄中发现,PSY1和PSY2;众所周知PSY1成熟的番茄果实是初级成绩单[26].我们还表明在类似的实验,该PSY1是成熟萼片中的初级转录本(未发表)。
出现的更戏剧性和主要的表达模式之一是PSY1,标签1,TM4,TM6,(AP2样)TC85031,TC85646,(YABBY2样)TC89502和TC84976。这些基因的转录物全部在16℃下在第14天或24天诱导,虽然在28℃培养的萼片中看到很少或没有变化。这些转录物,标签116℃时表达量最高,28℃时几乎无表达;其他转录本在16°C诱导,但在28°C也有低基础水平的表达,在24天轻微增加。PSY1、TC85031、TC89502、TC85646在16℃下放置2天后均有一定程度的诱导。之前,Ishida等人[15]表明了标签1,番茄同源物无性生殖的,一个MADS-Box基因参与拟南芥花发育,在萼片形态发生和果实成熟过程中上调。此外,在低温处理的萼片和成熟的果实中,聚半乳糖醛酸酶(PG)的mRNA水平升高。事实上,异位表达无性生殖的使温室植物的萼片膨胀并失去叶绿素,当将这些植物置于16 - 18°C时,萼片就会积累番茄红素[28,23].异位表达单独的事实无性生殖的没有足够的显著番茄红素积累表明,需要额外的因素,以使这个成熟过程发生。其他MADS-Box基因在7°C夜间和17°C白天的植物番茄花中被诱导[29].TM4,TM5,TM6,和标签1都诱导番茄花的凉爽温度处理的植物。这些植物的鲜花表现出患型物质和单独的转化,如木质萼片和胭脂蛋白雄蕊[29].这些异常可能与这些基因的高表达有关[29].我们在成熟过程中调查了许多推定的转录因子[20.]为了更完全了解有助于冷静萼片形态发生的过程。我们的RT-PCR结果显示了熟练相关的发育调节剂的许多有希望的候选者(图。1).TM4,标签1和TC84976均在低温生长过程中被诱导,在果实成熟过程中也被上调。我们在这里的结果证实了先前的结果TM4和标签1低温生长时的上调调节[15,29].TM6然而,由凉爽温度引起的,但在果实成熟下调。TM5在16°C处理14 d后仅表现出轻微的诱导,在tiger数据库分期果实采集中未出现。
这些结果指示的第二种模式是RIN,最近发现的番茄果实成熟所需的MADS-Box基因[14,它在低温培养过程中有一个非常有趣的表达模式。该基因在16和28°C的培养前14天的某个时间被诱导(图。1).而RIN在16℃下诱导更高的水平,在28℃下的诱导似乎似乎是显着的并且表明可能是由其他一些因素引起的发育过程的开始而不是冷温度。但是,该程序在28℃下不包括大的番茄红素积聚或标签1或PG老年病[25,15].一个推测的MADS-Box基因TC92226在果实折断-扭转阶段表达上调,但在本实验使用的周期数中,在萼片中未检测到该基因。
同源盒基因编码含有60个氨基酸基序的转录因子,这是一种称为同源结构域的dna结合结构。同源盒基因在植物的许多发育过程中起作用[30.].Bell1(BEL1)的同源盒基因拟南芥,影响胚珠发展[31].BEL1蛋白可以通过保守的蛋白基序与其他转录因子,特别是KNOX TALE同源结构域蛋白相互作用,这些因子共同激活转录[32].TC85646和TC89506具有66和46%的相似之处BEL1在氨基酸水平上,分别;然而,它们的基因表达模式不同(图1).TC85646在16°C诱导24天,而TC89506在28°C诱导14天,持续24天。这些基因是抑制还是激活其他基因的转录还需要进一步的研究。
含锌手指含有核酸结合蛋白质影响植物生殖发育[9].Hua1,CCCH型锌 - 手指蛋白拟南芥,调节雄蕊和心皮的特性,是一种rna结合蛋白[33].我们之前通过EST数据库的序列相似性搜索,鉴定出5个推测为HUA1-like的番茄转录本[20.].本实验研究了转录本TC87219和TC86074,其中只有一个转录本TC87219在16°c培养的萼片中被轻微诱导。WRKY锌指转录因子,因其锌指基序n端所含的氨基酸序列WRKYGQK而得名,主要参与植物的防御反应[9].但是,一个獾转录因子拟南芥,透明无毛种皮2(TTG2.),似乎与毛状体的发育有关[34,35].在我们的萼片实验中,在24天的培养后,只有TC95361略微诱导16℃。
TC89502最相似YABBY2,一拟南芥锌指蛋白,属于含有锌指结构域和螺旋-环-螺旋结构域(YABBY结构域)的转录因子蛋白家族,并确定细胞的轴向命运[36].该转录本在低温生长下诱导表达,在28°C时没有相应的增加。
MYB基因包含dna结合,氨基酸基序类似于那些发现c-MYB,动物原子致癌细胞反击部分V-MYB,禽流感成肌细胞瘤病毒的致癌成分[37].in.拟南芥已有超过92个MYB基因被描述[38].在植物中,MYB基因调控植物生长和病原体防御中的次生代谢、细胞形态和信号转导[39].14mybLin等人从番茄中克隆了相关cdna并对其进行了表征[39].我们之前在tiger番茄EST数据库中鉴定了超过136个推测的MYB转录本[20.].我们调查了其中一个TC85864,因为它在成熟的番茄果实中表达。我们的RT-PCR导致萼片实验在培养14天后在28℃下表明诱导,在16℃下进行诱导。用于该转录的推导蛋白含有两种MYB结构域,其与其相似93%和80%的身份。拟南芥R2R3-MYB基因CAA74604。需要进一步研究来确定该转录因子的功能。然而,在基因破坏实验中,Meissner等人。[38]在26个基因的32个纯合子插入系中未发现明显的表型。即使是更密集的温室和平板筛选也未能找到这些植物中的大多数的表型,这可能表明冗余[38].
在TIGR数据库的果实收集中鉴定的三种推定的多元组基因[20.]也没有太多的结果在我们的实验中萼片(图调查。1).在这个数量的PCR循环中,两个转录本未被检测到,第三个转录本几乎没有调控。多梳蛋白被认为通过与其他多梳蛋白形成复合物来重塑染色质并抑制基因转录而发挥作用[40,41].
先前认定为TC85031一个AP2结构域的基因与有趣的结果进行了研究。花发育的ABC模型涉及一种系统,其中萼片的A类基因表达指定的形成和结合的一类B基因指定花瓣形成。B和C基因的表达一起指定雄蕊形成,和C的表达单独指定心皮同一性[42,43].in.拟南芥,APETALA2(AP2),根据ABC模型的B函数基因,是拮抗的AG)并负面规定AG)在萼片和花瓣中的表达[44].我们的RT-PCR结果表明,TC85031在24天生长之前在16°C时高度诱导。表达这一点AP2类基因似乎与的相似标签1, EST分析表明该基因在成熟的番茄果实中高度表达[20.].AP2在拟南芥不遵循其他花器官特性基因的表达模式,因为它普遍表达于拟南芥[45].这AP2-like基因可能没有与之相同的功能拟南芥基因。可能的正交AP2在佩妮PhAp2A并补充拟南芥ap2-1突变,但表达拟南芥AP2在矮牵牛花中没有产生预期的表型[46,47].tiger番茄数据库列出了另一个AP2类转录本TC100241,在番茄果实中不高表达,但在花中表达。也许TC100241是拟南芥花同源,而TC85031可能在水果不同的功能。
TC85295是一种转录本,其编码的蛋白质与WCOR413非常相似,WCOR413是小麦中的一种低温诱导蛋白(小麦) [48].在凉爽的温度生长14天后,在我们的系统中也诱导了番茄中的该转录物。该蛋白质的功能未知,但序列分析表明若干跨膜螺旋,表明它在冷应力期间稳定质膜[48].
在所有情况下,我们表明,凉爽的温度萼片形态发生与致癌的疯箱基因的诱导基因表达复杂,标签1,TM4,和TM6,以及可能的发育调控RINTC85031、TC84976、TC85646、TC85295等特异功能尚不清楚的基因表达。两个调控功能未知的基因,TC89506和TC85864在28℃上调。需要进一步的实验来确定这些假定的调节器的具体功能。
两个番茄品种果实发育过程中表达基因的RT-PCR分析
番茄果实品质受遗传、环境、采前和采后等多种因素的影响。风味和香气挥发物因品种而异,在成熟过程中[49,50].环境和文化因素也会影响西红柿的味道[51].收获,处理和收获后处理也可能会影响果实品质[52].许多数量性状位点(qtl)和基因与番茄果实大小和形状有关[12,13].其中一些基因座和基因,即QTLfw2.2,取得了ORFX, QTL卵圆形的这产生了卵圆形的,似乎是水果大小和形状的新型负调节因子[12,13].我们对番茄成熟的调节特别感兴趣,这是一种更年期的果实。虽然在番茄中已经严格地研究和操纵了乙烯进化,但在番茄果实成熟的发育调节调查中,很少完成[1].如前所述,转录因子涉及植物和动物发育的许多方面。基因调节的差异可能算是在生物体演变过程中发展的生理和形态学差异10].包含同源盒的基因的5 '非翻译序列的改变Let6.对基因表达的表达改变先前取消素叶的表型以固定[53].这表明转录因子丰富的简单差异可能是植物中的形态学和生理方差的原因。至少一个基因,一个疯子箱基因RIN,是成熟的发育调节所必需的,标签1,涉及水果发展[14,15,28].我们的结果与先前的结果一致RIN和标签1结果并提出其他发育调节因子可参与果实开发和/或成熟。以前,我们描述了许多推定发育调节因素的基因表达谱[20.在tiger Tomato EST数据库中,番茄生长发育的不同阶段。在这里,我们提出了进一步的证据,其中一些基因可能参与番茄果实的发育。
MADS Box基因家族拟南芥由80多个成员组成,表明这些转录因子在植物中的重要性[18].RIN和标签1显示与之前公布的规则相似的规则。RIN在转阴期和红熟期均有较高的表达。在两个品种中表达的相似性表明该基因对成熟过程至关重要。标签1VC和AC的表达差异较大,实际上TC84976、TC90812和TC85320的转录本丰度均存在差异。表达的标签1在转基因番茄植株中使萼片变成果皮[28].这种效应可以反映果实成熟的关联标签1或表明大量的TAG1可能部分模拟另一个MADS-Box基因的作用[1].TM4在转动阶段上调并在红色成熟阶段下降,呈现出品种之间的差异很小。TM4,在花发育早期表达,在低温生长时上调[29,54].Seymour等人[55)提出TM4(TDR4)参与果实质地的,因为缺乏在这种基因的成熟相关的感应中国北车突变和蛋白质序列的相似性拟南芥基因富有成果的.的中国北车由于细胞分离增加,突变体与野生型的果实纹理不同。这些调查人员构建了转基因植物以确定之间的关系TM4和水果纹理[55].根据我们的结果,TM5在果实中似乎不高表达,但在转折期确实表现出一些诱导。TM6低温诱导的另一个番茄MADS Box基因在成熟绿期表达量高,而在转绿期和红熟期表达量低。两个品种之间表达的差异可能表明,该转录本在成熟过程开始之前具有关键作用。在我们之前的文章中,我们注意到TM6根据TIGR数据库显示,成熟绿期的表达量高于未成熟绿期、破碎绿期或红色成熟期[20.].TM6属于金鱼草DEF/拟南芥AP3疯狂箱子基因的家庭在花卉身份中执行B函数。然而,它在番茄花中的表达模式不同于AP3或DEF.TM6是表达在三个内轮不同于花瓣和花药的表达AP3和DEF[56].TM29属于SEPALLATA疯狂箱子基因的家庭参与花器官身份[57].该基因在所有四个花器官的原基以及花序和营养分生组织中表达[57].表达反义基因的转基因植物从单性果中产生异位芽,表明TM29是单性果形成的负调控因子[57].我们的结果表明归纳TM29在凉爽的温度和两种品种的转动阶段,以及该基因的其他功能。TC92226,最相似的TC92226矮牵牛刺痛基因PAGL1(GenBank登录L33973),在两个品种的转动阶段上调节,但在本实验中使用的PCR水平的萼片中未检测到。该结果可以指示在16℃下培养的萼片的凉爽温度成熟现象的不完整性。TC85320和TC90812在两种品种和TIGR数据库配置文件中差异表达[20.],但显示冷却温度过程中表达变化不大,在体外培养。一个非常有趣的成绩单,TC90812,显示在VFNT一个乐队,是上调在RR,而在AC PCR产物表现为两个频段是减少强度TU和RR果实。无论是在AC果这两个波段代表一个基因家族或剪接变异体是在这个时候未知的,但是,由于这两个频段的调节是类似的,拼接可能是一个因素。TC90812是从一级氨基酸序列辣椒非常相似MADS1,但辣椒基因在花的坐果率,而不是在幼果中高表达[58].TC85320与辣椒疯盒基因非常相似,MADS6,其表达式模式与MADS1.[58].这两个MADS Box基因可能对成熟或果实形成并不重要,但可能提供了果实结构或生理变异的来源。
推定的Homeobox基因,TC85646,TC94540在转动阶段诱导,VC中TC85646的表达水平较高。相同基因的不同含量表达可以具有表型效应[10].TC94540在转弯阶段上调,但在体外成熟期间未在萼片中检测到,因此表明没有一些调节组分。
在我们研究的锌指家族基因中,只有TC89462、TC95361和TC89502在VC和AC之间存在差异表达。锌指蛋白WRKY家族的TC89462在VC果实红熟期表达增加,而在AC中则保持低表达。在tiger数据库中使用的TA496品种中,TC89462的表达量在断裂期最高。TC95361也是WRKY型锌指转录因子,在两个品种的成熟期(TU和RR)均有升高,但在VC中升高幅度更大。
唯一的myb型转录因子在两个品种和tiger数据库中均有差异表达。VC红熟期的TC85864含量高于其他阶段,AC绿熟期的TC85864含量高于其他阶段。tiger数据库显示该基因在破果期表达较高[20.].
在该实验中研究的三个推定的多元组基因中,在水果组织中仅检测到435419表达(图。1).该基因仅在VC红熟果实中检测到,在AC的任何果期均未检测到。再一次,多梳基因被认为是通过染色质的重塑来影响基因表达的[40,41].
的AP2类基因TC85031在果实中的表达模式与TM4一种MADS-Box基因。TC85031在果实翻熟中被诱导,在VC和AC中表达相似,这是否表明它在成熟的某些方面具有关键的性质?
我们选择TC85295作为研究对象是因为它在成熟过程中上调,根据TIGR番茄果实EST收集,该转录本的相对丰度从成熟绿色果实中的0.2 / 1000 ESTs增加到破碎果实中的0.5 / 1000 ESTs,在红色成熟果实中的1.0 / 1000 ESTs。我们的结果表明,在轮转和红色成熟果实中有高表达,但在两个品种之间没有差异。这些结果可能暗示了该基因在成熟过程中的重要性。我们认为这种基因应该在进一步的实验中检验。
结论
低温下萼片形态发生与番茄果实成熟过程相同吗?而一些基因的表达,如polygalacturonase.,植物合成酶,TM4,和RIN是相似的,在成熟的水果和萼片形态不同的其它基因的表达。TC92226和TC94540在水果都引起,但其诱导萼片成熟过程中无法检测到。另一方面,TM6是诱导在低温处理萼片,但不是在果实成熟。在这两个品种的基因表达中还可以看到许多其他的差异。我们仍然必须确定这些假定的调控因子中哪些对番茄果实成熟至关重要,以及它们如何影响成熟和果实发育。我们已经揭示了一些非常有趣的基因,以进一步研究,并证实了我们之前的EST数据库挖掘的许多结果。希望我们在水果开发游戏中提供了更多有趣的目标。
方法
萼片培养
直径3- 10毫米的绿色小果实的萼片是从温室种植的植物(Lycopersicon esculentum简历。VFNT樱桃)。萼片被去除,在基部分离,并在如上所述的凝固培养基上培养[15在16或28°C。在这两种温度下培养的萼片样本随后在不同的时间收获,即0、2、14和24天,并立即在液氮中冷冻。
番茄果实
成熟绿果(MG),突变体(TU)和红熟果(RR)从温室种植的VFNT樱桃LA1221和艾尔萨克雷格番茄品种,都可从加州大学戴维斯分校的C. M. Rick番茄遗传资源中心获得[59].只有果皮,并用于RNA提取皮肤组织。
RNA提取和RT-PCR
根据Bartley和Ishida的研究,总RNA被提取纯化并用于RT-PCR反应[20.]以下修改:一个初始变性在94°C 2分钟,然后24变性的周期在92°C 30年代,退火55°C为3分钟,在72°C和扩展7分钟。最后在72°C扩展程序执行7分钟。寡核苷酸序列的AP2例如成绩单(TC85031),标签1(TC89786),TM4(TC94405)可在Bartley和Ishida找到[20.的序列小组Primers SPS3和PSY可以在Bartley和Scolnik中找到[26].其他转录物的寡核苷酸如表所示1.将MADS-Box引物与tiger数据库和GenBank中的各种可用核苷酸序列进行比较,发现在PCR条件下,不同MADS-Box基因之间缺乏交叉基因扩增。针对VFNT序列设计的引物序列比较,如:TM4,TM5,和TM6在tiger数据库中,不同品种和不同序列间无差异。事实上,这些转录本的总体序列在不同品种之间几乎没有差异,每个基因大约有2到3个核苷酸,除了TM4.一段糟糕的序列TM4入口有另外18个核苷酸与真序列交替间隔。对一些转录本的等量非逆转录总RNA进行PCR,显示基因组DNA缺乏扩增。
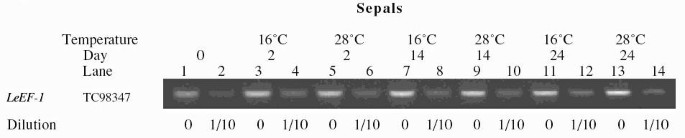
作为一个控制,番茄延伸因子1-α基因(LeEF-1, TC98347 and GenBank accession X14449)[60],因其在成熟番茄果实中表达量高且稳定[61,62].然而,涉及该基因克隆的原始论文显示,即使在成熟的水果中,表达也有一些变化[60].因此,我们检测了该基因在tiger数据库中的表达谱。在未成熟绿(2.8个/ 1000)、成熟绿(3.4个/ 1000)和破果期(2.8个/ 1000)中均有相当稳定的高表达,而红熟果(1.8个/ 1000)中表达量略有下降。TC98347的叶片表达,利用收集的叶片est假单胞菌易感文库T1079,较低,0.8个est / 1000。这可能解释了如果萼片确实从叶状器官转变为果实,那么在实验中0天萼片的强度较低。然而,这个图书馆是由假单胞菌- 叶子。在本文的写作时,没有适当数量的EST的正常叶图书馆可供使用。LeEF-1属于番茄的一个基因家族。我们比较了该家族中最相似的4个成员TC98347、TC98345、TC98346和TC98349的序列进行引物设计。上游引物阿尔法f1可能会扩增其他成员,因为最多有四个核苷酸不匹配。下游引物alphaR1只能扩增TC98347,因为TC98346和TC98345缺失三核苷酸,出现其他错配,TC98349出现6个错配碱基。在扩增TC98349的情况下,tiger数据库显示,在成熟绿期和破茧期,每1000个est中有0.2个est表达,而在TC98347(我们的对照)中,分别有3.4和2.8个est表达。为了显示RNA的相对丰度差异,我们将用于萼片实验的逆转录反应稀释10倍,并在相同的条件下进行PCRLeEF-1引物(图2)。每个花萼样品或果期在每个通道上装载2 μg总RNA(图底部)1)作为一个额外的控制来比较总量。
控制聚合酶链反应LeEF-1表明rna的相对丰度。奇数编号的车道完全如图所示1(萼片),而偶数通道用10次稀释的逆转录反应进行。
缩写
- 交流:
-
Lycopersicon esculentum简历艾尔莎•克雷格
- 风险投资:
-
Lycopersicon esculentumCV VFNT樱桃
- 美国东部时间:
-
表达序列标签
- rt - pcr:
-
逆转录聚合酶链反应
- TIGR:
-
基因组研究所
- LeEF-1:
-
番茄延伸因子1-α
- MG:
-
成熟的绿色阶段
- BR:
-
断路器的阶段
- 图:
-
把舞台
- RR:
-
红熟期
参考文献
- 1.
果实成熟与成熟的分子生物学。植物营养与肥料学报。2001,22(4):725-749。10.1146 / annurev.arplant.52.1.725。
- 2.
Grierson D:番茄成熟果实的基因表达。植物营养与肥料学报,1996,3:113-132。
- 3.
番茄果实成熟的分子遗传学研究。《趋势》1993年第9期:438-443页。10.1016 / 0168 - 9525 (93) 90108 - t。
- 4.
王志强,王志强,王志强,等:1-氨基环丙烷-1-羧酸合成酶基因在番茄乙烯合成过程中的表达调控。植物生理学报。2000,23(3):979- 986。10.1104 / pp.123.3.979。
- 5.
黄Theologis Oeller PW, LM, Rottmann WH, Gantz DM:使用番茄突变体采用反向遗传学研究水果成熟,一个复杂的发展过程。[j] .地理科学进展,1993,14:282-95。
- 6.
delapenna D, Lincoln JE, Fischer RL, Bennett AB:罗格斯大学多半乳糖醛酸酶和其他成熟相关基因的转录分析,rin,也不,和Nr番茄果实。植物生理学报。1989,30(4):591 - 598。
- 7.
Alvarez-Buylla ER, Pelaz S, liljgren SJ, Gold SE, burff C, Ditta GS, de Pouplana RL, Martinez-Castilla L, Yanofsky MF:一个古老的MADS-box基因复制发生在动植物分化之前。《美国国家科学院学报》上。2000年,97:5328 - 5333。10.1073 / pnas.97.10.5328。
- 8.
主要同源结构域序列类的早期进化起源。基因组学。1993,18:54-70。10.1006 / geno.1993.1426。
- 9.
Takatsuji h:植物中的锌指转录因子。细胞mol寿命。1998年,54:582-596。10.1007 / S000180050186。
- 10.
转录调控因子与植物形态的进化。植物学报。1998,10:1075-1082。10.1105 / tpc.10.7.1075。
- 11.
王瑞林,王志强,王志强,等:玉米驯化过程中的选择限制。自然科学。1999,398:236-239。10.1038/18435。
- 12.
Frary A,Nesbitt Tc,Grandiltho S,Knaap E,Cong B,Liu J,Meller J,Elber R,Alpert Kb,Tanksley SD:FW2.2:番茄果实大小演变的定量特质基因座键。科学。2000,289:85-88。10.1126 / Science.289.5476.85。
- 13.
刘家,范贝·j,cong b,坦克斯利SD:梨形番茄果实原因的新一类监管基因。《美国国家科学院学报》上。2002,99:13302-13306。10.1073 / PNAS.162485999。
- 14.
关键词:番茄成熟抑制因子,MADS-Box基因,果实成熟Rin)轨迹。中国科学:地球科学。10.1126 / science.1068181。
- 15.
ishida bk,jenkins sm,说b:诱导无性生殖的基因表达在番茄萼片离体成熟过程中起着关键作用。acta botanica sinica(云南植物学报),1998,36(6):733-739。10.1023 /: 1005941330004。
- 16.
拟南芥基因组计划:开花植物基因组序列分析拟南芥蒂利亚纳.自然科学。2000,408:796-815。10.1038 / 35048692。
- 17.
高夫SA,里奇D,局域网,普雷斯特G,王R,邓恩M, Glazebrook J,会话,Oeller P, Varma H,哈德利D,和记黄埔D,马丁·C片瞳F,兰格BM, Moughamer T,夏Y, Budworth P,钟J, Miguel T Paszkowski U,张年代,科尔伯特M,太阳王,陈L,库珀B,公园,木TC、毛L,鹌鹑P, R, R,院长于Y, Zharkikh,沈R,Sahasrabudhe年代,托马斯,罐头R, Gutin, Pruss D,里德J, Tavtigian年代,米切尔J·G,肖勒T,米勒RM,博年代,阿迪N, Rubano T, Tusneem N,罗宾逊R, Feldhaus J, Macalma T,奥列芬特,布里格斯S:水稻基因组的序列草案(栽培稻l . ssp。粳稻)。中国科学:地球科学。10.1126 / science.1068275。
- 18.
Riechmann JL, Heard J, Martin G, Reuber L, Jiang C, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR, Creelman R, Pilgrim M, Broun P, Zhang JZ, Ghandehari D, Sherman BK, Yu G:拟南芥转录因子:真核生物全基因组比较分析。科学通报。2000,32(4):457 - 461。10.1126 / science.290.5499.2105。
- 19.
Van der Hoeven R, Ronning RC, Giovannoni JJ, Martin G, Tanksley SD:基于大规模EST收集和选择性基因组测序的番茄基因组中基因的数量、组织和进化推断。acta botanica sinica(云南植物学报). 2002,14(4):441- 446。10.1105 / tpc.010478。
- 20.
Bartley Ge,Ishida BK:数字果实成熟:数据挖掘在TEGR番茄基因指数中。植物MOL BIOL REP。2002,20:115-130。
- 21.
石俊杰,李文杰:番茄红素在食品加工中的应用。食品科学。2000,40:1-42。
- 22.
Granado F, Olmedilla B, Blanco I, Rojas-Hidalgo E:生的和熟的西班牙蔬菜中的类胡萝卜素成分。中国农业科学,1998,20(4):427 - 434。
- 23.
石田,马宏,林丽玲:2-(4-氯苯硫代)三乙胺对番茄花萼和离体果实中番茄红素和风味挥发物产量的影响。中国农业科学。1998,26(4):477 - 482。10.1021 / jf980488b。
- 24.
番茄果实发育过程中类胡萝卜素的生物合成。植物生理学报。1994,19(4):457 - 461。
- 25.
Ishida BK:番茄离体子房培养过程中花萼发育调控的改变。植物学报。1991,3:219-223。10.1105 / tpc.3.3.219。
- 26.
水稻的cDNA克隆、发育过程中的表达及基因组定位PSY2这是第二个编码番茄红素合成酶的基因。中国生物医学工程学报,1999,19(3):457 - 461。
- 27.
Giuliano G,Bartley Ge,Scolnik PA:在番茄开发期间调节类胡萝卜素生物合成。植物细胞。1993年,5:379-387。10.1105 / TPC.5.4.379。
- 28.
黄志强,李志强,李志强,等:番茄的分离纯化无性生殖的基因标签1转基因植物中的仇恨作用分析。植物细胞。1994年,6:163-173。10.1105 / TPC.6.2.163。
- 29.
Lozano R, Angosto T, Gomez P, Payan C, Capel J, Huijser P, Salinas J, Martinez-Zapater JM:低温诱导的番茄花异常与MADS-Box基因表达变化相关。植物营养与肥料学报,1998,19(4):491 - 497。10.1104 / pp.117.1.91。
- 30。
陈志强,陈志强,陈志强:植物发育中的同源盒。生物化学学报,1998,1442:1-19。10.1016 / s0167 - 4781(98) 00119 - 5。
- 31。
Reiser L, Modrusan Z, margossip LM, Samach A, Ohad N, hofn GW, Fischer RL: TheBELL1基因编码的同源结构域蛋白参与模式形成拟南芥胚珠。Cell. 1995, 83: 735-742。
- 32.
Bellaoui M, Pidkowich MS, Samach A, Kushalappa K, Kohalmi SE, Modrusan Z, Crosby WL, hofn GW: The拟南芥BELL1和KNOX TALE同源结构域蛋白通过植物和动物之间的保守结构域相互作用。植物学报。2001,13:2455-2470。10.1105 / tpc.13.11.2455。
- 33.
李娟,贾东,陈旭:HUA1,雄蕊和心皮身份的调节器拟南芥,对于核RNA结合蛋白编码。植物细胞。2001年,13:2269年至2281年。10.1105 / tpc.13.10.2269。
- 34.
Johnson CS,Kolevski B,Smyth Dr:透明的外种皮GLABRA2,的毛状体和种皮发展基因拟南芥,编码WRKY转录因子。acta botanica sinica(云南植物学报),2002,14(4):457 - 461。10.1105 / tpc.001404。
- 35.
植物转录因子的WRKY超家族。植物科学进展,2000,5:199-206。10.1016 / s1360 - 1385(00) 01600 - 9。
- 36.
Siegfried KR, Eshed Y, Baum SF, Otsuga D, Drews GN, Bowman JL: YABBY基因家族的成员确定了细胞的背轴命运拟南芥.发展。1999,126:4117-4128。
- 37.
Lüscher B, Eisenman RN:对Myc和myb的新认识。第二部分。Myb。中国生物医学工程学报,2003,23(4):591 - 598。
- 38.
迈斯纳RC,金H, Cominelli E, Denekamp M,要塞,希腊R,克兰兹高清,Penfield年代,Petroni K, Urzainqui,马丁C, Paz-Ares J, Smeekens年代,Tonelli C, Weisshaar B,鲍曼E, Klimyuk V, Marillonnet年代,Patel K, Speulman E,蒂塞尔房颤,Bouchez D,琼斯JJD,佩雷拉,Wisman E,贝文M:大分子转录因子基因家族的功能研究拟南芥:评估反向遗传学鉴定R2R3 MYB基因插入突变的潜力。植物细胞。1999年,11:1827 - 1840。10.1105 / tpc.11.10.1827。
- 39.
陈志强,陈志强,陈志强,等:番茄myb相关基因的克隆与初步鉴定。艾尔莎•克雷格)。植物营养与肥料学报。1996,30(4):591 - 598。
- 40.
《转录记忆的机制》。acta细胞工程学报,2001,23(2):403 -421。10.1038 / 35073039。
- 41.
Kinoshita T,Harada JJ,Goldberg RB,Fischer RL:早期植物开发期间的Polycomb镇压。《美国国家科学院学报》上。2001,98:14156-14161。10.1073 / PNAS.241507798。
- 42。
科恩E,迈耶罗维茨EM:控制花的发育遗传相互作用:在旋涡战争。自然。1991年,353:31-37。10.1038 / 353031a0。
- 43。
王志强,王志强,王志强,等:花同源性基因的基本属性。细胞。1994,78:203-209。
- 44。
王志强,王志强,王志强。花器官同源性基因间的遗传相互作用拟南芥。发展。1991,112:1-20。
- 45.
KD, den Boer BGW, Van Montagu M, Okamuro JKL:控制拟南芥花和种子由同源基因发育APETALA2。植物学报。1994,6:1211-1225。10.1105 / tpc.6.9.1211。
- 46.
Maes T,Van Montagu M,Gerats T:Petunia Hybrida的花序建筑被修改拟南芥芥Ap2基因。开发遗传学。1999年,25:199-208。10.1002 /(SICI)1520-6408(1999)25:3 <199 :: AID-DVG3> 3.0.CO; 2-L。
- 47.
Maes T, Van De Steene N, Zethof J, Karimi M, D’hauw M, Mares G, Van Montagu M, Gerats T: peuniaAp2类基因及其在花和种子发育中的作用。植物学报。2001,13:229-44。10.1105 / tpc.13.2.229。
- 48.
Allard F, Houde M, Kröl M, Ivanov A, Huner NPA, Sarhan F:甜菜碱提高了小麦的抗冻性。植物营养与肥料学报。1998,19(4):513 - 514。
- 49.
Baldwin EA, Nisperos-Carriedo MO, Moshonas MG:两个番茄品种成熟过程中风味和其他挥发物及其他成分的定量分析。中国科学(d辑),1998,16(4):417 - 418。
- 50.
美国佛罗里达州6个番茄品种风味参数的定量分析(Lycopersicon esculentum机)。食品化学学报,1999,19(4):531 - 534。
- 51.
黄志强,王志强,王志强:番茄成熟突变体与转基因番茄品质的关系。acta entomologica sinica(昆虫学报),1995,13(4):457 - 462。
- 52.
风味琐事与番茄香气:重要香气成分的生物化学及可能的控制机制。中国科学(d辑):地球科学(英文版)。
- 53.
Chen Jj,Janssen Bj,Williams A,Sinha N:Homeobox Locus的基因融合:叶形的改变和形态演化的影响。植物细胞。1997,9:1289-1304。10.1105 / TPC.9.8.1289。
- 54。
关键词:番茄,MADS box,花发育,二级结构,同源性金鱼草属植物和拟南芥.工厂J.1991,1:255-266。
- 55。
Seymour GB, Manning K, Eriksson EM, Popovich AH, King GJ:影响果实质地因素的遗传鉴定和基因组组织。中国生物医学工程学报,2002,33(4):457 - 461。10.1093 / jxb / erf087。
- 56。
Pnueli L, Hareven D, Broday L, Hurwitz C, Lifschitz E: TheTM5MADS box基因介导了番茄花内部三个轮的器官分化。植物学报。1994,6:175-186。10.1105 / tpc.6.2.175。
- 57.
王志强,王志强,王志强,等TM29,一个番茄SEPALLATA同源,导致孤雌果的发育和花的逆转。植物营养与肥料学报。2002,30(4):413 - 417。10.1104 / pp.005223。
- 58.
宋世基,文永华,郑济,李世英,朴海峰,安广:辣椒MADS-box基因的特性分析。中国生物医学工程学报。2001,11:352-359。
- 59.
C. M. Rick番茄遗传资源中心。[http://tgrc.ucdavis.edu].
- 60.
Pokalsky, Haitt WR, Ridge N, Rasmussen R, Houck CM, Shewmaker CK:番茄伸长因子1 α的结构和表达。核酸学报1989,17:4661-4673。
- 61.
Perrotta G, Ninu L, Flamma F, Weller JL, Kendrick RE, Nebuloso E, Giuliano G:番茄含有同系物拟南芥隐色素1和2。植物生态学报。2000,42(4):765-773。10.1023 /: 1006371130043。
- 62.
马埃A,GrisvardĴ,德龙L:真菌和植物特异性基因标志物以跟随菜豆炭疽病感染过程和归一化几丁质酶豆mRNA诱导。分子植物 - 微生物相互作用。1992年,5:242-248。
- 63.
虎番茄基因指数。[http://www.tigr.org/tdb/tgi/lgi/].
确认
作者要感谢dr。Dominic Wong和Xiaohua He对手稿的批判性阅读。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
GB与BI共同构思了这项研究,进行了基因表达分析并起草了手稿。BI也对手稿进行了编辑。所有作者阅读并批准了手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
巴特利,G.E.,Ishida,B.K.番茄果实成熟过程中的发育基因调节体外萼片形态发生。BMC植物杂志3.4(2003)。https://doi.org/10.1186/1471-2229-3-4
收到:
接受:
发表:
关键字
- 番茄红素
- 番茄果实
- Parthenocarpic水果
- 初步共识序列
- 成熟的绿色阶段