抽象的
背景
各种种类的属三角形从医疗和烹饪方面都很重要。在这些当中,生长foenum-graecum通常作为蔬菜种植。这种抗糖尿病药草可以降低血糖和胆固醇水平。另一个物种,Trigonella caerulea以幼苗的形式作为食物。这种药草也用于制作奶酪。然而,人们对这些物种的遗传变异知之甚少。在这篇报告中,我们描述了利用ISSR和RAPD标记来研究两种植物的遗传多样性。生长foenum-graecum和Trigonella caerulea。
结果
17登记入册的生长foenum-graecum九次入选Trigonella caerulea使用ISSR和RAPD标记分析各国各国。遗传多样性参数(各种多态性基因座的平均等位基因数量,多态性,平均杂合子和标记指数)在各种物种中的RAPD方法计算。基于两者的相似性指标值,使用UPGMA算法构建树形图生长foenum-graecum和生长caerulea。UPGMA分析表明,来自不同地理区域的植物在各种种类中分布在不同的群体中。在生长foenum-graecum来自巴基斯坦和阿富汗的进入在一个群集中分组,但从印度和尼泊尔的加入将在另一个集群中分组。但是,在土耳其的各种各样的种群中都没有群体在一起并落在不同的集群中。
结论
基于遗传相似指数,观察到更高的多样性Trigonella caerulea相比生长foenum-graecum。两种植物的ISSR和RAPD标记生成的遗传相似性矩阵具有较高的相关性(r = 0.78, p = 0.001)生长foenum-graecumr = 0.98, p = 0.001Trigonella caerulea)表示这两个系统之间的一致性。这些观察在遗传多样性分析中的影响以及支持可能的原产地和/或多样性的分析三角形讨论过。
背景
FamaCeae家族包括许多用于食品,牧草,纤维,木材和观赏目的的作物。在这个家庭中,一些豆类,如鹰嘴豆,大豆,法比面,葫芦巴,扁豆,豌豆等被消耗为粮食豆类。谷物豆类是用作未成熟的豆荚,成熟种子或未成熟的干燥种子的形式的植物,直接或间接[1].谷物豆类不仅为人类饮食提供了多样性,而且还为饮食群提供膳食蛋白,缺乏动物和鱼蛋白的饮食。考虑到营养不良的不断增长的问题,用豆类物种作为高蛋白质食物非常重要。此外,豆类还能够富含共生氮固定,富集豆类作物后适用于作物的土壤条件[2].
属三角形是家庭Fabaceae和亚家庭Papilionseae中最大的Trifoliatae中最大的Trifoliata之一[3.].在三角形物种,生长foenum-graecum(俗称Fenugreek)是一个开花的年度,偶尔偶尔访问自动染色的白花。对地中海东部海岸的国家,Fenugreek在印度,埃及,埃塞俄比亚,摩洛哥和偶尔在英格兰广泛培育[4].生长foenum-graecum广泛种植印度的热带和亚热带地区。叶子和种子等植物的不同部分在印度消耗。它还用于药用目的。根据古代药用系统,阿育吠陀,它是一种草药药物,味道苦味或刺鼻。它针对厌食症有效,并且是一种胃刺激剂[5].Fenugreek在世界各地涌现,其摘要用于瑞士的奶酪,德国人工枫树糖浆和苦涩跑,烤种子作为非洲的咖啡替代品,种子粉与面粉混合在埃及制作平坦面包,作为以色列的抗糖尿病草药,用作昆虫和害虫在谷物储存中用作昆虫和害虫的植物,以及在法国香水中使用的油[6].近年来的研究报告表明胡芦巴可以通过降低血糖和胆固醇水平来治疗糖尿病[7].
T. Caerulae.另一方面,它是一种不太常见的草本植物。这种开花的一年生植物,有自花授粉的蓝色花,见于阿尔卑斯山和东欧和东南欧的山脉。顶叶主要用于烹饪,而幼苗则用油和盐食用。在中国和德国,风干的、粉状的叶子和花被用来给面包、奶酪等调味和着色。它们也被用作汤和土豆菜肴的佐料,叶子的汤剂被用作香茶[8].
谷物豆类等T. foenum-graecum和t . caerulea虽然在食物和医药方面很重要,但它们很少在本地以外生长。在世界各地,只有已知的和明确定义的品种在特定的地区种植。基因库中也有少量的种质资源三角形物种(9].这些局部重要作物的被忽视的和使用不利用状态表明了重要的植物材料消失的风险,其培养数千年。限制其大规模生产和更好品种发展的重要因素之一是,这些物种之间的遗传多样性,互联性和侵入性变异性和遗传关系很少。因此,试图分析可能的未开发的遗传多样性对繁殖和作物改善至关重要。本研究采取了分析各种遗产遗传多样性的目的T. foenum-graecum和t . caerulea代表了使用分子标记技术种植它们的各个国家。
结果
遗传多样性评价T. foenum-graecum和t . caerulea利用ISSR和RAPD标记
利用100条ISSR引物对7份植物进行初步筛选T. foenum-graecum其中40放大了扩增。但是,只有14个ISSR引物检测到I7类别的可惯性变化T. foenum-graecum产生明显的可再现模式,并在500bp至2kb的范围内显示100条带。这些七十二条带中的多态性为72%多态性[表3.].此外,在ISSR分析中获得11个独特的条带,其中6个由也门的accession TMP = 8714贡献,4个由土耳其的accession TMP = 8691贡献,1个由伊朗的accession TMP = 8685贡献。同样,在t . caerulea,用于初始筛选的100个ISSR引物的47个引起扩增。其中,18个引物检测到9种附加的内部内部变化t . caerulea显示93.64%多态性[表4].利用这18个引物,制备了16个独特的频带,其中9和7条带分别由仅来自土耳其的进入206901和206486贡献。
在RAPD分析中,使用100条RAPD引物进行初步筛选T. foenum-graecum其中22引物产生多态性模式,显示出70.12%的多态性[表3.].该引物获得8条特异条带,其中也门引物3条,埃及引物2条,阿富汗引物1条,土耳其引物8691条和8690条。同样在t . caerulea初步筛选的40条引物中,有10条引物产生多态性,多态性95.83%[表]4].用这些引物产生了8条独特的条带;来自土耳其的同一种质206901和206486再次产生了最大数量的独特条带(每个4个)。
系统树图分析T. foenum-graecum和t . caerulea
利用Nei相似性指数计算17份材料的遗传相似度T. foenum-graecum同时考虑ISSR和RAPD方法。仅以ISSR标记为基础,相似性指数为0.69 ~ 0.92。这些值被用来构建一个树状图使用算术平均的非加权对组方法(UPGMA)。基于ISSR的树状图T. foenum-graecum基因型形成4个簇[图未显示]。第一款集团将加拿大(8707),加拿大(1065),巴基斯坦(8717,8718),伊朗(8675)和土耳其(8690)共同分组起来。第二个集群包含来自印度的豁免(8686,8689,8675)。剩下从印度(8687)和尼泊尔(8706)中的一个加入,形成第三集群。第四集群包含埃及(8698,8679)和土耳其(8692)的甲基。从埃塞俄比亚(8696),土耳其(8691)和也门(8714)与主要集群分组。在本研究中分析的土耳其的三种加入落入不同的集群。
仅RAPD标记,相似性指数为0.71 ~ 0.91。在基于RAPD的树状图中,T. foenum-graecum基因型形成了2个主要集群[图中未显示]。第一个组有两个子组,第一个子组包含来自阿富汗(8707)、印度(8686、8687、8675)、土耳其(8690)和埃及(8698)的加入,而第二个子组包含来自巴基斯坦(8717、8718)、土耳其(8692)和埃及(8679)的加入。加拿大的加入与这些集群有关。第二个集群包括来自伊朗(8685)和尼泊尔(8706)的加入,以及与此集群相关的印度的加入。来自埃塞俄比亚(8696)、土耳其(8691)和也门(8714)的加入则从这两组中分离出来。在基于RAPD的树状图中,来自土耳其的植物也分为不同的类群。
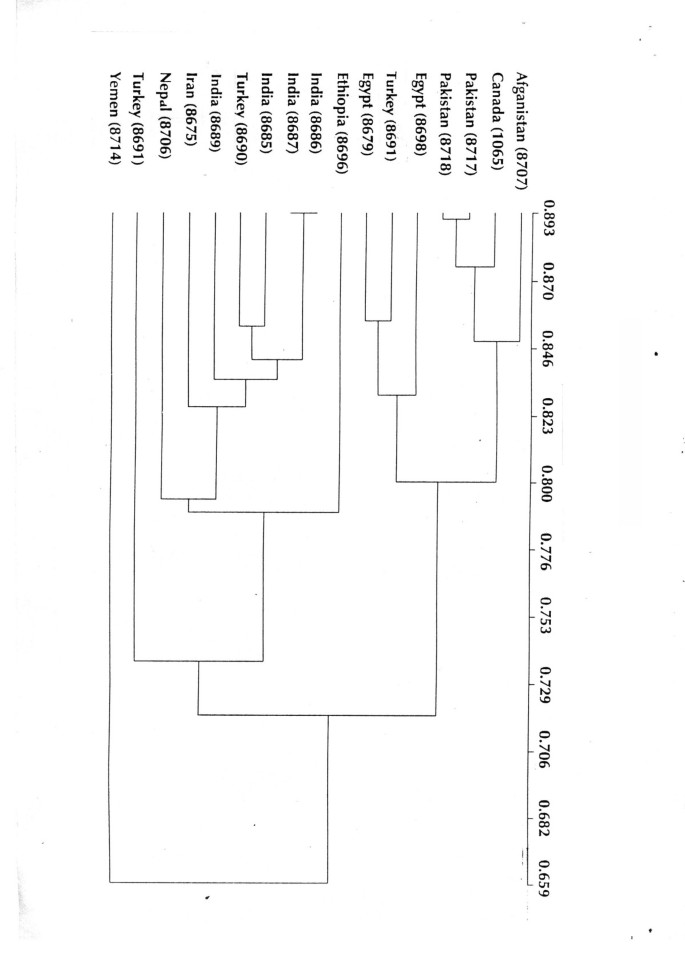
基于这两种标记系统,相似度指标的范围为0.65 ~ 0.89[图。1].在这里T. foenum-graecum来自埃及的进入(8698,8679)被分组在一起。来自巴基斯坦(8717,8718)和阿富汗(8707)的进入在一个集群中分组。来自印度的进入(8686,8689,8675,8687),尼泊尔(8706)和伊朗(8685)一起分组。然而,来自土耳其的所有三个牧群都在不同的集群中落下,并没有在他们之间进行群体。使用Winboot程序进行引导完成,以估算Clades的相对支持。群集的稳健性在不太强劲T. foenum-graecum(50-70%)。
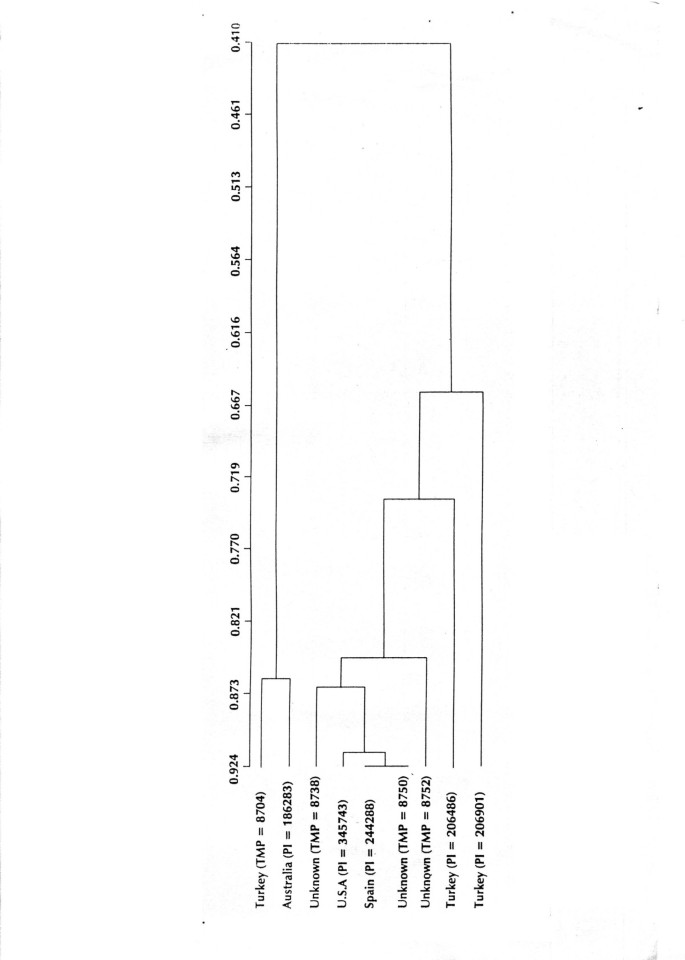
在t . caerulea,分别考虑ISSR和RAPD两种方法,利用Nei相似性指数计算遗传相似性。ISSR标记系统的相似性指数为0.41 ~ 0.92,RAPD标记系统的相似性指数为0.34 ~ 0.93。两种标记系统的相似性指数在0.38 ~ 0.92之间,表明物种多样性较高t . caerulea。基于ISSR和RAPD标记的树形图显示出类似的聚类图案,当单独使用[图形未示出]以及一起使用[图]2].在这里,树木图显示了两个主要簇。第一个集群分组在一起形成土耳其(TMP = 8704)和澳大利亚(PI = 186283)。第二群集中包含3个未知地理原点和1个中的一个加入,每个来自U.A(PI = 345743)和西班牙(PI = 244288)。剩下的2种附加I.E.进入PI = 206486和PI = 206901来自土耳其,从这两个主要集群中分组。因此,来自土耳其的牧场在观察到的情况下没有聚集在一起T. foenum-graecum。使用Winboot程序获得的引导值t . caerulea比例非常高(90-100%)。
杂合性和标记指数
分别使用ISSR和RAPD标记系统计算杂合度,并结合使用,详见表3.为T. foenum-graecum和表4为t . caerulea。在T. foenum-graecumHavISSR、RAPD和ISSR+RAPD计算值分别为0.214、0.203和0.211。在的情况下t . caeruleaHav相同的值分别为0.330、0.346和0.338。为,T. foenum-graecum和t . caerulea,H.avISSR和RAPD系统的值没有显著差异。计算ISSR和RAPD的标记指数(MI)值T. foenum-graecum分别为1.53和1.51t . caerulea分别为3.17和3.35。因此,在ISSR和RAPD系统中,两种植物的MI值没有显著差异。
相似性度量之间的相关性
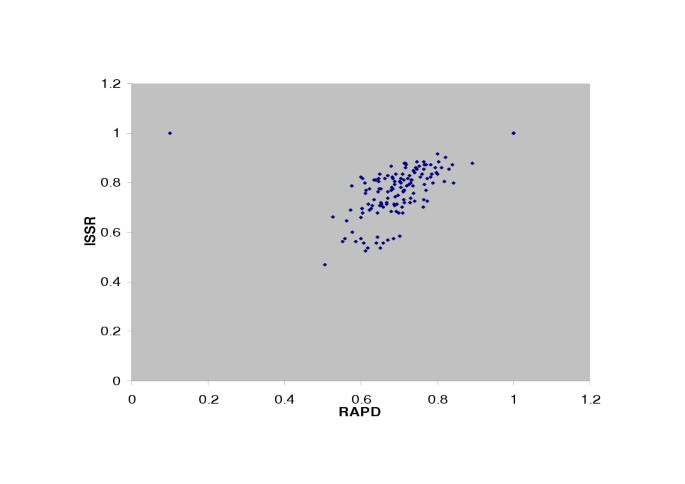
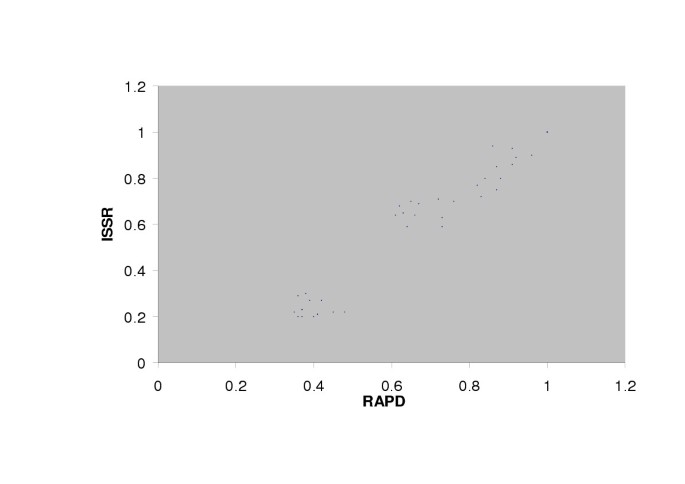
在T. foenum-graecum,当比较ISSR和RAPD标记生成的相似度矩阵时,r = 0.78, P = 0.001,表明两种系统生成的数据具有良好的相关性[图1]。3.].同样,比较ISSR和RAPD系统生成的相似度矩阵t . caerulea, r = 0.98,表明两个标记系统之间有很好的相关性[图。4].
讨论
本研究中使用的两个标记系统,ISSR和RAPD也被用作评估遗传多样性的有效工具,并在系统发育关系中抛光Brassica Napi.[油菜籽,[10.]],葱属植物教派。Sacculiferum[Alliaceae, [11.]]和Asimina Triloba.[木瓜,[12.]和[13.]]。利用ISSR和RAPD标记分析豆科植物的遗传多样性加工[[14.]和[15.]]和Cajanus.[[17.]和[18.都是在我们自己的实验室里进行的。这些研究为了解物种间的关系提供了重要的线索,并可能进一步帮助制定和规划育种策略。然而,目前还没有利用分子标记研究该属植物遗传多样性的报道三角形。在目前的研究中,我们尝试去检查内部的遗传变异水平T. foenum-graecum和t . caerulea从萨斯卡通(加拿大植物基因资源)和Pullman(USDA-ARS植物介绍车站,华盛顿)的种质收集中心获得。这T. foenum-graecum入选国家的选择是为了代表它生长的大多数国家。在的情况下t . caeruleaSaskatoon和Pullman的所有9份样本均用于本研究。
检测到的多态性分析T. foenum-graecum和t . caerulea
给定群体中的多态性往往是由于位于轨迹处的等位基因数量的遗传变体及其分布频率的存在。杂合性对应于可以使用所讨论的标记来区分从群体随机采取的两个等位基因的概率。因此,可以根据平均杂合子和标记指数来给出标记用途的方便定量估计和检测到的多态性[18.].在T. foenum-graecum也在t . caeruleaHav和ISSR和RAPD标记的标记索引(MI)值[表3.和4]的多态性差异不显著,说明两种标记系统在不同种质库中检测到的多态性水平相似。通过ISSR和RAPD标记系统的高相关系数也证实了这一点T. foenum-graecum和t . caerulea(无花果。3.和4].通过杂合子测量的遗传多样性较高t . caerulea(0.33)T. foenum-graecum(0.21)。根据等位酶多样性,估计自花授粉物种的平均杂合度值已被报道,豇豆属unguiculataHav= 0.027 (19.),野豌豆属tetraspermaHav= 0.342 (20.].的杂合度值豇豆属unguiculata那是下降的野豌豆属tetrasperma比T. foenum-graecum和t . caerulea。基于ISSR标记,对遗传多样性进行了估算av培养的Pawpaw报告= 0.358(亚洲特里奥多巴),与之相比较高T. foenum-graecum和t . caerulea[13.].
估计遗传相关性T. foenum-graecum和t . caerulea
使用ISSR和RAPD标记系统收集的数据用于比较各种含义之间的遗传相似性T. foenum-graecum和t . caerulea。这些材料可能是不同基因型的混合物。因此,为了有一个特定的加入的完整的代表,从15个植物的dna以相同的比例混合。因此,在加入内的多样性被消除,并使用一个完整的加入带剖面进行分析。
在T. foenum-graecumISSR和RAPD检测到的多态性水平基本相当(ISSR为72%,RAPD为70.12%)。在UPGMA分析中,T. foenum-graecum来自一个国家和邻近区域的加入在某些情况下被归为一类,而在某些情况下被归为不同的组群。来自巴基斯坦和阿富汗的加入归为一组,来自印度和尼泊尔的加入归为另一组。此外,土耳其加入的三个国家虽然在地理上非常接近,但却属于不同的集群。因此,本研究没有明确的地理距离较近的聚类模式,说明遗传相似性与地理距离之间的关联不显著。然而,有必要从每个地理位置使用更多数量的资源来确定可用的格局。
在t . caeruleaISSR(93.64%)和rapd(94.83%)检测到的多态性水平几乎相同。t . caerulea显示出更多的多态性T. foenum-graecum。在的情况下t . caerulea此外,UPGMA分析表明,来自不同地理区域的植物分布在不同的群体中。再次,来自土耳其的豁免并未分组在一起。从火鸡出来的两种加入从主群中分组,而其中一个被分组在与澳大利亚的第一个集群中。在t . caerulea我们可以让土耳其加入三次,其他国家只能加入一次。因此,在这种情况下,对地理距离和遗传多样性的相关性进行准确的评价还为时过早。为了确定可用的模式,需要从每个地理位置使用更多的资源。
起源中心和/或多样性中心三角形
瓦维洛夫解释说,一个物种的起源地是一个包含该物种大量遗传变异的地区。根据他的说法,变异是时间的函数,因此,一个物种中包含最大变异的地区会比其他地区支持和维持该物种更长的时间,这表明该地区是起源和/或多样性的中心。他建立了八个地理中心,其中两个是延伸到土耳其的近东中心和地中海中心[21.].
Vavilov已发布于Vavilov,即从以色列通过叙利亚延伸的近东地区,土耳其南部进入伊朗和伊拉克以及地中海中心,包括西班牙,摩洛哥和土耳其的地中海是原产地三角形,Trifolium.和Medicago物种(22.].在本研究中,T. foenum-graecum和t . caerulea来自土耳其的参赛作品表现出更多的多样性。这些结果支持了瓦维洛夫的假设。印第安人的加入T. foenum-graecumi.e. accession number 8686 (Khandwa), 8685(Mumbai), and 8687 (Patiala) separated by an aerial distance of 52 km, 104 km, and 135 km, respectively from each other, were genetically more similar (similarity index 0.893) and clustered together [Fig.1].然而,入世T. foenum-graecumfrom Turkey i.e. accession number 8692 (Malatya) and 8691 (Elbistan) separated by a distance of 100 km (similarity index value 0.875-0.745) were out grouped and were genetically more distant from each other although morphologically they were similar to each other as well to the accessions from other countries.
从植物遗传资源和植物多样性的角度来看,土耳其是世界上重要而独特的国家之一。该国有3000多种特有植物,据报道许多豆科植物具有巨大的多样性,例如维亚,Medicago,Trifolium.,Lathyrus,Onbrychis,三角形,Pisum,加工,镜头等(23.].许多栽培植物都喜欢加工,镜头,Pisum,Amygladus,李古鲁乌斯,小子,等等在这个国家有他们的起源中心和/或多样性[22.].瓦维洛夫指定土耳其东南部和毗邻的叙利亚为鹰嘴豆的主要起源中心(现在是多样性中心)。24.].类似于鹰嘴豆(和其他谷物豆类),在T. foenum-graecum地中海地区盛产大种子品种,而东部地区则以小种子品种为主。因此,土耳其也可能是主要的原产地中心T. foenum-graecum和t . caerulea。然而,这一假设需要通过考虑分布在广泛地理范围内,特别是近东和地中海中部区域的更多资源来证实。
结论
综上所述,利用分子标记技术可以初步估计植物的遗传多样性T. foenum-graecum和t . caerulea同时也揭示了基于分子的遗传关系。在UPGMA分析中,地理距离与遗传多样性之间没有显著相关。我们的数据进一步支持了近东和地中海中部是起源和/或多样性中心的假设三角形由瓦维洛夫提出。
方法
植物材料和DNA提取
的种子T. foenum-graecum加拿大萨斯卡通的加拿大植物基因资源获得了加拿大(PGRC)的植物基因资源。这些载体以及从收集的TMP号码和国家/地区都在表格中概述1。种子为各种t . caerulea从Pullman,华盛顿(W-6)的PGRC,Saskatoon,Canada和USDA-ARS厂房介绍站提供了进入,并在表格中详述2。每次加入的十五个植物都在盆中种植DNA分离。为每种植物收获两克幼叶组织,并在液氮中冷冻以进行DNA提取。用Doyle和Doyle方法提取植物DNA [25.然后从15种植物中提取等量的DNA用于每次添加。
PCR扩增
ISSR
从加拿大不列颠哥伦比亚省大学采购了一套100个锚定微卫星引物。在10mM Tris-HCl-HCl 7.5,50mM KCl,1.5mM MgCl 2,0.5mM亚颗粒,2%甲酰胺,0.1mM DNTPS,0.3μm引物和0.8μm的Taq DNA聚合酶(Ampli-TAQ DNA聚合酶,Perkin Elemer,USA)在使用Perkin Elmer 9700热循环仪25μl反应中。在94℃下初始变性5分钟后,每个循环由94℃的30秒变性,在50℃下45秒,在50℃下退火,72℃的2分钟延伸,在72℃下延长5分钟结束45个循环。
RAPD
采用加拿大英属哥伦比亚大学的任意十聚体引物进行RAPD分析。反应混合物(25 ul)含有10 mM Tris-HCI pH 7.5, 50 mM KCI, 1.5 mM MgCl2, 0.5 mM亚精胺,0.1 mM dNTPs, 15 pmol引物,20 ng基因组DNA, 0.8 U Taq DNA聚合酶(Ampli-Taq DNA聚合酶,Perkin Elmer, USA)。扩增使用Perkin Elmer 9700热循环进行40个循环,每个循环包括94°C下变性1分钟,36°C下退火1分钟,72°C下延伸2分钟。最后一个循环之后在72°C下伸展5分钟。扩增产物用0.5× TAE缓冲液(10 mM Tris HCl和1 mM EDTA pH. 8.0)在2%琼脂糖凝胶上电泳,溴化乙啶染色可见。在凝胶文件系统中以数码照片的形式对图案进行拍照和存储。每个实验重复三次,证实了扩增的重复性。
琼脂糖凝胶电泳
扩增产物用0.5x TAE缓冲液(10mM Tris HCl和1mM EDTA pH. 8.0)在2%琼脂糖凝胶上电泳,溴化乙啶染色可见。在凝胶文件系统中以数码照片的形式对图案进行拍照和存储。每个实验重复三次,证实了扩增的重复性。
数据分析
明确可重复的条带被评分并输入一个二进制字符矩阵(存在1,不存在0)。利用Nei′s遗传距离[26]确定各种质间的遗传相似性。基于距离矩阵,采用带算术平均的非加权对组方法构造树状图。进入矩阵的分数采用TAXAN 4.0版软件,根据频带共享程度进行分析。利用Dice系数SI = 2Nab/Na+Nb生成相似矩阵,其中Na = a道存在的总频带数,Nb = b道存在的总频带数,Nab与a、b道共有频带数[27]。然后用骰子值进行UPGMA分析。采用WinBoot程序[28]对二进制数据矩阵进行自引导,以评价分组的稳健性。采用重复采样和置换的方法重建1000次物候图,以分组形成的频率表示分组的强度。采用Smouse et al[29]方法计算两种菌的ISSR和RAPD数据生成的相似度矩阵的相关系数。一个遗传标记的期望杂合度Hn计算为:Hn = 1 - pi2,其中pi为第i个等位基因[26]的等位基因频率。 The arithmetic mean heterozygosity Hav for each marker class was calculated as Hav = Hn/n, where n = number of markers or loci analyzed [18]. The average heterozygosity for polymorphic marker (Hav)p was further derived as; (Hav)p = Hn/np; where np is the no. of polymorphic markers or loci [18]. Marker index (Ml) for each marker system was also calculated as, MI = E (Hav)p; where E = effective multiplex ratio [E = nβ where β is the fraction of polymorphic marker or loci,18].
参考
- 1。
Rachie KO, Roberts LM:热带低地的谷物豆类。农学进展。1974,26:1-32。
- 2。
王志强,王志强,王志强,等Sinorrhizobium meliloti与Medicago Sativa.和Medicago阿尔巴。可以j microbiol。2001,47:567-573。10.1139 / CJM-47-6-567。
- 3.
Balodi B,Rao Rr:属三角形L.(Fabaceae)在西北喜马拉雅山。j econ税,但是。1991,5(1):11-16。
- 4.
王志强,王志强:豆科植物系统学研究进展。英国皇家植物园。1981,2:
- 5.
胡芦巴兰:胡芦巴是一种美味的药物。农业工程学报。2001,5(6):43-44。
- 6.
胡芦巴兰:胡芦巴,这种草药能提供什么?自然。1998,1:1-4。
- 7。
沙姆加拉德:葫芦巴对1型糖尿病血糖和血脂的影响。欧洲临床营养杂志。1990年,44:301-306。
- 8。
肯·芬:植物的未来:可食用和有用的植物为一个更健康的世界:。1997,英国常设出版物
- 9。
hymowitz t:谷物豆类。在新作物的进展中。编辑:Janick J,Simon Je。1990年,木材压力机,波特兰,或54-57。
- 10。
Chao-Zia Ma,Ting-dong Fu,Stine Tuevesson,Bo Gertsson:中文和瑞典菜籽的遗传多样性(Brassica Napi.)通过序列简单重复(ISSR)分析。中国农业科学。2003,2:137-143。
- 11.
刚刚,董熙·李,6月的南·南卢克L:物种种类的研究葱属植物教派。Sacculiferum利用ISSR (Inter Sequence Simple Repeat, Inter Sequence Simple Repeat)标记对韭科(Alliaceae)及其近缘种进行了比较。植物生态学报,2002,43:63-68。
- 12.
Huang H,Layne Dr,Kubisiak T1:栽培Pawpaw的分子表征(Asimina Triloba.),采用RAPD标记。中国科学(d辑),2003,26(6):741 - 741。
- 13。
Pomper KW, Crabtree SB, Brown SP, Jones SC, Bonney TM:木瓜遗传多样性评估Asimina Triloba.)具有序列间的栽培品种重复标记。J Amer SoC Hort SCI。2003,128(4):521-525。
- 14.
Sant VJ, Patankar AG, Gupta VS, Sarode ND, Mhase LB, Sainani MN, Deshmukh RB, Ranjekar PK:印度优质鹰嘴豆品种分化和杂种优势分析的潜在DNA标记。应用程序网络。1999,98:1217-1225。10.1007 / s001220051187。
- 15.
陈志强,陈志强,陈志强,等。中国野生植物的亲缘关系加工使用Inter简单序列重复(ISSR)多态性。Euphytica。2003,129(1):15-23。10.1023 /答:1021567821141。
- 16.
rapnaparkhe MB, Gupta VS, Ven Murthy MR, Ranjekar PK:鸽子豆的遗传指纹分析(Cajanus毛竹)使用RAPD标记的野生亲属。您的App Genet。1995,91:893-898。
- 17.
Dabak MM, Ranade SA, Dhar MS, Gupta VS, Ranjekar PK:鸽子豌豆基因组的分子特征。生物化学学报。1988,25:230-236。
- 18。
A: RFLP、RAPD、AFLP和SSR(微卫星)标记在种质分析中的应用。《生物多样性》,1996,2:225-230。
- 19。
Pasquet rs:栽培豇豆的丙醇酶多样性,豇豆属unguiculata。应用程序学报。2002,101:211-219。10.1007 / s001220051471。
- 20.
文圭许,洪旭许:野生皮扁豆的遗传多样性和群体结构。作物科学,2001,41:1940-1946。
- 21。
瓦维洛夫NI:栽培植物的起源、变异、免疫和育种。植物学杂志,1951,13:1-366。
- 22。
Vavilov Ni:栽培植物的起源中心。趋势实践机器人生成SEL。1926,16:3-24。
- 23。
萨班奇奥尔特科:《土耳其山黧豆遗传资源》。亚洲山黧豆遗传资源。编辑:Aarora PK, Mathur PN, Riley KW. 1996, Adham, 77-87。
- 24。
范德梅森:起源、历史和分类。鹰嘴豆。编辑:Sexena MC, Singh KB。1987年,11-34。
- 25。
Doyle JJ, Doyle JL:对少量新鲜叶子组织的快速DNA分离程序。植物化学通报。1987,19:11-15。
- 26.
估计平均杂合度和遗传距离的少数个体。遗传学报。1987,83:583-590。
- 27.
Nei M,Li WH:用于研究限制性内切核酸酶遗传变异的数学模型。PROC NATL ACAD SCI。1979,76:5269-5273。
- 28.
Yap I, Nelson RJ:一个用于对二进制数据进行bootstrap分析以确定基于UPGMA的树状图置信限的程序。IRRI讨论文件系列14。国际水稻研究所,1996
- 29.
Smouse Pe,Long JC,Sokal RR:Matrix对应的Mantel测试的多元回归和相关延伸。sys zool。1996,35:627-632。
承认
作者感谢印度政府生物技术部门的财政支持。我们还感谢加拿大萨斯卡通省植物基因资源局(PGRC)和美国农业部(USDA)华盛顿州为本研究提供种子材料。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
RD进行了PCR和分子遗传学研究,参与了研究的设计并进行了统计分析。ML参与从不同来源和监测实验的种子采购种子和结果。LC一个分类家参加了从不同来源获得的种子的采购,生长和分析。PR和VG构思了该研究,参与了其设计和协调并监测了实验和结果。
所有作者阅读并认可的终稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
Dangi,R.S.,Lagu,M.D.,Choudhary,L.B.。et al。遗传多样性评价生长foenum-graecum和Trigonella caerulea利用ISSR和RAPD标记。BMC植物杂志4,13(2004)。https://doi.org/10.1186/1471-2229-4-13
收到了:
接受:
发表:
关键字
- RAPD标记
- ISSR标记
- ISSR PRIMER.
- 独特的乐队
- 标记指数