抽象的
背景
实时逆转录PCR(RT-PCR)大大提高了定量基因表达研究的缓解和敏感性。然而,使用该方法的基因表达的精确测量依赖于选择数据归一化的有效参考。研究很少验证参考基因的基因表达水平在所用的样品中是否充分一致,也不会使替代基因进行评估,这些基因对于分析的实验条件最可靠。
结果
使用实时RT-PCR来研究10杨树的表达(属杨树)管家基因,我们证明了一种确定基因表达稳定程度,在一组实验条件下确定基因表达的程度。基于一种分析植物育种中品种稳定性的传统方法,它定义了基因表达稳定性从方差分析(ANOVA)和线性回归的措施。我们发现潜在的内部对照基因在不同组织的表达稳定性中差异很大,所研究的发育阶段和环境条件。
结论
我们的研究结果支持,候选参考基因的定量比较是实时RT-PCR研究的重要组成部分,该研究寻求精确地评估基因表达的变化。我们证明的方法有助于基因表达稳定性的统计和图形评估。对给定的一组实验条件的最佳参考基因的选择应使得能够检测太小的基因表达的生物显着变化,其无法通过较少的精确方法揭示,或者当高度可变参考基因在不知不觉中在实时RT中使用时PCR实验。
背景
多年来,绝大多数基因表达研究采用了非定量或半定量的RNA凝胶斑和RT-PCR分析。实时PCR技术已经消除了与定量基因表达研究相关的许多困难[1],实时定量RT-PCR (real-time quantitative RT-PCR, qRT-PCR)正迅速成为深入表达研究的标准方法,包括选择性剪接研究、微阵列表达结果验证、分子诊断等[2-5.]。
实时QRT-PCR提供稳健的手段,用于在宽动态范围内精确地量化基因表达的变化。它还适用于RNA量是限制性的实验,例如用于微观疫苗的组织。然而,选择适当的归一化方法对于可靠的定量基因表达结果至关重要[1那6.]。归一化的目的是用于校正非特异性变异,例如在RNA的数量和质量的差异,这可能会影响RT和PCR反应的效率。
将总RNA含量归一化会带来一些问题。定量小数量的RNA是困难的,并且RT和PCR反应效率的变化不能用这种方法来解释。同样,由于RNA不稳定,将其标准化到外部RNA标准也是有问题的。最常用的方法是相对定量,将基因表达水平归一化到内参基因的表达水平。虽然这避免了绝对定量的问题和局限性,但选择一个合适的内部控制基因——在所有被调查的组织样本中以几乎恒定的水平表达——是必需的。不使用适当的控制基因可能会导致基因表达谱的偏差,以及低精度。结果可能是,只有表达水平的总体变化被宣布为具有统计学意义,或者表达模式被错误地描述。
直到最近,内部控制(通常被称为管理或维持基因)是根据定性研究(如RNA凝胶印迹目视检查)、低灵敏度检测(如杂交印迹密度法)或半定量RT-PCR的表达稳定性来选择的。这些都不足以确定实时qRT-PCR的可靠内部控制。例如,通过实时qRT-PCR对10个常用的人类内控基因进行表达谱分析,发现13种组织类型的表达程度和表达模式不同,没有一个基因可以适用于所有组织类型[7.]。虽然18岁RRNA经常用作内部控制,它远非理想。它需要使用总RNA和随机引物进行RT反应,并在非常高的水平下表达;有些手段衰减18岁当弱表达的基因进行了研究可能需要表达。此外,还有可在不同样品之间的rRNA和mRNA部分的不平衡,并18岁在所有条件下并不总是在恒定水平上表达[1]。最后,18岁与mRNA表达水平相比,表达水平似乎受部分RNA降解的影响较小[8.]。
在哺乳动物和微生物系统,其中实时定量RT-PCR已经被最广泛应用的最新研究,也开始包括正常化各种看家基因的评价[7.-11.]。Vandesompele等。[7.]认识到使用统计方法为给定的一组样本选择最佳内部控制的重要性,并开发了一种程序,根据一个基因与所有其他测试的控制基因的平均成对变异来选择内部控制。采用实时qRT-PCR方法有点像引入cDNA表达微阵列,因为最初的微阵列研究并没有通过统计方法识别差异表达基因,而是通过任意的fold change截断值[12.]。类似地,第一实时qRT-PCR的研究一般标准化表达水平到被假定为有效,而不是一个已被证明是由数据的统计分析有效内部对照。更将需要严格的方法为定量RT-PCR被越来越多地应用到调节基因的研究中,以及用于验证图案微阵列实验中观察到。
在这项研究中,我们采用实时定量RT-PCR检查杨树的多样性10个看家基因的表达(Populus Trichocarpa.×P. deltoides.在不同的发育阶段和一年的不同时间采集的组织。我们研究的目的是检测与季节发展和树木老化有关的几个调节基因的变化。因此,我们进行了一项研究,比较几个潜在的控制基因的稳定性。我们发现,被检测的基因在组织样本中表现出非常不同程度的表达差异,统计和图形方法帮助我们选择最适合我们正在进行的发育研究的基因。这种方法非常类似于植物育种家用来评估不同品种产量相对稳定性的经典方法[13.],可以适用于任何基因或一组组织以确定最稳定的内部控制。
结果与讨论
杨树持家基因的表达谱
代表不同的功能分类和基因家族十大看家基因被选为研究。这些包括泛素,肌动蛋白,微管蛋白,亲环胞质(肽基 - 脯氨酰异构酶),翻译起始因子,延伸因子,和rRNA基因。文献的搜索,发现所有类的成员已被用作用于使用RNA印迹凝胶或RT-PCR测定植物基因表达研究的内部控制。属于这些基因家族基因杨树通过EST数据库进行搜查被确定(表2).这些基因的表达水平在八个组织样本中测定(表1)收集了从成熟的雌性杨树在美国俄勒冈州的种植园成长七个月的时间。
在单个实验中,使用相同的cDNA合成反应的等分试样的每个10个基因的实时PCR扩增和所有基因的引物和cDNA的组合进行扩增以一式三份在一个单一的PCR运行。然后将整个实验重复组合用于统计分析的第二时间和结果。通过实时PCR定量是基于循环阈值(CT).CT是在其中在PCR产物(通过在荧光增加测定)的量的显著增加发生循环,扩增指数阶段的通常的中间。
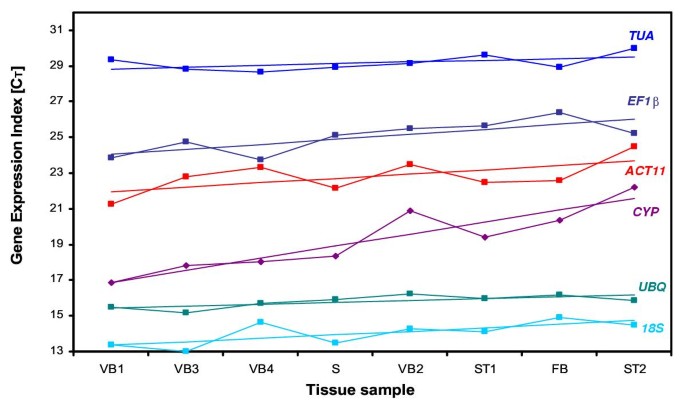
均值CT值(平均两个实验的)每个基因列于表3.。我们先前使用18岁作为用于表达研究的内部对照使用这些和其他组织样品和已经注意到18岁CT值有时相当大的改变(数据未显示)。这可能是主要是由于高丰度的18岁转录物。用于18岁作为用于在相对低的水平表达的基因的研究中的内部控制所需的cDNA模板扩增相对于基因18S额外的稀释正在研究中。在本研究中,cDNA的量是所有PCR反应相同,但18岁引物浓度为50 nM,其余基因引物浓度均为600 nM。正如所料,18岁是最丰富的(最低çT)看家成绩单;TUA是最少的。
基因表达水平的稳定性的统计分析
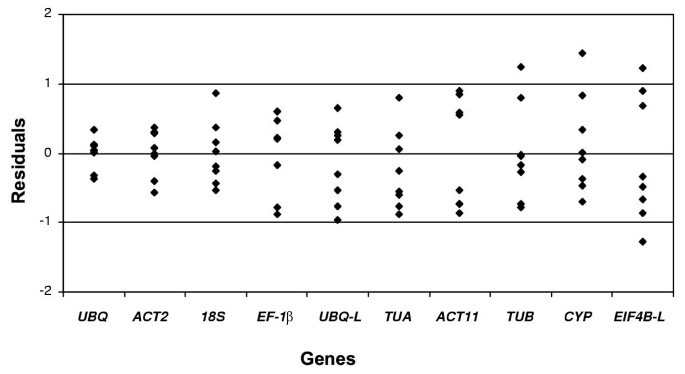
我们使用了单因素ANOVA和C的线性回归分析T值,以检查组织和RT-PCR实验中的变化。从ANOVA残余值的分布的检查表明关于方差和数据的正常性进行了充分满足(数据未示出)的同质性的假设。的组织之间的差异的ANOVA F检验表明,基因的5显示了组织样品中表达显著变化。残余变化的程度,这反映在均方误差(MSE),残差或波动(CV)的系数,差别很大。四个基因具有的CV低于5%,以及两个具有在或高于25%的CV(表3.).残差绝对值的平均值(图。1)变化4.2倍,从0.72 ACT11的水平,以0.17为UBQ。为了测试这种变化是否可能是由于单独的机会,我们通过列文的测试(列文1960)测试了残差的大小变化。基因中的变化是高度显著(P <0.004),并且在ACT11和UBQ之间残差的差异也显著根据Tukey的学生化范围测试,并且在5%的置信水平是Bonferroni t检验。
每个组织样品中每个基因的平均表达水平抵抗不同组织样品的总体方法。这一总体均值为该组织样品提供RNA质量和数量的指标,就像测试网站的手段一样,在产量试验中提供现场生育率的指数[13.]。斜率提供了基因对一般表达促进条件敏感的程度的估计,以及残留物(偏离回归预测)和均方残留物(MS-REG)估计基因表达的程度不可预测地变化的程度拆除线性效应后。回归后的残余变化很大(图2);MS区域改变大约14倍(表3.).假设需要在组织(低斜率)和高可预测性(低CV)上,我们创建了稳定性指数作为斜率和CV的产物。具有最低稳定性指数的基因通常提供最佳控制。在这项研究中,UBQ.具有最低的稳定性指数,既非常低的斜率和非常低的CV的结果。
内部控制的选择
除了表达水平的恒定性,内部控制的表达水平相比,被分析可能是重要的基因在某些情况下考虑。在我们的研究中,两个最稳定表达的基因表示的光谱的相对端。UBQ.中高度表达(平均ÇT= 15.8),而TUA以低得多的水平表达(均值CT= 28.9)(表3.).对于我们测试的样品,高稳定性UBQ.和TUA表达表明使用任何一个作为单一的内控基因是合适的。然而,对于一些研究来说,单个基因可能是不够的。在这些情况下,可能需要一种将两个或多个最稳定的内控基因归一化的方法。例如,将选定的内部控制基因归一化为几何平均值[7.]。以避免使用多个内部对照基因的额外的费用和劳动力的一个潜在的策略是设计一个PCR引物对将扩增对照基因家族,其结合表达水平可以表现出所需表达水平和稳定性的两个或更多个成员。
我们的引物是基于有限的EST集设计的,该EST集可能不包括所有家族成员,且序列质量各异。因此,引物可能扩增出一个以上的家族成员,或者由于EST序列错误导致引物不匹配,可能会降低PCR效率。虽然凝胶和实时PCR解离曲线分析没有表明我们的引物可以扩增多个基因,但这些分析可能无法检测到来自不同家庭成员的相同大小和相同PCR效率的多个扩增子。如上所述,这并不一定是有害的——多个家庭成员的扩增可能导致比单个基因扩增更稳定的内部控制。此外,即将发布的大型杨树单基因集和注释基因组序列[14.]将提高基因的选择和引物设计能力。
结论
使用方差分析和线性回归分析,我们证明了在许多潜在的控制基因之间的表达稳定性水平可以有很大的差异,并且测试一些基因并不困难,成本较高或劳动密集型。此外,这种验证试验还可能有揭示技术问题的额外好处,例如由于RNA质量或移液不一致而导致RT和PCR效率的过度变异。
对于一些实验,选择内部控制的选择很简单。例如,许多内政基因应该是令人满意的对照,用于在相同条件下生长的不同转基因素中的同一组织类型中的转基因表达水平的比较。然而,对于在不同的发育阶段或不同的环境条件下比较不同组织或细胞类型或在不同的环境条件下,如我们在七个月内的树木的研究中所代表的情况下,这并非如此。对于此类研究,应仔细测试内部控制并验证。QRT-PCR的内部控制的统计确认应使先前的表达水平难以清晰的较小变化是检测到的可靠性。
方法
组织收集和RNA提取
组织取自5年或6年生的杨树杂交无性系(毛果×P. deltoidies)2001年在七个月内(表格1).这些树一直生长在美国俄勒冈州波特兰市西北哥伦比亚河流域的商业种植园。去除芽鳞,将组织在液体N中冷冻2并储存于-80℃,直到RNA提取。总RNA,使用具有修改RNeasy小型试剂盒(Qiagen,瓦伦西亚,CA,USA)分离。组织(0.2克)研磨成细粉末,在液氮中研钵和研杵2。将粉末加入到含有1ml RNeasy RLT缓冲液和0.01g可溶性聚乙烯吡咯烷酮(PVP-40; Sigma,Sigma,St.Louis,Mo,USA)的管中的管中,并使用多螺杆均化约30秒。向匀浆中加入4体积的5m乙酸钾,将混合物在冰上温育15分钟,并在4℃下通过15分钟离心(12,000rpm)除去沉淀物。将上清液转移至两种1.5mL的微量离心管,加入0.5体积的100%EtOH。将样品转移到RNeasy Mini柱中,并且其余步骤根据制造商的植物RNA分离指令(步骤6-11)。使用分光光度法量化RNA260测量和质量进行OD assesed260/ od.280.比和通过在1%甲醛电泳琼脂糖凝胶接着溴化乙锭染色。将RNA贮存在-80℃。
杨树序列和PCR引物设计的选择
为了鉴定通常用作植物基因表达研究基因控制的杨树同系物,我们查询杨树EST数据库与拟南芥蛋白质序列使用TBLASTN [15.]。然后选择杨树的EST用于查询使用BLASTX拟南芥蛋白质数据库(表2).使用Primer3软件设计引物[16.或Primer Express (Applied Biosystems, Foster City, CA, USA),其融化温度为59-60℃。通过与杨树EST相关序列的比较,设计引物尽可能针对所选基因家族成员的特异性。所有引物对通过标准RT-PCR进行初步检测,采用与下面所述的实时RT-PCR相同的条件。通过3%琼脂糖-1000(美国卡尔斯巴德,美国加州)电泳和溴化乙锭染色验证预期大小的单个产物的扩增。
实时rt - pcr
根据制造商的协议,使用DNA- free试剂盒(Ambion, Austin, TX, USA)从RNA样本中去除污染的DNA,并进行两步实时RT-PCR。采用SuperScript RT-PCR (Invitrogen)第一链合成系统,按照说明书使用随机六聚体引物,从5 μg RNA中合成cDNA,但省略了最初的65°C变性步骤。用无核酸酶水1:5稀释cdna。所有引物均采用相同cDNA样本的Aliquots进行实时PCR,所有引物均在同一PCR程序中进行扩增反应。反应的体积为25 μl,每条引物含有600 nM, cDNA样品6.5 μl(输入RNA≈320 ng), 1X SYBR Green PCR主混合(Applied Biosystems)。对18S扩增,引物浓度为50 nm。使用ABI Prism 7700序列检测系统(Applied Biosystems)在96孔反应板上进行实时PCR,使用制造商推荐的参数(在50°C时2分钟,在95°C时10分钟,在95°C时15秒,在60°C时1分钟)。每个PCR反应进行三个重复,并包括无模板对照。PCR结束时使用ABI Prism解离曲线分析软件验证扩增的特异性。整个实验,包括RT和real-time PCR步骤,都是重复的,总共有两个实验重复。
统计分析
结果(C.T在Microsoft Excel中分析了ABI Prism 7700序列检测系统的值。使用Excel分析工具PAK执行使用最小二乘法的单因素ANOVA和回归分析。评价关于差异和正常性均匀性的假设从残留物(观察到的值与所有基因的总体均值之间的差异)从ANOVA进行评估(图。1).通过Fisher的F统计学[F =组织 - 样本平均正方形/误差平均线]评估不同样品中基因表达水平差异的水平和意义。假设三种复制PCR反应在完全独立观察之间的近似方差。其他统计数据如表所示3.。
比较作为内控基因的数据分析的一般程序是:
1)通过定量RT PCR生成来自基因表达的多种分析的数据,该定量RT PCR可以被认为是统计上独立的(或接近SO),包括从多个独立的样品括起来的感兴趣的实验条件。
2)行为ANOVA来检查变化的程度样品中,和(可选地)使用适当的F-比率测试他们的意义。检查残差与平均表达水平的情节,或者使用一个统计测试,以检查数据的常态。
3)基因表示ANOVA组织中高方差,特别是如果伴随着大的均方误差(或变异系数),是要避免的作为对照。
4)计算对每个样品类型研究的所有基因的平均表达水平,作为促进高水平测量表达的实验和生物条件的指标。使用大量基因和组织样品(例如,至少五个,优选更多)是期望在研究之间进行稳定性的估计。
5)回归每个样本类型中每个基因的平均表达水平高于样本类型的平均值。估计的斜率和均方残差(回归预测的偏差)提供了基因对一般表达促进条件的敏感性(斜率)和难以预测的表达的程度(残差)的估计。
6)假设样本类型的稳定性(低斜率)和高可预测性(低变异系数)都是可取的,可以创建一个稳定性指数作为它们的产品(或通过其他数学方法),并选择值最低的基因。
7)或者,视觉检查回归和残留曲线以选择最适合作为特定实验条件组的对照的基因。
参考
- 1。
Bustin SA: real-time reverse transcription PCR (RT-PCR)的mRNA定量:趋势和问题。中华内分泌杂志,2002,29:23-39。
- 2。
Charrier B,Champion A,Henry Y,Kreis M:通过实时逆转录酶 - 聚合酶链反应进行整个拟南芥毛茸茸的激酶多岛系列的表达分析。植物理性。2002,130:577-90。10.1104 / pp.009175。
- 3.
Veistinen E,LiippoĴ,拉西拉○:人类艾俄罗斯拼接的定量实时PCR变种。免疫学方法。2002年,271:113-123。10.1016 / S0022-1759(02)00370-8。
- 4。
Chuaqui RF,邦纳RF,最佳CJ,吉莱斯皮JW,弗莱格MJ,休伊特SM,菲利普斯JL,Krizman DB,Tangrea MA,金字塔,莱恩汉WM,克内热维奇V,埃默特降压MR:后分析随访和芯片的验证实验。NAT Genet。2002年,32(增刊):509-514。10.1038 / ng1034。
- 5。
Giulietti A,Overbergh L,Valckx D,Decallonne B,Bouillon R,Mathieu C:实时定量PCR的概述:用于量化细胞因子基因表达的应用。方法。2001,25:386-401。10.1006 / meth.2001.1261。
- 6。
弗里曼WM,沃克SJ,沃拉纳KE:定量RT-PCR:陷阱和势。生物技术。1999年,26:112-125。
- 7。
VandesompeleĴ,德译码K,PATTYN楼波佩B,范罗伊N,德Paepe A,Speleman F:通过多个内部对照基因几何平均实时定量RT-PCR数据的精确正常化。基因组Biol。2002年,3:research0034.1-0034.11。10.1186 / GB-2002年3月7日-research0034。
- 8。
Levene H:方差相等的稳健检验。《对概率和统计的贡献:纪念哈罗德·霍特林的随笔》。编辑:Olkin I, Ghurye SG, Hoeffding W, Madow WG, Mann HB。1960年,斯坦福大学出版社,278-292。
- 9.
损失是,Czerwinski DK,Wechser MA,Levy R:用于研究淋巴恶性肿瘤的定量实时RT-PCR参数的优化。白血病。2003,17:789-795。10.1038 / sj.leu.2402880。
- 10。
墨菲RM,瓦KK,卡梅隆 - 史密斯d,长臂猿CJ,雪RJ:使用实时RT-PCR人骨骼肌看家基因肌酸的影响。生理学基因组学。2003,12:163-174。
- 11.
Savli H,Karadenizli A,Kolayli楼Gundes S,乌孜别克U,Vahaboglu H:用于通过实时定量RT-PCR铜绿假单胞菌的抗性基因定量研究的提案:六个管家基因的表达稳定性。军医微生物。2003年,52:403-408。10.1099 / jmm.0.05132-0。
- 12.
Proudnikov d,Yuferov V,拉法格KS,何A,珍Kreek L:使用实时PCR光学大鼠脑区域的多个mRNA水平的定量。摩尔脑研究。2003年,112:182-185。10.1016 / S0169-328X(03)00056-1。
- 13.
崔旭,邱志华:基因芯片实验中差异表达的统计检验。中国生物医学工程学报。2003,29(4):457 - 461。
- 14.
比较品种的稳定性参数。作物科学,1996,6:36-40。
- 15.
Brunner Am,Busov Vb,Strauss Sh:Poplar Genome序列:生态主导植物种类的功能基因组学。趋势植物SCI。2004,9:49-56。10.1016 / J.Plants.2003.11.006。
- 16。
Altschul SF,马登TL,谢弗AA,张健,张Z,米勒W,李普曼DJ:缺口BLAST和PSI-BLAST:新一代的蛋白质数据库搜索程序。核酸RES。1997年,25:3389-3402。10.1093 / NAR / 25.17.3389。
- 17。
蔷薇S,Skaletsky HJ:引物3 WWW上的一般用户和生物学家程序员。在生物信息学方法和协议:分子生物学方法。Krawetz S,Misener S,托托瓦NJ:主编。2000年,Humana公司出版社,365-386页。
致谢
我们感谢Olga Shevchenko抵消RNA,Brian Stanton博士和格林伍德资源(以前堡垒James Corporation)允许研究他们的种植园树,以及在公开发布之前为提供Poplar EST序列提供杨树的序列。I.A.Y.由QualBright奖学金支持。这项工作的部分资金来自俄勒冈州立大学的树生物安全和基因组学研究合作社和USDA NRI竞争资助的研究计划(No.2002-35301-12173)。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
AMB开发的分子方法,参与研究的设计,并起草了手稿。IAY设计引物,进行实时RT-PCR试验,进行统计分析,并起草了手稿。SHS构思了分析,并参与了它的设计。所有作者阅读,帮助编辑,并同意最终的文本。
Amy M Brunner,Igor A Yakovlev同样地贡献了这项工作。
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
定量植物基因表达研究的内部控制验证。BMC植物BIOL.4,14(2004)。https://doi.org/10.1186/1471-2229-4-14
已收到:
公认:
发表:
关键词
- 候选参考基因
- 内部对照基因
- 基因表达的稳定性
- 偏见基因表达
- 多个内部控制基因