摘要
背景
当植物暴露在升高的温度下时,发生了广泛的细胞反应,包括膜脂肪酸的不饱和水平的调整。虽然膜结合去饱和酶介导了这些调节,但尚不清楚它们是如何被调节以实现这些特定的膜组成的。此外,不同的膜脂肪酸组成在光合作用中所起的确切作用才刚刚开始被了解。为了探索膜组成和光合功能对温度的响应调节,我们检测了温度对一组膜脂脂肪酸组成改变的突变体的影响。
结果
拟南芥膜脂肪酸不饱和水平与生长温度呈负相关关系,这与其他植物的研究结果一致。膜脂肪酸达到在高温下观察到的组成所需的时间与合成新脂肪酸所需的时间一致。比较了几种拟南芥系的膜中温度诱导的脂肪酸变化,包括野生型哥伦比亚和组成突变体,fad5,fad6,act1和双突变体,fad7 fad8而且act1 fad6.结果显示,不管甘油脂通路的特定突变如何,在温度升高时发生的关键变化包括三烯脂肪酸显著减少,不饱和16:0和二烯酸18:2水平一致增加。不同突变体的荧光测定结果表明,某些膜脂肪酸组成对光合稳定性和植株在高温下的生长有影响。
结论
本研究结果支持了膜脂中一定比例的饱和脂肪酸和不饱和脂肪酸是光合热稳定性和对高温的适应所必需的这一前提。结果还表明,膜脂肪酸组成的变化对温度的响应以这样一种方式被调节,以达到高度相似的不饱和水平,尽管突变改变了膜组成在高温暴露前。检测突变系的结果还表明,脂肪酸的细胞器间转移参与了介导温度诱导的膜改变,并揭示了脂肪酸不饱和途径中的步骤,似乎在膜对高温的适应中起关键作用。
背景
植物面临的最普遍的环境挑战之一是暴露在大范围的温度下。植物利用各种解剖、代谢和细胞策略来应对环境温度的变化。在细胞水平上,对高温的适应部分是由一般应激反应的诱导介导的,其中包括热休克蛋白的表达和活性的增加[1- - - - - -6].这些蛋白质通过作为分子伴侣的作用来抵消错误折叠蛋白质在暴露于高温时产生的损害,从而使生物体能够抵御高温。另一方面,细胞膜特性的改变是为了确保细胞膜内部过程的正常运作。叶绿体类囊体是光合电子传递机制的载体,是叶片组织中最丰富的膜。它们负责细胞内所有的光收集和光合作用能量转换。类囊体膜内的一些变化迅速发生,以减少环境立即变化所引起的压力。例如,在突然暴露在强光下时,细胞膜可以发生短暂的改变,以抵消多余的吸收能量[7,8].此类多余光能的热耗散是由类胡萝卜素玉米黄质的功能介导的,类胡萝卜素玉米黄质是由紫黄质通过去环氧化酶转化而来的,该酶在强光下迅速被激活[9].然而,总的来说,温度诱导的膜成分变化遵循时间尺度,反映了植物在不同温度下的适应性[10].
关于植物适应高温能力的早期研究是在适应高温生长的植物上进行的[10- - - - - -12].例如,沙漠灌木滨藜属lentiformis,通过降低十六烷基四烯酸(16:3)等不饱和脂肪酸水平,在较高生长温度下提高饱和脂类水平,改变其膜脂肪酸组成[13].温带环境植物的膜脂肪酸对温度的响应也有类似的趋势,这一观察表明,膜脂的变化通常有助于植物适应不同温度的能力[14,15].
在众多可能受膜成分影响的细胞过程中,光合作用可能是最关键的。因此,调整类囊体膜的不饱和水平可能会影响植物适应高温条件的能力,以避免光合效率的降低。在这方面,PSII的反应中心被认为是类囊体膜中对热分解最敏感的成分,PSII内部的水分裂D1蛋白的功能被认为是最容易被高温破坏的[10也是光抑制的主要靶点[16,17].因此,高温诱导的膜成分变化可能在这种蛋白质的稳定性中发挥作用,从而对整个植物在高温下的生长产生积极影响。
对蓝藻的研究表明,温度介导膜成分改变的机制是在转录水平上的。蓝藻细胞中的去饱和酶转录本水平随着低温生长而增加[18].蓝藻去饱和酶基因的转录很可能依赖于膜本身的物理性质[19].蓝细菌类囊体膜流动性程度的变化可能是感知热应激的一种手段,这一观点得到了一项发现的支持,即当膜流动性发生化学变化时,热休克蛋白会被诱导[20.].然而,大多数植物研究表明,转录并不是控制膜脂肪酸不饱和的主要手段。对拟南芥中去饱和酶基因表达水平的研究表明,它们中的大多数不通过转录变化对温度的升高或降低做出反应[21- - - - - -23],或由去饱和酶途径突变引起的膜脂肪酸组成的改变[24,25].只有相对罕见的由拟南芥催化的去饱和步骤fad8基因(25],以及针对特定植物种类的其他高度具体的例子[26],已经被证明在转录水平上受温度的调节。
本研究研究了拟南芥叶膜脂肪酸组成对温度的响应。在确定了在不同升高温度下发生的变化后,我们研究了一些具有很好特征的膜脂肪酸含量变化的拟南芥突变系。研究的品系主要不同于叶绿体膜中各种脂质的不饱和程度。对这些在高温下生长的细胞系的脂肪酸谱进行检查,发现了一个调节系统,即使在没有特定的去饱和酶步骤的情况下,也介导了膜成分的变化。结果还提示了一些可能在膜脂肪酸不饱和水平随温度变化而调整的机制中很重要的一般控制点。在进行这些研究的过程中,我们还研究了膜脂肪酸组成和在高温下生长之间的关系。
结果
升高的温度改变了拟南芥的膜脂肪酸
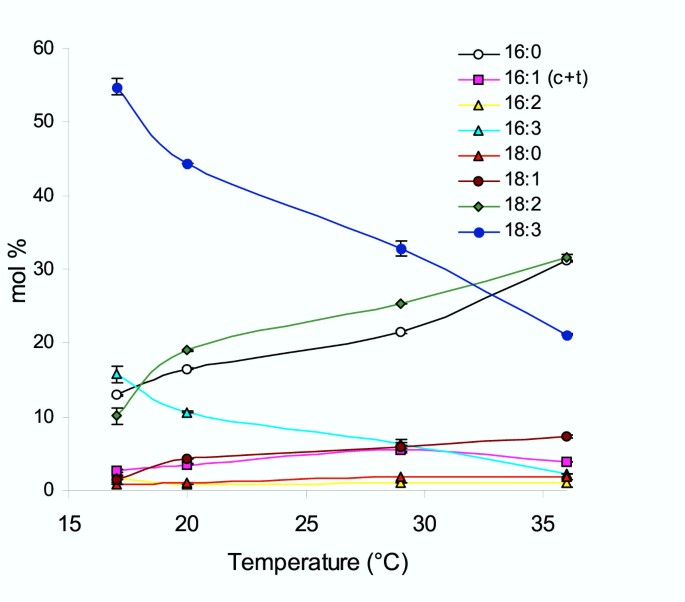
拟南芥株系在17℃下发芽生长7天,然后转移到指定温度。从不同温度下生长30 ~ 35 d的品系中提取叶片总脂肪酸,转化为甲基酯,用气相色谱法进行分析。在17°C、20°C、29°C和36°C条件下生长的哥伦比亚野生型系主要脂肪酸种类的相对丰度变化如图所示。1.在16和18碳长脂肪酸中,随着生长温度的升高,多不饱和物种的丰度下降的趋势是明显的。在相同的生长温度下,18℃和36℃生长的植物叶片中18:3脂肪酸占总脂肪酸的比例从54 mol%下降到21 mol%, 16:3种植物从约16 mol%下降到2.3 mol%。相比之下,双不饱和亚油酸(18:2)和单不饱和油酸(18:1)的比例对生长温度升高的响应相反,在生长温度越高的植物中,这两种物质的比例越高。具体而言,在17℃和36℃生长温度下,18:2脂肪酸占总脂肪酸的比例分别从10.1 mol%增加到31.5 mol%。这些变化在测量的温度上不是线性发生的,但在17°C到20°C之间的变化更大。在20°C以上的温度下,脂肪酸的相对丰度通常以更线性的方式变化。然而,与大多数其他脂肪酸不同的是,16:0在29°C和36°C这两个最高生长温度之间的变化更突然。为了提供对总膜不饱和水平的额外估计,双键指数由摩尔%脂肪酸数据计算(表2)。双键指数随生长温度的升高而降低。同样,在高温下生长的植物中,饱和棕榈酸的含量为16:0,积累到更高的比例,从12.9到31摩尔%。其他脂肪酸(16:1、16:2和18:0)的相对丰度显示,在高温下生长时,这些变化不太明显。
高温引起的膜改变的时间评价
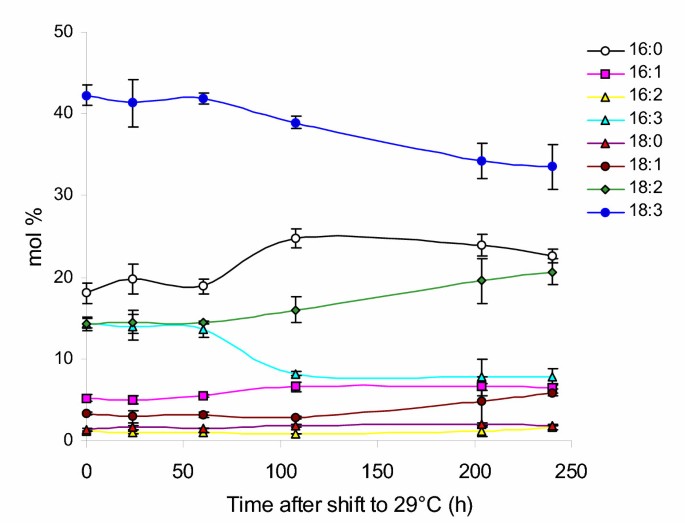
基于温度升高后检测到的实质性变化,我们希望确定这些变化是否在时间尺度上发生,与已知的脂肪酸新合成的时间相似。为了估算温度升高引起膜脂肪酸组成可测量变化所需的时间,拟南芥幼苗在22℃下发芽和生长7天,然后转移到29℃。然后,通过气相色谱分析评估在转换到高温后不同时间采样的莲座叶中的脂肪酸组成(图1)。2)。在22°C(0小时)下生长的植物的叶片脂肪酸分布与之前在相似温度下生长的植物的测定结果相当(图1)。1)。在转移到29°C 60小时后,未检测到脂肪酸分布的显著变化。对高温响应的最早变化发生在108 h,其中16:0和16:3变化最大、最突变,18:2和18:3变化可检测,但更平缓。在204小时的时间点,18:2和18:3种植物的积累发生了变化,其程度类似于在不同温度下生长的植物的显著变化。具体来说,18:2的比例从约16 mol%上升到19.5 mol%,而18:3的比例从约39 mol%下降到34 mol%,并在转移到高温240 h后的最后测量时间点保持相对不变。
观察到的脂肪酸组成随温度升高而变化的时间过程,与在放射性标签饲养实验中加入前体以达到稳态水平所确定的时间有关[27].转移到高温后,也观察到同样的脂肪酸变化的一般模式。例如,16-C脂肪酸,16:0和16:3,在108小时时分别从18.9到24.8 mol%和13.6到8.2 mol%突变,并保持相对不变,直到最后的时间点,除了16:0在108小时观察到的增加之后有一定的下降趋势。另一方面,18-C脂肪酸的相对比例发生了重大变化,其中很大一部分来自真核途径。直到204小时才显现出来。18:2和18:3和16:0和16:3的变化起始点的区别也反映在18:2和18:3的反应更线性,而16:0和16:3的反应更突变,然后是相当线性。对照实验中,野生型拟南芥系保持在22°C,并在相同的时间间隔内对膜脂肪酸进行采样,如图所示2在108小时时没有出现相同的变化,但在整个过程中保持了类似的剖面(数据未显示)。因此,检测到因生长温度升高而引起的脂肪酸组成的第一次变化与新脂肪酸合成所需的时间是一致的。这些结果还表明,膜脂肪酸对温度的响应变化需要新的脂质翻转和重新合成,以达到温度适应的组成。
温度诱导突变系膜脂肪酸组成的变化以探讨膜调控
许多拟南芥年代膜脂肪酸谱变化特征明显的细胞系1)被用来检查甘油脂通路中的特定块如何影响膜的组成,以响应高温。在本分析中,我们检测了生长在17°C和36°C的植物的膜脂肪酸含量。与以前的测定结果一样(图。1),所有的植物在17°C的环境箱中发芽和生长7天,然后转移到36°C的一组。在生长25-30 d后测定脂肪酸分布。根据之前确定的叶片膜脂肪酸组成对该温度的响应,以及植株的整体生长性能,选择了17℃的较低生长温度。36°C是根据在该温度下生长的野生型植物的脂肪酸组成的显著变化以及该温度代表土壤营养生长的生理上限而选择的。事实上,在这种温度下生长会导致植物不育(数据未显示)。这种种子产量的损失显然是由于花粉形成不足造成的,并且与在29°C下生长的品种种子产量显著下降(约50%)一致(数据未显示)。在36°C孵育也被用来提供条件,在这些条件下,在各种拟南芥突变系中最清楚地勾画出叶片脂肪酸的分布,并确定脂肪酸组成在温度升高时的变化幅度。
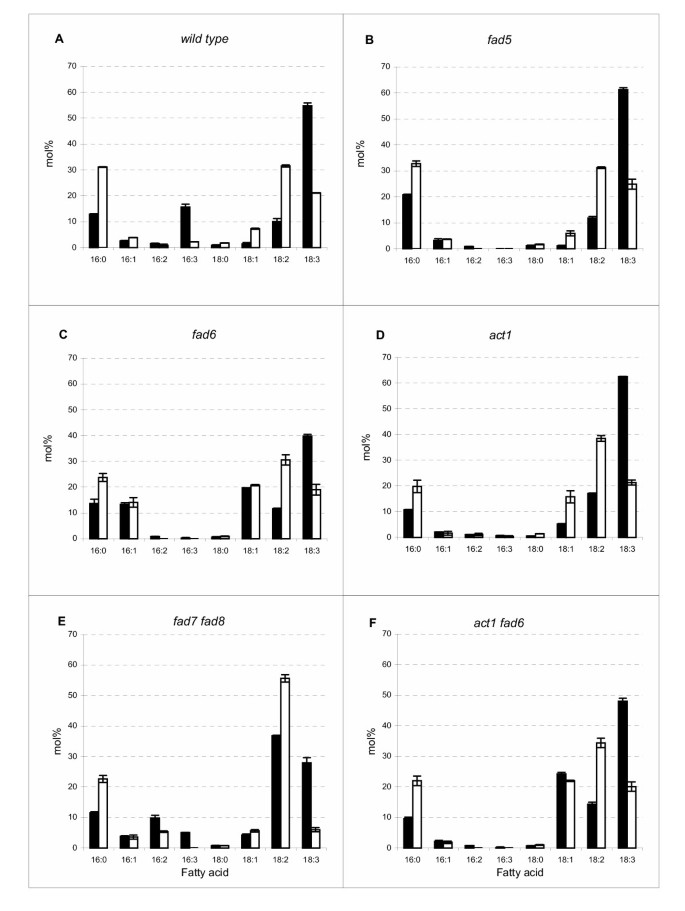
本分析中使用的每一个株系都有一个突变,主要影响叶绿体光合膜的组成1)。这些突变体中的一些以前已经显示出不同程度的热耐受性[28- - - - - -31].对这些品种的脂肪酸谱的检验反映了在17°C以上温度下生长的野生型植物的一般趋势(图1)。1)。如前所述,与在17°C下生长的植物相比,多不饱和脂肪酸的水平一般会随着二不饱和脂肪酸和饱和脂肪酸的增加而降低(图1)。3.)。其中,三烯酸(16:3和18:3)在温度升高时急剧下降,二烯酸18:2(但16:2没有上升)急剧下降。饱和16:0和某些品系的单不饱和18:1在36°C生长的植物中也累积到较高水平。由这些数据推导出的双键指数也提供了膜不饱和水平的一般估计(表2)。突变体行fad5,fad6,fad7 fad8,act1 fad6在17°C条件下生长的植物的双键指数较野生型低fad6显示出最明显的整体不饱和度下降。而在36°C条件下生长的突变系的膜的双键指数与野生型相似,平均值为1.5。因此,在较高的温度下生长的不同品系的总膜不饱和水平是相对相等的。
在个别品系中,对高温的响应有两个主要变化:16:0和18:2脂肪酸的丰度增加,16:3和18:3这两种三烯多不饱和脂肪酸的丰度明显减少。3.)。在这种情况下fad5突变系中,这是缺乏在16:0到16:1的饱和sn-2只在氯塑单半乳糖二酰甘油上的位置[32],在17°C下生长的植物所产生的16-C脂肪酸与在高温下生长的野生植物所产生的16-C脂肪酸相似。3 b)。这包括16:3的比例,由于原核途径在16:0水平上的阻塞,这一比例基本上是不存在的。在36°C时,组成fad5在所有被检测的突变体中,膜与在高温下生长的野生型最相似。高度的相似性fad5野生型组合物可能意味着由FAD5去饱和酶催化的步骤是膜组合物对温度响应的适应性的一个重要控制点。
膜脂肪酸组成的检查fad6对高温反应的突变系同样揭示了在高温下生长的野生型系的一般趋势(图1)。3 c)。因为fad6在所有叶绿体脂质上分别缺乏16:1和18:1到16:2和18:2的去饱和[33],这一行16:1和18:1的积累都很明显。这两种单不饱和脂肪酸的比例几乎没有变化fad6在低温和高温下生长的植物,表明由于FAD6去饱和酶的突变,这些物种的过度积累水平不受温度响应的变化的影响。
基因突变act1由于叶绿体GPAT缺乏,这条线阻断了脂肪酸进入原核途径[34].这反映在脂肪酸的组成上act1在低温和高温下生长的植物,所有16摄氏度的脂肪酸种类都减少了(图5)。3 d)。温度引起的脂肪酸组成的变化act1与野生型相比,18-C脂肪酸的总体轮廓高度相似,表明控制18:2到18:3转换的去饱和酶是调节叶膜不饱和水平的主要控制点。在两种温度下18:2的略高水平act1与野生型相比,可能反映了先前证明的通过主要是这种脂肪酸的转移进入叶绿体膜的脂肪酸通量的增加[27,34].
不足之处fad7 fad8Line是由于叶绿体中两个基因座发生突变,每个基因座分别编码将16:2和18:2转化为16:3和18:3的去饱和酶同工酶[35].在这一行中,二烯脂肪酸,16:2和18:2,被升高了,高温的影响导致这一升高的16:2从9.8 mol%降低到5.4 mol%(图。3 e)。而18:2的比例对高温的响应由36.8 mol%增加到55.7 mol%。三烯脂肪酸,18:3,这是因为fad7 fad8在17℃时,突变量低于野生型(28 vs 54.8 mol%),在36℃时,突变量降至6 mol%,为所有供试品系中最低的18:3叶量。因此,在缺少大部分FAD7和FAD8脱饱和酶活性的情况下,保留了响应高温生长增加18:2和减少18:3的总体趋势,FAD7和FAD8脱饱和酶活性催化叶膜中大部分三烯脂肪酸的形成。
交叉线从…之间交叉而来的线act1而且fad6在本研究中产生,并用于评估含有膜脂肪酸组成的植物的性能和温度响应,该膜脂肪酸组成的区别是升高的水平为18:1(由于FAD6去饱和酶的缺乏),但没有增加的相对数量为16:1(由于GPAT活性降低,进入原核途径的阻塞)。的合成结果act1 fad6在17°C下生长的双突变系表明在这些步骤中每个步骤的突变的预期轮廓。随着温度升高而改变的脂肪酸剖面与每一个在高温下生长的亲本突变系相似。3 f)。的act1 fad6因此,Line提供了不同于本研究中其他线的膜脂肪酸概况,它包含升高的18:1,但没有增加的16:1或16:3的比例。这样的轮廓可以用来说明所有其他脂肪酸的比例只增加了18:1但相对相似的功能意义(见下文)。
荧光效应增强
通过测量叶绿素荧光参数来测定PSII的热稳定性,对6个具有不同膜脂肪酸组成的拟南芥品系进行了评价。叶绿素荧光的使用已被广泛用于研究光合作用,以前的研究已使用类似的方法对分离的叶绿体或分离的叶片进行光合稳定性检查fad5而且act1行(29,36].然而,这里进行的分析是第一个使用的在足底并排比较的测量,以检查热容差的差异。此外,在荧光稳定性测量之前,测定了本分析中使用的所有系的脂肪酸组成,发现所有系的脂肪酸组成都在17℃下生长的系的脂肪酸剖面测定值的标准误差内(图1)。3.,数据未显示)。表格3.显示荧光分析结果。植株在17°C下生长,在大约四周大时进行评估。在这种温度下生长的所有植物中,显然突变系fad6,fad5和交流t1荧光过渡点(TP)温度有统计学意义的升高fad7 fad8显示出轻微但不显著的增长。这些结果很可能是由于在这种温度下生长的品系叶片中不同的膜脂肪酸组成所造成的差异。从这些完整的叶片测量中获得的TP值,与之前使用分离的叶绿体制剂或分离的整片叶片对一些品系进行的各种测定非常相似[29,36,37].因此,随着叶片温度的升高,只有部分品系的光合量子产率稳定性增强,这似乎与来自原核途径的三烯脂肪酸(尤其是16:3)的减少呈正相关。然而,16:3的相对比例似乎并不是增加热稳定性的唯一决定因素。
双突变体act1 fad6提供了一条与本研究中分析的其他线条不同的脂肪酸剖面(即,在17℃时,增加了18:1的百分比,但没有增加16:1的水平)(图。3 f)。为了确定这种成分是否导致光合热稳定性的差异,我们对act1 fad6连接到荧光测量。的act1 fad6双突变体的TP温度与野生型的TP温度没有显著差异,尽管每一个只具有单个突变的亲本株系都表现出可测量的热稳定性增强(表2)3.)。
的act1++系是一种过度表达GPAT的转基因系(即act1基因产物)。在这里,它被作为一个额外的线来测试它的脂肪酸组成是否会影响由叶绿素荧光测定的热稳定性测量。然而,叶片脂肪酸的组成act1++在17°C下生长的植物与野生型成分相似,除了16:0和16:3脂肪酸的百分比分别增加到2.0和1.5 mol%,高于野生型所确定的比例。叶绿素荧光测定表明,与野生型相比,该品系的热稳定性没有明显差异。
尽管不同品种之间的稳定性测量的最等效比较来自于在拟南芥认为温和的温度下生长的品种,如这里使用的17℃,但我们也确定了那些在高温生长后在17℃下表现出增强热稳定性的品种的TP温度。由于这项研究揭示了在不同的高温下膜脂肪酸组成的明显差异,基于荧光测量的高温驯化迹象可能是明显的。包括野生型在内的4株植物在29℃下生长3周后进行荧光稳定性测试。结果表明,在17°C下生长的野生型TP温度从42.7°C增加到29°C下生长的植物的约44.8°C(表2)3.)。然而,fad5,fad6而且act1与野生型相比,在17°C生长时表现出可复制的热稳定性增加的品系,在高温下生长时表现出与野生型基本相同的TP温度。突变株的热稳定性没有比在高温下生长的野生型株系的温度更高的可检测到的增加,这可能是在高温下生长后膜脂肪酸组成改变的结果。相似的TP温度也与双键指数为这些线计算的总体相似的不饱和水平一致。这些结果也可能反映了在生长温度升高时脂肪酸调整所能达到的耐受上限,至少对本研究品系的不同成分是如此。
高温生长
本研究中使用的突变系大多是根据其叶绿体膜中脂肪酸分布的改变来选择的。如图所示,许多在17℃下生长的品系中三不饱和脂肪酸总水平的下降反映了在高温下生长的野生型品系的组成。为了确定观察到的变化是否转化为整个植株水平上的性能提高,研究人员测定了不同温度下品系的生长速率。生长速率只在转向高温后的前6天内测定,以便在适应高温过程中膜发生变化之前保持株系的等效膜脂肪酸组成(图1)。2)。如表所示4的相对增长率fad5,fad6,act1而且fad7 fad8转高温后数天内,秧苗至少与野生型相同或略高于野生型。与村上等人的研究结果一致。[31),fad7 fad8从生长速率看,突变系对高温的耐受性最明显。这些结果表明,与野生型相比,多不饱和膜脂肪酸组成较少,有利于幼苗在高温下生长。
讨论
膜脂肪酸组成的几个明显的变化是对高温生长的响应。三烯脂肪酸的减少,包括仅在叶绿体原核途径中产生的16:3的强烈减少,与多不饱和脂肪酸在高温下的普遍减少是一致的。在高温下,三烯脂肪酸积累减少的同时亚油酸增加,分别为18:2和16:0(图5)。1而且3.)。观察到16-C脂肪酸表现出不同于18-C脂肪酸的模式,这表明不同的脂肪酸类别可能在维持最佳膜功能和不同的机制控制它们的合成方面有特定的作用。在大多数被检测的细胞系中,膜不饱和程度相对相似,这也支持了这种特定脂肪酸在膜中发挥不同作用的观点2),尽管在生长或光合稳定性方面存在差异。
值得注意的是,即使在减饱和途径早期或晚期缺乏步骤的突变系中,也能观察到这些普遍的改变。例如,配置文件fad5,这是缺乏在16:0的叶绿体去饱和相比fad7 fad8它缺乏形成三烯酸的最后一步去饱和酶,在对高温的响应中表现出类似的总体趋势。这些温度响应必须考虑到拟南芥中平行运行的两条甘油脂途径,一条在叶绿体包膜中,另一条在内质网中[38,39].
本研究中使用的所有突变体背景线的先前特征明确表明,每个突变体中所缺少的特定的去饱和酶(或酰基转移酶)活性作用于主要的脂质种(表2)1)。温度引起的膜组成的改变可以考虑在特定突变背景下及其在甘油脂通路的给定步骤中的相应缺陷。在这种情况下,检测的突变主要影响叶绿体脂质。此外,多不饱和16-C脂肪酸可以作为主要叶绿体脂类单半乳糖二酰甘油和双半乳糖二酰甘油的可靠标记物,因为它们是唯一含有这些脂肪酸的脂类。关于在高温下生长后的脂质组成,从相关物种中检验单个脂质的比例,芸苔属植物显著的研究表明,在20°C和30°C生长的植物的叶膜没有发生显著变化[15].这一发现表明,在这些温度下,最显著的变化是脂肪酸的不饱和程度,而不是主要叶脂本身的水平[15].
温度诱导膜改变的时间基础
脂肪酸组成适应高温生长条件所需的时间表明,叶膜的主要变化不会在温度升高时迅速发生。在脂肪酸结构发生明显变化之前的约60小时内,对应着新的脂质合成和转化的发生,因此,这并不表明温度诱导现有膜脂肪酸发生修饰的机制。这些结果也与标记研究一致,表明由原核途径产生的脂肪酸积累先于通过真核途径合成的脂肪酸。16-C脂肪酸在转移到高温后60小时开始发生突变,而18-C脂肪酸观察到的变化是逐渐的和更连续的(图1)。2)也符合这些标签模式。许多时间过程放射性示踪剂标记研究(包括对本文使用的大多数突变系进行的几项研究)都证实,甘油脂途径的早期阶段显示的改变早于通过真核途径形成的改变[27,33- - - - - -35,40].这包括在不饱和脂肪酸积累之前形成饱和脂肪酸,以及在原核途径中早期产生含棕榈酸的脂肪酸。总的来说,这些时间过程的观察表明,膜不饱和水平的调节在植物的长期驯化中起着作用。因此,环境温度的瞬时通量不太可能导致叶膜组成的明显变化。
突变系中膜的组成对温度的响应
不同遗传背景下高温生长产生的脂肪酸组成揭示了一个复杂的调控系统。因此,尽管在不同的突变体中有几个酶的步骤的缺陷,膜脂肪酸的组成经历了类似于在野生型中观察到的对温度升高的响应的调整。在高温生长后,其增幅类似于18:2水平fad5,fad6,act1,act1 fad6野生型系表明,18:2的比例可能是膜驯化的重要因素。这些结果还表明,去饱和酶的活性以及来自氯外塑料膜的通量也可能受到控制,以调节对温度的响应(见下文)。在测试的品系中,18:2(相对于18:1)的积累表明它是适于高温生长的膜的首选品种。尽管未知,但有一种猜测认为18:2可能是由于膜中双不饱和酰基链所代表的“中间”水平的无序。与含有两个双键的酰基相比,含有一个双键的脂肪酸(如18:1)对膜的无序程度更大,而酰基对膜的无序程度仅略低于三不饱和脂肪酸18:3。的组成fad7 fad8突变系支持这一观点,其摩尔%为18:2几乎是野生型膜的2倍,且该突变系在高温下生长最好。然而,生物膜是复杂的动态结构,很可能其他未知因素对维持膜的最佳功能很重要。
几个在高温下生长的突变体的脂肪酸谱表明,对来自真核途径的脂肪酸通量的控制是在18:2和18:3中观察到的由于温度引起的变化的部分原因。在fad6在高温下生长的突变体,18:2和18:3的比例与野生型中观察到的比例高度相似,尽管基本上所有18:2都必须来自真核途径。之前的标签研究表明fad6Line显示通过原核途径的脂质合成减少[33],这一机制可能是为了维持叶绿体膜的特定物理特性,也可能参与调节膜的组成以应对温度升高。在这种情况下,一个可能的机制可能是通过FAD7和FAD8去饱和酶转移到叶绿体去饱和的18:2脂肪酸的数量减少。的fad6研究还发现,在内质网中工作的FAD2酶的活性也可能受到温度调节的影响。
同样,在act1在该突变系中,脂肪酸进入原核途径被GPAT催化的步骤阻断,主要差异是在高温下生长时降低16:0水平。这大概反映了增加进入真核途径,但与类似的温度响应调节。18:2从真核途径返回叶绿体的通量似乎也受到了调节,因为18:1和18:2的比例在act1在这两种温度下,18:3的水平与野生型高度相似。
脂肪酸的组成fad7 fad8突变体揭示了在叶绿体中缺乏所有三烯脂肪酸形成的去饱和酶活性的情况下,对升高温度的响应发生的变化(图。3 e)。这也表明,脂肪酸从真核途径的转移可能是膜组成的温度调节的一个重要组成部分。这种机制是可能的,因为该品系产生的18:3的主要比例必须通过FAD3去饱和酶的真核途径合成[27].在高温下生长的植物中检测到18:3的低水平是内质网中FAD3酶也受温度调节的证据。因此,去饱和酶的活性似乎是由升高的温度反向调节的,这与先前提出的可能机制一致[41].对本文数据的分析表明,催化三烯脂肪酸形成的去饱和酶(FAD7, FAD8和FAD3)和FAD5去饱和酶是可能具有最大影响的酶,如果以这种方式调节。
膜脂肪酸的组成对增强光合作用、耐高温有一定作用
关于植物适应高温能力的研究主要集中在最可能影响光合电子传递稳定性的成分上,特别是PSII。在这方面,叶绿体类囊体的组成有望在光合电子传输的热耐受性中发挥重要作用[10].穆恩等人,[42的研究表明,PG的不饱和水平在植物中受损D1蛋白的去除和替换过程中起着重要作用。然而,直到最近才有人提出在高温下稳定D1蛋白与蛋白质-脂质相关的直接关系[43].这里提出的结果暗示了一种调节机制,在响应温度时赋予了类似的总体组成,而不考虑由于突变引起的膜中初始脂肪酸的改变。如此明显严格控制的一个可能原因可能是,利用存在于叶绿体和叶绿体外位置的去饱和酶途径,减少了对膜功能有害的成分。
叶片受热过程中PS II活性的测定被用来作为不同膜成分可能赋予的热稳定性的敏感指标。在这种情况下,在完整的叶片中确定了PS II电子输运的量子产率坍塌(TP)的温度。荧光测量是在17°C下生长的植物上进行的,以最小化变异和其他潜在的反应,如在更高的温度下可能诱导的热休克蛋白合成的增加。此外,只有在17°C的生长温度下,根据双键指数估计,不同品种间的总膜不饱和水平存在差异,这可能表明脂肪酸组成的最大影响发生在较低和较温和的温度下。
的fad6突变体在17°C生长时荧光产量提高最大。这个最大TP值基本上与在29°C下生长的几种植物(包括野生型系)获得的TP值相同3 b)。在17°C下生长的突变系中,2°C的差异可能是PSII热稳定性的精确指示,这种热稳定性可以通过膜脂肪酸组成的调整而获得,因此可能反映了这些调整对拟南芥高温适应的贡献程度。虽然还不清楚特定脂肪酸如何影响热稳定性,但分析act1 fad6本研究描述的突变体表明,改变16:1和18:1的相对丰度有影响。这两个act1而且fad6通过荧光测定,突变株表现出比野生型更强的稳定性act1 fad6曲线没有显示出16:1的升高,但略高于18:1的水平,表明TP温度与野生型相比没有统计学差异(表3.)。这三种突变体之间荧光TP温度的差异,以及TP值与双键指数之间缺乏相关性,说明了特定脂类的相对水平可以影响热稳定性。对蓝藻去饱和酶突变体中光捕获复合物扩散率的测量也指出脂质在光系统稳定性中可能具有明显的作用。在最近的一项研究中,藻胆体与反应中心的相互作用被认为是由脂质稳定的,而不是直接受膜不饱和水平的影响[44].使用光谱方法的研究也表明,尽管生长温度或不饱和水平不同,蓝藻膜的整体脂酰链紊乱是相似的[45]并且膜中的蛋白质-脂质相互作用似乎是膜动力学的一个关键参数[45,46].
由于膜成分变化而测量的单一物理参数往往与整厂性能测试的明显结果无关。与本文给出的结果类似,Murakami等人,[31的研究表明,叶绿素荧光测量可能不是评估整株植物性能的理想指标。例如,尽管fad7 fad8曲线在高温下生长速度最快,基于荧光产率的热稳定性差异不显著。使用其他功能测量,如CO2吸收速率或O2进化,可以提供更可靠的指标来评估潜在的高温耐受性,尽管这些测量也可能导致不可预测的结果,关于整个植物的生理。在一个几乎没有叶绿体膜中所有双半乳糖二酰基甘油的拟南芥突变体中,O2研究发现,尽管类囊体膜组织和荧光能量转移特性发生了巨大变化,但进化并未受到影响[47].因此,由膜中不同脂肪酸的相对水平引起的额外差异很可能影响热耐受性,而膜不饱和水平将不是唯一的因素。其他影响膜结构和功能的诱导变化也很重要。例如,脂质分子酰基链中双键的长度和位置的改变可能会带来截然不同的性质,这表明不同脂肪酸类别的特定比例可能是最佳膜功能所必需的[48].
为了应对诸如高温等压力,许多过程都起了作用。热休克蛋白的诱导是应对高温的一种对策[5以及它们在热耐受性中的具体作用正变得越来越清晰[2- - - - - -4,49,50].植物的抗氧化状态和耐热性之间的关系最近也被注意到[51- - - - - -53].另外,也许更具有物种特异性的反应可能在防止高温生长的有害影响方面很重要,包括甘氨酸甜菜碱等小分子的积累,以及通过rubisco激活酶调节碳固定[6,54].
尽管三烯酸含量的降低可能是植物耐热性的一个重要决定因素,但具有其他不同脂肪酸种类含量升高的品系则表现出不同的特征。拟南芥的一个三重去饱和酶突变体表明,在低温条件下,叶膜中的所有三烯酸脂肪酸都不是生长所必需的[55].这fad7 fad8 fad3突变体也表现出热稳定性,但实际上在长时间暴露于33°C后死亡,这表明一些三烯酸脂肪酸确实是高温生长所必需的[56].在这里测试的所有品种的长期高温暴露的上限约为34°C,植物继续生长和开花,但种子产量下降(数据未显示),这与一些三烯脂肪酸是必要的想法一致。尽管在本研究中没有涉及,但确定这种高温生长植物的种子产量下降是否与亚麻酸水平不足有关将是有意义的,亚麻酸是合成茉莉酸所需的前体,茉莉酸是花粉发育所必需的信号分子[57].
鉴于拟南芥不被认为是一种耐高温植物,本研究中有关高温下生长性能的结果是值得注意的。58].在耐热性较强的植物中,膜脂肪酸组成的调整对合理控制植物的耐高温性具有重要意义。例如,抑制烟草中FAD7同源物同时提高18:2和降低18:3使烟草在高温下生长增强[31].因此,消除三烯脂肪酸可能是改变膜成分以促进这种增强生长的最关键方面。然而,目前尚不清楚的是,在这些系中出现的单不饱和脂肪酸和双不饱和脂肪酸的相应增加是否也有助于提高耐受性。在这项研究中检测的几个突变系也具有非常低水平的三烯脂肪酸,但伴随而来的是其他脂肪酸的明显变化。大多数突变系中作为突变步骤前体的脂肪酸种类含量升高。的fad5在17°C条件下生长的细胞株,其16℃的脂肪酸与36°C条件下生长的野生型细胞株的脂肪酸最相似,并且在36°C条件下生长的膜脂肪酸分布与野生型细胞株几乎相同(图1)。3、3 b)。虽然这样的组合物在中等或较高的温度下没有有害的影响,这一行,以及fad6线,显示低温下生长和叶绿体发育受损[28].基于与高温生长的野生型植物相似的组成,由FAD5去饱和酶催化的反应,已被鉴定为表达的序列标签[59],可能是进一步操纵耐高温的附加目标。
结论
这项研究表明,温度精确地调节了膜脂肪酸的组成,而这些变化发生的机制不受脂肪酸去饱和途径中的许多突变的深刻影响。这些观察结果支持这样一种观点,即植物膜的不饱和水平在使植物能够忍受高温方面起着一定作用,但膜脂的其他特征可能也很重要。对一些脂肪酸去饱和酶突变体的检查还表明,膜脂肪酸的不饱和水平随生长温度的变化显然是通过控制脂类生物合成途径中几个步骤的去饱和酶活性水平以及通过调节叶绿体和胞质途径之间的间室通量而发生的。
方法
植物材料和生长条件
拟南芥系生长在环境控制的室内(Conviron, Inc.),在120-150 μmol m的连续光照下调节到给定的温度-2年代-1.种子播种在含有蛭石珍珠岩混合(1:1:1)的盆栽土壤上,每三次浇水用商业肥料灌溉。对于在高温下的花盆中生长,种子在17°C下发芽和生长7天,然后转移到相应温度的生长室,并设置湿度水平保持至少80%或更高,这被发现是在高于32°C的温度下保持生长的必要条件。利用这些室内盆栽植物测定叶膜脂肪酸组成和荧光产量特性。在含有1%蔗糖和0.7%琼脂的Murashige和Skoog盐培养基(Sigma)中萌发和生长,测定幼苗的生长速率。将表面灭菌的种子镀片,在4℃下处理2 - 3天以同步发芽,然后在16℃的生长室中生长16 d,然后转移到高温。光强在60 μmol m时保持不变-2年代-1.4株幼苗在转入高温后的第0、2、4和6天取样,在70℃下干燥2 d后称重。相对增长率(ω-1),取幼苗干重自然对数随时间的斜率(以天为单位)。在22.5°C和30°C下生长的幼苗分别进行了3次生长速率测定,以获得SE,在28°C和34°C下生长速率测定一次。
本研究使用的拟南芥突变系见表1.所有这些都是哥伦比亚生态型的后代。的act1 fad6通过首次杂交获得双突变系act1到fad6然后将杂交子代从由此产生的杂合子中带回fad6在选择具有表明两种纯合突变的脂肪酸组成的品系之前。的act1++系,是含有编码甘油-3-磷酸酰基转移酶(GPAT)基因的转基因系(Schneider and Somerville,未发表,[60])在双35S花菜花叶病毒启动子的控制下。它被作为叶绿素荧光研究的额外对照,具有与野生型几乎相同的膜脂肪酸组成,除了非常轻微的升高16:3 (~1.5 mol%,比野生型在17°C下的百分比)。
脂肪酸分析
每次测定,至少使用两种植物作为提取和分析叶片材料的来源。从每株植株上取下三片中间至完全展开(2至5厘米长)的莲座叶,取下约三分之一的叶子,立即在-80°C的特氟龙盖管中保存,直到需要时再取出。采用既定程序从这些叶子制备甲酯,并对所得提取物进行气相色谱分析[61]使用惠普5800系列气相色谱仪,配以Supelco SP2330玻璃毛细管柱(0.75毫米× 20米)。根据气相色谱数据的摩尔%值计算膜总不饱和水平(双键指数),根据公式:[Σ(摩尔%脂肪酸含量× no。双键)]/100如Skoczowski等人所描述的。[62].
荧光测量
叶绿素荧光测量使用光学科学OS500-FL脉冲调制荧光计(光学科学,Inc.)Tyingsboro MA)。采用自定义设计的铝加热块放置拟南芥莲座叶、相关光缆和温度探针,进行叶片叶绿素激发和荧光测量。将一个拟南芥叶片(约2.4 cm长)安装到加热块的凹陷(约0.5 mm)部分,以防止叶片部分的损伤。乙二醇溶液在块内循环以控制温度。该块和夹具模块还提供了一个可调节的夹具,在测量期间稳定地保持盆栽植物的叶子。
通过测定荧光量子产率(TP)的转变点温度,评价了不同品系的光合热稳定性。将附着的莲座叶放入热控制加热块中,每90秒用饱和光脉冲(0.8 s持续时间)监测荧光。在29°C(4-5次脉冲)稳定后,加热块的温度以0.75°C的速度增加-1使用数字温度控制单元(Omega Technologies Co. Stamford, CT)将最终温度控制在48.5°C。用与叶片表面接触的热电偶测量叶片温度。用方程F’计算量子产率。女士- f年代/ F '女士根据Genty [63), F年代为环境条件下的稳态荧光,F’女士是饱和光脉冲后获得的最大荧光产率。F米- fo/ F米,它是光系统II光化学效率的测量,是基于可变荧光(F米- fo),为最小值(Fo)和最大值(F米)在饱和光脉冲前后的暗适应叶的荧光。所有的测定都是在初始值为F的树叶样品上进行的米- fo/ F米比至少0.80,在启动温度升高之前。采取这一措施是为了确保引入夹具模块的叶片部分的完整性是健全的,并验证叶片正确地安装到测量模块中。0.83的均值比率表明,在未受胁迫的叶片中,光合器官功能良好,这在许多其他植物物种中已得到证明[64].
参考文献
- 1.
Heckathorn SA, Downs CA, Sharkey TD, Coleman JS:小的,富含蛋氨酸的叶绿体热休克蛋白在热应激时保护光系统II的电子传输。植物生理学报,1998,16(4):439-444。10.1104 / pp.116.1.439。
- 2.
Lee JH, Hubel A, Schoffl F:转基因拟南芥热休克因子活性的抑制导致热休克蛋白的本构合成和耐热性的提高。植物学报,2003,22(4):366 - 366。10.1046 / j.1365 - 313 x.1995.8040603.x。
- 3.
Lee JH, Schoffl F: Hsp70反义基因在转基因中影响Hsp70 /HSC70的表达、HSF的调控和耐热性的获得拟南芥.中国生物医学工程学报,2004,22(2):326 - 326。10.1007 / s004389670002。
- 4.
Prandl R, Hinderhofer K, Eggers-Schumacher G, Schoffl F:一种新的热休克因子HSF3拟南芥,在转基因植物中过表达时,会抑制热冲击反应并赋予耐热性。中国生物医学工程学报,2004,25(3):369 - 371。10.1007 / s004380050731。
- 5.
热休克蛋白在植物中的作用。植物生理学报,1998,27(4):369 - 371。10.1146 / annurev.pp.42.060191.003051。
- 6.
成D-Y, Kaplan F, Lee K-J, Guy CL:后天对极端温度的耐受性。植物生态学报,2003,23(4):447 - 447。10.1016 / s1360 - 1385(03) 00047 - 5。
- 7.
高等植物叶绿体叶黄素循环过程中类囊体膜的流动性和热稳定性。生物化学与生物物理学报,1997,30(2):179-193。10.1016 / s0005 - 2736(97) 00168 - 5。
- 8.
Niyogi K:重新审视光保护:基因和分子方法。植物生理学报,1999,30(5):359 -359。10.1146 / annurev.arplant.50.1.333。
- 9.
Niyogi KK, Grossman AR, Björkman O:拟南芥突变体定义了叶黄素循环在调节光合能量转换中的中心作用。植物生态学报,1998,10(7):1121-1134。10.1105 / tpc.10.7.1121。
- 10.
杨志刚,Björkman O:高等植物光合响应及其对温度的适应。植物工程学报,1998,28(4):391 - 394。10.1146 / annurev.pp.31.060180.002423。
- 11.
王晓峰,王晓峰,王晓峰,Björkman O:荒漠灌木光合作用对温度的适应Larrea衣属鸦葱.植物生理学报,1998,29(4):433 - 436。
- 12.
Pearcy RW, Berry JA, Fork DC:生长温度对其光合器官热稳定性的影响滨藜属lentiformis(托)。寺庙。植物学报,2004,27(3):366 - 366。
- 13.
水梨RW:生长温度对水梨叶脂脂肪酸组成的影响滨藜属lentiformis(托)。寺庙。植物生理学报,1998,28(4):488 -486。
- 14.
Harwood JL, Jones AL, Perry HJ, Rutter AJ, Smith KM, Williams M:植物脂质在温度适应过程中的变化。In:生物膜的温度适应性。编辑:Cossins AR. 1994,伦敦:波特兰出版社,107-117。
- 15.
Williams J, Khan M, Mitchell K, Johnson G:温度对双酰基甘油中不饱和脂肪酸水平和生物合成的影响芸苔属植物显著叶子。植物生理学报,1998,27(4):381 - 381。
- 16.
阿罗·EM,麦卡弗里S,安德森·JM:豌豆光抑制的恢复(Pisum一L.)适应不同生长辐照度。植物生理学报,2004,25(3):366 - 366。
- 17.
Aro EM, Virgin I, Andersson B:光系统II的光抑制。失活,蛋白质损伤和周转。生物化学学报,1993,21(2):369 - 369。10.1016 / 0005 - 2728(93) 90134 - 2。
- 18.
Los D, Horvath I, Vigh L, Murata N:脱饱和酶基因的温度依赖性表达desA在集胞藻属PCC6803。中国生物医学工程学报,2003,31(1):369 - 371。10.1016 / 0014 - 5793 (93) 81327 - v。
- 19.
Vigh L, Los DA, Horvath I, Murata N:温度生物感知中的主要信号:pd催化膜脂的氢化作用刺激了膜脂中desA基因的表达集胞藻属PCC6803。中国科学:地球科学,1998,19(3):369 - 369。
- 20.
Horvath I, Glatz A, Varvasovszki V, Torok Z, Pali T, Balogh G, Kovacs E, Nadasdi L, Benko S, Joo F,等:膜物理状态控制聚囊藻PCC 6803热休克反应的信号机制:hsp17作为“流动性基因”的鉴定。中国科学:地球科学,1998,21(3):369 - 369。10.1073 / pnas.95.7.3513。
- 21.
Iba K, Gibson S, Nishiuchi T, Fuse T, Nishimura M, Arondel V, huly S, Somerville C:一个编码叶绿体-3脂肪酸去饱和酶的基因补充了脂肪酸去饱和和叶绿体拷贝数的改变fad7突变体的拟南芥.中国生物医学工程学报,2003,23(3):369 - 369。
- 22.
Heppard EP, Kinney AJ, Stecca KL, Miao GH:两个不同微粒体-6去饱和酶基因对大豆发育和生长温度的调控。植物生理学报,2003,21(1):1- 6。10.1104 / pp.110.1.311。
- 23.
奥库利J,莱特纳J,费尔德曼K,亚达夫N,云雀E, Browse J:拟南芥FAD2基因编码的酶是合成多不饱和脂的必要条件。植物学报,1998,6(1):147-158。10.1105 / tpc.6.1.147。
- 24.
法尔科内DL,吉布森S,莱米厄B,萨默维尔C:一种互补基因的鉴定拟南芥叶绿体-6去饱和酶活性缺乏的突变体。植物生理学报,2004,25(4):369 - 369。10.1104 / pp.106.4.1453。
- 25.
Gibson S, Arondel V, Iba K, Somerville C:编码叶绿体-3去饱和酶的温度调节基因的克隆拟南芥.植物生理学报,2004,24(4):366 - 366。10.1104 / pp.106.4.1615。
- 26.
Berberich T、Harada M、Sugawara K、Kodama H、Iba K、Kusano T:两个编码omega-3脂肪酸去饱和酶的玉米基因及其对温度的差异表达植物生物学杂志,2003,31(2):369 - 369。10.1023 /: 1005993408270。
- 27.
浏览J, Warwick N, Somerville CR, Slack CR:“16:3”植物中脂质合成的原核和真核途径通量拟南芥.中国生物医学工程学报,2003,21(1):1 - 6。
- 28.
huly S, Somerville C:膜脂多不饱和在低温叶绿体生物发生中的作用。植物生理学报,2003,21(1):1 - 4。
- 29.
Kunst L, Browse J, Somerville C:棕榈酸不饱和缺陷拟南芥突变体的热耐受性增强。植物生理学报,2004,24(1):381 - 381。
- 30.
王晓燕,王晓燕,王晓燕,等。脂质不饱和度降低对番茄叶绿体超微结构和光合作用的影响拟南芥.植物生理学报,2003,24(2):356 - 356。
- 31.
村上杨,高山M,小林杨,田玉H,伊巴K:三烯脂肪酸与植物的高温耐受性。科学通报,2000,29(4):476- 476。10.1126 / science.287.5452.476。
- 32.
Kunst L, Browse J, Somerville C:一种拟南芥叶脂中棕榈酸饱和不足。植物生理学报,2003,21(3):347 - 347。
- 33.
浏览J, Kunst L, Anderson S, huly S, Somerville C: A mutant of拟南芥叶绿体16:1/18:1去饱和酶缺乏。植物生理学报,2004,25(2):529 -529。
- 34.
李文华,李文华,李文华,等。一种突变体脂质生物合成调控的改变拟南芥叶绿体缺乏甘油-3-磷酸酰基转移酶活性。中国地质大学学报(自然科学版),1998,25(4):369 - 369。
- 35.
McConn M, huly S, Browse J, Somerville C: Fad8位点的突变拟南芥识别第二叶绿体-3去饱和酶。植物生理学报,2004,24(4):369 - 369。
- 36.
huly S, Kunst L, Browse J, Somerville C:一个脂质减饱和缺陷拟南芥突变体光合热耐受性增强和叶绿体超微结构改变。植物生理学报,2003,21(3):369 - 369。
- 37.
张晓燕,张晓燕,张晓燕:拟南芥脂质脂肪酸失饱和突变体类囊体膜结构特征。生物化学学报,1994,(2):263-271。10.1016 / 0005 - 2736(94) 90127 - 9。
- 38.
脂质生物合成。植物生态学报,2004,24(6):673 - 673。10.1105 / tpc.7.7.957。
- 39.
萨默维尔C, Browse J:解剖去饱和:植物证明是有利的。细胞生物学进展,1996,6(4):148-153。10.1016 / 0962 - 8924(96) 10002 - 7。
- 40.
L, Browse J, Somerville C:一株拟南芥质体甘油-3-磷酸酰基转移酶活性缺乏突变体叶绿体结构和功能的改变。植物生理学报,2003,21(3):366 - 366。
- 41.
Cheesebrough T:在大豆种子适应变化的生长温度过程中,脂肪酸合成和去饱和酶的变化。植物生理学报,1998,19(4):366 - 366。
- 42.
Moon BY, Higashi S, Gombos Z, Murata N:转基因烟草植株叶绿体膜脂不饱和稳定光合机制以对抗低温光抑制。中国生物医学工程学报,2003,22(4):366 - 366。
- 43.
Alfonso M, Yruela I, Almarcegui S, Torrado E, Perez MA, Picorel R:一株新的抗除草剂D1突变体对高温的异常耐受大豆(l)稳定。缺乏脂肪酸的细胞培养物去饱和。植物学报,2001,29(4):359 - 359。10.1007 / s004250000421。
- 44.
Sarcina M, Tobin MJ, Mullineaux CW:藻胆体在蓝藻聚球菌7942类囊体膜上的扩散。藻胆体大小、温度和膜脂组成的影响。中国生物医学工程学报,2001,26(5):369 - 369。10.1074 / jbc.M107111200。
- 45.
Szalontai B, Nishiyama Y, Gombos Z, Murata N:用傅立叶变换红外光谱观察聚囊藻PCC 6803的膜动力学。脂质不饱和及蛋白脂比的影响。生物化学学报,2000,(1-2):409-419。
- 46.
邵隆泰B, Kota Z,野中H, Murata N:烟草类囊体膜磷脂酰甘油脂肪酸基因工程饱和的结构后果。红外光谱研究。生物化学,2003,42(14):4292-4299。10.1021 / bi026894c。
- 47.
Hartel H, Lokstein H, Dormann P, Grimm B, Benning C:半乳糖缺乏植物光合器官组成的变化dgd1突变体的拟南芥.植物生理学报,2004,25(3):366 - 366。10.1104 / pp.115.3.1175。
- 48.
Hazel JR, Williams EE:膜脂组成的改变在使生物适应其物理环境中的作用。脂质学报,1990,29(3):167-227。10.1016 / 0163 - 7827(90) 90002 - 3。
- 49.
Hong SW, Vierling E:变种人拟南芥对高温应力的耐受性有缺陷。中国生物医学工程学报,2000,29(4):359 - 359。10.1073 / pnas.97.8.4392。
- 50.
Queitsch C, Hong SW, Vierling E, Lindquist S:热休克蛋白101在拟南芥的耐热性中起关键作用。植物生态学报,2000,12(4):479-492。10.1105 / tpc.12.4.479。
- 51.
Dat JF, Lopez-Delgado H, Foyer CH, Scott IM: H的平行变化2O2过氧化氢酶在水杨酸或热驯化诱导的芥菜幼苗耐热性中的表达。植物生理学报,2004,24(4):369 - 369。10.1104 / pp.116.4.1351。
- 52.
Panchuk I, Volkov RA, Schoffl F:拟南芥热应激和热休克转录因子依赖性抗坏血酸过氧化物酶的表达和活性。植物生理学报,2004,24(3):378 - 378。10.1104 / pp.001362。
- 53.
史文敏,村本勇,上田一,高部等:大麦过氧化物酶体抗坏血酸过氧化物酶基因的克隆及过表达对耐热性的增强拟南芥.中国生物医学工程学报,2001,29(1):369 - 371。10.1016 / s0378 - 1119(01) 00566 - 2。
- 54.
张丽娟,张丽娟,张丽娟,张丽娟拟南芥以高温为条件通过基因工程合成甘氨酸甜菜碱。植物学报,1998,16(2):155-161。10.1046 / j.1365 - 313 x.1998.00284.x。
- 55.
鲁塔布尔JM,费舍尔SF, Browse J:在低温下,三烯酸是维持叶绿体功能所必需的。植物生理学报,2004,24(4):397 - 397。10.1104 / pp.124.4.1697。
- 56.
J:缺乏三烯脂肪酸拟南芥突变体增加了光合作用对高温的耐受性。见:植物脂类的生理学、生物化学和分子生物学。编辑:Williams JP, Khan MB, Lem NW。1997, Dordrecht: Kluwer学术出版社,200-202。
- 57.
McConn M, Browse J:对亚麻酸的关键要求是花粉发育,而不是光合作用拟南芥突变体。植物科学学报,1998,8(3):403-416。10.1105 / tpc.8.3.403。
- 58.
比奈利G,马斯卡伦哈斯JP:拟南芥:生长对高温的敏感性。林志军,1990,11:294-298。
- 59.
梅克海多夫,德·拉尔杜雅·欧罗格:植物基因组功能目录的建立。脂质生物合成基因综述。植物生理学报,2004,22(2):369 - 369。10.1104 / pp.122.2.389。
- 60.
西田I,田坂Y,白石H,村田N:甘油三酯酰基转移酶质体定位前体的基因和RNA拟南芥.植物生物学杂志,1998,21(2):267-277。
- 61.
Browse J, McCourt PJ, Somerville CR:联合消化后叶脂的脂肪酸组成和新鲜组织脂肪酸甲酯的形成。生物化学学报,1998,26(1):1- 4。
- 62.
Skoczowski A, Filek M, Dubert F:长期低温对冬小麦幼苗代谢的影响。2脂肪酸和磷脂的组成。中华热生物学杂志,1994,19(3):171-176。10.1016 / 0306 - 4565(94) 90028 - 0。
- 63.
王晓燕,王晓燕,王晓燕:叶绿素荧光猝灭与光合电子输运量子产率的关系。生物化学学报,1989,990(1):87-92。
- 64.
Björkman O, Demmig B: O的光子产率2不同来源维管植物在77-K下的进化和叶绿素荧光特性。植物学报,1998,17(4):469 - 471。
确认
我们非常感谢Olle Björkman在设置和进行与温度相关的荧光计测量方面提供的帮助和建议。我们也感谢Bonnie Kinney和Peggy Rice在确定增长率方面的帮助,感谢肯塔基烟草研究委员会提供的资源和一位匿名审稿人对手稿提出的有用建议。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
DF进行了脂肪酸分析、光合作用测量、数据分析并起草了手稿。JO负责制作act1过表达系,并协助构建双突变系。CS构想了这项研究。所有作者阅读并批准了最终稿件。
权利和权限
关于这篇文章
引用这篇文章
法尔科内,d.l., Ogas, J.P. &萨默维尔,c.r。温度对拟南芥突变体膜脂肪酸组成的调节与膜脂组成的改变。BMC植物杂志4,17(2004)。https://doi.org/10.1186/1471-2229-4-17
收到了:
接受:
发表:
关键字
- 膜ipids
- 耐热性
- 脂肪酸desaturase
- glycerolipid通路
- PSⅱ荧光