摘要
背景
异戊烯基二磷酸(IPP),常见的生物合成前体对哈达丹磷酸乳蛋白的乳蛋白,通过非甲戊二醇盐途径生物合成。天竺葵二磷酸二磷酸(GGPP)合成酶是Terpenoid生物合成中的重要分支点酶。因此,GGPP合酶被认为是Forskolin生物合成中的关键酶。在此,我们报告了第一次确认GGPP合成酶基因锦紫苏forskohliiBriq。
结果
开放式阅读框架为全长GGPP合成酶编码359个氨基酸的蛋白质,其中1,077个核苷酸长,计算分子量为39.3kDa。对齐C. forskohlii GGPP合酶氨基酸序列显示出与其他植物的高同源性GGPP合成酶.鉴定了几个高度保守的地区,包括两个富含天冬氨酸的基序。n末端区域的瞬态表达C. forskohlii.烟草细胞中GGPP合酶- gfp融合蛋白在叶绿体中表现出亚细胞定位。观察到类胡萝卜素产生大肠杆菌徘徊Paccar25Δ.crtE从欧文氏菌uredovora和质粒C. forskohlii GGPP合酶.这些结果表明cDNA编码功能性GGPP合酶。此外,C. forskohlii GGPP合酶表达在叶中强烈,茎中的茎减少,在根中观察到的表达很少。
结论
本研究提出forskolin是通过非甲戊酸途径合成的。GGPP合成酶被认为参与forskolin的生物合成,forskolin主要在叶中合成,随后在茎和根中积累。
背景
Forskolin,Labdane二萜是从肿块根中分离的主要活性化合物锦紫苏forskohliiBriq。(唇形科)1].C. forskohlii.已被用作印度的重要民间医学。Futher,已发现Forskolin是腺苷酸环酶的有效活化剂[2,导致c-AMP水平升高,从而影响心脏活动、血压和眼压。最近,福斯柯林已在日本作为一种治疗心脏病的药物上市。由于Forskolin结构复杂,不能通过化学合成。然而,有两组报道了forskolin完全合成的成功[3.那4.].
类异戊二烯是所有生物正常生长和发育过程所必需的。Isopentenyl二磷酸(IPP;C5.)是所有类异戊二烯的共同代谢前体。最近,一些研究小组证实了植物中IPP的合成有两种不同的途径。甲戊酸(MVA)途径发生在细胞质中,另一种不依赖甲戊酸的途径(2c -甲基- d -赤藓糖醇4-磷酸;MEP)途径发生于质体[5.-7.].
天竺葵二磷酸二磷酸(GGPP)合成酶催化烯丙基二磷酸的连续缩合用三个分子的IPP,以产生GGPP,是二萜的生物合成的基本线性前体,类胡萝卜素,类视黄糖和叶绿素的侧链[8.].GGPP合成酶是萜类生物合成中重要的支点戊基转移酶。
GGPP合成酶基因已在许多生物体中克隆,包括;拟南芥[9.那10.],水松黄花[11.],向日葵[12.],Scoparia dulcis和巴豆sublyratus[13.],硫化叶菌acidocaldarius[14.],粗糙脉孢菌[15.],老鼠和人[16.].氨基酸序列比较显示,GGPP合酶包含多个保守氨基酸残基域,包括第一个富天冬氨酸基序(FARM)和第二个富天冬氨酸基序(SARM) [17.].此外,最近的研究表明,序列中FARM前4位和5位的两个氨基酸,以及植物GGPP合酶FARM中插入的一个氨基酸,在产品长度的确定中起重要作用[13.那18.].
类胡萝卜素产生于GGPP的两个分子的偶联。类胡萝卜素生物合成基因簇(CRT.的基因)欧文氏菌uredovora被阐明了[19.,目前被用于研究类胡萝卜素相关基因在异种系统中的功能。这CRT.基因簇由6个基因组成;crtB(植物合酶),crtE(GGPP合成酶)crtI(植物去饱和酶),crtX(玉米黄质β葡糖苷酶),crtY(番茄红素环化酶)和crtZ(β-胡萝卜素羟化酶)。因此,使用类胡萝卜素使用大肠杆菌隐匿的CRT.基因簇可用于GGPP合酶活性的测定。
GGPP合成酶被认为是forskolin生物合成的关键酶。在此,我们报道了cDNA编码C. forskohlii.GGPP合成酶及其异源表达大肠杆菌.
结果与讨论
cDNA的克隆和测序C. forskohlii GGPP合酶基因
全长的开放阅读框架(ORF)GGPP合成酶基因编码蛋白质359个氨基酸,1077个核苷酸长,计算分子量为39.3 kDa。氨基酸序列c . forkohliiGGPP合酶在整个编码区均表现出高度同源性Catharanthus Roseus.(75%),拟南芥(73%),Sinapis阿尔巴(72%),巴豆sublyratus(69%),Scoparia dulcis(67%)和、(64%)(图。1).然而,与原核GGPP合成酶的氨基酸序列的比较显示出低的同源水平(30-53%)。高度保守的残留物被指定为Domains I-VII。鉴定了两个保守的天冬氨酸富含族的图案,DDXX(x)d。农场和SARM已被证明在底物结合和催化中是重要的[20.-22.].
的推定定位信号的瞬态表达式C. forskohlii.烟草细胞中的GGPP合酶
植物GGPP合酶序列比对显示,其n端同源性较低。我们有理由假设这些GGPP合酶在其n端有定位信号,将其定位到特定的亚细胞区室。的n端区域C. forskohlii.通过ChloroP 1.1 Prediction Server预测GGPP合酶在叶绿体中定位。在努力确定本地化C. forskohlii.GGPP合酶,该序列编码的80个氨基酸序列在n端C. forskohlii.将GGPP合酶融合到GFP报告基因的N-末端,并转化为2烟细胞。推定定位信号的模式C. forskohlii.GGPP合酶与阳性叶绿体靶向信号[35SΩ-pt-sGFP(S65T)]相同(图。2).的n端区域C. forskohlii.GGPP合酶含有叶绿体定位信号。最近,植物GGPP合酶已被确定易位到质体、线粒体和细胞质中[9.那23.].
异源表达及活性C. forskohlii.GGPP合成酶
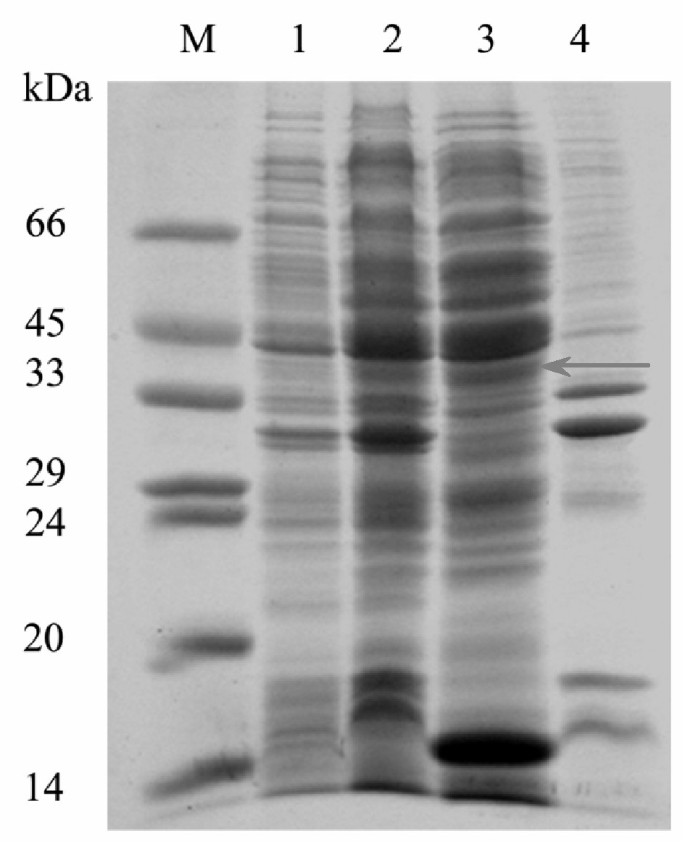
为了表达C. forskohlii GGPP合酶,构建并克隆到质粒pBluescript II KS中-.GGPP合酶与lacZ的计算分子量为41.6 kDa,在大肠杆菌IPTG诱导后携带PGGPPS(图。3.).
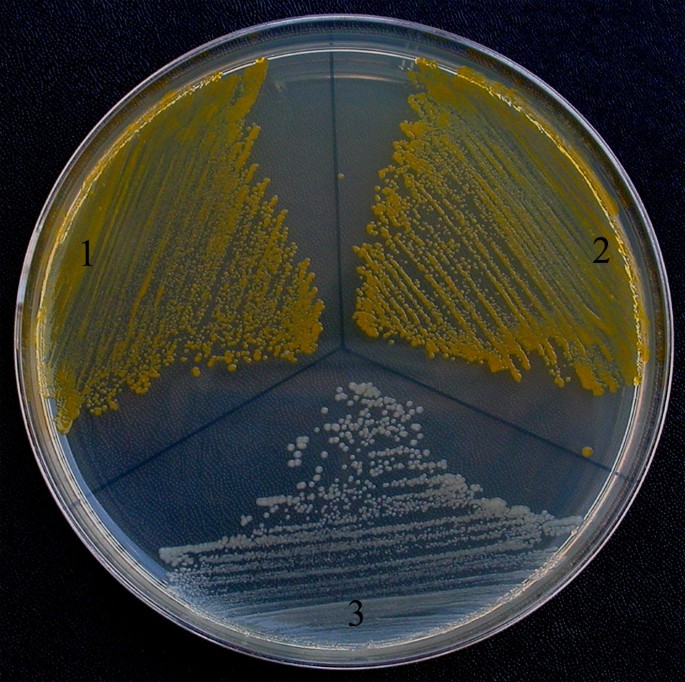
通过与泌尿病生成的遗传互补研究表达的GGPP合酶的功能活性CRT.基因簇。类胡萝卜素是在大肠杆菌窝藏一CRT.群集基因来自大肠uredovora.替换A.CRT.具有相同活性的未知基因的基因,可用于确定该基因的功能[15.].在此,C. forskohlii GGPP合酶基因克隆到pBluescript II KS中-矢量(PGGPPS)以生产alacZ融合蛋白。pGGPPS随后被转化为大肠杆菌DH10B携带质粒PACCAR25ΔcrtE在这一crtE编码GGPP合成酶的基因被删除。在转化体中观察到类胡萝卜素呈黄色,表明pGGPPS携带了取代黄酮功能的基因crtE基因(图。4.).比较了转化子的类胡萝卜素产量大肠杆菌携带转化质粒pACCAR25ΔcrtE和pBAA编码小鼠GGPP合成酶(阳性对照)[16.],携带转化质粒pACCAR25ΔcrtE和一个pBluescript II KS-(pBS)载体(阴性对照)。这一结果表明,cDNA的编码区C. forskohlii GGPP合酶编码有功能的GGPP合酶。
的表达GGPP合成酶器官基因C. forskohlii.
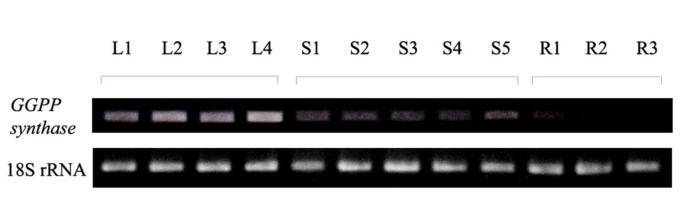
的表达GGPP合成酶RT-PCR法在不同器官中检测C. forskohlii..分析了八十个月植物的根,茎和叶子中提取的总RNA。这C. forskohlii GGPP合酶基因在叶片中强烈表达,而表达在茎中降低并在根中几乎表达(图。5.).因此,叶被认为是forskolin合成的主要位置。我们以前报道过在无性繁殖的植物器官中forskolin的浓度C. forskohlii.[24.].茎根和茎碱被测定含有比器官更高浓度的斯科啉。此外,分别分别分析茎底,表皮和皮质,血管束和髓质的部分。在血管束组织中鉴定出最高浓度的孢子蛋白。从这些数据中,我们提出了参与雌激素的生物合成的GGPP合酶主要在叶片中合成,随后分布于茎,最终累积在茎碱基和根中。
通过非甲戊酸途径产生Forskolin
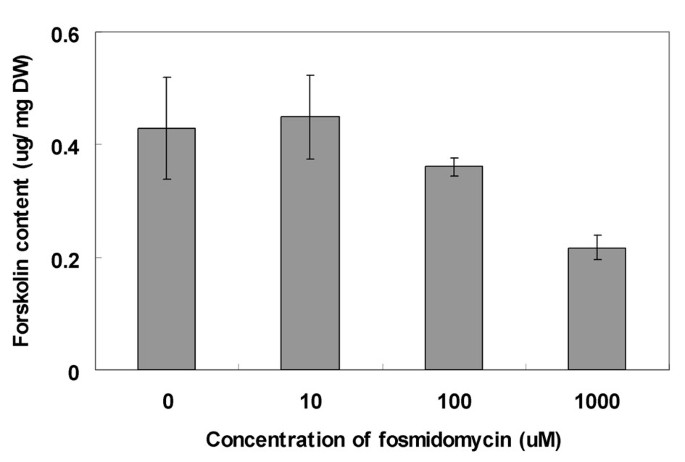
努力通过非甲戊酰型途径研究FORSKOLIN生物合成途径,将各种浓度的FOSMIDOMCIN,非甲醛途径中的1-脱氧-D-木糖-5-磷酸盐还原酶(DXR)酶的特异性抑制剂进行施用这C. forskohlii.测定根的forskolin含量(图。6.).治疗导致了苏克林的减少,而10μmFosmidomcin对Forskolin生产没有影响。在较高浓度下,观察到剂量依赖性抑制效果。在1000μmfosmidomycin,与无抑制剂治疗的对照组织相比,克洛林含量高达50%。因此,认为被认为是通过非甲戊二醇酯途径合成的。
最近13.c -葡萄糖饲养实验使用13.C-NMR分析方法提示forskolin的生物合成途径为非甲戊酸途径[25.].另外,从非甲戊酸途径第一步特异性酶中克隆到DXR基因C. forskohlii.[26.].
结论
C. forskohlii.克隆了GGPP合成酶并确定了其亚细胞定位。n端含有一个定位于叶绿体的信号。通过与胡萝卜素基因的遗传互补研究GGPP合酶的功能表达CRT.基因簇。类胡萝卜素是在crtE基因被替换为C. forskohlii.GGPP合成酶。GGPP合成酶被认为参与forskolin的生物合成,forskolin最初在叶片中合成,随后分布到茎中,最终在茎基部和根中积累。
方法
植物材料和试剂
C. forskohlii.植株在无激素MS (Murashige和Skoog)培养基中培养,25°C, 16小时光照周期。光照强度为3000勒克斯,相对湿度为60%。采用茎尖培养法繁殖的茎条(长10 mm)在蛭石中依次培养。BY-2烟草单细胞悬浮液[27.在补充有0.2 mg L的液体改性LS(Leinsmaier和Skoog)培养基中培养-12,4-d(2,4-二氯音氧乙酸)在25°C的黑暗条件下在轨道培养箱中。限制性内切酶、连接酶、pcr -聚合酶购自日本东京Takara Shuzo株式会社和日本东京Toyobo株式会社。Fosmidomycin (FR-3154)购自美国俄勒冈州Molecular Probes公司。化学试剂购自Sigma化学公司(圣路易斯,美国)和Nacalai Tesque公司(东京,日本)
菌株和质粒
大肠杆菌TOP10F”和大肠杆菌DH10B携带质粒PACCAR25ΔcrtE被用于本次调查中。利用pUC119载体进行cDNA克隆和测序。pBluescript II KS-矢量被用作GGPP合成酶表达质粒。35SΩ-sGFP(S65T)质粒作为绿色荧光蛋白(GFP)报告质粒。pBI121植物病媒和农杆菌肿瘤术LBA4404用于将GFP和GFP融合基因转化为植物细胞。
cDNA的克隆和测序C. forskohlii GGPP合酶基因
总RNA从根中提取C. forskohlii.用酸胍-苯酚-氯仿萃取法培养[28.].以oligo-dT适配引物、M-MLV逆转录酶和总RNA为模板,合成单链cDNA。简并引物基于之前克隆的植物GGPP合酶基因高度保守的氨基酸序列设计[13.].用Taq DNA聚合酶和简并引物A、B、C、D套式PCR扩增出470 bp的cDNA片段(见表)1).使用基因特异性引物I和J的CDNA末端(RACE)快速扩增CDNA的3'结束,并通过嵌套的PCR获得522bp产物。对于5'族,通过末端脱氧核苷酸转移酶在其5'末端在其5'端中聚酰基化。用特定引物G和H和H和FA和F进行第一和第二PCR,得到285bp产物。通过嵌套的PCR使用特定引物K,L,M和N扩增1,077bp的整个编码区域,由5'和3'赛产品设计。
所有扩增的cDNA片段经PCR引物纯化后,在引物引入的位点用限制性内切酶酶切,克隆到载体pUC119中。转换后大肠杆菌TOP10F',使用BIGDYE终结器周期测序试剂盒使用型号310遗传分析仪(PE生物系统)测序疏松插入物的克隆。
将从核苷酸序列推导的氨基酸序列与使用FASTA程序的基因组网www服务器中的序列数据库进行比较。使用基因组群集服务器中的Clustalw多序列对准进行多种氨基酸序列对准。
的推定定位信号的构造和表示C. forskohlii.GGPP合成酶
n端240 bp片段C. forskohlii GGPP合酶引物P和Q进行PCR扩增,PCR产物经酶切克隆到萨尔我- - - - - -以区域35SΩ-sGFP(S65T)质粒的I位点。35SΩ-pt-sGFP(S65T)为叶绿体靶向阳性对照[29.那30.].GFP,GGPP合成酶- gfp融合和pt-GFP融合,CaMV35SΩ启动子和NOS3终止子[35SΩ-sGFP (S65T), 35SΩ-GGPP合成酶-sGFP (S65T)和35SΩ-pt-sGFP (S65T)分别亚克隆到后III-EcoR我的PBI121向量网站然后转换为农LBA4404。将转化体在28℃下在含有25μg/ ml卡那霉素和25μg/ ml利福平的利福平的YEB液体培养基中培养两天。将转化体洗涤两次并重新悬浮在YEB培养基中。农杆菌属转化株(108.将细胞)施加至四毫升五天含量的止常悬浮培养培养物。将培养物在28℃下在暗条件下孵育两天。使用尼康Eclipse TE2000-U模型通过荧光显微镜分析GFP和GFP融合蛋白。在400倍放大率下观察细胞。
质粒的构建C. forskohlii.GGPP合成酶表达
的cDNA的编码区C. forskohlii GGPP合酶通过PCR使用特异性引物M和O扩增PCR。消化了PCR产物;纯化并克隆到Kpn一世-Sal.我网站的pBluescript II KS-矢量,即pggpps。将该质粒转化为大肠杆菌XL1-Blue MRF'为过表达。转化菌在含有50 μg/ml氨苄青霉素和25 μg/ml氯霉素的LB液体培养基中培养。用1 mM异丙基-1-硫代-β- d -半乳糖(IPTG)诱导培养,37℃培养6小时。收集细胞,用50 mM Tris-HCl pH 8.0离心洗涤。将颗粒重新悬浮,加入溶菌酶,孵育30分钟。然后将混合物以一分钟为间隔超声4次,每次15秒。在10000 × g离心10分钟后得到可溶部分。进行SDS-PAGE以检测蛋白[31.].
遗传互补表达
的pACCAR25ΔcrtE质粒包含基因簇crtB那crtI那crtX那crtY和crtZ编码类胡萝卜素生物合成酶,除crtE(编码GGPP合成酶)。质粒pBAA含有小鼠GGPP合成酶(阳性对照质粒)和大肠杆菌DH10B携带质粒PACCAR25ΔcrtE由日本Shimane大学M. Kawamukai博士提供[16.].pBluescript II KS-载体pBS作为阴性对照。pGGPPS、pBAA和pBS转化为大肠杆菌DH10B携带质粒PACCAR25ΔcrtE.将转化子均置于含有50 μg/ml氨苄青霉素和25 μg/ml氯霉素的LB琼脂培养基上,在25℃下孵育2 ~ 3天。
反向transcriptase-PCR (rt - pcr)
一个八个月的孩子C. forskohlii.分十二部分进行分析;叶(L1-L4),茎(S1-S5)和根(R1-R3)。数量是根据器官的成熟程度而定的。从植株各部位提取总RNA。以1微克总RNA为模板,合成第一链cDNA(采用SuperScript first - strand synthesis System for RT-PCR, Invitrogen)。利用引物M、O、cDNA第一链和kod -聚合酶进行扩增C. forskohlii GGPP合酶在变性条件下,98°C, 15秒;退火,60°C, 2秒,拉伸,74°C, 5秒。作为内对照的18S rRNA片段,在相同条件下用引物R和S进行扩增C. forskohlii GGPP合酶放大。扩增产物经1.0%琼脂糖凝胶电泳分析。
forskolin生产分析
C. forskohlii.用不同浓度的fosmidomycin处理植株,然后用HPLC法研究forskolin的含量,如前所述[26.].通过与202nm紫外吸收法检测的Forskolin标准品(Sigma)的保留时间进行比较,检测Forskolin。
缩写
- CRT.:
-
雌激素基因
- 农场:
-
第一个aspartate-rich主题
- 绿色荧光蛋白:
-
绿色荧光蛋白
- GGPP:
-
geranylgeranyl二磷酸
- 议员:
-
2 c-methyl-d-erythritol 4-phosphate
- MVA:
-
甲羟戊酸
- 指控:
-
富有的富含富含股票的主题
参考文献
- 1。
王志刚,王志刚,王志刚,等:一种新型二萜化合物的结构和立体化学性质锦紫苏forskohliiBriq。四面体结构,1977,18:1669-167210.1016 / s0040 - 4039(01) 93245 - 9。
- 2。
Metzger H,Lindner E:正面滴体氏氏硅胶,一种有效的腺苷酶活剂。药物res。1981,31:1248-1250。
- 3。
Ziegler FE, Jaynes BH, Saindane MT: forskolin的合成路线。化学学报。1987,39(4):497 - 503。10.1021 / ja00260a044。
- 4。
(+/-)-forskolin的全合成。化学学报。1988,32(4):497 - 503。10.1021 / ja00219a059。
- 5.
艾森赖希,施瓦z M, Cartayrade A, Arigoni D, Zenk MH, Bacher A:植物和微生物中萜类生物合成的脱氧木糖磷酸途径。化学学报。1998,5:R221-R233。10.1016 / s1074 - 5521(98) 90002 - 3。
- 6.
Rohmer M, Knani M, Simonin P, Sutter B, Sahm H:细菌中类异戊二烯的生物合成:导致二磷酸异戊二烯的早期步骤的新途径。生物化学学报,1993,32(4):517-524。
- 7.
Rohmer M, Seemann M, Horbach S, Bringer-Meyer S, Sahm K:甘油醛3-磷酸和丙酮酸作为异戊二烯单元的前体在一个替代的非甲戊酸途径中的萜类生物合成。化学学报。1996,18:2564-2566。10.1021 / ja9538344。
- 8.
Wang K, Ohnuma S:异戊二烯二磷酸合成酶的链长度测定机制及其分子进化意义。生物化学学报。1999,24:445-451。10.1016 / s0968 - 0004(99) 01464 - 4。
- 9.
冈田K, Saito T, Nakagawa T, Kawamukai M, Kamiya Y:表达于不同器官的香叶酰香叶酰二磷酸合酶定位于三个亚细胞区室拟南芥.植物生理学报。2000,22(4):457 - 461。10.1104 / pp.122.4.1045。
- 10。
朱XF,铃木K,冈田K,Tanaka K,Nakagawa T,Kawamukai M,Matsuda K:新型香菇焦磷酸盐合成酶基因的克隆和功能表达拟南芥在大肠杆菌.植物营养与肥料学报。1997,32(4):457 - 461。
- 11.
陈志强,陈志强,陈志强,等。香叶酰香叶酰二磷酸合成酶cDNA的克隆及功能表达水松黄花并评估这种戊二酰转移酶在紫杉醇生产诱导细胞中的作用。生物化学学报。1998,32(4):457 - 461。10.1006 / abbi.1998.0926。
- 12.
OH SK,Kim Ij,Shin DH,杨j,康H,汉kh:克隆,表征和向日葵官能甘油酰基焦磷酸酯合成酶的异源表达(Helianthus Annuus L.)。植物营养与肥料学报。2000,19(4):531 - 534。
- 13。
Sitthithaworn W, Kojima N, Viroonchatapan E, Suh DY, Iwanami N, Hayashi T, Noji M, Saito K, Niwa Y, Sankawa U:香叶酰香叶酰二磷酸合成酶的来源Scoparia dulcis和巴豆sublyratus.质体定位和转化为法尼基二磷酸合酶的诱变。化学药品杂志,2001,49:197-202。10.1248 / cpb.49.197。
- 14。
大沼,铃木M,西野T:古细菌醚连接脂质生物合成基因。香叶酰香叶酰二磷酸合酶的表达克隆、测序及特性分析。中国生物医学工程学报,2003,19(4):497 - 497。
- 15.
Sandmann G, Misawa N, Wiedemann M, Vittorioso P, Carattoli A, Morelli G, Macino G:功能鉴定AL.-3来自粗糙脉孢菌作为香叶酰香叶酰焦磷酸合酶的基因与之互补CRT.基因,在体外基因产物和突变分析的表征。j photochem photobiol b:biol。1993,18:245-251。10.1016 / 1011-1344(93)80071-g。
- 16.
Kainou T, Kawamura K, Tanaka K, Matsuda H, Kawamukai M:小鼠和人类香叶酰香叶酰二磷酸合成酶GGPS1基因的鉴定。Acta botanica sinica(云南植物研究),2003,23(4):531 - 534。
- 17.
小池- takeshita A, Koyama T, Obata S, Ogura K:构成新型二磷酸七烯基合成酶的两种必需蛋白的基因克隆和核苷酸序列。中国生物医学工程学报,1996,13(4):427 - 434。10.1074 / jbc.270.31.18396。
- 18.
OHNUMA S,Hirooka K,Hemmi H,Ishida C,Ohto C,Nishino T:古菌甘油烷基甲基二磷酸二磷酸合酶产品特异性的转化。脱烯基转移酶反应链长测定基本氨基酸残基的鉴定。J Biol Chem。1996年,271:18831-18837。10.1074 / JBC.271.31.18831。
- 19.
Misawa N, Nakagawa M, Kobayashi K, Yamano S, Izawa Y, Nakamura K, Harashima K:阐明欧文氏菌uredovora类胡萝卜素生物合成途径的基因产物的功能分析大肠杆菌.中国微生物学杂志,1998,16(4):427 - 434。
- 20.
Ashby Mn,Kutsunai Sy,Ackerman S,Tzagoloff A,Edwards PA:CoQ2是编码对羟基苯甲酸酯的结构基因的候选者:聚丙烯 - 转移酶。J Biol Chem。1992,267:4128-4136。
- 21.
保守的天冬氨酸和精氨酸残基定点突变对法尼酯二磷酸合酶活性的影响。中国生物医学工程学报。1993,27(3):493 - 498。
- 22。
wang L, Song L, Poulter CD:酵母法尼基二磷酸合酶:高度保守的戊二酰转移酶结构域I和II的残基位点定向突变。美国国家科学院学报。1994年,91:3044 - 3048。
- 23。
B:香叶酰香叶酰焦磷酸合成酶的cDNA鉴定甜椒:果实成熟过程中酶活性和转录水平的相应升高。植物学报1992,2:25-34。
- 24。
Yanagihara H, Sakata R, Shoyama Y, Murakami H:使用单克隆抗体快速分析含有forskolin的小样本。植物学报,1996,62:169-172。
- 25。
李伟,田田,吉川,佐佐木K,林林,Shimomura K: forskolin的生物合成。第120届日本药学会年会论文集:日本岐阜。主编:日本药学会。2000年3月3日5-29-31日
- 26。
ENGPRASERT S,TAURA F,Shoyama Y:重组1-脱氧-D-木糖-5-磷酸盐还原异构酶的分子克隆,表达和表征锦紫苏forskohliiBriq。植物科学。
- 27。
Natakata T,Nemoto Y,Hasezawa S:烟草BY-2细胞系作为高等植物细胞生物学中的“HELA”细胞。INT转速cytol。1992,132:1-30。
- 28.
硫氰酸胍-苯酚-氯仿单步法分离RNA生物化学学报。1987,16(4):457 - 461。10.1006 / abio.1987.9999。
- 29.
Niwa Y, Hirano T, Yoshimoto K, Shimizu M, Kobayashi H:无毒s56t型绿色荧光蛋白的非侵入性定量检测及其在植物中的应用。植物学报,1999,18:455-463。10.1046 / j.1365 - 313 x.1999.00464.x。
- 30.
Chiu WI, Niwa Y, Zeng W, Hirano T, Kobayashi H, Sheen J:转基因绿色荧光蛋白在植物中的重要报道。生物谷学报。1996,6:325-330。10.1016 / s0960 - 9822(02) 00483 - 9。
- 31.
Laemmli UK: T4噬菌体头部组装过程中结构蛋白的切割。《自然》,1970,227:680-685。
确认
35SΩ-sGFP(S65T)质粒由日本静冈县大学丹羽宇雄博士慷慨提供。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
SE进行了分子遗传学研究,参与了序列比对、forskolin分析并起草了手稿。TF参与了本次研究的设计与协调。MK参与了遗传互补与协调。YS构思了这项研究,并参与了其设计和协调。所有作者阅读并批准了最终的手稿。
Surang Engprasert, Futoshi Taura, Makoto Kawamukai对这项工作做出了同样的贡献。
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
关于这篇文章
引用这篇文章
Engprasert, S., Taura, F., Kawamukai, M.。et al。香兰酰基焦磷酸合酶的分子克隆与功能表达锦紫苏forskohliiBriq。BMC植物杂志4,18(2004年)。https://doi.org/10.1186/1471-2229-4-18
收到了:
公认:
发表:
关键字
- 绿色荧光蛋白
- 类胡萝卜素
- forskolin.
- 异戊烯基二磷酸酯
- crtE