摘要
背景
质stromules是基质填充小管,从高等植物中,质体的表面延伸,并且允许蛋白质分子的质体之间的交换。这些结构是高度动态的;stromules在细胞质中同时改变它们的形状和位置十分迅速。与微丝抑制剂以前的研究表明,stromule形状和运动都依赖于肌动蛋白骨架。要了解更多关于stromules和细胞骨架的相互作用的性质,我们成像荧光标记微丝和质。
结果
我们使用拟南芥表达绿色荧光蛋白的植物与人肌动蛋白结合蛋白浑石融合以观察微丝及其与血清的关系在活的有机体内.微丝与胚轴表皮的基质和质体密切接触。延时共聚焦显微镜显示微丝重排与质体和stromule的形态和位置的变化有关。我们还观察到双标记细胞中线粒体和基质之间的密切相互作用。
结论
我们的研究结果表明,微丝的重排与质体和基质的形状和位置的变化有关。基质与微丝相互作用,微丝也可被线粒体和其他细胞器利用。微丝与质体的相互作用可能是由质体包膜上的肌动蛋白结合蛋白介导的。
背景
一项的植物细胞生物学中最显着的特征是细胞质流:细胞质的快速混合在大液泡化细胞中观察到。在许多物种中,叶绿体参加本次细胞质流动[1].除了随机细胞质流外,电池内的叶绿体排列可以响应于光强度和机械刺激而改变[2-5.].在某些组织中,非绿塑体也高度移动[6.].一些证据表明质体的运动是肌动蛋白依赖的。在许多物种中,光诱导的叶绿体重排对肌动蛋白微丝抑制剂很敏感[1].此外,一些研究小组已经使用免疫定位来显示微丝(MFs)在非绿色质体和叶绿体周围的有序排列[7.-9.].
质体和MFs之间的明显关系表明,肌动蛋白也可能在调节基质的形成中发挥作用。基质是质体包膜的管状延伸[10.那11.].这些结构已经被观察到连接细胞内的质体,光漂白研究表明绿色荧光蛋白(GFP)可以通过stromule连接在质体之间移动[12.].Stromule的结构是高度动态的:Stromule快速改变它们的形状,并有能力在细胞质中快速移动[6.].我们感兴趣的是确定stromule的形态和运动是如何被植物细胞调节的。之前对肌动蛋白和微管蛋白抑制剂的实验表明MFs是维持stromules及其运动所必需的[6.].因此,我们有兴趣确定MFs是否直接与stromules相互作用。为此,我们观察了mf在活的有机体内在拟南芥表达一种GFP和人类talin之间的融合蛋白(GFP- htalin),该蛋白特别标记了MFs。
拟南芥表达与GFP融合的肌动蛋白结合蛋白使得MF动力学的研究成为可能在活的有机体内没有许多免疫定位或微量注射的限制[13.那14.].观察到GFP融合到小鼠Talin,以标记所有以前观察到的MF结构以及一些以前用其他方法未见过的新结构[13.].GFP-hTalin融合对MFs表现出相似的特异性[14.].在这项研究中,GFP-hTalin被证明是非常有用的可视化stromules及其与mf的相互作用。我们能够在与MFs密切接触的亮生长和暗生长组织中观察基质。观察质体和基质的能力在活的有机体内使我们能够记录基质细胞和基质细胞在细胞质中移动时的关系。
结果
gfp - htalin标记的微丝与基质相互作用
gfp - htalin标记的MFs和stromules出现在下胚轴表皮细胞中拟南芥.我们选择下胚轴表皮进行观察,因为这些细胞含有高频率的长、高流动性的基质。此外,细胞相对平坦的形状有助于细胞皮层质体和基质的成像。在这种细胞类型中,质体和基质很容易被DIC光学识别和成像,因此不需要产生一个带有两个荧光标记的细胞系。最后,我们在前面的工作中尼科尼亚塔哈瓦姆展示分子形状和运动与肌动蛋白抑制剂的敏感性[6.]也在下胚轴表皮进行了研究,表明这将是研究质体- mf相互作用的合适组织。
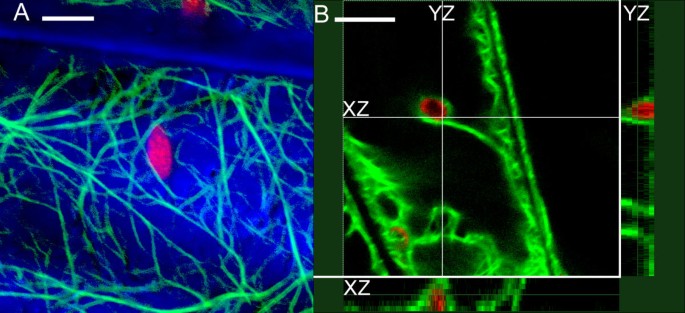
拟南芥表达GFP-hTalin的幼苗在光生长和暗生长的下胚轴表皮细胞中都表现出明亮的荧光。荧光标记的MFs与之前对GFP-Talin植物的研究以及免疫定位研究中看到的相似。MFs在细胞皮层形成致密的网状结构(图。1A).厚,分枝束产生较薄的细丝,在较大束的边缘中逐渐变化。突出的MF也被发现在细胞质链中,并围绕细胞核(数据未显示)。我们能够观察到GFP-HTALIN标记的MFS与光和深色组织中的塑体相互作用。在光中,通过存在叶绿素自发荧光来鉴定叶绿体。在黑暗中,通过它们的特征尺寸和形状和通过差分干扰对比显微镜(DIC或NOMARSKI)来鉴定塑体。在某些情况下,可以通过淀粉颗粒在深色种植体中鉴定体积。通过同时采集荧光和DIC图像,我们能够共同定位GFP-HTALIN和PLASTID。体积和叠层出现了在GFP-HTALIN缺口细胞中的形态和运动方面的野生型,证实GFP-HTALIN表达没有破坏粒子和塑性的正常活性
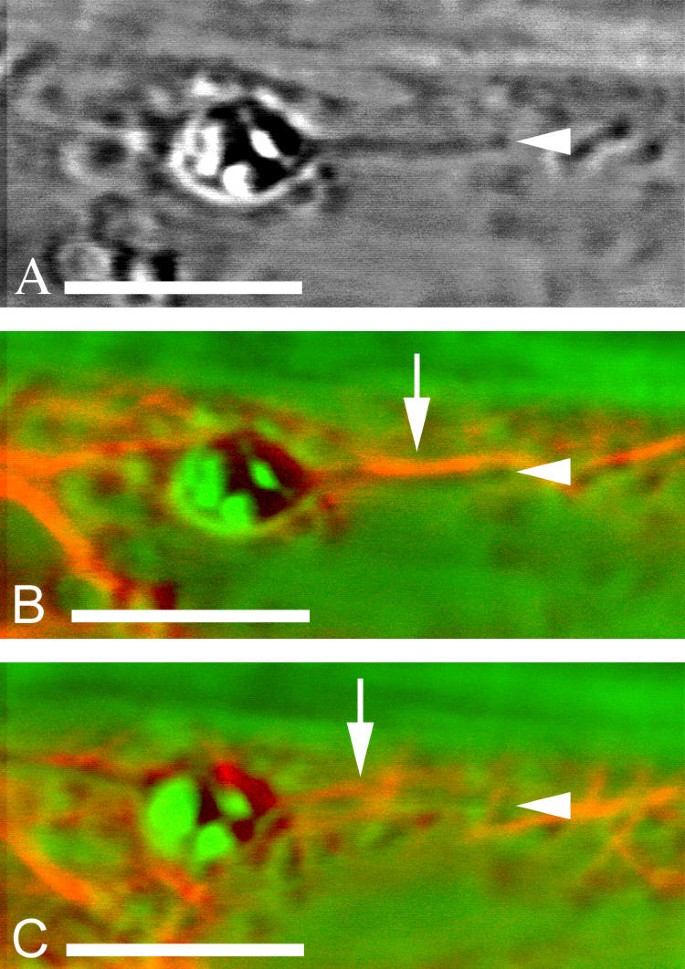
质体常与基质金属紧密结合。在轻生长的下胚轴中,叶绿体通常被MFs形成的篮状结构包围(图。1B.).质体基质也常被基质蛋白所结合。数字2A在深色生长的下胚轴表皮细胞中显示一个具有粗stromule的淀粉体。当gfp - htalin标记的MF的荧光图像叠加在该图像上时,可以观察到一个厚的MF沿着stromule的一侧延伸(图。2B.箭头)。当在不同的共焦平面上观察时,相同的stromule似乎被包裹在一个精细的mf网络中,可以观察到它们彼此交叉(图)。2C箭头)。在某些情况下,MFs似乎定义了stromules的边界。数字3显示另一个淀粉体与黄化组织的stromule。荧光显微镜显示在单个光学切片中,MFs沿着stromule的任意一侧运行(图)。3 b,箭头)。在相同的图像中,分子的尖端也由垂直于基分轴(箭头)的长轴运行的MF限定。也观察到MFS终止于粒子表面(图。3 c&3 d).
微丝制造与stromules直接接触A)深生长的下胚轴表皮中淀粉体的DIC图像(p)。在A&B中,stromule的顶端有一个箭头标记。B) MFs沿着stromule的两侧平行运行,如图A(箭头)和垂直于stromule的尖端(箭头)。gfp - htalin标记的mf为假红色。来自A的DIC图像为假绿色。C)光生长下胚轴细胞中带有stromule的叶绿体的DIC图像。在C&D中Stromule有一个箭头。D) MFs终止于C(箭头)所示stromule的表面。gfp - htalin标记的mf为假红色。来自C的DIC图像是假的绿色。 Chlorophyll fluorescence is false-colored blue. Bars: 5 μm.
微丝动力学与基质和质体的运动有关
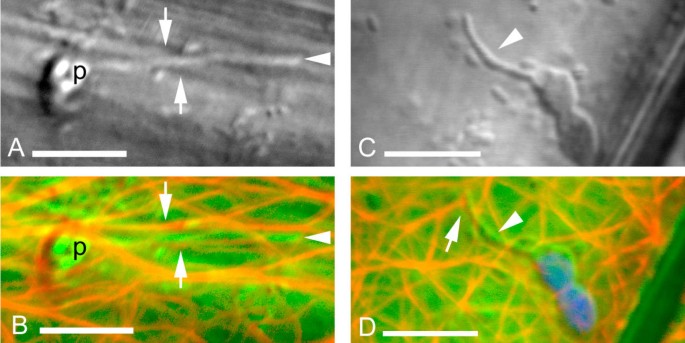
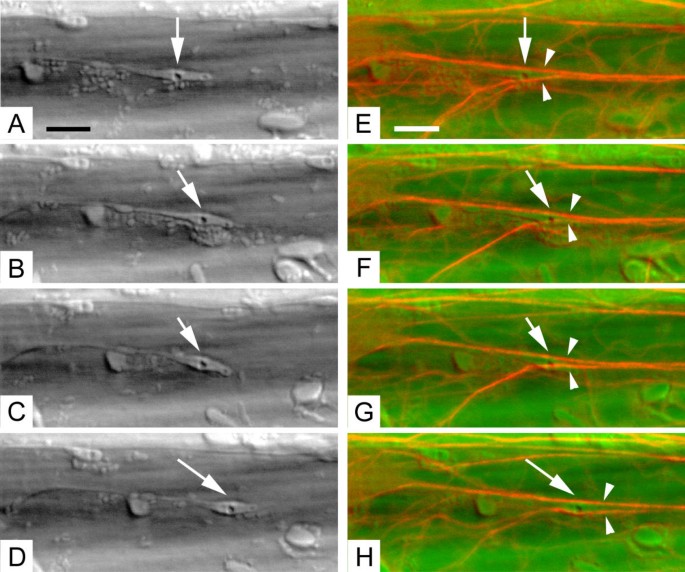
在暗生长的表达GFP-hTalin的下胚轴细胞中,基质细胞的延时图像揭示了基质细胞和基质细胞之间的复杂关系。在基质和基质之间观察到许多不同类型的相互作用。在许多情况下,基质似乎被锚定在与基质对齐的厚实的、固定的基质上。MFs固定化基质如图所示4.和延时电影1附加文件:1其中stromule的下半部分与厚的mf相关联,而上半部分则没有。在3分钟的观察期间,下半部分保持固定位置。这一较低的stromule区域经常被平行的MFs包围(图。4 f).
stromule的上半部分如图所示4.,其中包括质体体,似乎是独立于厚的mf。质体的上部区域在细胞质中快速移动。应该注意的是,stromule在它的中点似乎是枢轴(箭头,图)。4.).这个枢轴点是stromule与MF连接的最后一个点,支持MF稳定stromule的理论。DIC图像(绿色背景,图。4.)显示小泡或细胞器簇与体和质体的无栓区碰撞。这些小体的运动可能是由MFs介导的:簇内可见弥漫性GFP-hTalin信号。与这些囊泡的碰撞可促进未结合的stromule和质体的运动。另一方面,弥漫性GFP-hTalin信号,可能是非常细微MFs的指标,偶尔也可以在stromule上观察到,因为它与移动的囊泡相互作用。因此,这些瞬态MF-stromule相互作用可能是观测到的stromule运动的原因。
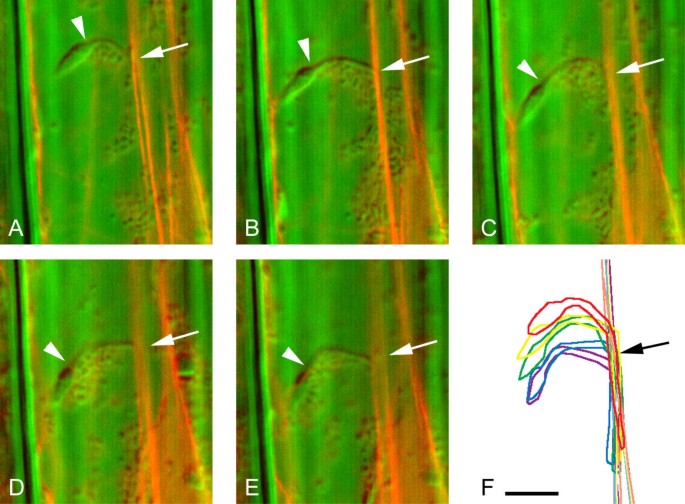
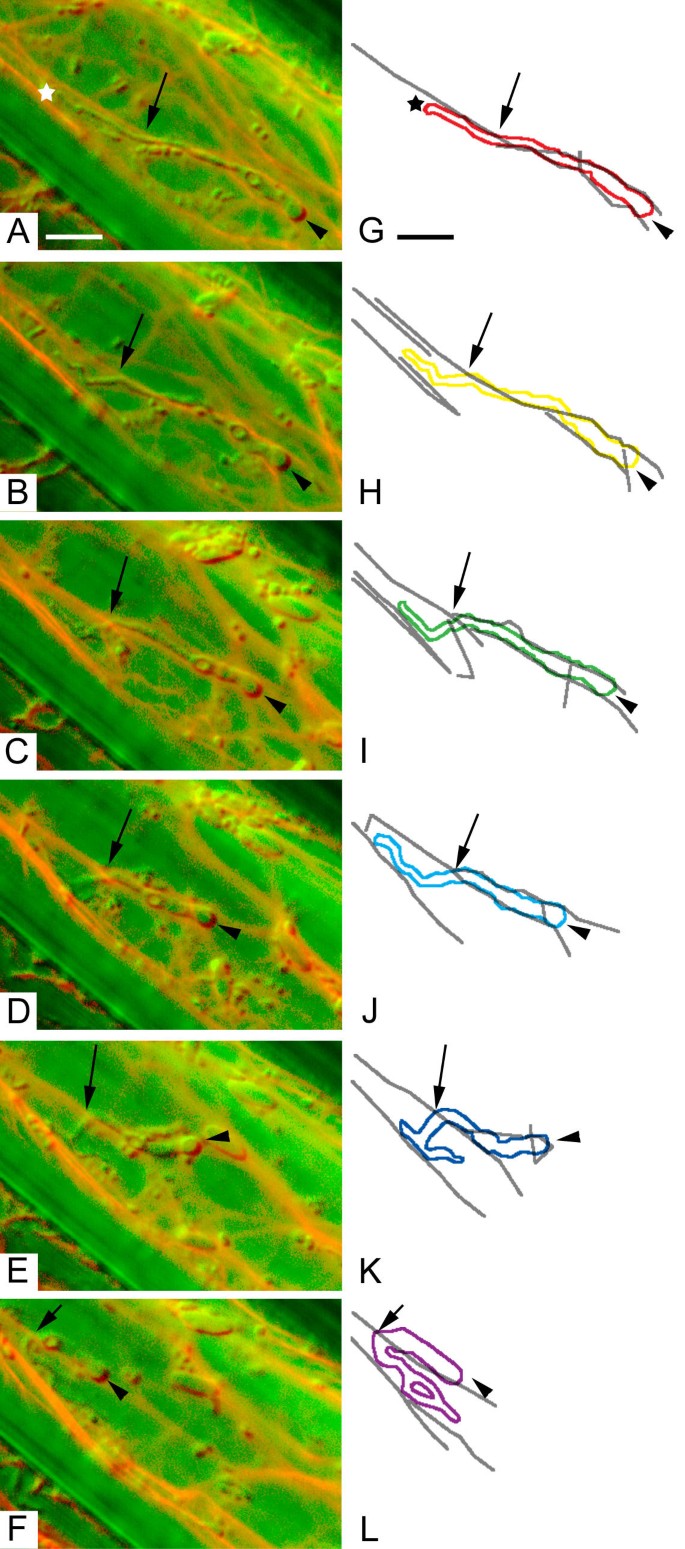
厚的MFs也被发现与快速移动的质体和基质有关。在图5.和延时电影2附加文件:2,带有stromule的质体从左向右穿过图像平面(箭头,a - h)。质体与两侧的两个厚的MFs紧密接触,并在质体的尖端相交(箭头,E-H)。当质体穿过细胞时,相关MFs的交点也会在细胞内转译。因此,MFs的运动与质体和基质之间有紧密的对应关系。在图中给出的例子中6.和延时电影3附加文件:3MFs的重排与质体和stromule的形态和细胞位置的改变有关。质体体(箭头,a - l)附着在一个长而厚的stromule上,它似乎被固定在图像左侧边缘的细胞质中(A&G星)。随着时间的推移,质体和stromule被拉回这个锚点,最终通过它。质体体和stromule的运动表现为stromule的显著变形(图)。6克,6 h, 6我6 j, 6 k, 6 l,箭头),因为如果有沿在其被施加用于移动的力的stromule的离散点。厚MF相交stromule正好该变形点,这表明MF可以用于牵拉stromule背面提供的力。在一个点上,质体的形态显着改变(图6我6 j,箭头)。塑性形状的这种变化伴随着与塑体接触的MF的类似重新排列。这些观察结果证实,平行地发生了塑体和分子形态的MF重排和改变。
基质与其他细胞器利用的微丝相互作用
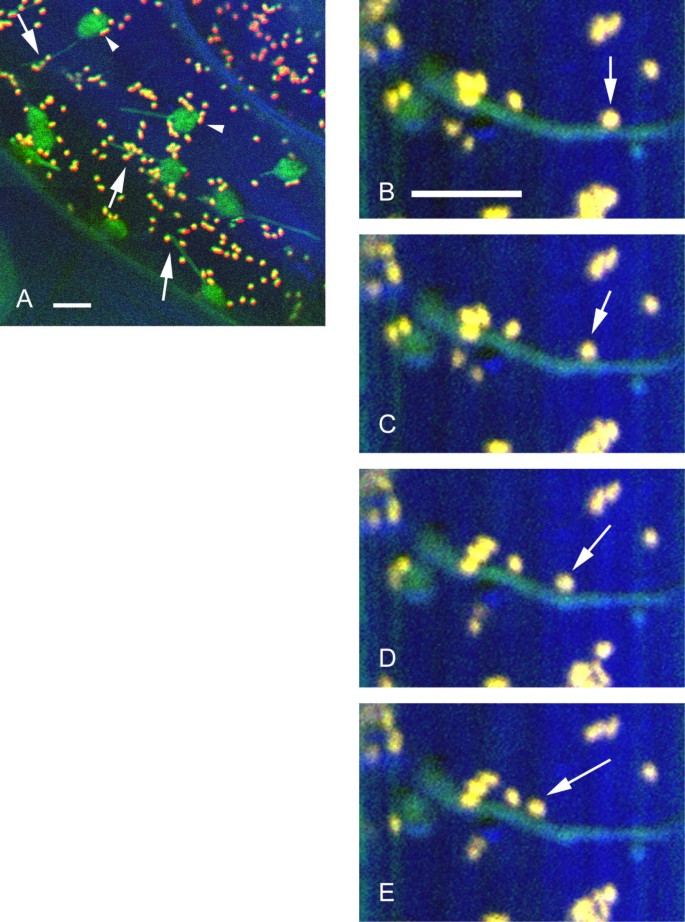
观察GFP-hTalin拟南芥表明MFs和stromules之间存在直接的相互作用,特别是在两种结构的运动方面。接下来,我们开始确定参与质体动力学的MFs是否也被其他细胞器(如线粒体)利用,这些细胞器已经被证明沿着MFs移动。DIC图像经常显示小的圆形或杆状结构与stromules碰撞,有时沿着stromules运行(图。4.).然而,基于DIC图像无法识别这些小细胞器。为了更好地区分细胞器,尼科尼亚塔哈瓦姆在线粒体和质体中均有荧光蛋白表达。将表达质体靶向青色荧光蛋白(CFP)的植物与表达线粒体靶向绿色荧光蛋白(GFP)的植物杂交生成双标记烟草植株。这些杂交后代携带两个荧光标记,可以通过仔细选择荧光检测通道来分离。下胚轴细胞的观察显示基质和线粒体共定位(图。7.).可以观察到圆形线粒体通过细胞皮质散射,但经常在与股骨和塑性体密切接触(图。7一个).延时图像显示,线粒体可以沿着基质的长度移动,这表明两个细胞器可能与相同的MFs有关(图。7 b, 7 c, 7 d, 7 e和延时电影4附加文件:4).
讨论
GFP-HTALIN被证明是研究MFS和STROMUELS之间相互作用的优异标签。下丘脑表皮中的GFP-HTALIN标记的MFS类似于使用GFP-mousetalin报告的那些[13.那15.].gfp - htalin标记的MFs与轻生长下胚轴的叶绿体直接相互作用。厚的MF束常包围细胞皮层的叶绿体,形成篮子状结构,类似于免疫定位研究中看到的[7.].在高倍镜下观察GFP-hTalin植物的基质,发现质体与基质之间存在复杂的相互作用。
大多数基质与细粒和厚粒基质直接接触(图。2那3.那4.).MFs定义了stromule结构的界限,通常在stromule的许多方面包围着stromule,或者在stromule周围形成网状鞘。在某些情况下,MFs似乎与路过的stromules相互作用;也就是说,一个stromule将与一个长得多的MF的一个短区域接触。在其他情况下,基质细胞似乎直接终止于基质表面。在GFP-hTalin植物中观察到的stromule动态支持了MFs和stromule之间的直接相互作用。与质体和基质密切接触的MFs的重排与细胞器形态的改变有关。MFs与质体和stromule形态之间的这种关系支持了抑制剂数据,表明stromule长度对肌动蛋白抑制剂Cytochalasin D和Latrunculin B很敏感[6.].
MFs也被发现与质体和stromule运动有关。我们观察到与活跃移动的MF束相关的运动质体和基质。相反,我们也观察到附着在MFs上的情况似乎稳定了质体的某些区域,而那些较远的、未附着的区域则在积极移动。未附着的基质细胞的运动可能是由于与胞浆内运动的小泡碰撞或与非常细小的基质细胞短暂结合。我们的观察表明MF重排实际上可能导致质体和基质通过细胞质的运动。这一理论与之前的一项研究结果一致,该研究表明stromule和质体运动对肌动蛋白抑制剂的敏感性[6.].高等植物的细胞器运动一般是肌动蛋白依赖性的。高尔基体、线粒体和过氧化物酶体的运动依赖于MFs [16.-21.].我们能够观察线粒体沿着stromule移动,也许沿着与stromule直接接触的MF移动。因此,基质植物可以利用植物细胞中一般的细胞器运动器。
因此,基质金属在质体结构和运动方面具有复杂的作用。肌动蛋白对质体形态和运动的直接活性模型将预测质体表面存在肌动蛋白结合蛋白,将外包膜连接到肌动蛋白网络。基于抗体的序列相似性和交叉反应性,植物中已经识别出类似于光谱蛋白、α-肌动蛋白和整合素的蛋白质,它们在MFs到膜的锚定中发挥作用[22.-24.].此外,植物中含有大量的肌球蛋白运动蛋白基因家族,这些蛋白对植物具有高度特异性[25.].免疫定位研究表明,质体包膜上可能存在肌凝蛋白。抗牛肌球蛋白抗体与从草花粉管中分离出来的淀粉体表面结合等pratensis[26.].今后的研究应着眼于质体膜表面介导质体与基质金属蛋白酶相互作用的蛋白质。
结论
细胞质mf在胚轴表皮细胞中与质体和基质直接接触。我们对mf的观察在活的有机体内与我们以前在MF抑制剂的存在stromule形态和运动损失的观察结果一致。我们发现微丝的是重排在两个质形态和运动变化相关。微丝也出现在细胞质内稳定stromules和质。我们的研究结果揭示的MF和质体之间的复杂关系,并表明蛋白质可介导的MF和膜之间的相互作用都有可能在质外囊膜被发现。
方法
所有的植物都是在Murashige和Skoog培养基上与Gamborg的维生素一起生长的[Sigma,圣路易斯,密苏里,美国,[27.那28.加30克升-1蔗糖和8.5 g l-1琼脂。幼苗在无菌培养皿中在21-25°C下生长。转基因拟南芥表达GFP-hTalin由Adrienne R. Hardham慷慨提供[14.].转基因尼科尼亚塔哈瓦姆通过交叉稳定的核转化体产生表达体积靶向的CFP和线粒体靶向GFP。塑体靶向的CFP线表达了Rubisco的小亚基之间的融合Pisum一(RBCS-3A)和CFP [29.那30.].Rubisco编码区包括一个氨基端质体过渡肽。线粒体靶向GFP系表达了酵母细胞色素氧化酶IV过渡肽与mGFP4 S65T突变体的融合[31].
对3- 5日龄的幼苗进行观察,这些幼苗的下胚轴被切割并安装在水中。使用配备TCS-SP2共聚焦扫描头(Leica Microsystems Inc., Bannockburn, IL, USA)的徕卡dre -7 (SDK)显微镜进行共聚焦显微镜检查。采用徕卡100 × HCX PlAPO油浸物镜采集图像(NA = 1.40)。对于GFP- htalin成像,GFP在488 nm激发,在500 ~ 600 nm之间检测到发射。在633 nm处激发叶绿素,在660 ~ 700 nm处检测到辐射。DIC图像由透射激光产生。因为RGB图像中的蓝色通道比绿色或红色通道提供的分辨率更低,所以在图中使用红色和绿色通道对每幅图像中最关键的特征进行假着色。因此,假着色方案在不同的数字是不相同的。
对于GFP-CFP植物的静态成像,分别收集对每个荧光团进行优化的连续扫描,然后使用Adobe PhotoShop (Adobe Systems Inc., San Jose, CA, USA)重新组合。在458 nm处激发CFP,在465 ~ 500 nm处检测到荧光发射。对于GFP-CFP植物的时移成像,两个荧光团都被单次458 nm的光激发。按照静止图像的描述收集了发射物。由于GFP和CFP两种荧光团的发射曲线存在重叠,双重成像不能很好地分离两种荧光团。特别是,GFP荧光通常流进CFP检测器。然而,只有很少的CFP信号流进GFP检测器。因此,有可能通过对两个通道进行假染色和叠加来分离两个荧光团。当CFP图像为假绿色,GFP图像为假红色时,表达CFP的质体呈现绿色,而积累GFP的线粒体呈现黄色,这是由于红绿结合的结果。
参考文献
- 1。
Williamson RE:细胞器运动。acta botanica sinica(云南植物学报). 1993,44:181-202。10.1146 / annurev.pp.44.060193.001145。
- 2。
黄志强,王志强:叶绿体运动。植物营养与肥料学报。1990,13(4):513 - 514。
- 3.
Wada M, Kagawa T, Sato Y:叶绿体运动。《植物生物学》,2003,54:455-468。10.1146 / annurev.arplant.54.031902.135023。
- 4.
Makita N,Shihira-Ishikawa I:通过机械刺激和其在硅藻土中的细胞外传递叶绿体组装。原生质。1997年,197:86-95。
- 5.
王志强,王志强,王志强:植物叶绿体对植物原体细胞的机械诱导回避反应。植物生理学报,2003,21(4):591 - 598。10.1104 / pp.121.1.37。
- 6.
Kwok Ey,Hanson Mr:微丝和微管控制非绿色塑体和尼古拉塔卡突氏菌的形态和运动。工厂J. 2003,35:16-26。10.1046 / J.1365-313x.2003.01777.x。
- 7.
拟南芥叶肉细胞中肌动蛋白-细胞器相互作用与叶绿体的关联。细胞运动与细胞骨架。1999,44:110-118。10.1002 / (SICI) 1097 - 0169 (199910) 44:2 < 110:: AID-CM3 > 3.3.CO; 2 - f。
- 8.
门田A,和田L:由叶绿体微丝形成圆形结构中的光诱导的蕨铁线蕨的原丝体细胞内取向期间。原生质。1992年,167:97-107。
- 9.
Collings Da,Zsuppan G,Allen NS,Blancaflor EB:在根霉菌中突出的肌动蛋白细丝的示范。Planta。2001,212:392-403。10.1007 / S004250000406。
- 10。
Stromules:移动的突起和质体之间的连接。植物学报。2001,33(4):457 - 461。10.1055 / s - 2001 - 15204。
- 11.
KöhlerRH:用于植物细胞亚细胞结构体内成像的GFP。植物科学趋势。1998年,3:317-320。10.1016 / s1360-1385(98)01276-x。
- 12.
Köhler RH, Cao J, Zipfel WR, Webb WW, Hanson MR:高等植物质体间的蛋白质分子交换。中国科学:地球科学。10.1126 / science.276.5321.2039。
- 13。
gfp小鼠talin融合蛋白在体内标记植物肌动蛋白丝,并显示生长花粉管中的肌动蛋白细胞骨架。植物学报。1998,16:393-401。10.1046 / j.1365 - 313 x.1998.00304.x。
- 14.
Takemoto D, Jones DA, Hardham AR:细胞组分的gfp标记揭示了拟南芥被卵菌病原体感染后亚细胞重组的动态变化。植物学报。2003,33:775-792。10.1046 / j.1365 - 313 x.2003.01673.x。
- 15.
ADF蛋白参与拟南芥开花调控和f -肌动蛋白组织、细胞扩张和器官生长。植物学报。2001,13:1333-1346。10.1105 / tpc.13.6.1333。
- 16.
Van Gestel K, Kohler RH, Verbelen JP:植物线粒体在F-actin上移动,但它们在皮层细胞质中的位置同时依赖于F-actin和微管。中国生物医学工程学报,2002,29(6):659-667。10.1093 / jexbot / 53.369.659。
- 17.
Boevink P, parka K, Santa Cruz S, Martin B, Betteridge A, Hawes C:堆栈在轨道上:植物高尔基体在肌动蛋白/ER网络上传输。植物学报1998,15:441-447。10.1046 / j.1365 - 313 x.1998.00208.x。
- 18.
通过GFP可视化技术研究过氧化物酶体在拟南芥中的分布和特性:动态形态和肌动蛋白依赖的运动。植物营养与肥料学报。2002,31(4):441 - 446。10.1093 /卡式肺囊虫肺炎/ pcf037。
- 19.
科林斯DA,哈珀JDI,马克Ĵ,总体RL,马伦RT:生活在快车道:植物过氧化物酶的基于肌动蛋白的活力。加拿大植物学杂志。2002年,80:430-441。10.1139 / b02-036。
- 20.
同时可视化的过氧化物酶体和细胞骨架元素揭示了肌动蛋白,而不是基于微管的过氧化物酶体的运动。植物营养与肥料学报。2002,32(4):429 - 434。10.1104 / pp.011018。
- 21。
NebenführA,加拉格尔LA,Dunahay TG,Frohlick JA,Mazurkiewicz AM,米尔JB,施特赫林LA:植物高尔基堆栈的停止和走的运动是由雅图肌球蛋白系统的中介。植物生理学。1999年,121:1127年至1141年。10.1104 / pp.121.4.1127。
- 22。
植物细胞中的肌动蛋白结合蛋白。acta botanica sinica, 2017, 36(5): 566 - 572。
- 23。
植物高尔基相关囊泡含有一种新的a-肌动蛋白样蛋白。中国生物医学工程学报,2003,23(4):531 - 534。
- 24。
植物重力感反应中的机械转导分子:淀粉体/平衡石成员脑含有b1整合素样蛋白。生物医学进展。1998,21(4):421 - 427。
- 25。
Reddy ASN, Day IS:最近完成的拟南芥基因组序列中肌凝蛋白编码的分析。生物技术学报。2001,2:1-17。10.1186 / gb - 2001 - 2 - 7 - research0024。
- 26.
Heslop-Harrison J, Heslop-Harrison Y:肌球蛋白与被子植物花粉粒和管的细胞器表面、营养核和生殖细胞相关。中国生物医学工程学报。
- 27.
利用烟草组织培养快速生长和生物测定的改良培养基。acta botanica sinica(云南植物学报),2000,15(4):493 -497。
- 28.
大豆根细胞悬浮培养的营养需求。细胞生物学杂志,1998,21(3):441 - 446。
- 29.
豌豆红细胞多基因家族的表达动态和转录本的器官分布。Embo J. 1986, 5: 2063-2071。
- 30.
Haseloff Jim:用于活细胞的多光谱成像的GFP变体。细胞生物学的方法。1999年,58:139-151。
- 31.
Köhler RH, Zipfel WR, Webb WW, Hanson MR:绿色荧光蛋白作为在体内观察植物线粒体的标记物。植物学报。1997,11:613-621。10.1046 / j.1365 - 313 x.1997.11030613.x。
确认
作者要感谢Adrienne R. Hardham拟南芥植物表达GFP-hTalin。这项工作得到了美国能源部能源生物科学项目M.R.H.的资助(DE FG02-89ER14030)。E.Y.K.获得了美国国家科学基金会/美国能源部/美国农业部康奈尔植物过程分子机制培训小组的资助。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
的Eyk进行显微观察并起草了手稿。MRH构思研究,参与其设计和协调,以及编辑的稿件。这位作者都读到并批准了最终手稿。
作者为图像提交的原始文件
12870 _2003_26_moesm1_esm.mov
附件1:微丝和固定stromules之间的相互作用。图中描述的质体和基质的延时影像。4..每隔1.6秒采集图像。电影在大约20 ×实时播放。(MOV 2 MB)
12870_2003_26_moesm2_esm.mov.
附加文件2:微丝的重排与stromule运动相关。图中描述的质体和基质的延时影像。5..每隔5秒采集图像。电影在大约20 ×实时播放。(MOV 2 MB)
12870_2003_26_MOESM3_ESM.mov
附加文件3:微丝的重排与stromule形态学的变化相关。图中描述的质体和基质的延时影像。6..每隔5秒采集图像。电影在大约20 ×实时播放。(MOV 3 MB)
12870 _2003_26_moesm4_esm.mov
线粒体与下胚轴表皮的质体间质有关。图中所示的线粒体和质体的延时影像。7..图像以6.5秒间隔收集。电影在大约20 ×实时播放。(MOV 1 MB)
权利和权限
关于这篇文章
引用这篇文章
郭怡云,韩伟生,mr . r .体内GFP标记微丝和质stromules之间的相互作用的分析。BMC植物杂志4,2(2004)。https://doi.org/10.1186/1471-2229-4-2
收到了:
公认:
发表:
关键字
- 绿色荧光蛋白
- 绿色荧光蛋白荧光
- 青色荧光蛋白
- 质体Stromules
- 外壳膜