摘要
背景
Ceratopteris richardii.是一种用于研究植物的配子体发育和性繁殖的有用实验系统。然而,对于该物种,存在用于克隆突变基因或破坏基因函数的工具。在本研究中检测了作为反向遗传工具作为反向遗传工具的系统基因沉默的可行性。
结果
靶向一个DNA构建体原卟啉IX镁螯合酶(Crchli.叶绿素生物合成所需的基因通过生物传递分别导入幼体配子体。它们在单个细胞中的瞬时表达导致无色的细胞表型,影响成熟配子体的大多数细胞,包括分生组织和配子囊。无色表型与内源性转录本丰度下降7倍有关。而用于促进a的瞬态表达式的结构Crchli.被发现双链,潜在的发夹形成RNA在系统性地沉默内源基因中是最有效的,含有含有的质粒Crchli.单独cDNA插入足以诱导沉默。轰击,无色雌雄同体配子体在自施后产生无色胚胎,证明沉默信号可以通过配子发生和施肥传播。用瞄准的构造轰击幼孢子体Ceratopteris丝状温度敏感(CrFtsZ),尿卟啉脱氢酶(CrUrod)基因也产生预期的突变表型。
结论
一种诱导靶基因系统沉默的方法Ceratopteris.配子体进行说明。它提供了一个简单,廉价且快速的方法来测试参与配子体发育,特别是那些参与细胞过程共同所有的植物基因的功能。
背景
植物与动物的不同之处在于在其生命周期中加入了多细胞的单倍体阶段,即配子体阶段,配子体阶段与二倍体的孢子体阶段相交替。虽然配子体在开花植物中极其稀少且不明显,但它在所有陆生植物的有性生殖中是必不可少的,因为它产生配子,促进受精,并且至少在短时间内哺育幼胚。我们使用了同孢子蕨类植物Ceratopteris richardii.作为研究配子体发育的模型系统,因为Ceratopteris.配子体是自养,小(〜1毫米),快速发展[1].它们也可以被信息素受精原操纵成雄性或雌雄同体[2而且很容易被越过。由于所有配子体都是单倍体,因此在孢子诱变和在选择培养基上生长的几天内,很容易选择影响配子体发育的突变。而Ceratopteris.已被证明是解剖其性别测定途径的有用基因体系[3.-5.],它还有待稳定转化的,这使得难以以已知仅对其突变表型或测试的gametophytically表达的基因的功能的克隆的基因。
表观遗传基因沉默的最新进展使其成为一种逆向遗传学工具,用于检查动植物的基因功能[6.-13.].根据生物体或所用方法,称为转录后基因沉默(PTGS),共转录,抑制,反义抑制,压缩或RNA干扰(RNAi),这些方法导致转录后和序列特异性基因引入转基因或双链RNA(DSRNA)时沉默([14.-16.])。将这些过程连续链接在一起的是存在小的21-23nt RNA分子,其介导互补同源RNA的降解。遗传筛选拟南芥蒂利亚纳那秀丽隐杆线虫和粗糙脉孢菌有需要的基因沉默鉴定同源基因[17.-20.],表明它们共享共同的和进化上保守的机构,其很可能是存在于所有植物,包括蕨类植物。基因沉默的一个显着特点是,沉默效应是非细胞自主,并蔓延到相邻小区。出于这个原因,瞬时表达而不是转基因的稳定整合足以诱导从基因沉默导致的表型。
本研究研究了基于DNA载体基因沉默的可行性作为研究配子体中基因功能的反向遗传技术。我们的选择Ceratopteris.目标基因是基于三个标准:它们在其他开花植物中突变时导致可见表型;它们在配子上表达;他们存在于一个Ceratopteris.从发芽的孢子[生成的EST文库21.].包含的三个基因包括在内Protoporphyrin IX镁切酶(Crchli.),丝状温敏Z-(CrFtsZ), 和尿卟啉脱氢酶(CrUrod),这是叶绿素生物合成或叶绿体发育所必需的。我们发现系统性基因沉默发生在Ceratopteris.当通过粒子轰击引入适当的转基因构建体时,沉默效应是非细胞自主的,并且可以从频率低频地传递由基因沉默产生的表型。通过比较各种基因沉默构建体的效率,我们还表明,没有任何可识别的启动子序列的cDNA构建体足以在高频下诱导在配子体中沉默。
结果与讨论
生物射弹引入CrChlI潜在形成发夹的构建体的抑制内源性Crchli.基因
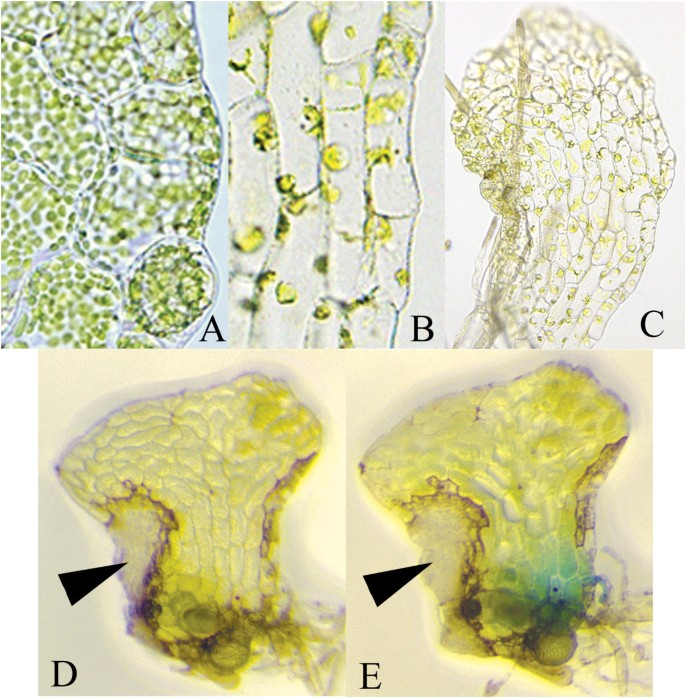
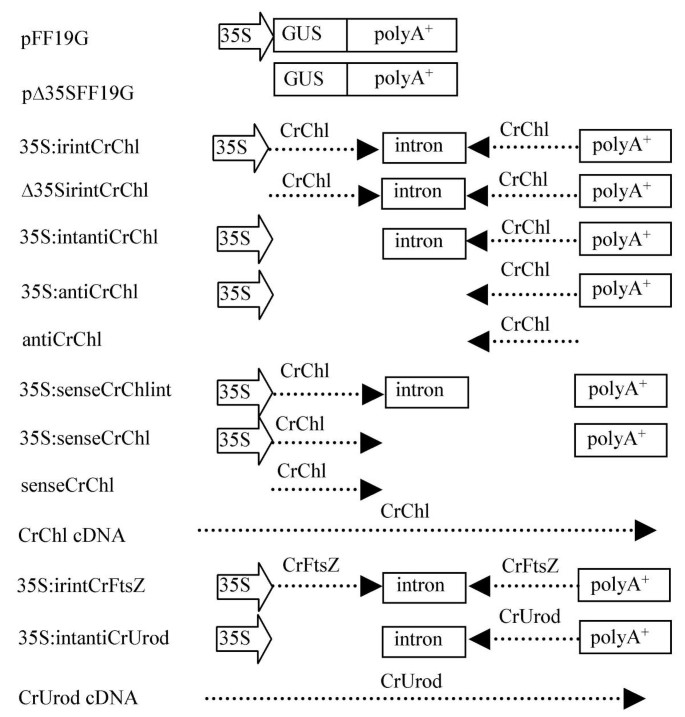
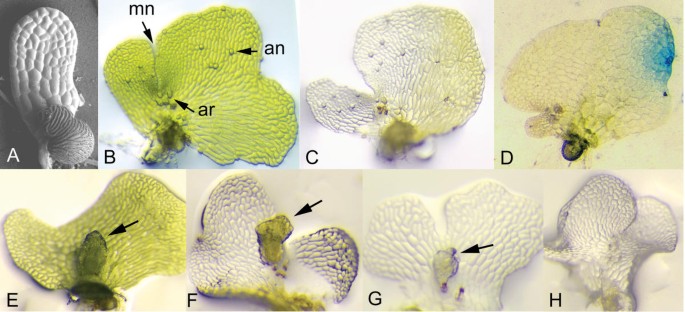
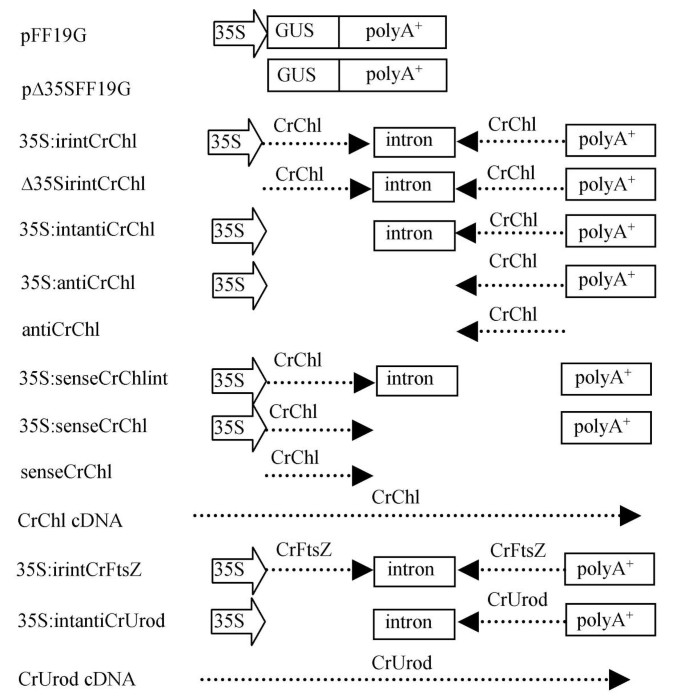
一种Ceratopteris.最初选择编码在氨基酸序列中的调用蛋白质> 75%与大麦CHLI蛋白相同的蛋白质,以测试内源基因的沉默Ceratopteris..这个基因是叶绿素生物合成所必需的,之所以选择它是因为它的失活导致一个容易得分的表型。在大麦中,植株为纯合子ChlI突变是黄色幼苗致命的,而杂合子是黄绿色的[22.].因为引入沉默通过组织的生物射弹轰击转基因已被证明触发全身的基因沉默在被子植物[23.-26.[此处应用相同的方法。雌雄同体Ceratopteris.配子体最初轰击与35S:irintCrChlI质粒(图1),这潜在地驱动的dsRNA发夹与内含子环路的表达,如果拼接,形成393 bp的双链Crchli.RNA分子。已知这种倒置重复构建设计在开花植物中诱导基因沉默中是非常有效的[13.].在轰击时,6岁的雌雄同体非常小(约0.3 mm),开始形成侧向的多细胞分生组织(图。2).雌雄同体的雌雄同体的简单形态,它由单一的细胞组成,该细胞包裹着用卵形成的成蛋白和形成的蛋白化,使得在所有细胞中检测基因沉默,而其性别使其成为可能自我施肥配子体并评估施肥后孢子体产生的沉默表型的传播。如果沉默内源性Crchli.基因从轰击到相邻细胞,配有35秒和GUS报告者PFF19G质粒共同轰击的配子体细胞蔓延,配子体细胞(图。1),预期发展成扇形或完全黄色至无色的原叶体,但仅在配子体的单个细胞中表达GUS,该细胞在轰击时存在。如图所示2只有在配子体的较老的细胞,雌雄同体联合轰炸两个质粒在大部分的原叶体的生成无色的细胞,包括分生组织,精子器和颈卵器,但显示GUS活性。而GUS活性可在几个相邻的单元(被检测图2摄氏度),这很可能是由于来自瞬时表达GUS基因的单个细胞的GUS蛋白或反应产物的扩散。只观察到所有GUS阳性配子体的99%的GUS阳性扇区,并且从未观察过两个以上的GUS行业。与35秒共同轰击的配子体:Irintcrchli和Pff19g并具有无色或GUS阳性表型,〜89%在轰炸后七天无色和GUS阳性(表1),表明将两个质粒导入同一细胞的效率很高。这些结果证明了这一点的存在Crchli.在一个或少量细胞的表达构建体是足以灭活内源Crchli.几乎所有栽培的prothallus的细胞中的基因导致无色表型,特别是在轰击后形成的细胞中。
内源性的相对丰度Crchli.利用35S:irintCrChlI质粒轰击6d后绿色和无色配子体产生的cDNA,采用实时定量RT-PCR检测沉默配子体的转录产物。丰富的CRCHII.标准化为丰的Ceratopteris EF.1α基因在两个配子体群体中的表达后者在两个种群之间没有变化(图。3).在丰度的A〜7倍的降低克与绿色配子体相比,在无色的配子体中观察到转录物(图。3 b),表明沉默机制干扰了Crchli.转录或内源性的稳定性Crchli.记录。
在配子体的内源性基因沉默是可逆的和遗传
用35秒轰炸的配子型无色表型的可遗传性:通过将195个无色的雌雄同体单独放入微量滴定孔并加入水中来评估Irintcrchli,允许精子游泳并施肥鸡蛋。三周后,四类配子体,图中所示2e,2f,2g,2h中,观察到,包括那些变成了绿色和法生产的生胚(32%;图2 e);那些保持无色并产生绿色胚胎的那些(26%;图。2 f);那些仍然是无色的,并产生无色胚胎的(7%),没有发育超过图中所示的阶段2 g;和那些保持无色和不产生胚胎(35%;图2 h).许多无色的配子体形成孢子体的不可能形成孢子体,由于这些结构似乎缺乏血管内膜,运动精子或弓形症,而且可能是由于缺乏足够的光合酸盐,以支持受精后胚胎生长。每种配子体类的相对比例表明沉默的Crchli.基因在配子体中几乎同样可能重新激活或保持沉默,但往往在受精时或受精后重新激活。内源性的再激活Crchli.由无色的配子化合物的绿化反映的基因也表明了Crchli.沉默是可逆的,因此是表观遗传的。虽然无色配子体发育出的无色胚的比例较低,但它们的存在表明无色胚的沉默状态可以通过配子体发生和受精维持,并可传递给下一代孢子体。由于无色孢子体在胚胎期之后就没有发育,因此无法评估无色孢子体是否可以通过减数分裂和随后的配子体产生来维持。
定义基因沉默所需的转基因元素
发现潜在的头发销形成构建体有效地促进内源的全身沉默Crchli.该结构的组装需要两步克隆,这限制了基因功能的高通量筛选。因此,从倒置的重复内含子结构中去除了各种元素(如图所示)。1)它们诱导基因沉默的能力评估。
以确定是否沉默的内源性Crchli.基因需要启动子,35S启动子被删除,给出Δ35S:irintCrChlI;该质粒与pFF19G共轰击配子体。令人惊讶的是,35S启动子的缺失导致了高比例的无色配子体,约82%的无色和/或gus阳性配子体同时显示这两种表型(见表)1),表明无论是Crchli.DNA序列单独足以用于基因沉默,或irintCrChlI的转录,可能会发生,并促进基因沉默在不存在的植物启动子的。为了测试后一种可能性,配子体进行共轰击两个构建:在35S:irintCrChlI质粒作为用于转化的标记物;和从该35S启动子已被去除的pFF19G构建体(以得到Δ35S:GUS)。后者构建体被用作一个标记在活的有机体内在不存在的植物启动子的GUS基因的基因表达。关于无色配子体,发达国家轰击后也GUS阳性的一半(表1),尽管GUS染色的强度小于用PFF19G轰炸的配子细胞中观察到的强度(数据未显示)。没有用35秒轰炸的配子体:虹膜,缺乏GUS阅读框架的质粒(参见材料和方法)染色的GUS活动(数据未显示)。由于发现可促进的GUS构建体促进在配子体中的GUS活动,因此转录CrChl1I沉默转基因也可能发生在缺乏植物启动子的情况下。使用与这里描述的类似的无启动子沉默器结构的基因系统沉默也在被子植物中观察到[23.].
为了解决内含子的贡献,35S启动子和第二个拷贝的转基因Crchli.在配子体沉默,每个与35S启动删除:irintCrChlI然后共轰击pFF19G成配子体。在与比较结构Crchli.片段以反义方向克隆,无色、GUS阳性配子体的比例减少约28%Crchli.从35秒:Irintcrchli(35秒:坦文基地),当内含子也删除时,进一步降低了49%(给予35s:禁止伤害)(表1).在轰击抗冲击力质粒时,几乎没有无色配方化合物,其缺乏35s启动子,内含子,聚(a)+的信号和第二(有义)复制Crchli..观察到同样的趋势配子时用的轰炸Crchli.在感觉方向中克隆的片段(表1).这些结果表明,内含子在基因沉默和内含子中起着重要的,但未知的作用和35S启动子一起增强内源性基因沉默的效率。在被子植物中,内含子用于在倒置取向的基因的两个拷贝分离(如在35S:irintCrChlI构建体)也增加基因沉默的效率,尽管这是如何发生是不明[13.].
确定…的效率Crchli.沉默由未修改Crchli.的cDNA从其中Crchli.最初是衍生的,配有PAF19G加上的配子体加上Crchli.cDNA的质粒(图1).大约14%的GUS阳性配子细胞是无色的(表1),其比〜1-2%显著更大观察到以下轰击与antiCrChlI或senseCrChlI质粒也缺少35S启动子和内含子序列(表1).观察到的频率差异可能是由于差异的差异Crchli.如senseCrChlI和antirchli质粒含有393bp的cDNA插入片段,而cDNA质粒含有1.2kb的cDNA插入片段。在被子植物中观察到消音基因的长度和消音效率之间有类似的相关性[26.].
CrFtsZ和CrUrod基因沉默于配子上
轰炸配有两种额外的基因轰炸Ceratopteris.进一步检测EST文库中基因沉默作为逆向遗传工具的应用Ceratopteris.孢子体。这两个选择,CrFtsZ和CrUrod,编码氨基酸序列至少70%相同的推定蛋白质FtsZ和ur在被子植物蛋白质。这FtsZ基因编码丝状质体骨架和质体分裂环的管状成分,这是植物叶绿体分裂所必需的[27.-29.].而拟南芥有四个FtsZ基因代表在FtsZ蛋白的细胞靶向方面不同的两个基因家族[28.那30.]灭活任何家庭成员的细胞,叶绿体较少,叶绿体的细胞,一种表型应该易于想象Ceratopteris.孢子体。接下来是反向重复内含子形成的轰击CrFtsZ构造35S:irintCrFtsZ(图1),雌雄同体与每胞细胞的非轰击的配子体相比,具有每个细胞的细胞具有较大且少于每种细胞的三个叶绿体的细胞(图。4a,4b).在轰击后的三周,叶绿体的大而少的表型并不明显,这表明表型需要新的细胞分裂才能发生。由于GUS活性随时间推移而减弱,通常在轰击后三周内检测不到,GUS阳性和阳性的频率CrFtsZ沉默的表型不可能确定该基因。叶绿体形态改变的配子体也形成了浅融资,没有功能性的群组,预防受影响的雌雄同体的自我施肥(图。4摄氏度).是否是功能CrFtsZ基因产物直接或间接涉及营业的发展,而且Gametangia是未知的,但这结果表明了这一点CrFtsZ灭活也会影响Gametangia的分化和多细胞分泌的组织。
这ur基因编码一种催化尿红素蛋白III脱羧脱羧至共氟卟啉代III的酶,植物中叶绿素和血红素产生的前体[31那32].玉米植物杂合子LES22.,一个突变ur基因,叶片上出现离散的、微小的、无色的或坏死斑点,而纯合子植物的幼苗则是致命的[33].的病变LES22.杂合子从尿卟啉的积累,这是有毒的在暴露的细胞的光产生。内源性的失活Ceratopteris CrUrod基因或者预计配子体或铅的抑制生长于开发未知大小的坏死性病变配子体。的雌雄同体的约60%的共轰击用构建体35S:intantiCrUrod(图1)和PFF19G在轰击一周内开发了一种或两个离散的坏死病变(图。4d,4e)并且也GUS阳性(表1).每个病变由几个最终死亡的几个相邻的无色细胞组成。可以仅在可能在轰炸时出现的成熟配子体的细胞中检测到GUS染色。GUS阳性细胞可能在轰炸之后与35s:坦率的爆炸构建轰击,因为每个轰击前各自产生足够的Crurod蛋白,因此能够催化尿红素的脱羧。在轰击原始的轰炸后,发育病变或轰炸CrUrodcDNA质粒加上PFF19G,61%均为GUS阳性和发育病变(表1),与内含子反义结构35S:intantiCrUrod + pFF19G撞击配子体时所获得的百分率相似。
基因沉默对基因功能高通量分析的应用
我们的研究结果表明,在蕨类植物配子体中,基于DNA载体的基因沉默可以有效地使目标基因系统失活,并导致在大多数配子体中明显存在的基因特异性突变表型。虽然PTGS和RNAi已经被证明可以沉默开花植物的基因,但蕨类植物配子体作为研究基因功能的系统提供了许多技术优势。一种是,产生沉默表型的方法快速而可靠,只需要一个cDNA质粒克隆,一个生物装置和一个6天大的培养皿Ceratopteris.孢子体。由于每种配子体快速成熟并且不大于酵母菌菌落,因此可以用每个轰炸产生大量(> 100)转化和基因沉默的配子细胞,并在轰炸后一到两周内确定。因此,轰击并在为期两周的时间内轰击并测试至少500种不同的cDNA克隆,这使得该方法适用于基因功能的高通量测试。像洋葱表皮果皮一样,每种雌雄同体是一种厚的单细胞层,使表型容易观察,而不会从相邻的细胞层干涉。蕨类植物配子体的另一个技术优势是与必要基因的失活相关的致命表型,例如CrUROD因为配子体只有在从孢子中萌发后才会被轰击。通过改变轰击时配子体的年龄,可以控制在发育过程中基因沉默发生的时间。
所述方法将有助于鉴定配子体萌发后过程中涉及的基因的生物学功能,包括分生组织发育、颈卵器、精子和卵子分化、精子趋化、受精和早期胚胎发育。这些过程大多是植物配子体的特征,在开花植物中很难研究,因为配子体是嵌入在花的孢子体组织中发育的。因为金颗粒不能穿透孢子外壳,所以控制原叶体出现前过程的基因不能用本研究中描述的方法沉默。发芽、最初的细胞分裂、极性的建立以及性别的确定都发生在生长的早期。5.].最近,一种RNAi方法首先描述Marsilea Vestita[34-36应用于Ceratopteris.孢子[21.].在这项研究中,孢子的存在下孵育体外合成了与已知在萌发孢子中表达的五个基因对应的双链rna。虽然没有报道与每种处理相关的表型,但在24小时的孵育期后,将孢子与dsRNA混合显示降低稳定状态的mRNA水平。如果这种方法在产生信息丰富的表型方面卓有成效,两种技术的结合将允许在配子体发育的所有阶段检测基因功能。
结论
1)通过通过粒子轰击将转基因构建体系将转基因构建成单一细胞,可以全身抑制蕨类植物中的内源基因的表达。
2)促进的表达的DNA构建潜在的发夹 - 内含子环或反义转录物是最有效的,尽管具有无启动子的基因构建体是在配子体诱导全身性的基因沉默足够。
3)测试的三种基因的沉默(Crchli.那CrFtsZ和CrUrod)导致表型模仿其他植物的突变表型。
4)该方法为快速有效地筛选配子体表达基因的功能提供了一种有用的反向遗传工具。
方法
配子体文化和成像
的雌雄同体的她19.本研究中使用的突变体在Eberle和Banks [37].从蕨类培养基上的灭菌孢子或FM,由0.5×Ms Salts,pH 6.5组成的FM,如前所述的雌激素培养物产生雌雄同体培养物,如[37].准备轰击,悬浮在水中的孢子以每培养皿2500-3000孢子的密度铺板于60毫米培养皿中。然后将培养物置于塑料袋中,以保持高湿度,并在30℃温育。到自受精配子体,单独的处女雌雄同体置于96孔含有FM加琼脂微量滴定板的孔中;然后足够的水淹没每个配子体加入到每个孔中。电子显微镜如前所述进行[2].所有灯光摄影都是使用连接到Leica解剖显微镜的Spot II相机完成的;使用Adobe Photoshop处理图像。
配子体轰击
在使用以下轰击条件前,优化了几个参数,包括轰击时配子体的年龄、传递DNA的数量、金粒大小、破裂盘类型和生物装置中的架子位置。1.6 μm金根据制造商说明书(BioRad, CA),在使用PDS 1000 Helium系统轰打之前,用Qiagen试剂盒(Qiagen, CA)制备并包覆未经修饰的质粒DNA。配子体培养物放置在装置停止筛下9厘米的架子上;使用了1100 psi的破裂盘。接种孢子后6 d,对配子体进行狂轰滥炸,每针剂DNA递送量为0.7 μg。除非另有说明,否则对配子体进行表型评分,并对-glucuronidase (GUS)活性进行组织学染色[38]轰击后6天。在诱导的基因沉默,零假设不同的质粒构建的效率进行比较(即,基因的失活的两个不同的构建体之间的效率是相同的)通过应用测试Z.测试两个比例。
DNA结构
通过去除pFF19G上的GUS编码区,构建了一种骨架沉默DNA载体35S:irint,该载体通过内含子的分离,可以很容易地以相反的方向克隆到靶基因[39]通过消化Nru1和太平洋标准时间1并用另一种含有蓖麻籽酶内含子1的另一个替换GUS片段[40].此内含子PCR使用pIGI121Hm [扩增41]作为模板和两个适配器/底漆序列:5'cgacgaccgatctagaacatgatccctacaggta和5'tcagctgcagactagtttacagggacggacgagtcgacggttc。用PCR产物消化太平洋标准时间1和Nru然后我连接到pFF19G减GUS载体。
靶向沉默的基因被选自一个Ceratopteris.EST数据库〜3700 CDNA,产生的发芽,20小时历史孢子[21.].获得ESTs的cDNA文库的克隆载体为pCMVSPORT6 (Invitrogen, CA)。倒repeat-intronCrchli.(CR.参考C埃拉特奥里斯R.ichardii)基因沉默构建体(35S:irintCrChlI),通过PCR扩增从两个393 bp的片段制成Ceratopteris.cDNA克隆(GenBank登录号BE642494)使用引物对5'GATACGGACCGGTTCTGGCAATCCAGAGGAA和5'ATGCGGATCCAAGGCAATTGGGAATCACTG用于克隆Crchli.在感测方向,5'GacggtcgacaAggcaAttggGaatcactg和5'cgtaactagtgtttggcaatcagagaa用于克隆Crchli.在反义方向。构建了针对CrFtsZ基因(35s:Irintcrftsz)由PCR扩增两种435 BP制备CrFtsZ从一个片段Ceratopteris.cDNA克隆(GenBank登录号Be64351)使用Primer对5'CatacGGAGGGCTCTTGAGGCATGATCGGATCAGCCAAGCTGGTAAC以在感测方向上克隆,以及5'CGTAACTAGTGCTCTGAGGCCATTGAAAG和5'GACGGTCGACGGATCAGCCAAGCTGGTAAC以反义方向克隆。用感测定向PCR片段消化RSR.II加BAM嗨,克隆到骨骼沉默矢量的相同部位。所有反义取向PCR片段用Sali和Spei消化并克隆到同一位点中。通过去除791 BP制作的促进组建器Irintcrchli后III-RSR.II片段,包含增强的35S启动子。额外的Crchli.通过适当的酶切,将35S:irintCrChlI中的不同序列删除,然后对质粒进行测序,或作为中间体克隆最终的35S:irintCrChlI构建物。反义结构用来抑制内源性的CrUrod基因(GenBank登录号为BE642240) PCR扩增413 bpCrUrod来自适当的片段Ceratopteris.cDNA克隆使用引物5'cgtaactagtgctgagaAgcaccccagttc3'和5'gacggtcgacaaaAgacttgggtgcctgt3'。这萨尔我和SPE.然后I消化PCR片段,克隆到萨尔我和SPE.35S的我的网站:irint。
定量聚合酶链反应
使用RNEasy植物迷你试剂盒(QIAGEN,CA)轰击35s:Irintcrchli质粒,从80个绿色和80个无色的游戏体中分离出RNA。在d(t)存在下,使用200u superscripti逆转录酶(Invitrogen,Ca)逆转录总RNA逆转录15..然后以单链cDNA为模板,使用Applied Biosystems公司的SYBR green PCR Master Mix进行实时PCR反应。以从3个配子体中分离到的RNA量约为2ng的cDNA作为模板。反应在ABI Prism 7700机器中进行,使用默认参数和引物5'AACGAGCAGGATGTGAAATG3'和5'AACGAGCAGGATGTGAAATCG3'进行实时SYBR Green I检测。对每个模板进行四次反应,以评估阈值循环(Ct)量测量的标准偏差Crchli.绿色和无色样品中的转录本。每次测量都归一化为CrEF1α(•CT)(GenBank登录号Be642078)使用相同的放大条件和引物5'cagaccagtcggagcaaaaaagt3'和5'tcctgtgggaaggggtggaa3'的成绩单。绿色和无色配子细胞中的Crchli丰度的折叠降低等于2•(Ct).
参考
- 1。
查特吉A,鲁SJ:水蕨richardii:信令和发展的秘密揭示一个的生产模式。J工厂增长调节。2000,19:284-289。10.1007 / s003440000032。
- 2。
银行Ja,Hickok L,Webb Ma:性质表型在床蕨类植物中的编程Ceratopteris-richardii..植物营养与肥料学报,2011,29(6):723 - 734。10.1086/297135。
- 3.
Banks JA:在发育中的配子体中,角翅蕨的TRANSFORMER基因同时促进分生组织和颈卵器的发育,同时抑制精子体的发育。遗传学。1997,147:1885-1897。
- 4.
菌株E,Hass B,银行JA:对蕨类植物蕨类植物的突变进行突变的表征。遗传学。2001,159:1271-1281。
- 5.
银行JA:蕨类植物的配子体发育。annu rev植物phys。1999年,50:163- +。10.1146 / annurev.arplant.50.1.163。
- 6.
阿什拉菲K,常FY,瓦JL,弗雷泽AG,卡马斯RS,AhringerĴ,Ruvkun G:的秀丽隐杆线虫的脂肪调节基因的全基因组RNA干扰分析。自然。2003,421:268-272。10.1038 / nature01279。
- 7.
Chuance,Meyerowitz em:双链RNA在拟南芥中的特定和遗传遗传干扰。P Natl Acad Sci USA。2000,97:4985-4990。10.1073 / PNAS.060034297。
- 8.
弗雷泽AG,Kamath Rs,Zipperlen P,Martinez-Campos M,Sohrmann M,Ahringer J:通过系统RNA干扰的C.秀丽隐杆线虫染色体的功能基因组分析。自然。2000,408:325-330。10.1038 / 35042517。
- 9.
gonczy p,echeverri c,oegema k,coulson a,jones sj,copley rr,duperon j,Oegema j,brehm m,cassin e,hannak e,kirkham m,pichler s,flohrs k,goessen a,leidel s,Alleaume Am,马丁C,Ozlu N,Bork P,Hyman AA:使用染色体III基因杆菌C细胞分裂的功能基因组分析。自然。2000,408:331-336。10.1038 / 35042526。
- 10。
Maeda I,Kohara Y,Yamamoto M,Sugimoto A:通过高通量RNAi的Caenorhabdisitis的基因功能大规模分析。Curr Biol。2001,11:171-176。10.1016 / S0960-9822(01)00052-5。
- 11.
Misquitta L,佩特森BM:用于鹦鹉螺在胚胎体细胞肌形成中起作用:通过RNA干扰(RNA-i)有针对性在果蝇基因功能的破坏。国家科学院院刊美A. 1999年,96:1451至1456年。10.1073 / pnas.96.4.1451。
- 12.
Stoutjesdijk Pa,Singh Sp,Liu Q,Hurlstone CJ,Waterhouse Pa,Green AG:HPRNA介导的拟南芥FAD2基因的靶向,提供高效稳定的沉默。植物理性。2002,129:1723-1731。10.1104 / pp.006353。
- 13.
Wesley SV,Helliwell Ca,Smith Na,Wang MB,Rouse DT,Liu Q,Gooding PS,Singh SP,Abbott D,Stoutjesdijk Pa,Robinson SP,Gleave AP,Green AG,Waterhouse PM:设计高效,有效和高- 在植物中脱离基因。工厂J. 2001,27:581-590。10.1046 / J.1365-313x.2001.01105.x。
- 14.
Hannon GJ:RNA干扰。自然。2002,418:244-251。10.1038 / 418244A。
- 15.
picford AS, Catalanotto C, Cogoni C, Macino G:大脉孢霉的抑制作用。地理学报,2002,46:277-303。10.1016 / s0065 - 2660(02) 46010 - 5。
- 16.
Vaucheret H,的Beclin C,Fagard L:转录后基因在植物中沉默。J Cell SCI。2001年,114:3083-3091。
- 17.
Cogoni C, Macino G:在粗链孢霉中分离到在转基因诱导的基因沉默中受损的抑制缺陷(qde)突变体。中国科学(d辑:地球科学),1997,19(4):593 - 598。10.1073 / pnas.94.19.10233。
- 18.
Cogoni C,Macino G:Neurospora Crassa中的基因沉默需要对RNA依赖性RNA聚合酶同源的蛋白质。自然。1999年,399:166-169。10.1038 / 20215。
- 19.
Ketting RF,PLASTERK RH:C.秀丽隐杆线虫的共抑制和RNA干扰之间的遗传联系。自然。2000,404:296-298。10.1038 / 35005113。
- 20。
Mourrain P,自噬基因Beclin C,Elmayan T,费尔巴哈女,Godon C,莫瑞尔JB,Jouette d,拉孔布AM,Nikic S,PICAULT N,Remoue K,Sanial男,VO TA,Vaucheret H:拟南芥SGS2和SGS3基因所需的转录后基因沉默和天然抗病毒。细胞。2000,101:533-542。10.1016 / S0092-8674(00)80863-6。
- 21。
Stout SC,Clark GB,Archer-Evans S,Roux SJ:在单细胞模型系统中快速有效地抑制基因表达,Ceratopteris Richardii。植物理性。2003,131:1165-1168。10.1104 / pp.016949。
- 22。
Hansson A,Kannangara CG,冯Wettstein D,Hansson M:镁嵌合酶Xantha-H(42-KDA)亚基的畸形突变的半组瘤的分子基础。Proc Natl Acad Sci U S A. 1999,96:1744-1749。10.1073 / pnas.96.4.1744。
- 23。
Voinnet O,Vain P,Angell S,BaulCombe DC:通过局部引入异位启动剂DNA来启动植物中序列特异性转基因RNA降解的系统扩散。细胞。1998,95:177-187。
- 24。
Palauqui Jc,Balzergue S:通过局部引入DNA激活全身沉默。Curr Biol。1999,9:59-66。10.1016 / s0960-9822(99)80016-5。
- 25.
克里特P,洛伊恩贝格S,Iglesias的VA,Suarez的V,Schob H,Holtorf H,面包车Eeden S,Meins F:几丁质酶的基因的诱导和自发转录后沉默的接枝传输。植物J. 2001,28:493-501。10.1046 / j.1365-313X.2001.01171.x。
- 26.
klhre U, Crete P, Leuenberger SA, Iglesias VA, Meins F., Jr:高分子量rna和小干扰rna诱导植物系统性转录后基因沉默。中国科学(d辑:地球科学),2002,19(4):581 - 586。10.1073 / pnas.182204199。
- 27.
高等植物叶绿体分裂需要与细菌ftsZ基因同源的两个功能分化基因家族成员。植物学报。1998,10:1991-2004。10.1105 / tpc.10.12.1991。
- 28.
环和网络:叶绿体中FtsZ的惊人复杂性。植物科学进展,2002,7:103-105。10.1016 / s1360 - 1385 (02) 02232 - x。
- 29.
Strepp R,Scholz S,Kruse S,Speth V,Reski R:植物核基因敲除揭示了血管细胞分裂蛋白FTSZ的同源物,祖先微管蛋白的体积分裂中的作用。Proc Natl Acad Sci U S A. 1998,95:4368-4373。10.1073 / pnas.95.8.4368。
- 30.
Osteryoung KW,McAndrew Rs:Plastid Divice机器。Annu Rev植物植物植物Mol Biol。2001,52:315-333。10.1146 / annurev.arplant.52.1.315。
- 31。
Elcer GH,Roberts AG:尿布吡喃酚脱羧酶。j生物学生物师。1995年,27:207-214。
- 32。
冯维特斯坦:叶绿素生物合成。acta botanica sinica(云南植物研究),2012,28(4):593 - 598。10.1105 / tpc.7.7.1039。
- 33。
胡锦涛,yalpani n,Briggs sp,幼儿园:卟啉途径障碍是玉米显性疾病病变模拟突变体的表型。植物细胞。1998,10:1095-1105。10.1105 / TPC.10.7.1095。
- 34。
Klink VP, Wolniak SM: Centrin是Marsilea精子细胞运动器官的形成所必需的。中国生物医学工程学报。2001,12:761-776。
- 35。
克林克副总裁,Wolniak SM:RNAi技术在植物细胞骨架研究中的疗效。J工厂增长调节。2000年,19:371-384。
- 36。
蔡CW,Wolniak SM:细胞周期阻滞允许精子苹在中心蛋白的翻译而不是基体形成。J Cell SCI。2001年,114:4265-4272。
- 37.
Eberle JR, Banks JA:在角翼蕨中决定性别的基因之间的遗传相互作用。遗传学报。1996,142:973-985。
- 38.
杰弗森·雷,卡瓦坦塔,Bevan MW:GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和多功能基因融合标记物。Embo J. 1987,6:3901-3907。
- 39.
Timmermans MC,Maliga P,Vieira J,Messing J:PFF质粒:利用CAMV序列的磁带表达植物外部基因。j biotechnol。1990,14:333-344。10.1016 / 0168-1656(90)90117-T。
- 40。
Suzuki M,Ario T,Hattori T,Nakamura k,Asahi T:差异调节蓖麻豆的两个紧密连接的过氧化氢酶基因的分离和表征。植物mol biol。1994年,25:507-516。
- 41。
Hiei Y,Ohta S,Komari T,Kumashiro T:由土壤杆菌介导的水稻(Oryza Sativa L.)的高效转化和T-DNA界限的序列分析。工厂J. 1994,6:271-282。10.1046 / J.1365-313x.1994.6020271.x。
确认
我们感谢卢克Gumaelius,德鲁·舒尔茨,琥珀霍普夫和Erlinda Embuscado技术援助,有见地的讨论和帮助,采摘植物和孢子,并感谢中村兼三热情地提供pIG121Hm质粒。我们也感谢斯坦博士空肠Roux提供从在普渡大学的基因学机构中产生的EST cDNA文库。这项工作是由美国国家科学基金会和普渡大学农业研究项目的支持。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
GR制作了构造。MT进行了转基因植物的植物转化和分子分析。GR,MT和JB参与了这项研究的设计。JB构思了这项研究,参与了其设计,并与MH和MT一起起草了稿件。所有作者阅读并认可的终稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
Rutherford,G.,Tanurdzic,M.,Hasebe,M.等等。一种适用于高通量的全身基因沉默方法,在蕨类植物中基因函数的逆向遗传分析。BMC植物杂志4,6(2004)。https://doi.org/10.1186/1471-2229-4-6
已收到:
公认:
发表:
关键词
- 基因沉默
- 诱导基因沉默
- 蕨类植物粉碎片
- 镁螯合酶
- 倒置重复构建

 基因。(b)Crchli丰度的ΔCt值,标准化为EF1α,以绿色和无色的配子体。
基因。(b)Crchli丰度的ΔCt值,标准化为EF1α,以绿色和无色的配子体。