摘要
背景
植物呼吸链包含几种能量耗散酶,这些酶是II型NAD(P)H脱氢酶和替代氧化酶,哺乳动物中不存在。II型NAD(P)H脱氢酶的生理功能目前尚不清楚,对它们的应激反应知之甚少。在本研究中,马铃薯(茄属植物tuberosumL.,CV。Desiree)用抗霉素A喷洒抗霉素A,是细胞色素途径的抑制剂。NAD(P)H脱氢酶(EC 1.6.5.3)和替代氧化酶的酶容量分析在分离的叶片线粒体中。
结果
从抗霉素A处理的叶片报告了线粒体内部旋转酮不敏感NADH脱氢酶容量的特定降低。外部NADPH脱氢酶和替代氧化酶容量仍未受到治疗的影响。Western印迹显示出两个特征NAD(P)H脱氢酶同源物,NDA1和NDB1的蛋白质丰度的变化,也没有用于复合物I的两个亚基。替代氧化酶最多仅略微增加。转录水平nda1,以及一个表达的序列标签,来源于一个以前没有研究过的密切相关的马铃薯同源物,在处理后保持不变。与日常节奏调节相比nda新同源物在调查时间内显示稳定的转录水平。
结论
内部旋转酮不敏感的NADH氧化在抗霉素A治疗马铃薯叶后降低。但是,降低不是由于已知表达的变化nda基因。低NADH脱氢酶能力的一个结果可能是稳定的呼吸链减少水平,如果细胞色素和替代途径的总能力受到限制。
背景
与哺乳动物相比,植物线粒体中的呼吸链含有用于将电子从NAD(P)H转移到泛醌的替代能量耗散途径。除了旋转源敏感和质子泵送NADH脱氢酶外,植物呼吸链含有至少四种不同的旋转酮不敏感,非质子泵送NAD(P)H脱氢酶[1那2].在马铃薯块茎线粒体中,NADH和NADPH可被两种单独的Ca氧化2+内膜外表面的依赖的外部脱氢酶,一个对NADH特异,另一个相对对NADPH特异[3.].类似地,在内膜的内侧,单独的旋转酮不敏感的脱氢酶氧化基质NADH和NAD(P)H [4.-6.].植物可以进一步利用非质子泵送的替代氧化酶(AOX)(在[7.那8.])。这种酶绕过了抗霉素a敏感的质子泵送细胞色素途径公元前1复合物(EC 1.10.2.2)和细胞色素C氧化酶(EC 1.9.3.1)。
酵母和酵母中非质子泵送NADH脱氢酶的两个同源物大肠杆菌那nda1,ndb1,已在马铃薯的特征。基因产物,NDA1和NDB1分别涉及内膜的内表面[9.].呼吸链蛋白的基因表达研究表明nda1在叶片发育过程中升高,是完全光依赖性的,并在成熟的马铃薯叶中显示昼夜节律,表明NDA1在光呼吸中的作用[10.].最近,在冷胁迫后观察到NDA1转录本和蛋白的特异性下调,以及鱼藤酮内不敏感的NADH氧化[11.].
在冷效应对基因表达的影响方面,AOX比鱼藤酮不敏感的NAD(P)H脱氢酶得到了更广泛的研究。然而,AOX在冷敷治疗中有不同的反应。在低温生长过程中,烟草细胞和绿豆下胚轴的AOX蛋白和/或能力均出现上调[12.那13.],而大豆子叶或马铃薯叶片中AOX蛋白含量则不受影响[11.那13.].
几份报告描述了通过用抗霉素A,抑制剂的抗霉素A治疗诱导替代途径的诱导公元前1复杂的。AOX蛋白以及酶活性,抗霉素治疗后烟草和喇叭菌细胞增加[14.那15.].抗霉素治疗也会导致对转录水平的上调AOX.基因在烟草细胞悬浮和拟南芥叶子(16.那17.].反过来,拟南芥用高浓度的抗霉素A处理的细胞仅显示AOX蛋白的轻微增加。相反,观察到柠檬酸循环的蛋白质的降解或降低,复合物I的两个亚基和ATP合酶复合物的一个亚基的亚基[18.].其他报道的抗霉素A的作用是烟草悬浮细胞和豌豆原生质体中ATP的减少,以及后者中光合氧进化的减少[14.那19.].
体外抑制抑制Hansenula是和大鼠心脏公元前1在半醌依赖的过程中,抗霉素A复合物导致活性氧(ROS)的数量升高[20.那21.].植物中已经进行了一致的观察[2那22.].有人提出,抑制剂诱导的电子传输链的减少增加了RO的形成,并且可以通过AOX减少这种效果[23.那24.].与添加抗霉素A的野生型细胞相比,AOX的过表达导致转基因烟草细胞悬浮液中的较少量的ROS [25.].因此,AOX的上调可能弥补了被抑制的细胞色素途径中泛素氧化能力的下降。这可以稳定泛素库的减少水平,并可能阻止ROS形成的增加[23.那24.那26.].
到目前为止,还没有进行过类似的实验来研究鱼藤酮不敏感的NAD(P)H脱氢酶对抗霉素A的反应。在这里,我们报道了抗霉素a处理马铃薯叶片中鱼藤酮不敏感NADH氧化能力的特异性下降,并讨论了呼吸链氧化还原状态的可能后果。
结果
抗霉素a处理的叶片线粒体内鱼藤酮不敏感的NADH氧化能力较低
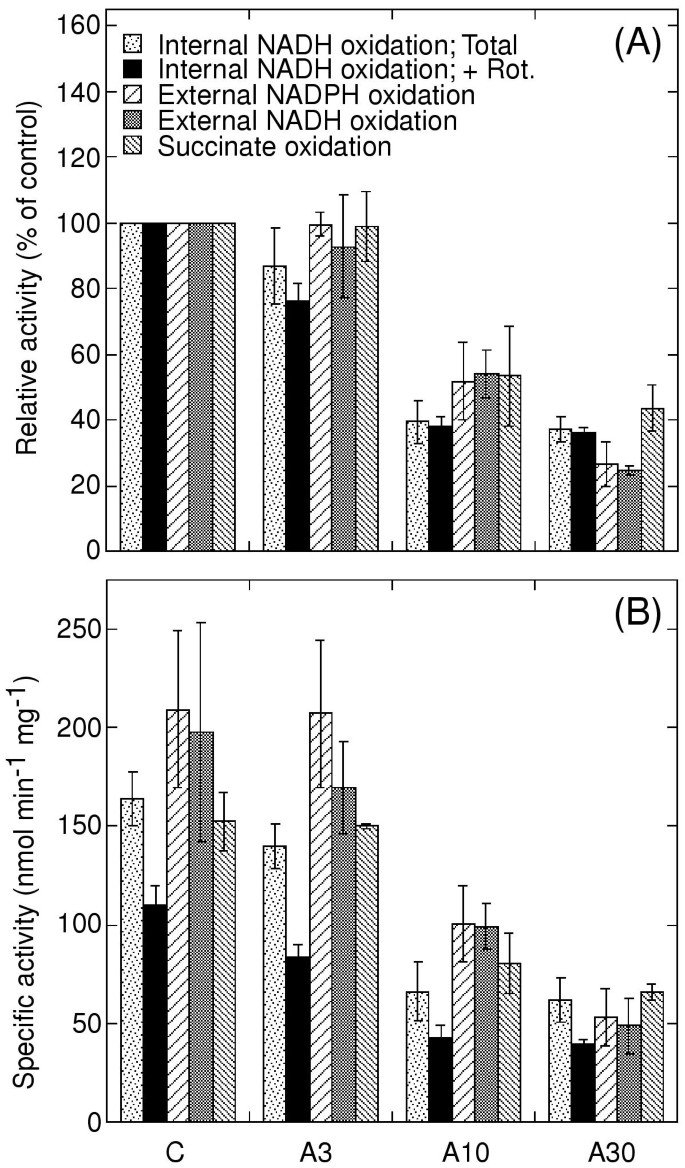
在马铃薯植株上喷施不同浓度的抗霉素A或以溶剂作对照。各处理均不致死性强,但抗霉素a喷施10 d后叶片出现坏死病变。抗霉素A浓度越高,病变越丰富(数据未显示)。喷施24小时后,从叶片中分离出线粒体。检测完整线粒体的NAD(P)H和琥珀酸氧化,以及渗透破裂后的内部NADH氧化以渗透内膜。研究发现,与对照叶片相比,抗霉素a处理后的叶片线粒体中鱼藤酮不敏感的NADH氧化活性显著降低,与琥珀酸和外部NAD(P)H相比,抗霉素a处理后的叶片线粒体对NADH氧化活性的影响更大。1).在3 μM抗霉素A处理后,NADH对鱼藤酮不敏感的氧化速率较低,在30 μM处理后,活性约为对照的38%。与溶剂对照相比,鱼藤酮不敏感NADH氧化在3 μM抗霉素A下的降低有统计学意义(P < 0.05)。
泛醇氧化受高抗霉素A的叶处理限制
外部NADH和NADPH氧化的活性基本上高于内部旋转酮不敏感的NADH氧化(图。1).在两种情况下用10和30μm抗霉素A治疗叶片,在隔离线粒体中的降低率降低。然而,与对照相比,外部NAD(P)H氧化活性在3μm抗霉素A中保持不变。用琥珀酸盐作为底物观察类似的结果(图。1).
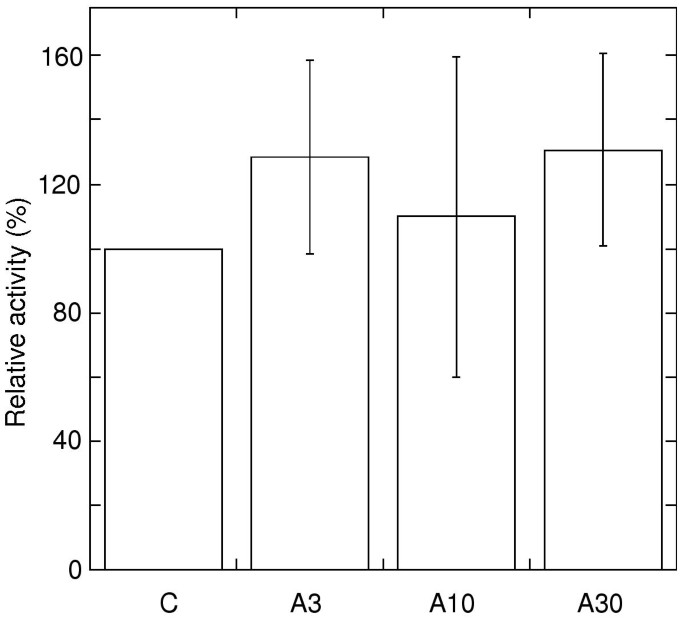
Since all other enzymes potentially capable of catalysing NAD(P)H oxidation to short chained quinone analogues, (e.g. complex I and dihydrolipoamide dehydrogenase), are located inside the inner membrane permeability barrier, external NADPH dehydrogenase can be measured directly using decyl-ubiquinone (DcQ) as acceptor. This activity is also independent of the capacity of enzymes further downstream in the electron transport chain. Fig.2表明,NADPH氧化在分离的线粒体中的DCQ主要不受叶霉素A的叶子处理影响。在实验之间的活动有所不同,但归一化平均值允许结论是由于抗霉素叶治疗而发生的外部NADPH脱氢酶容量没有降低。细胞色素的活性C氧化酶,位于下游公元前1复合物,在线粒体中类似于对照和抗霉素A处理的叶片(数据未显示)。
以DcQ为电子受体外氧化NADPH.Ca存在下NADPH脱氢酶活性2+和抗霉素A在每个试验中的比例作为对照。没有Ca则没有活性2+加入反应中。误差条表示标准差(N= 2)。对照活动是315和479 nmol nadph min-1毫克-1在两个实验中。样品如图所示。1.
结果表明,在线粒体中在活的有机体内抗霉素处理的叶片,外部NAD(P)H氧化活性受脱氢酶下游的另一种组分的限制。然而,在渗透地破坏线粒体中测量的内部旋转龙内不敏感的NADH氧化显然不受这种方式受到限制。在加入旋转晶酮之前测量的总内部NADH氧化为比旋转源不敏感组分高1.5-1.7倍(图。1B.),表明有足够的喹啉氧化能力,使得鱼藤酮不敏感率主要取决于脱氢酶能力。虽然外部的NAD(P)H氧化活性更高,因此更有可能受到下游抑制的影响,这些活动受到影响的程度要小于内部rotenone-insensitive NADH氧化后叶治疗3和10μM抗霉素a .因此可以得出结论,在线粒体内部rotenone-insensitive NADH氧化的低利率从叶子处理3和10μM抗霉素a是由于较低的脱氢酶而10 μM和30 μM处理后NAD(P)H氧化能力下降是由于抑制了泛素氧化的结果。
抗霉素在马铃薯叶中治疗诱导AOX容量
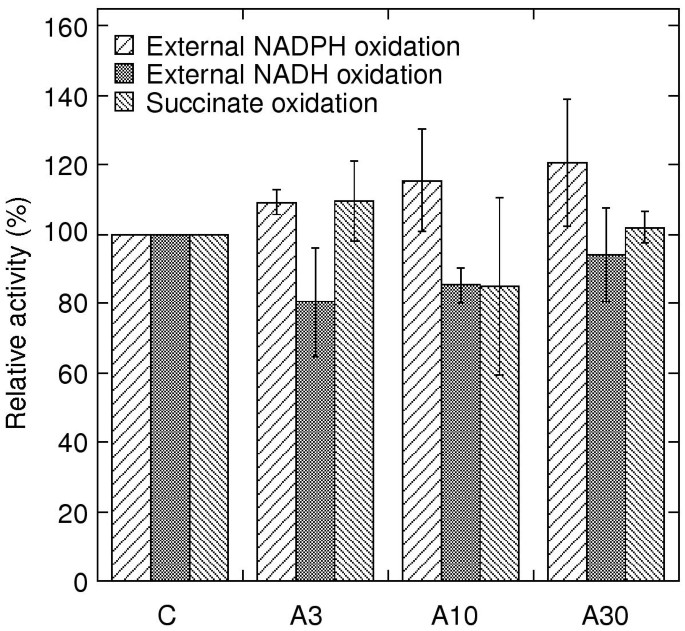
为了确定AOX的能力,通过向反应介质中加入抗霉素A完全抑制细胞色程途径活性。无花果。3.总结抗霉素后的速率,用琥珀酸盐和外部NAD(P)H作为底物添加。从抗霉素A处理的叶片和控制叶片之间的线粒体在线粒体之间没有看到AOX容量的差异。用30μm抗霉素治疗,速率完全不敏感体外添加抗霉素A(数据未显示),表明高度体内公元前1在这种浓度下复杂抑制。
替代途径活动.在DTT和丙酮酸存在的情况下,测定了抗霉素a对NADPH、NADH和琥珀酸的不敏感氧化,以确保最大速率。在每个实验中,呼吸链活动以对照活动的百分比显示。对照活性分别为:12、52和59 nmol NADPH min-1毫克-1;25、40和57 nmol NADH min-1毫克-1;或60和52 nmol琥珀酸盐min-1毫克-1在独立实验中。在加入抗霉素a和水杨羟肟酸后,琥珀酸的氧化速率被修正为较小的氧化速率;3-6和7-10 nmol O2闵-1毫克-1分别用于控制/A3和A10/A30。样本和误差条如图所示。1,其中给出了相应的总呼吸速率(细胞色素路径加上替代路径)。
基因表达的nda抗霉素后的型基因治疗
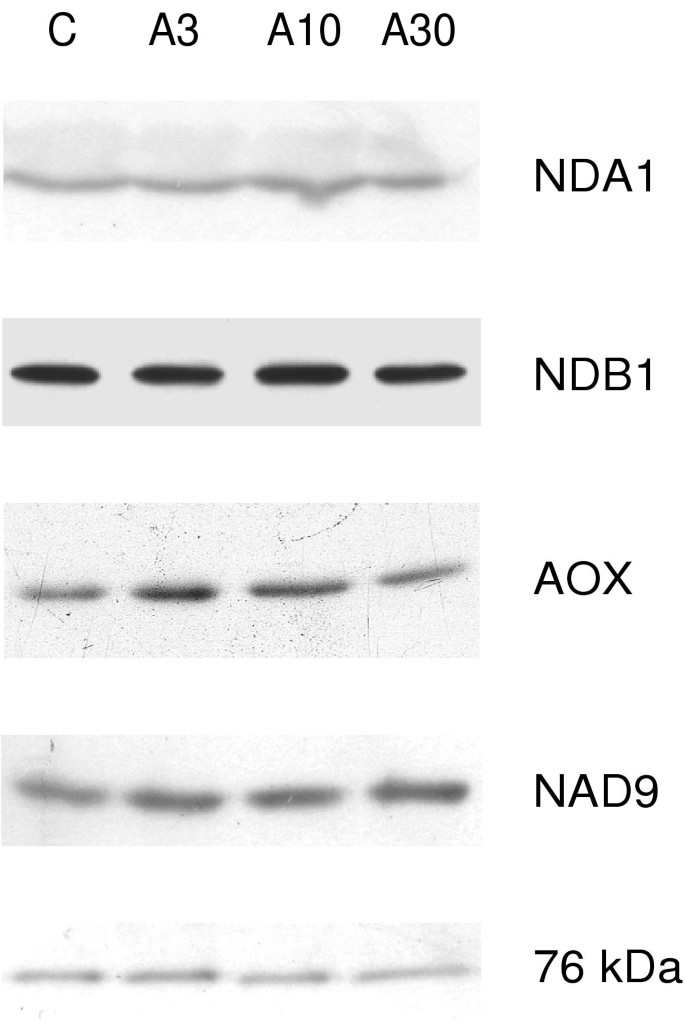
通过western blotting分析分离的叶片线粒体,研究抗霉素A处理是否对呼吸链酶的蛋白质丰度有影响。针对NDA1和NDB1的抗血清分别特异性识别48 kDa和61 kDa的蛋白,正如之前在分离的马铃薯叶片线粒体中看到的那样[27.].然而,络合物的NDA,NDB和NAD9和76 kDa亚基的免疫功能象存在于络合物中的治疗和对照之间没有显着变化(图。4.).在两个实验中,在叶片处理3和10 μM抗霉素a后,AOX均有轻微增加。4..在第三个实验中,这种增长是看不到的。这些结果表明,抗霉素A处理马铃薯叶片后,AOX蛋白可能略有升高。
呼吸链蛋白的西方分析.从对照和抗霉素A喷涂植物纯化马铃薯叶线粒体。在每个车道中加载了20μg线粒体蛋白。分析的蛋白质为右侧。对于NDA,NDB和复杂的I亚基,显示了来自3个代表实验的污点。对于AOX,描绘了最高诱导的实验。样品如图所示。1.
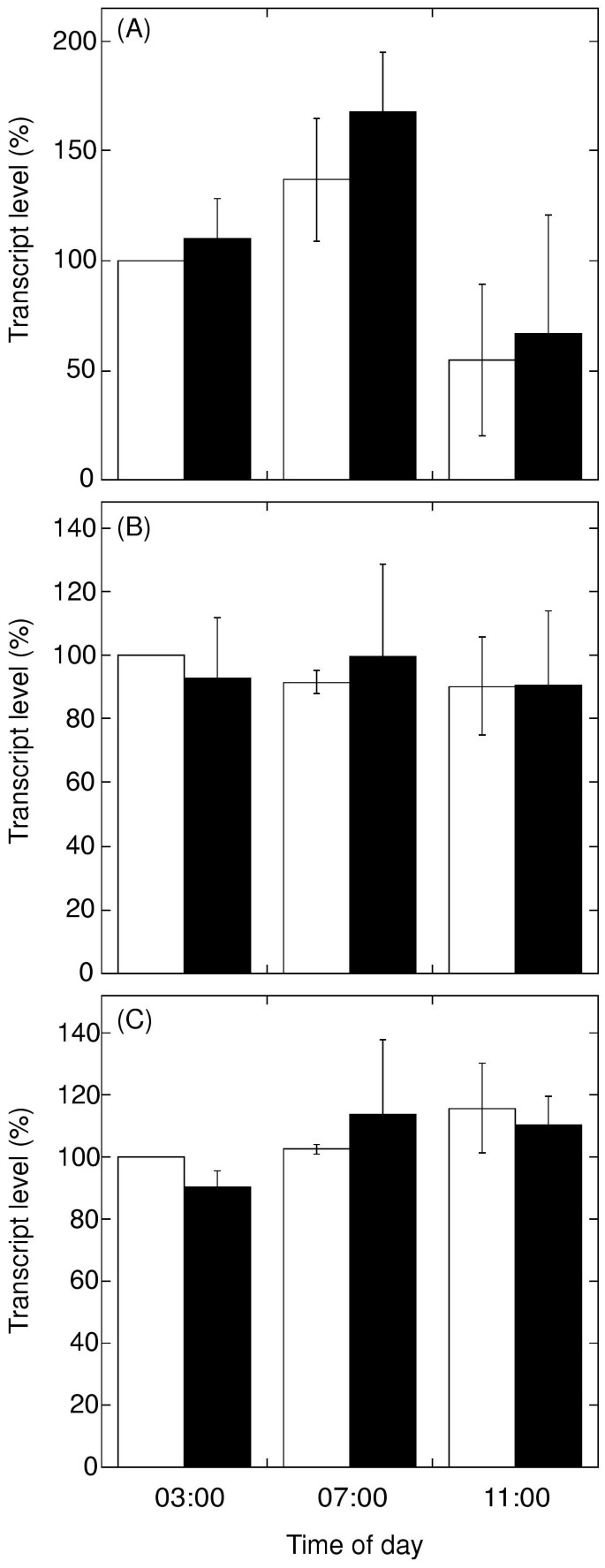
由于抗体对不同同工酶的检测不同,基因表达也不同nda使用实时PCR系统在转录物水平上另外分析1。在亮起之前喷洒植物1小时(03:00 h)和叶记录水平nda在治疗时(03:00),在4小时(07:00 h)和8小时(11:00 h)后量化。抗霉素治疗既不影响水平nda在一天的这段时间,转录本的表达也没有日变化(图。5A).复合物I 28.5 kDa亚基的转录本在所有分离株中相似(图2)。5C).在另一项实验中,总RNA从用于线粒体纯化的相同叶子材料中分离出来。没有明显的变化nda在喷涂0,3,10和30μm抗霉素A(未显示的数据)后,1转录物量24小时。
为了研究马铃薯中是否存在其他nda型蛋白,我们搜索了表达序列标签(EST)数据库。利用马铃薯NDA1蛋白全长序列查询tiger和GenBank马铃薯EST数据库。唯一高度显著的评分条目是EST contig TC54504,长度为1547 bp。该contig由6个重叠的ESTs组成,其中3个覆盖了一个与NDA1氨基酸序列高度相似的区域。下游部分,由单个EST 156H09 (BI406197)组成,与数据库的内含子注释相比,似乎包含未剪接的内含子序列nda型基因确定拟南芥[28.].这些被排除在比较之外。在两两序列比对中,TC54504的222残基长翻译与马铃薯NDA1蛋白序列的同源性为72%。与马铃薯NDB1相比,在216个残基重叠处仅43%的氨基酸序列同源,说明TC54504来源于一个nda类型的基因。推测的TC54504蛋白序列包含两个高度保守的核苷酸结合基序,与其他植物同源物相似[9.].
为了看抗霉素叶片处理对TC54504 mRNA有任何影响,实时PCR为NDA1进行。TC54504的叶转录水平(图。5B.)揭示了治疗和对照之间mRNA丰富的变化。此外,观察到TC54504表达的时间依赖性变化。
讨论
抑制抑制公元前1与对照叶片线粒体相比,抗霉素A处理的马铃薯叶片复合物导致离体线粒体内鱼藤酮不敏感NADH氧化能力显著降低(图2)。1).3 μM抗霉素A处理后,叶片对鱼藤酮不敏感的NADH氧化显著降低,只有在较高浓度的抗霉素A处理下,才降低了对NAD(P)H和琥珀酸的氧化(图2)。1),这很可能是由于在电子传递链下游的细胞色素通路受到抑制物诱导的速率限制。然而,在使用最高浓度的抗霉素A时,可能会发生对电子传递酶的其他非特异性损伤。
用于抗霉素A治疗影响呼吸链酶的能力在活的有机体内,抑制了公元前1复杂应该发生。抑制公元前1- 使用外部NAD(P)H作为底物,用10μm抗霉素A叶处理后,在分离的线粒体中观察到叶片治疗后观察到的分离线粒体。(图。1).因此,3 μM抗霉素A处理后也会有一定的抑制作用,但未见明显抑制作用。然而,底物氧化测量可能低估了控制线粒体的喹啉氧化能力,从而低估了叶处理的抑制作用。另外,抗霉素A可能在分离过程中从线粒体中丢失,特别是由于分离培养基中含有高浓度的牛血清白蛋白,它能有效地结合疏水分子。也有人认为抗霉素A在细胞中被降解[14.].因此,是短暂的,局部的公元前1可能发生了复杂的抑制在活的有机体内3 μM抗霉素A处理后,鱼藤酮不敏感的内源性NADH脱氢酶活性降低(图2)。1).较低的东西体外内部NADH脱氢酶的能力应反映较低在活的有机体内酶的能力,它可能限制电子进入呼吸链。
AOX容量没有上调后在活的有机体内抗霉素A处理马铃薯叶片时,AOX蛋白含量不变或略有增加(fig .;3.和4.).这与其他物种的研究结果相反,在其他物种中,AOX蛋白的数量和容量是被诱导的,例如烟草和矮牵牛花细胞悬液[14.那15.].在拟南芥植物,叶子喷洒10μm抗霉素A特别增加AOX.1A转录性丰富,但其他AOX.基因则不受影响[17.].但是,抗霉素治疗拟南芥细胞仅略微诱导AOX蛋白,可能是因为对照中已经存在了大量的蛋白质[18.].同样在本研究中,AOX蛋白浓度可能足够高以补偿一个在活的有机体内细胞色素途径的限制。或者,αox表达的调节在马铃薯中可能与其他研究的物种不同。关于温度降低对AOX表达的影响的物种之间存在变化。低生长温度导致烟草悬浮细胞中含氧蛋白质水平和酶容量[12.]但在大豆中没有看到效果[13.或马铃薯叶[11.],其中AOX蛋白和容量不受冷治疗影响。
总的来说,在能力上的短暂或持久的限制公元前1复合物和由抗霉素A处理引起的AOX容量不变,可能导致更高在活的有机体内泛素池的还原状态。一个由过度还原引起的次级效应可能是电子传递链中ROS产量的增加[2那26.].purvis和棚子[23.]假设,当NAD(P)H脱氢酶的电子流超过细胞色素途径的能力时,AOX可以阻止ROS的形成。我们的研究结果表明,在限制泛素氧化的情况下,通过减少泛素生成,降低鱼藤酮内不敏感的NADH氧化能力,可防止过度还原,并可能防止ROS的生成。与此一致的是,冷处理降低了鱼藤酮内不敏感NADH的氧化能力[11.]这是一种应力,作为其后果之一导致ROS形成[29.].在拟南芥细胞,氧化应激和抗霉素A治疗导致络合物I的76和24kDa亚基的蛋白质丰度,其可以通过旋转源敏感的NADH氧化限制泛醌还原[18.].然而,在马铃薯中,抗霉素A喷叶对76 kDa和NAD9复合体I亚基的蛋白质水平没有影响。4.),表明复合I的能力不会因此处理而降低。
除了ROS的产生,抗霉素A的其他副作用也有报道。在烟草悬浮细胞中可以看到较低水平的ATP [14.]和豌豆叶肉原生质体中,抗霉素a应用后,由于线粒体电子运输受损,这些原生质体的光合作用氧演化也较低[19.].在治疗细胞和原生质体之后观察到这些效果比在本研究中较低浓度的抗霉素a。因此,对ATP水平的类似后果,也会导致代谢变化,不能在本调查中排除。还已知抗霉素A可以抑制叶绿体中的光系统I周围的循环电子传输[30.].在剥离下表皮的叶盘上施用5 μM抗霉素A后,可以看到对循环电子运输的直接影响,导致叶绿体中ATP生成的降低[31.].另一项研究表明,应用于原生质体的1 μM抗霉素A不影响光合电子传递[19.].在这两个研究中,与完整叶片的治疗相比,必须预期更有效的抑制剂摄取。在本发明的研究中,已经在3μm抗霉素A中施加到具有完整表皮的叶片的3μm抗霉素A的内部旋转酮不敏感NADH氧化的影响(图。1).因此,在这个浓度下,不太可能直接抑制叶绿体中的电子传递。
内鱼藤酮不敏感的NADH氧化能力较低(图。1两者都不相关nda1转录水平(图1)5A),也不与免疫检测的NDA蛋白量(图。4.),两者都没有受到治疗的影响。一种可能的解释是,内部的NADH氧化是在酶水平上直接调控的,或者是土豆中存在着鱼藤酮不敏感的NADH脱氢酶基因,这一基因尚未被发现。以前认为NDA1是一种内部NADH脱氢酶的观点是基于蛋白质定位、生物信息学以及基因表达和活性的相关性[9.-11.那32.].此外,两种密切相关的nda型线粒体蛋白在拟南芥[33.[并强烈建议NDA1 / NDI1是内部NADH脱氢酶的进口和突变实验[34.].
在本研究中,潜在地衍生的马铃薯EST-CONTIG(TC54504)nda数据库搜索发现了型基因。先前的研究表明,土豆中可能存在至少一种额外的NDA同工酶,基于蛋白质和诱导期间的活性水平之间的相关性[10.],以及不同器官免疫识别的NDA蛋白分子质量的差异[27.].近日,在-nda1和 -nda2、两个与马铃薯密切相关的基因nda1、被发现在拟南芥[28.].在-nda与At-相反,1表现出对光的依赖nda2.在我们的研究中,与TC54504相对应的马铃薯基因的转录本丰度不受抗霉素A处理的影响(图)。5B.).另外,而且金额nda1 .如之前报道的那样,一天的文字记录各不相同[10.TC54504转录性丰度在调查的时间内是稳定的。需要进一步的实验来确定TC54504是否源于与光无关的nda基因。
结论
这项调查表明了这一点在活的有机体内抗霉素治疗马铃薯叶子明确降低了呼吸内旋转酮的能力不敏感的NADH氧化(图。1).近年来,下调鱼藤酮内不敏感NADH氧化和nda1在冷胁迫马铃薯叶片中表达[11.].缺席的情况下nda本研究中的抑制表明,在这两项研究中,控制鱼藤酮不敏感NADH氧化的方法不同。鱼藤酮不敏感的内部NADH氧化和/或nda先前的研究表明,基因表达会因叶片发育、一天的时间、光照和低温处理而发生变化[10.那11.].考虑到影响植物中AOX表达的信号种类繁多[8.],这可能是一些尚未发现的外部线索影响植物线粒体NAD(P)H脱氢酶。
无论是寒冷压力[11.[抗霉素A治疗(图。3.和4.)似乎显著影响了马铃薯的AOX能力,表明马铃薯与其他研究植物在呼吸链调节方面存在差异。本研究强调,AOX和鱼藤酮不敏感的NAD(P)H脱氢酶在应激反应中的相互作用应引起更多的关注。
方法
植物材料,植物处理和线粒体的分离
马铃薯植物的叶子(茄属植物tuberosumL.,CV。Desiree)用于所有实验。温室在20-25°C和40-70%相对湿度下生长4-5周。对于在冬季生长的植物,光周期为16小时,额外的光(04:00-20:00h),得到300μmolm-2年代-1.夏季,自然光补充有12小时的额外光(04:00-10:00,14:00-20:00 h),以提供300μmolm的相同光条件-2年代-1.每处理3株叶片喷施0.01% (v/v) Tween-20的抗霉素a溶液,体积约为每株50 ml。对照植株喷0.01% Tween-20。为防止根系吸收,在喷施时用铝箔覆盖土壤。为了分离线粒体,在喷洒24小时后采集40 g叶片材料,在4°C、5 L蒸馏水中缓慢搅动,以去除任何外部持久的洗涤剂或抑制剂,广泛清洗叶片至少5分钟。线粒体从树叶中纯化,主要根据[35.],冷冻液体n2在5%二甲基亚甲醚的存在下,并储存在-80℃。使用牛血清白蛋白作为标准用双子胆酸法(Sigma)测定蛋白质浓度。
酶的活动
使用amincoDW 2双波长分光光度计在340nm下测量NAD(P)H的氧化,基本上如[10.].反应培养基(medium A)含有0.3 M蔗糖、10 mM MOPS、0.5 mM EGTA、2.5 mM MgCl2/KOH (pH 7.2)和0.4 μM羰基氰化物对(三氟甲氧基)苯腙(FCCP)。为了验证AOX在耗氧过程中的最大活性,还原剂DTT (20 μM)和5 mM丙酮酸存在于反应过程中。线粒体(约16 μg)与二硫苏糖醇(6-7 mM)在冰上预孵育10分钟,然后将线粒体加入检测。首先加入100 μM NAD(P)H和1 mM CaCl2.抑制公元前1络合活性测定AOX容量,加入0.375 μM抗霉素A。用1mm水杨酸羟肟酸抑制AOX。
为了测量内部NADH氧化,预孵育与DTT的线粒体蛋白质在2-3 MOSM的低渗透压培养基(1mM MOPS,0.1mM EGTA,pH 7.2)中孵育6分钟,以破坏内膜[36.那37.].然后补充悬浮液以补充培养基,另外5mM丙酮酸含量,并通过加入100μmnadh开始反应。内部旋转酮不敏感的NADH氧化在15μm旋转酮的存在下测量。旋转源敏感性敏感活性被确定为差异加上旋转旋转酮。
在含有0.375 μM anti - ycin A的A培养基中,以DcQ作为最终电子受体,测定NADPH氧化反应。约1.5 μg线粒体蛋白与20 μM DcQ孵育,加入100 μM NADPH和1 mM CaCl开始反应2.
用氧电极(Rank Brothers, Cambridge, UK)在25°C下测量琥珀酸氧化的耗氧量。培养基含0.3 M蔗糖,5 mM MOPS, pH 7.2, 5 mM KH2宝4.,2.5 mm mgcl2、10 mM丙酮酸、250 μM ATP、10 mM琥珀酸和0.4 μM羰基氰化物对(三氟甲氧基)苯腙。线粒体与6-7 mM二硫苏糖醇预孵育10分钟,最终检测浓度为130 μM。通过添加0.375 μM抗霉素A和1 mM水杨酸来测定AOX容量。活性被重新计算成琥珀酸的消耗,使用每O的2琥珀酸的因子2分子。
苹果酸脱氢酶(EC 1.1.1.37)活性和线粒体潜伏量如[38.].细胞色素C氧化酶活性如[39.].
使用SPSS Win 8.0.0软件包(SPSS Inc., Chicago, Ill.)对酶活性数据进行统计分析,采用单因素方差分析(P > 0.05)。
西方分析
用于活动测量的相同线粒体制剂根据[40],而western则如[41.].针对NDA1和NDB1的抗血清在[10.那27.].抗的78 kDa亚基抗体检测到复合物I的76 kDa亚基神经孢子仓库[42.]如[1].综合体的NAD9亚基通过针对小麦同源物的抗体识别[43.]和AOX的单克隆抗体针对玉米蛋白[44.].抗血清以1:1000稀释。抗体检测由ECL系统可视化(Amersham Life Science Ltd, Little Chalfont, Bucks, UK)。
数据库筛选和转录本分析
通过Tblastn算法进行额外的NDA型基因的筛选[45.]使用马铃薯NDA1蛋白质序列作为针对TEGR独特基因指数数据库的探针[46.]国家生物技术信息中心的EST - 子集[47.].在SIM中进行了成对序列比对[48.]在[49.].
RNA制备、cDNA合成及实时PCR扩增,详见[11.].对TC54504进行实时PCR,共45个周期,每个周期分别为95°C 20 s、60°C 30 s、72°C 45 s和84°C 20 s(数据采集)。针对TC54504的两个重叠序列EST536929和156H09设计了特异性引物对,避免了序列变异区域:5'-TGC TGA ACC AGT TAC CCA GA-3';5' -tct TCC gaa atg CCT gga g-3 '。通过酶切验证了扩增产物的正确性质。进行了一个没有反转录的对照,以证明基因组DNA的污染不会扰乱cDNA模板的定量。
参考文献
- 1。
Rasmusson AG, Heiser V, Zabaleta E, Brennicke A, Grohmann L:植物线粒体复合物I的生理、生化和分子方面。生物化学学报,1998,32(4):591 - 598。10.1016 / s0005 - 2728(98) 00021 - 8。
- 2.
Møller IM:植物线粒体与氧化应激:电子传递、NADPH转换和活性氧代谢。植物营养与肥料学报。2001,22(3):581 -591。10.1146 / annurev.arplant.52.1.561。
- 3。
植物线粒体电子传递链上存在2个外部NAD(P)H脱氢酶的直接证据。2 .中国科学院大学学报(自然科学版)。10.1016 / 0014 - 5793 (95) 01059 - n。
- 4。
MøllerIM,Palmer JM:在植物线粒体内膜内表面上存在旋转酮抗性NADH脱氢酶的直接证据。physiol植物。1982,54:267-274。
- 5。
Rasmusson Ag,MøllerIM:NAD(P)H脱氢酶在内部线粒体膜的内表面使用内外排列颗粒研究。physiol植物。1991,83:357-365。10.1034 / J.1399-3054.1991.830305.x。
- 6。
Melo AMP, Roberts TH, Møller IM:两种鱼藤酮不敏感的NAD(P)H脱氢酶存在于马铃薯块茎线粒体内膜内表面的证据。中国生物化学学报,1996,12(6):593 - 598。10.1016 / 0005 - 2728(96) 00068 - 0。
- 7.
替代氧化酶:从基因到功能。植物营养与肥料学报。1997,19(4):491 - 498。10.1146 / annurev.arplant.48.1.703。
- 8.
Millenaar FF,Lambers H:替代氧化酶:体内调节和功能。植物生物学。2003,5:2-15。10.1055 / s-2003-37974。
- 9.
Rasmusson AG,Svensson AS,Knoop V,Grohmann L,Brennicke A:酵母和细菌旋转酮的同源物在较高真核中的酵母和细菌旋转酮不敏感NADH脱氢酶:马铃薯线粒体中存在两种酶。工厂J. 1999,20:79-87。10.1046 / J.1365-313x.1999.00576.x。
- 10.
Svenssonås,Rasmusson AG:马铃薯叶呼吸链中蛋白质的轻质基因表达。工厂J. 2001,28:73-82。10.1046 / J.1365-313x.2001.01128.x。
- 11.
SvenssonÅs,约翰逊Fi,Møllerim,拉斯莫森AG:冷应力降低了马铃薯叶中呼吸道NADH氧化的能力。费用。2002,517:79-82。10.1016 / s0014-5793(02)02581-4。
- 12.
Vanlerberghe GC,McIntosh L:较低的生长温度增加烟草中的替代途径能力和替代氧化酶蛋白。植物理性。1992,100:115-119。
- 13。
Gonzàlez-Meler MA, Ribas-Carbo M, Giles L, Siedow JN:生长和测量温度对替代呼吸途径活性的影响。植物生理学报。1999,20(4):765-772。10.1104 / pp.120.3.765。
- 14。
烟草细胞色素和替代途径呼吸的协调调控。植物生理学报。1992,100:1846-1851。
- 15.
王志强,王志强,王志强:抗霉素a对矮牵牛花细胞线粒体呼吸链组成的影响。植物生理学报,1997,19(6):637 - 642。
- 16。
线粒体电子传递对核基因表达的调控。烟草氧化酶替代基因的研究。植物营养与肥料学报,1994,21(4):457 - 461。10.1104 / pp.105.3.867。
- 17。
Saisho D,Nambara E,Naito S,Tsutsumi N,Hirai A,Nakazono M:来自拟南芥的替代氧化酶的基因家族的特征。植物mol biol。1997,35:585-596。10.1023 /答:1005818507743。
- 18.
研究表明:氧化应激对拟南芥线粒体的影响。植物学报,2002,32:891-904。10.1046 / j.1365 - 313 x.2002.01474.x。
- 19.
Padmasree K,Raghavendra As:氧化电子传输在氧化磷酸化上优化豌豆(Pisum Sativum L.)中的光合作用的氧化磷酸化。physiol植物。1999年,105:546-553。10.1034 / J.1399-3054.1999.105321.x。
- 20.
Minagawa N,Koga S,Nakano M,Sakajo S,Yoshimoto A:超氧化物阴离子可能参与汉莫马拉汉莫纳抗氰化物抗性的诱导。费用。1992,302:217-219。10.1016 / 0014-5793(92)80444-升。
- 21.
来自线粒体复合物III的超氧化物:锰超氧化物歧化酶的作用。生物医学进展。2000,29:170-180。10.1016 / s0891 - 5849(00) 00338 - 5。
- 22.
Rich Pr,Bonner Wd:高等植物线粒体中超氧化物阴离子一代的遗址。拱生物学生生物糖。1978,188:206-213。
- 23。
植物抗寒性研究进展[j]。植物科学学报。1993,88:712-718。10.1034 / j.1399-3054.1993.880426.x。
- 24。
Wagner AM, Wagner MJ:植物细胞中体内泛素减少水平的测量。植物营养与肥料学报,1995,21(4):427 - 434。
- 25。
Maxwell DP,Wang Y,McIntosh L:替代氧化酶降低了植物细胞中的线粒体反应性氧产物。Proc Natl Acad Sci USA。1999,96:8271-8276。10.1073 / pnas.96.14.8271。
- 26。
Millenaar FF,Benschop Jj,Wagner Am,Lamber H:替代氧化酶在稳定泛喹酮池的体内还原状态和替代氧化酶的激活状态方面的作用。植物理性。1998,118:599-607。10.1104 / pp.118.2.599。
- 27。
植物中鱼藤酮不敏感的NAD(P)H脱氢酶:线粒体中天然蛋白的免疫检测和分布。植物生理与化学学报。2001,39(4):457 - 466。10.1016 / s0981 - 9428(01) 01334 - 1。
- 28。
Svensson ÅS:植物呼吸性NAD(P)H脱氢酶-对光和冷反应的基因鉴定和表达。博士论文。隆德大学细胞与生物学系;2002。
- 29。
Wise RR:冷却增强光氧化——在光下冷却时产生的活性氧的产生、作用和研究。照片合成技术,1995,45:79-97。
- 30.
细胞色素在叶绿体循环电子传递途径中的作用。生物化学学报,1999,547:138-148。10.1016 / 0005 - 2728(79) 90102 - 6。
- 31.
Joët T, Cournac L, Horvath EM, Medgyesy P, Peltier G:叶绿体ndhB基因失活诱导抗霉素A的光合敏感性增加。NADH脱氢酶复合物参与光系统循环电子流的证据I.植物生理学。2001,125:199 -1929。10.1104 / pp.125.4.1919。
- 32.
Michalecka Agnieszka M.,Agius Stephanie C.,Møller伊恩M.,Rasmusson Allan G.:通过转基因Nicotiana Sylvestris过表达鉴定线粒体外部NADPH脱氢酶。工厂J. 2004,37:415-425。10.1046 / J.1365-313x.2003.01970.x。
- 33.
Michalecka Agnieszka M.,SvenssonÅ。员工,Johansson Fredrik I.,Agius Stephanie C.,Johanson Urban,Brennicke Axel,Binder Stefan,Rasmusson Allan G.:编码线粒体II型NAD(P)H脱氢酶的拟南芥基因具有不同的进化原因并显示出明显的光反应。植物理性。2003,133:642-652。10.1104 / pp.103.024208。
- 34.
拟南芥线粒体内非磷酸化NAD(P)H脱氢酶AtNDI1的鉴定。植物生理学报。2003,33(4):492 - 498。10.1104 / pp.103.029363。
- 35。
Boutry M,Faber Am,Charbobnier M,Briquet M:植物线粒体合成产品的微分分析:检测与细胞质雄性不育相关的变体多肽。植物mol biol。1984年,3:445-452。
- 36。
Fredlund Km:NAD(P)H植物线粒体中的脱氢酶。博士论文。1996年,隆德大学植物生理系。
- 37。
Douce r,Mannella,Bonner Wd:完整植物线粒体的外部NADH脱氢酶。Biochim Biophys Acta 1973,292:105-116。
- 38。
Møller IM, Lidén AC, Ericson I, Gardeström P:不同极性亚线粒体粒子的分离。甲安非他明酶1987,148:442-453。
- 39。
Rasmusson Ag,MøllerIM:利用植物线粒体基质中利用酶的NADP利用酶。植物理性。1990,94:1012-1018。
- 40.
Laemmli UK: T4噬菌体头部组装过程中结构蛋白的切割。自然。1970,227:680-&。
- 41.
Moos M,Nguyen Ny,Liu Ty:电泳分离电和转移到惰性载体的蛋白质的可再生高产序列。J Biol Chem。1988年,263:6005-6008。
- 42.
Friedrich T, Hofhaus G, Ise W, Nehls U, Schmitz B, Weiss H:在氯霉素处理的粗链孢霉(Neurospora crassa)中,无线粒体编码亚基的NADH:泛素氧化还原酶(Complex I)的小亚型。中国生物化学杂志,1989,19(4):417 - 418。
- 43.
Lamattina L,Gonzalez D,Gualberto J,Grienberger JM:高等植物线粒体编码核编码30-KDA亚基的同源物,牛线粒体综合体I. j jiochem。1993年,217:831-838。
- 44.
高等植物线粒体替代氧化酶的单克隆抗体。植物生理学杂志。1989,89:1311-1317。
- 45.
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ: gap BLAST和psp -BLAST:新一代蛋白质数据库搜索程序。核酸研究。1997,25:3389-3402。10.1093 / nar / 25.17.3389。
- 46.
TIGR基因指数。基因组研究所,[http://tigrblast.tigr.org/tgi/].
- 47。
- 48。
黄新强,王志强,王志强:一种高效的线性空间局部相似算法。应用数学学报,1994,12:337-357。
- 49。
蛋白质序列的SIM - 对准工具。[http://www.expasy.org/tools/sim-prot.html].
致谢
Drs。e.e Elthon,内布拉斯加州大学林肯分校,美国NE, T. Friedrich, Albert-Ludwigs Universität,德国Freiburg, J. M. Grienenberger, Université,法国斯特拉斯堡路易斯-巴斯德,因慷慨捐赠抗体而被公认。我们也感谢荷兰瓦赫宁根大学的Jacqueline Postma博士在统计方面的帮助,以及丹麦Risø国家实验室的Ian M. Møller博士对手稿的建设性意见。这项调查得到了Carl Tryggers Stiftelse、Carl Tesdorpfs Stiftelse和瑞典环境、农业科学和空间规划研究委员会的支持。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
DAG在手稿的实验、解释和起草中发挥了重要作用。FIJ参与了西方的分析和解读。ÅSS参与设计、前期实验及协调。AGR参与了稿件的设计、协调、解读和撰写。所有作者阅读,修改和批准的手稿。
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
地方检察官,约翰逊,f.i.s, Svensson, Å.S。等等。抗霉素A治疗可降低马铃薯叶中的呼吸内旋转型纳米氧化纳扎能力。BMC植物BIOL.4,8(2004)。https://doi.org/10.1186/1471-2229-4-8
收到了:
公认:
发表:
关键词
- 叶治疗
- 替代氧化酶
- NADH氧化
- 循环电子传递
- 土豆离开