抽象的
背景
即使在植物中检测到儿茶酚胺(多巴胺,去甲肾上腺素和肾上腺素),它们的作用记录不佳。最近对马铃薯植物的脱辛植物过度表达酪氨酸脱羧酶的相关性,介于介导儿茶胺合成第一步骤的酶,终止酚和淀粉浓度之间的相关性。渗透胁迫,脱落酸治疗和伤口后,最近最近的Norebinphrine水平显着增加。因此,儿茶酚胺可能通过调节初级碳代谢,可能通过与动物细胞中类似的机制来发挥植物应激反应中的作用。从迄今为止,没有在植物中鉴定出在植物中被鉴定出一种与编码人的多巴胺受体(HD1)的cDNA转化的马铃薯植物。
结果
通过对转基因植株块茎的分析,发现介导蔗糖向淀粉转化的关键酶(adp -葡萄糖磷酸化酶和蔗糖合酶)和蔗糖合成酶(蔗糖磷酸合酶)的活性发生了变化,导致可溶性糖和淀粉含量发生变化。令人惊讶的是,在转基因植物中检测到的儿茶酚胺水平显著升高;其原因尚不清楚。然而,受体的存在对酶活性的影响范围比植物过表达酪氨酸脱羧酶大量积累去甲肾上腺素所影响的范围更广。因此,外源受体的存在可能激活了植物儿茶酚胺cAMP信号通路。
结论
我们的数据支持儿茶酚胺可能参与调节植物碳代谢通过cAMP信号通路。
背景
儿茶酚胺(多巴胺,去甲肾上腺素和肾上腺素)是具有具有取代的3,4-二羟基苯基环的一组生物胺,其在动物王国中普遍存在;但它们也被植物检测到[1,2].儿茶酚胺在植物中的作用记录不佳,但很明显,他们参与了增长和发展的许多方面。他们被提出为各种生物碱的前体[3.,4并与乙烯产生、固氮、防御食草动物、开花、防止3-吲哚乙酸(IAA)氧化和赤霉素信号转导等过程有关[5,6].与儿茶酚胺刺激糖原动员的动物细胞类似,儿茶酚胺在调节植物碳水化合物代谢方面也有类似的作用。酪氨酸脱羧酶是儿茶酚胺合成的重要环节,转基因植物过表达酪氨酸脱羧酶后,去甲肾上腺素和可溶性糖浓度显著升高,而淀粉含量则显著降低。观察到的变化表明去甲肾上腺素与可溶性糖正相关,与淀粉负相关[7].儿茶酚胺在动物细胞中的生理作用是通过与g蛋白偶联受体的相互作用来刺激或抑制腺苷酸环化酶(AC)。在大多数动物细胞中,环磷酸腺苷(cAMP)通过激活cAMP依赖的丝氨酸-苏氨酸蛋白激酶(PKA)发挥作用。最近,有强有力的证据表明cAMP在高等植物中的发生和功能[8].研究表明,烟草亮黄2 (TBY-2)细胞中cAMP水平与细胞周期进程密切相关[9].中cAMP的赤霉素和脱落酸行动的参与也有人建议[10.,11.].分子证据已显示植物蛋白激酶的含有PKA [高度序列同源性的存在12.].此外,分子技术还鉴定了cAMP反应元件结合蛋白(CREBs) [13.],环核苷酸门控阳离子通道[14.]和cAMP结合酶[15.].这些数据强烈表示儿茶酚胺在调节植物碳水化合物代谢中,可能是通过类似于动物细胞中的机制。然而,该建议受到迄今为止在植物中鉴定出不含儿茶酚胺受体的事实的限制。在本研究中,我们将马铃薯植物表征用编码人多巴胺受体(HD1)的cDNA转化。受体是446个氨基酸,七个跨膜结构域和49kDa的分子量的罗多蛋白酶样的整体膜蛋白。我们的分析显示HD1对碳水化合物代谢的调节作用,包括关键酶活性的变化。
结果
转基因植物的选择
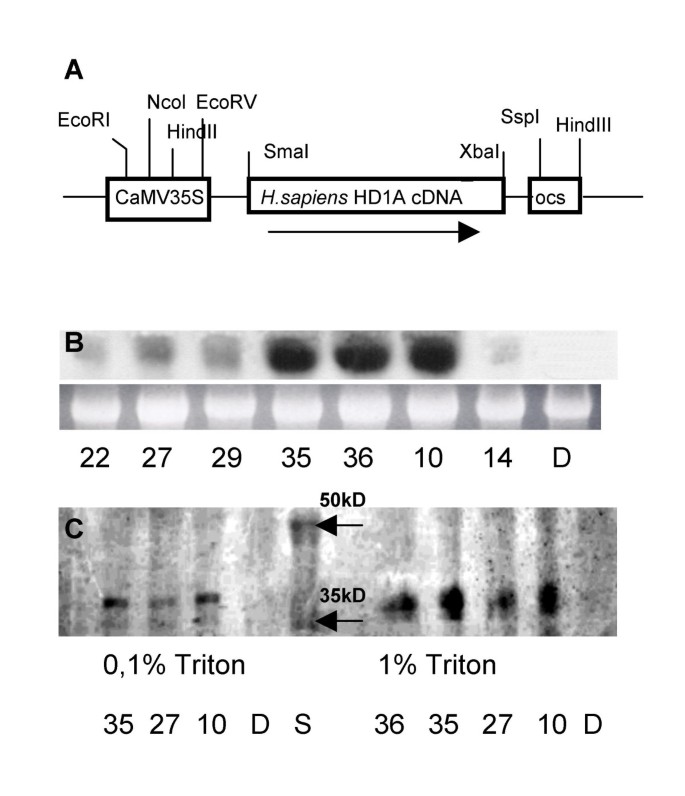
Solanum Tuberosum.pHD1-BinAR质粒在CaMV 35S启动子的控制下携带人类多巴胺受体的cDNA(图)1A),用新霉素磷酸转移酶(卡那霉素)基因引物进行PCR筛选,然后用northern blot分析筛选一种HD1特异性cDNA作为探针(图1B.).选择4个预期长度(1300 bp) mRNA表达量最高的转基因株系(HD1.10、HD1.27、HD1.35和HD1.36)进行western blot分析。利用市售兔IgG抗hd1抗体在转基因植物中检测到a ~ 37kda蛋白条带。在控制工厂中没有(图1C).令人惊讶的是,该蛋白比预期的小约10 kDa,这可能表明翻译后修饰。仔细检查cDNA序列,发现存在两个翻译信号(232 bp和313 bp),分别产生40 kDa和37 kDa蛋白。然而,由于翻译机制在植物和动物中非常相似,我们认为短形式的受体是蛋白质水解作用的结果,而不是从头合成。需要指出的是,HD1表达信号较强时,伴随着较强的蛋白信号(品系HD1.10;HD1.35;HD1.36)。相反,在HD1弱表达的植物中,蛋白信号相对较弱(HD1.27系)。1%Triton提取HD1蛋白的效率明显高于0.1%Triton提取HD1蛋白的效率,与预期HD1蛋白的膜定位一致。
表型分析
在田间生长的HD1植株的块茎在4个月后收获并进行分析。所有被检测的转基因株系每株产生更多的块茎。由于块茎数量的增加伴随着块茎重量的减少,因此产量变化不显著1).野生型Desiree与HD1植株地上部分形态无明显差异。
儿茶酚胺水平
为了建立一种简便、可靠的植物中儿茶酚胺的定量和定性分析方法,最近对气相色谱-四倍质谱联用(gc - ms)的适用性进行了研究。建立了一种灵敏的基于三甲基硅烷基儿茶酚胺衍生物分析的气相色谱质谱分析方法,用于监测这些化合物和相关代谢物的存在和浓度。根据标准品的保留时间和质谱,可以清楚地检测到多巴胺、去甲肾上腺素和一种新的化合物去甲肾上腺素在马铃薯叶片和块茎中的存在[2].
与之前对植物过表达酪氨酸脱羧酶的研究相比[7],其控制合成儿茶酚胺的一个重要步骤,我们工作的目标是通过将人多巴胺受体刺激的替代信号传导途径。令人惊讶的多巴胺受体的表达导致所有转基因品系检查(多巴胺,去甲肾上腺素和去甲变肾上腺素的两个以上的倍的增加图2B.).的儿茶酚胺含量此增加伴随酪胺和L-DOPA的显著增加,这是多巴胺的前体直接(图2A).尽管儿茶酚胺及其前体的浓度发生了变化,但作为酪胺和左旋多巴前体的酪氨酸的水平没有变化(数据未显示)。
转基因植物块茎中碳水化合物含量的测定
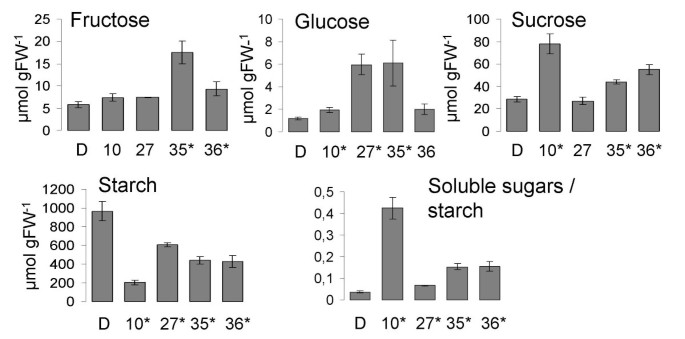
在我们最近发现多巴胺和去甲肾上腺素在马铃薯中的作用是淀粉动员,我们决定分析表达多巴胺受体的转基因块茎,用于可溶性糖和淀粉含量。所有转基因植物显示出降低的淀粉含量,水平范围为野生型的20%至60%。与desiree相比,这伴随着从2.7到1.15折叠的可溶性糖浓度的显着增加(图3.).淀粉和可溶性糖浓度高度相关。儿茶酚胺含量和葡萄糖,蔗糖,果糖的水平和淀粉之间所计算出的相关系数分别为0.38,0.69,0.38和-0.95。
在碳水化合物的变化最有可能负责转基因HD1块茎的改变的表型。减少块茎质量可通过减少淀粉含量而增加块茎数由可溶性糖浓度的增加来解释。
蔗糖-淀粉代谢
在正常生长条件下,马铃薯块茎碳代谢的主要途径是蔗糖通过磷酸己糖转化为淀粉[16.].
由于HD1植物的特征在于改变了可溶性糖和淀粉的浓度,因此我们测量了该途径中涉及的酶活性的活性。从叶片运输的蔗糖从韧皮肌互动下卸下,并通过蔗糖合成酶(Susy)降解。ADP-葡萄糖磷酸化酶(AGPase)将葡萄糖-1-磷酸盐(Glu-1-P)转化为ADP-葡萄糖,是淀粉的即时前体。Susy和AgPase都被认为是淀粉合成的关键酶[17.].
HD1植株的AGPase和SuSy活性显著降低,分别为野生型水平的56%和68%(图1)4).在与他们的淀粉合成的作用,以及他们提出的协调监管协议,这两种酶和淀粉含量的影响均显著相关(COR> 0.9)。
葡萄糖磷酸(PGM)催化葡萄糖-1-磷酸的葡萄糖-6-磷酸的转化。块茎通过葡萄糖磷酸的胞质和质体同种型的存在表征。任他们的镇压导致植株下降指出酶的重要性,淀粉积累淀粉水平[18.,19.].PGM的活性在所有转基因系中显著下降,最有可能有助于在淀粉合成的减少(图4).参与蔗糖 - 淀粉转化(六酮酶,UGPase和淀粉合酶)的其他酶的活性不会显着变化(图4).(表在大多数转基因系淀粉抑制合成的伴随着增加的己糖-6-磷酸2).
为了确定是否增强的淀粉动员也有助于所观察到的淀粉含量下降,我们测量了淀粉磷酸化酶的活性。在4个转基因株系中,有2个株系的淀粉磷酸化酶活性显著提高,进一步导致HD1植株淀粉含量降低(图)4)
此外HD1表达导致蔗糖磷酸合成酶(SPS),负责蔗糖生产的激活。最大SPS活性(王氏饱和底物,测得的Vmax)仅在两行改变,而包含限制性底物浓度(的Vmax /公里)在测定中测得的酶的活性并因此1 /公里中的所有行增加。
1/Km,与转基因块茎中蔗糖含量(cor -0.81)相关性较好4).
糖酵解/三羧酸循环
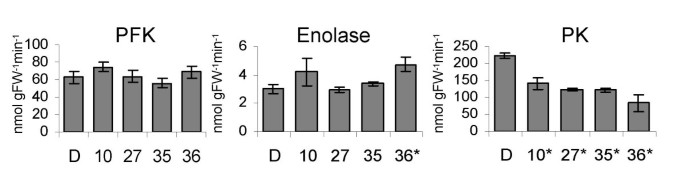
在HD1植物测量的高浓度的葡萄糖和GLC-6-P的指示在糖酵解途径的变化。然而,糖酵解酶(己糖激酶,磷酸果糖激酶和烯醇化酶)的活性没有改变。唯一的例外是丙酮酸激酶,其表现出活性的所有转基因品系一个显著下降(图5).研究这种活动的减少是否导致碳代谢的变化通过TCA循环我们测量了TCA中间体的含量。在所有转基因中,柠檬酸,异键酸和苹果酸盐显着降低,而富马酸盐显示出显着增加(表2).
讨论
与儿茶酚胺在哺乳动物中的作用和作用的广泛知识相比,儿茶酚胺在植物中的生理意义却知之甚少。由于动物儿茶酚胺信号通路的大部分成分(g蛋白、cAMP、PKA同源物)也已在植物中被鉴定出来,儿茶酚胺参与植物信号通路是可能的。近年来,通过对过度表达酪氨酸脱羧酶的转基因植物进行分析,发现其在儿茶酚胺中积累了大量的酪氨酸脱羧酶。儿茶酚胺增加导致淀粉浓度降低,但可溶性糖增加[7].
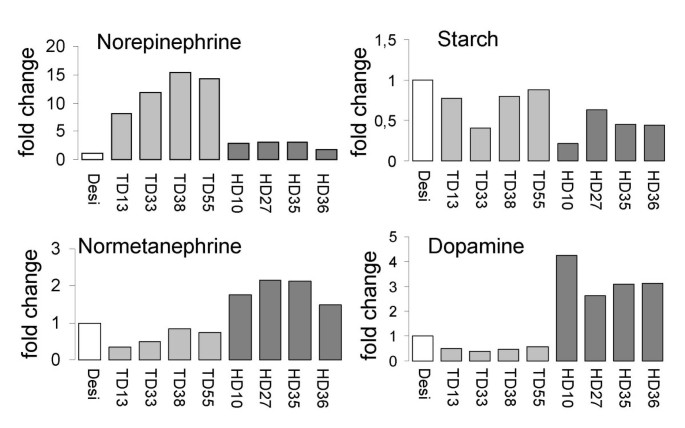
哺乳动物儿茶酚胺信号通路中至今尚未在植物中发现的唯一成分是儿茶酚胺受体。我们用编码人类多巴胺受体(HD1)的cDNA转化马铃薯植株,以分析受体的存在是否影响内源性儿茶酚胺的作用。Western blot分析表明该蛋白在转基因植株中产生,转基因块茎的生化分析显示其碳水化合物代谢和碳水化合物含量发生了巨大变化。令人惊讶的是,儿茶酚胺的含量也发生了变化。需要指出的是,与植物过表达酪氨酸脱羧酶相比,那些表达人多巴胺受体的植物,其特征是所有已知的管状儿茶酚胺(多巴胺、去甲肾上腺素和去甲肾上腺素)的增加。去甲肾上腺素含量与可溶性糖呈正相关,与淀粉呈负相关,认为去甲肾上腺素是去甲肾上腺素转化的产物。儿茶酚胺含量的增加伴随着其前体酪胺和L-DOPA的增加,表明生物合成途径的上调,分别由酪氨酸脱羧酶和酪氨酸羟化酶介导。很难解释人类受体的表达如何触发一个积极的循环,从而增强儿茶酚胺的合成和周转。比较植物过表达酪氨酸脱羧酶(TD)和人表达多巴胺受体的块茎碳水化合物水平是一项有趣的研究。在这两种情况下,淀粉含量都显著下降,HD1植株的下降幅度(从40%到80%)大于TD植株的下降幅度(从12%到60%),尽管TD植株的去甲肾上腺素含量较高(图)6).在TD植物中的去甲肾上腺素的含量比HD1植物高约四倍。
因此,我们认为外源受体激活了马铃薯中儿茶酚胺的作用。淀粉生物合成中酶的活性存在差异。HD1和TD植株的蔗糖水平相当,与SPS活性增强一致。TD和HD1植株的淀粉磷酸化酶活性均显著升高,但AGPase、SuSy和PGM活性仅在HD1植株中降低。
马铃薯中HD1的表达(Solanum Tuberosum.)导致碳代谢的改变
先前报道的儿茶酚胺水平与可溶性糖含量与淀粉水平的负相关性,以及在储存在4°C的蒸馏物中的土豆块的淀粉水平的淀粉水平的负相关性[2,7,在我们的研究中也发现了。多巴胺受体的表达导致儿茶酚胺含量增加,淀粉水平降低,葡萄糖、果糖和蔗糖含量增加。似乎引入的多巴胺受体激活了碳水化合物代谢中的儿茶酚胺作用。现在的问题是,儿茶酚胺是激活淀粉分解还是抑制其合成,还是这两个过程都受到影响。
在哺乳动物系统中,肾上腺素和去甲肾上腺素通过刺激糖原动员和抑制糖原合成来调节糖原转化术。在马铃薯中出现类似,HD1块茎中的淀粉含量下降是抑制淀粉合成和增强的淀粉动员的结果。AGPase和Susy,参与淀粉生物合成的两个关键酶,分别在其活性下降了44%和32%。PGM的活性也显着降低;我们尚未确定不同同种型(细胞溶质和塑性)对观察到的变化的贡献。六糖-6-磷酸酯的含量增加表明,直接抑制AGP酶,而不是基材短缺可能导致淀粉合成的抑制。或者,增加的己糖磷酸含量可能是由于含有升高的儿茶酚胺水平的淀粉降解增加。这是由四种转基因系中两种中淀粉磷酸化酶的活性增加。抑制淀粉合成和己糖磷酸盐的积累伴随着蔗糖合成的增加。应考虑两个因素。 First, that SPS is subject to allosteric activation by Glc-6-P and inhibition by Pi. Second, elevated catecholamine content led to a decrease of SPS Km suggesting increase of the enzyme catalytic activty. Sucrose phosphate synthase has many potential sites of phosphorylation and three of them were shown to influence its catalytic activity. In spinach leaf, phosphorylation of Ser 158 is responsible for enzyme downregulation in darkness, phosphorylation of Ser 229 enables binding of 14-3-3 proteins and down- regulates the enzyme whereas phosphorylation of Ser 424 under stress conditions stimulates SPS activity. There is a growing body of correlative evidence that the potato tuber SPS is regulated in an analogous manner to the leaf enzyme [20.].
由于14-3-3蛋白的水平在任何转基因株系中都没有改变(数据未显示),因此,这表明针对胁迫位点的酶磷酸化是HD1植物中14-3-3蛋白活性增强的原因。
在哺乳动物中,肾上腺素和去甲肾上腺素的作用是由参与糖原动员和合成的酶磷酸化介导的。最近的研究报道了淀粉代谢酶(支链淀粉合成)受蛋白质磷酸化调控的直接证据,并表明蛋白质磷酸化在控制淀粉合成和分解代谢中发挥了更广泛的作用[21.].因此,儿茶酚胺在植物中的作用可能也涉及淀粉代谢相关酶的磷酸化。
儿茶酚胺 - 植物中的新胁迫激素?
在哺乳动物系统中,儿茶酚胺作为应激激素,随着压力的增加而增加。为了观察植物是否会发生类似的反应,对马铃薯植株的叶片进行损伤,分别在损伤前和损伤后5、10和13分钟测定儿茶酚胺水平。尽管数据不同,但多巴胺、去甲肾上腺素和去甲肾上腺素的浓度有一致的上升趋势[2].最近,在受ABA和水分胁迫处理的马铃薯叶片中也发现了类似的去甲肾上腺素的增加。酪氨酸羟化酶(1.5和1.7倍)和酪氨酸脱羧酶(2.33和1.2倍)活性均增加[22.].在正常生长条件下,马铃薯块茎碳代谢的主要途径是蔗糖通过磷酸己糖转化为淀粉[16.].在环境扰动像伤人[23.,24.]水应力[25.,高温[26.]和缺氧[27.,28.]这种平衡受到干扰,因此,发生了块茎代谢物水平的大变化。升高的温度或水胁迫导致呼吸增加,3-磷酸糖(3PgA)的下降,抑制作用,因此抑制淀粉合成。淀粉减少伴随着通过蛋白磷酸化增加的己糖酰化水平和SPS激活而引起的蔗糖合成的刺激。Susy的活性降低,而淀粉动员则提出增加。这些碳水化合物代谢和碳水化合物含量的变化与在HD1植物中观察的那些相似,使其可以想到通过调节肿瘤初级碳代谢来说,儿茶酚胺可能在植物应激反应中发挥作用。
结论
将人道的多巴胺受体引入植物细胞可能是有争议的,但获得的数据可以证明我们的方法的价值。
在HD植物中,调节马铃薯块茎碳代谢的关键酶的活性发生了巨大的变化,导致淀粉含量急剧下降,但蔗糖含量增加。儿茶酚胺、初级碳代谢和应激之间的关系似乎是可能的。我们推测,与动物细胞的情况类似,土豆中HD1的表达导致cAMP介导的信号通路的激活。这一点可以从马铃薯植株表达人类多巴胺受体的另一亚型HD2的结果中得到支持。与HD1相比,HD2受体在动物细胞中不影响腺苷酸环化酶的活性。
同样,表达HD2的植物在碳水化合物代谢方面没有变化(数据未显示)。下一步显然是进一步研究我们的植物的激酶活性和cAMP水平。与此同时,我们也在努力识别一种植物多巴胺受体。
方法
植物材料
土豆植物(Solanum Tuberosum.L. cv。从“Saatzucht Fritz Lange Kg”(Bad Schwartau,Germany)获得的Desiree在16小时内(22°C)和8小时黑暗(15°C)制度下的土壤中培养。植物在单个盆中种植并每天浇水。对于分析,从30日龄温室生长的植物中午收获了叶子,并在组织培养植物转移到温室后3个月收获块茎。
转基因植物的构建
人类1.3 kb的SmaI, XbaI cDNA编码HD1(由Marc G.Caron提供(杜克大学医学中心);[EMB: XX55760])),在35S CaMV启动子和Nos终止子的控制下,在意义方向上连接到植物二元载体的同一限制位点。向量被引入农杆菌肿瘤术菌株C58C1:pGV2260,通过限制性内切酶分析验证质粒的完整性。野生型马铃薯幼叶马铃薯l .(简历。德西蕾)被转化农通过浸入细菌悬浮液中的叶子外植体。农接种后的叶片外植体转移到愈伤组织诱导培养基和芽再生培养基上。利用各自的磷酸转移酶(卡那霉素抗性)基因引物进行PCR筛选,然后以HD1特异性cDNA片段作为探针进行northern blot分析筛选。
Northern blot分析
用盐酸胍法从冷冻植物材料中制备总RNA。经过电泳(1.5% (w/v)琼脂糖,15%甲醛(w/v)), RNA转移到尼龙膜(Hybond N, Amersham, UK)。在含有7% SDS、1%牛血清白蛋白(BSA)和1mm EDTA的250 mmol磷酸钠缓冲液(pH 7.2)中,在42℃下杂交过夜。用放射性标记的全长cDNA作为杂交探针。过滤器在含0.5% (w/v) SDS的1 × SSC中,在65°C(高度严格条件)或在相同的缓冲液中,但在42°C(中等严格条件)下洗涤3次,30分钟。
免疫印迹分析
蛋白从冷冻的植物材料用提取缓冲液E(100毫摩尔的Hepes-NaOH调节pH为7.4,10毫摩尔MgCl萃取2,1mM的EDTA,1mM的EGTA,20%甘油(V / V),0.5毫摩尔PMSF,70毫β-巯基乙醇)与0.1%或1%或者补充TritonX- 100(V / V)。如先前所述进行HD1基因的表达通过蛋白质印迹分析使用兔IgG抗HD1蛋白的手段的评估。简单地说,溶解的蛋白在12个%SDS凝胶上运行聚丙烯酰胺(W / V)并电泳印迹到硝酸纤维素膜(施莱谢尔和Schuell)上。转移后,将膜依次用封闭缓冲液(5%(重量/体积)奶粉)一起孵育,然后用抗体针对HD1蛋白(1:2000稀释)。如先前所述进行形成和免疫复合物的检测[28.].碱性磷酸酶 - 缀合的山羊蚁兔IgG在稀释1:1500时用作二抗。
淀粉和可溶性糖含量的测定。
马铃薯块茎片和叶盘用80%乙醇-50 mM HEPES KOH, pH 7.4, 80℃提取。上清液用于葡萄糖、果糖和蔗糖的酶解分析[29.].对于淀粉测量,提取的植物材料在0.2N KOH中均化,并在95℃温育后用1N乙酸将其调节至pH5.5。淀粉用淀粉葡糖苷酶水解,酶酶促测定释放的葡萄糖。
组织提取儿茶酚胺含量测量
冷冻植物组织(400 mg)用液氮粉末状,用甲醇提取(每克4 ml)-1鲜重),在70℃下加热15分钟,并离心(5分钟,12000克)。将样品与水至50%甲醇浓度稀释并用氯仿(1:1 V / V)萃取。水相的一部分在真空下干燥并用于衍生化[2].将利比醇作为内标直接添加到样品匀浆中(30 μg g)-1鲜重)。
GC - MS分析
将干燥的提取物在吡啶/甲氧氧氧嘧啶(20mg mL)中温育-1),然后在37℃下与n -甲基- n -三甲基硅基三氟乙酰胺(MSTFA)衍生酸性质子,反应90 min。2 μl样品用于分析[2].使用HP四极杆质谱分光光度计(HP 5972A),气相色谱仪HP 6890和自动进样器(全德国惠普公司),配备30 m HP - 5MS,熔融石英毛细管柱。注入温度为230℃,界面设置为250℃,离子源调整为180℃。所使用的载气为氦气,其流速恒定为1ml min-1.温度程序在70℃下5分钟等温加热,然后用5℃每分钟-1烘箱温度上升至310℃,并在310℃下最后1分钟的加热。该系统然后温度在70℃下一个样品的注入之前先平衡6分钟。质谱是在2个扫描小号记录-1具有m/z 50 - 600的扫描范围。使用德国惠普公司的MSD ChemStation程序对色谱和质谱进行评估。以多巴胺、去甲肾上腺素、去甲肾上腺素、左旋多巴、酪胺、酪氨酸(Sigma)为标准。回收样品中添加多巴胺、去甲肾上腺素、去甲肾上腺素、左旋多巴、酪胺和酪氨酸;加样回收率分别为80、93、85、95、82、90%。以下离子用于定量:利比妥307;319年,左旋多巴218;267;368年,多巴胺174;338; 426, norepinephrine 174; 355, 514, normetanephrine 174; 297; 456, tyramine 174; 264; 338, tyrosine 218; 280, 354. The amounts of catecholamines were determined from the ratio of peak areas of catecholamines to peak area of the internal standard (ribitol).
酶活性样品的制备和分析
组织收获,称重并在液氮中迅速冷冻2.将0.5g±0.1g组织在含有30mM Hepes-NaOH,pH6.9,10mM DTT,1mM MgSO的2mL萃取缓冲液中的冷冻砂浆中均化。4,0.5mM的EDTA,0.5%(W / V)BSA和0.5%(W / V)在4℃下的PVP。将匀浆在16000克离心10分钟,并使用Sephadex G-25柱将上清液脱盐。使用以下公布的方法测定酶活性;SPS [30.];AGPase [31.];Susy,PK [32.];的PGM (33.];淀粉合成酶(34.];PGI,烯醇酶35.];UGPase [36.];己糖激酶[37.]和淀粉磷酸化酶,如[38.].
3.9。统计分析
t检验使用嵌入Microsoft Excel的算法进行。当P < 0.05时,使用显著性术语。
参考文献
- 1。
Smith TA:植物中的苯乙胺及其相关化合物。植物化学。1977,16:9-16。10.1016 / 0031 - 9422(77) 83004 - 5。
- 2。
SzopaĴ,WilczyńskiG,Fiehn O,Wenczel A,Willmitzer L:识别与在马铃薯植物的儿茶酚胺定量(马铃薯)通过GC-MS。植物化学。2001,58:315-320。10.1016 / s0031-9422(01)00232-1。
- 3。
异喹啉生物碱。生物碱和硫化合物。植物生物化学方法。编辑:Watermann PG, Dey PM, Harborne JB。伦敦,学术出版社;1993年,8:373 - 419。
- 4。
Smith TA:植物胺。植物次生产品,植物生理学百科全书新系列。编辑:Bell EA, Charlwood BV。柏林,施普林格Verlag, 1980, 8: 433-440。
- 5.
Dai Yr,Michaels PJ,弗洛雷斯他:在马铃薯细胞悬浮培养物中刺激Catecholamines和苯乙胺的乙烯生产。植物生长调节。1993,12:219-222。10.1007 / BF00027201。
- 6.
植物中的儿茶酚胺。植物营养与肥料学报。1995,14:91-97。10.1007 / BF00203119。
- 7.
Świędrych A, Stachowiak J, Szopa J:儿茶酚胺促进转基因马铃薯块茎淀粉动员。植物营养与肥料学报。2004,22(4):489 - 494。10.1016 / j.plaphy.2003.11.002。
- 8.
Richards H, Das S, Smith CJ, Pereira L, Geisbrecht A, Devitt NJ, Games DE, van Geyschem J, Gareth Brenton A, Newton RP:烟草BY-2细胞的环核苷酸含量。植物营养与肥料学报。2002,31(4):531-537。10.1016 / s0031 - 9422(02) 00266 - 2。
- 9.
esan H, Reichheld JP, Roef L, Witters E, Lardon F, Van Bockstaele D, Van Montagu M, Inze D, Van Onckelen H:消炎痛对烟草BY-2细胞周期依赖性环磷酸腺苷通量的影响。中华人民共和国农业部。1998,422:165-169。10.1016 / s0014 - 5793(97) 01610 - 4。
- 10。
环磷酸腺苷在赤霉素诱导大麦胚乳中α -淀粉酶释放中的作用。经验。1969,25:581。
- 11.
Godoy Ja,Lunar R,Torres-Schumann S,Moreno J,Rodrigo RM,Pintor-Toro Ja:脱氢丁Tas14在盐胁迫番茄植物中的表达,组织分布和亚细胞定位。植物mol biol。1994年,26:1921-1934。10.1007 / BF00019503。
- 12.
植物转录本蛋白激酶同源物的分子克隆。美国国家科学院学报。1989年,86:3140 - 3144。
- 13。
片桐楼林E,蔡NH:二烟草DNA结合蛋白同源的核因子CREB。自然。1989年,340:727-730。10.1038 / 340727a0。
- 14。
冷Q,Mercier的RW,粮农组织W,伯科维茨GA:克隆和植物环核苷酸门控阳离子通道的第一功能表征。植物理性。1999年,121:753-61。10.1104 / pp.121.3.753。
- 15.
Laukens K,Roef L,威特斯E,Slegers H,范Onckelen H:胞质甘油醛的环AMP亲和纯化和ESI-QTOF MS-MS鉴定-3-磷酸脱氢酶和二核苷二磷酸激酶的同种型从烟草BY-2细胞。Planta。2002年,214:510-20。10.1007 / s004250100644。
- 16.
植物生理学研究进展。植物科学进展。2002,7:36-41。10.1016 / s1360 - 1385(01) 02183 - 5。
- 17.
马铃薯块茎生长过程中蔗糖对淀粉转化的调控。中国生物医学工程学报,2003,19(4):457-465。10.1093 / jxb / erg074。
- 18.
Tauberger E, Fernie AR, Emmermann M, Renz A, Kossmann J, Willmitzer L, Trethewey RN:质体磷酸葡萄糖转化酶的反义抑制提供了令人信服的证据,表明马铃薯块茎淀粉体以葡萄糖-6-磷酸的形式从细胞质输入碳。植物学报,2000,23:43-53。10.1046 / j.1365 - 313 x.2000.00783.x。
- 19.
Fernie AR, Tauberger E, Lytovchenko A, Roessner U, Willmitzer L, Trethewey RN:反义抑制马铃薯(Solanum tuberosum)的胞质磷酸葡萄糖合成酶导致严重的生长迟缓、块茎数量减少和碳代谢改变。植物学报。2002,32(4):514 - 514。10.1007 / s004250100644。
- 20.
李志强,李志强。蔗糖合成的新复杂性。植物生态学报。2003,6:208-214。10.1016 / s1369 - 5266(03) 00033 - 5。
- 21.
Tetlow IJ, Wait R, Zhenxiao L, Akkasaeng R, Bowsher CG, Esposito S, Kosar-Hashemi B, Morell MK, Emes MJ:淀粉体中的蛋白质磷酸化调节淀粉分支酶活性和蛋白质相互作用。acta botanica sinica(云南植物研究),2004,16(6):694-708。10.1105 / tpc.017400。
- 22。
ŚwiędrychA,Lorenc-KukułaK,Skirycz A,Szopa Y:在马铃薯的儿茶酚胺的生物合成途径是通过应激的影响。植物理性生物化学。2004年,42:593-600。10.1016 / j.plaphy.2004.07.002。
- 23。
Hajirezaei MR,Sonnewald U,堇菜R,卡莱尔S,丹尼斯d,斯蒂特L:果糖-6-磷酸磷酸无明显可见的表型,并且在其块茎代谢通量只有轻微的变化:转基因马铃薯植物与焦磷酸盐的表达强烈减少。Planta。1994年,192:43-55。
- 24。
Geigenberger P,Reimholz R,Geiger M,Merlo L,Canale V,STITT M:对马铃薯块茎的蔗糖和淀粉代谢的调节响应于短期水缺损。Planta。1997年,20:502-518。10.1007 / S004250050095。
- 25。
Geigenberger P, Geiger M, Stitt M:高温抑制淀粉合成是由于生长中的马铃薯块茎中3PGA水平的降低抑制了ADPGlc焦磷酸化酶。植物杂志。1998年,117:1307 - 1317。10.1104 / pp.117.4.1307。
- 26。
马铃薯块茎糖酵解调控步骤的鉴定。植物化学学报。1998,19:1297-1301。
- 27。
Geigenberger P, Fernie AR, Gibon Y, Christ M, Stitt M:在马铃薯块茎生长过程中,代谢活动作为一种对低内部氧的适应性反应而降低。生物化学学报。2000,32(4):723- 734。10.1515 / BC.2000.093。
- 28.
Stitt M, Lilley RM, Gerhart R, Heldt WW:植物叶片特定孔和亚细胞室的代谢物水平。《微生物学杂志》1994年第4期:518-552页。
- 29.
DNA依赖RNA聚合酶I的190-kDa亚基被裂解,产生能够降解DNA的小多肽。中国生物化学杂志。
- 30.
菠菜叶片中蔗糖-磷酸合酶渗透胁迫激活的蛋白质磷酸化机制。植物营养与肥料学报。1997,19(4):457 - 461。10.1104 / pp.114.3.947。
- 31.
穆勒 - 罗伯特B,Sonnewald U,Willmitzer L:所述ADP葡萄糖焦磷酸化酶的抑制在转基因马铃薯导致糖储存块茎和影响块茎的形成和块茎储藏蛋白基因的表达。EMBO J. 1992年,11:1229年至1238年。
- 32.
SWEETLOVE LJ,Burrell的MM,AP里斯T:淀粉代谢的具有增加的ADP葡萄糖焦磷酸化酶的转基因马铃薯块茎(马铃薯)。生物化学杂志1996年,320:493-498。
- 33.
高宫S,福井T:从马铃薯块茎磷酸变。化学和催化性能。生物化学与。1978年,84:569-74。
- 34。
阿贝尔GJ,施普林格女,Willmitzer L,Kossmann Y:克隆和的cDNA编码来自马铃薯的新型139 kDa的淀粉合成酶的功能分析(马铃薯L.)。植物杂志1996,10:981-991。10.1046 / j.1365-313X.1996.10060981.x。
- 35。
Ainsworth C,Burrell M:小麦中腺苷二磷酸二磷酸葡萄糖焦磷酸化酶基因:差异表达和基因测绘。Planta。1995年,197:1-10。10.1007 / BF00239933。
- 36。
Zrenner R,Salanorbat男,Willmitzer L,Sonnewald U:的蔗糖合酶的用于使用转基因马铃薯植物宿强度的关键作用的证据(马铃薯L.)。植物杂志1995年7:97-107。10.1046 / j.1365-313X.1995.07010097.x。
- 37。
伦兹A,Merlo的L,斯蒂特L:从三个果糖激酶和三个己糖激酶,其示出不同器官和发育特异性的马铃薯块茎部分纯化。Planta。1993年,19:156-165。
- 38。
淀粉降解酶。植物生物化学方法。伦敦。学术出版社,1990,3:103-128。
确认
该工作得到了国家研究委员会(KBN)的赠款号3P06A 01523的支持。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
AS进行了转基因植物的代谢分析并起草了手稿。为开展转基因植物的结构和选择,并进行统计分析。JS所设想的研究,并参与了它的设计和协调。所有作者阅读并认可的终稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
Skirycz,A.,świędrych,A.&Szopa,J。马铃薯的人多巴胺受体的表达(Solanum Tuberosum.)导致改变的块茎碳代谢。BMC植物杂志5,1(2005)。https://doi.org/10.1186/1471-2229-5-1
收到了:
接受:
发表:
关键词
- 淀粉
- 儿茶酚胺
- 转基因线
- 可溶性糖
- 酪胺