摘要
背景
营养植物液泡占成熟植物细胞体积的90%。液泡在调节细胞稳态和允许细胞生长中起着基础性的作用。液泡的组成和体积的调节取决于液泡周围膜(称为液泡膜)上的转运体和通道的协调活动。虽然液泡膜蛋白复合物已经得到了很好的研究,但液泡膜本身却没有得到很好的描述。为了扩展我们对植物细胞内液泡折叠的认识,我们提出了表达液泡膜水通道蛋白融合基因的烟草悬浮细胞液泡的三维重建BobTIP26-1:绿色荧光蛋白.
结果
通过对细胞液泡的三维重建,可以准确分析正常和应激条件下液泡膜的大跨越褶皱,并提示周围质体之间的相互作用。不同生长条件下烟草悬浮细胞液泡的动态、高分辨率三维图像提供了液泡结构的更多细节。gfp修饰的液泡是由管状的经液泡束和大膜表面横切的单个连续室。在渗透胁迫下培养的细胞形成复杂的液泡网络,液泡膜表面积增加。深入的三维逼真检测表明,液泡在适应渗透胁迫过程中保持了统一性。液泡在胁迫适应过程中表现出的液泡统一,以及液泡与其他细胞器的密切联系,表明液泡在植物细胞的代谢和液泡与细胞器之间的通讯中发挥着重要的生理作用。PEG处理引起的脱水胁迫产生了与液泡内液泡膜紧密相连的“双”膜结构。当细胞被重新引入正常生长条件时,这些膜结构可以作为膜的储存库。
结论
GFP标记的Tonoplast的3-D加工提供了植物细胞液泡的令人信服的视觉结构,并详细阐述了调色剂折叠和架构的性质。此外,这些方法允许实时测定应力期间的膜重排。
背景
空间灌装,Turgor驱动液泡必须起源于生物进化的早期阶段,随后随后进化以进行各种功能,藻类众所周知,真菌(包括酵母)和植物1].许多先进的复杂功能在与真空SAP界限膜上进行操作或密切相关,即调色剂。调色剂介导的动态事件的详细结构研究应扩大我们对其蜂窝功能的了解。在过去,在活的有机体内液泡膜的观察受到光学显微镜分辨率的限制。与尺寸低于光学显微镜分辨率极限的其他细胞成分一样,液泡膜的研究主要是通过电子显微镜进行的。然而,这只允许对快速冷冻切片进行死后观察固定的或化学固定的电池[2,或快速冷冻细胞的破裂面复制品[3.,4].尽管这些研究为液泡膜的组织和生物发生提供了宝贵的见解,但对薄标本的分析只能提供有限的关于液泡膜空间结构的信息。高压电子显微镜能够通过固定的细胞从厚的切片中检索大量的信息,但依赖于使用有限数量的选择性(非至关重要的)。“染色”技术克服通常在高加速电压下看到的图像对比度下降[4- - - - - -6]因此,使用这些不同的技术很难研究和理解活细胞中液泡膜的动态变化。
共聚焦荧光显微镜可以消除失焦模糊。因此,可以通过无创光学切片获得完整生物标本的三维(3d)数据[7].十多年前,随着水母中“绿色荧光蛋白”(GFP)的应用,显微镜技术出现了一场新的革命在活的有机体内[8].GFP及其变体现在经常被用来产生荧光细胞器,例如线粒体[9],叶绿体[10]或分泌系统的组成部分[11这样就可以在活细胞中研究它们的动态。此外,一些研究提供了gfp标记的液泡质体的数据[12- - - - - -21,其中只有少数遵循液泡膜动力学[20.,21].
由于激光扫描共聚焦显微镜图像获得了最佳的活细胞分辨率,植物兼容的GFP cDNA [22]在我们实验室克隆的花椰菜BobTIP26-1液泡膜特异性水通道蛋白cDNA的3'端,在框架中进行融合[23].合成的嵌合基因在悬浮培养的烟草细胞(var. Wisconsin 38)中表达,显示gfp修饰的液泡膜[17].利用这种活体标记方法,对不同生长阶段和不同渗透胁迫下的细胞液泡膜进行了三维重建。我们的数据表明,烟草悬浮细胞中gfp修饰的液泡是一个单一的连续室。此外,渗透胁迫条件产生更大的液泡膜表面积,同时保持液泡的统一。此外,PEG处理产生与液泡膜内侧相关的球形结构。我们认为这些结构是细胞恢复正常生长后膜重组所必需的膜库。
结果
液泡的三维重建
我们最近表达了一种铜绿蛋白融合基因BobTIP26-1:绿色荧光蛋白CaMV35S启动子在烟草细胞中的作用[17].激光扫描共聚焦显微镜(额外的文件1).用表达嵌合蛋白的烟草细胞对细胞液泡进行三维重建。
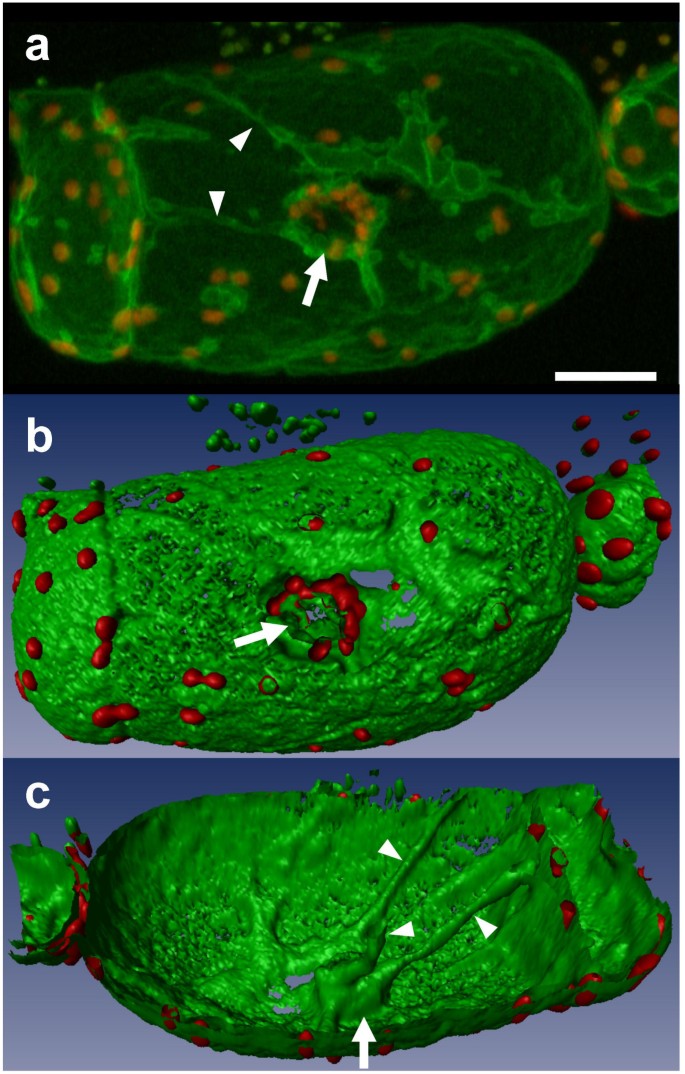
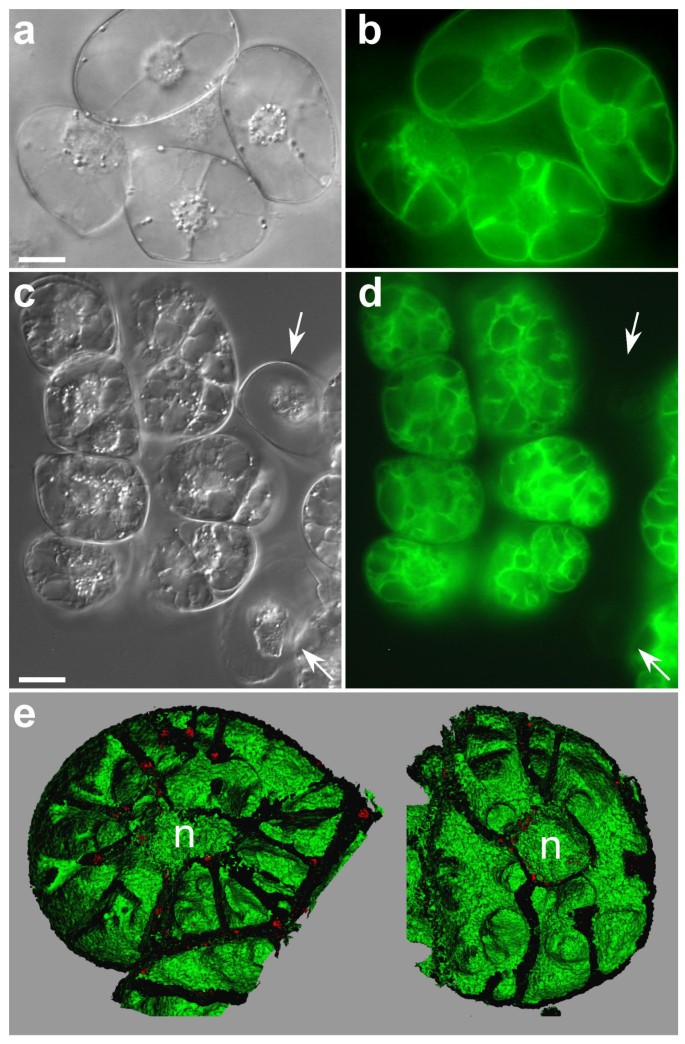
在7日龄的肿胀细胞中,液泡几乎占据整个细胞体积。在投影视图中,40个光学切片合并在一起(z-step = 1 μm;无花果。1),液泡的三维浮雕几乎看不到,液泡的结构细节不易识别。逼真的液泡膜3d图片(图。1 b, c),该过程将体积图像转换为几何表面[24]通过使用3-D可视化软件Imaris 2.7(瑞士Bitplane AG)。当仅重建“半液泡”时,液泡膜的针孔内表面易于检查。正如预期的那样,在GFP标记膜的外表面可以看到红色自体荧光叶绿体,确认其细胞质定位(图。1B.).叶绿体也围绕核聚集,其中调色剂形成腔体(图。1箭头)。可见经空泡的细胞质束辐射于整个液泡,从核区延伸到细胞周围(图)。1C箭头)。在液泡质体的细胞质侧偶尔也能观察到沟纹(图。2A箭头)。当用等值面模式同时观察大液泡细胞内的叶绿体和液泡体时,可以看到许多叶绿体位于这些沟槽内(图。2B.).
我们观察了非同步烟草细胞悬浮液中不同尺寸和形状的细胞。虽然共焦图像表明每个单元内存在几个液泡(图。3、3 c, e),每个细胞液泡膜的三维表征,以及液泡腔内开口的可视化清楚地支持“一个细胞,一个液泡”模型,即在细胞内gfp标记的液泡室之间存在液泡连续性(图)。3 b, 3 d, f).事实上,液泡的表面积很大,但液泡内部存在间隙,从而保持液泡内部的连续性。三个连接的细胞(图。3C)各自具有这种越野层,但是3-D表示表明它们没有限定每个电池中的离散液泡(图。3d).图中显示了这些三维重建液泡的动画序列附加文件2.在共聚焦显微镜下观察到的单个液泡腔在三维重建中被视为单个液泡腔室。通过原生质体的断层扫描仔细分析BobTIP26-1:绿色荧光蛋白表达烟草细胞也符合这一特征(附加文件3.).
在三维重建中,细胞结构的细节是显而易见的,包括一个液泡,其中有许多穿过液泡的线,从核区域向外辐射到细胞周围(图)。3 e, f).三维重建还表明,叶绿体不仅仅包围细胞核;它们的分布也与经液泡束平行。
质壁分解过程中的液泡体行为
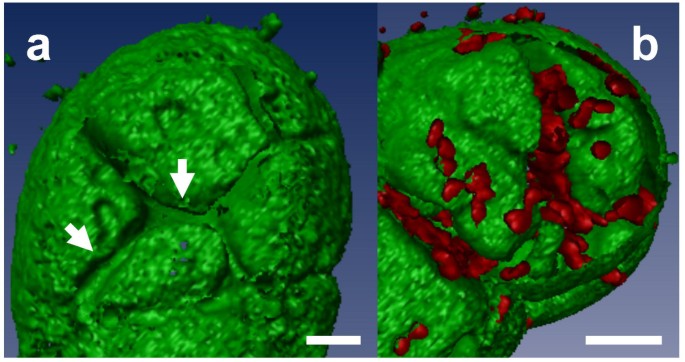
我们进一步分析了标记液泡膜在质壁分解过程中的行为。烟草悬浮细胞浸泡在添加不同渗透力(170 mM氯化钠、0.6 M甘露醇或0.5 M山梨醇)的培养基中,诱导胞浆分离-脱胞循环。渗透膜进入灌注室后30 - 60秒发生质壁分解。这种现象优先从细胞角开始,在3 ~ 5分钟后发生完全的质壁分解。烟草细胞中观察到两种形式的质壁分解,Oparka [25].最常见的是质壁分离的凸面形式,这是原生质体与细胞壁均匀分离的结果,从而形成一个对称的、大致为球形的原生质体(图。4A).偶尔可以观察到细胞质分裂的凹形(图。4B.).在这种形式中,当质膜与壁分离时,就会形成凹袋。在两种形式的质壁分解过程中,原生质体通过Hechtian链与细胞壁紧密连接(图2)。4C箭头)。
在质壁分解过程中,液泡内发育出一种特殊的折叠,其特征是围绕着核的复杂卷曲。4、4 b).接近卷曲结构的检查显示,它们比它们拴住的调色剂稍微荧光稍微荧光,这是由于两个相邻的标记膜的连接而可能是由于两个相邻的膜的观察结果。此外,液泡和调色剂保持完整,未检测到囊泡形成。通过质子溶性细胞的细胞断层显然明显证明了调色剂的不间断完整性,其折叠和曲线易于看见(附加文件4.).通过标记的缺失证实了Hechtian链内液泡膜的缺失(附加文件4.)然而,在质壁分离的液泡内仍然可以观察到跨液泡细胞质链(图。4A箭头;附加文件5.)和炎症细胞(额外的文件5).这些孔内结构似乎不如周围液泡膜灵活。细胞质裂解10 ~ 15分钟后,再次浸泡在正常MS培养基中。浆细胞在约10至20分钟后恢复正常形状(附加文件5.),卷曲的结构被解开。细胞核在细胞内的位置在细胞质分裂-脱质分裂过程中几乎是恒定的。
渗透胁迫对液泡膜结构的影响
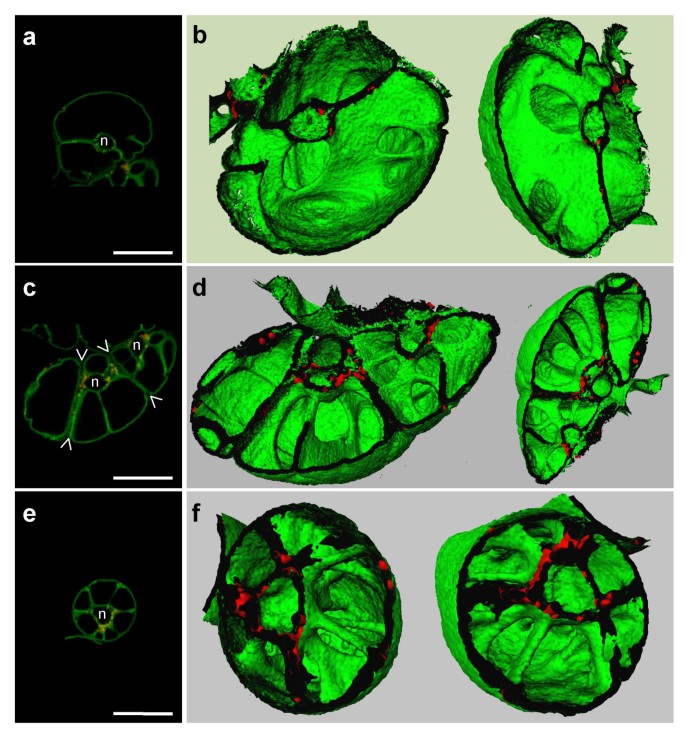
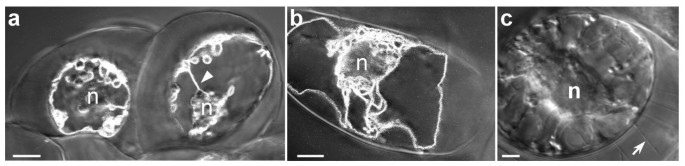
与用3-D重建获得的结果一致,我们尝试在渗透应激培养过程中确定仪表塑圈架构。实际上,在烟草悬浮细胞的NaCl培养条件下,已经描述了在烟草悬浮液的培养条件下,其特征在于中央液泡分离成多个较小的较小型较小的现象。[26].为了证明在显示荧光液泡膜的烟草细胞中存在这种碎片,BobTIP26-1:绿色荧光蛋白在含有170mM NaCl,0.6M甘露醇或0.5M山梨糖醇的超渗透MS培养基中转移表达细胞,最终水电位为-1.4MPa;-1.6 MPA和-1.2 MPA。与在正常MS培养基中转移的细胞相比(图。5、5 b),在高渗培养基中驯化的细胞较小(图。5C,5D).[以后,在含有渗透剂的培养基中生长的细胞称为“适应细胞”]。推测在正常MS和高渗培养基中生长的细胞体积平均为175·103.μm3.和53·103.μm3.,分别。驯化后,细胞体积减少约3.3倍。如果液泡占正常MS培养基细胞体积的90%,则原液泡体积为157·103.μm3..
在诺玛斯基对比干涉光学下可以监测空泡现象(图。5C).此外,这种现象更容易观察到液泡膜的荧光标记(图。5D)在这些培养物中,只有约25%的细胞完全分离(图。5C箭头),且不显示任何荧光,表明它们是未适应的死亡细胞(图。5D箭头)。此外,用中性红进行的活体染色显示,只有驯化细胞的液泡中含有这种染料(数据未显示)。
为了确定驯化细胞中大量独立的小液泡是否是连续液泡室的一部分,我们对整个液泡进行了三维重建。这些图像显示了一个复杂的液泡网络的存在。立体观察显示完全重建的液泡内各液泡腔之间存在相互联系。图中显示了重建的液泡的一半5e..核袋可以在细胞中心看到,包围小型互连的真空腔。尽管存在孤独的真空空间的有力证据,但我们不能排除适应细胞含有小的离散腔的可能性。但是,使用复杂的重建可以辨别这种性质的小结构。由于漂浮腔互连,我们建议调色剂表面积显着增加,而真空腔的连续性保持不变。用于3-D重建的软件(IMARIS 2.7)不允许定量调色剂表面积,也不达到适应细胞的调色剂表面与正常培养细胞的调色剂表面的比较。
脱水胁迫下液泡膜结构的变化
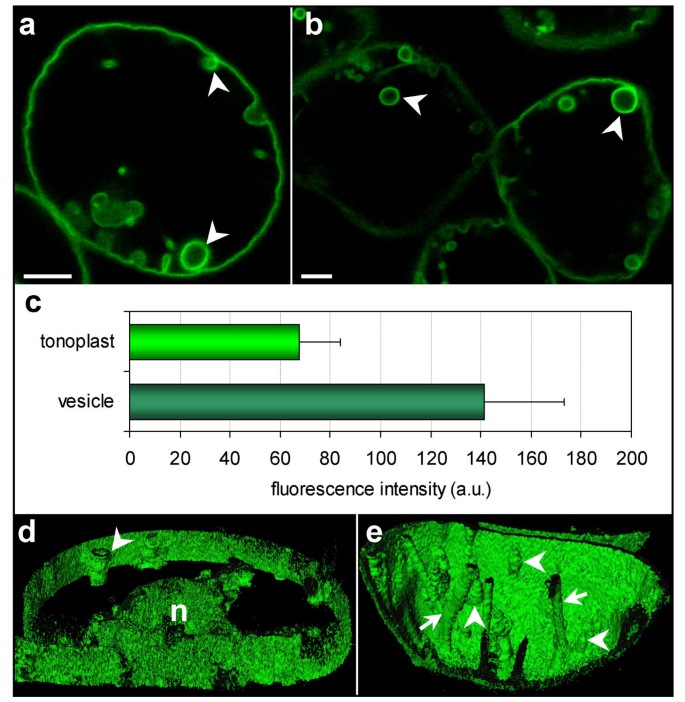
用高分子聚乙二醇(PEG)模拟脱水应激8000),要么很难通过,要么根本不通过细胞壁[27],从而降低细胞外游离水的浓度[28].高渗应激悬浮细胞的膜表面积总体增加,而MS培养基中添加10% PEG培养的细胞8000,显示出大量直径为5-10 μm的球状荧光结构,但没有复杂的膜重排或折叠。与外周液泡质相比,这些内部液泡结构表现出更明亮的膜荧光(图。6、6 b箭头)。事实上,这些结构周围的膜的荧光强度至少是周围液泡膜的两倍(图。6摄氏度).这些球形结构也是动态的,在真空腔内移动,但似乎附着在外周液泡膜上(图。6 d箭头)。它们很容易与经液泡束区分开来,后者保持了它们的形态(图。6 e箭头)。事实上,经液泡束从液泡的一部分横切到液泡的另一部分,而球形结构被栓在液泡的周长上。
讨论
原生条件下液泡的三维重建
植物液泡是一种多功能细胞器[1]它是真的内环境[29],在细胞增长期间发挥关键作用[30.],并且可能在细胞质渗透胁迫期间的水渗透调节中[31.].为了重新定义灰度架构,我们介绍了在“天然”条件下的含有GFP标记的调色剂的细胞中的真空装置的3-D重建。Tonoplast标记系统[17],以获得正常和渗透胁迫生长条件下烟草细胞液泡形态的新认识。利用共聚焦连续图像对液泡进行三维表征,可以最准确地说明液泡在植物细胞内是如何折叠的。事实上,以前对表达gfp标记的syntaxin的有丝分裂by -2细胞的研究,通过从顺序共聚焦切片获得的三维表面重建,获得了空泡结构的全面图像[32.].的副作用液泡膜的形态学由于膜蛋白的过表达如BobTIP26-1:: GFP,先天的,不排除在外,但结果35 s-gfp-atvam3p及亲脂性的探测fm4透露,在2 - 64细胞空泡的形态不是转基因2人为影响的细胞(32.].荧光液泡内BobTIP26-1:绿色荧光蛋白表达细胞与BY-2细胞中FM4-64染色细胞相似,假设在BobTIP26-1:绿色荧光蛋白表达细胞没有改变。
用于激光共聚焦显微镜数据表示的软件提供了两种形式的体可视化:等值面绘制和直接体绘制[33.].我们选择了等值面绘制方法,因为它允许我们将阴影表面表示为一个易于解释的三维物体。然而,这两种技术是互补的,最终的三维图像提供的结论是等价的。
表达BY-2烟草细胞的三维液泡结构提示::绿色荧光蛋白是由Mitsuhashi和他的同事首先建立的[13,但它们的表现主要是连续共聚焦图像的投影视图,显示细胞内存在几个折叠的大液泡。然而,正如本研究所证明的那样,投影视图的信息量可能不如三维重建(图。1, 无花果。3.).投影图显示了单个细胞内折叠的多个液泡,而三维重建精确地描绘了正常生长条件下培养的细胞内的单个液泡连续体(图2)。3.).Palevitz和同事描述了真空腔的这种连续性[34.他分析了细胞分化过程中的液泡葱气孔细胞。尽管通过电子显微镜观察到这些固定电池的薄切片显示出各个小型液泡,但是在100kV下观察的0.25至0.50μm厚的序列部分的3-D重建,清楚地显示出来自连续网状网络的部分。
连续液泡的概念对于植物细胞很重要,因为当通过应激细胞进行稳态措施时,真空SAP的含量可以在细胞的所有区域之间流动。
为了获得更高分辨率的液泡,应该使用基于电子断层图的重建作为获得的数据的例证拟南芥有丝分裂细胞板形成[35.- - - - - -37.和动物的高尔基体[38.]和酵母[39.]细胞。
液泡膜表面结构
通过对液泡的三维重建,我们能够从一个独特的角度分析其表面结构。早期烟草细胞液泡-细胞质界面的三维效果图显示,在吖啶橙标记的液泡表面有波纹[40],这与我们描述的表面皱纹不同。事实上,液泡涟漪浸入细胞质,而不是液泡[40].我们在等值面重建后观察到这些沟,这些沟似乎是某些细胞器对膨胀液泡施加压力的结果。细胞器因此被挤压在质膜和液泡膜之间,从而在与液泡的细胞质界面上产生沟槽。我们在这里展示了三维绘制对于可视化细胞器之间的相互作用也很有用。
在渗透胁迫期间调色剂表面增大
尽管细胞膜是应激诱导的细胞损伤的目标,液泡被认为在应激过程中具有中心作用,但在应激条件下液泡质体的研究很少有报道。我们推断,在不同的渗透胁迫下,仔细研究液泡膜的模式将建立在我们目前对环境变化中细胞如何组织细胞膜的知识基础上。糖细胞,如烟草细胞(烟草(var. Wisconsin 38),对NaCl的适应能力进行了分析[41.],并确定液泡化的增加以及广泛的跨液泡膜链网络[26].在光学显微镜下使用Narmarski光学器件容易地观察TransVacuolar Slards;然而,它们的组成更难以推断。我们使用我们开发的调色剂内在GFP标记的蛋白质[17]提供原位横切液泡腔的经液泡束也含有液泡质体相关分子的证据(图。1, 无花果。3F.).
在多种渗透介质存在下生长的烟草细胞形成了一个广泛的膜网络,似乎横切液泡,从而形成多个隔室。之前对NaCl驯化期间生长的细胞进行了类似现象的观察[26].通过三维表征,我们发现在添加了盐、甘露醇或山梨糖醇的培养基中生长,导致跨液泡链的组织模式完全改变,从正常条件下的薄形状转变为更大的表面积。伴随链纹改变的是几个小空洞的出现。这些现象都可以观察到,不管用于适应的渗透。从驯化细胞获得的三维图像可以清楚地看出,液泡的数量保持不变,而液泡体的总表面积增加,从而形成了更加复杂的液泡模式(图2)。5e.).因此,液泡体表面积与细胞质体积的比例是最适合于胞质和液泡之间交换(水和离子的运输)的。随着液泡膜总表面积的增加,膜化合物的总质量也随之增加。野生型烟草细胞在高渗透处理后也出现类似的空泡化变化;因此,膜表面的增加既与水通道蛋白的存在无关,也与细胞的大小无关BobTIP26-1:绿色荧光蛋白表达细胞[17].由于液泡形状不均匀,测量已适应细胞的液泡体表面积变得复杂。相反,长椭球形的维亚比亚法瓦保卫细胞可在三维重建后确定其表面积和体积[42.].在我们的研究中,这种条件的标准化是不可能的。
折叠等离子体溶液液泡
尽管液泡表面积随着质壁分解而发生巨大变化,但在渗透收缩过程中液泡的命运在相关文献中所描述的很少。在灌注室中进行质浆分解-脱质分解循环,观察荧光蛋白标记的液泡膜。在质壁分解过程中,液泡发生折叠,液泡并没有形成如前所述的“囊状、杆状或甜甜圈状结构”的分离的多层小泡。43.].此外,对质浆分解细胞(附加文件4.),表明液泡膜在原生质体内以一种特殊的方式折叠,而不是像之前报道的那样分裂成小泡[25].这种过程似乎比囊泡形成更好,以便在衰退期间更快地重新建立液泡。没有必要膜融合。
经液泡束,即穿过液泡的细管状结构,在质浆分解和脱质分解过程中均未被分解(附加文件5.).早期的研究表明,经液泡的链是由肌动蛋白丝稳定的[44.,45.],并通过肌凝蛋白马达与肌动蛋白丝的相互作用而重新排列[46.].尽管有这些观察链稳定性,但它们也被描述为动态和精致[26].我们的数据支持转瓦芬氏链表现出“强度”和稳定性的观点,因为它们的位置在突然环境变化期间留在液泡内静止(附加文件5.).
PEG处理导致液泡体组成的球状结构
令人惊讶的是,在添加10% PEG的MS培养基中,烟草悬浮细胞液泡腔内可见荧光强度为液泡膜两倍的球状结构8000.这些结构与在液泡膜gfp标记的烟叶中经常观察到的结构相似[47.,48.或者在拟南芥子叶(49.].此外,这些结构已被描述在子叶,下胚轴和根拟南芥真空生物发生bub(泡泡浴)突变体[50.]以及瞬时转化烟草benthamiana表达GFP融合蛋白的植物与高亲和力调色剂磷酸盐转运蛋白同源的植物[51.].我们在PEG处理过程中观察到的结构是独立于水通道蛋白基因的调控或过表达的,因为我们和其他作者发现了类似的鳞茎拟南芥具有天然尖端1的细胞; 1启动子(Bouhidel K.,个人通信)和在35s启动子的控制下表达其他调色剂蛋白的细胞[51.].观察到的结构拟南芥子叶(49.被称为“灯泡”,这个术语反映的是一种并非完全封闭的球形结构。这些鳞茎的开放部分可能是囊泡形成不完全的结果[49.].由于肌动蛋白抑制剂的治疗使其固定和三维重建,这些鳞茎似乎附着在肌动蛋白细胞骨架上[51.].我们在脱水胁迫下培养的烟草悬浮细胞中观察到的球形结构的三维图像与在表达GFP-AtVam3p的烟草根原生质体中观察到的三维重建圆柱形结构相似A. Thaliana.[52.].最近,在萌发花粉管中发现了δ -TIP::GFP表达的荧光环状结构拟南芥植物 [20.].这些流动性细胞质的侵略性可能是积极种植组织的广泛特征。
为什么PEG驯化的悬浮细胞液泡中含有“鳞茎”?当PEG应用于培养基时,模拟脱水,从而降低膨压。同样,子叶也经历干燥过程。在Spirodela介质在PEG包合后,观察到液泡膜分解成小泡[53.].观察到的膜荧光强度与蛋白质数量的相关性表明,球形液泡结构的膜每表面积含有的水通道蛋白可能是周围液泡膜的两倍,表明较高的水分交换水平。球形结构反映了液泡膜脂域的存在,在液泡膜内水通道蛋白集中,囊泡形成。事实上,一些研究表明液泡膜的流动性很高[54.],以及脂肪酸组成的一种特殊特征,这种特征可能是液泡质体具有独特流动性和高弹性的原因[55.细胞内渗透过程所需的。我们的研究结果支持Uemura及其同事提出的内陷模型[52.,液泡腔内部分液泡质体形成双层膜结构。球形结构可以作为一个水库,不仅为膜膨胀,而且允许更快的内稳态调整。较高的液泡体表面积与细胞体积比将极大地提高细胞在生长过程中维持大离子池的能力[56.].
结论
本研究中提供的数据证明了水通道蛋白BobTIP26-1::GFP作为可视化烟草细胞内三维膜重排的强大工具的用途。这里使用的技术提供了高分辨率的图像和支持的概念,烟草悬浮细胞包含一个单一的主要液泡具有溶解功能。烟草细胞在PEG介导的胁迫下所表现出的膜封闭、液泡内圆形结构的确切来源和功能还有待进一步研究。
方法
植物材料
烟草(烟草L. var。威斯康星州38)表达悬浮细胞BobTIP26-1:绿色荧光蛋白[17]在MS培养基中生长[57.,在24°C恒定光合光照(200 μE·m .)下,有规律地振荡-2·秒-1).
三维重建
在配备氩氪激光(488/515 BP-FITC)的Leica TCS 4D激光共聚焦显微镜(Leica Microsystems, Wetzlar, Germany)下分析3至7天大的细胞。激光通过40倍NA1油浸物镜聚焦在单个细胞上。对于每个细胞,收集100到200张图像(分辨率256 × 256, z步长0.50到0.65 μm)。合并的单个共聚焦图像(红色和绿色通道)使用Corel Photo-Paint 7软件(Corel, Ottawa, Canada)组成。为了获得三维重建,共焦图像堆栈被导入到在Silicon Graphics上运行的三维可视化软件Imaris 2.7 (Bitplane AG, Switzerland)中®Octane2™工作站(法国巴黎SGI)。基线相减后,定义一个子区域。然后,利用Imaris的等值面模块重建三维图像。在使用IvView查看计算表面之前,为每个通道定义了一个足够的等值值。然后使用MediaRecorder媒体工具将等值面渲染的图片存储为tiff文件。利用立体视觉设备(CrystalEyes)对三维重建的现实屏幕表现进行深入分析®,立体®).
细胞灌注
细胞灌注在自制的与蠕动泵相连的灌注室中进行(流量= 20 mL·h)-1(IBMP,法国斯特拉斯堡)。BobTIP26-1:绿色荧光蛋白表达细胞首先粘附在聚赖氨酸化的玻片上。以下溶液用于细胞灌注:MS添加0.17 M NaCl或0.6 M甘露醇或0.5 M山梨醇。使用倒置激光共聚焦显微镜LSM510 (Zeiss Axiovert 100 M,耶拿,德国)监测质粒分解和脱质分解,该显微镜装有Zeiss 63X水浸物镜。然后采集共焦时间推移序列。用vapo测量渗透压®蒸气压渗透计(型号5520;威科,洛根,UT,美国)。
适应压力条件
五毫升BobTIP26-1:绿色荧光蛋白表达指数生长期的细胞在MS培养基中继代培养,培养基中添加170 mM NaCl、0.6 M甘露醇、0.5 M山梨糖醇或10% PEG8000.在7天内分析了应激和对照(MS无渗透)细胞,并如上所述进行了三维重建。使用IPLab软件(Scanalytics, Fairfax, VA, USA)测量荧光强度。
参考文献
- 1.
植物液泡.植物细胞.1999,11:587-600.10.1105/tpc.11.4.587。
- 2.
植物原生质的电子显微镜。《细胞报》1963,14:41-55。
- 3.
Fineran BA:在冷冻蚀刻的根尖中的内质网和真空之间的关系。J超刀库。1973年,43:75-87。
- 4。
Marty F:小麦膜相互作用的高压电子显微镜。J Histochem cytochem。1980,28:1129-1132。
- 5。
Cosslet VE:组织的“超微结构”。通过电子显微镜的启示。放射学。1962,28:203-204。
- 6。
高电压电子显微镜下生物厚切片的制备与观察。电子学报,2003,31(4):457 - 461。
- 7.
Amos WB,White JG:共焦激光扫描显微镜如何进入生物学研究。Biol Cell.2003,95:335-342.10.1016/S0248-4900(03)00078-9。
- 8.
Tsien RY:绿色荧光蛋白。《生物化学学报》1998年第6期。10.1146 / annurev.biochem.67.1.509。
- 9.
Köhler RH, Zipfel WR, Webb WW, Hanson MR:绿色荧光蛋白作为在体内观察植物线粒体的标记物。植物学报1997,11:613-621。10.1046 / j.1365 - 313 x.1997.11030613.x。
- 10.
KöhlerRH,Cao J,Zipfel WR,Webb WW,Hanson Mr:通过高等植物塑性的连接交换蛋白质分子。科学。1997年,276:2039-2042。10.1126 / Science.276.5321.2039。
- 11.
Brandizzi F, Irons SL, Johansen J, Kotzer A, Neumann U: GFP是发光的方式:植物内膜系统的生物成像。中国有色金属学报,2004,29(4):429 - 434。10.1111 / j.0022-2720.2004.01334.x。
- 12.
Ueoka-Nakanishi H, Tsuchiya T, Sasaki M, Nakanishi Y, Cunningham KW, Maeshima M:绿豆Ca2+/H+逆向转运蛋白在酵母中的功能表达及其在下胚轴和烟草细胞中的定位。中国生物化学学报。2000,27(4):591 - 598。
- 13.
Mitsuhashi N, Shimada T, Mano S, Nishimura M, Hara-Nishimura I:利用GFP可视化烟草by -2细胞液泡分选途径的细胞器特性。植物营养与肥料学报。2000,31(4):491 - 497。10.1093 /卡式肺囊虫肺炎/ pcd040。
- 14。
陈志强,陈志强,陈志强:拟南芥“双孔”K+通道KCO1的液泡膜定位。植物J. 2002, 29: 809-820。10.1046 / j.1365 - 313 x.2002.01260.x。
- 15。
陈志刚,陈志刚:烟草BY-2细胞周期发展过程中液泡结构和微管结构的动态组织。植物营养与肥料学报。2002,23(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pcf138。
- 16。
Yamaguchi H, Nishizawa NK, Nakanishi H, Mori S: IDI7,一个新的铁调控的ABC转运体,从大麦根定位到液泡膜。中国生物医学工程学报,2002,33(4):427 - 435。10.1093 / jexbot / 53.369.727。
- 17。
Reisen D, Leborgne-Castel N, Özalp C, Chaumont F, Marty F:烟草悬浮细胞中标记有GFP的花椰菜液泡膜水通道蛋白的表达与细胞大小的增加相关。植物生态学报。2003,32(4):489 - 494。10.1023 /: 1023961332391。
- 18.
Yano K, Matsui S, Tsuchiya T, Maeshima M, Kutsuna N, Hasezawa S, Moriyasu Y:质膜和中央液泡对烟草细胞自溶酶体形成的贡献。植物营养与肥料学报。2004,29(4):451 - 457。10.1093 /卡式肺囊虫肺炎/ pch105。
- 19.
KATAOKA T,Watanabe-Takahashi A,Hayashi N,Ohnishi M,Mimura T,Buchner P,Hawkesford MJ,Yamaya T,Takahashi H:真空硫酸盐转运蛋白是控制拟南芥中硫酸盐内部分布的必要决定因素。植物细胞。2004,16:2693-2704。10.1105 / TPC.104.023960。
- 20.
Hicks GR, Rojo E, Hong S, Carter DG, Raikhel NV:花粉萌发具有管状液泡,液泡生物发生具有高度动态,需要液泡1来发挥正常功能。植物营养与肥料学报。2004,29(4):429 - 434。10.1104 / pp.103.037382。
- 21.
Saito C,Morita Mt,Kato T,Tasaka M:拟南芥活泼茎的活性劫掠细胞中的淀粉蛋白和阳粉膜动力学。植物细胞。2005,17:548-558。10.1105 / TPC.104.026138。
- 22.
Haseloff J,Siemering KR,Prasher DC,Hodge S:去除一个隐蔽的内含子和绿色荧光蛋白的亚细胞定位是标记转基因拟南芥植物所必需的。美国国家科学院学报,1997,94:2122-2127.10.1073/pnas.94.6.2122。
- 23.
Barrieu F, Thomas D, Marty- mazars D, Charbonnier M, Marty F:花椰菜(Brassica oleracea L. var. botrytis)液泡膜固有蛋白的免疫学分析、cDNA克隆和在分生组织表达的证据。植物学报。1998,19(4):337 -344。10.1007 / s004250050264。
- 24.
利用共聚焦显微镜观察三维细胞,图像重建和等值面绘制:应用于小鼠中枢神经系统的胶质细胞。激光与光电子学进展。
- 25.
《原生质分离:对旧过程的新见解》,《新植物志》,1994,126:571-591。
- 26。
Chang PFL, Damsz B, Kononowicz, Reuveni M, Chen Z, Xu Y, Hedges K, Tseng CC, Singh NK, Binzel ML, Narasimhan ML, Hasegawa PM, Bressan RA:适应渗透胁迫后细胞膜结构的改变和膜相关蛋白的表达。植物科学学报。1996,98:505-516。10.1034 / j.1399-3054.1996.980310.x。
- 27。
陈志强,陈志强,陈志强:植物细胞质和膜间隔的动态连续性。中国生物医学工程杂志,1998,16(4):421 - 427。10.1083 / jcb.106.3.715。
- 28。
植物组织和原生质体培养:在逆境生理生化方面的应用。植物在压力之下。编辑:Jones HG, Flowers TJ, Jones MB. Cambridge,剑桥大学出版社;1989:181 - 169。
- 29。
液泡的生物起源:显微观察。植物液泡的研究进展。编辑:Leigh A and Sanders D. San Diego,学术出版社;1997:25: 1-42。
- 30.
Raven JA:液泡的作用。植物生态学报,2003,21(4):457 - 462。
- 31.
陈志强,王志强,王志强:高盐胁迫下植物的细胞和分子响应。植物营养与肥料学报。2000,22(3):423 - 427。10.1146 / annurev.arplant.51.1.463。
- 32.
关键词:烟草细胞,有丝分裂,液泡膜,管状结构植物营养与肥料学报。2003,27(4):489 - 494。10.1093 /卡式肺囊虫肺炎/ pcg124。
- 33.
多色激光共聚焦显微镜数据的体积可视化。图表。2001,25:371-382。10.1016 / s0097 - 8493(01) 00061 - 9。
- 34.
Palevitz BA,O'Kane DJ,Kobres RE,Raikhel NV:葱属气孔细胞中的液泡系统液泡运动和分化细胞形态的变化,如荧光、视频和电子显微镜所示。原生质。1981, 109: 23-55. 10.1007/BF01287629。
- 35.
Otegui MS, Mastronarde DN, Kang BH, Bednarek SY, Staehelin LA:通过高分辨率电子断层扫描可视化的胚乳细胞分化过程中合胞型细胞板的三维分析。植物学报。2001,13:2033-2051。10.1105 / tpc.13.9.2033。
- 36.
Otegui MS, Staehelin LA:拟南芥花粉发育过程中减数分裂后细胞分裂的电子层析分析。植物学报。2004,32(4):457 - 461。10.1007 / s00425 - 003 - 1125 - 1。
- 37.
高压冷冻保存拟南芥分生组织细胞中体细胞板形成的电子层析分析。植物学报。2004,32(6):832 - 836。10.1105 / tpc.017749。
- 38。
Marsh BJ, Mastronarde DN, Buttle KF, Howell KE, McIntosh JR:高分辨率电子断层扫描显示胰腺β细胞系HIT-T15高尔基区细胞器关系。《美国国家科学院学报》上。2001年,98:2399 - 2406。10.1073 / pnas.051631998。
- 39。
Mogelsvang S,Gomez-Ospina N,Soderholm J,Glick BS,Staehelin La:Pichia Pastoris的Golgi Cisternae连续转交的断层依据。mol Biol细胞。2003,14:2277-2291。10.1091 / mbc.e02-10-0697。
- 40.
Verbelen JP,TAO W:储华纹体的移动阵列在植物细胞中常见。植物细胞代表1998,17:917-920。10.1007 / S00299005050509。
- 41.
Binzel ML,长谷川PM,Handa AK,Bressan RA:烟草细胞对NaCl的适应。植物生理学。1985, 79: 118-125.
- 42.
Shope JC,Dewald DB,Mott Ka:完整保护细胞表面区域的变化与膜内化相关。植物理性。2003,133:1314-1321。10.1104 / pp.103.027698。
- 43.
Johnson-Flanagan Am,Singh J:在硬化和非硬化植物细胞中的等离子体溶解期间膜缺失。植物细胞环境。1986,9:299-306。
- 44.
微注射profilin通过快速解聚肌动蛋白微丝影响植物细胞的细胞质流动。《自然》,1994,4:215-219。10.1016 / s0960 - 9822(00) 00050 - 6。
- 45.
gfp小鼠talin融合蛋白在体内标记植物肌动蛋白丝,并显示生长花粉管中的肌动蛋白细胞骨架。植物学报1998,16:393-401。10.1046 / j.1365 - 313 x.1998.00304.x。
- 46.
Hoffmann A, Nebenführ A: BY-2细胞中跨液泡链的动态重排暗示了肌凝蛋白在重塑植物肌动蛋白细胞骨架中的作用。中国生物医学工程学报。10.1007 / s00709 - 004 - 0068 - 0。
- 47.
Reisen D:etude de l'表达D'UngèneCodantUne Aquaporine Tonoplastique de Chou-Fleur Chez Le Tabac。分析De La Dynamique Vacuolaire et de l'Effet de Regry Osmotiques。博士论文。法国第戎大学勃艮第大学;2003年。
- 48.
AtRabF2b (Ara7)在烟草叶表皮细胞液泡运输通路中的作用。中国生物医学工程学报。2004,31(6):691 - 698。10.1242 / jcs.01564。
- 49.
Saito C, Ueda T, Abe H, Wada Y, Kuroiwa T, Hisada A, Furuya M, Nakano A:在拟南芥幼苗的连续液泡膜中,一个复杂的和可移动的结构形成了一个独特的亚区。植物学报,2002,29:245-255。10.1046 / j.0960-7412.2001.01189.x。
- 50。
Avila EL, Zouhar J, Agee AE, Carter DG, Chary SN, Raikhel NV:研究植物细胞器生物发生的工具。液泡破裂的点突变系和绿色荧光蛋白标记细胞器的高速共聚焦筛选。植物营养与肥料学报。2003,33(4):453 - 457。10.1104 / pp.103.033092。
- 51.
Escobar NM,Haupt S,Thow G,Boevink P,Chapman S,Oparka K:CDNA-绿色荧光蛋白融合的高通量病毒表达揭示了新的亚细胞地址,并识别与纤维饼相互作用的独特蛋白质。植物细胞。2003,15:1507-1523。10.1105 / TPC.013284。
- 52.
上村,吉村,竹康,佐藤MH:GFP-AtVam3融合蛋白揭示的液泡膜动力学。基因细胞。2002,7:743-753.10.1046/j.1365-2443.2002.00550.x。
- 53.
kich MG, Didone NG, Fernandez OA, Mujica MB:渗透诱导缺水对中间螺旋藻超微结构的影响。生物技术学报。2000,24:85-88。
- 54.
Leborgne N,Dupou Cezanne L,Teulières C,Canut H,Tocanne JF,Boudet AM:表现出不同抗冻性的古尼桉品种特定细胞膜中脂质的侧向和旋转流动性。植物生理学。1992,100:705-715。
- 55.
Makarenko SP,Konenkina TA,Salyaev RK:高等植物真空膜中脂质脂肪酸组成的特征。MEMBR细胞BIOL。2000,13:687-695。
- 56.
Reuveni M, Bennett AB, Bressan RA, Hasegawa PM: NaCl适应后液泡膜H+-ATP酶的H+运输能力和ATP水解活性的增强。植物生理学报。1999,19(4):524-530。
- 57.
Murashige T,Skoog F:一种修订的培养基,用于快速生长和烟草组织培养的生物测定。physiol植物。1962,15:473-497。
致谢
作者要感谢J.C.罗宾斯的英语更正和有意义的讨论。dr . r .得到了Ministère de l'Education national de la Recherche et la technology (N°99-5-12166)的支持。在CMAB-SERCOBIO (Université de Bourgogne)中使用了Octane2™工作站和Imaris软件。我们感谢斯特拉斯堡生物研究所Moléculaire des Plantes(斯特拉斯堡)研究所共聚焦显微镜板形研究所的C. Ritzenthaler对灌注实验的帮助。康塞尔Régional de Bourgogne资助了这项工作。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
博士起草了稿件,进行了实验,包括微观观测和计算机生成的重建。FM和NLC构思了该研究,并参与了其设计和协调。NLC还有助于起草稿件。所有作者阅读并认可的终稿。
作者的原始提交的图像文件
三维重建空泡的动画。
附加文件2:图中重建的液泡3d注意:叶绿体(红色)位于液泡的外侧,在跨液泡链和细胞的外围
通过带有gfp标记的液泡质体的原生质体进行细胞断层扫描。
附加文件3:原生质体由BobTIP26-1:绿色荧光蛋白如前所述表达细胞[17].(MOV 578 KB)
12870_2005_58_moesm4_esm.mov.
附加文件4:通过细胞质裂解细胞的细胞断层扫描,显示完整的液泡质体结构及其折叠。液泡膜发出绿色荧光。赫赫天链没有标记。Bar = 5µm。(MOV 4 MB)
12870_2005_58_moesm5_esm.mov.
附加文件5:用0.5 M山梨糖醇浸泡的细胞质裂解-脱质裂解周期。时间标记在左下角;左上方给出培养基的变化(10分钟:+ 0.5 M山梨醇;23.5分钟:+正常MS培养基)。Bar = 20µm。(MOV 6 MB)
权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
渗透胁迫下植物液泡的液泡结构和液泡动力学的新认识。BMC植物BIOL.5,13 (2005). https://doi.org/10.1186/1471-2229-5-13
收到了:
接受:
出版:
关键词
- 渗透胁迫
- 烟草细胞
- 真空膜
- 投影视图
- 液泡室