摘要
背景
在拟南芥在乙烯生物合成途径中,ETO1(乙烯-过量生产者1)通过与速率限制酶-1-氨基环丙烷-1-羧酸合成酶(ACC合成酶或ACS)的异构体AtACS5相互作用,是乙烯进化的负调控因子。ETO1直接抑制AtACS5的酶活性。此外,ETO1与一种新型E3泛素连接酶复合物的组成部分AtCUL3的特异性相互作用提示了通过蛋白酶体依赖途径促进AtACS5降解的分子机制。因为在包括番茄在内的许多植物物种中都发现了ETO1的同源序列,我们将番茄转化为拟南芥ETO1研究其对番茄果实中乙烯的抑制作用。
结果
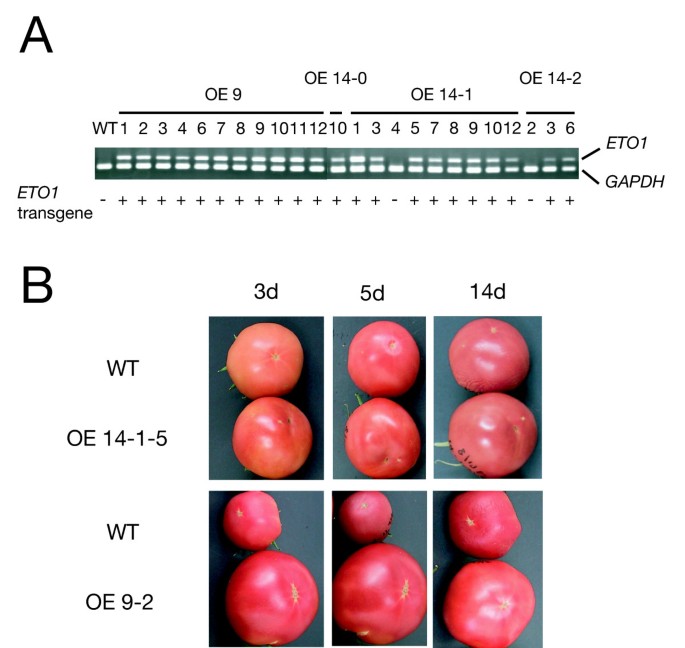
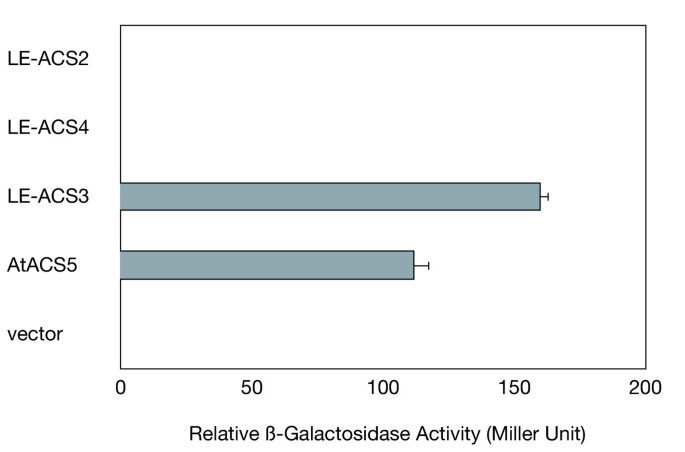
过度表达的转基因番茄系拟南芥ETO1(ETO1-OE)没有显示出果实成熟的显著延迟。因此,我们进行了酵母双杂交试验,以研究ETO1与番茄ACC合成酶的三个同工酶之间可能的异源相互作用。在酵母双杂交系统中,ETO1与LE-ACS3和AtACS5相互作用,而不与LE-ACS2和LE-ACS4这两种主要同工酶相互作用,这两种酶的基因表达在成熟果实中被显著诱导。根据ACC合成酶以c端氨基酸序列为基础的分类,LE-ACS3和AtACS5均属于2型同工酶,具有一致的c端序列。相比之下,LE-ACS2和LE-ACS4分别是1型和3型同工酶,它们都不具有这个特定的c端序列。利用LE-ACS2和LE-ACS3之间的嵌合结构进行酵母双杂交分析,发现2- acs2特异性的c端尾与ETO1相互作用是必需的。用生长素诱导时LE-ACS3,苗ETO1-OE产生的乙烯比野生型少,尽管有相似的表达LE-ACS3野生型的基因。
结论
这些结果表明ETO1家族蛋白特异性地与2型ACC合成酶相互作用并负调控。我们的数据也表明了这一点拟南芥ETO1可调控异种植物番茄2型ACS。
背景
乙烯是一种简单的气体,作为植物激素;它控制植物生命周期中的各种过程,包括种子萌发、根毛发育、根结瘤、花衰老、脱落和果实成熟[1].乙烯也可在反应病原体攻击、损伤、缺氧、臭氧、低温和冰冻等应激时合成[2].这些反应是通过整合乙烯生物合成、感知和信号转导途径来控制的。乙烯的生物合成和信号通路在生理学、生物化学、分子生物学和遗传学方面都有很好的特征。的研究拟南芥揭示了所有植物乙烯信号通路中普遍保守的一组成分。乙烯被乙烯受体家族ETR1、ETR2、EIN4、ERS1、ERS2感知[3.- - - - - -6],它们的组装需要RAN1铜转运体[7].信号被信号通路组件CTR1进一步转导,CTR1是一个类似raf的MAPKKK [8,9, EIN2,一种与nramp相关的整体膜蛋白[10],以及转录调控因子EIN3/EILs的级联[11], ERF1 [12], EDF1-4 [13].EIN3/EIL蛋白被乙烯调节的EBF1/2 F-box蛋白水解,在调节所有已知的激素反应中起着关键作用[14,15].认为MAPK(包括AtMPK6)级联参与乙烯信号转导[16],然而,最近的一项研究表明,AtMPK6并不参与乙烯信号转导,而是通过AtACS6参与乙烯生物合成的调控[17,18].其他尚未确认的成分也被认为与此有关[19,20.].
对乙烯的生物合成途径进行了详细的研究,并对两种关键酶的编码基因进行了克隆和表征[21- - - - - -25].1-氨基环丙烷-1-羧酸(ACC)合成酶(ACS)转化年代-腺苷- l-蛋氨酸(SAM)转化ACC, ACC氧化酶(ACO)氧化ACC产生乙烯。一般情况下,ACS催化的反应是一个速率限制步骤[26].
ACS和ACO在许多植物物种中都由基因家族编码。就番茄而言(Lycopersicon esculentum),至少有10个ACS(27)和四个华基因(28].的成员ACS而且华基因家族在发育过程中或对发芽、叶片衰老和花脱落、果实成熟、伤害、浸水、暴露于臭氧、触摸、激素治疗和病原体攻击等刺激的反应中表达差异[28- - - - - -33].最近的研究结果表明,转录后调控是控制的一个重要方面ACS表达式[22,34- - - - - -38].药理和分子生物学研究表明,磷酸化参与了ACS活性的调节[34,39].番茄ACS, LE-ACS2,在c端区域被磷酸化,这种修饰似乎参与了酶的翻译后调节[40].然而,植物在转录后或翻译后水平调控乙烯生物合成的分子机制尚不清楚。
最近的研究拟南芥等hylene -overproducer突变体(eto1,eto2-1,eto3)(36- - - - - -38,41揭示了乙烯生物合成的翻译后调节机制。的采访时表示在没有外源激素作用的情况下,突变体组成地表现出乙烯诱导的三重反应表型;它们可以被区别开来ctr1突变体,在没有乙烯的情况下也表现出三重反应,因为表型采访时表示乙烯生物合成和作用的抑制剂抑制突变体[8,42].因此,采访时表示突变体可能在乙烯生物合成的调控酶或结构酶中受损。eto1是一种隐性突变,与野生型植物相比,黄化幼苗的乙烯过剩产量约为10倍[42),而eto2-1而且eto3是在黄化苗中分别导致乙烯生物合成增加20倍和100倍的显性突变[8].的eto2-1而且eto3被鉴定为突变内密切相关的AtACS5而且AtACS9基因,分别。这些突变导致每种蛋白质c端氨基酸序列的改变[36,38].此外,这两个eto1而且eto2-1突变增加了AtACS5蛋白的稳定性[38],提示某些ACC合成酶的c端参与了ETO1介导的ACS蛋白的翻译后调控/加工或稳定性。另一项研究表明,AtMPK6通过一种未知的机制磷酸化AtACS6的c端以稳定同工酶[17].
ETO1蛋白的鉴定揭示了调控AtACS5活性和稳定性的分子机制[41].ETO1是一个新的植物特异性蛋白家族的成员,具有三个不同的蛋白-蛋白相互作用基序,即n端BTB结构域和c端TPR结构序以及一个螺旋-线圈结构序。c端TPR结构域与AtACS5相互作用,n端BTB结构域与E3泛素连接酶复合物的组成部分AtCUL3相互作用,ETO1被认为是底物特异性适配器蛋白。ETO1抑制AtACS5的酶活性,并以蛋白酶体依赖的方式靶向该蛋白进行降解。其他研究也表明,蛋白质水解参与了乙烯生物合成的调节[43,44].
ETO1有两个谬误拟南芥、EOL1及EOL2 (ETO1 -lIKE),两者都与AtACS5相互作用并抑制其活性。虽然在包括番茄在内的许多其他植物物种中都发现了ETO1相关序列,但没有研究检验ETO1蛋白家族成员是否可以与AtACS5以外的ACC合成酶相互作用并调节ACC合成酶。在本研究中,我们利用番茄的异源系统,证明et1特异性地与ACC合成酶的一个亚家族,即2型ACC合成酶,包括AtACS5、AtACS9和LE-ACS3相互作用,但不与其他类型的ACC合成酶,包括AtACS6、LE-ACS2和LE-ACS4相互作用。的本构表达式ETO1导致转基因番茄中2型ACC合成酶LE-ACS3的转录后抑制。这些结果表明,ETO1蛋白家族成员是植物王国中2型ACC合成酶负调控的组成部分。
结果
过度表达ETO1的转基因番茄植株果实成熟不受影响
ETO1的同源序列在许多植物物种中都有发现,包括番茄[HY和JRE,未发表的数据]。这些同源物在其TPR结构域上与ETO1具有高度的相似性,这些结构域被认为参与了与ACC合成酶的特异性相互作用[41].实际上,两个ETO1的谬误拟南芥EOL1和EOL2在酵母细胞中与AtACS5相互作用并抑制其活性大肠杆菌。在番茄中,乙烯是果实成熟的关键调节剂[45], LE-ACS2和LE-ACS4已被证明参与了这一过程[46].因此,有可能是番茄中的任何ETO1同源物与ACS同工酶相互作用和调节。因为我们期望异源相互作用拟南芥ETO1和LE-ACS2或LE-ACS4会抑制番茄果实中乙烯的生物合成并阻碍其发育拟南芥ETO1CaMV 35S启动子调控的cDNA导入番茄(l . esculentum简历。Shu-gyoku)通过农杆菌属介导的转换。在含有卡那霉素的培养基上选择转化菌,并使用聚合酶链反应(PCR)进行验证(见方法)。的表达ETO1T基因的转基因1分离的个体通过逆转录(RT)-PCR检测。所有的T1含有转基因的细胞系表达外源ETO1基因(图。1).22 T1个人ETO1-overexpressing (ETO1-OE)系由四个独立的T衍生而来0行(无花果。1).然而,所有的果实ETO1-OE系在与野生型植物相同的时间过程中发展为全红色(图。1 b).这些结果表明,ETO1可能没有抑制成熟番茄果实中两种主要的ACS同工酶LE-ACS2和LE-ACS4,因为ETO1与LE-ACS2和LE-ACS4没有明显的相互作用。
ETO1在酵母细胞中专门与LE-ACS3相互作用,而不与LE-ACS2或LE-ACS4相互作用
研究潜在的相互作用之间拟南芥我们对番茄的三种ACS同工酶LE-ACS2、LE-ACS3和LE-ACS4进行了酵母双杂交分析。如前所述,LE-ACS2和LE-ACS4是参与番茄果实成熟的主要ACS同工酶。LE-ACS3受生长素和水浸的诱导[46,47].在酵母双杂交试验中,尽管LE-ACS3显示出与ETO1的强相互作用,其水平与AtACS5相当,但LE-ACS2和LE-ACS4均未与ETO1相互作用(图1)。2).这些结果表明ETO1可能对包括LE-ACS3和AtACS5在内的ACS同工酶有偏好。
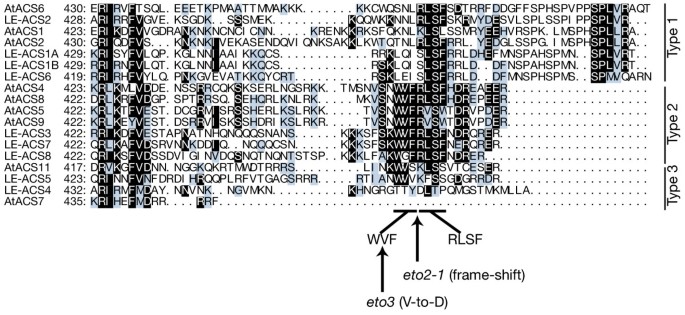
为了研究这种可能性,我们聚焦于各种ACC合成酶的c端拟南芥和番茄作为ETO1的潜在靶点。ACC合成酶的c端氨基酸序列是这些蛋白质中最不保守的部分[26,48].然而,在几个ACC合成酶的c端有一个小的保守基序,RLSF(精氨酸[R] -亮氨酸[L] -丝氨酸[S] -苯丙氨酸[F]) [27,38,40].Oetiker等人根据DNA序列的相似性对ACC合成酶进行了分类。[35],以及基于氨基酸序列相似性的系统发育分类拟南芥ACC合成酶也被设计出来[17,49].除了这些分类外,基于上述的c端共识基序,我们进一步对番茄和番茄的ACS同工酶进行了分类拟南芥如图所示分为三种类型。3.:(1) RLSF一致序列后的长尾(23-27个氨基酸)同工酶(如LE-ACS2);(2)在RLSF之前具有'WVF(色氨酸[W] -缬氨酸[V] -苯丙氨酸[F])'共识序列的同工酶,在RLSF之后具有富含精氨酸[R]和酸性氨基酸(天冬氨酸[D]或谷氨酸[E])的短尾(5-8个氨基酸),以'ER(谷氨酸[E] -精氨酸[R])'共识结尾的同工酶(如AtACS5和LE-ACS3);(3)缺少RLSF共识序列的同工酶(如AtACS7和LE-ACS4)。AtACS3、AtACS10和AtACS12不包括在此对齐中,因为AtACS3为假基因,AtACS10和12不是ACC合成酶,而是转氨酶[27].接下来,我们使用“类型”而不是“类”来避免以前基于序列的分类和我们基于c端基序和结合ETO1/EOL蛋白能力的功能分类之间的混淆。
基于番茄ACC合成酶c端的分类拟南芥。ACC合成酶可以根据其c端氨基酸序列的相似性分为三种不同的类型。ACC合成酶c端氨基酸序列使用CLASTALW程序进行比对,使用MacBoxShade绘制,并分为三种不同的类型。八个ACC合成酶拟南芥(AtACS1、AtACS2、AtACS4、AtACS5、AtACS6、AtACS7、AtACS8、AtACS9和AtACS11;AtACS3被认为是假基因,AtACS10和AtACS12是转氨酶)和来自番茄的9个基因(LE-ACS1A, LE-ACS1B, LE-ACS2, LE-ACS3, LE-ACS4, LE-ACS5, LE-ACS6, LE-ACS7和LE-ACS8)对齐。相同的氨基酸和保守的变化分别用反转和阴影字符表示。WVF和RLSF基序和突变位点eto2-1而且eto3是表示。
尽管AtACS11、LE-ACS4和LE-ACS5的c端尾长度与2型同工酶相当,但它们缺乏RLSF基序和R/D/ e富区。因此,我们将这三种同工酶与c端尾巴短得多的AtACS7一起归为3型同工酶。AtACS5和LE-ACS3与ETO1相互作用强,属于类型2,LE-ACS2属于类型1,LE-ACS4属于类型3。因为我们之前已经证明AtACS5的c端是ETO1的靶点,这增加了2型ACC合成酶的c端包含一些与ETO1相互作用所必需的特定特征的可能性,而这些特征在其他植物中也可能是保守的。
酵母菌中ETO1不与LE-ACS2的一系列c端缺失突变体相互作用
如上所述,第2型ACC合成酶的一个显著特征是RLSF基序后c端尾的长度。1型ACC合成酶在RLSF后具有比2型更长的c端尾,而3型同工酶缺乏RLSF。此外,ACS的c端似乎被蛋白水解了在活的有机体内(50].尽管另一项研究表明,1型酶LE-ACS2的c端截断不会发生在活的有机体内(40],其他1型ACC合成酶的c端可能被截断到“最佳长度”(即与2型相似的长度),然后可能能够与ETO1家族蛋白相互作用。因此,我们研究了改变ACS蛋白c端尾的长度对其与ETO1相互作用的影响。
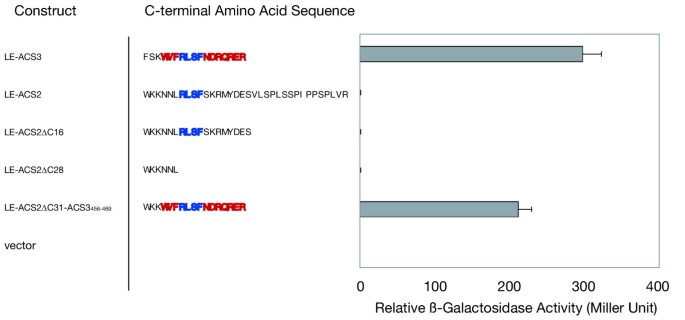
构建两个LE-ACS2 c端截断突变体,将其cDNA克隆到pACT2中(方法见)。LE-ACS2Δ16含有从c端缺失的16个氨基酸;因此,其c端长度可与天然的2型ACS蛋白相媲美。4).另一个突变体LE-ACS2Δ28被修剪到RLSF上游的一个氨基酸(图。4).如果RLSF后的c端尾部的特定长度对于与ETO1的相互作用是必要的,那么LE-ACS2Δ16应该与ETO1相互作用,而LE-ACS2Δ28不应该。然而,在酵母双杂交试验中,这些被截断的突变体都不能与ETO1相互作用。4).这些结果表明,1型ACS的c端长度并没有阻止ETO1的结合。简单地将1型ACS的c端尾截短到2型同工酶的长度不足以与ETO1相互作用,这意味着需要其他因素来介导这种相互作用。
2型ACC合成酶的c端序列是与ETO1相互作用所必需的
接下来,我们检测了RLSF周围2型特异性氨基酸序列对ETO1相互作用的影响。如前所述,2型ACC合成酶具有特定的c端一致序列(即WVFRLSF基序后面是R/D/ e丰富区)。RLSF在1型和2型ACC合成酶中都是保守的,而WVF基序和R/D/E-rich区域仅在番茄和番茄的2型ACC合成酶中是保守的拟南芥(无花果。3.).在eto3突变时,该WVF基序中的缬氨酸残基突变为AtACS9中的天冬氨酸[38,暗示了这个小母题的重要作用(图。3.).我们用LE-ACS3的456-469氨基酸(LE-ACS2ΔC31::LE-ACS3)取代了LE-ACS2的c端31个氨基酸456 - 469).这种ACS嵌合蛋白足以将与ETO1的强相互作用恢复到与LE-ACS3相当的水平。4).这些结果强烈表明,包含WVFRLSF基序和R/D/E-rich区域的c端尾是2型ACS特异性的,是与ETO1相互作用的必要和充分条件。
ETO1过表达抑制番茄幼苗生长素诱导的乙烯生物合成
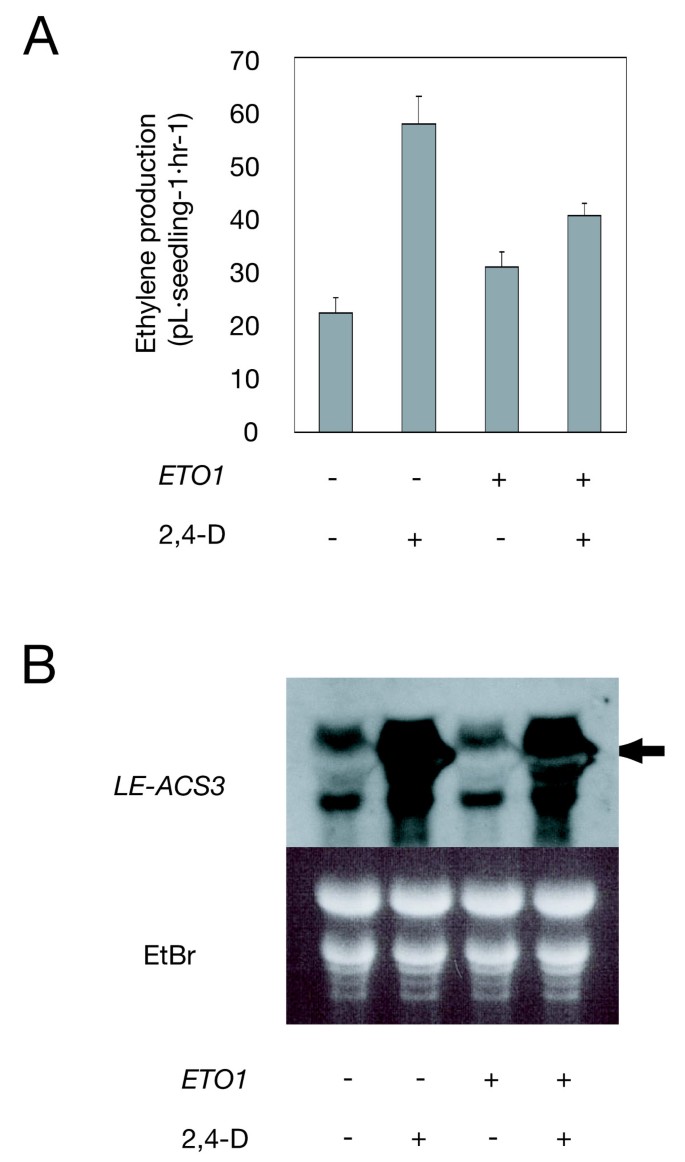
研究ETO1与LE-ACS3的相互作用在足底我们研究了合成生长素2,4- d对黄化番茄幼苗乙烯生物合成的诱导作用。使用T2属纯合子系的幼苗ETO1oe (14-1-H2;不包括在图中。1),我们测量了乙烯从生长素处理的野生型和ETO1转基因番茄幼苗。
当6日龄黄化野生型幼苗经100 μM 2,4- d处理24 h时,其乙烯产量是未处理的2.1倍(图1)。5).LE-ACS32,4- d处理在野生型中诱导mRNA(图。5 b).然而,当ETO1-OE转基因植物以这种方式处理,它们只比未经处理的植物多生产1.6倍的乙烯,尽管LE-ACS3mRNA被强烈诱导到与野生型相当的水平。5而且5 b).以上结果与酵母双杂交试验结果一致,表明过表达ETO1蛋白可能在一定程度上抑制LE-ACS3的ACS活性,从而导致乙烯生物合成的减少,与AtACS5和细胞分裂素处理相同拟南芥(41].
讨论
ETO1与2型ACC合成酶相互作用并抑制
在之前的研究中,我们证实了ETO1,一个新的植物特异性BTB/TPR蛋白,负调控乙烯生物合成酶拟南芥AtACS5,通过直接相互作用[41].然而,这种相互作用和调节作用是否仅限于AtACS5及其同源物,还是在整个植物ACC合酶家族中普遍存在,尚未阐明。在这项研究中,我们发现ETO1和ACS之间的相互作用仅限于2型ACS同工酶。我们根据ACC合成酶的c端氨基酸序列将其分为三种类型。Oetiker等人分类中番茄“I类”ACC合成酶的所有成员(LE-ACS1A, LE-ACS1B, LE-ACS6) [35]对应于我们的1型ACC合成酶,而它们的“II类”(LE-ACS2和LE-ACS4)和“III类”(LE-ACS3和LE-ACS5)都包含了我们的1型和3型的成员。这种差异可能是由于不同的系统发育分析方法(即部分DNA序列[35和c端氨基酸序列[本文])。另一方面,我们的2型同工酶拟南芥在B组ACC合成酶中被分为两个密切相关的系统发育分支[49], 3型同工酶属于B组分支,而不是“2型”分支。我们的1型同工酶也对应于A族同工酶[49].这些巧合可能反映了每种同工酶的功能相关性,事实上,密切相关的ACS同工酶之间的功能异二聚已被证实[49].
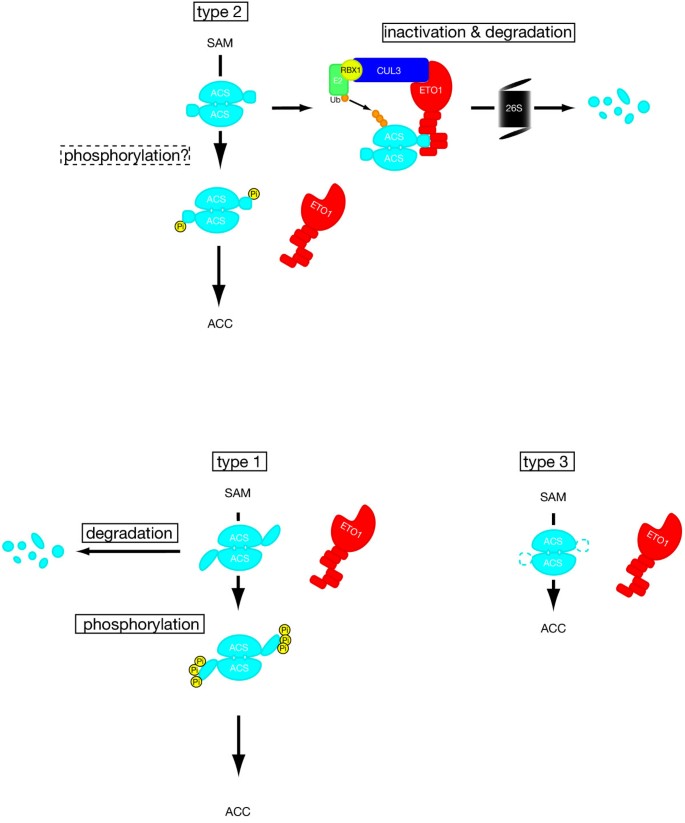
乙烯生物合成的内源性调控因子在植物发育、对胁迫的反应和果实成熟中的作用尚不清楚。因为番茄至少有一个ETO1的同源物[LeEOL1;HY和JRE,未发表],ACS同工酶家族和许多乙烯相关表型,我们测试了ETO1是否可以与番茄ACC合酶家族的成员相互作用和抑制。我们发现,在酵母双杂交系统中,ETO1特异性地与两种2型ACC合成酶AtACS5和LE-ACS3相互作用,但与LE-ACS2(1型)或LE-ACS4(3型)不相互作用。此外,我们证明过表达的ETO1转基因在异源植物中转录后抑制LE-ACS3的活性。这些结果表明,2型ACC合成酶代表了一组与ETO1家族蛋白特异性相互作用并被ETO1家族蛋白抑制的蛋白。6).是否对ETO1家族有抑制作用在足底限于2型仍是未知的;我们还没有检查et1与LE-ACS2和LE-ACS4的相互作用在足底。在酵母双杂交系统中,ETO1的相互作用明显局限于2型同工酶。然而,在足底atmpk6依赖的AtACS6磷酸化(1型ACS)可以稳定该同工酶并增加乙烯的生物合成[17].此类第1型ACC合成酶修饰的磷酸化可能授予与ETO1相互作用的能力[52].此外,LE-ACS2的RLSF基序内丝氨酸残基的钙依赖性磷酸化[40],或任何蛋白水解裂解[27,40可能改变c端构象,并使之与ETO1家族相互作用。这些可能性可以通过使用能够区分1型ACS的磷酸化和非磷酸化形式的抗体的共免疫沉淀实验来阐明,或者使用1型特异性c端肽的下拉实验来阐明。相反,3型ACC合成酶不包含这个潜在的磷酸化位点,这表明它们可能没有类似的调节。Ctr的-组成表达AtACS5 c端截断版本的植物表型[41支持这一假设。
ETO1对ACC合成酶的2型特异性调控模型。ACC合成酶和ETO1蛋白分别显示为浅蓝色和红色。ACS的c端为浅蓝色小圆或椭圆形。注意,每一对ACC合成酶形成一个具有共享活性位点的二聚体(每个二聚体有两个囊)。上面板:2型ACS二聚体与ETO1相互作用。因此,ACS的酶活性被抑制,并靶向于蛋白酶体依赖的降解。但2型ACS的c端未知修饰(可能是磷酸化(黄圈))可能抑制ACS和ETO1之间的相互作用,从而导致ACC的产生。下面板(左)1型:由于1型ACS的c端尾部(蓝色椭圆形)不适合与ETO1相互作用,因此ETO1不与1型ACS二聚体相互作用,但ETO1也被降解,其降解机制尚不明确。MAPK的c端三倍磷酸化稳定了1型ACS二聚体,二聚体从SAM产生ACC。下面板(右),type 3: ETO1不与type 3 ACS二聚体相互作用,因为它缺乏与ETO1相互作用所需的特定的c端尾。
另一个问题是ETO1家族的其他成员是否与其他类型的ACC合成酶相互作用。在酵母双杂交系统中,EOL1的两个分支EOL1和EOL2都显示出与番茄ACC合成酶的相互作用,与EOL1类似(即,它们只与2型ACS相互作用,而不与1型或3型ACS相互作用;数据未显示)。这表明2型特异性调控可能与ETO1家族的其他成员相同,至少在酵母细胞中是这样。然而,除了2型同工酶修饰外,任何EOL蛋白都可能与ACC合成酶相互作用并抑制ACC合成酶在足底仍然不排除。
2型ACS特异的c端序列是ETO1的靶点
2型ACS特异的c端氨基酸序列(即WVFRLSF后面是富含R/D/ e的区域)是ETO1的靶点。此外,在RLSF中发现了AtACS5的R/D/ e富区突变eto2-1AtACS9的WVF基序eto3突变体(36,38强烈暗示了这种氨基酸序列的重要性。在分子病变中拟南芥eto1目前发现的突变,eto1-1仅缺乏最后一个TPR基序的ETO1 (tETO1)的c端缺失突变体在酵母双杂交试验中未能与AtACS5相互作用[41].这些结果表明et1的TPR基序在与AtACS5的相互作用中是必不可少的。
TPR基序参与多种蛋白质-蛋白质相互作用。一般来说,TPR结构域与其目标肽之间的相互作用受到静电和疏水相互作用的严格限制[53].在这方面,ACC合成酶的2型特异性c端具有一些与ETO1的TPR严格相互作用所需的特征。LE-ACS2的晶体结构已经确定,LE-ACS2的c端尾部似乎从ACS单体和二聚体表面突出[54].在LE-ACS2的二聚体形式(头尾方向)中,n端残基11-19与c端螺旋H14在c端尾之前接触。N端和c端相互作用的意义尚不清楚,但正如生化研究表明的,它可能对构象稳定和催化很重要[50].WVF基序可能位于N端和c端相互作用区域之外,可能对与ETO1相互作用表面的形成很重要。ETO1-ACS配合物的晶体结构分析将揭示WVF基序的意义。另外,2型ACS的同工酶LE-ACS8不具有精确的WVF序列。相反,它包含WGF,与WVF密切相关(图。3.).相比之下eto3在AtACS9版本中,WVF基序的缬氨酸残基转变为带电的天冬氨酸残基,LE-ACS8的c端甘氨酸残基为中性氨基酸。因此,LE-ACS8很可能也像其他2型同工酶一样与ETO1相互作用。
乙烯生物合成的翻译后调控
我们已经确定了许多的同源序列ETO1这表明以eto1为基础的调控系统在植物王国中很常见。在目前的研究中,我们证明了拟南芥ETO1在异源植物番茄中与2型ACS - LE-ACS3互作并转录后调控。这说明ETO1蛋白家族是植物乙烯生物合成负调控的共同组成部分。考虑到eto1的同源序列在所有植物中都有,但在动物或原核生物中没有,这个乙烯调节系统可能在植物进化的早期就已经形成了。ACC合成酶类似于依赖吡氧醛5-磷酸(PLP)转氨酶的I亚群家族[55].这两个家族的相似性大多在活性位点附近,而ETO1的靶点位于ACS的c端,在保守区之外。早期植物是如何获得这种调节乙烯生物合成的独特机制的,这是一个有趣的问题。
最后,有人可能会问,为什么只有2型ACC合成酶受ETO1调控。对植物来说,及时合成乙烯是非常必要的。例如,一个显著的表现型采访时表示在黄化苗期观察到突变体,表明乙烯的产生在萌发过程中受到ETO1的调节。虽然乙烯的进化对种子的萌发很重要,但如果长时间过量使用乙烯,幼苗会继续表现出类似于三重反应的表型,这种表型在种子萌发后通常消失。乙烯在应对各种压力方面也很重要。为了避免乙烯在生理和发育过程中产生不必要的过量,植物必须进化出一个由2型ACC合成酶和ETO1蛋白家族和未知系统(如AtMPK6-AtACS6系统)组成的严格调控系统,以便及时控制乙烯的生物合成,直到需要这种重要的生长调节剂和应激植物激素。
结论
在本研究中,我们阐明了ETO1蛋白的底物特异性。我们发现ETO1与ACS蛋白家族的相互作用仅限于具有特定c端氨基酸序列的2型ACS同工酶。我们的数据表明ETO1抑制了生长素诱导的乙烯进化LE-ACS3还表明,拟南芥ETO1在异源植物中可调控2型ACS。
方法
植物材料
野生型植物及转化番茄(l . esculentum简历。在温室的标准条件下种植。转化苗生长在添加1/2 × Murashige和Skoog (MS)最低盐的培养基上。
转换的番茄
在含NAA 1 mg/l, BA 0.5 mg/l,蔗糖3%的MS培养基上预培养番茄下胚轴或子叶农杆菌属介导的过程(56].全身的ETO1cDNA在CaMV 35S启动子和pROK2载体的Nos终止子之间进行定向导入NPT2基因作为可选择标记[41].用特异引物对35S启动子进行PCR扩增,确定转化植株ETO1互补脱氧核糖核酸。
核酸分析
基因组DNA采用Isoplant II (Nippon Gene)进行分离。使用RNeasy Plant Mini Kit (Qiagen)提取总RNA。转录水平的ETO1逆转录- pcr法分析总RNA。RNA (1 μg)用于每个RT-PCR,遵循制造商的协议(Titan One Tube RT-PCR系统,罗氏诊断)。Gene-specific引物对ETO1被使用,GAPDH被用作内部控制。两种引物被添加到同一管中。PCR扩增进行第一轮10周期如下:变性在94°C,持续30秒,退火30秒55°C,在68°C和扩展了45秒,然后进行第二轮周期如下:变性在94°C,持续30秒,退火30秒55°C,在68°C和扩展了45秒+ 5 /周期秒。最后在68°C扩展进行了7分钟,然后反应是停在4°C。在Northern blot分析中,每个lane使用总RNA (10 μg),并将其印迹到带正电的尼龙膜上(罗氏诊断)。digg标记的RNA探针LE-ACS3是按照制造商的方案合成的(罗氏诊断),并由CDP-Star检测(罗氏诊断)。
酵母2台混合动力分析
酵母双杂交试验如前所述进行[41].ETO1cDNA被克隆到pAS2载体中。互补的LE-ACS2,LE-ACS3,LE-ACS4通过RT-PCR,使用SuperScriptII (Invitrogen)逆转录酶和空斑形成单位涡轮DNA聚合酶(Stratagene),并克隆到pACT2。的缺失或嵌合突变体LE-ACS2而且LE-ACS3用PCR方法构建空斑形成单位涡轮DNA聚合酶。根据制造商的说明(BD Biosciences),对β-半乳糖苷酶活性进行定量液体测定。每个实验都使用独立的克隆体重复至少三次。
乙烯生物合成的测定
黄化苗(每瓶1株)2纯合子系14-1-H2 (ETO1/ETO1)及14-1-H4 (wt/wt)生长在小瓶(直径10毫米,长75毫米,带橡胶隔)中,其中含有1克海沙(20-35目,Wako Chemicals)和0.5毫升水,在28°C的黑暗环境中。6 d后,加入2,4- d(在1%乙醇中)至终浓度为100 μM,在相同条件下培养。第二天,使用配备活性氧化铝柱(60/80目,3 mm × 1.5 m)和FID的气相色谱仪(型号GC-7A, Shimadzu)测量累积的乙烯。从顶空注入0.5 ml体积的每个样品到柱上。每次治疗使用8个个体。乙烯产量以pL·苗计算-1·人力资源-1。
参考文献
- 1.
Johnson PR, Ecker JR:乙烯气体信号转导途径:一个分子的角度。科学通报,1998,32:227-254。10.1146 / annurev.genet.32.1.227。
- 2.
王klc,李宏,Ecker JR:乙烯生物合成与信号网络。植物生态学报,2004,15(4):381 - 381。
- 3.
张聪,郭顺丰,Bleecker AB, Meyerowitz EM:拟南芥乙烯反应的基因ETR1:产品与双组分调节器的相似度。科学通报,2003,29(4):539-544。
- 4.
华健,常超,孙强,Meyerowitz EM:乙烯不敏性拟南芥人队基因。科学通报,1995,29(4):514 - 514。
- 5.
华J,酒井H, Nourizadeh S,陈庆国,Bleecker AB, Ecker JR, Meyerowitz EM:EIN4而且ERS2假定的乙烯受体基因家族的成员在吗拟南芥。植物学报,1998,10:1321-1332。10.1105 / tpc.10.8.1321。
- 6.
华娟,Meyerowitz EM:乙烯反应受一个受体基因家族的负调控拟南芥。细胞学报,1998,94:261-271。10.1016 / s0092 - 8674(00) 81425 - 7。
- 7.
Hirayama T, Kieber JJ, Hirayama N, Kogan M, Guzman P, Nourizadeh S, Alonso JM, Dailey WP, Dancis A, Ecker JR:乙烯信号通路需要响应-拮抗蛋白1,一种与门克斯/威尔逊病相关的铜转运蛋白拟南芥。细胞科学。1999,97:383-393。10.1016 / s0092 - 8674(00) 80747 - 3。
- 8.
基伯JJ,罗森伯格M,罗曼G,费尔德曼KA,埃克JR:CTR1,乙烯反应通路的负调控因子拟南芥,编码Raf蛋白激酶家族的一个成员。细胞学报,1993,72:427-441。10.1016 / 0092 - 8674 (93) 90119 - b。
- 9.
Clark KL, Larsen PB, Wang X, Chang C:协会拟南芥CTR1 raf样激酶与ETR1和ERS乙烯受体。美国国家科学研究院。1998年,95:5401 - 5406。10.1073 / pnas.95.9.5401。
- 10.
Alonso JM, Hirayama T, Roman G, Nourizadeh S, Ecker JR: EIN2,乙烯的双功能传感器和应力响应拟南芥。科学通报,1999,38(4):447 - 447。10.1126 / science.284.5423.2148。
- 11.
Chao Q, Rothenberg M, Solano R, Roman G, Terzaghi W, Ecker JR:乙烯气体反应通路的激活拟南芥由核蛋白乙烯不敏蛋白3和相关蛋白。细胞学报,1997,89:1133-1144。10.1016 / s0092 - 8674(00) 80300 - 1。
- 12.
索拉诺R, Stepanova A, Chao Q, Ecker JR:乙烯信号通路中的核事件:乙烯-不敏感3和乙烯-反应因子1介导的转录级联。基因学报,1998,12:3703-3714。
- 13.
Leisse TJ,阿隆索JM,斯金CJ,陈H,希恩P,史蒂文森DK,齐默尔曼J,巴拉哈斯P, Cheuk R, Gadrinab C,海勒C, Jeske, Koesema E,迈耶斯CC,帕克H, Prednis L,安萨里Y,白菜N,迪恩H, Geralt M, Hazari N, Hom E,圆锥形石垒,穆赫兰C, Ndubaku R,施密特,古兹曼P, Aguilar-Henonin L,施密德M,魏盖尔D,卡特德玛珊德T, Risseeuw E, Brogden D,泽柯,克罗斯比西城,贝瑞CC,艾克尔JR:全基因组的插入突变拟南芥。科学通报,2003,30(3):553 - 557。10.1126 / science.1086391。
- 14.
郭宏,Ecker JR:植物对乙烯气体的反应是由SCF介导的EBF1 / EBF2-依赖的EIN3转录因子蛋白水解。细胞学报,2003,115:667-677。10.1016 / s0092 - 8674(03) 00969 - 3。
- 15.
Potuschak T, Lechner E, Parmentier Y, Yanagisawa S, Grava S, Koncz C, Genschik P: ein3依赖性植物乙烯激素信号转导的调控作用拟南芥F盒蛋白:EBF1和EBF2。细胞科学,2003,15:679-689。10.1016 / s0092 - 8674(03) 00968 - 1。
- 16.
Ouaked F, Rozhon W, Lecourieux D, Hirt H: MAPK通路介导植物乙烯信号转导。中华医学杂志,2003,22:1282-1288。10.1093 / emboj / cdg131。
- 17.
刘颖,张松:1-氨基环丙烷-1-羧酸合成酶被应激响应型丝裂原活化蛋白激酶MPK6磷酸化,诱导乙烯生物合成拟南芥。植物学报,2004,16:3386-3399。10.1105 / tpc.104.026609。
- 18.
Ecker JR:乙烯MPK6模块重返大气层。植物学报,2004,16:369 - 371。10.1105 / tpc.104.161210。
- 19.
Roman G, Lubarsky B, Kieber JJ, Rothenberg M, Ecker JR:植物乙烯信号转导的遗传分析拟南芥: 5个新的突变位点整合到一个应激反应通路。中国生物医学工程学报,2004,25(3):369 - 369。
- 20.
Larsen PB, Chang C: The拟南芥eer1突变体增强了下胚轴和茎的乙烯反应。植物生理学报,2001,25(3):366 - 366。10.1104 / pp.125.2.1061。
- 21.
植物乙烯生物合成的关键酶1-氨基环丙烷-1-羧酸合成酶mRNA的克隆。美国国家科学研究院。1989年,86:6621 - 6625。
- 22.
中岛N,中川N, Imaseki H:创伤诱导的1-氨基环丙烷-1-羧酸合酶的分子大小Cucurbita最大值荷兰人。损伤后酶的可翻译mRNA的变化。植物生理学报,1998,29:989-998。
- 23.
Hamilton AJ, Bouzayen M, Grierson D:通过酵母表达鉴定番茄乙烯生成酶基因。美国国家科学研究院。1991年,88:7434 - 7437。
- 24.
番茄中乙烯生成酶mRNA的功能表达分析及克隆非洲爪蟾蜍光滑的卵母细胞。中华医学杂志,1991,10:2007-2013。
- 25.
Van der Straeten D, Rodrigues-Pousada RA, Villarroel R, Hanley S, Goodman HM, Van Montagu M: an的克隆、基因定位和表达分析拟南芥编码1-氨基环丙烷-1-羧酸合成酶的基因。美国国家科学研究院。1992年,89:9969 - 9973。
- 26.
乙烯生物合成。植物生理学报,1998,25(4):369 - 369。10.1146 / annurev.pp.44.060193.001435。
- 27.
山上文,王文华,王文华,王文华,王文华,王文华拟南芥基因家族。中国生物医学工程学报,2003,29(3):394 - 394。10.1074 / jbc.M308297200。
- 28.
Moeder W, Barry CS, Tauriainen AA, Betz C, Tuomainen J, Utriainen M, Grierson D, Sandermann H, Langebartels C, Kangasjarvi J: 1-氨基环丙烷-1-羧酸合酶和1-氨基环丙烷-1-羧酸氧化酶基因双相诱导下的乙烯合成是过氧化氢积累和臭氧暴露番茄细胞死亡的必要条件。植物生理学报,2002,30(4):381 - 381。10.1104 / pp.009712。
- 29.
杨顺峰,Hoffman NE:高等植物乙烯的生物合成及其调控。植物生理学报,1988,35:155-189。10.1146 / annurev.pp.35.060184.001103。
- 30.
Mattoo AK, Suttle JC:植物激素乙烯。CRC出版社;1991.
- 31.
2.《乙烯在植物生物学中的作用》。学术出版社;1992.
- 32.
Nakatsuka A、Murachi S、Okunishi H、Shiomi S、Nakano R、Kubo Y、Inaba A: 1-氨基环丙烷-1-羧酸合成酶、1-氨基环丙烷-1-羧酸氧化酶和乙烯受体基因在番茄果实发育成熟过程中的差异表达和内部反馈调控植物工程学报,2004,24(3):366 - 366。10.1104 / pp.118.4.1295。
- 33.
Peck SC, Kende H:黄化豌豆幼苗中编码1-氨基环丙烷-1-羧酸(ACC)合成酶基因的差异调控:吲哚-3-乙酸、伤害和乙烯的影响。植物生物学杂志,1998,38:977-982。10.1023 /: 1006033030081。
- 34.
王晓明,张晓明,张晓明,等。蛋白质磷酸化和去磷酸化调节番茄细胞中1-氨基环丙烷-1-羧酸合成酶的表观转化。植物生理学报,2004,24(4):529-535。
- 35.
杨顺生,邵玉玉,杨顺生:诱导子在番茄悬浮培养中分化诱导7个1-氨基环丙烷-1-羧酸合酶基因(英文)Lycopersicon esculentum).植物生物学杂志,1997,34:275-286。10.1023 /: 1005800511372。
- 36.
Vogel JP, Woeste KE, Theologis A, Kieber JJ:乙烯生物合成基因的隐性和显性突变ACS5的拟南芥分别授予细胞分裂素不敏感和乙烯过度生产。美国国家科学研究院。1998年,95:4766 - 4771。10.1073 / pnas.95.8.4766。
- 37.
Woeste KE, Ye C, Kieber JJ:两个过度产生乙烯的拟南芥突变体影响1-氨基环丙烷-1-羧酸合成酶的转录后调控。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.119.2.521。
- 38.
Chae HS, Faure F, Kieber京晶:eto1,eto2,eto3基因突变和细胞分裂素处理增加乙烯的生物合成拟南芥通过增加ACS蛋白的稳定性。植物学报,2003,15:545-559。10.1105 / tpc.006882。
- 39.
梁旭,沈乃楠,神学A:理+-调控1-氨基环丙烷-1-羧酸合酶基因表达拟南芥。植物学报,1996,10:1027-1036。10.1046 / j.1365 - 313 x.1996.10061027.x。
- 40.
Tatsuki M, Mori H:番茄1-氨基环丙烷-1-羧酸合成酶(LE-ACS2) c端磷酸化。中国生物医学工程学报,2001,26(4):359 - 359。10.1074 / jbc.M101543200。
- 41.
王klc, Yoshida H, Lurin C, Ecker JR:乙烯气体生物合成的调控拟南芥ETO1蛋白质。自然学报,2004,428:945-950。10.1038 / nature02516。
- 42.
Guzman P, Ecker JR:利用三重响应拟南芥识别乙烯相关突变体。植物学报,1990,2:513-523。10.1105 / tpc.2.6.513。
- 43.
Larsen PB, Cancel JD: rub1结合酶的隐性突变,RCE1,揭示了对RUB改性控制乙烯生物合成和适当诱导的要求基本的几丁质酶而且PDF1.2在拟南芥。植物学报,2004,38(4):369 - 369。10.1111 / j.1365 - 313 x.2004.02068.x。
- 44.
Bostick M, Lochhead SR, Honda A, Palmer S, Callis J:与泛素1和2相关的泛素1和2是多余的和必要的,调节植物生长,生长素信号和乙烯的产生拟南芥。植物学报,2004,16:2418-2432。10.1105 / tpc.104.024943。
- 45.
王晓燕,王晓燕,王晓燕。反义RNA对番茄果实衰老的可逆抑制作用。科学通报,1991,34(4):437-439。
- 46.
林肯JE,坎贝尔AD,欧提克J,罗特曼WH,欧勒PW,沈NF,神学A:LE-ACS4番茄果实成熟和创伤诱导的1-氨基环丙烷-1-羧酸合酶基因(Lycopersicon esculentum).表达大肠杆菌、结构表征、表达特征和系统发育分析。中国生物医学工程学报,1994,29(3):394 - 394。
- 47.
叶伟强,摩尔T,杨顺峰:番茄1-氨基环丙烷-1-羧酸合酶4个同源物在不同条件下转录本的差异积累。美国国家科学研究院。1992年,89:2475 - 2479。
- 48.
神学A:乙烯的生物合成和作用:一个节约的案例。植物生物学杂志,1994,26:1579-1597。10.1007 / BF00016491。
- 49.
1-氨基环丙烷-1-羧酸合酶多肽间的异二聚相互作用拟南芥基因家族。美国国家科学研究院。2004年,101:2275 - 2280。10.1073 / pnas.0308515101。
- 50.
Li N, Mattoo AK: 1-氨基环丙烷-1-羧酸合成酶的羧基端区缺失,这是乙烯生物合成中的一个关键蛋白,导致催化活性高的单体酶。中国生物医学工程学报,1994,29(4):369 - 369。
- 51.
Olson DC, Oetiker JH, Yang SF:分析LE-ACS31-氨基环丙烷-1-羧酸合成酶基因在番茄植株根部的淹水过程中表达。中国生物医学工程学报,2004,24(3):366 - 366。10.1074 / jbc.270.23.14056。
- 52.
Kim CY, Liu Y, Thorne ET, Yang H, fukushigh H, Gassmann W, Hildebrand D, Sharp RE, Zhang S:胁迫响应的丝裂原激活蛋白激酶级联激活植物乙烯的生物合成。植物科学学报,2004,25(3):327 - 327。10.1105 / tpc.011411。
- 53.
Scheufler C, Brinker A, Bourenkov G, Pegoraro S, Moroder L, Bartunik H, Hartl FU, Moarefi I: TPR结构域-肽复合物的结构:Hsp70-Hsp90多伴侣机器组装的关键元素。Cell. 2000,101: 199-210。10.1016 / s0092 - 8674(00) 80830 - 2。
- 54.
怀强,夏艳,陈艳,Callahan B, Li N,柯红:1-氨基环丙烷-1-羧酸(ACC)合酶与氨基乙氧乙烯基甘氨酸和吡哆醛-5'-磷酸络合的晶体结构为催化机制提供了新的认识。中国生物医学工程学报,2001,26(3):394 - 394。10.1074 / jbc.M008127200。
- 55.
转氨酶:同源性的证明和进化亚群的划分。中国生物医学工程学报,2004,24(3):359 - 361。10.1111 / j.1432-1033.1993.tb17953.x。
- 56.
永田M,森H,田井Y,佐藤T,平井M, Imaseki H: 1-氨基环丙烷-1-羧酸合酶基因的显义或反义嵌合转化对番茄果实成熟的影响。园艺学报,1995,32(4):326 - 326。
确认
作者感谢E. Kadowaki-Fujii和T. Watase的娴熟协助。我们也感谢北海道地区国家农业研究中心植物生物技术实验室成员和国家农业研究中心水稻应用遗传学实验室成员的支持。这项工作得到了日本农林水产省的部分支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
HY构想了这项研究,为项目安排了资金,制作了转基因番茄,分析了它们的表型和表达ETO1用ACS突变型构建双杂交载体,并进行所有酵母双杂交分析。MN测定了番茄的乙烯进化,并进行了番茄的北方杂交勒-ACS3。KS参与了转基因植物的基因分型和维护。KLCW用ETO1,参与讨论,帮助起草稿件。JRE参与讨论,并协助起草稿件。所有的作者都阅读并认可了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
吉田,H,永田,M,斋藤,K。et al。拟南芥ETO1与2型1-氨基环丙烷-1-羧酸合成酶特异性相互作用并负调控。BMC植物杂志5,14(2005)。https://doi.org/10.1186/1471-2229-5-14
收到了:
接受:
发表:
关键字
- 乙烯生物合成
- 转基因西红柿
- 成熟番茄果实
- 不同的植物
- ETO1蛋白质