摘要
背景
葡萄藤可以是一种鞘周嵌合体植物,它至少由两个不同的细胞层(L1, L2)组成。通过体细胞胚胎发生将该植物的细胞层分离,再生植株可以显示出不同的DNA谱和与亲本植物不同的新表型。
结果
从遗传学上讲,霞多丽克隆96是一种鞘周嵌合体植物,其中L1和L2细胞层是不同的。通过分生体的器官发生获得的植物显示由两层细胞组成。然而,通过从花药或节外植体开始的体细胞胚胎发生再生的植物仅由L1细胞组成。这些体细胞无性系在再生后3年内与亲本无性系没有表型差异。有趣的是,唯一显示非典型表型(不对称叶片)的体细胞无性系显示基因型修饰。
结论
这些结果表明,霞多丽96的表型不是由两个不同的细胞层L1和L2之间的相互作用引起的。如果表型一致性得到进一步证实,体细胞胚胎发生将导致霞多丽96型体细胞无性系的真型,并将很适合基因转移。
背景
葡萄砧木和接穗品种的改良可以通过种间杂交或克隆选择来实现。葡萄无性系选择是指在一个品种中选择一种具有预期特性的植物。这种选定的植物进一步通过已知的保持型真性的营养繁殖进行繁殖。但是克隆选择仅限于给定品种的自然变异,在其特征的范围内,这种特征是型真性的基础。体细胞胚胎发生可能是品种改良的另一种可能。转基因技术为葡萄品种抗病虫害等特性的改良开辟了更广阔的前景,大多数转基因技术是基于葡萄的体细胞胚胎发生[1]和芽器官发生[2].一个需要解决的问题是通过体细胞胚胎发生或芽器官发生培养的葡萄无性系的表型和基因型变异性。最近,Desperriers等.[3.)提出了一项为期十年的观察结果葡萄Gamay体细胞无性系在葡萄的育性、糖含量、大小和成熟度方面都有差异。这些观察表明,体细胞无性系可以在不改变葡萄酒的基本类型性的情况下与原始亲本不同。变异的一个可能的起源可能是生长无性系的母株细胞层的分离。
葡萄分生组织被认为至少由两个不同的细胞层L1和L2组成[4],可以产生嵌合组织结构。例如,葡萄简历。皮诺莫尼耶表型是由于遗传不同细胞层的相互作用。通过体细胞胚胎发生将皮诺莫尼耶皮诺周鞘嵌合体的细胞层分离,再生植株显示出不同的DNA谱,证明与亲本植物不同。再生体细胞无性系也显示出一种新的表型[5].
目前,约有500种葡萄基因组微卫星标记可广泛有效地用于葡萄品种的鉴定[6- - - - - -8].Riazet al。[9]采用微卫星标记技术检测了小麦品种间的可重复性多态性葡萄霞多丽和黑比诺。此外,这些微卫星标记使得在这两个品种的某些无性系中区分L1和L2两个细胞层成为可能[9,10].
先前的论文[11],结果表明,在霞多丽96的叶片组织中,微卫星标记VMC 5g7显示了两个标准等位基因(198:220 bp)和一个Riaz先前定义的变异等位基因(222 bp)等.[9].木材组织和根只存在VMC 5g7的两个标准等位基因。利用第二个微卫星标记(VMC 6g10),在叶片中检测到2个标准等位基因(114:140 bp)和1个突变等位基因(142 bp)。该突变等位基因取代了木材和根中的一个标准等位基因(114:142 bp)。此外,我们还发现,体细胞无性系由单一花序的花药再生而来,全部来源于L1细胞。
在本文中,我们报道了从不同花序的花药或从霞多丽96的节外植体再生的体细胞无性系的更广泛的基因型分析结果。同样的微卫星标记也用于比较通过芽器官发生获得的不同无性系的基因型。基因型特征(L1;L2)的再生无性系符合各自的表型特征。
结果
霞多丽96母无性系各组织的基因型分析
利用微卫星标记VMC 6c10在霞多丽96母无性系叶片中检测到3个等位基因,分别为114 bp和140 bp的标准等位基因和142 bp的变异等位基因1).标准等位基因由Riaz定义et al。[9]是同一品种不同无性系中最常被检测到的等位基因。VMC 5g7在叶片中显示出两个198 bp和220 bp的标准等位基因和一个222 bp的变异等位基因(表2)1).同样的基因型观察到的叶在体外或者是温室种植的植物。VMC 6c10和VMC 5g7分别检测到茎根和木本组织提取的DNA中,只有114:142和198:220两对等位基因被检测到1).在浆果皮肤中,两种标记均可检测到试验等位基因。已知木材和根仅由L2细胞组成,而树叶由L1和L2细胞层组成。结果表明,霞多丽96的L2细胞中存在VMC 6c10 114 bp和142 bp等位基因,VMC 5g7 198 bp和220 bp等位基因。我们还可以推断L1细胞具有VMC 6c10 114 bp和140 bp等位基因,VMC 5g7 198 bp和222 bp等位基因。
通过体细胞胚胎发生或芽器官发生的植物再生
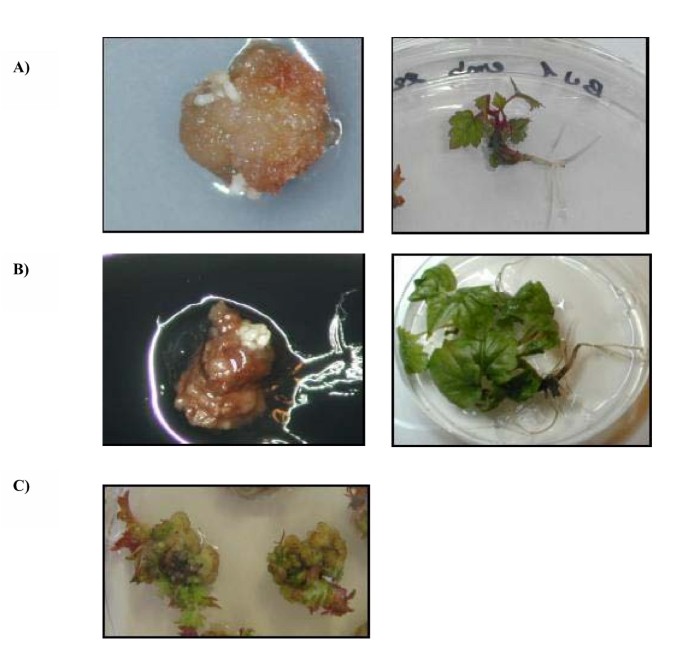
用霞多丽96的四种不同花序采集花药。胚性胚性愈伤组织经过2个月的培养获得初级体细胞胚1).胚性愈伤组织形成1个月后获得次生胚。2-4个月后,从节级外植体获得胚性愈伤组织和初级胚胎(图1 b).在苯腺苷浓度增加到13.2 μM的IM培养基上连续转移后,芽体形成分生体。从分生组织中切下的切片中再生出大量的不定芽,生根植株进一步发育(图1 c).
利用一些体细胞无性系进一步获得了高效的植物生长。与生长室和温室栽培的霞多丽96进行目视比较,植株未表现出任何非典型表型。除1个体细胞无性系(n°21)来源于花药来源的愈伤组织外。
霞多丽96花药和节外植体体细胞无性系的基因型分析
从4个不同花序的花药中再生的29个体细胞无性系和从节点外植体中再生的16个无性系获得了相同的基因型谱(表2)2).在树叶中在体外和温室植物,用VMC 6c10显示标准基因型(114:140)。对于VMC 5g7,除了198 bp的标准等位基因外,在所有体细胞无性系的叶片中都检测到222 bp的变异等位基因2).在细根中,用VMC 6c10检测出标准双等位基因型。VMC 5g7检测到198 bp的标准等位基因和222 bp的变异等位基因2).结果表明,霞多丽96外植体的L1细胞均能再生出体细胞无性系。
体细胞无性系n°21的表型和基因型分析
与霞多丽96母无性系未分裂或有5个裂片的成熟圆形叶片相比,体细胞无性系n°21的所有叶片均为一个圆形未分裂的一半,另一半裂片分离(图2).这种表型在驯化后观察到,3年后仍在温室植物上观察到,只有该体细胞无性系。
在树叶中在体外和温室培养的体细胞无性系21,用VMC 6c10检测到试验等位基因。VMC 5g7除检测到198 bp的标准等位基因外,还检测到222 bp的变异等位基因。浆果皮也得到了同样的结果。在细根中,用VMC 6c10检测到标准等位基因(114)和突变等位基因(142),用VMC 5g7检测到标准等位基因(198)和突变等位基因(222)(表2)3.).这些结果表明,体细胞无性系21的基因型与VMC 6c10的母株相同,而VMC 5g7的基因型仅存在于母株L1细胞层的2个等位基因。母克隆L1细胞型微卫星序列VMC 6c10突变可能发生在克隆21胚胎发生过程中。
芽器官发生无性系的基因型分析
通过茎部器官发生获得的所有7个无性系的叶片均显示了VMC 6c10和VMC 5g7的试验等位基因谱2).这表明,通过分生体器官发生获得的植物来自霞多丽96组织的L1和L2细胞层。
讨论
葡萄霞多丽无性系96是一个鞘周嵌合体
在葡萄藤中,顶端分生组织由两层或两层以上的细胞层组成,形成皮体[4,12].在霞多丽96的叶片组织中,微卫星标记VMC 5g7显示了两个标准等位基因和一个由Riaz先前定义的变异等位基因et al。[9].木的组织和根只表现出2个标准等位基因,而木的组织和根完全起源于L2层。叶中第三个等位基因的存在表明霞多丽是一个周周嵌合体,突变等位基因仅存在于L1层,如Riaz等人所描述的那样。[9].对于微卫星标记VMC 6g10,在叶片、木材组织和根中检测到一个突变等位基因。这种突变等位基因取代了木材和根中的一个标准等位基因,而在树叶中,突变等位基因与两个标准等位基因同时存在[11].这些结果表明,导致VMC 6c10 140 bp等位基因被142 bp等位基因取代的2 bp突变只发生在L2。Riazet al。[9]提出突变最有可能发生在L1或L2细胞,然后分布在分生组织的两层,而不是两个相同的突变分别出现在L1和L2细胞。Riaz报告的结果等.[9]是基于扩增产物电泳谱的目视解译。我们认为这样的观察结果可能被DNA聚合酶滑移所误导。我们使用ABI PRISM进行的分析允许区分等位基因和不同的口吃带,没有歧义。
体细胞无性系仅由霞多丽96的L1细胞发育而来
在本研究中,我们发现体细胞无性系不仅可以从不同花序的花药中获得,而且可以从所有来源于L1细胞的节外植体中获得。胚性愈伤组织完全由母无性系霞多丽96的L1细胞组成(数据未显示),这表明L2细胞至少在我们的培养条件下不能增殖成愈伤组织。另一方面,通过芽器官发生培养的无性系由显示母无性系L1和L2细胞遗传特征的细胞组成。这些结果表明,霞多丽96的遗传嵌合是通过芽器官发生而不是体细胞胚胎发生来维持的。
花药是葡萄体细胞胚形成中应用最广泛的器官。已有研究表明,胚性细胞来源于花药丝。L1和L2细胞层似乎都能在某些条件下形成胚性愈伤组织,正如Franks对莫尼耶皮诺的报道et al。[9].霞多丽96花药的花丝由L1和L2细胞组成(数据未显示)。但是,在我们的条件下,只有霞多丽96的L1细胞发育成胚胎。最近在灰比诺中也报道了类似的结果,其中只有L1细胞层能够形成胚性愈伤组织[10].
霞多丽96体细胞无性系的表型变异
当母株是基因上不同细胞层的嵌合体时,胚胎发生可能产生新的葡萄表型。例如,通过体细胞胚胎发生分离莫尼耶皮诺的嵌合细胞层,产生了具有不同DNA谱的植物,并具有不同于亲本植物的新表型[5].我们从花药中获得的所有体细胞无性系的表型已经在温室中观察了2-3年:与母无性系霞多丽96相比,没有发现明显的变化(除了体细胞无性系n°21)。这种表型一致性表明L2基因型不会显著参与L1-L2嵌合霞多丽96的表型表达。坐果和葡萄酒品质上更微妙的变化可能只有在未来的葡萄园中种植somaclone时才能发现。经过十年的观察,Gamay的成体无性系在葡萄的颜色强度、糖含量、大小和成熟度方面都有变化[3.].虽然没有对不同的Gamay体细胞无性系进行基因型分析,但可以假设这种体细胞无性系变异是表观遗传起源[13].霞多丽96母无性系表现出霞多丽品种的典型葡萄酿酒特征,成熟的圆形叶不裂或有5个裂片,叶柄窦略开,叶柄端脉常有限。体细胞无性系21的部分成虫叶形状不对称,一半不裂或微裂,另一半深裂。体细胞无性系21可能与其他体细胞无性系一样起源于霞多丽96的L1细胞。我们认为,在早期细胞分裂过程中,6c10位点发生突变,140 bp等位基因被142 bp等位基因取代。体细胞无性系21的L2细胞层起源于双等位基因突变的细胞(114:142),而非双等位基因突变的细胞(114:140)进一步繁殖产生体细胞无性系21的L1细胞层。这一假设与以下事实相一致:最常观察到的等位基因大小变化是一个基序的添加[14].
结论
通过胚胎发生再生霞多丽96通常可以产生非嵌合植株,表型不变,非常适合基因转移。
方法
植物材料
葡萄简历。霞多丽克隆96,从ENTAV (Etablissement National Technique pour l'Amélioration de la葡萄栽培,Le Grau du Roi,法国)获得,这是法国国家注册葡萄克隆库。在25±0.5°C, 70±10% RH, 16 h光周期的生长室中培养成虫。
从花药开始胚性愈伤组织
花药解剖和生长描述毛罗et al。[15].对于胚性愈伤组织的长期培养,每三周在Perrin描述的MPM培养基上进行一次传代培养et al。[16].除第一步——离体花药培养——在黑暗中进行外,所有培养均保持在25±0.5°C, 70±10% RH,光周期为16小时。
为了产生次生胚,切断初级胚,转移到一半强度的Murashige和Skoog培养基(MS培养基)上[17]补充20 g l-1蔗糖、0.7%细菌琼脂、2.5 μM 2,4-二氯苯氧乙酸(2,4- d)和0.5 μM 6-苄基氨基嘌呤(BA;N6-benzyladenine)。在25±0.5℃黑暗环境下孵育3周。愈伤组织每三周在MPM培养基上进行传代培养,并在相同的条件下维持。
从节型外植体开始胚性愈伤组织
从生长的植株上切除节外植体在体外镀于半强度的MS培养基上,并添加25 g.l-1蔗糖,0.7% bacto -琼脂,9 μM 2,4- d和4.5 μM BA。在添加60 g.l的MS培养基上进行传代培养-1蔗糖、0.7%细菌琼脂、20 μM吲哚-3-乙酸(IAA)、10 μM 2-萘氧基乙酸(NOA)和1 μM BA。在最后一种培养基上多次转移后获得胚性愈伤组织。对于胚性愈伤组织的长期培养,每三周在同一培养基上进行一次传代培养。除愈伤组织萌生在黑暗中进行外,其余培养均维持在25±0.5℃,70±10% RH,光周期为16 h的条件下。
体细胞无性系的再生与驯化
小心切除胚胎,转移到含20 g.l的半强度MS培养基上-1蔗糖、0.7%琼脂和0.4 μM BA。在25±0.5℃、16 h光照条件下,将生长中的胚胎分别转入含半强度不含植物生长因子的MS培养基的试管中。带细根的植株被转移到土壤中,在生长室中驯化约三周后再转移到温室。
Ampelographic观察
通过对夏多丽无性系96的叶片形态和叶层结构的观察,对不同3年生体细胞无性系进行了整合。
拍摄器官发生
在体外传播的诉酿酒用葡萄霞多丽96在MS基础培养基中添加4.4 μM BA, 30 g.l-1蔗糖和0.7% Bacto琼脂。在Mezzetti的IM培养基上发生分生体块et al。[2]添加0.05 μM NAA (α-萘烯乙酸),BA浓度逐渐增加:前30 d为4.4 μM,第2次为8.8 μM,最后为13.2 μM。每次移植时,根尖穹窿均被切除。
为了诱导芽器官发生,从分生体的内部切下薄片,转移到含13.2 μM BA的IM培养基上。生长芽转入Quoirin和Lepoivre生根培养基[18]含有4.9 μM吲哚-3-丁酸(IBA)和5.7 μM IAA [2].育成苗在含半强度大元素的无激素MS培养基上进行增殖。
DNA提取
从通过体细胞胚胎发生或芽器官发生再生的植物中收获叶片:这些植物是在体外还有温室生长的体细胞克隆人在体外从器官发生中培养克隆。以霞多丽96母无性系温室栽培植株叶片为对照。细根被从在体外,植株生长。首先刮去树皮和形成层后,从休眠的藤条上获得木材组织。用手术刀切除的浆果皮也被分析。使用研磨机(Retsch MM200)将约80mg组织在液氮中研磨,并按照供应商的描述使用Qiagen Dneasy Plant mini-kit (Qiagen, Hilden, Germany)提取总DNA。
微卫星扩增与多态性检测
DNA分析使用位于两个不同微卫星区域两侧的两对引物:VMC6c10和VMC 5g7(葡萄微卫星联盟,Rosa Arroyo Garcia博士和Kirsten Wolff博士),分别用荧光团HEX和FAM标记。在总体积为50 μl的条件下,用10 ng模板DNA、0.35 μM 6-FAM或HEX荧光团标记的正向引物、0.35 μM未标记的反向引物、200 μM dNTP (Invitrogen)、1.5 mM MgCl进行扩增反应2, 1X PCR Buffer和0.2单位铂®Taq DNA聚合酶。PCR用GeneAmp进行®PCR系统2700热循环器(应用生物系统)。循环程序包括以下步骤:在94℃下2分钟,然后在92℃下40秒循环35次,在57℃下1分钟,在72℃下1分钟,最后在72℃下延长7分钟。扩增产物通过毛细管电泳分离,并使用ABI PRISM 310遗传分析仪(Applied Biosystem)进行检测,以HD400-ROX作为内部尺寸标准。PCR片段用GeneScan™分析软件3.1版进行检测,等位基因用genetyper™DNA片段分析软件2.5.2版(Applied Biosystems)进行评分。
参考文献
- 1.
Martinelli L, Mandolino G:转基因葡萄。农林生物技术,2003,47:325-338。
- 2.
Mezzetti B, Pandolfini T, Navacchi O, Landi L:通过器官发生的葡萄遗传转化。生物技术学报,2002,2:1-10。10.1186 / 1472-6750-2-18。
- 3.
Desperrier JM, Berger JL, Bessis R, Fournioux JC, Labroche C: Création克隆dirigée par embryogenèse somatique。o.i.v公告。2003, 26(3): 344 - 344。
- 4.
Thompson NM, Olmo HP:细胞嵌合和四倍体葡萄的细胞组织学研究。中华医学会学报,2003,26(3):357 - 357。
- 5.
杨晓明,陈晓明,陈晓明:葡萄嵌合现象的研究进展。应用理论与实践,2002,29(3):344 - 344。10.1007 / s001220100683。
- 6.
Sefc KM, Lefort F, Grando MS, Scott K, Steinkellner H, Thomas MR:葡萄微卫星标记技术的发展现状。葡萄分子生物学与生物技术“,”编辑:roubelakis angelakis KAKluwer出版社,阿姆斯特丹;2001:433 - 463。ISBN 0-7923-6949-1
- 7.
This P, Jung A, Boccacci P, Borrego J, Botta R, Costantini L, Crespan M, Dangl GS, Eisenheld C, Ferreira-Monteiro F, Grando S, Ibanez J, Lacombe T, Laucou, Magalhaes R, Meredith CP, Milani N, Peterlunger E, Regner F, Zulini L, Maul E:葡萄品种鉴定微卫星参考等位基因标准集的建立。应用理论与实践,2004,29(4):344 - 344。10.1007 / s00122 - 004 - 1760 - 3。
- 8.
Merdinoglu D, Butterlin G, Bevilacqua L, Chiquet V, adams - blondon AF, Decroocq S:一组葡萄微卫星标记的开发与表征(葡萄)适用于多重PCR。《分子育种》2005。
- 9.
李亚泽,柯加里森,唐格,郭志刚,梅雷迪斯CP:古无性繁殖酿酒葡萄品种的遗传分化与嵌合。环境科学学报,2002,29(3):349 - 349。
- 10.
Hocquigny S, Pelsy F, Dumas V, Kindt S, Heloir MC, Merdinoglu D:葡萄品种间的多样化经历嵌合状态。中国生物工程学报,2004,47:579-589。10.1139 / g04 - 006。
- 11.
伯奇C,基弗F, Triouleyre C, Butterlin G, Merdinoglu D, Walter B:分子分析葡萄通过体细胞胚胎发生获得的霞多丽。中华医学科学杂志,2003,34(3):344 - 344。
- 12.
莫里森J:萌芽发育在葡萄.《中国科学》,2001,29(4):344 - 344。10.1086/337894。
- 13.
体细胞无性系变异的分子和生化特征。作物改良中的体细胞无性系变异和诱导突变。编辑:Jain SM, Brar DS, Ahloowalia BS。Kluwer学术出版社,多德雷赫特,波士顿,伦敦;1998:485 - 499。
- 14.
Hocquigny S: La diversité génétique intra-variétale chez La vigne: caractérisation et origines。博士论文。Université路易斯·巴斯德,斯特拉斯堡;2003:138。
- 15.
杨晓明,李志刚,张晓明,等。葡萄花药培养对体细胞胚胎发生和植株再生的影响。赤霞珠。植物细胞学杂志,1996,5:377- 388。10.1007 / BF00268606。
- 16.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。葡萄体细胞胚胎发生细胞的诱导应答。植物科学学报,2001,26(3):344 - 344。10.1016 / s0168 - 9452(01) 00385 - 5。
- 17.
Murashige T, Skoog F: A修订烟草组织培养快速生长和生物测定的培养基.中国生物医学工程学报,2004,27(3):344 - 344。
- 18.
刘志强,李志强,李志强,等。桃树离体培养培养基的研究进展。园艺学报,2004,18(4):437-442。
确认
作者对Rosa Arroyo Garcia博士和Kirsten Wolff博士的VMC 6c10和VMC 5g7引物序列表示感谢。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
CB进行分子研究,参与组织和提取物分析,并起草手稿。FK和SF参与了花药胚性愈伤组织的产生。PM参与了由节点外植体产生胚性愈伤组织的过程。GM和DM参与了组织分析。BW发起了笋的器官发生,并设想和监督所有的研究,并起草了手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
伯奇,C.,基弗,F.,梅洛特,P.。et al。的基因嵌合葡萄简历。霞多丽96是通过器官发生而不是体细胞胚胎发生来维持的。BMC植物生物学5,20(2005)。https://doi.org/10.1186/1471-2229-5-20
收到了:
接受:
发表:
关键字
- 体细胞胚胎发生
- 胚胎发生的愈伤组织
- 拍摄器官发生
- 贝瑞皮肤
- 木材组织