抽象的
背景
发展能积累更多营养组织蛋白的单子叶植物是提高牧草和青贮作物氮素吸收和营养价值的一种策略。在大豆(一种双子叶豆科植物)中vspA和B基因编码二聚体营养储存蛋白的亚基,其在营养组织中发挥着重要作用。在单焦点中发现了类似的基因;然而,它们不会在叶片中累积作为储存蛋白质,并且有问题的单子叶叶对支持异位表达的大豆VSP积累的能力。测试这一点,转基因玉米(玉米L. HI-II杂交)系列表达大豆vspB从玉米泛素Ubi-1启动子。
结果
从81次轰击中再生了101株植物,并产生了5个独立品系的植物vspB转录物和Vspβ多肽。在七周龄植物(开花之前)的叶子中,VSPβ累积在原发性转基因植物中的可溶性叶蛋白的0.5%(R.0),但在R中仅为0.03%1植物。灌浆期(青贮期)1在植物中,尽管VSPβ蛋白继续存在,但在叶片和茎中不再检测到VSPβ蛋白vspBRNA。这段肽的RNA转录本要么翻译效率降低,要么VSPβ蛋白在种子填充过程中变得不稳定。
结论
大豆VSPβ在玉米中表达时的积累发育差异表明,尽管转基因玉米中VSPβ的积累没有变化vspB转录水平,即VSPβ蛋白,在开花前植物叶片中很容易检测到,随着种子开始发育,变得无法检测。
背景
尽管在饲料植物中发现了蛋白质含量的遗传变异,但这种变异性比观察到其他特征(如消化率)窄1].由于单子叶牧草和青贮作物的主要蛋白质成分参与代谢活动,因此不是“真正的”贮藏蛋白质,因此有人认为,通过常规育种对蛋白质质量或蛋白质组成进行重大改变是不可行的[1].然而,基因工程可以通过表达一种在草营养组织中未发现的储存蛋白来提高蛋白质的质量和含量。
编码各种植物种类种子储存蛋白的基因已转基因表达以改善营养质量。大多数实验用烟草和豆类物种进行,包括苜蓿,大豆,油菜,三叶草和羽扇豆。对于核靶向基因,转基因植物营养组织中这些种子储存蛋白的积累是不可检测的或非常低的。这些包括豌豆vicilin [2,3.],大豆伴球蛋白[4,向日葵种子凝集素[5,6和phaseolin [7].转基因植物非种子组织中种子蛋白的不稳定性通常归因于蛋白质靶向营养细胞中富含蛋白酶的液泡,并随后降解[5,7,8].
来自核靶向基因的种子储存蛋白的最大积累是通过玉米醇溶蛋白实现的。玉米醇溶蛋白是一种直接从内质网(ER)靶向“蛋白体”的玉米种子储存蛋白,从而避免了分泌到细胞液泡的途径。CaMV 35S启动子在烟草中的转基因表达导致这些含有玉米醇溶蛋白的蛋白体在营养组织中形成[8,9].另外,通过在储存蛋白编码区添加内质网保留信号来“短路”蛋白靶向路线也增加了蛋白积累高达100× [5,6,10,11.].
在许多豆类中,叶片和茎中特定营养储存蛋白(VSP)的积累是增加氮含量的主要来源[12.- - - - - -14.].使用VSP代替种子储存蛋白质以增加单焦度中的营养蛋白质含量可以提供优势,因为它们已经进化到植物细胞类型中的功能。积聚Vsp蛋白的豆类植物细胞含有多种液泡类型和储存蛋白质的靶向特定的真空菌,其中它们不迅速降解[15.],并且不会干扰细胞代谢过程。如果单焦点可以产生类似的液泡或成功地瞄准VSP是不确定的。最多研究的VSP是大豆VSPα和VSPβ蛋白,其是富含赖氨酸的糖基化的真空蛋白,其在叶子,茎和豆荚中积聚,但不是种子[12.- - - - - -14.].近日,大豆vspA和/或vspB在转基因烟草中表达35S基因,研究其在双子叶植物中的积累。核靶向基因产生的VSP在转基因植物叶片可溶性蛋白的2%到6%之间[16.];而靶向同一植物内的叶绿体和液泡,导致包含大于10%可溶性蛋白的VSP [17.,18.].因此大豆VSP为在植物蛋白的转基因状态改善用的优异候选,尤其草包含限于赖氨酸的水平[16.].然而,VSPs是否能在单子叶植物中表达和积累还有待确定,因为存储蛋白的稳定性依赖于单子叶植物和双子叶植物之间可能不同的翻译后事件。本文介绍了大豆VSPβ在转基因玉米叶片中的转基因表达,并讨论了转基因玉米叶片中VSPβ的表达与植株发育阶段的关系。
结果与讨论
初级的发展(R0)转基因玉米表达vspB
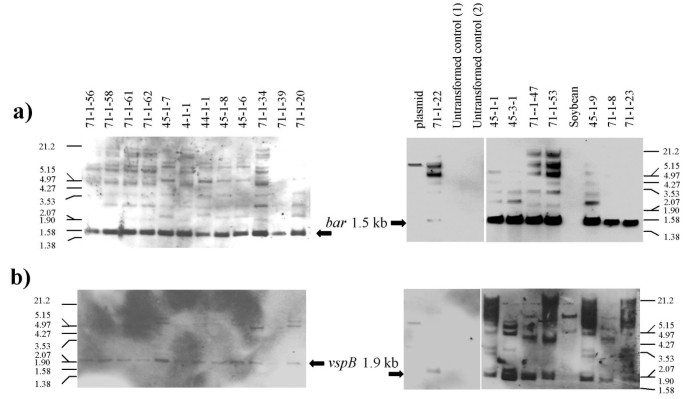
在101株植物中,有20株属于5个独立的株系(71-1、45-1、45-3、44-1和4-1),含有与完整株系对应的1.5 kb杂交带酒吧基因(图。1).所有20株植物都包含预期的1.9 kb带,与vspB基因。同一个探测器探测到两个波段生态RI限制性大豆基因组DNA,约5.7 Kb和8.6 Kb,对应高度同源基因vspA和vspB[13.].
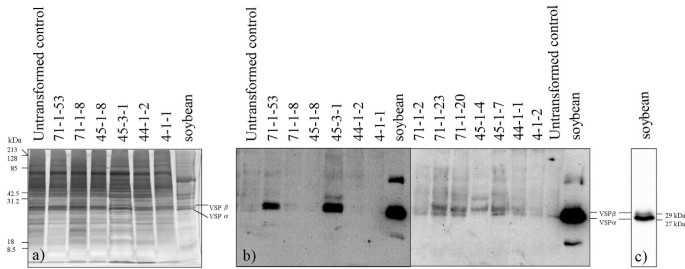
用Western印迹分析从14初级(R检测在叶提取物中的多肽VSPβ0)在营养阶段(7周龄)的转基因玉米植物。由于总蛋白质图案的复杂性和相对低的Vspβ表达水平的复杂性,在银染色的SDS-PAGE分离的玉米提取物中不可见一个不同的Vspβ带。(图。2A).然而,其中一些植物表达的VSPβ水平高到足以被Western blot检测到(图2)。2B.).两种植物(71-1-53和45-3-1)具有最高水平的VSPβ,而四种植物(71-1-23,71-1-20,45-1-4和45-1-7)累积较低水平的VSPβ。尽管在阴性对照玉米提取物中可见微弱的下部MW肽带,但VSP显然仅存在于转基因中。微弱地检测在未转化的玉米中的条带(对大豆Vspβ的相同尺寸)与先前的大豆VSP抗体与来自单蛋白质的蛋白质的交叉杂交的报道一致[14.].在用作阳性对照的大豆提取物中,VSPβ的抗体识别VSPα和VSPβ多肽(图。2 b, c)
计算机分析Western blot的数字图像,检测免疫检测的VSPβ肽相对条带强度的差异。由于天然大豆VSPs (VSPα + VSPβ)在总蛋白染色凝胶上很容易看到(图。2A),大豆样品中的总蛋白质染色的相对定量表明的VSP代表关于在年轻大豆叶中总可溶性蛋白的10%。这是接近15%,此前公布的值12.].转基因玉米45-3-1 VSPβ条带的Western blot检测强度为大豆VSP条带的44% (Fig。2B.).考虑到应用于凝胶的总蛋白的差异(大豆总蛋白负载较少),估计VSPβ蛋白已积累到总可溶性蛋白的0.5%。这类似于在玉米醇溶蛋白异位表达时观察到的最高水平的种子贮藏蛋白积累[8,9,但仍低于Wandelt等人预测的1%的最低表达水平[11.]将需要直接改变叶子的营养品质。虽然总可溶性蛋白的0.5%太低以改变45-3-1允许在叶片监测VSPβ水平的营养价值,检测VSPβ的和植物发育过程中的茎。
存在vspB在R1植物
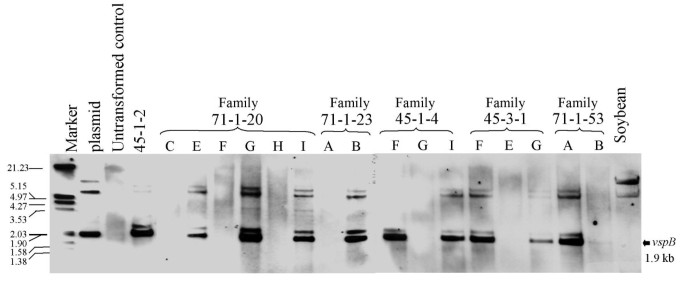
R1植株进行回交的R上产生0以Hi II控制非转化花粉的植物。回交是由于R0直接从组织培养中再生植株不能同步产生花粉和雌花。R1家庭的分离酒吧分析了表达的存在vspB基因Southern blot分析。来自57个R1植物进行分析,Southern印迹分析表明,35(61%)含有的vspB基因集成到基因组中。数字3.展示了几个R的例子1从5 R0父母的线。~ 1.9 kbvspB乐队可以在16 r的九个中看到1行。也有较暗的波段,一个略大于1.9 kb波段,一个或两个迁移在4和5 kb之间。这些通常被认为是全部的不完全限制生态RI位点内部的质粒DNA被整合到玉米基因组。类似频带甚至用质粒对照中观察到。
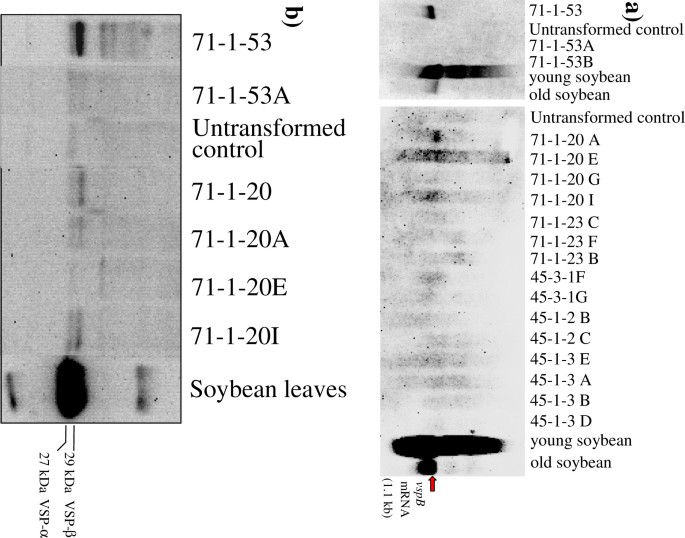
从年轻r的叶子中分离出总RNA1植物在营养阶段(种植后7周)。十八转基因R.1植物,包括源自r的植物0代表不同水平的VSPβ积累的植物(高VSPβ积累:45-3-1,71-1-53;中电平VSPβ蓄电池:71-1-23,71-1-20,45-1- 4,45 -1-7和低电压VSPβ蓄电池:44-1- 4- 4-1-2)的分析vspB记录。因为高序列相似性(85%)vspA和vspBCDNA,用STASWICK的STASWICK和MRNA在大豆中杂交的相同探针[13.].转基因植株71-1-53A、71-1-20A、71-1-20E和71-1-20I产生了一个大约1.1 kb的杂交带,表明转基因表达(图1)。4);然而,大多数人没有。的使用UBI.-1启动子vspB和酒吧基因可能导致了大量的转基因与vspB沉默,更高水平的VSPβ积累可能会导致未来的工作使用不同的启动子的组合。
对转基因植株幼叶中VSPβ蛋白的免疫检测表明,与亲本(R0)和他们的R1结果表明,VSPβ表达的R最高,变异最大0植物(图4 b).亲本71-1-53表达量较高,但其转基因子代71-1-53A几乎检测不到VSPβ;相反,低电平蓄电池71-1-20产生R1VSPβ表达水平不同,但均不高于亲本。VSPβ相对表达水平的定量分析1叶子表明,测得的最高水平是总可溶性蛋白的仅0.03%。
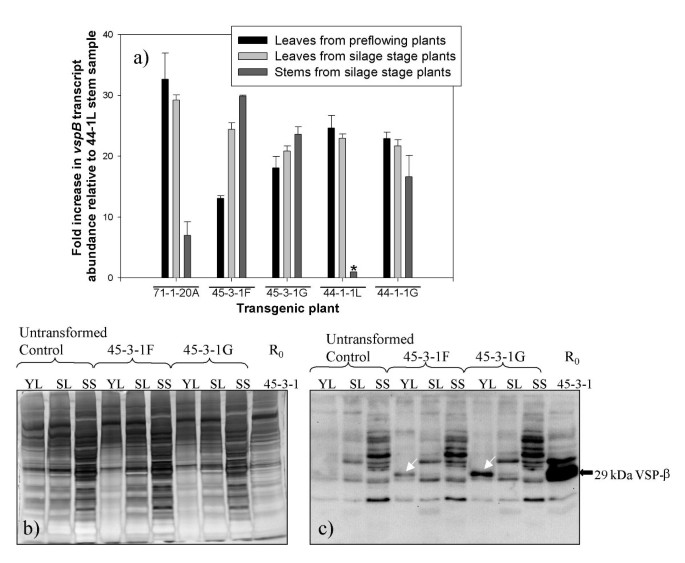
尽管VSPβ总体表达水平较低,但在一些植物中,VSPβ的积累量足以研究植物发育阶段和生长发育之间的关系vspB/垂直地震剖面β积累。同时测定了转录本丰度和VSPβ蛋白的积累1分别使用实时定量RT-PCR和Western印迹免疫检测线。实时RT-PCR是北印迹分析更敏感,并且能够检测标准总RNA印迹方法未见的转录物。的vspB从未成熟的植物(在流苏形成之前)和青贮阶段植物(在授粉阶段的18天的植物中发育种子的植物)中量化转录物,以及来自青贮饲料阶段的茎(图5).的vspB在所有五种转基因中检测到转录物(其中四个使用标准Northern印迹方法没有检测到RNA)。不同植物样品中的RNA的相对水平在不同的线上不一致,其中一些在幼叶中具有更多的成绩单,而其他植物在较旧的叶子和茎中有更多的叶子。
a) Real-time RT-PCR定量vspBR.的转录物1转基因玉米组织。以200微克总RNA为模板源,进行实时RT-PCR检测vspB记录。使用Qiagen quantitative SYBR Green试剂盒在15ul体积内进行反应。表达式值是通过对所有阈值周期(Ct)vspB到18S rRNA Ct并转换该值来倍数增加超过值的最低表达组织,* 44-1-1-干,将其任意地设定在1.0。B,C)在发育的转基因玉米植物组织改变VSPβ水平。大豆VSPβ在从由12%SDS-PAGE分离,并印迹到Hybond到-P膜的粗提物的总蛋白质的30个μgsWestern印迹免疫检测。从制备粗提物:YL,从preflowering植物的叶子;SL,从青贮饲料级植物的叶子;和SS,从青贮阶段的植物茎。(二)考马斯蓝染色的SDS-PAGE分离从粗提取物中的蛋白质;(c)中VSP使用VSPβ抗血清和重生试剂盒化学发光检测法(NEN生命科学产品公司)免疫检测。箭头指示VSP-β蛋白条带。
什么时候vspBRNA丰度与VSPβ蛋白积累量比较,两者之间没有相关性(图2)。5 a, b, c).抗VSPβ血清只在未开花的玉米幼苗叶片中检测到VSPβ。青贮期种子发育的玉米叶片和茎中均未检测到VSPβ。在转基因玉米幼叶中,大豆VSPβ肽是与抗VSPβ抗血清反应的主要条带,但在青贮期茎秆和青贮期叶片中,检测到多个不同大小的条带。这些也在非转基因对照植物样品中检测到,因此,不是由于大豆VSPβ的不同修饰。在青贮期,虽然71-1-20A、45-3-1F和45-3-1-G植株的VSPβ蛋白含量低于检测水平,但在青贮期,VSPβ蛋白含量低于检测水平垂直地震剖面β转录本仍可检测到。事实上,在71-1-20A植株中,转录水平最高的是青贮期叶片,没有检测到VSPβ。因此,转录后事件(即,无论是翻译效率的变化vspB转录物或VSPβ的蛋白质稳定性)在青贮阶段的叶子被改变和茎相比未成熟植物的叶子作为。
结论
的vspB基因成功导入R0再生玉米,转入R1后代,其中vspB检测和研究转录物和VSPβ蛋白。这是单子植物中豆类植物植物储存蛋白引入和表达的第一报告。在种子发育时,无法检测来自玉米营养组织的Vspβ,即使vspB转录本仍然表达,一定是由于要么翻译效率降低vspB或VSPβ蛋白稳定性下降。在紫花苜蓿中表达维西林,也可以观察到转基因双子叶植物叶片中种子贮藏蛋白水平的降低[11.]及烟草[2];而VSPα在烟草中的表达则未见明显变化[16.或紫花苜蓿中的卵清蛋白[30.].这些数据表明,控制营养组织蛋白积累发育变化的因素是寄主植物性状和异位表达蛋白的固有特性的结合。有趣的推测,如果,在玉米(单子叶植物),大豆垂直地震剖面β是退化的方式提供氨基酸,支持种子发展转移到种子,然后发展高水平垂直地震剖面表达单子叶植物可能是一种改善种子的含氮量/粮食生产的工厂。
方法
植物材料和组织培养方法
混合的植物“的Hi-II”玉米建立在温室和未成熟流苏被用于II型胚性愈伤组织的生产,如通过阿姆斯特朗[描述19.].
转基因植物的发展
使用Somers等人的程序进行愈伤组织的微妙轰击。[20.].Calli以等量的PRSVP-1(碎片,未发表的)和PAHC25互乱21.].通过限制大豆构建质粒prsvp-1vspBcDNA克隆(998个碱基)从pKSH3 [22.)与生态使用S1核酸酶产生该片段的钝端,将片段克隆成类似的钝端BAMHI限制pAHC17 [21.].因此,vspB编码区域被插入到Ubi-1启动子和一个5'非翻译区域(外显子)和内含子;和上游的号终止子序列。质粒pAHC25携带酒吧基因和uidA报告基因,无论是在控制下Ubi-1启动子。轰炸是用生物武器进行的®PDS-1000 / HE粒子输送系统(BIO-RAD实验室,母细胞,CA)和渗透处理用于降低由基因转移方法引起的细胞损伤[23.].假定的转基因玉米是从阿姆斯壮[19.,并在5加仑的花盆中种植,容器中装有无菌沙子和Metromix-350(1:1)。每周用Peter's 20-20-20的微量元素对植物进行施肥(密苏里州圣路易斯联合工业公司分部)。
印迹分析
一克冷冻的嫩叶组织在液氮中研磨,用delaporta程序提取基因组DNA [24.].基因组DNA的20微克与消化生态ri,释放了一个1.9 kB片段,含有含有的1.9 kB片段vspB基因,号终止与部分Ubi-1启动子。将DNA分离在0.8%琼脂糖凝胶上,呈上杂志n+Amersham Pharmacia Biotech, Inc。皮斯卡塔韦,新泽西州)[25.]和紫外线交联。非放射性地藻素系统(Roche分子生物化学素,印第安纳波利斯,IN)用于标记和检测转基因。用611或843bp探测涂色的DNAvspB从PrSVP-1和凝胶纯化的基因段扩增。分别使用前向和反向引物5'-GTTCTTCGGAG GTAAAT-3'和5'-TTCGCCTCTGGGT-3',以扩增611bp段,并引物对5'-gcaggctaccaaaaggt-3'和5'-taggtgacttaccacat-3'用于扩增843 bp的产物。
识别的酒吧转基因植物,DNA被消化生态RI,它释放了一个约1.5 Kb的片段,其中包含部分Ubi-1启动子,酒吧基因,号利用5'-GGCGGTCTGCACCATCGT-3'和5'-GCCAAGTTCCCGTGCTTGA-3'对pAHC25进行PCR扩增,得到419 bp的地高辛标记探针。
北部污点分析
使用酸性胍异硫氰酸苯甲酸苯酚 - 洋红色提取从2g组织中分离出总RNA的总量分离[26.,在T10E1并用2μlrnasin治疗®(4U /μL)RNase抑制剂(Promega,Madison,Wi)并储存在-70°C直至使用。在1.2%琼脂糖甲醛凝胶上分离30微克总RNA,并转移到杂合+用Posiblot通过毛细管印迹或通过压力印迹1小时的膜®根据制造说明,30-30压力吸气器(Stratagene,La Jolla,CA)。膜是UV交联的,并用与Southern印迹分析描述的相同探针探测。使用柯达数字科学图像站440 CF(伊斯曼柯达公司,罗切斯特,纽约州)捕获了化学烟道。
实时RT-PCR
使用研钵和杵在液氮的存在下使用500mg的组织研磨成细粉,进行总RNA提取用于实时RT-PCR,然后用RNeasy试剂中提试剂盒(Qiagen,德国)处理时,按照制造商的协议。氯仿中的5:1点的pH = 4.7的提取和DNA酶I处理(Ambion公司,得克萨斯州)微量DNA污染物通过酸苯酚的组合从总RNA中移除。实时定量RT-PCR方法上进行了转子基因RG-3000使用的Quantitect的SYBR Green实时RT-PCR试剂盒(Qiagen,德国),并与300纳克的DNase I的制造商协议(科贝特研究,澳大利亚)处理的总RNA。引物设计用于扩增大豆的108 bp片段vspB使用以下引物:5'-TGGTTCAACGCACTTTC-3'和5'-GGCTATGGTGAGCGTTTTTC-3'。在50℃下进行逆转录30分钟,然后在95℃下在95℃下变性,40 s在95℃,40℃下在58℃和40s处,在72℃下在58℃下为40℃。通过用引物(5'-CCTGcGGCGCGCGCTGACTC-3'和5'-GTTAGCAGGCTGAGGTCTCG-3')扩增174bp片段,基于对玉米18SRNA的相对丰度基于玉米18SRNA的相对丰度。,并使用转子-CENERG-3000软件的比较定量函数.所有实时RT-PCR实验均以三份和三份RNA制剂进行三份进行。进行熔化曲线分析和琼脂糖凝胶电泳以验证单一产品。
免疫印迹分析
用0.5 ml磷酸盐缓冲盐水(137 mM NaCl, 2.7 mM KCl, 10 mM Na)从100 mg叶片和茎中提取蛋白2HPO4, 2毫米KH2阿宝4)添加1片/10毫升的Complete-Mini蛋白酶抑制剂鸡尾酒缓冲液(罗氏分子生物化学公司,印第安纳波利斯,IN),在直径0.1 mm的氧化锆/二氧化硅存在下均质。珠子。离心提取上清液去除,用于蛋白质浓度测定[27.].由于茎提取物中的低蛋白质产率,用10%三氯乙酸(TCA)沉淀,用冰冷丙酮洗涤并在SDS-PAGE分析之前重悬了。
在12%SDS-聚丙烯酰胺凝胶上分离了30微克蛋白质。凝胶中的蛋白质染色硝酸银[28.[使用反式印迹SD半干燥传输电池显示器和推荐方案(Bio-rad Laboratories)转移到杂交-P(PVDF)膜(Amersham Pharmacia Biotech,Inc.Piscataway,NJ)转移到羟基-P(PVDF)膜(Amersham Pharmacia Biotech,Inc.)。用抗VSPβ血清的PDF膜上免疫检测到大豆VSP(由内布拉斯大学P. Staswick提供,如前所述制作的[29.用1:5 000稀释。采用鲁米诺基板和NEN生命科学产品公司(Boston, MA)再生试剂盒进行检测。化学发光信号由柯达数字科学图像站(440cf)捕获,并用柯达1D科学图像软件进行分析。波段强度的定量总是相对于同一凝胶的样品进行比较。
缩写
- RT-PCR:
-
逆转录酶-聚合酶链反应
- 垂直地震剖面:
-
营养储存蛋白
参考
- 1.
Vogel KP,Slepper Da:通过遗传和植物育种改变植物。饲料质量,评估和利用。编辑:Faher GC。麦迪逊,威廉,美国:美国农艺学会;1994年:891-921。
- 2。
花椰菜嵌合花叶病毒(CaMV 35S)基因在烟草中的表达。植物科学学报,1999,74:89-98。10.1016 / 0168 - 9452 (91) 90259 - b。
- 3.
Wandelt CI,Knibb W,施罗德HE,汗MRI,斯宾塞d,克雷格S,希金斯TJV:卵清蛋白的表达和在转基因植物的叶子种子蛋白基因。植物分子生物学2.编辑者:赫尔曼RG,拉金斯B.纽约:Plenum出版社;1991:471-478。
- 4.
Lawton MA, Tierney MA, Nakamura I, Anderson E, Komeda Y, Dube P, Hoffman N, Fraley RT, Beachy RN:菜花花叶病毒35S和19S启动子控制下大豆β-聚甘氨酸基因在矮牵牛组织中的表达。植物生态学报,1998,19(4):491 - 498。10.1007 / BF00014906。
- 5.
Tabe LM,HIGGINS CM,MCNABB WC,HIGGINS TJV:谷物和牧场豆类的基因工程,提高营养价值。genetica。1993年,90:181-200。
- 6.
Khan MRI, Ceriotti A, Tabe L, Aryan A, McNabb W, Moore A, Craig S, Spencer D, Higgins TJV:转基因地下三叶草叶子中向日葵富含硫的种子蛋白的积累(三叶草subterraneuml .)。转基因生物学报,1996,5(5):489 - 494。
- 7.
Bagga S, Sutton D, Kemp JD, Sengupta-Gopalan C: β-phaseolin基因在转基因苜蓿不同组织中的组成性表达并不保证phaseolin在非种子组织中的积累。植物生态学报,1998,19(4):551 - 558。10.1007 / BF00040527。
- 8.
陈志强,王志强,王志强,等。玉米醇溶蛋白在转基因烟草中表达的研究进展。植物营养与肥料学报,1995,19(4):423 - 427。
- 9.
玉米种子贮藏蛋白delta-zein在白三叶草中的表达Trifolium Repens.),以提高饲料的质量。摩尔品种。1998年,4:435-448。10.1023 / A:1009656002068。
- 10.
表L,希金斯TJV:改良营养的工程植物蛋白组成。植物科学进展。1998,3:282-286。10.1016 / s1360 - 1385(98) 01267 - 9。
- 11.
Wandelt CI,汗MRI,克雷格S,施罗德HE,斯宾塞d,希金斯TJV:豌豆球蛋白与羧基末端KDEL被保留于内质网和积聚至高水平在转基因植物的叶子上。植物杂志1992年,2:181-192。
- 12.
维滕巴赫VA:大豆叶贮藏糖蛋白的纯化和特性。植物生理学。73:125-129。
- 13。
大豆营养贮藏蛋白的结构与基因表达。植物营养与肥料学报。
- 14。
Staswick PE:营养植物组织的贮藏蛋白。植物营养与肥料学报,2003,22(4):429 - 434。10.1146 / annurev.pp.45.060194.001511。
- 15.
Jauh G-Y, Fischer AM, Grimes HD, Ryan A, Rogers RC: δ-液泡质体固有蛋白定义了植物液泡特有的功能。《美国国家科学院学报》上。1998年,95:12995 - 12999。10.1073 / pnas.95.22.12995。
- 16.
Guenoune D,Amir R,Ben-Dor B,沃尔夫斯,加利利S:大豆营养储存蛋白积聚在转基因烟草植物的各种器官中的高水平。植物SCI。1999年,145:93-98。10.1016 / s0168-9452(99)00079-5。
- 17.
Guenoune D, Amir R, Badani H, Wolf S, Galili S: S- vspalpha在两种不同细胞器中的联合表达增强了转基因烟草叶片中S- vspalpha的积累和总赖氨酸产量。中国农业科学。2002,53:1867-1870。10.1093 / jxb / erf046。
- 18.
Guenoune D,Amir R,Badani H,Wolf S,Galili S:大豆营养储存蛋白β亚基(S-VSPBeta)的共同用细菌反馈 - 不敏感二氢嘧啶合酶或S-Vspalpha稳定S-VSPBeta转基因蛋白并增强转基因烟草植物中的赖氨酸产生。转基因Res。2003,12:123-6。10.1023 /答:1022130100493。
- 19.
Armstrong CL:体细胞培养植物再生:应用体外遗传操作。玉米手册。编辑:Freeling M, Wallbot V.纽约:Spring-Verlag;1994:663 - 677。
- 20.
Somers DA, Rines HW, Kaeppler HF, Bushnell WR:肥沃的转基因燕麦植物。生物/技术。1992年,10:1589 - 1594。10.1038 / nbt1292 - 1589。
- 21.
基于泛素启动子的载体用于单子叶植物中可选择和/或筛选标记基因的高水平表达。转基因研究。1996,5:213-218。
- 22.
曼森HS,Guerrero的FD,博耶JS,鲻JE:蛋白质同源的叶的糖蛋白是在丰富茎黑暗生长的大豆幼苗。分析蛋白质和cDNA的。植物分子生物学。1988年,11:845-856。10.1007 / BF00019524。
- 23.
渗透处理增强了颗粒轰击介导的玉米瞬时和稳定转化。植物学报,1993,12:84-88。10.1007 / BF00241940。
- 24。
Dellaporta SL,Wood J,HICKS JB:植物DNA微量方法:II版。植物mol biol rep。1983,4:19-21。
- 25。
南部南部:检测由凝胶电泳分离的片段中的特定DNA序列。J Mol Biol。1975,98:503-517。
- 26。
硫氰酸胍-苯酚-氯仿单步法分离RNA《肛门生物》1987,162:156-159。10.1016 / 0003 - 2697(87) 90021 - 2。
- 27。
布拉德福德MM:利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物。1976,72:248-254。
- 28.
Oakley BR, Kirsch DR, Morris NR:聚丙烯酰胺凝胶中检测蛋白质的简易超灵敏银染剂。生物化学学报。2000,21(4):497 - 503。
- 29.
Staswick PE:植物水槽对大豆叶植物储存蛋白基因表达的发展调节及影响。植物理性。1989,89:309-315。
- 30.
Schroeder HE, Khan MRI, Knibb WR, Spencer D, Higgins TJV:鸡卵清蛋白基因在三个苜蓿品种中的表达。植物生理学报,1998,18:495-505。
致谢
这项工作得到了佛罗里达乳制品研究委员会的部分资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MFG参与实验设计,进行转基因植物的培育、植物杂交、分子印迹/检测等方法,并参与手稿的起草。RLS参与了实验设计,并对转基因玉米的开发提供指导和培训。CM进行了RT-PCR实验。BTS参与了实验设计,并提供了植物杂交方面的专业知识和培训。RGS构思研究,参与实验设计,协调实验方案,撰写初稿。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
格兰多,m.f.,史密斯,r.l.,莫雷拉,C。等等。玉米与大豆核转化后VSPβ蛋白丰度的发育变化垂直地震剖面β互补脱氧核糖核酸。BMC植物BIOL.5,3(2005)。https://doi.org/10.1186/1471-2229-5-3
收到了:
接受:
发表:
关键词
- 转基因植物
- 存储蛋白质
- 总可溶性蛋白
- 种子贮藏蛋白质
- 菜豆素