摘要
背景
关于植物细胞死亡的形态学终点,人们已经知道了很多,但关于其事件的顺序和/或其在生物化学水平上的执行,人们却知之甚少。使用gfp标记的活细胞成像是一种强大的方法,可以提供细胞过程的动态画像,反过来可以为未来的生物化学和遗传学研究提供有价值的描述基础。
结果
在对一组随机gfp蛋白融合标记进行特征分析时,我们发现机械损伤诱导gfp -硝化酶1融合蛋白在拟南芥细胞中直接毗邻伤口部位快速聚集。这种反应的延时成像显示,聚集发生在受伤后30 - 60分钟死亡的细胞中,这表明GFP-Nit1聚集是受伤部位细胞死亡的早期标志。利用GFP-Nit1和细胞核和内质网标记物,采用延时共聚焦成像来表征创伤诱导的细胞死亡。这些分析提供了众所周知的死亡相关反应的动态描述,如核收缩和细胞崩溃,并揭示了新的特征,如核膜分离,内质网囊泡和核腔内容物的丢失。作为成像细胞死亡的平行系统,我们开发了一种化学方法,使用除草剂溴苯腈或氯苯腈快速触发细胞死亡,它们导致GFP-Nit1快速聚集、核内容物丢失和细胞崩溃,但不导致核收缩,将这种反应与植物细胞死亡中的其他反应区分开来。
结论
我们的观察表明,硝化酶1的聚集是与伤口和除草剂诱导的细胞死亡有关的最早事件之一,并强调了植物细胞死亡时发生的几个新的细胞事件。我们的数据为未来植物细胞死亡的研究创造了一个详细的描述框架,并为其细胞和生化分析提供了新的工具。
背景
破坏单个细胞完整性的事件可能威胁到整个多细胞有机体的健康,这一事实反映在有机体用来消除潜在危险细胞的各种机制上[1].例如,当损伤经高剂量照射或细胞毒性制剂治疗后无法修复时,可激活调节细胞死亡以清除受损细胞。在动物细胞中,通过对细胞凋亡机制的广泛分析,可以最好地理解这一过程。细胞凋亡是一种受调控的过程,其标志是细胞结构的一系列定型变化,最终导致细胞死亡[2,3.].
在植物细胞中,受调控的细胞死亡发生在多种情况下,如在木质部元素的发育过程中[4或作为病原体攻击的过敏反应(HR)的一部分[5- - - - - -7].尽管过敏反应是由高度特异性的植物-病原体相互作用触发的,并且受基因控制[7- - - - - -9, HR表现出许多相似的植物反应引起的伤害。这两个过程都激活了通过木质素化、细胞壁蛋白交联和细胞外基质的其他修饰形成保护屏障的局部机制[10,11],这被认为可以限制病原体的接触。HR和伤口反应在转录反应中有大量重叠[12和HR的病原体衍生的激发子可以激活伤口诱导的激酶活性[13这表明这两种反应在监管方面存在一些共同点。因此,伤口和过敏反应都激活了相关的防御,这些防御来自于它们的起始部位,并从它们的起始部位传播开来,但它们的激活信号不同。
人们对伤口和病原体引起的无数反应的信号传导机制进行了深入的研究。一些证据表明,这两种反应的局部和传输成分在一定程度上是由过氧化氢介导的信号事件调节的[14- - - - - -17].有人建议H202是一种广谱信号分子,可触发细胞壁蛋白交联等局部过程[14和细胞死亡[6以及基因诱导等远距离效应[11].尽管H202信号是局部启动的,然后传输是不完全知道的,它们涉及NADPH氧化酶的激活,产生H202通过生产超氧化物[18,类似于哺乳动物免疫系统中巨噬细胞的氧化防御。NO信号似乎也参与了这种氧化反应[19,20.].
与触发这些反应的信号介导事件相比,我们对伴随细胞死亡的有序细胞解构模式的下游事件所知相对较少。在动物细胞中,许多特征性事件归因于caspase蛋白酶的活性,它启动和执行参与亚细胞解构的蛋白水解事件的级联[21].通过观察HR细胞死亡过程中的细胞收缩、核收缩和DNA碎片,我们发现植物细胞死亡和动物细胞凋亡之间存在相似之处。植物有一个caspase相关蛋白家族,称为元caspase,大量研究表明caspase样蛋白酶在植物细胞死亡激活的控制中起作用[22].最近,在氨基酸序列水平上发现一种与半胱天冬酶无关的液泡蛋白酶具有半胱天冬酶蛋白酶活性,并被证明是病毒诱导的烟草超敏细胞死亡所必需的[23,表明caspase活性介导植物细胞死亡的某些成分。尽管如此,这种和其他caspase在植物细胞死亡过程中介导亚细胞结构变化的靶标仍然难以捉摸。
在筛选有用的GFP融合蛋白的过程中[24],我们观察到GFP-Nitrilase 1融合蛋白在损伤反应中表现出聚集状态的变化。为了将这一现象置于更大的背景下,我们启动了一系列活细胞成像实验,以识别和表征与物理和化学诱导的细胞死亡有关的标记。我们的研究揭示了一系列先前描述的与植物创伤诱导的细胞死亡相关的事件,并提出了关于植物细胞死亡执行的新的机制问题。
结果
GFP-Nit1聚集标志着创伤诱导细胞死亡的早期步骤
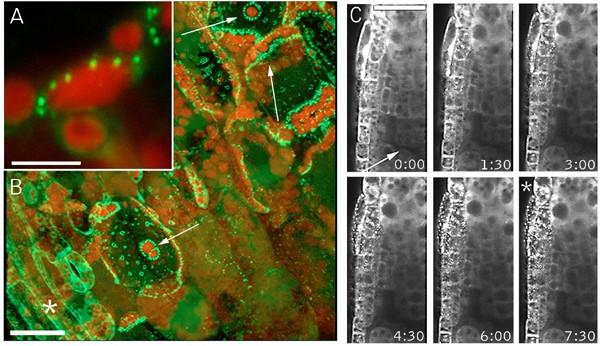
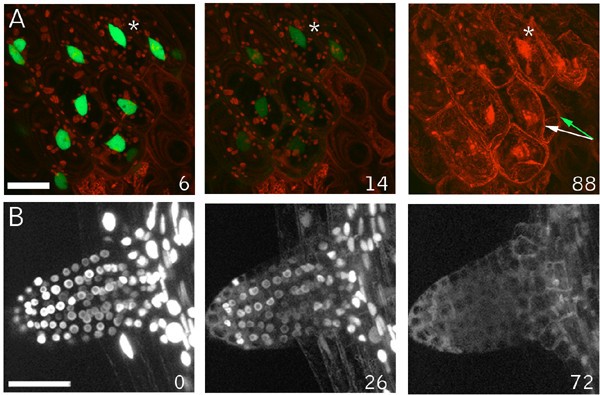
我们对细胞死亡的调查源于对伤口反应的GFP标记GFP- nit1的发现,该标记在之前的随机标记筛选中被识别[24].GFP- nit1结构对融合在GFP编码序列c端的硝化酶1的全长编码序列进行编码。在未损伤的细胞中,融合蛋白存在于整个细胞质和核质中(与可溶性GFP类似),并以弥漫性荧光的形式可见(结果未显示)。穿刺伤口后,GFP-Nit1迅速从细胞质转移到邻近细胞的细胞器相关聚集物(图。1 a, B)和远离伤口(图5)。1 c,并参阅附加文件1),表明该标记对伤口诱导信号有反应。基于下面描述的观察,我们认为在伤口部位的局部反应(这里定义为被伤口损伤的细胞直接相邻的细胞)与传输反应不同,传输反应可以从伤口部位传播许多细胞层。
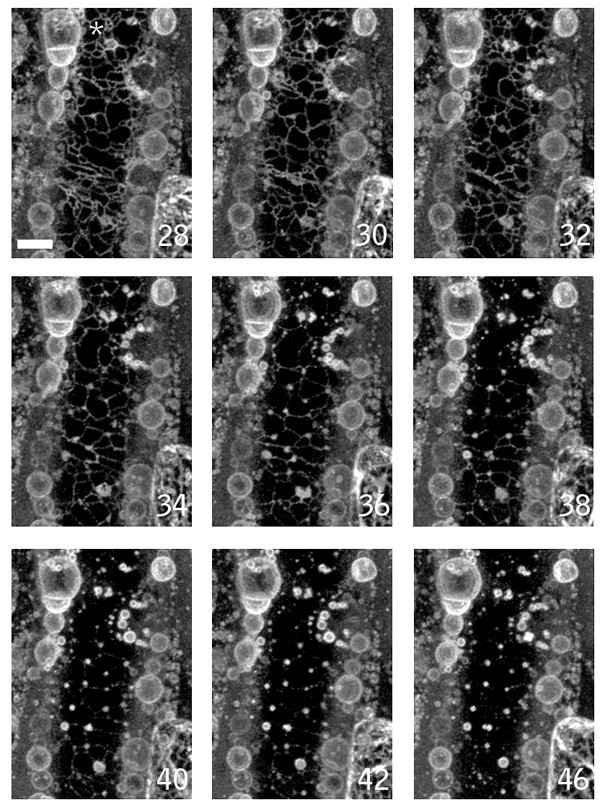
GFP-Nit1标记的局部和传输伤口反应.(A, B)伤口周围细胞的聚集。用刀片切取35S GFP-Nit1叶片叶柄,与叶柄主轴成45°角。被伤口暴露的三个叶肉细胞由白色箭头(图B)表示——注意这些细胞中标记物广泛重新分布到与细胞器相关的聚集物,这在叶绿体周围特别明显(红色荧光)。(C)传播伤口反应。将35S GFP-Nit1幼苗置于0.5X MS中,在根分生组织上方穿刺(切口处用箭头标记)。在伤口和根尖与视野对齐之间约45 - 60秒的延迟后开始成像。从伤口部位去除几层细胞,聚集物变得明显(用星号标记)。显示的时间以分钟为单位。A和B所示的图像是伤后5分钟拍摄的z系列的三维重建。 Chloroplasts are visible because of their red autofluorescence. Images in C are single optical sections. Scale bars: A 10 μm; B, C 25 μm.
为了表征局部反应,我们对转基因GFP-Nit1植物的下胚轴或子叶组织穿刺伤口附近的细胞进行了成像。我们观察到创面部位的不同数量的细胞显示GFP-Nit1聚集体和圆形细胞核(图。2).几个创面区的时间推移成像显示,在形成GFP-Nit1聚集体后,这些细胞显示核收缩(图。2),然后是剧烈的细胞崩溃(图。2 b请参阅附加文件2) (n = 6个独立伤口实验)。这两种反应(细胞塌陷和核收缩)是HR过程中细胞死亡的形态学标志[11,25,27],并认为局部GFP-Nit1反应标志着更普遍的创伤引发的细胞死亡反应的一个组成部分。与局部反应不同,我们发现传递反应是可逆的,随着GFP-Nit1聚集物的消失,细胞质流恢复(见附加文件)3.).因此,我们的观察表明GFP-Nit1聚集并不标志着所有细胞的细胞死亡承诺点。然而,它确实标志着一个独特的细胞死亡过程的早期阶段,该过程发生在邻近伤口的细胞中。
在伤口反应过程中核和细胞塌陷.GFP-Nit1线N1P2E受伤后,每隔60秒立即从毗邻伤口的区域收集共聚焦z系列。(A)伤口近端子叶表皮细胞的核收缩(靠近白色箭头),在受伤后显示聚集反应(红色箭头表示的聚集),然后崩溃。(B)伤口部位显示GFP-Nit1聚集和收缩的几个细胞之一的细胞塌陷。红色箭头指向收缩细胞的边缘,白色箭头指向相邻细胞的壁。注意细胞从壁上脱落(损伤后48分钟最明显)。(C)传输响应的可逆性。琼脂糖挂载的35S GFP-Nit1植株在根分生组织上方进行损伤,以每隔2分钟采集z系列成像,持续60分钟(完整图像系列见补充数据)。在损伤后的第一个时间点,聚集反应已经扩散到根分生组织的大部分。随着时间的推移,聚集恢复到细胞质分布模式,细胞质流是明显的。 Images in A are single confocal optical sections, B and C are reconstructions from Z-series stacks. The numbers in the lower right of each panel indicate time in min from the start of imaging. Scale bars A, B = 25 μm; C = 20 μm.
为了探索GFP-Nit1融合蛋白可能诱导异常细胞死亡反应的可能性,我们检查了该过程是否独立于GFP-Nit1融合蛋白发生。我们使用先前分离的核标记物(N6)检测了GFP-Nit1在伤口反应过程中观察到的核收缩[24].将N6 GFP转基因植物的下胚轴损伤,伤口附近的细胞连续成像超过1小时(图1)。3.).用GFP-Nit1观察到,伤口部位的细胞亚群具有肿胀、肥大的细胞核,并进展到收缩状态(图1)。3请参阅附加文件4).在成像缓冲液中加入碘化丙啶以监测反应过程中质膜的完整性。细胞核的强烈染色发生在主要的核收缩之后,表明质膜完整性的退化是一个后期步骤。因此,伤口诱导的细胞死亡过程中的核收缩不是GFP-Nit1融合蛋白诱导的伪产物,这一结论得到了另一个核标记物和ER标记物的结果的支持(见下文)。此外,如下文所述,我们开发了一种生化分析法来探测Nit1再定位聚集,并发现这发生在野生型植物中(即在完全缺乏任何GFP融合蛋白的情况下)。
伴随核收缩的是核泄漏和核裂
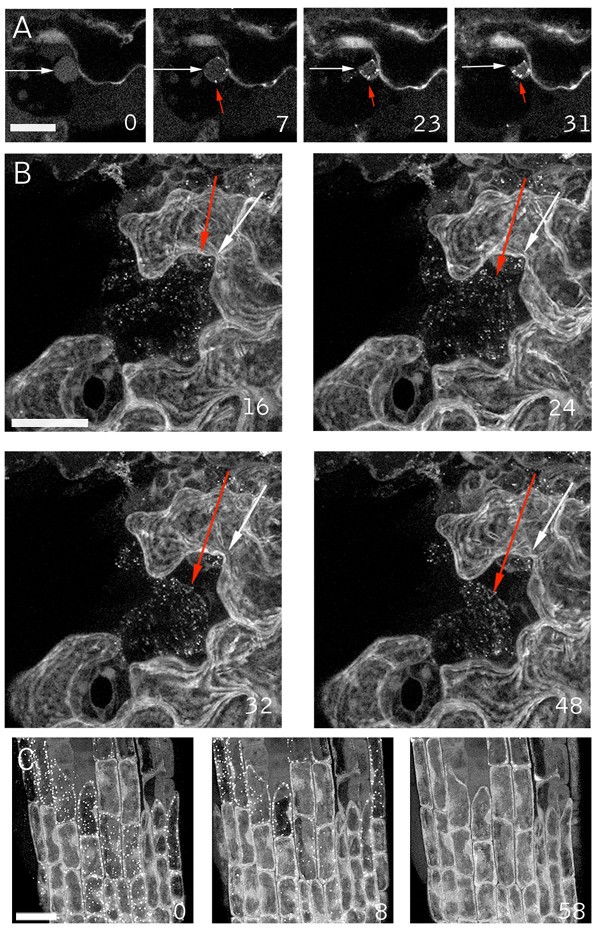
除了核收缩,创伤诱导的N6标记线中GFP核荧光强度的下降在损伤后不到20分钟内就很明显(图。3).对于核荧光减少的几种解释似乎是可能的,包括GFP的破坏,pH值的改变使荧光淬灭,或核内容物排出到细胞质中。虽然这些可能性并不相互排斥,但后者似乎特别有吸引力,因为收缩可能引起核内容物的挤压。N6标记具有较低的细胞质GFP定位背景水平,这可能掩盖核内容物的释放,也可能通过与DNA的结合从整体核质中部分固定(该标记在有丝分裂期间照亮染色体,[26])。因此,我们使用核标记线N7检查伤口反应,显示较低水平的背景细胞质荧光,并没有与染色质相关的有丝分裂的延时成像评估(数据未显示)。对携带N7标记的植物下胚轴进行损伤成像。伤口近端细胞的延时成像显示,随着细胞核荧光和收缩的减少,细胞质逐渐被照亮,提示细胞核标记丢失或排出到细胞质中(图1)。3 b).核质和细胞质同时照射,通过阴性对比显示了核上叶的形成,因为这些叶的内部不包括GFP标记(见图中箭头)。3.).
叶裂是由核膜分离引起的
由于细胞核是由核膜结合的,与内质网相连的膜系统(有关植物内质网的综述见[28])如果核膜的内膜收缩而外膜没有相应的收缩,即如果两层膜分离,就可能发生裂片。如果这是正确的,可能会从裂片内部排除胞质GFP,因为内外核膜之间的空间,即核周空间,与内质网管腔相邻,因此与细胞质隔离。这一假设得到了两个ER标记的观察结果的支持,Q4是一个ER膜标记,mGFP5是一个kdel标记的腔内ER标记。数字4显示使用Q4标记线的延时伤口成像实验的时间点。数字4显示了一个图像系列的三维重建,并说明了在核收缩过程中形成的特征叶。与核膜分离的假设一致,4A中通过同一收缩核的中平面的光学切片显示了一个清晰的双膜结构,随着核的收缩而分离(图4)。4 b).我们接下来测试了核收缩和分叶过程中er-管腔GFP标记物(mGFP5)的行为,发现在不同收缩和分叶阶段的核在叶间间隙中包含er-管腔标记物mGFP5(图。4 d, E).
核瓣与内质网膜结合,包含内质网腔内容物.将内质网膜标记线Q4的下胚轴损伤,每隔2分钟用共聚焦显微镜成像。核的同时收缩和分裂表现为核膜的分离。(A)用获得的数据集的最亮点重建进行收缩核的三维重建。(B)与图4A中相同的数据集,通过收缩核的中平面的单个光学切片,照亮双膜结构(箭头所指)及其分离。(C)通过收缩核的单一光学切片显示内部碘化丙啶染色(红色),表明核管腔位于叶瓣内部。(D, E)表达er -管腔GFP标记mGFP5的下胚轴被损伤。显示的是在受伤约10分钟后使用mGFP5进行的两个独立伤口实验中收缩的表皮核(白色箭头)。叶间空间包含mGFP5标签(红色箭头),表示该隔室与ER管腔相邻。绿色显示绿色荧光蛋白,红色显示碘化丙啶。 Scale bars = 10 μm.
根据我们的观察,叶间空间不包括细胞质GFP,包含腔内ER标记mGFP5,叶由与ER相邻的膜系统划分,我们认为对所观察到的核分叶最简单的解释是核膜的内外膜在核收缩时分离。因此,核收缩并不反映整个核本身的收缩,而是核腔及其紧密相连的内膜的收缩。
皮质-内质网的退化伴随细胞死亡
内质网小管和核膜都包含紧密贴合的双膜结构,具有相似的组装性能在体外[28,43],是连续的膜系统。因此,死亡反应可能会额外改变皮质内质网小管。为了检验这一点,我们对Q4 er膜标记线的创伤近端细胞成像(图4)。5和额外的文件5).伤后约20分钟,明显可见广泛的核收缩和叶裂(图中有星号标记)。5)时,部分ER膜系统已形成气泡状结构,但大部分ER管状网络仍完好无损。此后不久,管状内质网迅速退化,由小管收缩成小泡状结构。5).因此,在局部创伤诱导的细胞死亡反应中,核膜和皮质内质网小管的完整性都发生了改变,尽管动力学明显不同。在内质网小管囊泡形成之前,但同时伴随着核收缩和裂片,我们观察到细胞内的质体远离细胞皮层(数据未显示)。由于质体运动依赖于一个特征良好的肌动蛋白基础运动系统[29这些观察结果表明,在伤口诱导的细胞死亡的早期阶段,该系统至少部分完整。进一步的研究需要使用细胞骨架标记进行成像实验。
苯腈除草剂可导致细胞快速死亡
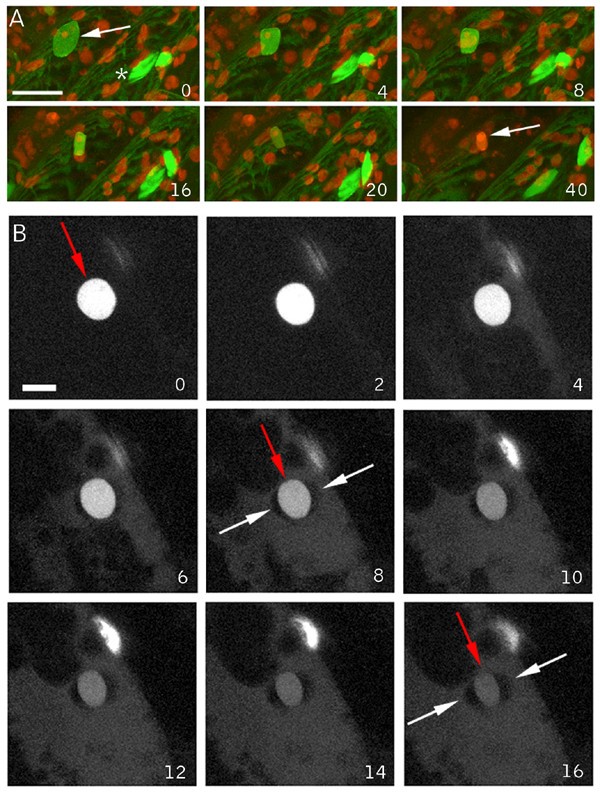
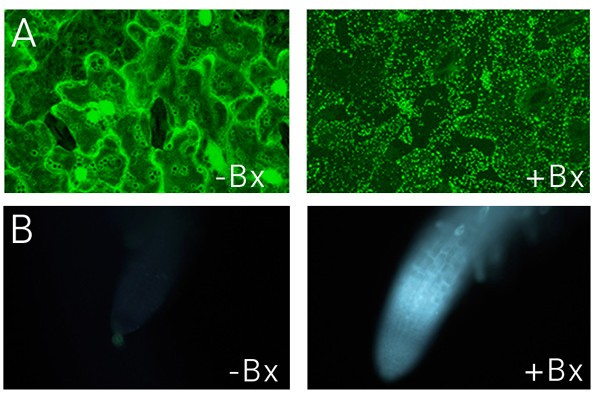
为了探测局部伤口反应的特异性,我们寻找了一种简单的方法,在与我们的损伤实验(45 - 90分钟)相似的时间框架内,用化学方法诱导细胞死亡。许多化学诱导的细胞死亡形式已经被描述出来,但它们的影响通常在数小时到数天的时间尺度上发生,而不是几分钟。为了确定一种快速作用的分子,我们使用GFP-Nit1聚集反应来筛选一些除草剂和其他快速活性的小分子,重点是硝基化合物,在其他实验中,硝基化合物已被用于触发细胞死亡(即KCN, [5])。氰化钾虽然具有明显的毒性,但并没有诱导我们所寻求的GFP-Nit1在1小时内的快速聚集、细胞死亡和细胞崩溃[30.].我们发现,当浓度在250 - 500 μM之间时,羟基苯腈除草剂溴苯腈(2,4 -二溴-对羟基苯腈)及其类似物氯苯腈(2,4 -二氯-对羟基苯腈)可使拟南芥组织细胞迅速死亡。溴虫腈和氯虫腈施用于幼苗1小时内可诱导GFP-Nit1迅速聚集(图。6)、广泛的细胞收缩和细胞死亡(附加文件6).与伤人一样,这些除草剂也会诱发胼胝质沉积(图5)。6 b),早在施于根部8分钟后就显现出来。这些除草剂的具体作用模式尚不清楚,但它们对线粒体呼吸有充分的影响[31,32]并与光系统II蛋白结合[33].无论它们的作用机制是什么,它们都被证明是在我们的成像实验中使用的无伤细胞死亡的方便快速诱导剂。
溴苯腈对GFP-Nit1的聚合和胼胝质诱导.(A)将8日龄的GFP-Nit1植株(N1P2E)幼苗浸泡在500 μM Bromoxynil (+Bx)或模拟溶液(-Bx)中1 h,然后用共聚焦显微镜成像,注意到除草剂处理后融合蛋白大量聚集在团聚体中。(B)溴苯腈处理后胼胝质的积累。野生型苗用500 μm溴苯腈(+Bx)或模拟溶液(-Bx)处理。在紫外线照射下,利用常规的表观荧光和DAPI过滤器对根系进行定期检查;图中显示15分钟的时间点。用在实验开始时以100 ug/ml添加的胼胝质特异性染色剂sirofluor观察胼胝质沉积。在加入溴苯腈约8分钟后,首先可见到Sirofluor荧光。图像是在使用相同曝光设置的数码相机上拍摄的。
细胞核和细胞的收缩可以在细胞死亡时断开
为了探讨化学诱导的细胞死亡过程中的核动力学,我们检测了施用氯苯腈后N7标记系的下胚轴细胞。时间推移成像实验表明,在细胞崩溃的晚期诱导和核的碘化丙啶染色之前,N7标记离开了核,照亮了细胞质,类似于创伤诱导的细胞死亡(图。7 b).然而,下胚轴核的透镜状特征始终存在,表明这种创伤诱导的细胞死亡特征并不发生在这种特殊的化学诱导的细胞死亡中(图1)。7一个).在这些实验中值得注意的是GFP荧光的快速损失,这在我们的损伤实验中没有看到同样程度的损失。我们接下来检查了根细胞的反应,也没有显示核收缩,但清楚地显示了GFP标记的核泄漏(图。7 b和额外的文件6).因此,在这两种细胞类型中,核泄漏发生时没有伴随的核收缩,表明这两种反应是可以分离的。重要的是,这一观察结果表明,核泄漏是由收缩诱导挤压引起的简单假设是不可能的。
氯苯腈引起细胞死亡-无核收缩的细胞崩溃.(A)将核标记线N7装入琼脂糖中,加入溴苯腈-类似物氯苯腈至终浓度为500 μM,每隔2 min收集下胚轴-根结z系列。细胞核标记在细胞质中丢失,GFP荧光普遍丢失,随后细胞核被碘化丙啶染色,大量细胞塌陷。细胞核的形状在整个实验过程中保持不变,没有表现出创伤诱导细胞死亡时所见的典型收缩。白色的星号表示同一个细胞核,绿色的箭头表示两个细胞在这个平面上显示出大量的质裂解。(B)氯虫腈诱导12日龄N7植株的核质释放N7标记物,植株安装在琼脂糖中,覆盖氯虫腈至最终浓度为500 μM。每隔120秒采集z系列成像起始侧根。细胞核标记的逐渐释放和细胞质的发光没有损伤引起的特征性核收缩。比例尺= 25 μm。插入数表示添加除草剂后的最小值。
梭形体球化伴损伤和化学细胞死亡
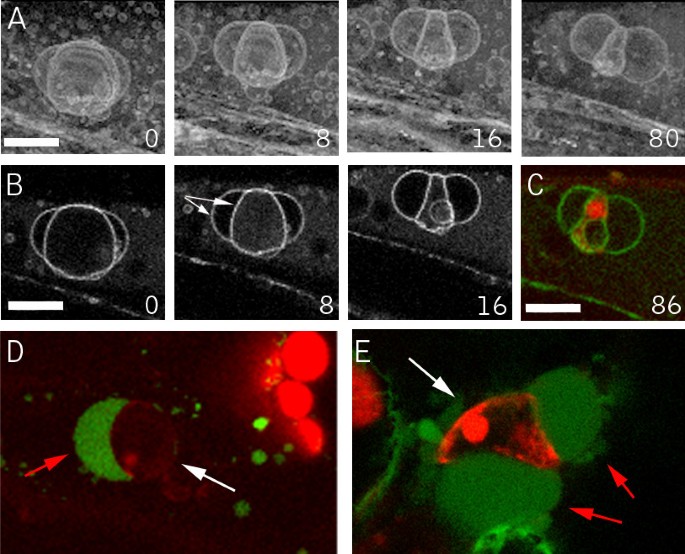
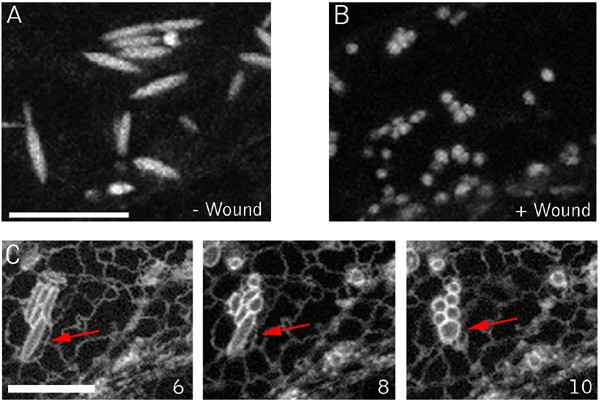
拟南芥中ER的标记照亮了一个被称为梭状体的雪茄形状的附属细胞器[34,35].最近的证据表明,该细胞器可能参与细胞死亡,但其具体功能仍不清楚[36].这种结构在表达ER标记mGFP5和Q4的拟南芥植物中很明显。8).在我们使用Q4标记线对内质网小管和核膜退化的延时观察中,梭状体明显缺失。这促使我们使用mGFP5更仔细地研究它们,它明亮地照亮了这些结构[37,35].在伤口近端表达mgfp5的细胞中,从受伤后的第一个时间点开始,最明显的结构是球体,梭形体缺失(图1)。8).这一观察结果表明梭状体在损伤反应中迅速失去其特征形态。为了检查这种反应是否发生在除草剂导致的死亡过程中,我们在施用氯虫腈后对Q4 er膜标记线进行了成像。在加入氯苯腈后不久,细胞质流停止,随之而来的是梭形体向球形结构的转变(图1)。8 b, C和额外的文件7).因此,伤害和除草剂处理都在早期阶段起作用,以影响维持该细胞器独特形状所需的成分。
GFP-Nit1聚集物在细胞死亡时转移成颗粒部分
苯甲腈除草剂引发GFP-Nit1的大量聚集,促进了该过程的生化表征。GFP-NIT1在未受伤的植物中是可溶性的,在低速离心过程中不会成球9).相比之下,我们观察到GFP-Nit1植株中的团聚体在超声破坏组织过程中是稳定的,并通过离心分裂成一个低速triton - x100不溶颗粒部分(图1)。9).低速颗粒组分中还含有肌动蛋白结合蛋白cofillin,但不含膜蛋白PIP2A,后者存在于低速上清液中;因此,我们使用这两种蛋白质作为每个分数的标记和负载控制(图。9 b).Nit1的低速成球使我们能够测试除草剂诱导的野生型植物中硝化酶溶解度的变化。制备了一种重组Nit1的多克隆抗体,并用于检测从nit1-3零突变(38].粗血清能识别两种蛋白质,其中一种在nit1-3突变体(无花果。9 b),表明该抗体能忠实地识别Nit1蛋白,上带的身份未知,对固定化重组Nit1抗体进行亲和纯化后未检测到。用亲和纯化抗体检测经溴苯腈处理的植物在引起GFP-Nit1转基因系大量聚集的条件下。在野生型植物中,经溴苯腈处理后,体内GFP-Nit1聚集,Nit1蛋白分裂成颗粒部分(图1)。9 c).GFP-Nit1融合蛋白的Western blot结果显示,融合蛋白在低速颗粒组分中有类似的积累(数据未显示)。这些实验为溴苯尼基诱导的Nit1溶解度变化提供了独立的生化分析方法,并表明溴苯尼基和伤口诱导的GFP-Nit1标记物聚集不是融合蛋白的伪产物。
Nit1聚集物的生化分析.(A)在Triton X100中提取溴乙腈处理过的植物的4%提取物,在10000 g下离心10分钟,用共聚焦显微镜成像。(B)野生型和野生型叶组织蛋白提取物的Western blotNit1-3突变体表明该抗体识别野生型的Nit1蛋白,但不识别空突变体。(C)在除草剂诱导的细胞死亡过程中,Nit1聚集到低速颗粒馏分中。将3周龄的幼苗浸泡在溴苯腈(0、125、250、500 μM)溶液中1 h后提取,调至4% Triton X100, 10000 g离心10 min。用SDS-PAGE分离上清和颗粒中的蛋白,用western blotting检测各种蛋白。抗体对抗PIP2A(质膜固有蛋白)和cofillin显示两个部分完全分离。
讨论
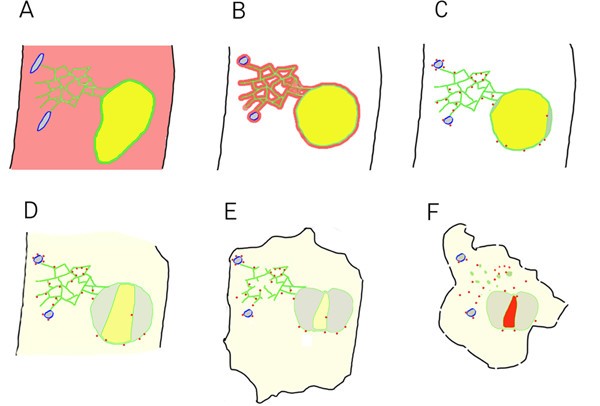
本研究的灵感来自于一个偶然的观察,即GFP-Nit1融合蛋白在穿刺伤口附近的细胞中迅速发生了从可溶性到颗粒状的状态变化。由于重复产生穿刺伤口的技术困难,我们调查了一些化学物质诱导GFP-Nit1聚集的能力。我们发现,几种苯甲腈除草剂造成的效果类似于刺伤。使用各种基于gfp的标记物,我们观察到毗邻伤口部位的细胞,或在使用苯甲腈治疗后,显示出一系列动态形态事件,最终导致细胞收缩和细胞死亡。使用内质网膜标记,我们能够同时观察皮质内质网小管、梭形体、核膜和细胞核的改变。同样,使用GFP-Nit1,我们观察到硝化酶聚集物的形成先于细胞核和细胞的收缩。总的来说,我们的数据与我们合成成描述方案的一系列事件是一致的。10).
与创伤诱导的细胞死亡相关的细胞学事件.(一)完好无损的细胞。纺锤形体为蓝色,细胞质GFP-Nit1为红色,内质网和核膜为绿色,内质网管腔含量为灰色,核管腔含量为黄色,质膜为黑色。(B - F)创伤后事件。(B)最早记录的事件是梭状体的崩溃和核肥大。(C)在这些早期快速事件发生后不久,GFP-Nit1聚集,核开始收缩,同时核膜分离。(D)随着收缩和分裂的继续,核浆的内容物泄漏到细胞质中。目前尚不清楚这次发布是一般性的,还是对丢失的特定内容有特异性。(E)稍后,在核收缩基本停止后,仍然完整的管状内质网完整性急剧丧失并退化,形成囊泡结构。(F)随后是碘化丙啶对细胞核的强烈染色和细胞的广泛收缩。 Propidium iodide staining of nuclei is indicated in (F) by the red color of the nucleus.
损伤后最早的事件是梭状体改变,GFP-Nit1聚集和核肥大。在除草剂处理后,我们观察到纺锤状体的改变发生在GFP-Nit1聚集之前(数据未显示)。在这些早期事件发生后不久,核收缩随之而来,伴随着核膜的分离和核浆泄漏到细胞质中。目前尚不清楚这是否反映了核质的普遍丢失,或丢失的内容物是否有特异性。随后,在核收缩基本停止后,剩下的管状内质网完整性急剧丧失并变性,形成囊泡结构。随后细胞核被碘化丙啶染色,细胞大量收缩。由于碘化丙啶是一种带电的荧光团,在很大程度上被阻止进入重要细胞,我们将这一晚期事件解释为质膜完整性的重大退化,并认为这可能是细胞死亡的点,尽管这是一个操作定义。对质膜标记物的观察表明,在创面反应的早期阶段,质膜大体完好,尽管已经观察到非典型的复卷和极端的光敏性(数据未显示)。
我们记录的事件发生在一个相对较快的时间尺度上。通常情况下,在受伤的几分钟内,我们观察到对细胞核形状、梭状体和GFP-Nit1聚集的可检测的影响。在1 - 2小时内,细胞收缩的细胞核被碘化丙啶染色。虽然我们没有获得程序性细胞死亡(PCD)的证据,但这种快速反应与植物细胞通过组成性表达的分子机制经历PCD的证据是一致的[39].这似乎是合理的,通过限制可能的病原体通过伤口部位,伤口诱导的细胞死亡功能,以有机体作为一个整体的利益。
尽管我们还远远没有对这些事件进行机械的描述,但我们的观察表明,核收缩可以与细胞崩溃分离。已知的苯甲腈除草剂对线粒体功能的影响可能表明核收缩是能量依赖的。由于细胞在氯苯腈处理后发生坍塌,这可能表明收缩是能量独立的,这也许并不令人惊讶,因为膨压部分是通过液泡atp酶和质子泵产生的。
我们在这项研究中的重点是将GFP-Nit1的聚集置于创伤诱导细胞死亡期间的细胞反应背景下。我们在文献中找不到类似转换的任何先例。我们不了解GFP-Nit1从可溶性蛋白质转化为粒状形式的机制。观察到野生型植物中硝化酶1在化学诱导损伤后沉积系数发生变化,表明这种现象不是GFP融合蛋白的人工效应。我们不知道硝化酶1是否是唯一具有这种特性的蛋白质。然而,在对其他数百个gfp蛋白融合进行表征时,我们并没有观察到类似的反应[24(以及未发表的结果)。GFP-Nit1聚集体的大小相对恒定,与分泌囊泡的大小大致相当,这一观察结果可能表明,聚集的基础是氮化酶被包裹或结合到一个囊泡类型的结构上。然而,观察到Triton X100处理并没有分散聚集物,这表明它们不是简单的膜结合囊泡。
结论
伤人除草剂和苯甲腈除草剂都能引起细胞的快速死亡,导致细胞膜破裂的细胞崩溃。在这两种细胞死亡系统中,最早的反应之一是Nit1重新分配为聚集物,在体内可见为GFP-Nit1颗粒或生物化学上为Nit1的低速颗粒形式。Nit1聚集先于核收缩和细胞崩溃,这是植物细胞死亡的两个典型细胞学特征。利用GFP-Nit1和其他标记来成像植物细胞在体内的死亡,揭示了新的亚细胞反应,我们之前没有描述过,如核膜分离,核瓣的形成和核内容物释放到细胞质中。我们的数据为植物细胞死亡提供了一个新的详细的描述模型,并提出了新的机制问题。
方法
植物生长和用于显微镜的准备
植物生长在由0.5X MS盐(Gibco-BRL)和0.8%琼脂(研究有机物)组成的琼脂固化培养基上。种子萌发前在MS板上4℃冷冻4天,然后转移到生长箱中,在300 μE m连续光照下生长-2年代-1.除非另有说明,否则对4 - 8天大的完整幼苗进行成像实验,并将其安装在0.5X MS或成像缓冲液(IMB)中,该成像缓冲液由0.5X MS盐、25 μg/ml碘化丙啶(Sigma)和0.01% Silwet (Lehle Seeds, Tucson, AZ)组成,以促进碘化丙啶穿透表皮角质层。为了防止标本在时间延迟实验中漂移,0.5X MS中的整株幼苗在42℃下添加2体积的熔融2%低熔点琼脂糖(研究有机物),2%高分辨率3:1琼脂糖(FMC)和0.5X MS盐(Gibco-BRL)。细胞在安装后显示活跃的流动,表明安装过程诱导的最小应力。
有针对性的GFP行
本文中用于成像的大部分转基因系之前已经被描述过[24,37],但为了清楚起见,在这里进行了描述。对于GFP-cDNA系,在T3.从初级转基因植物中获得的种子。除非另有说明,这些系包含单一的GFP-cDNA融合。绿色荧光蛋白的融合可以从俄亥俄州立大学的拟南芥生物资源中心(ABRC)获得http://Arabidopsis.org.
核标记
N7标记系(ABRC #CS84731)包含一个GFP和一个锚结蛋白重复序列的含转录因子样蛋白(Genbank Accession CAA16704)的羧基端之间的融合蛋白。N6标记系(ABRC #CS84815)包含HMG-delta蛋白(Genbank登录Y14075)和GFP之间的近全长融合。在分裂的细胞中,它照亮了沿着中期板排列的染色体,因此可能与染色质有关(26)。在间期细胞中,它照亮核质。这一行还包含第二个pcr检测插入,其中包含一个框外的cDNA与GFP融合。
ER标记
mGFP5系由Wolf Scheible通过在质粒pmGFP5-ER上转化mGFP5构建而成[37转化为拟南芥的哥伦比亚生态型。Q4 ER膜标记系(ABRC #CS84728)是GFP和一个预测羧基末端跨膜的新蛋白(Genbank Accession AAB71445)的融合产物。
伤口诱导聚合
GFP-Nit1标记包括一个全长的硝化酶1 [38] (Genbank登录号U47114)融合到GFP的c端。本研究使用了两条系35S- gfp -Nit1,其中融合蛋白由35S启动子驱动,N1P2E由Nit1起始密码子上游的1.8 kb序列驱动表达[30.].这两个株系在转基因植株中表达量相近,但与35S-GFP-Nit1相比,N1P2E株系在根表皮细胞和保护细胞中的表达量较低
成像
装入琼脂糖的幼苗用刀片或锋利的镊子尖在植物组织中切开。将伤口位置与视野对齐一段时间(45 - 60秒)后收集图像数据。在成像实验期间和之前,琼脂糖嵌入标本覆盖加湿圆顶,以防止干燥。大部分图像序列是通过收集30 - 60个时间点的20 - 25 μM深度z序列(通常为15X 1.5 μM z步长),间隔120秒获得的。通过使用BioRad软件包LaserSharp (BioRad, Hercules, CA)对每个z序列进行最亮点重构,从这些数据集生成3d时间序列。对于一些时间序列,在NIH图像中使用最亮点重建进行手动重建(Wayne Rasband, RSB, NIH,马里兰州贝塞斯达)。尼康倒置荧光显微镜,配备尼康60X 1.2数值孔径水浸物镜和Bio-Rad MRC 1024共焦头,带有氪氩激光器。EGFP在488 nm激发,通过525-30带通滤波器收集发射的荧光。在568 nm激发下,通过596 - 615 nm带通滤波器收集发射的荧光,获得叶绿体自身荧光和碘化丙啶荧光。
化学治疗
氯虫腈在乙醇和水中的溶解度比溴虫腈高,用于成像实验。通过发芽试验,两种除草剂对拟南芥的毒性相似[30.].1 M氯苯腈(ChemServices, West Chester, PA)在乙醇中制成。为了进行成像实验,在IMB中配制1 mM的氯虫腈溶液,将100 μl的氯虫腈溶液覆盖在安装在100 μl琼脂糖中的幼苗上,最终浓度为500 μl。
Nit1抗体生产
重组Nit1在大肠杆菌作为his标记的硫氧还蛋白融合蛋白,使用载体pET32(a) (Novagen, Madison, WI),并通过镍螯合树脂色谱纯化(Novagen, Madison, WI)。抗重组Nit1蛋白的多克隆血清由商业供应商(Cocalico, Reamstown, PA)制备。将2 mg纯化的重组Nit1吸附在6 × 8 cm的硝化纤维素膜上,用200 mM甘氨酸、150 mM NaCl ph2.0处理,将Nit1抗体亲和纯化。用Tris碱将洗脱抗体中和至pH 7.0,用Tris缓冲盐水透析过夜,用15 kDa的自旋柱浓缩器浓缩至2 mg/ml,用甘油将浓缩抗体稀释至1 mg/ml。
Nit1造粒化验
经过除草剂处理的植株被转移到体积为3倍重量的冰镇颗粒隔离缓冲液中(GEB, 400 mM蔗糖,75 mM KCl, 50 mM管pH 6.9, 10 mM MgCl21 mM EGTA, 1 mM DTT, 1 mM PMSF, 1 μg/ml leupeptin, 1 μg/ml抑肽素)。然后对它们进行超声处理,用Miracloth过滤,Triton-X 100加入最终浓度为4%的Triton-X 100。冰孵育10 min后,10000 g离心10 min,取上清留置,用GEB + 4% Triton-X 100洗涤球粒。使用氯仿-甲醇萃取协议沉淀上清馏分中的蛋白质[40].颗粒部分和沉淀的低速上清部分在等量的SDS-PAGE样品缓冲液中重悬,一般为每100 mg输入组织(鲜重)500 μl。
将2 ~ 3周龄拟南芥幼苗移栽到ddH溶液中进行除草剂诱导制粒20.01% Silwet和不同剂量的溴乙腈。在室温下轻轻摇动孵育1小时后,将幼苗转移到eppendorf管中,放置在冰上,并如上所述在GEB中进行超声干扰。
蛋白质分析
采用8 - 20%的梯度小凝胶进行SDS-PAGE,按照Ausubel等人的描述制备和运行。[41].在西方分析中,使用Towbin转移缓冲液中的半干电吸墨器将蛋白质转移到硝化纤维素膜上[42].使用Pierce SuperSignal HRP衬底(Pierce, Rockville, IL)开发西部片。作为对照抗体的cofillin和Pip2A来自Rose Biotechnology [44,并在1/2000稀释度下使用。Nit1抗体用1/1000稀释。
参考文献
- 1.
王晓燕,王晓燕,王晓燕。细胞凋亡的进化视角。Cell. 1994,76: 777-779。10.1016 / 0092 - 8674(94) 90350 - 6。
- 2.
Kerr JF, Wyllie AH, Currie AR:细胞凋亡:一种在组织动力学中具有广泛意义的基本生物学现象。中华癌症杂志,1992,26:239-57。
- 3.
Lockshin RA, Zakeri Z, Tilly JL:当细胞死亡。Wiley-Liss。1998
- 4.
Fukuda H:植物管状细胞程序性死亡的范例。植物生物学杂志,2000,44:245-53。10.1023 /: 1026532223173。
- 5.
Ryerson DE, Heath MC:在真菌感染或非生物处理诱导的细胞死亡过程中,核DNA裂解成寡核体片段。植物学报,1998,8:393-402。10.1105 / tpc.8.3.393。
- 6.
Levine A, Pennell RI, Alvarez ME, Palmer R, Lamb C:植物超敏抗病性反应中钙介导的凋亡。中华微生物学杂志,1996,6:427-37。10.1016 / s0960 - 9822(02) 00510 - 9。
- 7.
植物-病原体相互作用中的程序性细胞死亡。植物生理学报,1997,32(4):525-545。10.1146 / annurev.arplant.48.1.525。
- 8.
Greenberg JT, Guo A, Klessig DF, Ausubel FM:植物细胞程序性死亡:一种病原体触发的反应与多种防御功能协同激活。细胞学报,1994,77:551-63。10.1016 / 0092 - 8674(94) 90217 - 8。
- 9.
一氧化氮、环GMP、环adp -核糖诱导烟草防御基因的研究美国国家科学研究院。1998年,95:10328 - 33所示。10.1073 / pnas.95.17.10328。
- 10.
Bostock RM, Stermer BA:对抵抗病原体的伤口愈合的展望。植物生态学报,1998,27(4):343-371。10.1146 / annurev.py.27.090189.002015。
- 11.
Lamb C, Dixon RA:植物抗病中的氧化爆发。植物生理学报,1997,32(4):371 - 371。10.1146 / annurev.arplant.48.1.251。
- 12.
Durrant WE, Rowland O, Piedras P, Hammond-Kosack KE, Jones JDG: cDNA-AFLP揭示了种族特异性抗性和创伤反应基因表达谱的惊人重叠。植物学报,2000,12:963-977。10.1105 / tpc.12.6.963。
- 13.
张松,刘勇,Klessig DF:真菌诱导素诱导烟草细胞死亡过程中WIPK的多水平激活。植物学报,2000,23:339- 347。10.1046 / j.1365 - 313 x.2000.00780.x。
- 14.
Bradley DJ, Kjellbom P, Lamb CJ:一种富含脯氨酸的植物细胞壁蛋白的诱导和诱导氧化交联:一种新的快速防御反应。细胞科学,1992,70:21-30。10.1016 / 0092 - 8674 (92) 90530 - p。
- 15.
Levine A, Tenhaken R, Dixon R, Lamb C:来自氧化爆发的H2O2协调了植物的超敏抗病性反应。细胞学报,1994,79:583-593。10.1016 / 0092 - 8674(94) 90544 - 4。
- 16.
Orozco-Cardenas M, Ryan CA:过氧化氢在植物叶片中通过十八烷类途径损伤和系统生成。美国国家科学研究院。1999年,96:6553 - 7。10.1073 / pnas.96.11.6553。
- 17.
Orozco-Cardenas ML, Narvaez-Vasquez J, Ryan CA:过氧化氢在番茄植株中作为第二信使诱导防御基因,以应对伤害、系统素和茉莉酸甲酯。植物学报,2001,13:179-191。10.1105 / tpc.13.1.179。
- 18.
Torres MA, Dangl JL, Jones JD:拟南芥gp91phox同源物AtrbohD和AtrbohF是植物防御反应中活性氧中间体积累所必需的。美国国家科学研究院。2002年,99:517 - 22所示。10.1073 / pnas.012452499。
- 19.
Delledonne M, Xia Y, Dixon RA, Lamb C:一氧化氮在植物抗病中的信号作用。自然学报,1998,394:585-588。10.1038/29087。
- 20.
一氧化氮、环GMP和环adp -核糖诱导烟草防御基因的研究美国国家科学研究院。1998年,95:10328 - 10333。10.1073 / pnas.95.17.10328。
- 21.
张海燕,杨雪:细胞自杀蛋白酶:半胱天冬酶的功能及调控。微生物学报,2000,34(4):371 - 371。10.1128 / mmbr.64.4.821 - 846.2000。
- 22.
Watanabe N, Lam E:植物中caspase样蛋白酶和Bax抑制剂-1的研究进展:它们在程序性细胞死亡调节中的可能作用。植物病理学杂志,2004,5:65-70。10.1111 / j.1364-3703.2004.00206.x。
- 23.
初菜N,黑柳木M,山田K,梅施T,津田S,近藤M,西村M,原西村I:植物液泡蛋白酶介导病毒诱导的高敏细胞死亡。科学通报,2004,30(5):555 - 558。10.1126 / science.1099859。
- 24.
Cutler SR, Ehrhardt DW, Griffitts JS, Somerville CR:随机GFP:: cDNA融合使拟南芥细胞亚细胞结构的可视化在高频率。美国国家科学研究院。2000年,97:3718 - 3723。10.1073 / pnas.97.7.3718。
- 25.
Alvarez ME, Pennell RI, Meijer PJ, Ishikawa A, Dixon RA, Lamb C:活性氧中间体介导植物免疫系统信号网络的建立。Cell. 1998,92: 773-784。10.1016 / s0092 - 8674(00) 81405 - 1。
- 26.
拟南芥液泡化细胞的极化胞质分裂。美国国家科学研究院。2002年,99:2812 - 2817。10.1073 / pnas.052712299。
- 27.
希思·MC:神秘的超敏反应:诱导、执行和角色。植物病理学杂志,1999,55:1-3。10.1006 / pmpp.1999.0217。
- 28.
植物ER:由大量离散功能域组成的动态细胞器。植物学报,1998,15(4):371 - 371。10.1046 / j.1365 - 313 x.1997.11061151.x。
- 29.
拟南芥叶肉细胞中肌动蛋白-细胞器相互作用与叶绿体的关系。细胞生物学杂志,1999,44:110-118。10.1002 / (SICI) 1097 - 0169 (199910) 44:2 < 110:: AID-CM3 > 3.0.CO; 2 o。
- 30.
Cutler SR:利用随机生成标记在拟南芥中进行活细胞分析。2001年,斯坦福大学
- 31.
Zottini M, Scoccianti V, Zannoni D: 3,5 -二溴-4-羟基苯甲腈(Bromoxynil)对高等植物线粒体生物能学的影响。植物生理学报,2004,24(3):366 - 366。
- 32.
卡朋特K,海伍德BJ: 3,5 -二卤-4-羟基苯甲腈的除草作用。自然,1963,200:28-29。
- 33.
Giardi MT, Marder JB, Barber J:除草剂与孤立光系统ii反应中心的结合。生物化学学报,1998,19(4):364 - 371。
- 34.
拟南芥植物表达GFP的神秘细胞器的鉴定。植物科学进展,1998,3:417-417。10.1016 / s1360 - 1385(98) 01336 - 3。
- 35.
Ridge RW, Uozumi Y, Plazinski J, Hurley UA, Williamson RE:用绿色荧光蛋白观察拟南芥细胞皮层ER的发育转变和动态。植物生理学报,1999,30(4):359 - 361。
- 36.
Hayashi Y, Yamada K, Shimada T, Matsushima R, Nishizawa NK, Nishimura M, Hara-Nishimura I:拟南芥表皮细胞中准备细胞死亡或应激的蛋白酶储存体。植物生理学报,2001,27(4):394 - 394。10.1093 /卡式肺囊虫肺炎/ pce144。
- 37.
Haseloff J, Siemering KR, Prasher DC, Hodge S:绿色荧光蛋白的隐内含子去除和亚细胞定位是标记转基因拟南芥植物的必要条件。美国国家科学研究院。1997年,94:2122 - 2127。10.1073 / pnas.94.6.2122。
- 38.
Normanly J, Grisafi P, Fink GR, Bartel B:耐吲哚-3-乙腈生长素效应的拟南芥突变体是Nit1基因编码的硝化酶缺陷。植物科学学报,1997,19(3):369 - 369。10.1105 / tpc.9.10.1781。
- 39.
Elbaz M, Avni A, Weil M:本构caspase样机制在植物细胞中执行细胞程序性死亡。细胞死亡差异,2002,9:726-733。10.1038 / sj.cdd.4401030。
- 40.
韦塞尔D, Flugge UI:一种在有清洁剂和脂类存在的稀溶液中定量回收蛋白质的方法。生物化学学报,2004,25(3):354 - 354。10.1016 / 0003 - 2697(84) 90782 - 6。
- 41.
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K:分子生物学的当前协议。Wiley-interscience。1993
- 42.
杜斌,王晓燕,王晓燕,等:蛋白质从聚丙烯酰胺凝胶到硝化纤维素片的电泳转移过程及其应用。美国国家科学研究院。1979年,76:4350 - 4。
- 43.
Dreier L, Rapoport TA:体外内质网的形成独立于微管,通过可控的融合反应发生。中国生物医学工程学报,2000,29(3):394 - 398。10.1083 / jcb.148.5.883。
- 44.
Biotechnololgy上升。[http://www.rosebiotech.com/]
确认
我们感谢David Ehrhardt在共聚焦显微镜方面的协助和富有成效的讨论。我们也感谢Farhah Assaad对手稿和数据提出的宝贵意见。这项工作得到了美国能源部(DOE-FG02-00ER20133)的资助。
作者信息
从属关系
相应的作者
作者提交的图片原始文件
伤口诱导的GFP-Nit1颗粒在远处显示作用
附加文件1:用注射器尖端在根分生组织上方损伤35S GFP-Nit1根,快速对准显微镜,然后以4秒间隔在单个焦平面上成像,持续8分钟(伤口部位在时间序列的焦平面之外,但在根尖中心分离细胞的深色区域可见)。最初,gfp - nit1标记是可见的弥漫性荧光。在几分钟的过程中,明亮的颗粒结构变得明显,伴随着细胞质荧光的减少,表明标记物重新分配到颗粒中。图像系列的总时间为8分钟。在其他时间序列中,我们观察到随着细胞质流的恢复,标记物向细胞质分布的逆转(见附加文件)3.).用该标记观察到的远距离动作表明,该标记对受伤后发送的运动信号有响应。图1a中所示的数据是从这个数据集推导出来的。(MOV 3 MB)
12870 _2004_49_moesm3_esm.mov
一个挂载琼脂糖的35S GFP-Nit1植株在根分生组织上方被损伤,每隔2分钟获取z系列成像,持续90分钟。伤口在视野上方。在获得第一个时间点时,造粒反应已经扩散到根分生组织的大部分。随着时间的推移,颗粒恢复到细胞质分布模式,细胞恢复细胞质流。图像为受伤后每2分钟采集的z系列最亮点重建。(MOV 4 MB)
12870 _2004_49_moesm8_esm.mov
附加文件8:创面区域内细胞的塌陷-创面诱导的GFP-Nit1颗粒化,随之而来的是细胞收缩和从邻近细胞分离。电影2A的全帧图像数据来源于此。注意伤口区域的大量细胞在受伤后显示肉芽,并在时间序列中随后收缩。手稿中的图2B就是从这个数据集推导出来的。(MOV 6 MB)
12870 _2004_49_moesm4_esm.mov
用刀片损伤琼脂糖嵌入核标记线(N6)的下胚轴,每隔2分钟采集共聚焦z系列成像。在成像缓冲液中加入碘化丙啶以监测质膜的完整性。在受伤后,左侧的细胞核相对于未受伤的正常透镜状细胞显示肥大(见影片中右侧细胞中的细胞核)。在时间序列的过程中,核的收缩伴随着GFP荧光的下降,在所示的16到20分钟时间点之间的时间序列中最明显。随后用碘化丙啶对收缩的细胞核进行强染色。(MOV 1 MB)
12870 _2004_49_moesm5_esm.mov
创伤诱导细胞死亡过程中皮层内质网的退化。我们对内质网膜标记线Q4的一个创伤-近端叶柄表皮细胞进行了成像。部分内质网在损伤后迅速形成泡状结构,其余完整的管状内质网随后变性,形成大量的泡状结构。图像为受伤后每2分钟采集的z系列最亮点重建。(MOV 1 MB)
12870 _2004_49_moesm6_esm.mov
将核标记线N7安装在琼脂糖中,加入氯苯腈(终浓度500 μ M),每隔2分钟收集下胚轴-根连接处的z系列,开始成像。细胞核标记在细胞质中丢失,GFP荧光普遍丢失,随后细胞核被碘化丙啶染色,大量细胞塌陷。细胞核的形状在整个实验过程中保持不变,不显示创伤诱导细胞死亡时所见的典型收缩。(MOV 4 MB)
氯苯腈期间梭状体改变引发细胞死亡
附加文件7:琼脂糖安装的Q4幼苗的表皮下胚轴细胞以120秒间隔获取z系列成像。获得三个z系列后,加入氯苯腈至最终浓度为500 μ M。活跃的流媒体在前3个时间点很明显。施用除草剂4分钟后,流停止,梭状体和管状内质网缺乏运动是明显的,而梭状体和管状内质网通常是高度动态的。此后不久,梭状体转变为球形结构,这也发生在创伤诱导的细胞死亡过程中。数据如图所示8都是从这个数据集推导出来的。(MOV 1 MB)
权利和权限
关于这篇文章
引用这篇文章
成像植物细胞死亡:GFP-Nit1聚集标志着伤口和除草剂诱导的细胞死亡的早期步骤。BMC植物杂志5,4(2005)。https://doi.org/10.1186/1471-2229-5-4
收到了:
接受:
发表:
关键字
- 核被膜
- 过敏的反应
- 标记线
- 刺伤
- 溴苯腈