摘要
背景
植物色素沉着受多种因素的影响。光作为植物发育的重要信号,主要通过激活调控类黄酮生物合成途径的转录因子来影响花青素的积累。在本研究中,我们利用玉米黑墨西哥甜(BMS)细胞表达的R和C1调控花青素生物合成的光不敏感启动子,作为一种手段来研究是否存在额外水平的光控制色素沉积。
结果
表达R和C1调控因子的BMS细胞CaMV 35 s本构启动子在完全黑暗条件下积累花青素,表明转录因子R和C1足以完成该途径结构酶对应基因的转录,不需要额外的光诱导调控因子。有趣的是,在表达R和C1的转基因BMS细胞中,光诱导紫色花青素色素沉着的颜色“变暗”。这种色素色调的变化与花青素的水平或类型的变化无关,也与几种类黄酮生物合成基因的转录水平的改变无关。然而,细胞学观察表明,光驱动的形态和分布的花青素液泡室的意外变化。
结论
通过解耦光对花青素积累的效果,我们发现光诱导含半粘蛋白的漂浮粘合的漂浮,其中含有的花氰酸真空夹杂物(AVI) - 样结构的聚结,以及花青素从夹杂物中的扩散到真空SAP中.在玉米花圈积累花青素的表皮细胞中,类似的光引起的逼伤改变也是明显的。我们的研究结果表明了一种新的光学作用机制对花青素的真空储存的作用。
背景
花青素是类黄酮途径的有色终端产物,在吸引昆虫或动物授粉和种子传播中起着重要作用。此外,它们还发挥抗氧化剂的作用,保护DNA和光合器官免受高辐射通量[1].花青素的其他可能功能,如抵御寒冷胁迫或提供抗旱能力,可能与限于特定植物类别的活动有关[2].
黄酮类化合物是一种由苯丙类衍生的酚类化合物,它的生物合成提供了对植物代谢途径的最好描述,该途径中的许多结构和调控基因已被识别和克隆[3.那4.].关于从它们的合成部位输送水溶性花青素的机制,已知的较少是已知的,内质网的细胞质表面[5.那6.],在液泡中,它们通常被隔离的地方[7.].植物液泡是高度动态的多功能细胞器,是大分子的主要储存和周转位点。这些膜结合的细胞器可以占据总细胞体积的高达90%,是端膜系统的组成部分,用作分泌途径的终端产物[8.].
有几种植物将花青素储存在液泡内含物中,这些液泡被松散地称为花青素质体。人们观察到,花青素质体从细胞质中的小泡开始,似乎是膜结合的[9.那10].最近,在各种植物的花瓣中观察到的孔内结构,包括香石竹和甘草花,被称为花青素液泡内含物,或AVIs [11].这些内含物被认为是无膜的蛋白基质,作为花青素陷阱,优先为花青素3,5 -二糖苷[11或酰化花青素[12].一旦进入液泡,许多因素会影响体内花青素提供的色素沉着,具有对植物生态生理学的重要影响[13那14].其中一些因素包括存在的特定类型的花青素(如天竺葵花青素或杨梅素),色素积聚所在细胞的形状[15]、色素的浓度、花青素与辅色素之间复合物的形成[16]和真空pH [17那18].
众所周知,环境条件可以诱导花青素色素在主要的高等植物群中积累,其中光是研究得最好的[2那19那20.].在拟南芥,花青素途径以昼夜时尚调节,具有黄酮基因在黑暗循环结束时达到峰值,可能为黎明制备植物[21].在玉米中,PL1 / C1 R2R3 MYB和B / R BHLH系列的调节蛋白的成员合作用于调节花青素颜料[3.]对于表达花青素生物合成基因是必要的C2.(Chalcone合成酶),Chi1.(查耳酮异构酶),f3h(黄烷酮3-hydroxylase)a1(dihydroflavonol 4-reductase),a2(亮藻霉素二氧化根酶/花青素合成酶),BZ1.(UDP葡萄糖:黄酮类化合物3-O.-glucosyl转移酶)和BZ2.(谷胱甘肽S.转移酶)19].这些R2R3、MYB和bHLH转录因子的光诱导表达被认为是光诱导玉米花青素产生的原因[22-26].
在这里,我们研究了光是否通过激活已知的R2R3 MYB和bHLH调控通路以外的水平影响玉米花青素色素沉淀的积累。为了实现这个目标,我们分析了前面所描述的[27转基因黑墨西哥甜(BMS)玉米细胞在培养中表达Zea Mays.R和C1调节剂来自组成型,光不敏感CaMV 35 s推动者(BMS.35 s:: R + 35 s:: C1).我们在这里展示BMS35 s:: R + 35 s:: C1即使在完全黑暗中生长,细胞也是红色的。在轻微的处理时,BMS的颜色有变暗35 s:: R + 35 s:: C1细胞中,花青素的数量或花青素的类型没有明显的增加。与这些发现一致的是,一些花青素生物合成基因的稳态水平在光照处理下没有增加。有趣的是,在亚细胞水平上,光诱导花青素在液泡室中的分布方式发生改变。在光照射下,玉米雄穗颖片的花青素积累液泡的形态也发生了类似的变化,这与BMS中观察到的现象类似35 s:: R + 35 s:: C1培养细胞也发生在Planta..综上所述,我们的发现表明了光作用于花青素在液泡和液泡下的包装的新机制。只有使花青素的生物合成不依赖于光才能揭示光的这种作用。
结果
表达转录因子R和C1的BMS细胞积累了黑暗中的花青素
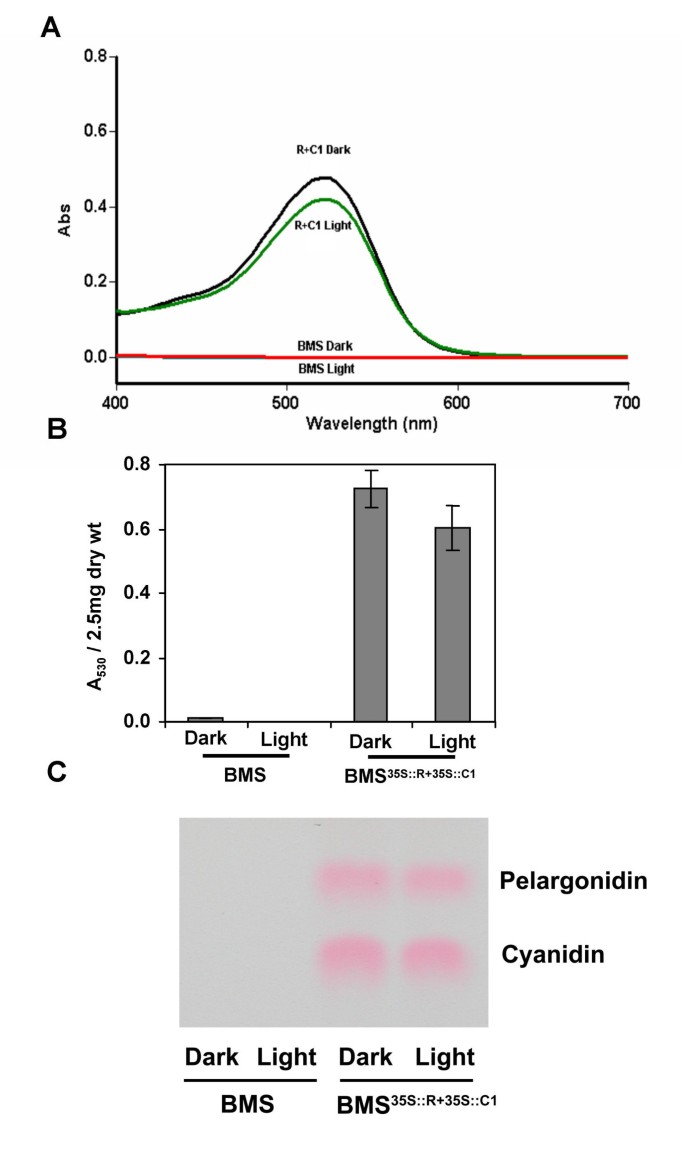
确定玉米花青素途径的光控制是否由B/R和C1/PL调节基因和/或生物合成基因的表达介导[23,我们研究了表达R和C1基因的BMS细胞的色素沉着CaMV 35 s推动者(BMS.35 s:: R + 35 s:: C1) [27].BMS.35 s:: R + 35 s:: C1在完全黑暗中培养30天的细胞完全被花青素着色(图。1).由35S启动子驱动的R和C1调控子轰击BMS细胞(p35SR + p35SC1),即使在轰击后细胞完全处于黑暗状态下,也能在15小时内导致红细胞的积累(对比图)。1 b和1 c).这些结果表明,即使在缺乏光的情况下,R和C1调节因子的组成性表达也足以激活该通路。
BMS.35 s:: R + 35 s:: C1细胞在光线下会变暗
研究光线是否对BMS中的色素沉着有任何额外的影响35 s:: R + 35 s:: C1细胞,我们比较了BMS和BMS的颜色35 s:: R + 35 s:: C1细胞在完全黑暗中或在轻质条件下生长六天(参见方法)。BMS.35 s:: R + 35 s:: C1与在黑暗中生长的细胞相比,在光中生长的细胞显示出视觉变暗(图。2,百时美施贵宝35 s:: R + 35 s:: C1).然而,光没有诱导不表达C1和R调节剂的对照BMS细胞的白色黄色的任何可见差异(图。2,BMS)。我们量化了这些视觉颜色差异体内使用一个反射计和CIELAB颜色空间值系统。L*值表示亮度水平,不受光照的影响1).BMS的a*值35 s:: R + 35 s:: C1细胞呈阳性(+a),与这些细胞的红色特征一致。然而,当BMS时,a值显著降低(p < 0.05)35 s:: R + 35 s:: C1将细胞置于光照下,实验进行三次,每次观察光照(见表)1).虽然b*值,有助于黄色(+b)或蓝色(-b),在黑暗和光明生长的BMS之间有显著差异(p < 0.05)35 s:: R + 35 s:: C1它们在零值附近徘徊,表明对观察到的整体色移的贡献很低。因此,观察到的a*和b*值对应的是可量化的红色(暗红色),在光线下红色程度下降,这与我们的视觉观察(图。2).在没有L *值的情况下,电池的明显变暗可能是由反射光朝向更少红色的光谱偏移引起的。
白光不改变BMS中生物合成基因的花青素含量和mRNA稳态水平35 s:: R + 35 s:: C1细胞
调查暗和光生长BMS之间观察到的颜色变化是否35 s:: R + 35 s:: C1细胞是由于色素的质量或数量的变化,对花青素进行了提取和定量。细胞甲醇提取物,归一化干重,用分光光度法分析。从酸性甲醇提取物中提取的色素在530 nm处具有相同的吸收光谱和非常相似的吸光度值(图3)。3a,b).为了确定呈现出存在的花青素的类型的光是否诱导出存在的花青素的类型,通过薄层色谱法(TLC)萃取并分离总花青素。在轻质和深色处理的BMS中存在类似水平的Cyanidin和Pelargonidin35 s:: R + 35 s:: C1细胞(图。3C),与之前在BMS中描述的两种主要类型的花青素35 s:: R + 35 s:: C1细胞(28].
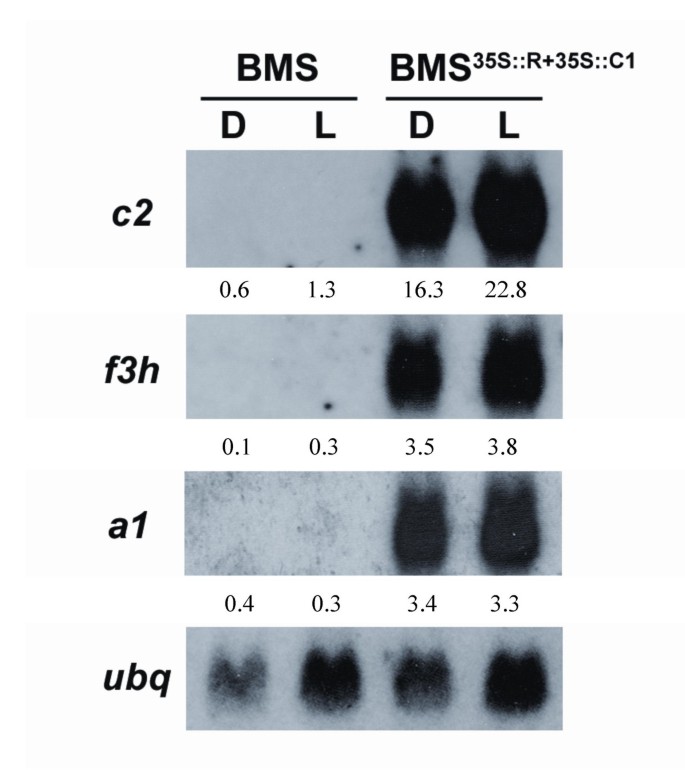
在BMS细胞中,已知R和C1激活几种黄酮类生物合成基因[27].为了研究光处理是否进一步增强了这些基因的激活,从BMS中提取总RNA35 s:: R + 35 s:: C1细胞在光中培养六天或暗黑并通过RNA凝胶印迹分析(Northern印迹,图。4.).查尔酮合酶(chalcone synthase,C参照图2.4.)、黄酮3-羟化酶(f3h,无花果。4.)或二氢黄酮醇4-还原酶(a1,无花果。4.观察到光长生长的BMS35 s:: R + 35 s:: C1细胞。对照BMS细胞没有这些基因的mRNA积累(图。4.).总之,这些结果表明BMS的变暗35 s:: R + 35 s:: C1光处理下的细胞不是由于花青素色素数量或质量的改变。
白光诱导花青素亚细胞分布和液泡组织的改变35 s:: R + 35 s:: C1细胞
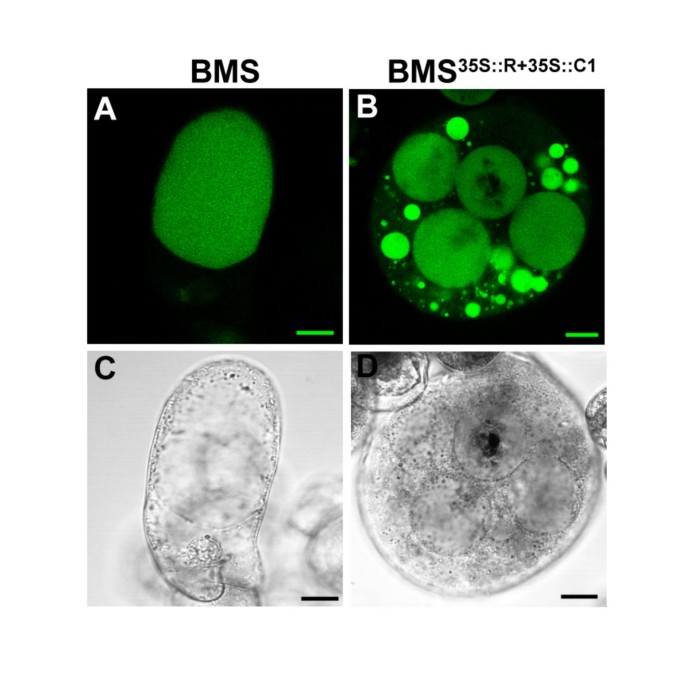
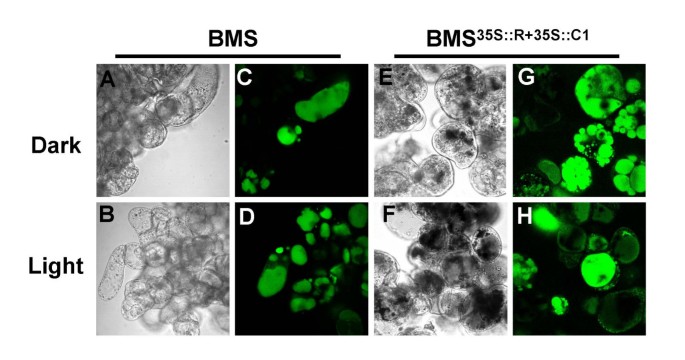
玫瑰花卉色素沉着的改变以前用AVI样结构形成相关[29].研究花青素的包装变化是否与BMS的光致色度变化有关35 s:: R + 35 s:: C1细胞,我们研究了深色和浅谈的BMS的亚细胞形态35 s:: R + 35 s:: C1细胞。明确显示液泡、BMS和BMS35 s:: R + 35:: C1用荧光液泡染料2',7'-双(2-羧基乙基)-5(6)-羧基荧光素(BCECF-AM)的可渗透的乙酰氧甲基衍生物进行染色。在对照BMS细胞中,通常有一个到几个大的液泡室(图。5a,c).相比之下,BMS35 s:: R + 35:: C1细胞呈多液泡状(图。5B,D).不幸的是,在液泡包涵体中富集的花青素会熄灭BCECF-AM染料的荧光,这在一些较大的液泡中可以观察到(图)。5B.).
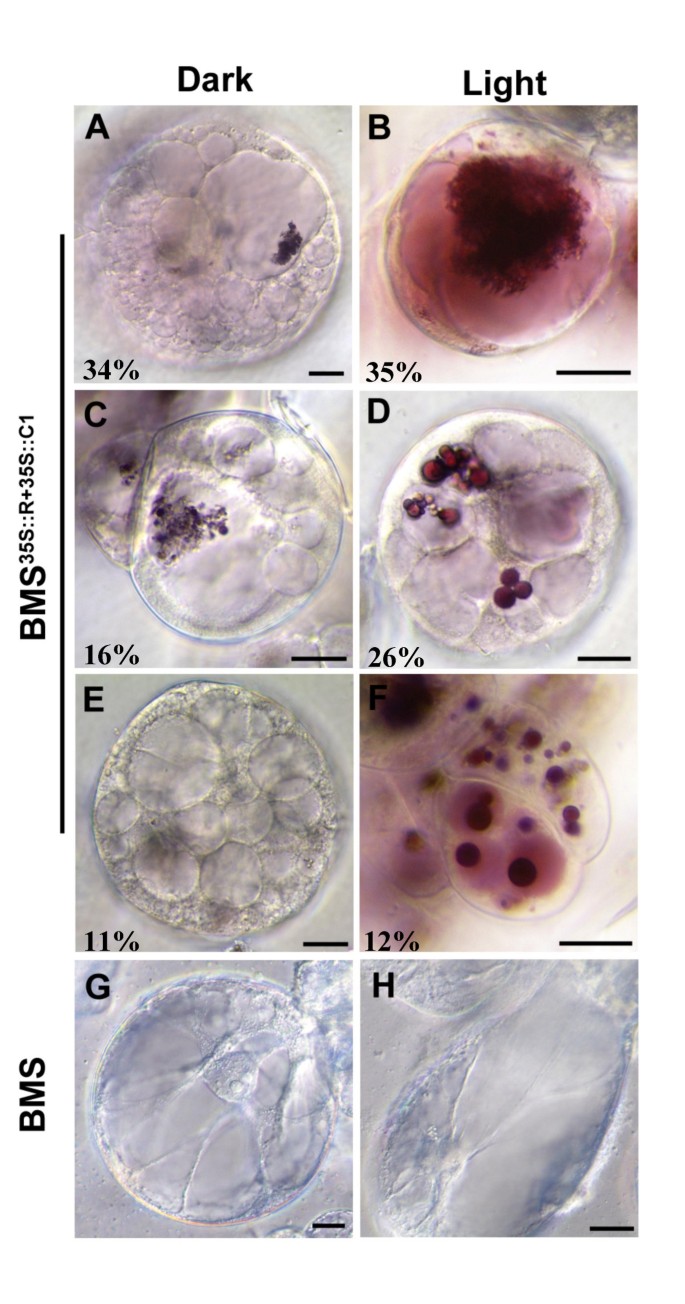
在液泡内,花青素在夹杂物中积聚,当在偏振光下观察时,在偏转光下观察到的形状或常规或聚集,如具有填充的细弦的交叉线(图。6.).光对BMS中液泡数量和每个液泡内含物的数量有显著影响35 s:: R + 35 s:: C1细胞。在黑暗处理的BMS中35 s:: R + 35:: C1细胞,主要代表细胞类型(图。6A,表示观察到所有239个细胞的34%),具有20至30个可观察空泡(表2).在这些细胞中,花青素主要存在于圆形真空夹杂物中,具有真空SAP的特征苍白粉红色着色,在此称为“花青素涂抹”的现象。在黑暗处理的BMS中存在下两个最丰富的细胞类型35 s:: R + 35:: C1对应于所有细胞的16%和11%的细胞分别具有每种细胞10-20或20-30个视觉可观察的真空吸尘器(表2).这些基团的细胞的特征在于在光学显微镜下的真空SAP中不可观察到的花青素,但在液泡中具有红色或浅红色的花青素夹杂物(图。6C,E.).
在光照下,BMS占多数35 s:: R + 35:: C1细胞(35%,表2)显示1 ~ 10个着色液泡,其中含有红色内含物,大部分时间呈弥漫状,类似“缠结的线”(图,6B.).直径测定这些结构的直径为0.1至0.3μm,出现在某些细胞中,以在其端部的BLEB样结构支化。大量细胞群(26%,表2)具有10-20个液泡,轻微着色,具有离散的色素的球形夹杂物(图。6D.).第三类大量的BMS35 s:: R + 35:: C1灯中存在的细胞(12%,表2)显示深沉的着色液泡和扩大的夹杂物(图。6f.).
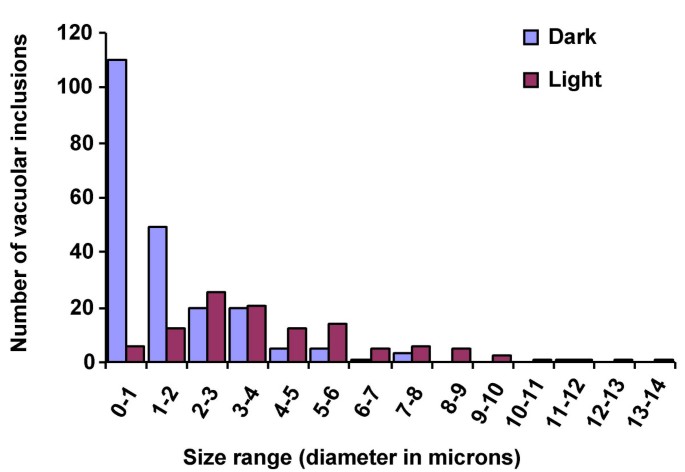
在深色和浅生BMS中的真空夹杂物的尺寸的比较35 s:: R + 35:: C1细胞(图。7.)显示暗种样品中的大部分夹杂物的尺寸范围为0.1μm - 1μm,具有明显的较大的较大。光生长细胞中真空夹杂物的模态范围为2μm - 3μm,其中一些大至14μm。这可能反映较小的真空夹杂物的融合,以产生更大的真菌夹杂物(见下文)。在黑暗或光中生长的对照BMS细胞未显示出任何明显的亚细胞形态变化(未示出)。
为了进一步了解光对花青素积累细胞的影响,我们对BCECF-AM负载的BMS进行激光共聚焦显微镜扫描35 s:: R + 35:: C1细胞。暗生长的细胞可见多个液泡的存在(图。8G),经光处理后,它们似乎合并形成更少、更大的液泡(图。8h.).光生长的细胞显示荧光的减少,可能是由于从真空夹杂物中释放的花青素猝灭。暗或光生长的BMS细胞显示出视觉荧光强度或真空形态没有明显的差异(图。8 c,d),表明观察到的形态改变是R和C1调节剂的表达的结果,其中花青素的积累或花青素积聚的空泡的孤立的独特性质。
总之,这些结果表明,暴露在阳光下的BMS35 s:: R + 35:: C1细胞的液泡数量显著减少,液泡大小增加,AVIs的数量、形状和大小发生变化,花色苷从AVIs释放到液泡中。
光诱导积累花青素的玉米花器官液泡形态的改变
建立在BMS细胞中观察到的光诱导空泡改变是否也能被观察到在Planta.,我们看着玉米的流苏b我Pl累积大量花青素的植物(图。9.).内层有光保护的外稃和外稃(图。9B.)是观察光诱导液泡形态变化的材料选择。植物附属物的表皮细胞C2-IDF.缺乏花青素的突变体(图。9C.)有一对一的大,可观察,无色,中央液泡(图。9D.).相比之下,取决于小花的生理和发育阶段,引理的表皮细胞或PALEA的表皮细胞b我PlFlorets(图。9B,E.)已经填充了花青素,或者是积累的初始阶段(图9F.).这些细胞显示出具有独特的多血泡形态,并且耐气含量常用于花青素和类似的结构(图。9F.).
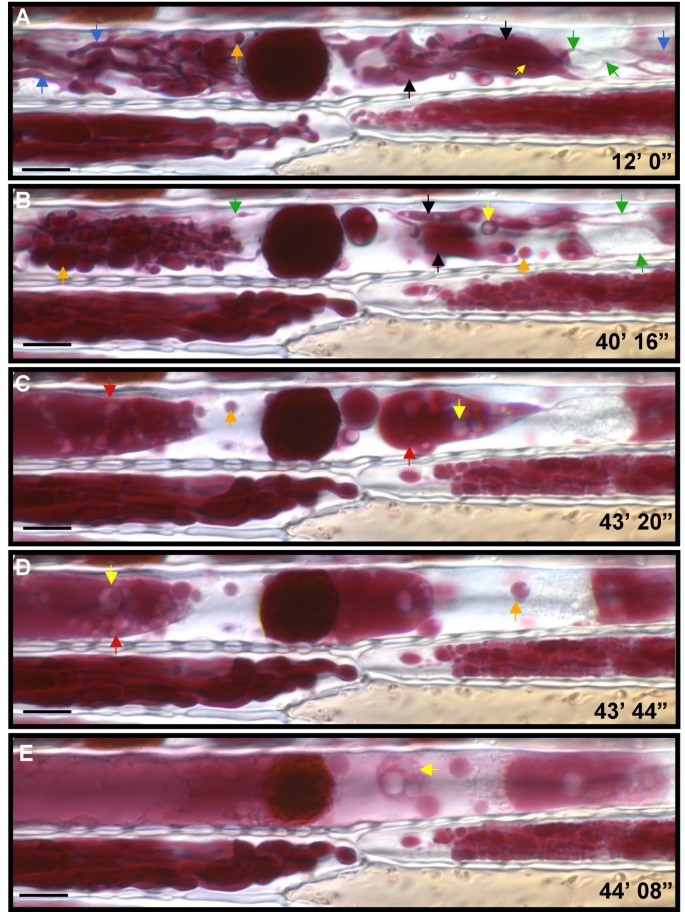
来自显微镜的光足就是诱导含有花青素的真空结构的形态和分布的显着改变,如在四秒间隔所拍摄的时间流逝图像中所见(图。10, 看额外的文件1:用于执行此分析的原始数据为电影1)。在这些系列中,最初薄,管状花青素填充结构(平均直径0.6 μm,图。10,绿色箭头)膨胀至约1.4μm的厚度,动态填充整个电池(图。10蓝色箭头)。这些粗的手指状突起变得肿胀,形成片状结构(直径约3.3 μm,图10,黑色箭头),然后变成圆形(图10 a, B, C;橙色箭头)和彼此保险丝。这些圆形/椭圆形隔室的直径为1-9μm,就像管状结构一样,动态形态变化。观察到肿胀的“灼热”沿细小管移动,厚管的端部膨胀成圆形结构。一旦发起,融合事件非常迅速,导致形成大融合体(图。10 c, D, E;红色箭头)含有大量透明(即不含花青素)结构(图10 c, D, E;黄色箭头)。最初也在片状结构中初始观察到这些透明夹杂物,并形成小管的尺寸。融合体迅速进展以填充整个细胞,最后聚结合在一起,导致在整个隔室中扩散的花青素(图10 e).大型中央AVI样结构周围的限定边缘(〜15μm)变得更加漫反射,在不透明的暗体周围的较轻的半透明红光晕(图。10 e).
亚细胞形态BI Pl玉米花细胞积累了花青素。B-I/B-Peru植物花青素过度积累的玉米外稃的DIC图像。以上是从延时序列中提取的图像(见额外的文件1:电影1)。图像上的时间点指示从时间0'的时间段。当样品安装到阶段并暴露于显微镜光时。(a)和(b)在系列中更早地发生,而(d),(c)和(e)迅速连续(相隔24秒)。大型中央包合物对应于含有直径为15μm的花青素的真空包含。以这种顺序,绿色,蓝色和黑色箭头表明,在将薄管状花青素的结构转化为厚的片状结构的转化阶段。橙色箭头表示下一步,这是转换成圆形结构。红色箭头表示由肿胀圆形结构的熔化产生的大型融合体。黄色箭头指向缺乏花青素的透明球形结构。杆代表10μm。
与BMS相比35 s:: R + 35 s:: C1细胞,其中花青素的产生从光诱导的形态改变中脱离,其中花青素的积累b我Pl细胞是由光诱导的[23].因此,染色体形态的观察到的变化可能是在BMS中观察到的真空形态的光诱导的抗诱导变化的转录因子的光诱导因子表达的结果35 s:: R + 35 s:: C1细胞,或它们的组合。
讨论
花青素颜料在植物中起着许多重要的生态生态生态作用。虽然已经过广泛描述了花青素的生物合成和调节,但对于这些颜料在液泡中螯合以及它们在多大程度上,它们的储存模式如何影响颜色的程度。这里介绍含有玉米细胞中的花青素的空泡和亚真空室的细胞学变化。
我们在BMS中的研究35 s:: R + 35 s:: C1细胞显示花青素,即使在总黑暗中也会积聚,而不对花青素的水平的任何效果,也没有各种类黄酮生物合成基因的转录物的量。从这些结果来看,我们得出结论,当r和c1调节剂表达时,不需要额外的光引起因子来影响途径的控制。这为先前的研究结果提供了强烈的支持,表明,黄酮型途径在已知的R2R3 MYB和/或BHLH转录活化剂的转录水平下进行调节,而不是在途径结构基因的水平下进行调节[23那25那26].因此,百时美施贵宝35 s:: R + 35 s:: C1细胞提供了一种强大的工具,使光对花青素积聚和色素沉着的效果来偏离,在大多数植物系统中不可行,其中花青素被光诱导。
与BMS中花青素含量相似35 s:: R + 35 s:: C1在暗或光线下的细胞使我们揭示了在色素沉着上的光的第二次效果。浅谈的BMS35 s:: R + 35 s:: C1与在黑暗中生长的相同细胞相比,细胞颜色更深(图。2).在BMS之间观察到显着的可量化反射差异35 s:: R + 35 s:: C1细胞在连续光或黑暗中生长六天(表1),这些变化与花青素的数量或类型的变化无关(图。3.).显微镜研究证实了广泛的液泡形态学改变(图。6.)与颜色变暗有关。不表达花青素调节因子的BMS细胞通常有一个或几个液泡室(图。5.).相反,这些细胞中R和C1的组成型表达导致真空数量显着增加。仍有待成立类黄酮类/花青素,调节剂的表达,或两者的积累是必要的,并且足以引发新的真空室的生物发生。在真空中,花青素在类似于真空花青素的红色球体中积聚在玉米细胞中[27].虽然我们尚未明确地确定BMS中是否存在的花青素夹杂物35 s:: R + 35 s:: C1细胞是膜结合的,它们具有非常相似的特性,其具有在BMS细胞的泡沫中存在的最近描述的黄色自动荧光体(YFB),通过3-脱氧黄酮类化合物的P1调节剂的表达诱导[30.].
组织在BMS中存在的花青素夹杂物35 s:: R + 35 s:: C1细胞在有光的情况下发生剧烈的变化。这些改变包括减少它们的数量和扩大它们的尺寸(图。6.).此外,光处理液泡常表现为花青素在液泡腔内的扩散,这可能是由病毒样结构释放的结果。观察到BMS液泡形态的变化35 s:: R + 35 s:: C1细胞不是培养细胞的“好奇物”。我们发现,在光诱导下,玉米花组织的液泡结构也发生了类似的变化,积累了大量的花青素。8.那9.).延时实验(见额外的文件1:电影1)说明了管状和球状花青素的填充结构的形成和融合,最终结合的聚结剂,以给予色素玉米细胞的一个或多个大型中心液泡。这些管状囊泡结构,其中一些填充有透明囊泡,请让人想起在真空中发现的管状氟酚的观察大戟根细胞(8.那31].这些结构的解剖学特征仍有待确定,但类似于报道的大戟根细胞,来自较小的含有较大的花青素的真空吸收的血液的发生是使真空融合和/或自噬的中生。
这些光诱导的含花青素结构的形态变化可能与观察到的颜色变化直接相关,如果不是相关的话。然而,液泡pH值的改变或花青素与辅助色素的关联也会导致花青素色素沉着的色调变化[13那14].为了研究光是否诱导BMS细胞的真空pH的变化,我们利用BCECF-AM荧光染料,其可以校准490nm / 440nm的双激发波长的荧光发射比率。可以校准体内生成的pH曲线[32].使用这种方法,我们确立了黑暗和光生长的BMS细胞的液泡在pH5.8处是酸性的,并且没有显着的pH差异(见额外的文件2: 图。1).类似地,pH测量BMS或BMS的粗匀浆35 s:: R + 35 s:: C1在水中生长的细胞之间以及在光照和黑暗条件下生长的细胞之间没有显著的pH值差异(数据未显示)。虽然不太可能,基于λ的缺乏移位马克斯颜料(图。3 A, B),我们还调查了光线是否参与了可以作为共色性的植物化学物质的诱导,因此有助于颜色变化。反相HPLC分析在黑暗和光生长的BMS和BMS中表现出酚类化合物的峰谱没有显着差异35 s:: R + 35 s:: C1细胞(未示出)。
虽然这些结果不排除局部和/或瞬时光诱导的pH变化或诱导负责颜色移位的次要共色素的可能性,但是一种可能的解释是真空形态的改变是原因光诱导含花青素细胞的变暗现象。先前针对红甘蓝的花青素形成了类似的光诱导的效果,该观察结果归因于光的增强的花青素积累[9.].然而,我们的结果提供了替代解释,即光本身可以影响液泡内花青素的包装和分布,独立于花青素水平的变化。同样,“蓝色”玫瑰品种的花朵表现出由年龄诱导的颜色的变化,从红紫色到蓝紫色,这种变化与花青素的逐渐积累进入AVI样结构的逐渐积累相关[29].桔梗花还表现出花青素的包装与AVIS的包装之间的相关性,在花瓣底部存在“黑紫色”色素沉着,以及与该区域的更轻的紫色有关的AVIS的减少或不存在[11].因此,可以观察到的光生物BMS色调的改变35 s:: R + 35 s:: C1在液泡内花青素的包装以及色素沉着上,细胞反映了更为普遍的光机制。如果是,BMS35 s:: R + 35 s:: C1由于可获得的分子和细胞工具,细胞提供了一种用于解剖该过程的机制的方便系统。
结论
本文的研究结果表明,光影响花青素色素沉着的机制超出了基因编码途径酶的转录调节。在玉米花器官和培养细胞中,光诱导花青素的堆积和液泡和亚液泡室的分布发生戏剧性的形态变化。以前也观察到过类似的现象,但由于花青素的分离与包装上的形态变化有关,因此无法得出确切的因果关系。
方法
BMS细胞的生长、维持和处理
BMS细胞在先前描述的条件下保持[33].简单地说,BMS细胞每7天在含有2,4,d (0.5 g/L), 3%蔗糖(BMS培养基)的MS液体培养基中进行传代,在25±2℃的黑暗环境下,旋转摇床(150 rpm)上进行传代。在暗光处理中,悬浮培养的细胞被镀在滤纸上,滤纸上覆盖着含有0.3%植酸酯的BMS固体培养基,并在25±2°C的黑暗中培养20天。移至完全黑暗(用铝箔覆盖)或50±5 μmol.m光照-2.S.-1(冷白。215W, F96T12/CW/VHO, Sylvania, Canada)。
瞬态表达实验
将BMS悬浮细胞(3 g细胞置于25 ml BMS培养基中)在BMS培养基中用1.7% PEG处理过夜。1 ml细胞覆盖在培养皿中预先浸泡过的滤纸上。10微克35S::R+35S::C1质粒(pPHP687 in [27])根据制造商的建议(Bio-Rad Laboratories,Inc.,USA)涂覆在金微粒上。使用1,100psi的生物化PDS-1000 / HE粒子(Bio-Rad Laboratories,Inc. USA)轰击涂覆的金颗粒被轰击到PEG处理的BMS细胞中。将板保持在黑暗(用箔覆盖)中或暴露于光照的时间为24小时,之后分析细胞进行显微镜。
反射态分析
在活的有机体内用MINOLTA CR-300反射计/色度计(日本Minolta)采取反射措施。颜色表示为CIEL * A * B *值(用于CIE D65 / 10°光源/观察者条件)。L *值表示亮度水平,范围为100(白色)到0(黑色),A *(+红色; - 一个绿色)和B *(+ B黄色; -B蓝色)。该仪器被标准化为随着仪器提供的标准白色瓦片,然后在培养板上的固体BMS介质上生长的细胞分析之前提供。
花青素颜料的提取与分析
BMS.35 s:: R + 35 s:: C1或对照BMS细胞在光或暗处理后冻干36小时。花青素和其他酚类物质在50%甲醇中以50 μg干组织/ μl甲醇的比例提取过夜。甲醇提取物用1%盐酸稀释50%甲醇,用Cary 50紫外-可见分光光度计(Varian, Inc.)在400 - 700 nm范围内收集吸收光谱,间隔5 nm, 0.5 s。美国)。使用Cary WinUV软件生成图形。在530 nm处用分光光度法测定花色苷。通过加入等体积的2 M HCL (37% v/v)水解甲醇提取物,在沸水浴中加热20分钟,得到相应花色苷。水解样品用异戊醇提取。采用HCL/甲酸/H在纤维素板(5730/7,EM Science, Germany)上薄层色谱(TLC)分离花青素2O, 3:30:10, v/v为流动相。未水解和水解样品甲醇提取物20 μL注入Waters Alliance®如上所述,2695分离模块(Waters Corporation,Milford,MA)[34].采用Waters 2996光电二极管阵列检测器在280 nm处获得HPLC图谱,并使用Empower软件(Waters Corporation, Milford, MA)进行分析。
RNA的提取和分析
暗培养和光照培养的BMS细胞在液氮中均质,按照制造商(Invitrogen, Life Technologies, USA)的建议,使用TRIzol试剂提取总RNA。对于Northern分析,25 μg总RNA在含有1%甲醛的琼脂糖凝胶上分离,并印迹于硝酸纤维素膜上(Bio-Rad Laboratories, Inc., USA)。与相应的cDNA探针杂交C2.[35],f3h[36] 和a1[37].泛素(38]作为标准化控制。杂交信号在BioRad磷酸化成像仪(BioRad Laboratories, Inc., USA)上进行比较,并比较暗生长和光生长愈伤组织杂交信号与泛素归一化对照的比值。
植物材料
玉米内核C2-IDF.遗传股票418D C2-IDF1(Active-1);A1 A2 C1 R1和毕格219年,我B1-I;A1 A2 C1 C2 PLL-RHOODES RL-R,219J B1-I;A1 A2 C1 C2 PL1-Rhoades R1-G是从玉米Cop获得的http://w3.aces.uiuc.edu/maize-coop/.在夏季田间播种,开花期前采集雄性穗状花序,观察外稃或外稃的液泡结构。
显微镜分析和真空染色
用尼康COOLPIX 5700相机拍摄了玉米花轮和愈伤组织细胞的数字图像。采用日本奥林巴斯SZH10立体显微镜对瞬态实验的宏观图像进行可视化,采用奥林巴斯DP10数码相机进行图像采集。在尼康Eclipse E600显微镜下观察明暗生长的BMS细胞。使用SPOT、RT-Slider数码相机拍摄差分干涉对比(DIC)照片,并使用SPOT成像软件(Diagnostic Instruments, Inc., USA)进行分析。DIC延时图像每4秒拍摄一次,持续2小时,并使用SPOT成像软件转换成电影。为获得液泡染色,转化和对照BMS细胞用10 μM BCECF-AM (Molecular Probes, USA)在BMS培养基中室温孵育40分钟。细胞被纺丝,洗涤两次,在BMS培养基中重新悬浮。激光扫描共聚焦显微镜与PCM 2000/尼康Eclipse600系统(尼康生物科学共聚焦系统,NY)使用尼康Plan Fluor 40X/0.75空气物镜(1像素= 0.3 μm)捕捉BCECF染色细胞的数字化图像,如所述[39.].氩激光的488nm激发波长与515/30nm带通发射过滤器(EM515 / 30HQ)结合使用。使用SimplePCI软件(Chpix Imaging Systems,PA)捕获图像,并使用Adobe Photoshop(Adobe Systems,Caper View,CA)组装。
pH值测量
在光线下以0lg / ml(新鲜重量/体积/体积)的浓度为35mM培养皿(6mL)在35mm的培养皿中生长6天(50μmol.mm-2.S.-1)和暗(覆盖箔)以100 rpm。过滤细胞,称重并以0.1g / ml的浓度重悬浮。如上所述,用10μMBCECF-AM加载一毫升细胞。将一百μl的装载和洗涤的细胞移液到96孔微量滴定板中。一个原位分别对暗培养和光照培养的BMS细胞的每个重复分别生成校准曲线。100 μl 0.1 M的各种pH缓冲液,范围为5.0 - 7.0,含0.005%洋地黄苷[40添加到100μl细胞中,并孵育10分钟。使用Flex Station™和数据分析程序Softmax Pro 4.3(Molecular Devices,CA),在440nm和490nm处,在440nm和490nm的激发下以535nm和490nm测量荧光发射。490/440的排放比用于计算pH,其中消除了不平等负载的不规则性。这些测量一式三份进行。
参考文献
- 1.
Gould KS:大自然的瑞士军刀:花青素在叶子中的多种保护作用。生物工程学报,2004,34(4):417 - 418。
- 2.
花青素在植物胁迫反应中的环境意义。光化学与光化学。1999,70:1-9。
- 3.
Mol J,Grotewold E,Koes R:基因如何绘制花和种子。趋势植物SCI。1998年,3:212-217。
- 4。
Winkel-Shirley B:黄酮类生物合成。遗传学,生物化学,细胞生物学和生物技术的彩色模型。植物理性。2001,126:485-493。
- 5。
作为酶复合物的代谢途径:膜结合酶复合物合成苯丙素和黄酮类化合物的证据。生物化学学报,2003,31(4):457 - 461。
- 6。
苯丙酸和类黄酮通路中酶复合物的证据。植物营养学报。1999,19(4):457 - 461。
- 7。
在细胞内和细胞外移动化学物质的挑战:洞察植物天然产物的运输。植物学报。2004,29(6):926 - 929。
- 8。
Marty F:植物真空。植物细胞。1999,11:587-599。
- 9。
Pecket Cr,小CJ:花青素的发生,位置和开发。植物化学。1980,19:2571-2576。
- 10.
利用分离原生质体和液泡研究花青素质体的胞内位置。植物营养与肥料学报,1998,21(4):457 - 461。
- 11.
Markham KR, Gould KS, Winefield CS, Mitchell KA, Bloor SJ, Boase MR:花青素液泡包体-它们在花着色中的性质和意义。植物化学学报。2000,55:327-36。
- 12.
Conn S,张W,Franco C:花氰酸阳性夹杂物(AVIS)选择性地结合酰化的花青素Vita Vinifera.L.(葡萄)悬浮培养。Biotech LTRS。2003,25:835-839。
- 13.
Forkmann G:黄酮类化合物作为花卉颜料:基因工程形成自然光谱及其延伸。植物育种。1991,106:1-26。
- 14。
Markham Kr,Ofman Dj:Lisianthus flavonoid颜料和影响他们在花色中表达的因素。植物化学。1993年,34:679-85。
- 15.
Noda K-I, Glover BJ, Linstead P, Martin C:花的颜色强度取决于由myb相关转录因子控制的特殊细胞形状。自然。1994,369:661-664。
- 16。
Kondo T,Yoshida K,Nakagawa A,Kawai T,Tamura H,Goto T:来自花瓣的蓝色发育的结构基础Commelina普通的.自然科学。1992,358:515-518。
- 17。
Yoshida K,Kondo T,Okazaki Y,Katou K:蓝色花瓣的原因。自然。1995年,373:291。
- 18。
Fukada-Tanaka S, Inagaki Y, Yamaguchi T, Saito N, lida S:蓝色花瓣中的增色蛋白质。自然。2000,407:581。
- 19。
黄志强,黄志强,黄志强:花青素色素沉着的调控。植物化学学报,2003,38:59-78。
- 20.
Winkel-Shirley B:黄酮类化合物的生物合成和压力影响。CurrOp植物BIOL。2002,5:218-23。
- 21.
Harmer SL,Hogeresch JB,Straym M,Chang H-S,Han B,Zhu T,Wang X,Kreps Ja,Kay SA:核心途径的策划转录拟南芥昼夜时钟。科学。2000,290:2110-2113。
- 22.
Taylor LP,Briggs WR:玉米幼苗中的花青素积累的遗传调节和光电子。植物细胞。1990年,2:115-127。
- 23.
玉米籽粒色素调控基因的时空表达及其光依赖性。植物学报。1997,9:1547-1557。
- 24.
Petroni K, Cominlli E, connini G, Gusnaroli G, Gavazzi G, Tonelli C:玉米调控基因Hopi的发育表达决定了发芽依赖的花青素积累。遗传学报。2000,32(4):457 - 461。
- 25.
Piazza P, Procissi A, Jenkins GI, Tonelli C: c1/pl1调控基因家族的成员介导玉米糊粉和中胚轴对不同光质量和细胞分裂素的响应。植物生理学报。2002,32(4):591 - 598。
- 26。
玉米光诱导组织特异性调控基因Sn的遗传和分子分析。王志强。
- 27。
Grotewold E,Chamberlin M,Snook M,Siame B,Butler L,Swenson J,Maddock S,Clair GS,Bowen B:通过异位表达转录因子的异位表达来玉米细胞中的工程二次新陈代谢。植物细胞。1998,10:721-40。
- 28。
Dong X,Braun El,Grotewold E:植物次级代谢酶的功能保护互补拟南芥具有玉米基因的黄酮突变体。植物理性。2001,127:46-57。
- 29。
Gonnet JF: Cv颜色的起源。《蓝色玫瑰狂想曲》和其他一些所谓的“蓝色”玫瑰。中国农业科学。2003,31(4):491 - 498。
- 30.
林艳艳,陈志强,陈志强,等。植物化学物质在玉米细胞内的亚细胞转运。植物学报。2003,2003:10。
- 31.
Marty F:关于Gerl,Provacuoles和varoSematic细胞中的细胞化学研究大戟.美国国家科学院学报。1978年,75:852 - 856。
- 32.
Swanson SJ,Jones RL:赤霉酸在大麦啤酒酮中诱导真空酸化。植物细胞。1996,8:2211-2221。
- 33.
作为功能基因组学工具的代谢物分析。植物功能基因组学:方法与方案。编辑:Grotewold E. Totowa, NJ: Humana出版社;2003:415 - 425。
- 34.
利用转录因子调控玉米培养细胞中酚类物质的积累。生物化学学报,2003,14:207-216。
- 35.
Wienand U,Weydemann U,Niesbach-Klîsgenu,Peterson P,Saedler H:分子克隆C2.轨迹Zea Mays.,对Chalcone合酶的基因编码。Mol Gen Genet。1986,203:202-207。
- 36.
Deboo GB, Albertsen MC, Taylor LP:黄酮3-羟化酶转录本和黄酮醇积累在玉米花药中是暂时协调的。植物学报1995,7:703-713。
- 37.
Schwarz-Sommer Z,Shepherd N,Tacke E,Gierl A,Rohde W,Leclercq L,Mattes M,Berndtgen R,Peterson Pa,Saedler H:转换元件对结构和功能的影响A1基因Zea Mays..Embo J. 1987,6:287-294。
- 38。
玉米多聚泛素基因:结构、表达和转录本剪接的热干扰,以及电穿孔转移到原生质体后的启动子活性。植物生态学报,1998,18(4):489 - 494。
- 39。
Rose A,Meier I:植物独有的域名是植物植物的责任,它负责其对植物核轮辋的目标。美国国家科学院学报。2001,98:15377-82。
- 40。
MOSEYKO N,FELDMAN LJ:拟南芥PH敏感绿色荧光蛋白的表达。植物细胞环境。2001,24:557-63。
致谢
作者感谢史蒂文·施瓦兹的援助与反射计实验,表丁和JC张成泽为援助使用显微镜,迈克朱板的使用读者,Annkatrin玫瑰和阿苏卡Itaya批判阅读的手稿,j . Marcela埃尔南德斯的原始观察光线昏暗的细胞,俄勒冈州立大学植物微生物基因组学基金支持代谢组学实验室的建立。这项研究得到了美国国家科学基金会(MCB-0139962)对EG的资助。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
NGI进行了描述的所有分子和细胞实验。例如,构思了该项目并参与了该研究的设计和协调。
电子补充材料
查看产品说明:
附加文件1:来自玉米引理的延时DIC图像b我Pl植物over-accumulating花青素。每四秒钟拍摄一次照片。延时系列以每秒一帧的速度转换成电影,因此实时速度加快了4倍。最后四幅图像如图所示。10(C, D和E)来自这个延时系列。注意管状结构中清晰的圆形内含物和末端的大液泡。有关详细描述,请参阅结果部分。查看产品说明:影片可以可视化使用Quicktime播放器或Windows Media player。插件可以从网站下载http://www.apple.com/quicktime/downlond(QuickTime播放器)或http://windowsmedia.com/download/download.asp球员)。电影大小约为2mb,因此,通过下载电影到您的硬盘驱动器更有效地查看。(MOV 2 MB)
使用BCECF-am测量真空pH。
附加文件2:图1.原位使用BCECF-am测量真空pH。将等量(0.01 g/100 μl fresh wt) BCECF AM负载细胞置于微量滴定板中,在535 nm、440 nm和490 nm激发波长下测量发射(A)。计算490/440比值(B)原位校准曲线对于每个黑暗和光样的单独生成,具有各种pH缓冲液,其中0.005%的Digitonin(C)。黑暗和光生长的BMS细胞的液泡在pH5.8处是酸性的,并且没有显着的pH差异(d)。(PPT 136 KB)
作者的原始提交的图像文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
光诱导玉米细胞花青素积累液泡的形态学改变。BMC植物BIOL.5,7(2005)。https://doi.org/10.1186/1471-2229-5-7
收到了:
公认:
发表:
关键字
- 花青素颜料
- 花青素色素沉着
- 玉米细胞
- 真空舱
- 花青素生物合成基因