摘要
背景
Gal4增强子诱捕系统驱动LacZ和GFP报告基因的表达已经在果蝇中得到了广泛应用。然而,在拟南芥中Gal4增强子诱捕系统尚未在原始文献中被描述。在果蝇中,报道者拥有Gal4上游激活序列(UAS)为5重复序列(5XUAS),从组织特异性增强子中表达Gal4的细胞系也被用于任何转基因的异位表达(由5XUAS驱动)。虽然在拟南芥中已经证实了Gal4的反式激活,但由于缺乏详细的分析,陷阱的广泛使用尚未出现,这正是本研究的目的。
结果
本研究的一个关键特点是使用荧光素酶(LUC)作为主要报告基因,rsGFP-GUS作为次要报告基因。搭载5XUAS的记者比搭载1X或2X无人机的记者更适合拟南芥。一个5XUAS-LUC报告基因在由完全增强的35S启动子驱动的Gal4转化的拟南芥株系中高水平表达。相反,Gal4的上游至少有35S(包含TATA区域)作为增强剂陷阱系统。荧光素酶在T1、T2和T3代trap细胞株中的表达基本稳定,但在T4代,约25%的细胞株明显沉默。在含有5-aza-2'-脱氧胞苷的培养基上生长的植物可以逆转这种沉默。Gal4和LUC mRNA的多重定量RT-PCR表明,这种沉默可能发生在Gal4或LUC转录水平。1万事件库的生产和筛选观察,以及Gal4驱动系统在其他植物物种的潜力进行了讨论。
结论
这里所描述的Gal4的陷阱系统采用5XUAS-LUC和5XUAS rsGFP-GUS的记者,并允许在Planta.定量筛选,包括静音的快速监测。我们得出的结论是,大约75%的情况下,沉默是在Gal4转基因的转录水平上,并且是在一个可接受的频率,使拟南芥的Gal4诱捕系统有价值。该系统将有助于具体报告线和驱动线的隔离和全面表征。
背景
许多不同的方法在拟南芥蒂利亚纳发现并分析由组织特异性或环境条件调控的启动子[1- - - - - -4].这些包括使用报告基因GUS、GFP和最近的荧光素酶(LUC)[5,6来检测“被困”的DNA元素,从而赋予某种类型的调控。个体报告者和诱捕系统的确切类型(例如,基因融合与增强子)对于更经常被识别的表达元件的类型以及它们自身的优缺点都有各自的偏见,这些已在前面进行了综述[7- - - - - -9].在现有的技术方法中,在激活剂/上游激活序列(UAS)双部系统中,一个转录激活剂(因子)被用来捕获内源性增强子。用合适的上游UAS报告基因检测转录因子表达。该系统的优点是利用捕获系来随后驱动导入转基因的异位表达。利用激活因子Gal4的基因捕获增强因子,随后激活报告因子,如的lacZ(拥有一个Gal4 UAS),已经在酵母和果蝇中非常成功[10.].果蝇群落的结果是,在过去十年中出现了明确定义的果蝇诱捕线,显示出发育或组织特异性的Gal4表达[8,11.].这些句子通常可以用于记者的表达研究的lacZ或GFP,也作为驱动线异位表达被放置在Gal4的UAS [下游的任何感兴趣的基因12.].
增强子是DNA的调节元件,在可变距离内发挥作用,改变基因表达水平。增强子通常不足以表达基因,需要最小的启动子元件来启动转录。增强子元件在植物中提供了大量的空间、时间和环境调控的基因表达。拟南芥Gal4诱捕线能够快速定量分析基因表达水平,这将为了解基因表达的组织特异性和环境调节提供有价值的资源。作为开始,Haseloff描述了一种潜在的Gal4陷阱系统,该系统使用5XUAS GFP(没有红移,rs),一些拟南芥系在根中显示了表达([13., p 146-147 of ref. [14.]及引用的网站[15.])。本报告的目的是描述我们的陷阱库在拟南芥中gal4特异性表达的质粒、沉默特性和验证。为了开发一个理想的Gal4捕集系统,报告器应该是定量的,敏感的和稳定的世代。由于GFP半衰期较长,很少用作环境基因调控的报告基因,用GFP进行定量表达研究的可行性较低在Planta..基于荧光素酶半衰期短,以及其敏感性和筛选能力,我们使用荧光素酶作为本研究的主要报告基因[5,16.- - - - - -18.].
最近有报道称,在烟草中,Gal4系统表达不良(即沉默),因为胞嘧啶的高甲基化状态(28-32%)损害了Gal4与UAS的结合[19.].(果蝇和酵母DNA不甲基化)。GAL4结合位点(UA)通常含有GGCN11CCG,从晶体结构研究预测,甲基化将防止结合[20.,甲基化已被证明直接抑制结合[19.].在烟草中的研究雇用了9或10x的UA重复,作者表明,由于UA较少重复由于甲基化抑制由于GAL4结合的抑制可能较少,但这未测试。答:芥只具有5%的胞嘧啶甲基化[21.],但Gal4捕集系统在该生物体的特性尚未在原始文献中被记录。Guyer等人之前在拟南芥上的一项研究使用了带有完整35S启动子驱动Gal4的10XUAS-GUS报告基因[22.].这项研究表明反式活化是可行的,没有沉默或甲基化的问题。一个问题是,拟南芥(以及甲基化频率介于拟南芥和烟草之间的植物)是否可能成为开发Gal4诱捕系统进行调控或异位表达研究的候选人。本研究的主要目的是:1)使用5XUAS-LUC作为报告基因,并确定由完整的35S启动子驱动的Gal4是否与最低的35S启动子驱动的荧光素酶表达相比较具有组成性(从而起到诱捕作用);2)确定5XUAS在拟南芥中是否最优(与1X或2X UAS相比);3)测定荧光素酶诱捕系幼苗至幼苗及世代间的稳定性(即沉默率和沉默基础);4)建立一个诱捕文库,可筛选Gal4激活的LUC、GUS、rsGFP三种报告基因。
结果与讨论
T-DNA载体用于Gal4研究,使用5XUAS-LUC报告
构造来检查Gal4的激活器/ UAS系统中的拟南芥的可行性的增强子捕获载体图解图1A和1B.Gal4、LUC+ (pspLuc)和rsGFP-GUS基因上游序列如图所示1C.第一个载体,pRGK336,具有完整的35S启动子(e35S),包括35S增强子,直接位于Gal4 orf的上游。(该orf是Gal4 DNA结合域和VP16激活域的混合)。陷阱向量pRGK335只包含最小的35S TATA区域。这两个载体都具有直接位于Gal4启动子区域上游的T-DNA右边界(图)1C).这酒吧选择编码Basta抗性的基因以易于选择在土壤中生长的转基因植物。将Luc +基因插入最小35s和5×5×10(图1C).
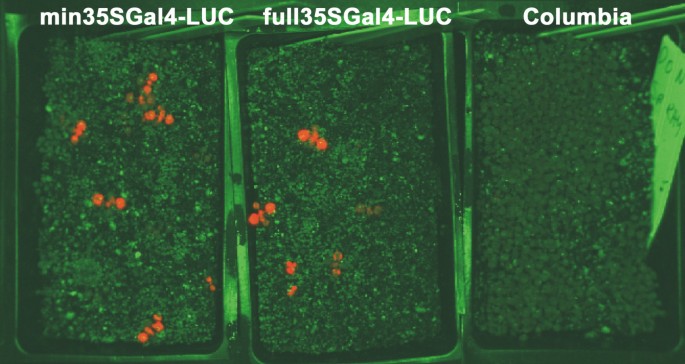
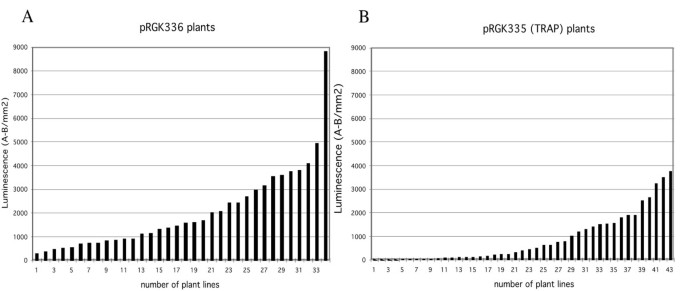
如果诱捕系统以Gal4依赖的方式发挥作用,那么预计带有e35S启动子驱动Gal4表达的载体(pRGK336)应该表现出更高的荧光素酶活性在Planta.比带有pRGK335(陷阱)的转化子要多。最初,大约300个转化植株的种子被播种,喷洒BASTA, 10天后喷洒荧光素并进行成像。无花果2显示荧光素酶活性的图像(如红色的光发射)从这些罐中。没有用Basta喷射的控制植物(即哥伦比亚)的锅。正如预期的那样,没有哥伦比亚植物表现出荧光素酶活性。用PRGK336转化的所有抗组榴植物显示出荧光素酶表达和大约一半的BASTA抗性PRGK335植物显示出在所示检测水平的荧光素酶表达。这验证了荧光素酶基因可以从两个载体中表达。将抗菌幼苗移植(来自Basta选择培养基)和14天以后测量荧光素酶活性在Planta..在每个秧苗相对水平显示在图3.,其中ZHON划分哥伦比亚控制(即NO LUCIFIRA酶)。在该实验中,对于PRGK336转化的植物,可以观察到34个(94%)中的32种(94%)作为表达式的数字化图像的表达器(如图1所示)2).剩下的两个仍然有显著的荧光素酶表达(200-300相对单位)。图中显示了用pRGK335(诱捕载体)转化的植物的剖面3..大约50%在数字化图像上观察到,活动超过200个相对单位。pRGK336的荧光素酶平均活性为2054个单位,pRGK335的荧光素酶平均活性为846个单位。因此,植物似乎依赖于荧光素酶表达的预期Gal4表达水平。综上所述,与pRGK335相比,pRGK336表达的荧光素酶和Gal4的表达量都更高,表明这种荧光素酶的活性依赖于Gal4的表达。
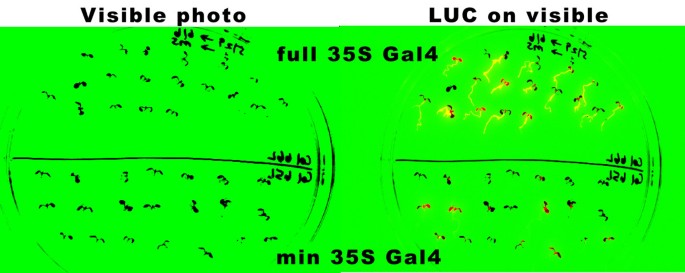
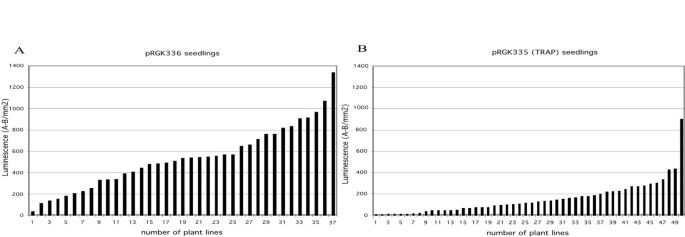
使用早期生长阶段的幼苗进行类似的实验,并且琼脂培养基用于在根和空中组织中检查荧光素酶活性。在选择含有MS培养基的琼脂平板后转移八天的幼苗,在含有50μmLuciferin,24小时后,对荧光素酶活性成像(图4).植物的可见图像以黑色显示在人工绿色的背景上(图4,左)和叠加的荧光素酶活性(图4,右),这样的红色或黄色表示LUC表达。除了PRGK336的两种幼苗均显示出根系和子叶中荧光素酶的表达。只有2种PRGK335植物中只有2种植物表达了根系中的表达,其中21个中的7种中的7种。组织特异性的可变性表明,“被困”增强子元件驱动Gal4在PRGK335植物中。从类似实验中的每个幼苗中的发光定量如图所示5.用PRGK336转化的植物中的平均荧光素酶活性为536个单位,并且用PRGK335为151个单位,再次显示含有由E35S启动子驱动的GAL4的植物中的表达更高。
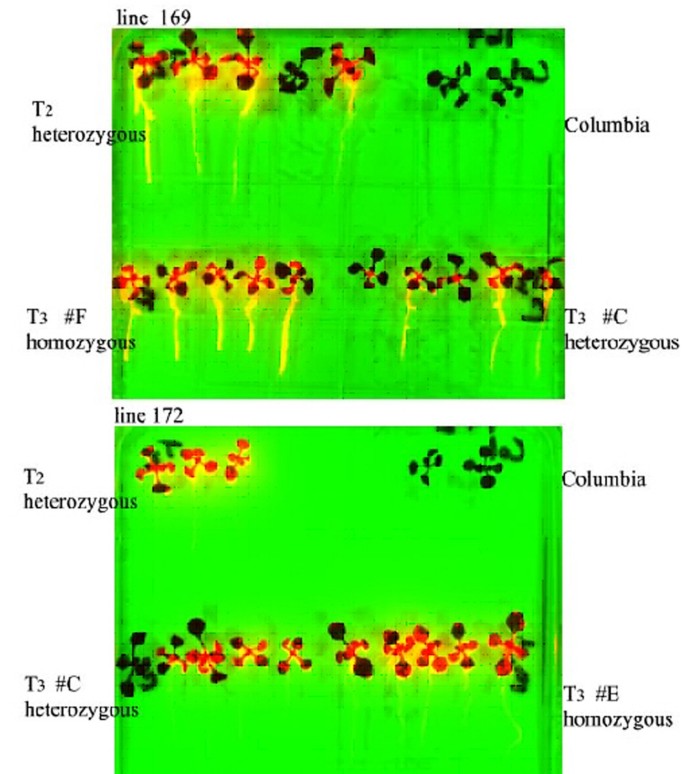
我们从陷阱线(用PRGK335)确定T2世代中Basta和Luc表达的遗传比率。在T2种子池中,在Basta选择的220幼苗(25%)中,55个中的55个,建议为3:1的整体遗传Basta选择,如果大多数转基因都处于单个基因座,则为预期。在没有选择的T2种子的池中,用1mm Luciferin喷涂时,100个幼苗中的52个幼苗的发光。还量化了在T3代所选系中的一个幼苗对另一个幼苗的变化。无花果6显示评估的两条线的例子。T2幼苗不在Basta选择(称为“T2杂合”幼苗)6)杂合,纯合的,或者由于偏析而没有Basta基因。如预期的那样,如果抗蛋白抗性损失,则荧光素酶活性也不存在(例如,见第169行,“T2杂合”幼苗)。纯合线对甘油磷酶水平和组织特异性的幼苗与幼苗产生一致的表达。这表明线可以保持为HOMOZYGOTES,并且期望在T3代中始终表达。
使用5XUASrsGFP-GUS二级报告基因,测试5X、2X或1X UAS重复是否在拟南芥中更好
通常,次要报告(或表型)可用于确认调节性或作为理解基因表达的额外工具。GFP和GUS记者在使用中有自己的优势作为记者,因此开发了一个系统,可能会适应所有三个记者(LUC,GFP,GUS)的使用,每个都是由GAL4激活的。GFP-GUS融合蛋白(ORF)用于这些研究(见下文)。此外,我们希望在拟南芥中确定1x,2x或5倍是否更好。约翰斯通和同事的报告[23.]的研究表明,在酵母中,改变UAS重复的数量可以影响“报告”对Gal4水平的敏感性。如上文所述[19.,由于甲基化沉默现象,在植物中减少UAS重复也可能是有利的。
将3个rsGFP-GUS载体(1X, 2X, 5X UAS)转化拟南芥,如图所示1B..这些是基于pCAMBIA1304,但是GFP被突变为红移GFP以获得更高的量子产率[24.].通过PCR诱变,将65位的丝氨酸转化为苏氨酸。指向的UAS区域(TATA来自min35S)上游克隆(见图中的序列)1C).用湿霉素对哥伦比亚植株进行转化筛选。接下来,我们将Gal4载体转化到不同的rsGFP-GUS转基因株系中,定性地确定哪些株系(1X、2X、5X UAS)表达更多的GFP和/或GUS。表格1在随机具有1X、2X或5X UAS和Gal4 T-DNA的转基因植株中,对它们的GUS活性进行了定性评估。正如预期的那样,不含Gal4的T-DNA的植物不表达GFP,而且绝大多数不表达GUS或低水平表达GUS。在22个株系中,13个株系以5XUAS rsGFP-GUS基因和完整的e35S驱动Gal4基因组合的GUS活性较高。其中一些细胞株也表现出GFP表达(见图)7对于高GUS和GFP表达者)的例子。1x和2x UAS系显示较弱的表达模式并且是因此不适合未来测定。我们选择了单个基因(5XUAS-rsGFP-GUS)线,命名为RGK1,即具有较高的GUS和GFP它失去了活动时,与GAL4(BASTA抗性)在下一代中分离出来。此5XUAS rsGFP-GUS报道纯合RGK1线被选择作为用于制造使用pRGK335陷阱向量库中的亲本菌株(见下面用于文库构建)。具有不同数量重复UAS的结果表明,在拟南芥中5XUAS是下所描述的实验方法是最佳的。此外,这些定性的数据与假设,Gal4的水平从5XUAS记者口述表达相一致。
占拟南芥的Gal4系统的沉默
为了确定Gal4转基因的沉默频率和特性,我们随机选择了在T2幼苗中表现出显著发光并在T2、T3和T4代幼苗中定量表达的pRGK336和pRGK335株系。对9个pRGK336和9个pRGK335株系的初步研究表明,从T2到T3代,LUC的表达没有出现重大下降(未显示),有的株系减少,有的株系增加,但通常不会超过2 - 3倍。
对pRGK335(捕集器)BASTA抗性品系T2、T3和T4代进行了研究,所有三代在同一平板上生长,并测定了荧光素酶活性(见表)2).同样,T2至T3的变化通常小于3倍。然而,当将T2到T4代比较时,一些线条显着沉默:5中的5个(28%)显示出超过18(22%)的Luc表达减少超过10倍(22%),显示出大于100倍T4代的表达(相对于T2)。遗传分析确定这些所选系列中的基因座数基于T2植物抗植物抗性/灵敏度比。大约25%的单个轨迹插入,50%有两个基因座,25%有两个以上的基因座。沉默和刀片数之间没有相关性。
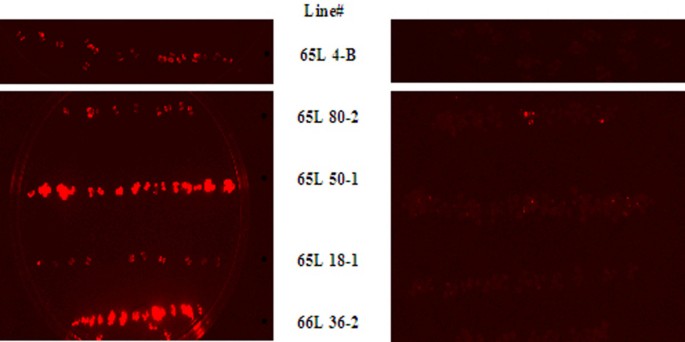
为了确定这种表达的急剧下降是否由于甲基化,每个沉默系T4代的幼苗在有或没有5-aza-2'-脱氧胞苷(AZA)的培养基中生长,5-aza-2'-脱氧胞苷(AZA)是一种DNA甲基转移酶抑制剂。静音pRGK336 (e35S驱动Gal4)线路也包括在本研究中。在每个品系中,当在7 ug/ml AZA培养基上生长时,每个幼苗都恢复LUC的表达(图8).荧光素酶活性的定量显示,恢复最高的表达是在pRGK336细胞株中,总体表达与T2代中观察到的LUC活性成正比(未显示)。这表明,恢复与细胞中预期的Gal4水平成正比,而沉默是由于甲基化,可能在5XUAS水平(见下一段)。
从T2到T4(或T3到T4)代,Gal4或5XUAS-LUC转录水平均出现沉默。为了研究这一点,在荧光素酶活性成像后,从选定的不同世代的幼苗中立即制备mRNA。采用多重Q-RT-PCR检测血清中Gal4和LUC mRNA水平。基于本构表达UBC-10检测mRNA水平。荧光素酶活性、Gal4 mRNA和LUC mRNA水平见表3..仅显示荧光素酶活性的轻微降低的控制线(169和213)也表现出Gal4和Luc mRNA的几乎变化。线65L-4B主要沉默,主要处于5×UAS LUC的水平,而线50-1,80-2和36在GAL4和5×5 uc转录的水平下静音。因此,观察到两类沉默(参见讨论)。
图书馆建设
使用单个轨迹纯合线RGK1(参考上述5xuasRSGFP-GUS),我们使用PRGK335(陷阱)向量产生了大约10,000个事件的库。上一节报告的数据表明,大约25%的沉默线条将主要沉默于5xuas luc);使用单个轨迹线作为收件人的潜在优点是在5×grgfp-gus中随后的几代沉默的可能性(例如[25.,26.].为了确保库中事件的统一表达,在BASTA选择之后,66株T1植物被移植到土壤平面上。每个单元都分别收获,种子储存在单独的信封里。将每个托盘上的等量重量的种子称重,并与其他8到9个托盘上的种子结合。如果植物死了,种子的数量也相应调整。已经生成了19个独立的T2种子池,每个种子池大约包含550个事件。通过对40种植物的荧光、GUS和GFP水平的比较,确定了GUS和GFP的存在与荧光素酶的高水平有关。例如,在21株大于1200 AU发光单位的植物中,有13株表达了GFP,而在小于1200 AU发光单位的植物中,没有一株表达了可检测到的GFP。目前正在筛选在后代中表现出组织特异性和稳定表达的细胞系。我们没有注意到转化后的植物有异常的特性(如发育不良或褪绿),这表明LUC、rsGFP、GUS、Gal4或酒吧在图书馆。
结论
基于拟南芥的激活体/ UA方法的可靠,可量化的增强器陷阱系统是本研究的主要目标。选择Gal4活化剂作为我们的系统的转发器。虽然果蝇的Gal4系统非常有用,但以前的烟草研究揭示了技术障碍,例如甲基化诱导的沉默。在烟草研究中,使用9或10×10xuAs驱动GUS表达,并且GAL4从完整的35s启动子表达[19.].使用该载体的烟草转基因在60个株系中仅显示了10个株系(17%)的GUS表达,与我们在这里观察到的大于94%的表达(使用pRGK336)有很大不同。此外,与这里显示的拟南芥不同,特定烟草转基因表达株系的GUS表达在幼苗间的变异性超过20倍。烟草的结果显示是不稳定的,因为UAS重复的甲基化,当然是该物种的高甲基化频率(32%)的分支[19.].虽然我们还没有比较10XUAS重复序列的结果,但5XUAS似乎比1X或2X UAS更适合在拟南芥中表达。我们已经证明,在拟南芥中,大约25%的株系在第4代时会发生甲基化沉默。另一方面,在我们的研究中,75%的细胞系通过T4代保留了表达(见下文)。此外,T3幼苗似乎保留了表达,这在许多应用中可能是充分的。
从我们的研究中提出的一般结论是生物体的甲基化状态越高,无论采用的UAS重复的数量如何,都将越少的Gal4型系统。最近的报告[27.表明“Gal4/VP16-UAS元件为水稻增强子诱捕提供了一个有用的系统”。这有点令人惊讶,因为大米大约有19%的甲基化[21.,28.].Wu等人使用6XUAS-GUS报告基因,在最初的转化代(称为T0)中GUS的表达频率令人印象深刻(超过70%的转基因株系)[27.].T1代植株的表达水平和组织特异性与T0相似,表明甲基化对植株的影响不大。T1之后的代均未进行评估。作者认为,在其他一些技术差异中,使用6XUAS而不是10XUAS,可能可以解释与烟草相比,水稻的甲基化问题较少[19.].后代在水稻系统中可能开始显示沉默性质。由于不同一想的甲基化,不同的物种也可能表现出沉默效应,并且当然纸张的拷贝数将影响沉默性质。基于其烟草的结果,摩尔及同事均开发了一种不同的UAS二分体系,其中改性的Lac压缩机DNA结合结构域与GAL4活化域(称为LHG4)组合[29.].这在烟草中至少证明了技术上可行,最近,这已被应用于拟南芥以异常驱动所选基因的表达[30.].在本例中,驱动系从克隆的启动子元件中表达LhG4。使用乙醇响应AlcR激活剂的二部分系统阿尔卡最近有关于反式激活启动子的报道[31.,32.].该系统需要外源乙醇,并且还与促进ALCR表达的组织特异性启动子结合。如上所述,这种“乙醇开关”提供了某些优点31.,32.],并将对司机行研究其独特的应用程序。我们在使用比较常见的Gal4的随机捕捉从我们的研究结果得出结论:VP16结果在25%沉默由T4代,但是,许多这种沉默可能是在GAL4的水平:VP16转基因表达(表3.).这表明,在拟南芥中,任何T-DNA传递的诱捕文库(包括LhG4和AlcR)都会导致一些沉默,5XUAS的甲基化不是主要缺陷。
方法
质粒构建
图中所示的三种质粒的完整DNA序列1A和1B.已存入Gen Bank。Genbank登录号是AY739897(PRGK335);AY739898(PRGK336);AY739899(PRGK337)。
GFP-GUS载体
GFP-GUS融合载体基于pCambia 1304,其有一个工程的融合GFP-GUS orf(图)1B.).GFP改为红移GFP以增强检测[24.].的PCR产物用寡核苷酸引物rsGFP-F(由5'CTGTTCCATGGCCAACACTTGTCACTACTTTC一个CTTATGGTGTT)和rsGFP反向(5'AACGATCGGGG AAATTCGAG)。以粗体和下划线的A被从T变化为A至丝氨酸改变为苏氨酸。两者的pCAMBIA 1304和PCR产物用NcoI和BstEII的消化和连接,得到p1304-R-20。
使用寡核苷酸引物Uascp7F1(5'TAT)制备含有5X UAS,M35S和ER信号的PCR产物(5'TATGGTACC.GATTACGCCAAGCTTGCATG)和5XUAS/ER-REV (' TTGGCCATGGAacaggtagttt)与PBINMGAL4-VP16 + USAMGFP5-ER(剑桥大学J. Haseloff提供提供的,请参阅网站[33.]作为模板。kpni和ncoi网站以粗体。用KPNI和NCOI消化P1304-R-20以除去LacZα和全35s启动子。用KPNI和NCOI消化PCR产物并将其连接到P1304-R-20。使用5×5×5的新质粒被指定为PRGK337。
为了构建含有2XUAS和1XUAS序列的rsGFP-GUS衍生物,我们利用了5XUAS结构的一些自然的、自发的缺失。它们包含一个1XUAS或2XUAS,序列如图所示1C.对于2XUAS,我们使用了与pRGK337相同的左右寡核苷酸引物。PCR产物和p1304-r-20均用KpnI和nco酶切并连接。对于1XUAS版本,以上述Gal4载体中的自然缺失作为模板。引物5XUAS/ER-FWD(5’caata .GGTACC.tgaacgcgtcggagtactg)和5xuas / er-rev(5'ttggCCATGGAACAGGTAGTTT)。NcoI和KpnI站点用粗体表示。PCR产物和p1304-r-20均用KpnI和nco酶切并连接。
Gal4,吕克·向量
使用PMON51850作为核心载体(含有细菌SPC / STR抗性的基因)构建PRGK336和PRGK335质粒,如图所示1A.pRGK336和pRGK335的结构相同,只是分别插入了e35S和m35S。这些是在以下步骤中构建的,以插入指示的磁带(描述从图中定义的右边界开始1A):插入m35S和Gal4/VP16,以pBinMGal4-VP16+UASmgfp5-ER中含有m35S和Gal4VP16的PCR产物为模板,加入PmeI和BglII位点(序列如图所示)1C);将PmeI-BglII片段替换为完整的e35S启动子(pMON23449)构建pRGK336;从BglII到AvrII (NOS 3’utr末端)的重叠PCR,以Gal4/VP16 orf (pBinMGal4-VP16+UASmgfp5-ER为模板)和NOS 3’utr (pMON51850)组成盒;GAL4PME-S (GATCGTTTAAACCTTCGCAAGACCCTTCCTC) GAL4NOS-S (GACGAGTACGGTGGGTAGCCCGATCGTTCAAACATTTGGC) GAL4NOS-R (GCCAAATGTTTGAACGATCGGGCTACCCACCGTACTCGTC) NOS-AVRII (GATCCCTCGGGATCTAGTAACATAGATGAC)的重叠的PCR产物AvrII ('utr第3号)MluI网站形成的盒式酒吧基因(pCGN9978)和7 s UTR (pMON51728);35-AVRII (GATCCCTAQGGCTATCTGTCACTTCATC) BAR7S-S (cctgcccgtcaccgagattttgaccgtcctttctcttcaattttcaatgggcagg) BAR7S-R (CAAAATTGAAGACAAAGGACGGTCAAATCTCGGTGACGGGCAGG) 7S-MLU-R (GATCACGCGTTCAATATTGTGGCAGGAC)为5xuas - lu -tml区域,一个MluI-BamHI PCR产物(来自pRGK337)包含5XUAS区域;将中间质粒与Kpn1和BamH1进行剪切,插入LUC基因,将荧光素酶载体psp-luc+载体(Promega)与BglII和KpnI进行剪切并整合。为了只留下LUC区域,这些被EcoRI、KpnI和html UTR消化[34.,35.]的插入步骤如下:利用寡核苷酸引物TML F1(5’CGA)制作TML盒Gaattc.gggaggaaattacactgagg)和tml r1(5'cggcaggatattcaattgtaaattcc);ECORI位点处于粗体,而KPNI位点位于引物的上游[该盒子衍生自包含由TML(PCGN9978)形成的重叠PCR产物的质粒;UASTML-S(GATCACGCGTCGGAGTACTGTCCTCCG)GFPTML-S(CAACATGATGAGCTTTAACCCGGGTACCGAGCTC)GFPTML-R(GAGCTCGGTACCCGGGTTAAAGCTCATCATGTTTG)TMLSPE-R(GATCACTAGTTTTCAAATCCTTCAGATGG)和5Xtet区域(pMON33643)TETSPE-S(GATCACTAGTCGTTAACTGCAGCTGAG),其包含在所述指示的KpnI位点TETMFE-R(GATCCAATTGTAAATTCCTCTCCAAATGAAATGAAC)。通过EcoRI和KPNI消化了TML盒并连接形成PRGK335。
植物和生长条件,土壤
答:芥所有实验均采用生态型Columbia-0。土壤中的植物分别在长日照和短日照条件下生长。长日生长室在21°C下有16小时的光照(175 uE)。短昼室在19°C下有8小时的光照(175 uE)。种子结实后,植物被放置在温室中,辅以照明以加速干燥。土壤培养基为司各特发芽剂、司各特再土和蛭石#3 1:1:14 .4的混合。植物每周用Peters 15-16-17施肥一次。选择具有BASTA抗性的幼苗,在7天和14天喷洒1:20 00稀释的芬勒浓缩液。
琼脂植物生长条件
植物生长在MS盐和维生素,2%蔗糖随pH 5.7和0.7%琼脂。光照制度为16小时光照(100 UE)在22℃和在20℃的C 8小时黑暗。琼脂平板包裹在微孔外科胶带(3M)。选择在25微克/毫升,在29中的琼脂上使用的潮霉素植物微克/毫升或BASTA。BASTA(草铵膦)来自Sigma。尼龙网用于幼苗转移是从Sefar公司美国(目录号#06-300 / 34)。
植物转化
植物是通过根癌土壤杆菌用花浸渍法[36.].A. Tumefaciens.ABIwas用于pRGK336和pRGK335转换。A. Tumefaciens.GV3101用于所有其他转换。25 mL的小规模培养物在28°C的LB和选定的抗生素中过夜。将400 mL的大规模培养物与1.5 mL的过夜培养物接种,生长至OD600为1.3。细菌被纺丝并重悬在由5%蔗糖、1 mg/ml BAP和0.03% Silwet组成的浸渍溶液中,OD600为0.6。将植物浸泡在菌液中5分钟,轻轻沥干,侧身放置,覆盖24小时。
植株在含有0.7%琼脂的2%蔗糖的MS培养基上开始转化,根据植株背景选择是否进行选择。幼苗在14天后移栽到2 1/2英寸的花盆中,每盆4株。植株被移栽到一个短日生长室中,用圆顶覆盖1天,以帮助适应。4周后,植物被转移到长日照条件下;螺栓在下潜前修剪一次。长日处理1周后进行浸提转化,6 d后进行二次浸提。最后转化三周后,植物从长日生长室移到温室,以加快干燥过程。种子是在植物完全干燥时收获的。
GFP表达式
在Zeiss Stemi SV11显微镜下,使用500 nm GFP滤光片检测幼苗的GFP表达。图像是通过AxioCam相机和软件拍摄的。
GUS表达
如前所述,对幼苗进行β-葡醛酸酶活性染色[37.].将整个幼苗浸入1.5mm X-Gluc的溶液中,真空渗透2次,约1分钟,并在黑暗中在37℃下孵育过夜。在观察之前,通过乙醇:乙酸(3:1,v / v)饮用组织。X-Gluc溶液由1.5毫米X-Gluc,100毫米NaHPO组成4缓冲pH 7,0.5 mm k3.[Fe (CN)6],0.5毫米K.4[Fe (CN)62毫米EDTA。
荧光素酶的成像和定量
萤火虫D-Luciferin,钾盐(合成)来自Biosynth International。荧光素在1mm的植物上喷洒,或者在50或100μm下掺入培养基中。对于成像,使用来自Fujifilm的FUJI LAS-1000 PLUS CCD发光图像分析仪。定量整株植物,根部或其他组织中的荧光素酶活性(发光)使用科学实验室99-Image Gauge Ver。3.4软件(Fujifilm)。
T3和T4植物的选择
每个T2株系种植6株,采集T3种子。这样,每株有6个单独的T3种子库。对T3种子进行BASTA抗性测定,并让纯合子系结实籽(T4种子)。这些株系用于表中的代研究2.
RNA分离、cDNA合成及多路实时定量PCR
种子在MS培养基和生长3周进行BASTA选择。被测定每个植物品系两代中生长在同一板上。接着,将植株用1mM荧光素喷洒并在富士CCD照相机成像和荧光素酶活性进行定量。组织从整个植株中采收并根据制造商的说明书(目录号#74903)RNA用Qiagen的RNeasy植物试剂盒提取。将RNA用Invitrogen公司安培级的DNase-I根据制造商的说明书(目录号#18068-015)处理。第一链cDNA合成在2微克该RNA为使用Invitrogen的SuperScript III逆转录酶(目录号#18080)各样品的情况下进行。将cDNA稀释4倍,并在随后的Q-RT-PCR实验中使用。对于Q-RT-PCR实验,光在扩展(LUX)引物由Invitrogen公司的在线LUX Designer软件设计和序列及荧光体名称如下:
Gal4 Forward: CACTTGCCGCCTCAAGAAGCTCAAG [FAM] G
Gal4相反:AGAGTAGCGACACTCCCAGTTGTT
荧光素酶Forward: CACCGCTCTTCAATTCTTTATGCCGG [FAM
Luciferase反向:TGCGAAATGCCCATACTGTTG
UBC-10 Forward:cactgcctcgacatttgaaggagcag [joe] g
UBC-10反向:GCTATCTCGGGCACCAAAGG
FAM = 6-carboxy-fluorescein
JOE = 6-羧基-4',5'-二氯-2',7'-二甲基氧荧光素
用Sigma JumpStart进行反应TaqReadyMix定量PCR(目录# D7440)根据制造商的说明,除了使用最终浓度为4.5 mM氯化镁外2为Gal4基因和6.5 mM MgCl2荧光素酶基因。在造父变星智能自行车系统上,骑车的条件包括94°C 120秒,接着是50个94°C 15秒,65°C 30秒和72°C 30秒的循环。除了Gal4或荧光素酶引物对外,每个PCR反应都包含Ubc-10基因的引物对作为内部控制。对于每个cdna样本,反应进行3个重复。对于每个PCR管,相对于UBC-10基因Ct计算样本基因(Gal4或荧光素酶)的ÄCt,然后计算ÄCt。S在三组中取平均值。首先确定样本间ÄÄCt值,然后使用Fold Change = 2的公式计算样本间基因表达的Fold差异(ΔΔct).
材料分配
本研究中描述的所有新材料均可用于非商业研究目的。RGK联系:Kranz@biology.wustl.edu
参考
- 1。
王志强,王志强,王志强:基于基因诱捕技术的拟南芥基因标记研究。中国科学(d辑:地球科学),1997,19(4):593 - 598。10.1073 / pnas.94.23.12722。
- 2。
杨玉梅,杨玉梅,杨玉梅,杨玉梅,杨玉梅。拟南芥增强子诱捕系的产生及其在花序中的表达模式。植物学报,1999,17:699-707。10.1046 / j.1365 - 313 x.1999.00409.x。
- 3.
何永强,唐伟,王志强,王志强,甘志强:利用拟南芥增强子诱捕系构建衰老调控通路。植物生理学报。2001,27(6):716 - 724。10.1104 / pp.126.2.707。
- 4.
Klimyuk VI,Nussaume L,哈里森K,琼斯JD:以下在拟南芥中的增强子陷阱Ds的元件的换位新型GUS表达模式。Mol Gen Genet。1995年,249:357-365。10.1007 / BF00287097。
- 5.
Yamamoto YY,Tsuhara Y,Gohda k,Suzuki K,Matsui M:用萤火虫荧光素酶记者拟南芥基因组的基因诱捕。工厂J. 2003,35:273-283。10.1046 / J.1365-313x.2003.01797.x。
- 6.
Eckardt NA: Luc基因筛选阐明应激反应基因调控。植物学报。2001,13:1969-1972。10.1105 / tpc.13.9.1969。
- 7.
Stewart CNJ:转基因植物中绿色荧光蛋白的效用。植物细胞批准。2001,20:376-382。10.1007 / S002990100346。
- 8.
Bellen HJ:十年的增强剂检测:苍蝇的教训。acta botanica sinica(云南植物学报). 1999,11:2271-2281。10.1105 / tpc.11.12.2271。
- 9.
罗佳斯- pierce M,施普林格PS:基因和增强子陷阱的发现。方法:中国生物医学工程学报,2003,21(4):427 - 434。
- 10.
Brand AH, Perrimon N:靶向基因表达作为改变细胞命运和产生显性表型的一种手段。发展。1993,118:401-415。
- 11.
达菲·杰比:《果蝇》中的GAL4系统:苍蝇遗传学家的瑞士军刀。《创世纪》2002,34:1-15。10.1002 / gene.10150。
- 12.
菲尔普斯CB,品牌AH:使用Gal4系统果蝇中的异位基因表达。方法。1998,14:367-379。10.1006 / meth.1998.0592。
- 13。
拟南芥根对干旱、盐和寒冷的细胞类型特异性钙响应。植物学报,2000,23:267-278。10.1046 / j.1365 - 313 x.2000.00786.x。
- 14。
Haseloff J:用于活细胞多光谱成像的GFP变异。细胞生物学方法。编辑:Sullivan KF和KAy SA。1999年,58:139 - 151。
- 15.
Haseloff J:英国剑桥分子生物学MRC实验室。[http://www.mrc-lmb.cam.ac.uk].
- 16.
Millar AJ,Short SR,Chua NH,Kay SA:一种基于转基因植物中萤火虫荧光素酶表达的新型昼夜节律表型。植物细胞。1992年,4:1075-1087。10.1105 / TPC.4.9.1075。
- 17.
Chinnusamy V,Stevenson B,Lee BH,Zhu JK:通过生物发光成像筛选基因调节突变体。sci stke。2002年,2002年:PL10。
- 18.
Brandizzi F,Fricker M,Hawes C:一个更环保的世界:植物生物体的革命。NAT Rev Mol Cell Biol。2002,3:520-530。10.1038 / nrm861。
- 19.
Galweiler L, Conlan RS, Mader P, Palme K, Moore I:技术进展:植物染色质中gal4结合位点的甲基化抑制了gal4的dna结合活性。植物学报,2000,23:143-157。10.1046 / j.1365 - 313 x.2000.00805.x。
- 20.
Marmorstein R,Carey M,Ptashne M,Harrish Sc:通过Gal4的DNA识别:蛋白质-DNA复合物的结构。自然。1992,356:408-414。10.1038 / 356408A0。
- 21.
关键词:番茄,核DNA,胞嘧啶甲基化,基因工程abstract:植物生态学报,1998,16(4):593 - 598。10.1007 / BF00015069。
- 22.
Guyer D, Tuttle A, Rouse S, Volrath S, Johnson M, Potter S, Gorlach J, Goff S, Crossland L, Ward E:利用杂交转录因子激活拟南芥潜在转基因基因。中国生物医学工程学报。
- 23。
徐鹤,柯德克T,Johnston SA:单个Gal4二聚体可以在生理条件下最大程度地激活转录。Proc Natl Acad Sci U S A. 1995,92:7677-7680。
- 24。
庞绍忠,DeBoer DL, Wan Y, Ye G, Layton JG, Neher MK, Armstrong CL, Fry JE, Hinchee MA, Fromm ME:一个改良的绿色荧光蛋白基因在植物中的重要标记。植物生理学报。1996,32(6):691 - 698。10.1104 / pp.112.3.893。
- 25。
Flavell RB:由于特定序列复制而导致植物中基因表达的灭活。Proc Natl Acad Sci U S A. 1994,91:3490-3496。
- 26。
Chalfun-junior A,MES JJ,Mlynarova L,AARTS MG,Angenent GC:拟南芥中T-DNA的激活标记的低频与CAMV 35S增强子序列的甲基化相关。费用。2003,555:459-463。10.1016 / s0014-5793(03)01300-0。
- 27.
吴超,李旭,袁伟,陈刚,Kilian A,李军,徐超,周德兴,王胜,张强:水稻基因组功能分析的增强型诱捕系的建立。植物学报,2003,35:418-427。10.1046 / j.1365 - 313 x.2003.01808.x。
- 28.
Ashikawa I:在水稻品种基因组中测量5'-CCGG的CpG甲基化。植物mol biol。2001,45:31-39。10.1023 /答:1006457321781。
- 29.
摩尔I,Galweiler L,Grosskopf d,谢尔Ĵ,帕尔梅K:用于转基因植物中调节基因表达的转录激活系统。国家科学院院刊美A. 1998年,95:376-381。10.1073 / pnas.95.1.376。
- 30.
Brewer PB, Howles PA, Dorian K, Griffith ME, Ishida T, Kaplan-Levy RN, Kilinc A, Smyth DR:三螺旋转录因子基因PETAL LOSS调控拟南芥花被结构。发展。2004,131:4035-4045。10.1242 / dev.01279。
- 31。
Maizel A,威格尔d:时间和空间上控制基因表达的诱导在拟南芥。植物杂志2004年,38:164-171。10.1111 / j.1365-313X.2004.02027.x。
- 32.
Deveaux Y,Beocelle A,Roberts Gr,Coen E,Simon R,Mizukami Y,Traas J,Murray Jah,Doonan Jh,Laufs P:乙醇开关:植物开发过程中的组织特异性基因诱导工具。工厂J. 2003,66:918-930。10.1046 / J.1365-313x.2003.01922.x。
- 33.
Haseloff J:Jim Haseloff的实验室主页。[http://www.plantsci.cam.ac.uk/Haseloff/Home.html].
- 34.
Garfinkel DJ, Simpson RB, Ream LW, White FF, Gordon MP, Nester EW:冠瘿基因分析:位点定向突变的T-DNA精细结构图。细胞。1981,27:143-153。10.1016 / 0092 - 8674(81) 90368 - 8。
- 35。
Willmitzer L,Dhaese P,Schreier Ph,Schmalenbach W,Van Montagu M,Schell J:Nopaline Crown Gall肿瘤的T-DNA编码成绩单的大小,位置和极性;章鱼和Nopaline肿瘤中的常见转录物。细胞。1983年,32:1045-1056。10.1016 / 0092-8674(83)90289-1。
- 36。
花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 37。
Naleway JJ:组织化学,分光光度法和荧光GUS基材。GUS协议:使用GUS基因作为基因表达的记者。编辑:Gallagher SR。1992年,纽约,学术出版社,Inc。,61-76。
确认
我们感谢Valerie Harlan为技术援助,Robert Feissner为富士成像系统提供帮助,并Rita Varagona,Barry Goldman,Dan Harageman,Dan Harage,Dan Haragem,Dan Haragem,Dan Harageman,Dan Harageman,Dan Haragon,Dan Haragers,Dan Haragon,Dan Haragon,Dan Haragon,Dan Harageman,Dan Haragers,丹希顿讨论,以及阅读稿件的埃里克理查德Craig Pikaard用于使用GFP显微镜。这项工作得到了蒙斯托托/华盛顿大学协同协议的支持。
作者信息
从属关系
相应的作者
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
关于这篇文章
引用这篇文章
工程师,c.b., Fitzsimmons, K.C, Schmuke, J.J.等等。拟南芥中gal4介导的LUC/GFP/GUS增强子诱捕系统的建立和评价。BMC植物杂志5,9(2005)。https://doi.org/10.1186/1471-2229-5-9
收到了:
接受:
发表:
关键词
- 荧光素酶活性
- BASTA
- 陷阱系统
- 陷阱一行
- Gal4表达