摘要
背景
反应调节剂代表了细菌双组分系统的组成成分,已从双子叶植物等进行了表征拟南芥但是关于单子叶植物的信息很少,包括谷类作物。本研究的目的是研究水稻a型反应调节基因的特性,并研究它们在不同器官中的表达以及对不同激素(包括细胞分裂素和环境刺激)的响应。
结果
通过分析整个基因组序列,我们已经基于接收域内的高序列标识来识别编码响应调节器的10个基因。外显子内组织,内含子序列以及所有RT-PCR扩增的水稻的染色体位置(奥雅萨苜蓿)反应调节(OSRR)基因已被分析。的成绩单OSRR虽然存在定量差异,但可以通过在光和深色幼苗/植物的所有器官中进行实时PCR来检测基因。大部分的稳态转录水平OSRR即使在环己酰亚胺存在下,基因也在外源细胞蛋白蛋白酶上迅速增加(15分钟内)。而且,表达了OsRR6基因在暴露于含盐量,脱水和低温胁迫水稻幼苗增强。
结论
在模式单子叶植物水稻中鉴定的10个a型反应调节基因在不同器官和对光的响应中表现出重叠/差异的表达模式。的感应OSRR即使在缺乏细胞分裂素的情况下德诺维蛋白质的合成使它们成为主要的细胞分裂素反应基因。的感应OsRR6对不同环境刺激的响应表明其在非生物胁迫和细胞分裂素信号之间的交互作用。这些结果为进一步研究水稻a型反应调控因子的特异性和重叠细胞功能奠定了基础。
背景
Cytokinins调节各种植物生长和发育过程,包括细胞分裂,顶端优势,叶绿体生物发生,叶片衰老,血管分化,光学发生,组织培养和花青素的拍摄分化,主要通过改变不同基因的表达[1那2].近年来,植物遗传学和分子生物学研究表明,细胞分裂素信号感知和转导中涉及双组分传感器-调节系统,包括传感器组氨酸激酶(HK)蛋白、组氨酸磷酸转移(HPt)蛋白和效应响应调节蛋白[3.-9.].这种信号转导系统曾被认为局限于原核生物,但在许多真核生物中也发现了,包括酵母、真菌、黏菌和高等植物[10].在拟南芥,已经确定了与双组分系统的所有元素具有同源性的蛋白质[7.].
分析拟南芥基因组显示存在32个假定的反应调节基因[7.].基于预测的蛋白质结构域架构和氨基酸组成,响应调节剂已被广泛地分为三个不同的家庭:A型,型-B和伪响应调节器。类型-A响应调节器相对较小,包含接收器域以及小的N-和C终端扩展[11].b型反应调控因子包括一个与dna结合域融合的受体结构域,被认为是转录调控因子[12-14].伪响应调节器与其他响应调节器的接收器域共享显着的序列相似性,但不存在不变的D-D-K图案[7.].伪响应调节器也被认为是生物钟中的元素拟南芥和大米[15-18].
类型 - 响应调节基因拟南芥(类型-A加勒比海盗)通过外源细胞蛋白迅速且特异性诱导,尽管具有不同的动力学,并且已经表征为原发性细胞素反应基因[11那19那20.].类型的转录加勒比海盗基因部分是由b型arr调控的[21那22].一些a型arr执行部分冗余功能,通过反馈机制作为细胞分裂素反应的负调控因子[21那23那24].相比之下,ARR4被认为是细胞分裂素信号的正调节因子,因为它的过表达增强了转基因细胞分裂素的响应性拟南芥植物[25].然而,功能缺失突变体并没有揭示ARR4在细胞分裂素信号转导中的积极作用[24而这一差异仍有待解决。ARR4的组织分布与光敏色素B (phyB)的组织分布有很大的重叠,并与phyB的n端相互作用以稳定其活性形态[26].转基因拟南芥过表达ARR4的植物对红光特别敏感[26],表明ARR4可以参与整合红光和细胞蛋白信号传导。
a型反应调节剂已经从玉米中分离出来并进行了表征[27那28].然而,尽管在数据库中有一些EST/cDNA序列,但没有关于其他单子叶植物a型响应调节剂特征的报道。本文报道了水稻a型反应调节基因家族的鉴定和分析。奥雅萨苜蓿),模型单子叶植物。对所有十个成员分析了外显子内组织,染色体分布和序列同源性。当OSRR基因差异表达检查各个器官,同时也响应光。外源性细胞分裂素的诱导中的应用OSRR基因在没有的情况下德诺维蛋白质合成。OSRR6在非生物应激信号中的可能作用也提供了证据。
结果与讨论
米米型响应调节剂的鉴定
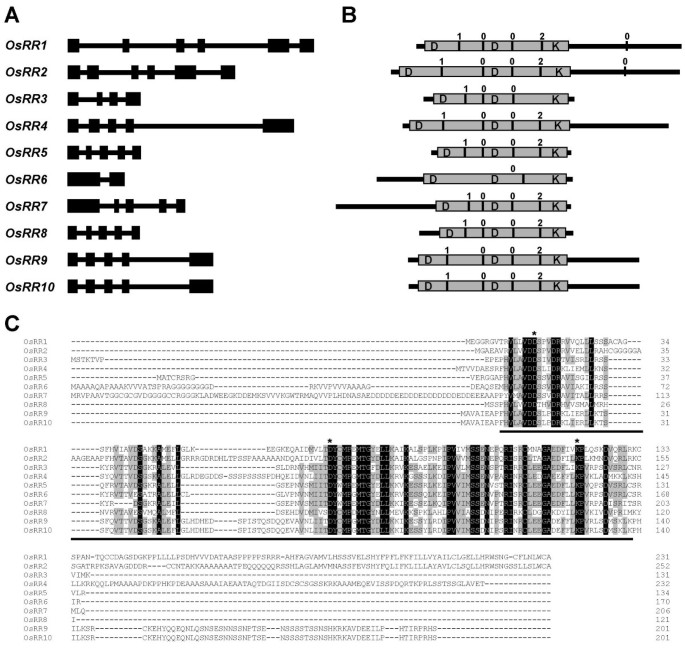
有关稻米基因组序列的资料[29那30.]提供了一个强大的工具,通过数据库搜索从其他生物体已知功能的基因来确定假定的同源蛋白。为了识别水稻中的a型响应调控因子,我们利用TBLASTN搜索技术,对水稻全基因组动态翻译的所有阅读框进行了分析拟南芥a型反应调节蛋白作为查询。本研究共鉴定出10个与该基因序列高度相似的基因拟南芥a型血人响应监管机构。这些预测蛋白包含一个特征的受体结构域(含有保守的D-D-K残基),具有短的N-和c端延伸,被命名为奥雅萨苜蓿反应调节剂(OSRR)蛋白。我们扩增(通过RT-PCR)并测序九个OSRRcdnas(OsRR9和10由于它们在编码区域和侧翼序列内具有> 99%的同一性,因此不能特别地扩增。通过与相应的基因组序列进行比较来确认它们的序列。在Genbank中沉积了cDNA序列,并在表格中沉积在GenBank中,预测数量,预测的蛋白质长度和基因组轨迹1.
外显子内组织和染色体分布
本研究获得的全长cDNA序列与相应的基因组DNA序列(在数据库中可查到)进行了比较,结果表明,该基因的大部分编码序列OSRR基因(10个中的6个)被4个内含子破坏(表1,无花果。1),表明他们的起源与常见的祖先基因,古典图案为5个外显子和4个内含子。然而,对于其他成员,观察到其基本基因结构的变化,暗示增益(OsRR1和OsRR2)或损失(OsRR3和OsRR6)内含子。高度保守的内含子相位和内含子的相对于它们的氨基酸序列图的位置(。1 b)也表明它们是通过外显子改组从同一祖先基因进化而来的[31].
A型反应调节水稻。(A)外显子 - 内含子的组织OSRR基因。外显子和内含子分别由黑匣子和线条表示。(b)欧姆尔蛋白的示意图(相对于第二保守ASP(D)残余物对准)。保守的接收域表示为具有D-D-K残留物的灰度盒。黑色垂直条表示内含子位置。垂直条上方的数字0,1和2分别表示相0,1和2内含子。(c)用CLUSTALX获得的OSRR蛋白的多次对准。完全和部分地保守(存在于50%的对齐序列中)残留物分别在黑色和灰色盒中突出显示。已经引入了差距(标有短划线)以最大化对齐。保守的接收域已加下划线。 Conserved Asp and Lys residues are marked with asterisks.
鉴定了携带OsRR蛋白基因的BAC(细菌人工染色体)或PAC(噬菌体人工染色体)克隆1).BAC/PACs在染色体图谱中的位置以染色体顶端的厘米(cM)为单位,以及与每一个厘米距离最近的标记OSRR基因显示在表中1.十OSRR发现基因分布在12种水稻染色体中的7个(表1).三OSRR基因存在于4号染色体上,2号染色体上有两个,1号、7号、8号、11号和12号染色体上各有一个。的分布OSRR水稻染色体的基因没有揭示明显的簇。但是,OsRR9和osrr10.存在于11号和12号染色体之间的复制块上[32那33].
序列分析
a型RRs主要由具有短N端和c端扩展的接收域组成[34],基本上类似于大肠杆菌响应调节器(RR) CheY参与趋化,缺乏典型的输出域。所有OsRR蛋白在受体结构域还包含高度保守的Lys和两个Asp残基(D-D-K)(图)。1b,c).对全长OSRR蛋白序列的成对分析表明整体身份的范围为28%至71%(奥斯尔9和10之间100%,表2).然而,接收域内的氨基酸同一性达到高达95%。Type-A RRS的接收域拟南芥与b型的符合率为60% ~ 93%,低于30%。预测的OsRR蛋白N端和c端延伸的氨基酸序列变化更大(图)。1 c),如拟南芥RR蛋白(11].ARR6和ARR7的C终端延伸显示为核定位负责[35].水稻a型响应调控因子OsRR1、OsRR2、OsRR4、OsRR9和OsRR10也具有富含酸性和带电残基的c端延伸(图1)。1b,c).然而,OsRR6和OsRR7的n端延伸段富含甘氨酸和asp残基(图2)。1 c).这些N端和c端可变区可能在其定位到不同的细胞室中发挥作用。
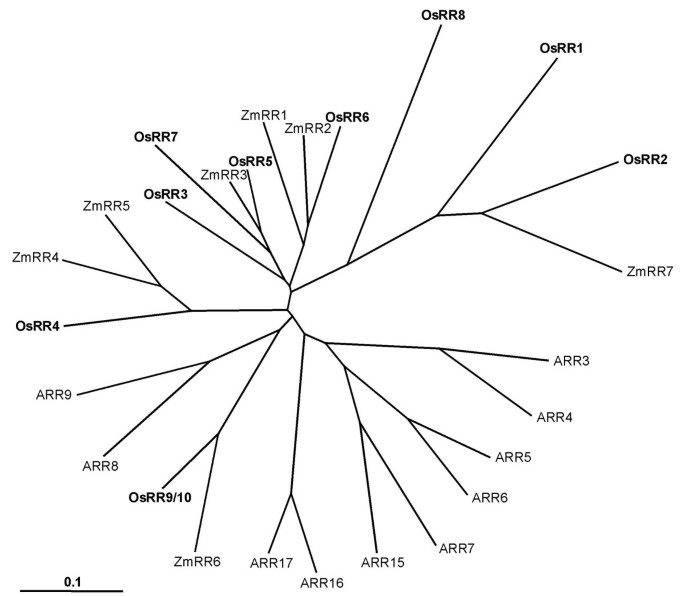
检查水稻,玉米的系统发育关系和拟南芥a型应答调节因子,通过对其全长蛋白序列的比对构建了一棵无根树(图。2).这些OsRR蛋白形成了四对姐妹(OsRR1和2,OsRR3和6,OsRR5和7,OsRR9和10)。这种a型RRs配对与最近假定在水稻基因组中发生的进化复制相一致[32那36].a型响应调节器拟南芥还形成了五个姐妹对,并发现所有这些都位于同源复制的染色体段上[24].因此,显着的是,姐妹对响应调节剂基因的复制与两种水稻和染色体块重复相关拟南芥.最近,广泛的重复和优先保留早期胃肠响应性AUX / IAA.两者都报道了基因拟南芥和大米[37那38].在水稻的复制A型应答调节基因的保持率(本研究)也支持了涉及转录和信号转导的基因已被优先保留在拟南芥[39].此外,大多数osrr与玉米rr (ZmRRs)聚在一起,其分支与玉米rr (ZmRRs)不同拟南芥RRs (arr)(图。2).在早期的研究中拟南芥RRs是一项系统发育分析,只包括少数单子叶植物的RRs,显示a型ARRs属于不同于水稻和玉米的分支[24].目前的研究证实了这一观察结果,并加强了单子叶和双子叶的祖先可能只有一个小的RRs家族,随后通过基因复制在单子叶和双子叶中都发生了扩增。
瀑特异的表达OSRR基因
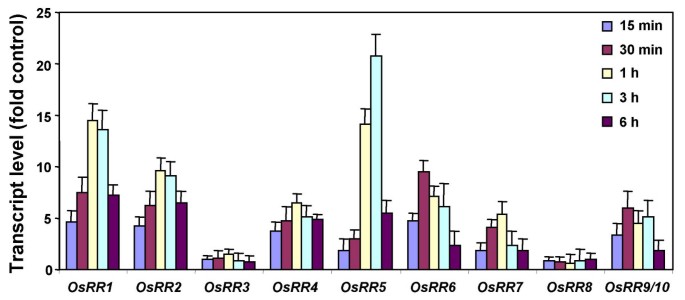
来检查每个的表达式模式OSRR通过实时荧光定量PCR (quantitative real-time PCR)分析从黄化苗、绿苗、绿芽、根、成熟叶和花中分离的总RNA,以评估光照的影响。所有的记录OSRR在检查的各种器官中检测到基因,但它们显示了复杂的表达模式(图。3.).大部分的OSRR基因在成熟的组织(叶和花)相对较高的水平表达。的表达OSRR根系在根(目前的研究)中也较高,这与大多数ARR相关相似[11].转录水平OsRR2那3.那4.那6.那7.,9.与绿色幼苗相比,黄化幼苗的叶绿素含量显著升高(图。3.).但是,OsRR5在绿色幼苗中表现出较高的表达。有趣的是,在最近的一项研究中加勒比海盗突变体拟南芥表现出改变的红光敏感性[24].此外,ARR4已发现用光敏色素乙相互作用并稳定其活性形式[26].这些结果表明OSRR基因表现出重叠和差异的表达模式,在特定器官中发挥主要作用,也可能参与光信号转导。
奥尔斯尔代表主要细胞素蛋白反应基因
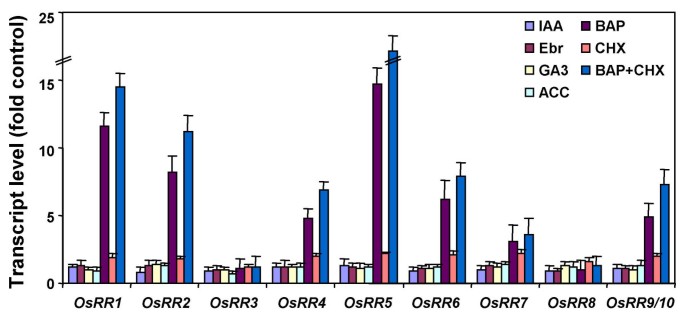
细胞分裂素调节大量基因的表达,包括a型反应调节因子拟南芥和玉米11那27那40].研究细胞分裂素对个体转录水平的影响OSRR外源细胞分裂素处理水稻幼苗6 h,进行实时荧光定量PCR分析。与之前报道的结果一致拟南芥[11的稳态转录水平OSRR基因在外源细胞蛋白涂布后的15分钟内升高(图。4.).细胞分裂素诱导的动力学基本一致OSRR转录量在1 h内达到最大值,随后下降。然而,在转录丰度上没有显著变化OsRR3和8.在细胞蛋白处理后(图。4.).外源细胞分裂素对a型arr的快速诱导已被证明介导了一种反馈机制,这降低了植物对激素的敏感性,表明a型arr在细胞分裂素诱导的反应中起负调节作用[21那23那24].B型RRS是响应于细胞蛋白的响应调节剂的转录激活的转录因子[13那21那22].
许多主要响应基因,例如养猪诱导的奥克斯/国际宇航科学院基因在没有缺席的情况下诱发德诺维蛋白质的合成[41].编码类型的基因 - RRS拟南芥也被描述为主要细胞分裂素反应基因[11那42].来确定OSRR基因也属于相同的类别,在蛋白质合成抑制剂的存在下,在蛋白质合成抑制剂的存在下检查它们的诱导(图。5.).大部分的稳态转录水平OSRR基因增加(高达2-2-25倍)用环己酰亚胺处理,表明这些基因的转录由短寿命的阻遏蛋白调节。转录物丰富的增加(高达4-6倍)的米饭AUX / IAA.检查基因(OsIAA9那OsIAA13和OsIAA20)[38,证实环己亚胺处理在我们的实验中具有生物学上的有效性。此外,环己亚胺未能阻断细胞分裂素对这些基因的诱导;的转录水平OSRR在有环己亚胺的BAP处理的样本中,基因含量比单独BAP处理的样本高(图。5.).这些结果表明OSRR基因构成一类初级细胞素反应基因。
的表达OSRR对其他植物激素,包括生长素、油菜素内酯、赤霉素和乙烯的应答基因也进行了检测。然而,这些激素对稳定状态下的转录水平没有显著影响OSRR基因(图。5.),表明主要在细胞分裂素信令它们的作用。
表达OSRR应激条件下的基因
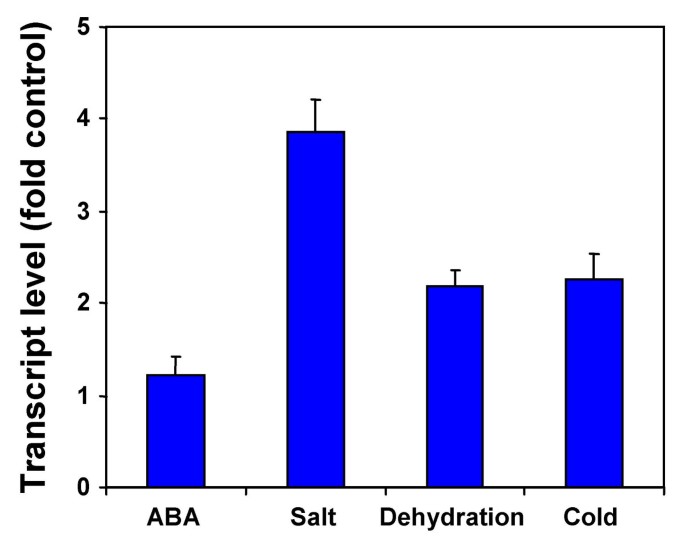
早前已经有人声称,在拟南芥由不同的环境压力诱导,如干旱,盐度和低温[43].来调查一下,是否有些OSRR基因也参与胁迫应答,其表达水平通过从经受各种非生物胁迫处理年轻稻苗分离的RNA进行实时PCR分析来检查。大多数的表达OSRR基因没有显著在压力下改变(数据未显示),具有显着的例外OsRR6.的表达OsRR6在盐、脱水和低温处理下,基因被诱导至显著水平(图2)。6.),结果具有可重复性。这表明,除了作为细胞分裂素信号的组成部分外,OsRR6可能在水稻非生物胁迫信号中发挥重要作用。值得注意的是,与细胞分裂素受体密切相关的跨膜杂交型组氨酸激酶AHK1被认为是一种渗透传感器拟南芥[44].
OsRR蛋白可能的功能是什么?
type-A RRs拟南芥已被证明用作部分冗余函数的细胞蛋白信号传导的负调节剂[11那24].此外,这些arr和双组分传感器调节磷酸化中继的其他元件参与细胞分裂素和光信号(由光敏色素介导)以及气体激素乙烯之间的交互[4.那45].a型RRs之一,即ARR4,也被归因于红光介导的光形态建成[24那26].事实上,ARR4在物理上与光敏色素B结合以延长其活性构象Pfr的稳定性,并突出红光信号。b型arr(可能还有a型arr)的作用也被设想在乙烯和细胞分裂素信号之间的交叉对话中,尽管它们可能不同地调节这些成分来控制不同的植物过程[4.].对…的功能略知一二OSRR基因,米饭Tos17插入突变体数据库[46]提供米饭的表型Tos17Retrotroansposon插入突变体[47]使用BLAST程序访问。我们可以识别仅对应于插入突变体OsRR9/10基因(NE6006_0_401_1A和ND8005_0_402_1A);界定是否侧翼的序列是难以划分的Tos17插入代表OsRR9或osrr10.因为它们之间有超过99%的相似性。尽管事实是OsRR9和osrr10.插入突变体(仅代表这两个位点中的一个)的表型表现为矮化、不育、病变模拟和胎生。由此可以推测OsRR9/10基因可以定量地影响受光和细胞分裂素影响的不同细胞过程。详细分析了现有的插入突变体和其余的RNAi策略OSRR基因将这些基因的确切作用,阐明有很大帮助。
结论
水稻型RR蛋白的结构分析结果及其与ARRS的系统发育关系将有助于其在水稻中的功能验证。器官特定的差异表达谱OSRR基因表明,它们的产物很可能在水稻的不同细胞类型中执行不同的和重叠的功能。本研究也反映了OSRR光和细胞分裂素信号传导的基因。的感应OsRR6由不同的非生物胁迫的刺激提供应力之间和细胞分裂素信令以及一个分子链接。这些结果提供了未来对水稻A型应答调节细胞功能的阐明工作提供了基础。
方法
序列分析
通过在国家生物技术信息中心进行爆炸搜查来确定水稻中的响应调节基因[48]和TIGR基因组和注释数据库[49使用的反应调节蛋白序列大米]资源拟南芥查询。个人的外显子和内含子的数量和位置OSRR通过将CDNA与其相应的基因组DNA序列进行比较来确定基因。通过在TIGR(第3份)的水稻染色体假调子的基因组序列中发现每个基因对水稻染色体的位置。使用Clustalx(版本1.83)程序进行多个序列对齐[50],采用邻域连接法进行系统发育分析[51].利用Treeview程序显示系统发育树。使用Gene Runner程序3.04进行DNA和蛋白序列分析。与DNASTAR MegAlign 4.03包进行两两比较,确定序列的同源性。
植物材料和生长条件
赖斯(奥雅萨苜蓿l . ssp。indicvar。普萨巴斯马蒂1)种子用0.1%升汞消毒2溶液1小时并用RO(反渗透)水彻底洗涤,然后在RO水中浸泡过夜。幼苗在用RO水饱和的棉花上生长,在28±1℃,无论是完全的黑暗还是在培养室中,每日光周期循环为14小时和10小时黑暗。从温室生长的水稻植物收集了鲜花和成熟叶子。
激素和压力治疗
对于细胞分裂素处理,将6日龄的轻生水稻幼苗转移到50 μM苄基氨基嘌呤(BAP)溶液中,并在指定的时间收获。与其他激素治疗/化合物,6-day-old light-grown稻秧被转移到烧杯包含解决方案indole-3-acetic酸(IAA, 50μM), epibrassinolide (Ebr, 10μM)、赤霉素(GA3, 50μM), 1-aminocyclopropane-1-carboxylic酸(ACC, 50μM)、脱落酸(ABA、50μM)和环己酰亚胺(CHX,50 μM),孵育3 h。模拟处理后的幼苗作为对照。
对于盐和干旱胁迫处理,将6天历史的浅稻幼苗转移至250mM NaCl或300mM甘露醇6小时。对于低温处理,将幼苗保持在8±1℃的6小时。幼苗在水中保持相同的持续时间,28±1℃,用作对照。
RNA隔离
使用RNeasy植物迷你套件(德国Qiagen)提取总RNA。为了除去任何基因组DNA污染,根据制造商的指示,用无RNA酶DNase I(QIAGEN)处理RNA样品。对于每个RNA样品,测量260nm处的吸收,并计算为a的RNA浓度260×40(μg/ ml)×稀释因子。通过琼脂糖凝胶Elecrophoreris监测RNA样品的完整性。
cDNA的分离、克隆和测序
的编码区OsRR基因根据制造商的说明,通过使用基因特异性引物(RT-PCR)使用基因特异性引物扩增来自从生长幼苗的总RNA(Roche,USA)。30或35次循环后,通过凝胶电泳和ETBR染色检查PCR产物。根据制造商的说明,RT-PCR产物克隆到PGEM-T易于载体(Promega,Madison,Wi)中。使用Abi Prism 377测序仪(PE应用生物系统,USA)进行测序,具有硫鼻蛋白酶染料终止子循环序列测序试剂盒(Amersham,UK)。
定量实时PCR表达分析
类型-A的转录水平OsRR基因使用ABI Prism 7000序列检测系统和软件(PE Applied Biosystems, USA)进行实时PCR分析,如前所述[52].通过使用底漆设计软件引物Express 2.0(PE Applied Biosystems,USA)设计了引物。为了确保引物扩增唯一和期望的cDNA段,在TIGR数据库中可用的水稻基因组序列的BLAST程序中检查每对引物。底漆序列列于表中3..特异性引物,以OsRR9和10编码区域和侧翼序列的一致性超过99%,无法设计。根据制造商的说明,使用高容量cDNA Archive kit (Applied Biosystems, USA)逆转录3 μg总RNA合成第一链cDNA。以稀释后的cDNA样品为模板,将每个引物与SYBR Green PCR Master Mix (Applied Biosystems, USA)混合200 nM进行实时PCR分析。PCR反应采用以下参数进行:在50°C下进行2分钟,在95°C下进行10分钟,在96孔光学反应板中进行40个循环,分别在95°C下进行15 s,在60°C下进行1分钟(美国Applied Biosystems公司)。琼脂糖凝胶电泳和熔融曲线分析分别验证了扩增子的同源性和反应的特异性。相对的mRNA水平OSRR基因的不同RNA样品中相对于计算为内标,UBQ5,对RNA质量和输入cDNA数量的方差进行归一化。至少用两种不同的RNA分离和cDNA合成进行定量,每个cDNA样本进行实时PCR,重复三次。所示值是两个生物重复的平均值,每个重复有三个技术重复。误差柱表示与平均值的标准差。
参考资料
- 1.
MOK DW,MOK MC:Cytokinin新陈代谢和行动。Annu Rev植物植物植物Mol Biol。2001,52:89-118。10.1146 / annurev.arplant.52.1.89。
- 2.
《植物激素:生物合成,信号转导,行动》,2004,荷兰:Kluwer学术出版社
- 3.
kakimoto t:细胞素的感知和信号转导。Annu Rev植物Biol。2003,54:605-627。10.1146 / annurev.arplant.54.031902.134802。
- 4.
王志强,王志强,王志强,等。植物细胞分裂素信号转导的研究进展[j]拟南芥.中国生物医学工程学报。2002,29(4):489 - 494。10.1266 / ggs.77.383。
- 5.
细胞分裂素的信号转导拟南芥.植物细胞。2002年,S47-59。增刊14
- 6。
LohrmannĴ,哈特K:植物双组分信号系统和响应调节剂的作用。植物理性。2002年,128:363-369。10.1104 / pp.128.2.363。
- 7。
黄I,陈春春,辛J:双组分信号转导途径拟南芥.植物理性。2002,129:500-515。10.1104 / pp.005504。
- 8。
细胞分裂素信号的感知与转导。植物营养与肥料学报。2003,6:480-488。10.1016 / s1369 - 5266(03) 00087 - 6。
- 9。
Grefen C,Harter K:植物双组分系统:原则,功能,复杂性和交叉谈话。Planta。2004,219:733-742。10.1007 / S00425-004-1316-4。
- 10.
股票AM,罗宾逊VL,Goudreau PN:双组分信号转导。annu rev biochem。2000,69:183-215。10.1146 / annurev.biochem.69.1.183。
- 11.
D’agostino IB, Deruere J, Kieber JJ:表征的反应拟南芥细胞分裂素反应调节基因家族。植物生理学报。2000,19(4):593 - 598。10.1104 / pp.124.4.1706。
- 12.
Sakai H,Aoyama T,Bono H,Oka A:双组分响应调节器来自拟南芥包含一个假定的dna结合基序。植物营养与肥料学报。1998,39(4):459 - 461。
- 13.
Sakai H,青山T, Oka A:拟南芥Arr1和Arr2响应稳压器作为转录激活器运行。工厂J.2000,24:703-711。10.1046 / J.1365-313x.2000.00909.x。
- 14.
关键词:b型响应调控因子,表达模式,基因工程,基因工程引用本文拟南芥.植物理性。2004,135:927-937。10.1104 / pp.103.038109。
- 15.
Makino S, Kiba T, Imamura A, Hanaki N, Nakamura A, Suzuki T, Taniguchi M, Ueguchi C, Sugiyama T, Mizuno T:编码伪反应调节的基因:对histo - asp磷酸化relay和生理节律的研究拟南芥.植物细胞生理。2000年,41:791-803。
- 16。
Makino S, Matsushika A, Kojima M, Yamashino T, Mizuno T: APRR1/TOC1五重奏涉及昼夜节律拟南芥: I.过表达aprr1的植物的特性。植物生理学报。2002,43(4):514 - 518。10.1093 /卡式肺囊虫肺炎/ pcf005。
- 17。
Matsushika A,Makino S,Kojima M,Yamashino T,Mizuno T:APRR1 / TOC1 Quintet涉及昼夜节律拟南芥:II。用CCA1过度抑制植物表征。植物细胞生理。2002,43:118-122。10.1093 / PCP / PCF006。
- 18。
Murakami M, Ashikari M, Miura K, Yamashino T, Mizuno T:进化上保守的OsPRR五环:涉及昼夜节律的水稻伪反应调节。植物营养与肥料学报。2003,27(4):429 - 436。10.1093 /卡式肺囊虫肺炎/ pcg135。
- 19。
谷口男,木叶T,榊原H,Ueguchi C,水野T,杉山T:表达拟南芥反应调节剂同源物由细胞分裂素和硝酸盐诱导。费用。1998年,429:259-262。10.1016 / s0014-5793(98)00611-5。
- 20.
木场T,谷口男,今村A,Ueguchi C,水野T,杉山T:响应于细胞分裂素和硝酸盐在基因应答调节的差异表达拟南芥蒂利亚纳。植物细胞生理。1999年,40:767-771。
- 21.
黄I,辛Y:在双组分电路拟南芥Cytokinin信号转导。自然。2001,413:383-389。10.1038 / 35096500。
- 22.
Sakai H,Honma T,Aoyama T,Sato S,Kato T,Tabata S,OKA A:Arr1,立即响应细胞胰岛素的基因的转录因子。科学。2001,294:1519-1521。10.1126 / Science1065201。
- 23.
Kiba T,Yamada H,Sato S,Kato T,Tabata S,Yamashino T,Mizuno T:响应稳压器,Arr15,作为Cytokinin介导的信号转导的负调节器拟南芥.植物细胞生理。2003,44:868-874。10.1093 / PCP / pcg108。
- 24.
对于JP,Haberer G,Ferreira FJ,Deruere J,Mason Mg,Schaller Ge,Alonso JM,Ecker JR,Kieber JJ:类型 - 拟南芥响应调节剂是细胞蛋白信号传导的部分冗余负调节剂。植物细胞。2004,16:658-671。10.1105 / TPC.018978。
- 25.
sakabe Y, Miyata S, Urao T, Seki M, Shinozaki K, Shinozaki KY:过度表达拟南芥反应调节剂ARR4/ATRR1/IBC7和ARR8/ATRR3在芽和愈伤组织形成中不同程度地改变细胞分裂素反应。中国生物化学学报。2002,29(3):423 - 427。10.1016 / s0006 - 291 x(02) 00286 - 3。
- 26.
Sweere U,Eichenberg K,Lohrmann J,Mira-Rodado V,Baurle I,Kudla J,Nagy F,Schafer E,Harter K:响应调节器ARR4在调制红光信号中的植物色彩B中的相互作用。科学。2001,294:1108-1111。10.1126 / science1065022。
- 27.
朝仓Y,Hagino T,太田Y,青木K,米仓-榊原K,德基A,Yamaya T,杉山T,榊原H:他的 - 天冬氨酸phosphorelay信令在玉米叶因素的分子表征:通过信号发散影响细胞分裂素可诱导的应答调节在胞质溶胶和细胞核。植物mol biol。2003,52:331-341。10.1023 / A:1023971315108。
- 28。
Giulini A,Wang J,Jackson D:通过细胞蛋白诱导响应调节剂同源物的Phyllotaxy控制ABPHYL1.自然。2004,430:1031-1034。10.1038 / Nature02778。
- 29。
Goff Sa,Ricke D,Lan Th,Presting G,Wang R,Dunn M,Glazebrok J,Sessions A,Oeller P,Varma H,Hadley D,Hutchison D,Martin C,Katagiri F,Lange Bm,Moughamer T,夏Y,Budworth P,Zhong J,Miguel T,Paszkowski U,张S,COLBERT M,Sun WL,Chen L,Cooper B,Park S,Wood TC,Mao L,鹌鹑P,Wing R,Dean R,Yu Y,ZharkhA,Shen R,Sahasrabudhe S,Thomas A,罐头R,Gutin A,Puss D,Reid J,Tavtigian S,Mitchell J,Eldredge G,Scholl T,Miller RM,Bhatnagar S,Adey N,Rubano T,Tusneem N,Robinson R,Feldhaus J,Macalma T,Oliphant A,Briggs S:水稻基因组的序列(奥雅萨苜蓿l . ssp。粳稻).科学。2002,296:92-100。10.1126 / Science1068275。
- 30.
yu J,Hu S,Wang J,Wong GK,Li S,Liu B,Deng Y,Dai L,周Y,张X,Ca M,Liu J,Sun J,Tang J,Chen Y,Huang X,Lin W,叶c,桐树,cong l,geng j,韩y,li l,李w,胡g,黄x,李文,李j,刘z,李l,刘j,qi q,刘j,李l,李t,王x,lu h,wu t,zhu m,ni p,han h,dong w,ren x,feng x,cui p,li x,wang h,xu x,zhai w,xu z,张j,他,张俊,徐j,张k,zheng x,dong j,zeng w,tao l,ye j,tan j,ren x,chen x,他j,liu d,tian w,tian c,夏H,宝q,李g,gao h,cao t,王j,zhao,李p,陈某,王x,张y,胡j,王j,liu s,yang j,张g,熊y,李z,毛,周c,zhu z,chen r,郝b,zheng w,chen s,gu w,li g,liu s,tao m,王j,zhu l,元l,杨h:水稻基因组的序列(奥雅萨苜蓿l . ssp。indic).科学。2002,296:79-92。10.1126 / Science1068037。
- 31.
通过外显子改组的蛋白质定向进化。自然生物技术。2001,19:423-428。10.1038/88084。
- 32.
帕特森啊,鲍德·杰,查普曼坝:古代多倍化谷物的差异性,以及对比较基因组学的后果。Proc Natl Acad Sci USA。2004,101:9903-9908。10.1073 / pnas.0307901101。
- 33.
水稻染色体11和12测序组:水稻染色体11和12的序列,富含抗病基因和最近的重复。BMC生物学。2005,3:20-10.1186 / 1741-7007-3-20。
- 34.
Imamura A,Hanaki N,Umeda H,Nakamura A,Suzuki T,Ueguchi C,Mizuno T:响应调节器涉及他 - ASP Phosphotor转换信号拟南芥.Proc Natl Acad Sci USA。1998,95:2691-2696。10.1073 / pnas.95.5.2691。
- 35.
Imamura A,Yoshino Y,Mizuno T:信号传导组件的蜂窝定位拟南芥他 - asp磷。Biosci Biotechnol Biochem。2001,65:2113-2117。10.1271 / BBB.65.2113。
- 36.
国际水稻基因组测序项目:基于图谱的水稻基因组序列。自然科学进展。2005,436:793-800。10.1038 / nature03895。
- 37.
Remington DL, Vision TJ, Guilfoyle TJ, Reed JW:不同的多元化模式奥克斯/国际宇航科学院和东盟地区论坛基因家庭。植物理性。2004,135:1738-1752。10.1104 / pp.104.039669。
- 38.
Jain M,Kaur N,Garg R,Thakur JK,Tyagi Ak,Khurana JP:恢复早期疗效的结构和表达分析奥克斯/国际宇航科学院大米的基因家庭(奥雅萨苜蓿).Funct综合基因组学。2006,6:47-59。10.1007 / s10142-005-0005-0。
- 39.
多倍性过程中复制基因的功能分化拟南芥进化。植物营养学报。2004,16(4):491 - 498。10.1105 / tpc.021410。
- 40。
Rashotte Am,Carson SDB,JPC,Kieber JJ:Cytokinin行动的表达分析拟南芥.植物生理学报。2003,32(6):691 - 698。10.1104 / pp.103.021436。
- 41.
阿贝尔S,阮MD,Theologis答:PS-IAA4/5类似家族的早期生长素诱导mrna拟南芥.中国生物医学工程学报,2003,22(4):531 - 534。10.1006 / jmbi.1995.0454。
- 42.
Brandstatter I,Kieber JJ:具有与细菌反应调节剂相似的两种基因是迅速的,并且由Cytokinin迅速诱导拟南芥.植物细胞。1998,10:1009-1019。10.1105 / TPC.10.6.1009。
- 43.
Uraao T,Yakubov B,Yamaguchi-Shinozaki K,Shinozaki K:对两个组分反应调节剂样蛋白的基因的应激响应性表达拟南芥.费用。1998年,427:175-178。10.1016 / S0014-5793(98)00418-9。
- 44.
Uraao T,Yakubov B,Satoh R,Yamaguchi-Shinozaki K,Seki M,Hiryama T,Shinozaki K:跨膜杂化型组氨酸激酶拟南芥用作渗透传感器。植物细胞。1999年,11:1743年至1754年。10.1105 / tpc.11.9.1743。
- 45.
韩立德,范克豪瑟:光敏色素激素信号网络。植物营养学报,2003,19(4):449-463。10.1046 / j.1469-8137.2003.00689.x。
- 46.
大米Tos17插入突变体数据库。[http://tos.nias.affrc.go.jp/]
- 47.
Miyao A, Tanaka K, Murata K, Sawaki H, Takeda S, Abe K, Shinozuka Y, Onosato K, Hirochika H: Tos17逆转录转座子的靶位点特异性显示了对基因内插入的偏好,而对基因组中富含逆转录转座子的区域插入的偏好。acta botanica sinica(云南植物学报),2003,27(5):457 - 461。10.1105 / tpc.012559。
- 48.
国家生物技术信息中心。[http://www.ncbi.nlm.nih.gov]
- 49.
tiger水稻基因组注释。[http://tigrblast.tigr.org/euk-blast.]
- 50。
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG: CLUSTAL_X窗口界面:在质量分析工具辅助下的多序列比对的灵活策略。核酸学报1997,25:4876-4882。10.1093 / nar / 25.24.4876。
- 51。
斋藤N,NEI玛:邻接法:用于重建系统发生树的新方法。mol Biol Evol。1987年,4:406-425。
- 52。
耆那男,考尔N,特亚吉AK,库拉纳JP:生长素响应性GH3大米的基因家庭(奥雅萨苜蓿).功能基因组学。2006,6:36-46。10.1007 / s10142 - 005 - 0142 - 5。
确认
MJ认识到新德里科学和工业研究委员会的高级研究奖学金奖。我们非常感谢印度政府和大学新德里的生物技术系的财务支持。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
MJ设计并完成了所有的在网上分析和湿实验室实验,并起草了手稿。AKT和JPK参与了实验设计,协调研究,并协助起草了手稿。所有作者阅读并同意最终的文本。
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
水稻细胞分裂素- a型应答调节因子的分子特性和差异表达(奥雅萨苜蓿).BMC植物杂志6,1(2006)。https://doi.org/10.1186/1471-2229-6-1
收到了:
接受:
发表:
关键字
- 接收机域
- 细胞分裂素信号
- 外源性细胞蛋白
- 妹妹对
- 反应调节剂蛋白