摘要
背景
切花作物的花序非洲菊矮牵牛(菊科)由两种主要的花类型组成,射线花和圆盘花,它们形成一个紧密包裹的头状花序或头状花序。尽管人们对植物形态进化和非洲菊系统的可驯化性很感兴趣,但关于花型规范的遗传机制却知之甚少。在这里,我们通过对数百个协调发育的花原基的显微解剖,提供射线花和盘状花发育的比较分期和差异表达基因的微阵列筛选。
结果
使用9K非洲菊cDNA芯片,我们鉴定了一些基因,推测其对单个花类型具有特异性。有趣的是,这些基因中有几个编码MADS-box转录因子的同源物,否则就会知道它们调节花器官的发育。根据这些和之前获得的数据,我们假设了几个非洲菊MADS-box因子的功能和蛋白质-蛋白质相互作用。
结论
我们的RNA表达结果表明,花型特异性MADS蛋白复合物可能在非洲菊头状花序射线花和圆盘花的差异发育中起着中心作用,并且在花器官确定中与已知的蛋白质功能有一些共同之处。这些发现支持了一个有趣的猜想,即非洲菊花头在基因调控水平上不仅仅是花的类似物。
背景
花序的非洲菊矮牵牛(菊科)由三种不同类型的花(射线花、反花、圆盘花)组成,它们紧密地包裹在一个凝结的、放射状组织的花头(头状花序)中。在单一基因型中存在形态上不同的花类型,这使得非洲菊成为生殖发育研究的独特目标,因为传统的欧迪科模型植物(拟南芥、金鱼草和佩妮)在花序中只开单花。在非洲菊属植物中,所有花类型的第一阶段在形态上都是相似的,只有个别花原基在发展中的头状花序中的位置决定了它们的发展命运。然而,在发育的后期出现了许多形态上的差异。花的类型之间最显著的区别是它们的性别表现。非洲菊是一种雌雄同株的植物,在同一花序中同时开雌花和雌雄同体花。在外部的雌花和反花中,雄蕊发育停止,形成原始的退化雄蕊[1],而在中央盘花中,花药发育充分,产生花粉,并形成覆盖心皮的生殖后融合结构。此外,射线花的花冠(融合花瓣)长且左右对称(两侧对称),而圆盘花的花冠则从花瓣短且不太对称到位于头状花序正中央的放光对称(放射状对称)不等。不同非洲菊品种的花冠大小和颜色可连续变化[2]。
不同类型花的混合在具有头状花序或其他密集花序的物种中很常见[3.,4],并可能反映了这种类型的组织的选择性优势。非洲菊的头状花序明显地模仿了一个大的单花,其鲜艳的、细长的射线花吸引传粉者到花序中心两性花所在的地方。在菊科的花头形态可以从放射状到盘状变化,至少有射线花和圆盘花,或只有圆盘花的周期[5]。不同的头形在菊科的不同亚科和部落之间的流行程度各不相同[5,6]。射线花的存在与否似乎受一两个主要基因的控制,但几个修饰基因也参与其中[综述在[6,7]]。也许在这方面研究得最好的系统是千里光,其中花头型主要由雷位点,放射状表型占优势于盘状[8- - - - - -10]。表型上的大体相似centroradialis(岑突变体的金鱼草属植物,其顶花呈放射状对称,在花序顶端周围的周边区域被左右对称的腋生花包围,促使研究人员检验假说[11),雷基因座编码花对称基因的同源物CYCLOIDEA(12- - - - - -14]。然而,最近微阵列的比较千里光主要在花形态上不同的类群只揭示了少数基因——也没有CYCLOIDEA-可能与观察到的花发育差异有关[15]。
近二十年来植物生殖发育遗传学的进展表明,指定花发育的最重要基因编码转录因子,其中许多是MADS结构域蛋白[16- - - - - -18]。有几个例子表明,由于亚功能化或新功能化,同源基因在不同物种中进化出了不同的功能[17]。此外,转录因子中相对简单的调控变化可以负责新形态的进化[例如,]19- - - - - -21]]。在这项研究中,我们已经在形态学上描述了非常早期阶段的射线花和圆盘花的发育非洲菊矮牵牛。我们使用非洲菊cDNA微阵列,包括9000个代表来自不同组织和处理的ESTs探针,比较了盘状花和射线花发育的三个不同阶段的基因表达谱[22]。我们的目标是通过识别可能在射线花和圆盘花的分化途径中起不同作用的基因,来收集有关非洲菊早期花发育过程的总体图像。令人惊讶的是,我们发现控制花器官决定的MADS-box基因在不同的花类型中表达差异很大。
结果
花发育的早期阶段非洲菊矮牵牛
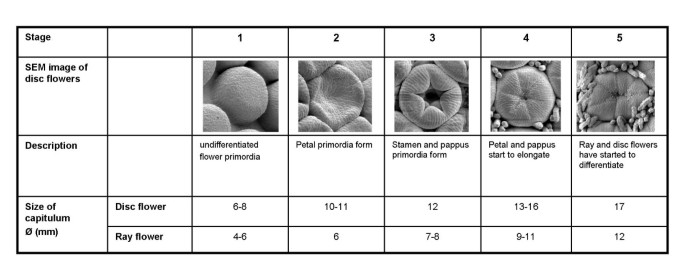
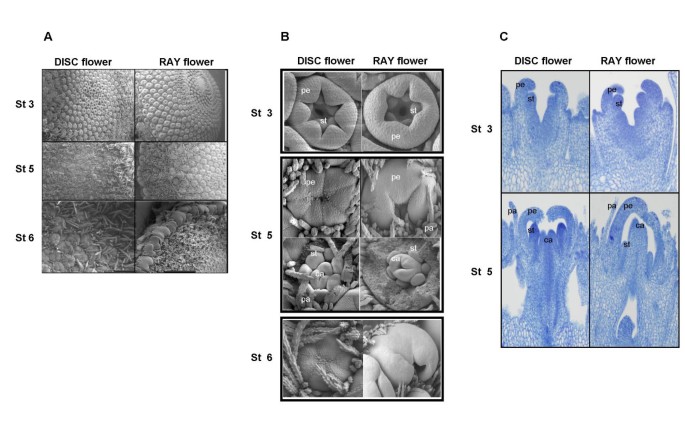
在繁殖发育的早期阶段,单个花原基从花序分生组织以顶瓣螺旋形式产生。未分化的射线花原基最先出现在直径小于6毫米的花序中,而第一个盘花原基则出现在直径约6 - 8毫米的花序中(图1)。我们将早期花的发育分为6个不同的阶段,用扫描电子显微镜(SEM)和组织染色(图1和2)。数字1演示了完美(完全双性)碟花发展的前五个阶段。在第1阶段,花原基是小的、未分化的肿块,而在第2阶段,环状花瓣原基开始形成。在第3阶段,可以清楚地区分出花冠原基(轮1)、花瓣原基(轮2)和雄蕊原基(轮3)。直到发育到这一阶段,射线花和盘状花在形态上仍然表现出相似,只能根据它们在花序中的位置进行识别(图2)。在第四阶段,花瓣开始拉长,覆盖正在发育的雄蕊和心皮原基。花器官在第5和第6阶段继续伸长(图2 b)。与扫描电镜一样,组织学分析显示在第3期射线花和圆盘花之间没有形态学差异(图2摄氏度)。然而,在第5阶段,雌性射线花的雄蕊落后,与完美的圆盘花相比,雄蕊更短(图2 b和2摄氏度)。此外,在第5阶段,射线花的花瓣已经融合在一起,可以分辨出双裂射线花的形状,它们有三个高度延伸的下裂片和两个微小的上裂片。相反,在碟状花中,发育中的花瓣是相互分离的。到了第6阶段,花瓣伸长的差异更加明显。在这个阶段,两种花型的乳头刚毛都长得多,几乎覆盖了发育中的原基(图2和2 b)。在早期的工作中,我们根据射线花瓣的发育来定义头状花序的发育阶段[23]。这里所描述的射线花和圆盘花的发育阶段6分别对应于头状花序的发育阶段1和发育阶段3 [23]。
射线花和花盘花发育过程中基因表达的微阵列分析
在发育的第3、5和6个阶段分别进行了射线花和花盘花原基的cDNA微阵列分析。非洲菊cDNA微阵列包含约9000个探针,代表非洲菊EST集合中所有不同的unigenes [22]。打印在微阵列上的大多数探针(约80%)代表花的cDNA文库和在花序发育过程中表达的基因的转录本[22]。用于RNA分离的微解剖材料是在一年多的时间里从几十个花序上的数百个花原基中收集并汇集在一起的。在非洲菊花原基采样等情况下,由于植物材料数量有限,无法进行真正的生物复制,聚集是一种最小化生物变异的手段。在我们的实验中,我们还汇集了几个独立的RNA分离物,并在染料标记之前对它们进行了扩增。每个实验包括4个技术复制,每个复制有两次染料交换。我们已经用实时逆转录酶PCR对12个随机转录本和8个非洲菊MADS-box基因验证了目前的微阵列结果(见附加文件1和2)。
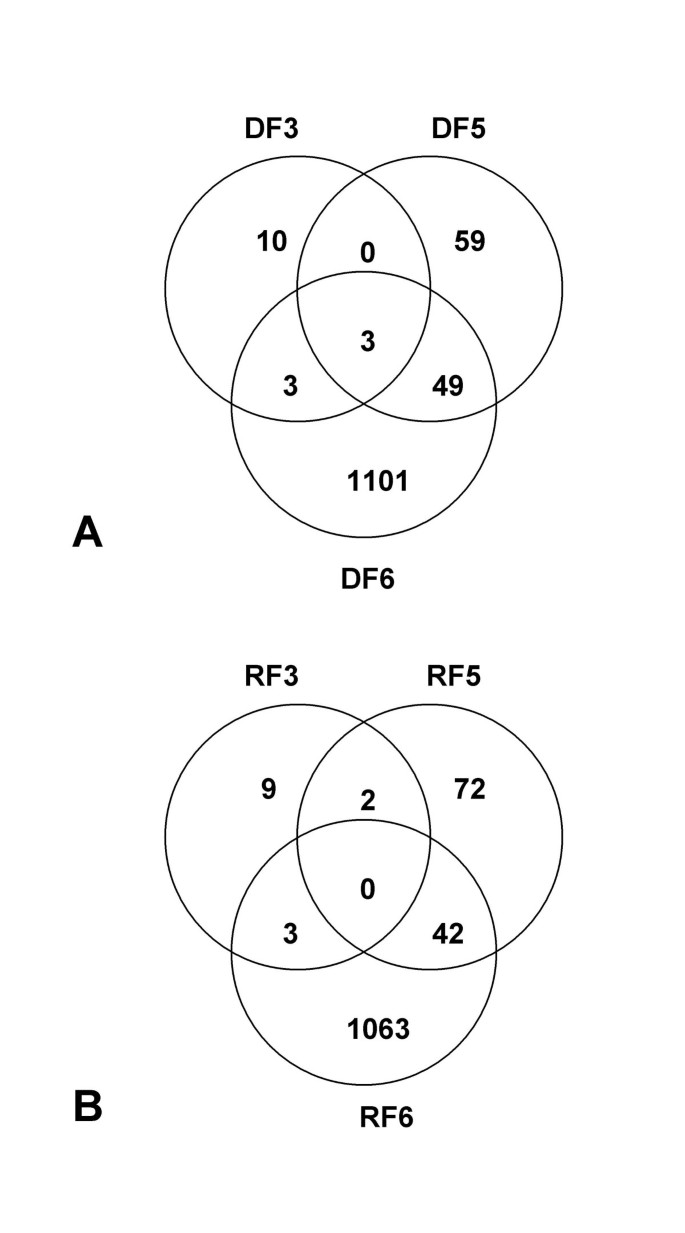
对微阵列数据进行非线性Lowess归一化处理后,进行统计分析(单样本t检验),以发现表达显著差异的基因。对每个发育阶段分别进行分析。为了尽量减少误报的数量,我们使用Benjamin-Hochberg错误发现率(FDR)来控制I型家庭错误。选择p值< 0.05的转录本具有统计学意义。由此分析,3期差异表达基因总数为29个,5期为227个,6期为2264个。这些基因在花型内部和花型之间的分布用图中所示的维恩图进行可视化3.。只有少数表达的基因在不同阶段之间共享,这表明在非洲菊花发育的非常早期阶段发生了快速的转录变化。这里所展示的实验的原始数据已存放在ArrayExpress,登录号为E-MEXP-418。
射线花和花盘花发育过程中的基因差异表达
在比较(3)中所包含的最早发育阶段,圆盘花和射线花在形态上是相似的。这反映在基因表达水平上,很少检测到变化。只有27个转录本的表达存在显著差异,p值< 0.05,倍变大于1.2(表1)。其中15种在圆盘花中表达较强,12种在射线花中表达较强。在碟状花中,大多数基因与基本代谢过程有关。在碟状花中,表达量最多的转录本之一是非洲菊植物营养储存蛋白(VSP)基因的同源体。vsp主要积累在液泡中,在氮的储存以及生物和非生物胁迫反应中具有公认的作用。在拟南芥, VSP mrna在花中高度丰富,它们在繁殖发育过程中可能有不同的作用[24,25]。非洲菊VSP同源物在第6期花盘花中也表现出明显更高的表达。在3期的射线花中,大部分上调的基因都编码了未知蛋白。然而,非洲菊的一个MADS-box基因,GRCD1,表达量更高。GRCD1曾被认为是界定非洲菊雄蕊身份所必需的[1]。
研究发现,差异表达基因的数量随着发育时间的增加而增加,与花型之间日益增加的形态差异相一致。在圆盘花中,第5期和第6期表达差异显著的基因数分别为111个和1156个,射线花中分别为116个和1108个。下面,我们将进一步讨论的范围局限于在第5和第6阶段均表现出花型特异性表达上调的基因组(表2)。在碟状花中,在第5和第6阶段有49个转录本上调(表2)。其中20个(41%)给了一个BLAST hit,而其余的功能未知。
其中一个上调最显著的基因与gdsl -脂肪酶相匹配。这些酶在拟南芥在花药形态发生过程中,花和被假设具有特定的功能[25,26]。GDSL-motif脂肪酶基因在花被片发育过程中也高度表达虹膜hollandica(27]。另一种上调的基因编码alpha-expansin,已知与生长和发育有关[28,29]。然而,最突出的一组基因是编码脂质转移蛋白的基因,它们在非洲菊中形成了一个庞大的基因家族[22]。与射线花相比,非洲菊c类MADS-box基因GAGA1在第5期和第6期的圆盘花中表达也更为丰富。
在第5和第6个阶段,射线花中42个基因的表达比圆盘花更强(表2)。其中,55%(23)具有未知的功能,许多其他的编码核糖体蛋白。在我们之前的微阵列分析中,大多数被识别的基因(36)也在早期花瓣发育过程中(在射线花中)上调[22反映出在花型分化的早期阶段花瓣发育的差异。
G0000600014B5(GEG4),是GASA蛋白家族的一员(Kotilainen,未发表的结果),除了在早期花瓣发育过程中表达外,之前还在拉长花景中被检测到[22]。G0000700014E10,被注释为多酚氧化酶前体,其在射线花原基中的表达比花盘花上调了5倍以上。多酚氧化酶(PPOs)在高等植物中普遍存在,是由于酚基物氧化而导致组织褐变的主要原因。有人认为PPOs在防御昆虫和植物病原体方面有作用,但它们也可能被机械应激激活。由金葡氨酸合成酶编码的PPO同源物已被证明在花卉着色中起作用[30.]。
转录因子基因在第5期和第6期表达差异
由于转录因子广泛调控发育的许多方面,我们更仔细地检查了这些基因。除了统计标准(p < 0.05)外,我们对差异表达的转录本使用了> 1.2的倍数变化阈值。如前所述,在第3阶段,只有MADS-box基因GRCD1在射线花中检测到的表达量高于圆盘花中相应阶段的表达量。在这两种花型中,大部分差异表达的转录相关基因都在第5和第6阶段中表达,而且表现出了阶段性的特异性表达(见表3.和4)。尤其突出的是几个同型MADS-box基因的上调,这些基因已知可以调节花的发育(下文单独讨论)。
除了MADS-box基因外,我们还发现了一个在盘花第5期差异表达的基因,编码一种可能的RING锌指蛋白。RING和变环结构域蛋白广泛存在于植物中,作为多蛋白复合体的一部分,它们参与多种细胞功能,如泛素化途径[31,32]。碟状花中上调的两个非洲菊同源体HD-ZIP因子基因与木质部特异性基因具有高度的序列相似性Zinnia线虫基因(33]以及与拟南芥REVOLUTA(牧师),电晕(中央社)基因,都是HD-ZIP III基因家族的成员[34,35]。HD-ZIP III基因在发育过程中发挥着多种作用,包括胚胎模式形成、维管束发育、叶片发育(器官极性)以及分生组织起始[35,36]。非洲菊EST数据库目前包括4个基因簇,它们与Squamosa启动子结合蛋白(sbp)和Squamosa启动子结合样蛋白(SPL)同源。其中两个基因在第6期的碟状花中上调。在拟南芥,SPL3已被证实与花的转变有关[37,38),SPL8在花粉囊发育中[39]但对其他16种基因有作用SPL基因在很大程度上仍然未知。我们还发现了两个编码YABBY转录因子的基因(G0000800003E02 G0000700008F1)。在一起KANADI的基因,淡水螯虾基因家族促进器官的背面同一性[36]。此外,与调控转录起始、染色质组装和mRNA处理相关的几个转录因子在碟状花中被上调。
在鳐花原基中,39个基因被差异上调(表4)。其中许多转录因子属于不同种类的锌指蛋白[40]。BLAST搜索表明,G0000100020B08和G0000600011G06与在玉米中鉴定的开花时间基因同源(不确定的1, (41])和拟南芥(君士坦斯例如3.)。G0000500013B9锌指样蛋白GATA1的功能作用尚不清楚。我们还发现了射线花第6阶段上调的LIM结构域蛋白同源物。我们之前已经观察到pLIM2 [22]在雄蕊发育后期上调了8倍以上。然而,植物中LIM结构域蛋白已被证明具有多种功能,包括在细胞核中的转录调节[42,43,40]。最后,在第6阶段,我们检测到由G0000600012D07,以前被孤立为GMYC1参与非洲菊花青素调控[44]。
一些MADS-box基因在射线花和花盘花发育过程中表现出差异表达
几个此前被表征的非洲菊MADS-box基因[[45,46)图5在射线花和盘状花分化的早期阶段表现出差异表达(表1,2,3.和4)。GAGA1和GAGA2c功能基因已知参与非洲菊雄蕊和心皮特性的调节[47]。GDEF1具有高度的序列相似性GDEF2,非洲菊中的另一个b功能基因,但它在系统发育上与TM6b类谱系的类基因[48]。其在非洲菊花发育过程中的作用尚未确定[45]。GRCD2是心皮识别所必需的,但该基因也控制着花分生组织识别的维持以及花序确定性[49]。以上所有基因在两性盘花中都相对于雌性射线花上调。PHEP7F1编码squamosa样基因GSQUA1(47),而G0000800002C9,在花盘花中也上调,编码一个MADS-box基因同源于菊花CDM8,属于FRUITFULL进化枝(50]。
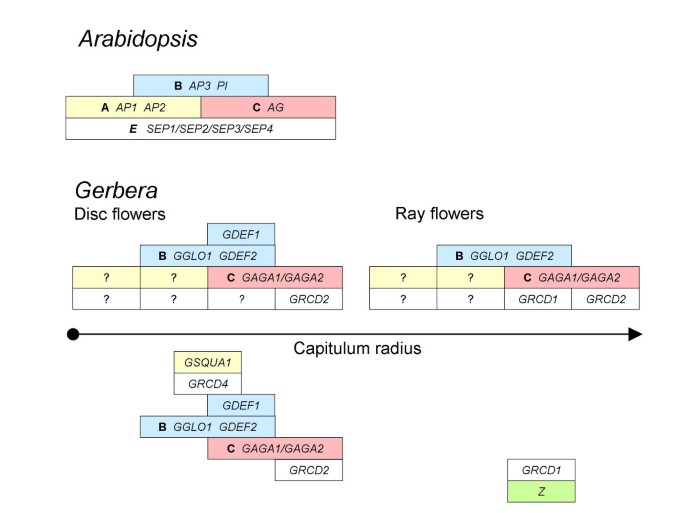
花型特异性ABC(D)E模型非洲菊。在拟南芥,基因AP1,AP2,AP3,π和AG)根据ABC模型[59]编码确定花器官身份所需的同源功能,加上这些基因,发育拟南芥花器官需要第四个功能的活动,在花发育的扩展“四边形”模型中标记为E[74],该功能由四个相关的MADS盒基因冗余编码,SEP1,SEP2,SEP3和SEP4。在非洲菊,基因GGLO1和GDEF2为B函数所必需。C函数是由两个高度相似的基因冗余编码的,GAGA1和GAGA2,但对于E功能,我们观察到之间的亚功能化9月例如基因假字。在非洲菊,GRCD1仅在边缘雌花的第3轮中需要正确的花器官鉴别。相应地,GRCD2仅心皮发育所必需,在中央盘花中观察到较强的功能丧失表型。根据这些观察,我们预测,在盘花1号和2号轮以及盘花3号轮中,仍未确定(可能是冗余的)E功能MADS盒基因是必需的。此外,我们还没有鉴定出来非洲菊该基因可能编码在1号和2号螺旋中活跃的A功能。这些旋体对异位表达的反应不同GAGA1或GAGA2,增加了A函数本身被拆分的可能性非洲菊。在我们的微阵列实验中观察到的相对MADS盒基因上调现象,沿着头状骨半径(箭头)组织,总结如下(并根据上面非洲菊圆盘和射线花ABCE模型进行格式化)。Z代表了TM3例如基因G0000100021A03。花盘花中GSQUA1和GRCD1的表达在2号和3号轮缘之间被偏移,表明其在功能方面的轮缘特异性不确定。
在射线鲜花,GRCD1,在第3阶段已经表达得更多,在第6阶段同样上调。除了GRCD1,另一个MADS-box基因,G0000100021A03,在第6阶段射线花中表达更大。G0000100021A3(包括3’ESTG0000100002C11)是一个TM3-like MADS-box基因,在我们之前的微阵列分析中显示了晚花瓣特异性表达[22]。G0000700003A3(现在叫GRCD5),该基因在鳐花中表达明显更多,在系统发育上与之前确定的非洲菊基因接近GRCD1以及拟南芥SEPALLATA3(数据没有显示)。GRCD5与的序列相似度最高CDM44菊花和FBP2佩妮的50,51]。事实上,GRCD5似乎与CDM44在系统发育分析中(数据未显示)。根据相同的系统发育分析(数据未显示),G0000200014A7(GRCD3),在射线花中转录丰富,在于AGL6进化枝(52,分组紧密地与AGL6,MDMADS11,ZAG3和ZAG5(cf。1)。G0000200001C06显示了与菊花的序列相似性CDM51和非洲菊G0000500017F4MADS-box基因,后者具有叶片特异性表达模式[22)类似于拟南芥AGAMOUS-like MADS-box蛋白质AGL12。我们使用实时逆转录酶PCR(见额外的文件2)。
非洲菊花发育过程中MADS-box基因的共表达
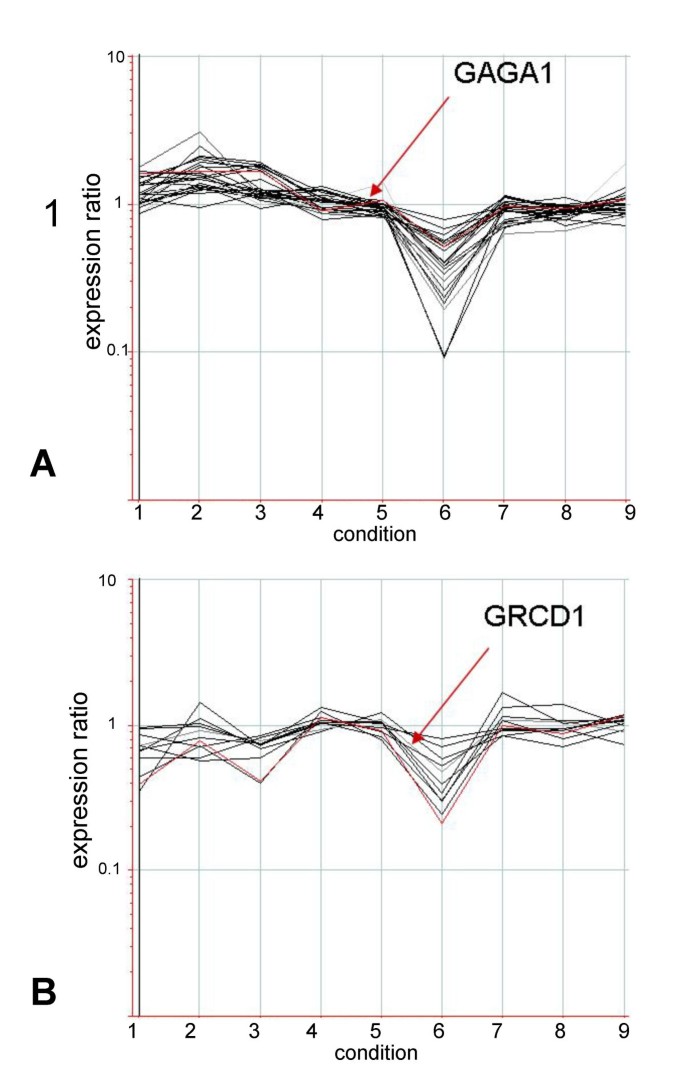
MADS结构域蛋白形成特定的同质二聚体和异质二聚体,甚至更高阶的复合体来执行其功能[53,54]。MADS结构域蛋白之间的特异性相互作用要求它们存在于相同发育阶段的相同细胞和组织中,相应的,已有研究表明,具有重叠表达模式的转录本是蛋白质相互作用伙伴的首选[55,56]。为了加强我们上述的观察并揭示非洲菊MADS-box基因的协调表达模式,我们将目前的观察结果与之前的分析相结合[22]。在一项独立的分析中,我们寻找的基因是随着GAGA1和GRCD1。GAGA1之所以选择它,是因为它在第5和第6个阶段的盘花中表达不同,而GRCD1因为它在第3阶段的鳐花中提早上调(见表1和2)。之前(22],我们使用非洲菊cDNA芯片来识别花序特异性基因,并与叶片组织进行比较,以及特定于单个生殖器官和阶段的基因(花葶、乳头刚毛、花瓣发育的早期和晚期以及雄蕊)。与这里分析的花原基发育早期阶段相比,这些样本代表了花器官发育的相对较晚阶段。采用标准相关法寻找表达相关(相关系数>0.80)的转录因子GAGA1或GRCD1在所有9种情况下(图4)。表格5总结已识别的基因。
第一组基因代表与c类基因共表达的基因GAGA1,这是唯一的MADS-box基因在第5和第6阶段的表达都有显著变化(表2和3.)。在分析包括的所有9种情况中,27个基因的表达模式类似于GAGA1。的相关性最高(0.96)GRCD2,这种产品之前已经被证明可以相互作用GAGA1利用酵母双杂化分析[49]。此外,第二个非洲菊c功能基因,GAGA2,以及b功能基因GGLO1和GDEF2,与GAGA1。GGLO1,一个与拟南芥同源的b功能基因PISTILLATA花瓣和雄蕊鉴定所需的基因[47]。还显示了在微阵列中第3和第5阶段的圆盘花特异性表达(当不应用多重检测校正时)。该结果通过实时RT-PCR(表S1b)和northern blotting(数据未显示)进行验证。功能未知的TM6例如基因GDEF1,SEPALLATA -就像基因GRCD4,GSQUA1也包括在GAGA1-共表达基因组。除了MADS-box基因外,还发现了其他几个共表达的转录因子基因,包括编码Squamosa Binding Protein Like homolog 3的基因、两个锌指蛋白和一个MYB结构域因子类似金鱼草MYB305,苯丙类途径的早期调控因子。
GRCD1,在第3阶段已经在射线花中强烈上调,并继续到第6阶段,与TM3例如MADS-box基因G0000100021A03在所有九种情况下(图4 b、表5)。两个SEPALLATA-like基因也表现出高度相关的表达模式。此外,我们还发现了一个编码MYB结构域转录因子的共表达基因PisumMYB26 [57花粉特有的LIM结构域和nam样蛋白。
讨论
无论是在菊科植物中,还是在单一基因型内具有异型花的任何其他植物中,有关花型规范的遗传机制几乎一无所知。我们已经确定了射线花和盘状花发育的早期阶段非洲菊矮牵牛研究表明,尽管两种花的花朵发育起始阶段相似,但花瓣和雄蕊发育的差异可以在花序发育的相对年轻阶段被识别出来。非洲菊花序的巨大尺寸以及数百个协调发育的花的存在,使我们能够对单个花的原基进行显微解剖,以进行RNA分离,并比较发育早期的基因表达。总的来说,我们并没有在选定的发育阶段中识别出组成性表达的基因,这表明在非洲菊射线花和碟状花发育的非常早期阶段发生了快速的转录变化。在我们的微阵列比较中,差异表达基因的数量随着发育时间急剧增加,这与扫描电镜和组织学分析所显示的形态分化有关。
在我们的实验中,我们特别关注在射线花和花盘花原基中差异表达的转录因子。花盘花的典型特征是大量的基因被认为参与了mRNA的处理和转录调控。我们还发现了一些鳞粒启动子结合蛋白同源体,它们的功能甚至在很大程度上仍不清楚拟南芥。HD-ZIP III型转录因子基因类似REVOLUTA在花盘花中也有上调。有5个基因编码HD-ZIP III因子拟南芥,Revoluta, phavoluta, phabulosa, corona,ATHB8。在胚胎发生,拟南芥HD-ZIP III三重突变体无法区分发育中的胚胎的中心区域和外围区域,这导致形成一个单一的径向对称的子叶[35]。考虑到这种在正常情况下发生的不对称中的潜在作用,我们很容易推测,确定的非洲菊HD-ZIP III因子可能在花序水平上调节对称性。在射线花中,最显著的一组上调的转录因子基因编码MADS-box调节蛋白。
雄蕊和花瓣发育的差异
在雄蕊和花瓣发育的花类型之间有明显的形态学差异(图2 b和2摄氏度)开始于第5阶段的基因可能反映了细胞分裂和延伸以及器官融合的差异。最显著的区别是鳐花中雄蕊发育的停滞。在非洲菊中也观察到,产生单性花的一个常见机制是雌性或雄性器官原基的选择性发育阻滞,这可能发生在不同物种的不同发育阶段[58]。在开花植物中区分性别的最基本基因是同型B类和c类基因,它们区分心皮和雄蕊的发育[58]。基于花发育的ABC模型,雄蕊的同一性由B类和c类MADS-box基因的活性共同决定,而c类基因的活性单独控制心皮的发育[59]。然而,对于单性花的发育将涉及B-或c功能基因表达模式的改变这一假设,几项针对euudicot物种的研究未能提供明确的支持,这表明性别决定的遗传机制必须作用于器官身份的下游[60- - - - - -64]。在非洲菊中也是如此,B和c类MADS-box基因表达的改变不太可能是鳐花雄蕊发育受阻的原因。我们的研究结果表明9月例如基因GRCD1,在射线花中高度上调,可能与花型特异性抑制雄蕊发育有关。在转基因植物的射线花中GRCD1表达下调,不育的退化雄蕊转化为花青素染色的花瓣。然而,在两性盘花中雄蕊发育只受到轻微影响,虽然没有释放出可育花粉[1]。总的来说,这些结果表明雄蕊发育的停滞与射线花和圆盘花中不同的器官特性有关。我们认为,螺纹3器官同一性的建立涉及GRCD1功能,但仅在射线花中存在。
编码MADS结构域转录因子-花型特异性调控复合物的基因差异表达
实时RT-PCR支持的微阵列数据表明,在菊科植物花序发育过程中,MADS-box蛋白可能参与了单个花类型分化所需的特定复合体。几个非洲菊MADS-box基因的差异基因表达(GGLO1,GDEF2, GAGA1,GAGA2和GRCD1)早前已通过代表本研究中使用的相同花发育阶段的北方印迹进行检测(M. Kotilainen,未发表数据)。我们在基因表达水平上观察到的定量差异可能反映了后来蛋白质-蛋白质相互作用的定性差异,从而反映了参与调节不同花型器官特征的特定蛋白质复合物的组成。由于我们的表达数据揭示了在不同非洲菊组织中表达在空间和时间上都相关的基因,我们能够假设特定的蛋白质-蛋白质相互作用,其中一些已经被酵母双杂交试验证实或得到转基因表型的支持。的综合相互作用分析拟南芥MADS-box因子表明,几乎100%的相互作用蛋白在表达模式上有重叠[56]。共表达可以作为一种可能的指示在足底互动(56]。此外,我们还发现了new的差异表达9月-like基因,在非洲菊和其他植物中显示出超出所描述的功能的多样性拟南芥(1,49,65]。数字5总结了我们目前对非洲菊器官识别基因的观点,指出(箭头上方)在转基因植物中显示花型特异性效应的特定因子[46]。
B类和c类MADS-box基因以及9月例如基因GRCD2在中央盘花中可能反映了这些基因在决定正常雄蕊和心皮同一性(心皮仅在GRCD2)。在转基因植物中,抑制B (GGLO1, GDEF2)、C (GAGA1, GAGA2)或GRCD2功能导致两种花型的表型相似[47,49]。有趣的是,的表达GSQUA1和9月例如基因GRCD4与B和c类基因表达相关。尽管其序列与拟南芥相似APETALA1,GSQUA1可能与A功能的建立无关,因为它的表达是在发育中的花的基部、花瓣中以及在头状花序的维管束发育中被检测到的[47,45]。然而,GRCD4在我们之前的微阵列研究中,在花瓣发育后期也被上调[22],表明它与B和C功能基因一起,可能编码了一种花瓣特异性基因9月基因在非洲菊。的功能GDEF1,一种在碟状花中上调的类似tm6的b级基因,则不太清楚。不像GDEF2,在花瓣和雄蕊中都有强表达,GDEF1在雄蕊中表达最多(S. Broholm,未发表的结果),表明在雄蕊发育中具有功能。矮牵牛花中高度相似的基因(PhTM6)也表现出雄蕊表达,并与矮牵牛PHGLO2多肽有很强的蛋白-蛋白相互作用[66]。在非洲菊中,酵母双杂交的结果表明,GDEF1和GDEF2都与B功能蛋白GGLO1形成异二聚体(数据未显示),而两种蛋白都不与GRCD2相互作用,其功能是心皮特异性的[49]。GRCD1和TM3例如基因G0000100021A03都在射线花中高度上调。这表明,这两个基因可能编码与雄蕊发育停滞有关的相互作用蛋白质。此外,的表达GRCD1和G0000100021A03在花器官水平上,所有9种分析的条件都是相关的,这表明它们可能有额外的功能作用,例如,在花瓣发育过程中。图中总结了盘状花和射线花中特定的上调现象5箭头下方,箭头的方向遵循头状骨半径。
MADS蛋白复合物和径向形态发生梯度
菊科植物的头状花序历来被用作研究花序分生组织发育的模型。通过损伤实验研究了花序的决定和分叶性,并从遗传学角度分析了花型特异器官的发育。这两项研究都表明了径向形态发生梯度在头状花序发育中的作用。早期向日葵花序的圆柱形损伤产生孤立的头状花序托组织栓,导致发育完整的微型头状花序嵌在更大的头状花序中[67,68]。因此,径向组织的向日葵花托可以通过破坏细胞-细胞之间的通信而重置为进一步的径向模式区域。向日葵生殖性状的遗传研究Microseris也建议细胞-细胞放射状通讯。毛状和黄色瘦果(果实)性状均在MicroserisCapitula,虽然它们是独立调控的[69]。在检测的菌株中,毛状瘦果(由至少两种基因控制)始终位于光滑瘦果的外围,并且有一个重叠区域(“半毛状”瘦果),在这个区域中,单个细胞似乎对一个定义梯度有专门的反应。黄色瘦果性状也表现为径向分带,其程度在不同菌株之间有所不同Microseris为两个黄色瘦果等位基因分离的品系。巴赫曼及其同事[70,69]假设,负责外围毛瘦果的基因参与了径向形态发生梯度的建立,而黄色瘦果的等位基因对这种梯度有不同的响应阈值。
只要反馈回路是非线性的,就可以通过短范围激活和长范围抑制的简单阈值模型来建立具有明显模式效应的形态发生梯度,例如非洲菊中的射线花和反花盘花的产生[71]。非线性关系的一个例子是抑制激活蛋白,它必须作为二聚体发挥作用。MADS结构域蛋白形成特定的同型和异型二聚体,甚至更高阶的复合体来执行其功能[53,54]。长程(非细胞自主)抑制剂可能是一种扩散的小分子量化合物,但也已证明植物转录因子蛋白,包括金鱼草属植物MADS结构域因子DEF和GLO本身,可以通过胞间连丝移动并非细胞自主作用[72,73]。MADS多聚体的产生将显著增加对形态发生梯度的可能响应。总之,MADS蛋白系统可以提供一个简单的数值支架(二聚体、多聚体),在此基础上通过沿半径的差异调节产生大量的细胞、组织和器官多样性。这在单个花分生组织的轮状结构的发展中得到了很好的表现,但推而广之,同样的一般径向梯度机制可能在花序水平上起作用,正如之前对向日葵和Microseris。因为我们已经发现不同的MADS结构域蛋白在非洲菊的射线花和圆盘花中有不同的表达(图。5),我们假设对菊科头状花序的发育控制可能不仅仅是它所相似的单花的简单类似物。MADS-box基因对候选梯度建立分子的转录响应的花/花序比较研究,以及在活的有机体内蛋白质-蛋白质相互作用,可以帮助检验这一假设。如果得到证实,那么还需要进一步证明,非洲菊是否可能获得了类似花朵的发育调节,或者它们的浓缩结构是否使更一般的模式更容易被检测。
结论
菊科植物花型分化的遗传机制尚不清楚。我们利用非洲菊花序的大尺寸特性,对发育中的射线花和盘状花原基进行了形态学表征。虽然单个花类型的发育开始相似,但在相对早期的阶段观察到花瓣和雄蕊的发育差异。利用非洲菊cDNA微阵列进行的全局基因表达分析表明,快速的转录变化与不同花型的形态分化相关。最有趣的是,我们发现了几个编码MADS域转录因子的基因,这些基因在射线花和花盘花原基中有差异表达。我们假设,发现的定量和定性表达差异反映了通过头状花序径向形态发生梯度的控制,这可能导致特定的MADS蛋白复合物的形成,调节单个花类型的分化。基于共表达,我们提出了几个MADS-box转录因子的功能假设,这些转录因子将在蛋白质-蛋白质相互作用研究和使用转基因非洲菊植物中进一步得到验证。
方法
扫描电子显微镜(SEM)
年轻的花序被固定,在临界点干燥装置中干燥,并涂上铂/钯[49]。在赫尔辛基大学生物技术研究所的电子显微镜实验室,通过扫描电子显微镜(蔡司DSM 962)对样本进行了检查。
光学显微镜
幼小的花序被固定在FAA(50%乙醇,5%乙酸,2%甲醛)中,通过乙醇系列转移到100%二甲苯中。样品用石蜡包埋,切成10 μm截面。组织学染色用二甲苯去除石蜡,切片用藏红花素(1%在水中)和苯胺蓝(1%在50%乙醇中)染色。在光学显微镜(Olympus CX41)下观察切片并拍照。
样本采集和RNA分离
射线花和圆盘花的花原基在立体显微镜下用手术刀分离,立即存放在液氮中。用Trizol试剂(Invitrogen, Carlsbad CA, USA)按比例缩小的协议分离RNA。收集了至少10个花序,每个花序包含数百个原基,并将其聚集在一起,用于每个阶段的RNA分离。每个池中包含超过1000个独立的花原基。收集样本是为了尽量减少样本之间的生物变异,而不是真正的生物重复,因为材料数量有限,这不是一个选择。每个实验都包括至少两个RNA分离物,并将其汇集在一起。RNA的质量和产量由Agilent 2100生物分析仪(Agilent Technologies, Waldbronn, Germany)使用RNA 6000 Nano LabChip进行分析®kit (Agilent Technologies, Waldbronn, Germany)和RNA 6000 ladder (Ambion, Austin, TX, USA)。
微阵列实验
微阵列实验遵循MIAME标准,可以在ArrayExpress数据库中查看。从2 μg总RNA开始,使用氨基烯丙基信息扩增试剂盒(Ambion, Austin, TX, USA)对样本进行扩增和标记。如前所述,在这个总RNA样本中,几个RNA分离物被聚集在一起。总RNA是从花原基池中分离出来的。当需要多次扩增才能获得足够的扩增RNA (aRNA)时,会进行多次扩增并汇集在一起。对于一次杂交,7.5 μg aRNA进一步用Cy3或Cy5荧光染料标记(Amersham Biosciences, Little Chalfont白金汉郡,英国)。对于每个发育阶段,包括4个技术重复,其中2个进行染料交换。在实践中,每个发展阶段都要进行几次杂交,选择用于分析的4个技术重复都是高质量的。预杂交、杂交和洗涤遵循之前的协议[22]。杂交后,用GSI Lumonics ScanArray 5000 (Packard/Perkin Elmer)扫描第3和第5阶段的幻灯片,用Genetix 5000 AL扫描仪(Genetix, New Milton, Hampshire, UK)扫描第6阶段的幻灯片,生成两张灰度TIFF图像。在GSI Lumonics ScanArray中,为了调整两个通道,激光功率被改变,而在Genetix 5000中,激光值保持在100%,PMT增益被改变,以调整两个通道。在所有情况下,分辨率均为10 μm。
微阵列数据分析
所有实验均采用Genepix pro 5.0(美国Axon Instruments)进行斑点定位和强度值量化。使用局部特征背景中值来减去背景噪声,并从进一步的分析中过滤出视觉缺陷点。使用GeneSpring 7.2 (Silicon Genetics)对数据进行归一化和过滤。由于数据的非线性,采用了Lowess归一化。将背景信号高于表达信号的特征排除在进一步分析之外。在此之后,进行以下统计分析,以找到四个重复的两个样本之间表达水平显著改变的转录本。使用单样本t检验对数据进行过滤。为了找到差异表达的基因,对每个发育阶段(3、5和6)分别进行t检验。通过控制I型家族误差的Benjamini和Hochberg错误发现率方法调整p值进行多次比较,选择p值修正< 0.05的基因作为具有统计学意义的基因。在这里,使用单样本t检验,我们可以选择在圆盘花和射线花之间差异表达的基因,因为从两种花类型中提取的RNA在同一芯片上杂交。 Therefore, when the t-test p-value was non-significant, the gene was not differentially expressed, and it was excluded from further analysis. Furthermore, in addition to the p-value criterion a transcript had to show more than 1.2-fold change in order to be considered as differentially expressed.
对与GAGA1和GRCD2共表达转录本的数据挖掘
来自这里报道的实验的3个条件,stage 3, 5和6,与之前完成的6个微阵列比较合并[22,形成一个包含9个条件的组合数据集。之前进行的6个条件包括各种花器官(花瓣发育早期和晚期、乳突刚毛、雄蕊和花葶)的基因表达分析,并与汇集的参考样本进行比较。同时也包括了花序样本与叶片样本的比较。这些实验已在[22数据可在ArrayExpress数据库中通过E-MEXP-206和E-MEXP-207获得。所有9个条件的数据合并后,在genesspring 7.2 (Silicon Genetics)中使用Lowess归一化对实验进行归一化。以不同条件下表达模式的相似性作为共表达的标准,并在GeneSpring中使用标准相关计算。在数学上,标准相关与Pearson相关非常相似,但它测量的是表达向量在0附近的角分离,而不是在1附近。对类“转录”进行了功能注释的转录本被包括在分析中。与微阵列探针GAGA1(在圆盘花中高度上调)或与GRCD1(在射线花中高度上调)的相关系数大于0.80的转录本被认为表达相似。
实时rt - pcr
总共20个打印在非洲菊cDNA芯片上的转录本,通过实时RT-PCR进一步验证。总RNA (1.5 μg)使用TaqMan反转录试剂盒(Applied Biosystems, Roche Molecular Systems Inc., New Jersey, USA)进行cDNA合成,5 μl cDNA作为模板进行PCR反应。引物使用PrimerExpress软件(Applied Biosystems, Foster City, CA, USA)设计。使用ABI 7700序列检测系统(Applied Biosystems, Foster City, CA, USA)循环条件默认,使用50 nM的引物进行三次PCR。泛素作为标准,对原始阈值(Ct)进行归一化处理,以得到?Ct值(归一化Ct值)。用真实的表达值计算表达比,而真实的表达值又由公式2计算出来ΔCt。每个板块都包含单独的泛素标准。。
加入数据
本文中使用的微阵列阵列设计可以在array - express中找到http://www.ebi.ac.uk/arrayexpress注册号为A-MEXP-244和A-MEXP-249,实验数据注册号为E-MEXP-418。先前的微阵列结果[22,包含在本文的分析中,可以在E-MEXP-206和E-MEXP-207条目下查看。本文的EST序列数据可在EMBL/GenBank数据库中找到,登录号为AJ750001-AJ766994。EST序列数据和注释也可在OpenSputnik数据库中找到http://sputnik.btk.fi而在http://www.pgn.cornell.edu
参考文献
- 1.
Kotilainen M、Elomaa P、Uimari A、Albert VA、Yu D、Teeri TH:GRCD1,一个AGL2类MADS box基因,参与雄蕊发育过程中的C功能非洲菊矮牵牛。植物细胞,2000,12:1893-1902。10.1105 / tpc.12.10.1893。
- 2.
Kloos WE, George CG, Sorge LK:花型的遗传非洲菊矮牵牛。中国科学(d辑:自然科学版)。
- 3.
Albert VA, Gustafsson MHG, Di Laurenzio L:个体发生系统学,分子发育遗传学,和被子植物花瓣。In Molecular Systematics of Plants II编辑:Soltis P, Soltis D, Doyle J. Boston: Kluwer Academic Publishers;1998:349-374。
- 4.
Coen E, Nugent JM:花和花序的进化。发展1994:107 - 116。
- 5.
Bremer K:菊科:枝系和分类。或者:波特兰木材出版社;1994.
- 6.
Gillies ACM, Cubas P, Coen ES, Abbott RJ: Asteraceae中制造射线:辐射状与盘状头状花的遗传和进化。在发育遗传学和植物进化编辑:Cronk QCB, Bateman RM, Hawkins JA。伦敦:Taylor & Francis;2002: 233 - 246。
- 7.
Baldwin BG:蛇形特有草本植物的起源Layia discoidea从广泛的l . glandulosa(菊科)。进化,2005,59:2473-2479。
- 8.
Abbott RJ, Ashton PA, Forbes DG:辐射状地菊的渐渗起源狗舌草寻常的varhibernicus赛姆:Aat-3证据。遗传,1992,68:425-435。
- 9.
HP:杂草进化过程中的主要基因效应:表型性状与射线小花位点的等位基因共分离狗舌草寻常的l .(菊科)。中华植物学报,1998,89:54-61。10.1093 / jhered / 89.1.54。
- 10.
Andersson S: Senecio jacobaea (Asteraceae)花变异的适应度后果:来自分离杂交种群和资源操纵实验的证据。中国植物学报,2001,27(4):394 - 394。10.1006 / bijl.2001.0559。
- 11.
Abbott RJ, James JK, Milne RI, Gillies AC:植物引种、杂交和基因流。Philos Trans R Soc Lond B Biol science . 2003, 358: 1123-1132。10.1098 / rstb.2003.1289。
- 12.
罗D, Carpenter R, Vincent C, Copsey L, Coen E: Antirrhinum花不对称的起源。《自然》,1996,383:794-799。10.1038 / 383794 a0。
- 13.
Cubas P, Lauter N, Doebley J, Coen E: TCP结构域:在调节植物生长发育的蛋白质中发现的基序。植物学报,1999,18:215-222。10.1046 / j.1365 - 313 x.1999.00444.x。
- 14.
Citerne HL, Moller M, Cronk QCB:与花对称相关的苦苣苔科摆线状基因的多样性。安Bot (Lond)。2000年,86:167 - 176。10.1006 / anbo.2000.1178。
- 15.
Hegarty MJ, Jones JM, Wilson ID, Barker GL, Coghill JA, Sanchez-Baracaldo P, Liu G, Buggs RJA, Abbott JA, Edwards KJ, Hiscock SJ:开发匿名cDNA微阵列来研究对千里光杂交形成过程中的花转录组。分子生态学报,2005,14:2493-2510。10.1111 / j.1365 - 294 x.2005.02608.x。
- 16.
Buzgo M, Soltis DE, Soltis PS, Ma H:朝着花发育的形态和遗传研究的全面整合。植物科学进展,2004,9:164-173。10.1016 / j.tplants.2004.02.003。
- 17.
爱尔兰VF, Litt A:花的发育和进化:基因复制、多样化和重新部署。Curr Opin Genet Dev. 2005, 15: 454-60。10.1016 / j.gde.2005.06.001。
- 18.
杰克·T:花控制的分子和遗传机制。植物细胞,2004,16:S1-S17。10.1105 / tpc.017038。
- 19.
Doebley J, Stec A, Hubbard L:玉米顶端优势的进化。自然,1997,386:485-488。10.1038 / 386485 a0。
- 20.
He C, Saedler H: MPF2的异位表达是茄科形态新种Physalis中国灯笼进化的关键。中国植物科学学报,2005,32(5):593 - 593。10.1073 / pnas.0501877102。
- 21.
Jaramillo MA, Kramer EM: APETALA3和PISTILLATA同源物在植物特有的花被中表现出新颖的表达模式马兜铃(马兜铃科)。进化与发展,2004,6:449-458。10.1111 / j.1525 - 142 x.2004.04053.x。
- 22.
Laitinen RAE, Immanen J, Auvinen P, Rudd S, Alatalo E, Paulin L, Ainasoja M, Kotilainen M, Koskela S, Teeri TH, Elomaa P:花转录组分析揭示了与花器官分化相关的新的调控因子或器官决定和基因家族非洲菊矮牵牛(菊科)。Genome Res. 2005, 15: 475-486。10.1101 / gr.3043705。
- 23.
Helariutta Y, Kotilainen M, Elomaa P, Teeri TH:非洲菊矮牵牛(菊科)在花序发育过程中对二氢黄酮醇-4-还原酶基因进行了几个解剖层面的调控。植物生物学杂志,1995,28:935-941。10.1007 / BF00042077。
- 24.
Utsugi S,坂本W,村田M,茂丰石F:拟南芥营养储存蛋白(VSP)基因:基因组织和组织特异性表达。植物生物学杂志,1998,38:565-576。10.1023 /: 1006072014605。
- 25.
Hu W, Wang Y, Bowers C, Ma H:植物花表达cdna的分离、序列分析和表达研究拟南芥。植物分子生物学,2003,53:545-563。10.1023 / B: PLAN.0000019063.18097.62。
- 26.
Nakayama N, Arroyo JM, Simorowski J, May B, Martienssen R, Fukuchi-Mizutani M, Ueda T, Nakao M, Tanaka Y, Kusumi T, nisino T:基因陷阱线定义了基因调控的区域拟南芥花瓣和雄蕊。植物细胞,2005,17:2486-2506。10.1105 / tpc.105.033985。
- 27.
van Doorn WG, Balk PA, van Houwelingen AM, van Houwelingen, Hoeberichts FA, Hall RD, Vorst O, van der Schoot C, van Wordragen MF:开花和衰老过程中的基因表达in .爱尔兰花。植物生物学杂志,2003,53:845-863。10.1023 / B: PLAN.0000023670.61059.1d。
- 28.
Li Y, Jones L, McQueen-Mason S: Expansins和细胞生长。植物生物学杂志,2003,6:603-610。10.1016 / j.pbi.2003.09.003。
- 29.
Choi D, Lee Y, Cho HT, Kende H:调控扩张素基因表达影响转基因水稻植株的生长发育。植物细胞学报,2003,15:1386-1398。10.1105 / tpc.011965。
- 30.
中山T, Yonekura-Sakakibara K,佐藤T,菊池S,福井Y,福井水谷M,上田T,中尾M,田中Y,草umi T,西野T: Aureusidin synthase:负责花着色的多酚氧化酶同源物。《科学》2000,10:1163-1166。10.1126 / science.290.5494.1163。
- 31.
Jensen RB, Jensen KL, Jespersen HM, Skriver K:高度保守的RING-H2锌指motif在模型植物中广泛存在拟南芥。FEBS Lett. 1998, 436: 283-287。10.1016 / s0014 - 5793(98) 01143 - 0。
- 32.
Greve K, La Cour T, Jensen MK, Poulsen FM, Skriver K:植物RING-H2与植物特异性NAC的相互作用(南/ ATAF1/2 / CUC2)蛋白:RING-H2分子特异性和细胞定位。中国生物医学工程学报,2003,38(4):369 - 371。10.1042 / BJ20021123。
- 33.
Ohashi-Ito K, Demura T, Fukuda H:油菜素类固醇对新型百日草未成熟木质部特异性HD-Zip III同源盒基因转录本积累的促进作用。植物细胞生理学报,2002,43:1146-1153。10.1093 /卡式肺囊虫肺炎/ pcf135。
- 34.
Green KA, Prigge MJ, Katzman RB, Clark SE: CORONA,拟南芥III类同源域-亮氨酸拉链基因家族成员,调节干细胞规格和器官发生。植物细胞,2005,17:691-704。10.1105 / tpc.104.026179。
- 35.
Prigge MJ, Otsuga D, Alonso JM, Ecker JR, Drews GN, Clark SE: Class III homeodomain-亮氨酸拉链基因家族成员在拟南芥发育过程中具有重叠、拮抗和截然不同的作用。植物细胞,2005,17:61-76。10.1105 / tpc.104.026161。
- 36.
Engström EM, Izhaki A, Bowman JL: Promoter bashing, microRNAs,和诺克斯基因。拟南芥侧器官极性建立的新见解、调控因子和调控靶点。植物生理学报,2004,35:685-694。10.1104 / pp.104.040394。
- 37.
Cardon G, Höhmann S, Nettesheim K, Saedler H, Huijser P:的功能分析拟南芥SBP-box基因SPL3:一种参与花转变的新基因。植物学报,1997,12:367-377。10.1046 / j.1365 - 313 x.1997.12020367.x。
- 38.
Cardon G, Höhmann S, Klein J, Nettesheim K, Saedler H, Huijser P:拟南芥SBP-box基因。基因,1999,237:91-104。10.1016 / s0378 - 1119 (99) 00308 - x。
- 39.
Unte US, Sorensen A-M, Pesaresi P, Gandikota M, Leister D, Saedler H, Huijser P:SPL8,一个影响拟南芥花粉囊发育的SBP-box基因。植物细胞,2003,15:1009-1019。10.1105 / tpc.010678。
- 40.
Takatsuji H:植物中的锌指转录因子。细胞分子生命科学,1998,54:582-596。10.1007 / s000180050186。
- 41.
Kozaki A, Hake S, Colasanti J:玉米ID1开花时间调节剂是一种锌指蛋白,具有新颖的DNA结合特性。核酸学报,2004,32:1710-1720。10.1093 / nar / gkh337。
- 42.
Eliasson A, Gass N, Mundel C, Baltz R, Krauter R, Evrard JL, Steinmetz A:开花植物LIM蛋白基因家族的分子和表达分析。分子生物学杂志,2000,264:257-267。10.1007 / s004380000312。
- 43.
Mundel C, Baltz R, Eliasson Å, Bronner R, Grass N, Kräuter R, Evrard J-L, Steinmetz A:来自向日葵的一个limi结构域蛋白定位于多种组织的细胞质和/或细胞核,并与分裂细胞中的phragmoplast相关。植物分子生物学杂志,2000,42:291-302。10.1023 /: 1006333611189。
- 44.
Elomaa P、Mehto M、Kotilainen M、Helariutta Y、Nevalainen L、Teeri TH: bHLH转录因子介导二氢黄酮醇-4-还原酶上的器官、区域和花型特异性信号(dfr)在花序中的基因表达非洲菊矮牵牛(菊科)。植物学报,1998,16:93-100。10.1046 / j.1365 - 313 x.1998.00273.x。
- 45.
Teeri TH, Albert VA, Elomaa P, Hämäläinen J, Kotilainen M, Pöllänen E, Uimari A:非abc MADS-box基因参与决定雄蕊和心皮的同源性非洲菊矮牵牛(菊科)。在Developmental Genetics and Plant Evolution Edited by: Cronk QCB, Bateman RM, Hawkins JA.London: Taylor & Francis; 2002: 220-232.
- 46.
Teeri TH, Kotilainen M, Uimari A, Ruokolainen S, Ng YP, Malm U, Pöllänen E, Broholm S, Laitinen R, Elomaa P, Albert VA:花发育遗传学非洲菊(菊科)。难以机器人Res。
- 47.
Yu D, Kotilainen M, Pöllänen E, Mehto M, Elomaa P, Helariutta Y, Albert VA, Teeri TH:在非洲菊矮牵牛(菊科)。植物学报,1999,17:51-62。10.1046 / j.1365 - 313 x.1999.00351.x。
- 48.
Kim S, Yoo M-J, Albert VA, Farris JS, Soltis PS, Soltis DE:被子植物中b功能MADS-box基因的系统发育和多样化:一种2.6亿年前复制的进化和功能含义。中国植物学报,2004,29(5):593 - 593。
- 49.
Uimari A, Kotilainen M, Elomaa P, Yu D, Albert VA, Teeri TH:通过A .整合生殖分生组织命运SEPALLATA例如MADS-box基因。中国生物医学工程学报,2004,29(4):359 - 359。10.1073 / pnas.0406844101。
- 50.
Shchennikova AV、Shulga OA、Immink R、Skryabin KG、Angenent GC:四个菊MADS-box基因的鉴定与表征,属于APETALA1 / FRUITFULL和SEPALLATA3亚科。植物生理学报,2004,34:1632-1641。10.1104 / pp.103.036665。
- 51.
Angenent GC, Busscher M, Franken J, Mol JNM, Van Tunen AJ:两个MADS Box基因在野生型和突变型矮牵牛花中的差异表达。《植物细胞》1992,8:983-993。10.1105 / tpc.4.8.983。
- 52.
Zahn LM, Kong H, Leebens-Mack JH, Kim S, Soltis PS, Landherr LL, Soltis DE, DePamphilis CW, Ma H: MADS-box基因SEPALLATA亚家族的进化:在被子植物历史中具有多重复制的前被子植物起源。遗传学,2005,4:2209-2223。10.1534 / genetics.104.037770。
- 53.
Egea-Cortines M, Saedler H, Sommer H: MADS-box蛋白SQUAMOSA, delimens和GLOBOSA之间的三元复合体形成参与了在金鱼草majus。Embo j . 1999, 18: 5370-5379。10.1093 / emboj / 18.19.5370。
- 54.
Honma T, Goto K: MADS-box蛋白复合物足以将叶片转化为花器官。自然,2001,409:525-529。10.1038 / 35054083。
- 55.
Immink RGH, Ferrario S, Busscher- lange J, Kooiker M, Busscher M, Angenent GC:矮牵牛MADS-box转录因子家族分析。Mol Genet Genomics, 2003, 268: 598-606。
- 56.
de Folter S, Immink RGH, Kieffer M, Paøenicová L, Henz SR, Weigel D, Busscher M, Kooiker M, Colombo L, Kater MM, Davies B, Angenent GC:拟南芥MADS盒转录因子综合相互作用图谱。植物细胞,2005,17:1424-1433。10.1105 / tpc.105.031831。
- 57.
Uimari A, Strommer J: Myb26:豌豆花中的一种myb样蛋白,对苯丙类基因启动子具有亲和力。植物学报,1997,12:1273-1284。10.1046 / j.1365 - 313 x.1997.12061273.x。
- 58.
Grant S, Houben A, Vyskot B, Siroky J, Pan W-H, Macas J, Saedler H:开花植物性别决定的遗传学。Dev Genet, 1994, 15: 214-230。10.1002 / dvg.1020150304。
- 59.
Coen ES, Meyerowitz EM: The warof The whls:控制花发育的基因相互作用。《自然》1991,353:31-37。10.1038 / 353031 a0。
- 60.
Hardenack S, Ye D, Saedler H, Grant S:雌雄异株植物白campion雌雄花发育过程中MADS box基因表达的比较。《植物细胞》1994,6:1775-1787。10.1105 / tpc.6.12.1775。
- 61.
Perl-Treves R, Kahana A, Rosenman N, Xiang Y, Silberstein L:黄瓜(Cucumis sativus L.)雌雄花中多个agamus -like基因的表达。植物细胞生理学报,1998,39:701-710。
- 62.
Kater MM, Franken J, Carney KJ, Colombo L, Angenent GC:雌雄同株种黄瓜的性别决定仅限于特定的花轮盘。植物细胞,2001,13:481-493。10.1105 / tpc.13.3.481。
- 63.
朴jh,石川Y,吉田R,菅野A,龟谷T:表达的AODEF,一个b功能MADS-box基因,存在于雌雄异株物种的雄蕊和内花被中AsparagusofficinalisL. Plant Mol Biol. 2003, 51: 867-875。10.1023 /: 1023097202885。
- 64.
Ainsworth C, Rahman A, Parker J, Edwards G: Rumex acetosa的双性花序表明每一朵花的性别决定是独一无二的。植物学报,2005,25(5):711-720。10.1111 / j.1469-8137.2005.01281.x。
- 65.
Malcomber ST, Kellogg EA:异质表达模式和分离的作用SEPALLATA基因绿叶船体STERILE1在草。植物细胞,2004,16:1692-1706。10.1105 / tpc.021576。
- 66.
Vandenbussche M, Zethof J, Royaert S, Weterings K, Gerats T:复制b类异质二聚体模型:在佩妮矮牵牛花的发育。植物细胞,2004,16:741-754。10.1105 / tpc.019166。
- 67.
Hernandez LF, Palmer JH:花托圆柱形损伤后的向日葵头状骨再生。中华医学杂志1998,75:1253-1261。10.2307 / 2444447。
- 68.
Palmer JH, Marc J:在向日葵花序发育过程中,伤口诱导总苞片和小花的启动。植物细胞生理学报,1982,23:1401-1409。
- 69.
Bachmann K:开花植物的进化遗传学和形态发生的基因控制。《进化生物学》1983,16:157-208。
- 70.
Mauthe S, Bachmann K, Chambers KL, Price HJ:两个果实性状对发育调控的独立响应Microseris douglasii(菊科Lactuceae)。《经验》1984,40:1280-1281。10.1007 / BF01946674。
- 71.
Meinhardt H:形态发生梯度控制下的空间依赖性细胞决定。中国生物医学工程杂志,1998,27(4):394 - 394。10.1016 / 0022 - 5193(78) 90078 - 4。
- 72.
Perbal M-C, horon G, Saedler H, Schwarz-Sommer Z:非细胞自主功能金鱼草属植物植物蛋白质同源转化DEFICIENS和GLOBOSA是通过细胞间的极性迁移而产生的。发展,1996,122:3433-3441。
- 73.
会议A, Yanofsky MF, Weigel D:花转录因子leaf和APETALA1的细胞-细胞信号传递和运动。科学通报,2000,289:779-781。10.1126 / science.289.5480.779。
- 74.
Theiâen G:花器官身份的发展:来自MADS家的故事。《植物生物学》,2001,4:75-85。10.1016 / s1369 - 5266(00) 00139 - 4。
确认
我们感谢赫尔辛基大学生物技术研究所电子显微镜组和微阵列实验室提供的实验室设施。特别感谢微阵列设施负责人Petri Auvinen博士在这项工作期间的指导。来自赫尔辛基大学生物芯片中心(Biomedicum Biochip Center)的Outi Monni博士为打印微阵列幻灯片而受到感谢。感谢芬兰IT科学中心(CSC)的Jarno Tuimala对微阵列数据的统计分析提出了宝贵意见。我们感谢Anu Rokkanen在非洲菊实验室提供的技术帮助,以及Sanna Peltola在温室中照料植物。感谢弗雷德里克·斯托达德博士修改了语言。这项工作得到了芬兰学院的支持(为体育拨款104608)。R. Laitinen得到了Viikki生物科学研究生院的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
RAEL和PE构思并设计了实验。RAEL和SB进行了实验。RAEL对数据进行了分析。THT和PE贡献了试剂。RAEL、VAA和PE起草了手稿。所有作者阅读并批准了最终稿。
电子辅料
12870 _2006_119_moesm1_esm.doc
附加文件1:表A1。对随机选择的12个转录本进行实时RT-PCR分析,验证微阵列结果。(DOC 56 KB)
12870 _2006_119_moesm2_esm.doc
附加文件2:表A2。对碟状花和射线花原基不同发育阶段的8个MADS-box基因进行实时RT-PCR分析,验证微阵列结果。(DOC 56 KB)
图片作者提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用署名许可(https://creativecommons.org/licenses/by/2.0),它允许在任何媒介中不受限制地使用、分发和繁殖,只要适当地引用原始作品。
关于这篇文章
引用这篇文章
莱蒂宁,r.a.,布罗霍姆,S.,艾伯特,退伍军人et al。MADS-box基因表达模式标志着花型发育非洲菊矮牵牛(菊科)。BMC植物杂志6,11(2006)。https://doi.org/10.1186/1471-2229-6-11
收到了:
接受:
发表:
关键字
- 阀瓣花
- 雄蕊发展
- 花原基
- 花瓣发展
- 营养贮藏蛋白质