摘要
背景
红皮葡萄果实着色主要是由花青素色素引起的。我们分析了9个品种的面板,包括浆果颜色的极端表型,从绿色(缺乏花青素)到红色、紫色、紫色和蓝色。黄酮羟化酶花青素通路6个基因的表达(F3H)、类黄酮3’-羟化酶(F3'H)、类黄酮3',5'-羟化酶(F3’5是什么), UDP-glucose: flavonoid-3 -O葡糖基转移酶(UFGT)、谷胱甘肽-年代转移酶(销售税),O甲基转移酶(OMT)和四个转录因子(MybA,MybB,MybC,MybD)采用RT-PCR定量分析了从成熟前到完全成熟的四个发育阶段,并与花青素代谢产物进行了比较。
结果
成熟期总花青素含量与累积表达量有良好的相关性F3H,UFGT而且销售税在成熟。最后两个基因的转录本在绿色皮肤的品种“苏维尼奥纳斯”(Sauvignonasse)中不存在,也被称为“Tocai friulano”,而在淡红色品种中,如“灰比诺”和“Gewürztraminer”,与全颜色品种相比,其数量至少少10倍。三羟基花青素(飞燕草素、飞燕草素和malvidin)在紫色和蓝色深色浆果品种中的优势与较高的比例有关F3’5是什么/ F3'H与红皮肤品种相比,转录。更高水平的OMT在积累甲氧基型花青素的品种的浆果中,观察到转录本比非甲氧基型花青素更丰富。
结论
葡萄浆果的颜色变化符合一整套花青素基因的基因型特异性表达的特殊模式,并具有直接的转录-代谢-表型关系。结构基因的累积mRNA水平及其在成熟过程中的相对丰度可以解释本身果实成熟时葡萄花青素含量、花青素组成、颜色强度和色相的最终表型。
背景
花青素生物合成的调控已经在许多开花植物中进行了研究,这要归功于颜色突变体的可用性,这些突变体促进了复杂调控网络的解剖。许多研究主要集中在观赏植物花器官颜色表型的遗传控制上金鱼草majus而且佩妮×矮牵牛)或在玉米和种子被盖拟南芥,使我们对这些植物花青素调控的共同特征和种特异性特性有了全面的认识[1- - - - - -6].在果树中,越桔花青素色素沉着存在与否的遗传学已得到阐明。7],葡萄藤[8,9]和苹果[10].然而,有关水果中花青素的定量和定性变化以及由此导致的颜色变化的研究,仅通过单独分析单个基因的作用,触及了调控网络的表面[11- - - - - -13]或单一转录因子[14,15].
葡萄是一种水果作物,在浆果颜色上有广泛的表型变异。植物对不同环境的适应和几个世纪的人类选择产生了许多基因型,其中红色的强度和色调变化很大。花青素含量的变化和不同花青素的相对比例的混合可以产生极端表型的皮肤色素沉着。表皮细胞中的花青素浓度与浆果颜色的深浅有很好的相关性。根据[16],花青素浓度为6.2 ~ 26 mg kg-1一组64个有色品种的浆果。花青素的轮廓和色调也可能有显著的变化。我们先前已经证明,蓝色三羟基化花青素与红色二羟基化花青素的比例受类黄酮3'(5')-羟基化酶基因的转录控制(F3'H而且F3’5是什么),这与梅洛品种在整个成熟过程中颜色的演变有很好的相关性[11].迄今为止研究的所有红色品种都能合成所有五种葡萄花青素(花青素、芍药苷、飞燕苷、芍药苷和麦芽糖苷)[16,17].这意味着所有品种都表现出功能性F3'H而且F3’5是什么3'4'-OH和3'4'5'-OH花青素的合成基因O-methyltransferases (OMT)用于初级花青素的甲基化。这些基因,以及核心通路的其他关键基因,被认为在不同的遗传背景下受到不同的调控。我们旨在解决的生物学问题是:成熟水果中花青素生物合成的大多数调控是否发生在转录水平,与发生在其他物种中色素器官(而不是水果)的方式相似?结构基因表达的不同模式是否足以解释观察到的每个品种特有的对比色表型的变化?
葡萄品种间红到蓝的颜色变化具有令人着迷的进化、技术和健康意义。一般认为,红色是植物中合成花青素的生殖器官的最原始形式。花青素大约出现在1.2亿年前[18,19]自然地用于种子散布剂的招募和紫外线防护。与玫瑰和康乃馨不同的是,包括葡萄藤在内的大多数物种后来都获得了合成花青素蓝色色素的能力。根据这种观点,基因F3'H导致红色花青素的酶的编码是该基因的祖先F3’5是什么编码将红色转化为蓝色花青素的酶[20.].根据系统发育分析,大多数F3’5是什么源自F3'H在被子植物和裸子植物分化之前通过基因复制,但在有记录的菊科案例中,这一事件反复发生,而且在进化时间尺度上要晚得多[20.].这就提出了一个问题,即蓝色基因是如何以及何时出现在葡萄基因组中的。F3'H而且F3’5是什么目前已知的葡萄基因组在系统发育树的两个不同分支中分裂,其中包括F3'H而且F3’5是什么来自其他植物[11].F3’5是什么从葡萄基因组中与同源组在一起F3’5是什么来自其他物种,而不是副同源物种F3'H从葡萄。这一特征预示着它的古代起源F3’5是什么在今天的葡萄藤中发现的,在主要双子系谱系分裂之前,已经存在于古祖先中。最近,F3’5是什么在葡萄基因组中经历了进一步的进化,这从包含6的连锁基团上的基因组区域的结构复杂性可以看出F3’5是什么[11].
花青素的组成对从一个特定品种获得的葡萄的颜色有技术上的影响。纯花青素的颜色随着b环上取代基数目的增加以及甲氧基取代羟基而逐渐由红向蓝转变[21].在必须发酵之后,葡萄酒中花青素的稳定性受到许多因素的威胁(光照,储存温度的波动,氧气,酶活性,等),可能会导致颜色过早退化。b环上的羟基和甲氧基的数量和模式也会影响部分的反应性。花青素、飞燕草素和飞燕草素均含有增强抗氧化性的原-二酚基团[22].甲氧基花青素,如芍药苷和麦芽糖苷,更稳定。羟基和甲氧基的相对数量也分别影响相应的花青素在水和水酒精溶液(如葡萄和葡萄酒)中的极性和溶解度。
红葡萄和葡萄酒中存在的多酚化合物,包括花青素,被认为是ROS清除剂的强大来源[23,24].然而,每种化合物对人体健康的益处取决于其生物利用度和抗氧化能力。膳食中的花青素作为完整的3-单葡糖苷被胃粘膜上皮细胞中的一种胆汁转位酶吸附。例如,该载体对5种3-单葡糖苷花青素的亲和度在6倍范围内变化[25].这极大地影响了食品和饮料的生物学价值,这不仅取决于它们的总花青素含量,还取决于它们独特的花青素结构。
在本文中,我们报道了不同品种的花青素基因、花青素和浆果颜色之间的转录-代谢-表型关系葡萄.花青素生物合成途径6个基因的调控(F3H,F3'H,F3’5是什么,UFGT,OMT,销售税),以及四个相关的转录因子(MybA,MybB,MybC,MybD)在四个成熟阶段进行监测。在9个品种中分析了基因转录水平、花青素含量/分布和皮肤色素沉着之间的相关性,其中包括天然葡萄中已知的大多数浆果颜色的极端变异。
结果
花青素含量
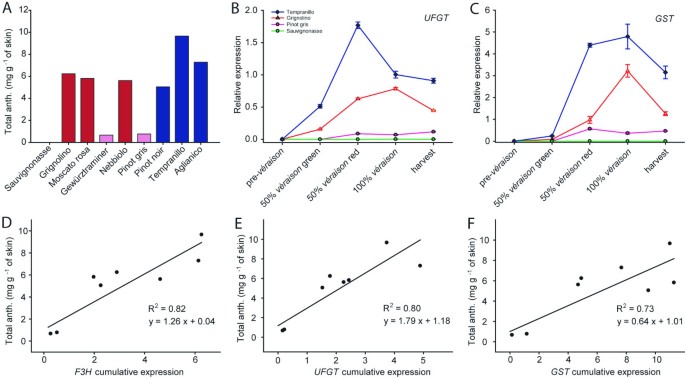
色素品种成熟浆果中花青素含量在0.7 ~ 9.7 mg g之间-1皮肤(表1,图1).在白色(绿色/黄色皮肤)品种“Sauvignonasse”的浆果皮中没有检测到花青素,“Tocai friulano”的同义词。总花青素含量小于1 mg g-1在浅色品种“Gewürztraminer”和“灰比诺”的皮肤中,含量从5.0到6.2毫克不等-1“Grignolino”,“Moscato rosa”,“Nebbiolo”和“Pinot noir”中的皮肤含量超过7.3毫克-1深色品种Aglianico和Tempranillo的皮肤。的累积转录UFGT,花青素生物合成的特异性基因,以整个成熟过程中表达曲线下的面积计算,随着花青素含量成比例增加(表1),并表现出较强的相关性(R2= 0.80),最终花青素含量(图1 e).花青素在4个成熟阶段的积累动力学与基因表达曲线重叠UFGT.的表达式配置文件的四个例子UFGT图中报告了一种不合成花青素的品种(‘Sauvignonasse’),一种几乎检测不到花青素的品种(‘Pinot gris’),一种花青素含量中等的品种(‘Grignolino’)和一种花青素含量丰富的品种(‘Tempranillo’)1 b.除了一种全色品种(“黑比诺”、“丹普兰尼罗”、“内比奥罗”、“玫瑰莫斯卡托”和“格里尼奥利诺”)外,其他所有品种的表达谱均为UFGT在中间和完全之间达到峰值veraison.同样的基因转录水平在‘苏维诺那塞’中检测不到,在浅色品种‘灰比诺’和‘Gewürztraminer’中几乎检测不到。的高峰UFGT与所有其他品种相比,Aglianico品种的基因表达延迟(数据未显示)。糖的积累,有机酸的爆发,表达DWF1在Aglianico中,一种参与油菜素类固醇依赖性促进成熟的基因和其他花青素基因也被延迟了。该品种的栽培更适合温暖的气候,在本试验地点它没有达到完全成熟的酚。其他品种均表现出花青素积累曲线和基因表达模式DWF1而且UFGT因为他们在收获时就已经满足了生长度数的要求。
的基因销售税表现出类似于的表达模式UFGT(图1 c),尽管在整个成熟过程中累积转录与最终花青素含量的相关性略低(R2= 0.73)(图1 f).的累积转录F3H与最终花青素含量(R2= 0.81)(图1 d).四个转录因子都没有MybA,MybB,MybC,MybD累积转录之间存在较强的相关性(表1)和收获期总花青素含量(R2< 0.52)。
完全成熟时的花青素分布图
3-单葡糖苷,乙酰-3-葡萄糖苷和p各品种的-香豆素-3-葡萄糖苷花青素见表1.在糖基酰基化方面,除'Gewürztraminer'外,其他品种中非酰基化花青素含量最高,其中乙酰-3-葡萄糖苷(50.6%)占主导地位。的贡献p除Aglianico和Tempranillo外,其他品种-香豆素基含量最低。“黑比诺”是唯一能合成单一葡萄糖苷(92.4%)和乙酰-3-葡萄糖苷(7.6%)花青素的品种,而p果实皮中未检测到-香豆素基花青素。
每种花青素(花青素、芍药苷、飞燕草苷、芍药苷、麦芽糖苷)对最终花青素谱的贡献是根据单葡萄糖苷形式计算的,并在表中以百分比表示1.三羟基化花青素普遍存在的品种中,Malvidin含量最高。在双羟基花青素优势品种中,“Grignolino”、“Moscato rosa”和“Nebbiolo”的芍药苷含量最高,“Gewürztraminer”的花青素含量最高。
成熟过程中b环羟基化与花青素组成的演化
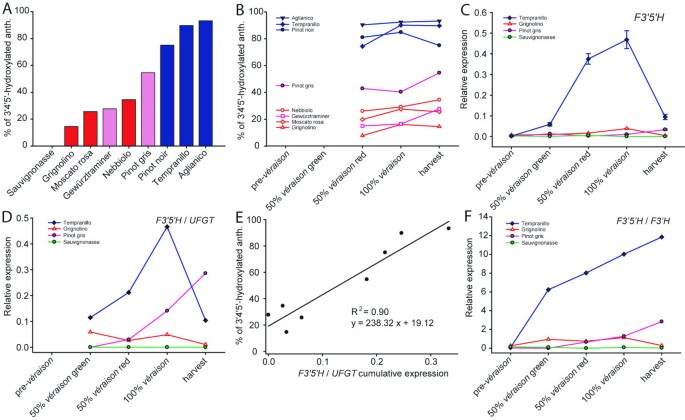
9个研究品种的花青素分布差异显著。成熟浆果中蓝色三羟基花青素的丰度范围从'Grignolino'的14.5%的最低极端到'Aglianico'的93.2%的最高极端(表2)1和图2).‘丹魄罗’和‘黑皮诺’中三羟化花青素的含量也很高(分别为89.7%和70.0%)。“灰比诺”中的三羟基化衍生物大致等同于二羟基化衍生物。相比之下,“Grignolino”、“Moscato rosa”、“Gewürztraminer”和“Nebbiolo”的花青素二羟基化多于三羟基化。花青素在成熟过程中的演变如图所示2 b.基于花青素的色素在着色开始后的第一个采样阶段积累得更快,但随着成熟的进行,它们对总花青素含量的贡献下降,这有利于更丰富的基于飞燕草素的花青素的合成。无论在每个品种中最终百分比如何,三羟基花青素的贡献在收获时高于开始时veraison除了‘黑比诺’以外的所有色素品种。
的表达模式F3’5是什么如图所示2摄氏度本文采用了四个不合成花青素的品种(“苏维尼奥纳斯”)、3’4’-OH花青素占主导地位的品种(“格里尼奥里诺”)、3’4’-OH和3’4’5’-OH花青素同样占最终花青素含量的品种(“灰比诺”)以及富含3’4’5’-OH花青素的品种(“丹普兰尼罗”)。我们也规范化了的表达F3’5是什么以花青素生物合成的速率除以转录水平F3’5是什么的转录水平UFGT(F3’5是什么/UFGT).比率的演变F3’5是什么/UFGT如图所示二维.累积比率F3’5是什么/UFGT结果表明,三羟基化花青素(R2= 0.90)(图2 e).我们还计算了之间的表达比F3’5是什么而且F3'H图中所示为4个代表性品种2 f).其中栽培品种浆果果皮的颜色F3’5是什么转录的高度激活显示了向蓝色的转变,与较高的三羟基化花青素相对丰度相一致。肤色演变如图所示3..颜色是由图像编辑软件(CorelDraw)使用均值复制l,一个,b本研究调查了70个浆果在各个成熟阶段的平均数值。
b环的甲氧基化
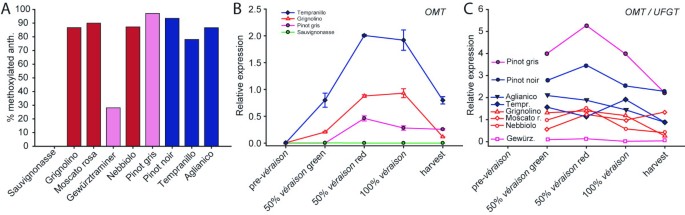
在研究的基因型中,计算了甲氧基化花青素(芍药苷、芍药苷和锦葵苷)和非甲氧基化花青素(花青素和飞燕草苷)对最终图谱的贡献(图4).'Gewürztraminer'的甲氧基化花青素比例最低(28.1%),而所有其他色素品种的甲氧基化花青素比例均高于78%。其中,“灰比诺”(Pinot gris)和“黑比诺”(Pinot noir)的比例最高,分别为97.1%和93.4%。“Grignolino”、“Moscato Rosa”、“Nebbiolo”和“Aglianico”的甲氧基花青素含量在86%到90%之间;在‘丹魄罗’中,这一比例低于80%。在相应的羟基化形式中计算出的每种甲氧基衍生物的百分比见表1.的表达模式OMT图中报告了四个参考品种,‘Sauvignonasse’,‘Pinot gris’,‘Grignolino’和‘Tempranillo’4 b.的相对表达式OMT的转录水平被归一化为花青素生物合成的速率OMT的转录水平UFGT(OMT/UFGT).转录水平比值的演变OMT/UFGT而甲氧基化花青素的相对丰度与OMT在b环甲氧基化中的作用是一致的(图4摄氏度).
讨论
花青素色素葡萄出现了许多惊人的颜色变化。尽管在任何研究的品种中,所有花青素生物合成基因的存在都是不变的,但沿着核心途径和主要分支点的基因的基因型特异性调控被认为是观察到的花青素含量的定量变化和花青素色素沉着的红到蓝转变的基础[26].在本文的实验中,九个葡萄品种果实中花青素色素沉着的差异可归因于全球花青素基因组的特殊表达模式的变化。基因表达F3H,UFGT,OMT,销售税在veraison除了无色素的“苏维诺纳塞”,以及浅色的“Gewürztraminer”和“灰比诺”。在后两个浅色品种中,转录本水平仍然很低,尽管在整个成熟过程中都可以检测到。黄酮羟化酶的调控也有显著差异。表达谱F3'H在花青素生物合成开始之前就相对较高,在花青素生物合成开始之后,该基因的转录本就存在了veraison在所有品种中,也包括白色品种“苏维那塞”。相比之下,转录F3’5是什么发作后发育被激活了吗veraison在“Aglianico”、“Tempranillo”和“Pinot noir”中,这些品种主要合成3’4’5’-羟基化花青素,并结出蓝色的浆果,而红色品种中花青素含量较低,在“Sauvignonasse”中完全没有转录。累积mrnaF3H而且UFGT在整个成熟和相对丰富的F3’5是什么来UFGT和OMT来UFGT解释本身果实成熟时葡萄花青素含量、花青素组成、颜色强度和色相的大部分表型变异。大多数类黄酮通路的调控已被证明发生在转录水平,也发生在其他物种的色素器官中,而不是果实[1,6,27,28].在z梅斯在籽粒中,从查尔酮合成酶向下的整个类黄酮途径同时受到调控Myb类型和基本螺旋-环-螺旋转录因子;在答:majus在花器官中,花青素通路被调控为基因的阻断F3H向下;在P.矮牵牛花的调控途径是由基因作为一个单位调控的DFR向下。在葡萄中,花青素数量变异的主要控制点在途径下游的UFGT水平上,这与早期的观察结果一致。29],但花青素组成的变化在UFGT上游的类黄酮羟化酶(F3’h和F3’5’h)水平和UFGT下游的类黄酮羟化酶水平上被精细调节O甲基转移酶。这反映了在浆果发育的不同阶段积累在同一组织中的类黄酮中间体向不同类别的最终产品(黄酮醇、儿茶素、各种花青素)分配的更高的专门化。
我们已经证明,葡萄果实的颜色变化直接依赖于花青素酶基因整体组mRNA水平的变化。同样,在其他物种(主要是观赏植物)中,跨基因型花朵颜色的变化更多地与基因表达调控的变化有关,而不是与导致蛋白质活性改变的结构突变有关[30.,31].酶基因表达的变异可能最终取决于控制部分或全部结构基因转录的调控基因或酶基因的变异独联体-响应调控因子的目标结构基因的作用元件[32].我们分析了其中四种的基因表达Myb葡萄中已知的型转录因子,包括MybA控制转录激活的基因UFGT[8].四种转录因子的累积表达量均不充分本身解释花青素含量的数量变化,这可能掩盖了参与该过程的其他因素的存在。不同种类的类黄酮化合物从共同的前体合成发生在葡萄皮内的相同细胞。因此,迄今为止在葡萄中研究的少数花青素转录因子可能只是更复杂的类黄酮通路调控网络的冰山一角。就像其他物种一样,其他物种可能Myb类型和基本螺旋-环-螺旋转录因子和WD40蛋白可能在不同发育阶段和不同基因型中对该途径早期和晚期、核心主干和侧支结构基因的表达有不同的调节作用。
结论
自然表型差异为我们提供了机会来追踪导致葡萄极端着色的花青素基因的作用。我们追踪了浆果颜色的决定,从表型水平到转录水平,再到代谢物水平。花青素通路的调控因栽培品种而异。通过从开始的表情剖面veraison直到完全成熟,有可能将花青素代谢产物和离散的颜色表型与结构基因的转录谱联系起来。需要进一步的研究来确定不同品种间调控元件的变化。由于有幸成为第一种获得基因组测序的水果作物[33由于葡萄花青素在酿酒价值(生产优质红酒)、营养价值(膳食多酚)和染料工业用途(天然着色剂)方面的经济影响,葡萄可能成为研究水果中花青素调节的原型,就像牵牛花一直是研究花中花青素调节的原型一样。
方法
植物材料
葡萄树生长在意大利东北部的Vivai Cooperativi Rauscedo(46°04′N;12°50′e;110 masl)。葡萄藤被培育成西尔维兹。取样安排在四个成熟阶段:前、前、后veraison(平均为4.2°Brix的可溶性固形物和37.1 g L-1可滴定酸度),中veraison(50%的彩色浆果在着色cutlivars或50%的软化浆果在‘Sauvignonasse’和‘Gewürztraminer’),100%veraison,完全成熟(平均在可溶性固形物的17.4°Brix和7.4 g L-1可滴定酸度)。由于对热量的要求不同,在不同的品种中达到相同的物候期,完整veraison发生在7月28日之后的一段时间内th2005年9月2日在《莫斯卡托·罗莎》(Moscato rosa)上映nd在“Aglianico”,“Grignolino”和“Nebbiolo”中,技术从9月5日开始成熟th在“黑比诺”、“玫瑰色莫斯卡托”、“灰比诺”和“Gewürztraminer”的展览中展出,截止日期为10月4日th在“Aglianico”和“Nebbiolo”中[见附加文件]1].在每个阶段,收集70个浆果样本进行浆果重量测定和比色测量。在中期veraison,绿色浆果分别从同一簇的红色浆果中取样。用X-Rite 948色度仪(X-Rite)测量浆果的颜色。比色规范参照CIELab量表。然后剥皮提取花青素(见下文),用果肉定量总可溶性固形物和可滴定酸度。可溶性固形物用折光计测量,表示为°Brix,可滴定酸度表示为酒石酸当量。在相同的簇上又取样了40个浆果,剥去皮用于RNA提取。
花青素的定量和概况
用2 mL甲醇从200 mg浆果皮中提取花青素4小时,然后用0.2 μm聚四氟乙烯过滤器(Chemtek analytica)离心过滤。甲醇蒸发后,用27:73甲醇:0.3%高氯酸(v/v), 100 ~ 400 μL重悬花青素。采用C18 purosspher RP-18色谱柱(5μm, 250 mm × 4 mm) (Merck)高效液相色谱法分离花青素。11].花青素含量以mg L表示-13-葡萄糖苷。用单葡糖苷花青素的组成计算3’4’-OH和3’4’5’-OH衍生物的百分比和甲氧基化花青素的百分比。
记录分析
RNA提取,DNase处理和cDNA合成,如[11].实时定量PCR在DNA引擎Opticon2 (MJ Research)上使用SYBR Green进行。每次反应(20 μL)均含有200 nM引物,1:60(或1:240)稀释的cDNA, 0.4 U的HotMasterTaq聚合酶(Eppendorf), 4.0 mM醋酸镁,0.4 mM dNTPs和SYBR溶液(Eppendorf)。热循环条件为95°C持续3分钟,94°C持续15秒,56°C持续20秒,68°C持续30秒,持续40次循环,然后从65°C到95°C进行熔解循环。每个cDNA样本在两种不同的稀释度(原始cDNA的1:60和1:240)下进行分析,每种稀释都重复进行。经泛素偶联因子归一化后,通过比较周期阈值(CT)与的基因相匹配UbiCF(CF203457.1,引物正向5'-CTATATGCTCGCTGCTGACG,引物反向5'-AAGCCAGGCAGAGACAACTC)。基因表达计算为所有稀释和重复的总平均值和标准误差。引物对UFGT检索自[34],DWF1从[35],销售税从[36],F3h, f3 ' h, f3 ' 5'h,OMT,MybA, MybB, MybC而且MybD从[11].
参考文献
- 1.
Mol J, Grotewold E, Koes R:基因如何描绘花和种子。植物科学进展,1998,3:212-217。10.1016 / s1360 - 1385(98) 01242 - 4。
- 2.
Winkel-Shirley B:用突变方法分析黄酮类化合物的生物合成拟南芥.植物化学学报,2002,36:95-110。
- 3.
Quattrocchio F, Wing JF, Leppen H, Mol J, Koes RE:控制花青素色素沉着的调控基因在植物物种中功能保守,具有不同的靶基因集。中国生物医学工程学报,2003,23(4):457 - 457。10.1105 / tpc.5.11.1497。
- 4.
拼写C, Quattrocchio F, Mol JN, Koes R:anthocyanin1矮牵牛基因编码一种基本的螺旋-环-螺旋蛋白,直接激活结构花青素基因的转录。中国生物医学工程学报,2000,12:1619-1632。10.1105 / tpc.12.9.1619。
- 5.
黄志刚,黄志刚,黄志刚,黄志刚,黄志刚:植物花青素生物合成的调控金鱼草majus.植物学报,2001,1:37- 38。10.1111 / j.1365 - 313 x.1991.00037.x。
- 6.
Selinger DA, Chandler VL:突变淡糊粉色基因鉴定了一个新的玉米花青素通路调控因子。植物细胞学报,1999,11:5-14。10.1105 / tpc.11.1.5。
- 7.
Jaakola L, Määttä K, Pirttilä AM, Törrönen R, Kärenlampi S, Hohtola:越橘果实发育过程中花青素、原花青素和黄酮醇水平与花青素生物合成相关基因的表达。植物科学学报,2002,29(3):349 - 349。10.1104 / pp.006957。
- 8.
小林,郭志刚,李志刚,李志刚:逆转录转座子诱导葡萄皮肤颜色突变。科学通报,2004,30(4):344 - 344。
- 9.
Walker AR, Lee E, Bogs J, McDavid DA, Thomas MR, Robinson SP:白葡萄是通过两个相似且相邻的调控基因突变而产生的。植物学报,2007,29(3):344 - 344。10.1111 / j.1365 - 313 x.2006.02997.x。
- 10.
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC:苹果果实的红色是由于MYB转录因子MdMYB10的活性。植物学报,2007,49:414-427。10.1111 / j.1365 - 313 x.2006.02964.x。
- 11.
Castellarin SD, Di Gaspero G, Marconi R, Nonis A, Peterlunger E, Paillard S, adams - blondon AF, Testolin R:红葡萄的颜色变异(葡萄L.):基因组组织、类黄酮3′-羟化酶、类黄酮3′,5′-羟化酶基因的表达以及浆果皮肤中红花青素/蓝飞燕草素花青素的相关代谢产物分析。中国生物医学工程学报,2006,29(4):344 - 344。
- 12.
杨晓东,李志强,王晓明,等。葡萄黄酮羟化酶的鉴定及其在果实发育中的调控作用。植物科学进展,2006,30(4):349 - 349。10.1104 / pp.105.073262。
- 13.
郑志军,郭藤山本N, Hashizume K, Esaka M:葡萄黄酮3'-羟化酶和黄酮3',5'-羟化酶基因的表达及类黄酮组成(葡萄).植物科学学报,2006,17(3):344 - 344。10.1016 / j.plantsci.2005.07.025。
- 14.
Lijavetzky D, Ruiz-García L, Cabezas JA, De Andrés MT, Bravo G, Ibáñez A, Carreño J, Cabello F, Ibáñez J, Martínez-Zapater JM:鲜食葡萄果实颜色变异的分子遗传学研究。中国生物医学工程学报,2006,27(3):344 - 344。10.1007 / s00438 - 006 - 0149 - 1。
- 15.
此P, Lacombe T, Cadle-Davidson M, Owens CL:葡萄酒葡萄(葡萄L.)颜色与驯化基因的等位基因变异有关VvmybA1.应用理论与实践,2007,29(1):1 -7。10.1007 / s00122 - 006 - 0472 - 2。
- 16.
马蒂维,郭祖松,吴晓明,黄青素和黄酮类化合物的研究进展。中国农业科学,2006,29(4):457 - 457。10.1021 / jf061538c。
- 17.
杨晓明,杨晓明,杨晓明,等:用高效液相色谱法研究50个红鲜食葡萄品种花色苷谱的差异。中国生物医学工程学报,2005,30(4):344 - 344。10.1016 / j.chroma.2005.07.096。
- 18.
黄酮类化合物在低等植物中的分布及其进化意义。类黄酮:1980年以来的研究进展。编著:Harborne J. 1988,纽约:学术出版社,427-468。
- 19.
类黄酮进化:一种酶的方法。植物科学学报,1997,26(3):366 - 366。
- 20.
Seitz C, Eder C, Deiml B, Kellner S, Martens S, Forkmann G:黄酮3′-羟化酶和黄酮3′,5′-羟化酶cdna的克隆、功能鉴定和序列分析揭示了菊科黄酮羟化酶的独立进化。中国生物医学工程学报,2006,29(3):344 - 344。10.1007 / s11103 - 006 - 0012 - 0。
- 21.
霍顿TA,康沃尔E:花青素生物合成的遗传学和生物化学。植物科学学报,2004,27(3):379 - 379。10.1105 / tpc.7.7.1071。
- 22.
Sroka Z:植物酚类物质的抗氧化和抗自由基特性。中华自然科学学报,2005,30(4):344 - 344。
- 23.
侯d,藤井M, Terahara N, Yoshimoto M:花青素化学预防作用的分子机制。中国生物医学工程学报,2004,5:327 - 327。10.1155 / S1110724304403040。
- 24.
罗德里戈,博斯科C:氧化应激和多酚的保护作用:人类和啮齿动物肾脏的比较研究。复习一下。中国生物医学工程学报,2006,29(3):344 - 344。10.1016 / j.cbpc.2005.11.002。
- 25.
杨晓明,李志刚,李志刚,李志刚。花青素与胆素转移酶相互作用的研究。生物化学学报,2002,29(6):631-636。10.1016 / s0006 - 291 x(02) 00927 - 0。
- 26.
agorges A, Fernandez L, Vialet S, Merdinoglu D, Terrier N, Romieu C:花青素代谢途径的四个特异同基因与葡萄浆果的红色系统共表达。植物科学学报,2006,17(3):342 - 344。10.1016 / j.plantsci.2005.09.007。
- 27.
Quattrocchio F, Wing J, van der Woude K, Souer E, de Vetten N, Mol J, Koes R:矮牵牛花青素2基因的分子分析及其在花色进化中的作用。植物学报,1999,29(4):344 - 344。10.1105 / tpc.11.8.1433。
- 28.
Schwinn K, Venail J, Shang Y, Mackay S, Alm V, Butelli E, Oyama R, Bailey P, Davies K, Martin C: myb调控基因控制花色素浓度和图案的小家族金鱼草属植物.植物学报,2006,18:831-851。10.1105 / tpc.105.039255。
- 29.
Boss PK, Davies C, Robinson SP:花青素通路基因在发育中的表达分析葡萄l .简历。设拉子葡萄浆果及其通路调控的意义。植物科学学报,1996,26(3):357 - 357。
- 30.
克莱格,德宾,ML:从生态学到分子的植物适应。中国科学(d辑),2003,(4):366 - 366。10.1038 / nrg1023。
- 31.
惠特尔杰,沃克尔C, Kliebenstein DJ Hodges SA:适应性辐射过程中基因表达的收敛性、约束和作用:花花青素耧斗菜.分子生物学学报,2006,15:4645-4657。10.1111 / j.1365 - 294 x.2006.03114.x。
- 32.
Quattrocchio F, Wing JF, van der Woude K, Mol JN, Koes R: bHLH和MYB结构域蛋白的分析:种特异性调控差异是由目标花青素基因的分化进化引起的。植物学报,1998,13:475- 478。10.1046 / j.1365 - 313 x.1998.00046.x。
- 33.
"啊,Aury J-M,诺尔B, Policriti, Clepet C, Casagrande, Choisne N,奥堡年代,Vitulo N, Jubin C, Vezzi, Legeai F, Hugueney P,达席尔瓦C,霍纳D,云母E, Jublot D, J,也不会Bruyere C, Billault, Segurens B, Gouyvenoux M, Ugarte E, F Cattonaro, Anthouard V, V维科,德尔Fabbro C,塞德cedreic Alaux M, Di Gaspero G,杜马斯V,菲利斯N,主料,Juman我Moroldo M, Scalabrin年代,Canaguier, Le Clainche我Malacrida G,杜兰E, Pesole G, Laucou V,小城堡P, Merdinoglu D, Delledonne M,Pezzotti M, Lecharny A, Scarpelli C, Artiguenave F, Pè ME, Valle G, Morgante M, Caboche M, adams - blondon A-F, Weissenbach J, Quétier F, Wincker P:葡萄基因组序列提示主要被子植物门的祖先六倍化。大自然。doi: 10.1038 / nature06148
- 34.
Goto-Yamamoto N, Wan GH, Masaki K, Kobayashi S: 3种葡萄查尔酮合成酶基因的结构和转录(葡萄).植物科学学报,2002,29(3):344 - 344。10.1016 / s0168 - 9452(02) 00042 - 0。
- 35.
Symons GM, Davies C, Shavrukov Y, Dry IB, Reid JB, Thomas MR:类固醇葡萄。油菜素内酯参与葡萄果实的成熟。植物科学学报,2006,30(4):344 - 344。10.1104 / pp.105.070706。
- 36.
Terrier N, Glissant D, Grimplet J, Barrieu F, Abbal P, Couture C, Ageorges A, Atanassova R, Leon C, Renaudin JP, Dedaldechamp F, Romieu C, Delrot S, Hamdi S:等基因特异性寡核苷酸阵列揭示葡萄果实中基因表达的多面变化(葡萄l .)发展。植物学报,2005,22(3):344 - 344。10.1007 / s00425 - 005 - 0017 - y。
确认
作者感谢A. Pfeiffer、M. Degan、G. Comuzzo、R. Frezza、S. Nimissutti和S. Cantoni的技术工作,感谢R. Forti、F. Anaclerio和Vivai Cooperativi Rauscedo提供的植物材料。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
SDC和GDG构想了实验并对结果作出了同等贡献。SDC进行了现场实验,代谢产物分析和整合代谢产物和转录数据。GDG进行表达分析并起草稿件。两位作者都已阅读并批准了最终稿。
电子辅助材料
12870 _2007_187_moesm1_esm.pdf
附加文件1:本研究中使用的9个品种在成熟期间的物候特征。所提供的数据代表了浆果成熟四个阶段的浆果生长和果汁成分的参数。(pdf 17kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Castellarin, S.D, Di Gaspero, G.花青素生物合成基因在天然葡萄浆果色素沉淀极端表型中的转录控制。BMC植物生物学7,46(2007)。https://doi.org/10.1186/1471-2229-7-46
收到了:
接受:
发表:
关键字
- 花青素含量
- 花青色素
- 花青素生物合成
- 花翠素
- 总花青素含量