摘要
背景
大多数转录因子在复合物中发挥作用,通过与位于上游区域的DNA基序或内含子结合来调控靶基因。迄今为止,关于转录因子靶基因及其对应的转录因子结合位点的认识仍然非常有限。两个相关的方法允许在活的有机体内转录因子结合位点鉴定为染色质免疫沉淀(ChIP)和染色质亲和纯化(ChAP)。对于ChAP,用肽或蛋白质标记感兴趣的蛋白质,可用于蛋白质- dna复合物的亲和纯化,从而鉴定目标基因。
结果
本文介绍了拟南芥MADS结构域蛋白AGAMOUS、SEPALLATA3和FRUITFULL的通用标记方法的实验结果。为此,拟南芥野生型植物被转化为含有MADS-box基因融合到双基因中的一种喉炎的症状标签®ii - flag -标签,一个三重ha -标签,或一个egfp -标签,都在构成性双35S花椰菜花叶病毒(CaMV)启动子的控制下。引人注目的是,在所有情况下,具有功能缺失表型的转化子数量都比具有过表达表型的转化子数量大得多。使用内源性启动子代替35S CaMV可显著降低功能丧失表型的频率。此外,偶尔由过表达策略引起的多效性缺陷可以通过使用基因的原生启动子来克服。最后,在携带与GFP融合的MADS-box基因基因组片段的植物上,使用GFP抗体进行ChAP结果展示。
结论
本研究揭示了MADS-box蛋白对小肽标记和GFP标记的融合非常敏感。此外,对于MADS-box基因嵌合版本的表达,将整个基因组区域用于选择的标签是有利的。有趣的是,尽管出乎意料,在强35S CaMV启动子的控制下使用MADS-box基因的嵌合版本似乎是获得显性阴性突变体的非常有效的方法,无论是由共抑制还是由重组蛋白活性的改变引起。最后,我们能够证明AGAMOUS通过ChAP绑定到它的一个目标。
背景
在过去的15年里,为了了解MADS-box基因在植物中的功能,人们使用功能丧失和功能获得的方法进行了许多研究,从而获得了关于它们在发育中的作用的大量信息[1,2].很少有人知道它们在分子水平上是如何作用的,它们如何与DNA基序结合(独联体-elements)并激活下游靶基因。研究表明,MADS结构域蛋白能够与DNA基序CC(A/T)结合。6GG,所谓的CArG-box(在[3.])。该基序也在少数基因的启动子序列中被发现,这些基因已被注释为靶基因(例如:[4- - - - - -7])。然而,这个DNA基序被MADS-box转录因子结合的确切要求在活的有机体内仍然未知。因此,需要对DNA靶位点进行鉴定的方法。
染色质免疫沉淀(ChIP)是一种有效的识别靶点的方法,它可以纯化在活的有机体内形成DNA结合蛋白和相关DNA的复合物(综述于[8])。简而言之,该方法包括植物组织的固定和总蛋白质- dna混合物的分离,然后是针对感兴趣的蛋白质的抗体的免疫沉淀步骤。接下来,DNA可以被纯化、扩增,最后通过测序进行鉴定。或者,扩增的DNA可以杂交到包含启动子元件的微阵列或作为平铺寡核苷酸的整个基因组(ChIP-chip方法,[9,10])。近年来已有报道利用ChIP技术从MADS结构域蛋白中鉴定靶基因[5,7,11].ChIP的一个缺点是,每个感兴趣的蛋白质都需要一个新的特异性抗体。为了克服这一缺点,可以采用一种具有通用标记的蛋白质标记方法,我们称之为染色质亲和纯化(ChAP)。在这种方法中,通用标签被融合到感兴趣的蛋白质上,随后用于分离基于亲和纯化的蛋白质- dna(或蛋白质-蛋白质)复合物(在[12- - - - - -14])。
在本研究中,我们重点研究了拟南芥中的三个MADS结构域蛋白,即AGAMOUS (AG)、SEPALLATA3 (SEP3)和FRUITFULL (FUL)。AG和SEP3均为花器官识别蛋白,基于ABC模型[15],分别代表C-和e型蛋白(在[16])。AG)是雄蕊和心皮形成所必需的,在内两个花轮中表达[17].SEP3表达于内三轮,是花瓣、雄蕊和心皮形成的必要条件,与SEP1而且SEP2[18- - - - - -21].富尔语在花分生组织鉴定(早期功能)和果实发育(晚期功能)中有作用[22- - - - - -24],并在花序分生组织、花序茎、茎生叶和发育中的子房壁中表达[25].在本文中,我们报道了这三个MADS结构域蛋白在不同标记融合的拟南芥中的表达及表型分析。此外,介绍了使用GFP抗体的ChAP所获得的第一个结果。
结果
植物表达的蛋白质标记载体
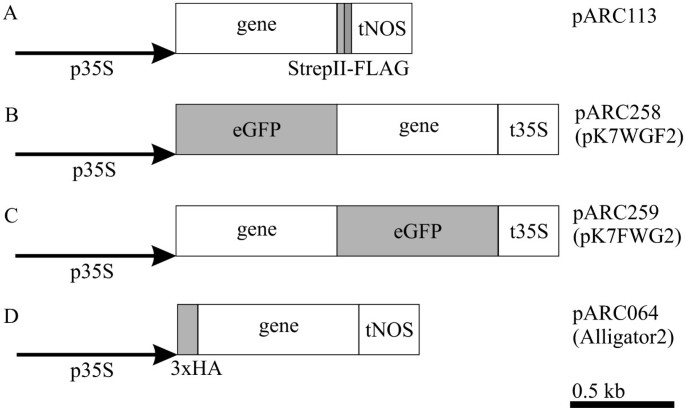
四种不同的二进制向量被用于植物的标记方法(图1).第一个向量(图1)包含一个双标记,即喉炎的症状标签®二世(26],后面跟着FLAG-tag [27],位于相关蛋白质的c端。这些肽标签都非常小,每个只有8个氨基酸长。另外两个向量(图1 b而且1 c)包含eGFP(增强型绿色荧光蛋白,Clonetech)的编码区[28,29],它位于相关蛋白质的N端或c端[30.].第四个向量(图1 d)含有三联ha标签(源自血凝素)[31],每个编码9个氨基酸组成的长肽。此外,所有载体都有一个本构双35S CaMV启动子[32,33的融合产物AG),SEP3,富尔语转基因拟南芥植物。
拟南芥嵌合MADS-box基因的表型和表达分析
将所有构建物导入拟南芥野生型植物Columbia-0,并对获得的转化子进行过表达表型分析。结果汇总于表中1和图2.预期的过表达表型AG)花器官的同种异型变化,类似于apetala2像花一样,叶子卷曲,开花早,如[34].对异位SEP3表达,卷曲的叶子和早开花是值得期待的特征[35],而异位表达的富尔语由于开裂区缺失,导致角锥无法破碎[23,24].
不同标记结构转基因拟南芥植株的表型。(A)蔷薇花期的野生拟南芥,(D)花期的拟南芥,(G)花的特写。(B)与AG-eGFP融合结构显示AG)过表达表型(pARC276)。(C)与SEP3-eGFP融合结构显示SEP3过表达表型(pARC277)。玫瑰花期图像(A-C)取自在相同条件下生长并具有相同年龄的植物(柱状表示相对大小)。(E, H)与eGFP-AG融合结构显示ag)突变型(par308)。(F, I)与eGFP-SEP3融合结构显示部分9月样突变表型(pARC309)。(J)与GFP-FUL与a的融合结构富尔语超表达(富尔语),富尔语突变体(富尔语)表型,或野生型表型(WT) (pARC310)。(K)拟南芥的根尖和(L)开放的角果,有一线状表达的胚珠GFP-FUL荧光显微镜观察融合结构(par310)。Dz,开裂区;v,阀;机汇,胚珠;n, nuclues;心皮壁。
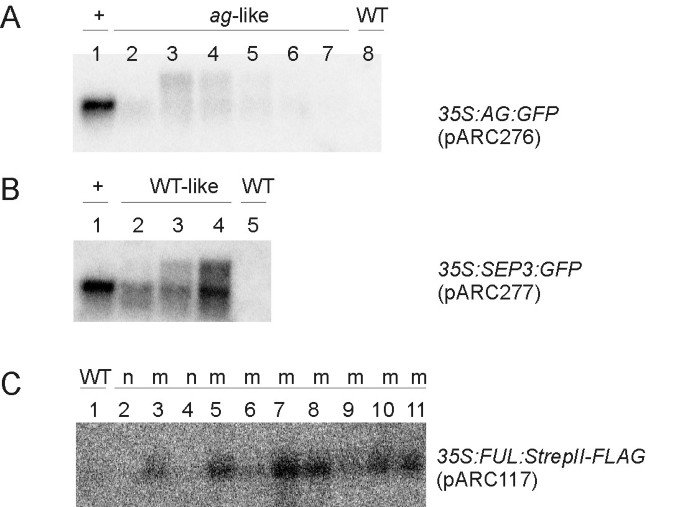
当eGFP蛋白在N端或c端融合时,仅在约10%的植株中观察到过表达表型(图2)2 b, C,2 j).令人惊讶的是,许多植物含有一种eGFP融合构建显示突变表型(图2e f h I,2 j).通过构建pARC276和pARC277获得的具有过表达表型或突变表型的植物(表2)1),用northern blot杂交法分析引入的表达AG)或SEP3分别为转基因(图3而且3 b).这揭示了在叶片中具有高异位基因表达的过表达表型的植物与具有高异位基因表达的植物之间的完美联系ag)突变型(pARC276)无表达。相反,后一种植物在Northern blot中表现出涂抹,这通常是在基因被共抑制时观察到的[36,37].值得注意的是,对于含有SEP3融合结构(pARC277),未观察到功能缺失表型,但Northern blot显示出共抑制的特征,提示蛋白的沉默SEP3可能发生过。最有可能的是平行序列和冗余基因SEP1而且SEP2均不受影响,说明未获得突变表型。携带富尔语未对融合结构(par310)进行分子分析,但观察到一系列严重程度的突变样植物,这表明也发生了共抑制。此外,少数过表达和突变植物与AG),SEP3,富尔语融合,eGFP荧光分析(图2 k而且2 l),并证实了表达和表型之间的相同联系。
植物转化的结构含有喉炎的症状标签®II-FLAG-tag或三重HA-tag仅表现为野生型或突变型。含有该双核苷酸的pARC117结构的转基因植物喉炎的症状标签®II-FLAG-tag,用Northern blot检测其表达富尔语熔合产物(图3 c).值得注意的是,与eGFP融合构建中,所有功能丧失表型的植物均显示异位富尔语表达,这在野生型植物中是缺乏的。这表明该突变体表型与双标记获得喉炎的症状标签®II-FLAG-tag是由显性负向效应引起的,而不是由协同抑制机制引起的。
采用RT-PCR对具有三ha标记融合结构的植株进行分析(数据未显示)。具有使人联想到的突变表型的植物ag)(pARC346)或富尔语(pARC348)突变体分别表现为无表达(提示共抑制)和过表达(提示显性-阴性效应)。
拟南芥中SEP3启动子的表达分析
双35S CaMV启动子的强组成使转基因基因在高表达表型的植株中得到高表达。然而,在的情况下AG)而且SEP3,该启动子导致多效性缺陷,从而产生了极小且早开花的植物,只有少量的花(图2 b而且2摄氏度).为了克服这一问题,我们将双35S CaMV启动子替换为内生启动子。的ATG起始密码子上游的2.6 kb片段SEP3与β-葡萄糖醛酸酶报告基因融合,编码GUS [38].在转基因拟南芥植株中,在花的三个内旋中检测到GUS染色(附加文件)1),SEP3通常表示为[20.].然而,在萼片、花梗甚至茎生叶和莲座叶中也检测到GUS信号(附加文件)1的上游区域SEP3缺乏独联体-正确表达的作用调节区域。
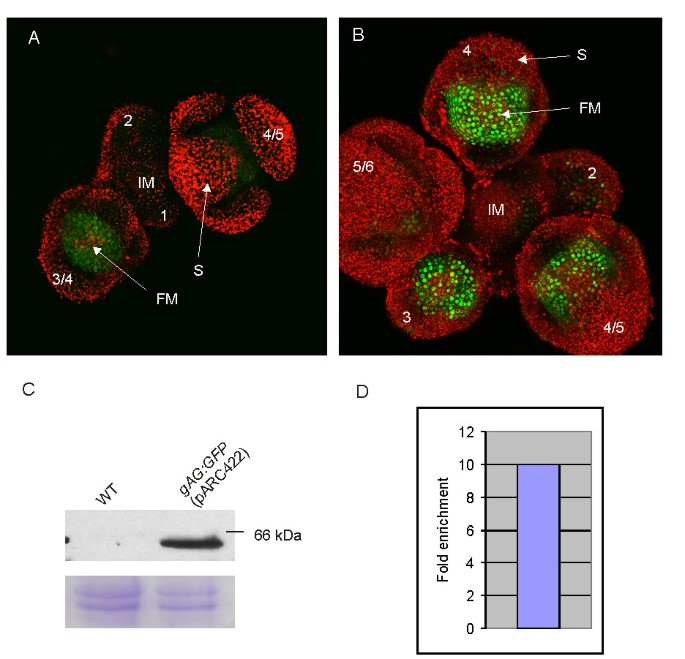
在MADS-box基因中也观察到类似的错误表达AG)而且SEEDSTICK(STK),当分别只有第一个内含子或ATG上游的DNA区域与GUS报告基因融合时[39,40].在这种情况下AG),似乎第二个内含子,其中包含各种独联体-作用规管要素[39,41- - - - - -43]对于正确的空间表达模式至关重要,而对于正确的STK表达时,第一个内含子应包含在报告结构中[40].当SEP3首先详细分析了内含子序列,确定了可能起作用的不同基序独联体-监管要素,包括完美的CArG-box(数据未显示)。来调查的重要性SEP3内含子序列,一个3.5 KB的基因组片段SEP3包括上游和内含子序列,融合到一个GFP标签(pARC423),并引入拟南芥植物。相比之下,观察到的错误表达时只有SEP3采用上游区域,得到了正确的时空表达SEP3包括内含子序列(图4).的gSEP3:绿色荧光蛋白(pARC423)的表达主要在花芽的花分生组织细胞核中可见,从第3期开始(包括第2、3和4轮),而在花序的其余部分不表达或很少表达(图4)4 b).值得注意的是,使用内源性MADS-box基因启动子(pARC422和pARC424)观察到的功能丧失表型的数量明显少于使用35S CaMV启动子的情况(表4)1),甚至不存在SEP3(pARC423)(表1).
AG和SEP3表达分析和染色质免疫沉淀(ChIP)。(A)的共聚焦扫描激光显微成像(CSLM)呕吐:绿色荧光蛋白(pARC422)及(B)gSEP3:绿色荧光蛋白(pARC423)。具有不同花芽阶段(用数字表示)的花序的俯视图(A, B)。GFP(绿色信号)的表达主要定位于花芽的花分生组织细胞核中,从第3期开始(分别包括AG的第3和第4轮,SEP3的第2、3和第4轮)。自发荧光是可见的红色信号。(C)拟南芥WT和拟南芥的抗gfp Western blot呕吐:绿色荧光蛋白(pARC422)植物。蛋白质产物仅在转基因植物中检测到。底部面板显示考马斯染凝胶作为加载控制。(D)用GFP抗体进行ChAP后AG靶DNA的富集,并与免疫前进行比较。的第二内含子序列对应引物,采用Real-time PCR对目标DNA进行定量AG).FM,花分生组织,S,萼片,IM,花序分生组织,WT,野生型。
综上所述,所报道的结果与AG)而且STK我们的结果是SEP3表明MADS结构域基因中的内含子区域对于正确的时空表达非常重要。
AG蛋白检测及染色质亲和纯化
为了研究使用标签的ChAP程序是否可行,我们使用转基因拟南芥植物表达呕吐:绿色荧光蛋白此处以“pARC422”为例。AG在空间和时间上的正确表达被观察到,主要是在花芽的花分生组织细胞的核中,从第3期开始(包括第3轮和第4轮)(图)4).
首先,我们分析了呕吐:绿色荧光蛋白(pARC422)通过Western blotting检测嵌合AG蛋白是否能被多克隆GFP抗体检测到。为此,从野生型拟南芥(Col-0)植物的核提取物中分离出蛋白质,并与野生型拟南芥的提取物进行比较呕吐:绿色荧光蛋白植物。Western blot(图4摄氏度)中显示预期大小的特定频带呕吐:绿色荧光蛋白这在野生型植物中是没有的。
最后,用GFP抗体进行染色质亲和纯化,从蛋白质提取物呕吐:绿色荧光蛋白(pARC422)植物。如前所述,AG蛋白能够与自己的内含子序列结合进行自我调节[7].通过Real-time PCR对该调控区域进行富集分析,结果表明嵌合AG蛋白能够结合在活的有机体内到它的目标序列。目标DNA序列(AG)第二个内含子)在GFP抗体亲和纯化后富集10倍,这表明嵌合AG确实能够结合到其调控区域(图4 d).
讨论
表位标记的使用可以促进蛋白质- dna或蛋白质-蛋白质复合物的分离。在这里,我们报告了第一次尝试采用通用标记方法对MADS结构域蛋白AG, SEP3和FUL进行标记。不同的标签和标签的组合被用来产生在植物中表达的融合产物。在进一步通过染色质亲和纯化(chalmatin Affinity Purification, ChAP)鉴定靶基因之前,有两个重要的标准。第一个基本也是最重要的方面是获得融合蛋白的稳定表达。其次,表达的融合蛋白应该具有生物活性。这两个方面似乎都不是直截了当的,似乎取决于所使用的标签。
在植物中使用组成型和强35S CaMV启动子的表达实验导致了所有结构的突变表型,尽管在许多情况下,不是预期的过表达表型。值得注意的是,所获得的功能丧失表型的百分比非常高,在这种情况下甚至高达100%GFP: SEP3(pARC309)。功能丧失的表型最有可能是由两种现象引起的,一种是由共同抑制eGFP融合,或由显性负效应的情况下喉炎的症状标签®II-FLAG-tag融合。有了三重ha标签,这两种现象都可能发生。这些不同的标签已用于许多生物和许多不同的蛋白质(例如:[13,31,44- - - - - -46]),然而,从未报道过它们导致这些与mRNA表达或重组蛋白活性相关的严重问题。高频率的消音eGFP融合可能与35S CaMV启动子有关,导致转基因的高表达。不含GFP标签的35S CaMV启动子控制下MADS-box cdna的表达(如[47])或使用内源性MADS-box基因启动子表达的GFP标签并没有显示出如此高的共抑制植物比例(表1),表明35S CaMV启动子与GFP标签组合可诱导沉默。使用GFP标签与35S CaMV启动子联合使用MADS-box基因表达的沉默效率似乎与使用RNA干扰策略时相当[48].这条规则唯一的例外是SEP3:绿色荧光蛋白(pARC277),没有导致任何植物功能丧失表型。相比之下,所有GFP: SEP3植物表现出突变表型。虽然这是一个有趣的观察,但却缺少一个解释。融合到短肽标签的FUL蛋白的生物活性的改变,在这里被称为“显性-阴性”作用模式,可能是由于捕获相互作用的蛋白质并形成无功能的蛋白质复合物,空间位阻阻止某些相互作用,或改变蛋白质的折叠。然而,具有表位标记的融合产品的功能必须逐案分析。这取决于所使用的标记以及它可能对目标蛋白质产生的影响。我们的结果表明,在N端和c端与小肽标签和GFP标签融合后,MADS-box基因及其产物的活性会受到显著影响。然而,这种对融合的高敏感性也可以用作获得高比例显性功能缺失突变体的有效方法。
过表达策略的一个缺点可能是出现不必要的多效性效应,例如提前开花或花的数量减少。此外,过度表达或异位表达不能模拟自然情况。最优雅的解决方案是在突变背景下表达基因的原生启动子,这将直接揭示它们的生物活性,并消除与未标记的内源性蛋白质的任何竞争。为了分离原生启动子,通常克隆ATG起始密码子上游的DNA序列,尽管没有可用的通用规则可以预测启动子区域(在[49])。这种方法被用于SEP3然而,与以前的报道相比,启动子显示缺乏特异性原位杂交实验[20.].如前所述的MADS-box基因AG)而且STK,内含子序列对正确表达很重要[39,40].这似乎也适用于SEP3,因为绿色荧光蛋白到一个3.5 KB的基因组片段SEP3包括上游和内含子序列显示正确的表达模式。最后,也是最重要的是,似乎有可能在携带基因组的植物上使用GFP抗体进行ChAPAG)片段(包括上游和内含子序列)融合到GFP (pARC422)。
结论
ChIP或相关的ChAP是识别目标基因的一种有效方法。ChAP利用一个表位标签与感兴趣的蛋白质融合,该研究揭示了MADS-box蛋白的活性对与小肽和GFP标签的融合非常敏感。此外,对于嵌合版本的MADS-box基因的表达,在框架中使用整个基因组区域和选择的标签是有利的。有趣的是,尽管出乎意料,在强35S CaMV启动子的控制下使用MADS-box基因的嵌合版本似乎是获得功能缺失突变体的非常有效的方法,无论是由共抑制引起的还是由重组蛋白活性的改变引起的。最后,使用GFP抗体的嵌合MADS-box蛋白可以实现ChAP。
方法
植物的生长
拟南芥ecotype Columbia-0 (Col-0)植株在正常温室或生长室条件下(22°C,长日照条件)生长。
二元向量的构建与植物变换
带有c端双标记的向量喉炎的症状标签®II (WSHPQFEK)和FLAG-tag (DYKDDDDK)称为pARC113。双标记由两个正向互补引物和三个反向互补引物构建,使用拟南芥密码子得到5'-CTCGAGTGGTCTCATCCTCAATTTGAAAAGTCTTCTGATTACAAGGATGATGATGATAAGTAACTCGAG-3'(标记编码的核苷酸下划线)。在两个标记之间有两个丝氨酸氨基酸残基作为连接子,在flag标记之后引入一个停止密码子。简单地说,每个引物1 ul (100 pmol/ul)聚集在一起,在96℃下孵育10分钟,然后慢慢冷却到室温,形成双链片段。用2 ul T4激酶(10 U/ul)磷酸化片段,在37°C下孵育30分钟。接下来,从12%的聚丙烯酰胺凝胶中分离出69个核苷酸双链片段。随后,该片段被克隆到一个Xho我消化二进制pGD121矢量[50],含有双35S CaMV启动子(来源于pGD120;[51])。全长开放阅读框AG)(At4g18960;编码252个氨基酸),SEP3(At1g24260;编码251个氨基酸),以及富尔语(At5g60910;编码242个氨基酸)用基因特异性引物从起始到终止密码子进行扩增,c端融合的克隆缺乏终止密码子,并被亚克隆到pGEM-T中®Easy (Promega, Madison, WI)和/或Gateway™技术的亚克隆(Invitrogen, Carlsbad, CA)。序列控制后,将所有基因克隆(在pARC113中)和/或重组(在pARC064、pARC258和pARC259中)到相应的载体中,进行融合构建。
A 2.6 kbSEP3ATG上游区域用特异性引物(PRO117 5'-CACCGGCGCGCCATCCATCCATCCAAATGGGACC-3'和PRO118 5'- gaagctttttctttttcctcctctcccc -3')进行扩增,并与pENTR/D-TOPO (Invitrogen)中的Gateway™技术进行重组,随后在双载体pBGWFS7中进行重组[30.],导致转录eGFP-GUS融合结构(par213)。
基因组片段AG)(6882个基点),SEP3(3489 bp),以及富尔语(5298 bp)用基因特异性引物进行扩增,其中正向引物PRO433位于上游区域AG)-5'- caccgatcaaagactacacatac -3', pro407SEP3-5'- CACCCATACCTTTGTGTCCATCAC-3'和PRO429富尔语-5'- CACCTCGATCAGAATTTGAGCTG-3',以及3'-区域缺乏每个基因的终止密码子的反向引物PRO431AG)5 ' -CACTAACTGGAGAGCGGTTTG-3’,PRO408SEP3-5'- aatagagttggtgtcataaggtaac -3', PRO430富尔语-5'- CTCGTTCGTAGTGGTAGGAC-3',并在pENTR/D-TOPO中重组。序列控制后,所有基因组片段在二元载体pMDC204中重组[52],从而得到平移GFP6融合结构(分别为:pARC422, par423,和par424)。
拟南芥用根癌土壤杆菌株GV3101使用花浸法[53].
RNA凝胶印迹分析
用RNeasy植物RNA提取试剂盒(Qiagen)从冷冻植物组织中分离总RNA。每个RNA样本用1.5 M乙二醛变性5微克,在pH 6.5的15 mM Na-phosphate缓冲液中,在1.2%琼脂糖凝胶上分离,检查相等的负载,然后在pH 6.5的25 mM Na-phosphate缓冲液中,在hybondn +膜(Amersham Biosciences, Piscataway, NJ)上进行印迹。探针使用RadPrime DNA标记系统(Invitrogen)进行标记,印迹按照Angenent等人(1992)的描述进行杂交[54].采用PRO383引物PCR扩增基因特异性探针AG)-5'-GGGTCAATGTCTCCCAAAGA-3'和PRO384AG)5 ' -CTAACTGGAGAGCGGTTTGG-3’,PRO105SEP3-5'- gtctagaatgggaagagagtag -3'和PRO106SEP35“-CGGATCCAATAGAGTTGGTGTCATAAGGTAACC-3”。的富尔语片段来源于pGEM-T®容易(Promega)克隆消化与Xba我- - - - - -Kpn我。
格斯分析
检测β-葡萄糖醛酸酶(GUS)活性[38],植物组织在90%的冰冷丙酮中-20°C固定1小时,然后用0.1 M的磷酸钠缓冲液(pH 7.0,含1mm的亚铁氰化钾)冲洗三次。三个冲洗步骤总共需要1小时,在第一个冲洗步骤中,真空应用约15分钟。最后,将底物添加到样品中,其中含有50 mM钠磷酸盐缓冲液pH 7.0, 1 mM EDTA, 0.1% (v/v) Triton ×-100, 1 mM亚铁氰化钾和1 mM X-Gluc (Duchefa, Haarlem,荷兰),真空应用5分钟,然后在37°C黑暗中孵育一夜。叶绿素首先在96%乙醇中孵育1小时,然后转移到70%乙醇中去除。
显微镜
使用蔡司Axioskop紫外显微镜观察植物组织中GFP的表达,该显微镜配备了13号滤光组(激发BP 470/20,分束器FT 493,发射BP 505-530)。图片使用徕卡DFC320数码相机拍摄,曝光时间为18秒。采用蔡司LSM 510倒置共聚焦显微镜,40× C-Apochromat (NA 1.2 W Korr)镜头,对植物组织进行共聚焦扫描激光显微(CSLM)成像。用0.8%琼脂将组织嵌入硅胶隔离器(Grace Bio-Labs, Bend, OR)的孔中,0.5× ms用氩离子激光的488线激发GFP。GFP的发射用505-530 nm带通滤波器过滤,而植物组织的红色自发荧光用650 nm长通滤波器过滤。用蔡司LSM图像浏览器版本4对获得的共焦z-堆栈进行3D投影。
染色质亲和纯化(ChAP)
手术过程如前所述[7作了一些修改。固定(15-30分钟)的花序组织(~ 0.8 g)用于含有含有基因组的构建物pARC422的转基因拟南芥植株AG)与GFP融合的碎片。染色质用探针超声仪(MSE, Soniprep 150)在冰上溶解,通过3次15秒最大功率的脉冲,脉冲之间冷却30秒。采用GFP抗体进行亲和纯化(ab290;Abcam, Cambridge, UK)和阴性对照完全兔血清。蛋白a -琼脂糖珠用于预先清除和亲和纯化(sc-2001;圣克鲁斯生物技术,圣克鲁斯,加利福尼亚州)。洗脱珠粒后,用蛋白酶K处理样品,然后进行沉淀。将沉淀的DNA溶解在100 ul水中,用PCR纯化试剂盒(Qiagen, Valencia, CA)纯化,用30 ul EB(含10 mM Tris的水,pH 8)洗脱。通过将亲和纯化样品(抗gfp)与阴性对照(兔血清)比较,使用实时PCR检测系统(MyiQ, Bio-Rad Laboratories, Hercules, CA)测定目标区域的富集。的序列对两个样本之间的结果进行归一化处理热休克因子1(HSF1;At4g17750)。使用以下引物PRO469AG)-5'- TGGTCTGCCTTCTACGATCC-3'和PRO470AG)5 ' -CAACAACCCATTAACACATTGG-3’,PDS1045HSF1-5'- GCTATCCACAGGTTAGATAAAGGAG-3'和PDS1046HSF15 ' - GAGAAAGATTGTGTGAGAATGAAA-3”。
蛋白质分离与检测
从0.5 g拟南芥花序中提取核,按照ChIP实验的方案进行[7].核球重悬于120 ul 2× SDS样品缓冲液中,冰孵育,在4℃下以20800 × g离心10分钟。将上清液煮沸5分钟。Western blotting基本上按照前面所述进行[55].GFP抗体(ab290;Abcam)以1:5000稀释。
参考文献
- 1.
吴敏,Yanofsky MF:植物MADS-box基因家族的功能和进化。植物学报,2001,2(3):186-195。10.1038 / 35056041。
- 2.
Theissen G, Becker A, Di Rosa A, Kanno A, Kim JT, Munster T, Winter KU, Saedler H:植物MADS-box基因的简史。植物分子生物学,2000,42(1):115-149。10.1023 /: 1006332105728。
- 3.
de Folter S, Angenent GC:反式满足独联体在MADS科学。植物科学进展,2006,11(5):224-231。10.1016 / j.tplants.2006.03.008。
- 4.
Sablowski RWM, Meyerowitz EM:同源没有顶端分生组织是花同源基因的直接目标吗APETALA3 / PISTILLATA.中国生物医学工程学报,1998,32(1):344 - 344。10.1016 / s0092 - 8674(00) 80902 - 2。
- 5.
王慧,唐伟,朱晨,Perry SE:一种染色质免疫沉淀(ChIP)方法分离AGL15调控基因,AGL15是一种优先积累在胚胎中的MADS结构域蛋白。植物学报,2002,32:831-843。10.1046 / j.1365 - 313 x.2002.01455.x。
- 6.
Ito T, Wellmer F, Yu H, Das P, Ito N, alvs - ferreira M, Riechmann JL, Meyerowitz EM:同源异型蛋白AGAMOUS通过调控小孢子发生SPOROCYTELESS.自然科学学报,2004,29(6):366 - 366。10.1038 / nature02733。
- 7.
Gómez-Mena C, de Folter S, Costa MMR, Angenent GC, Sablowski R:花同源异型基因控制的转录程序无性生殖的在早期器官发生过程中。发展,2005,132(3):429-438。10.1242 / dev.01600。
- 8.
奥兰多V:通过甲醛-交联-染色质免疫沉淀绘制体内染色体蛋白。生物化学,2000,25(3):99-104。10.1016 / s0968 - 0004(99) 01535 - 2。
- 9.
Buck MJ, Lieb JD: ChIP-chip:全基因组染色质免疫沉淀实验设计、分析和应用的考虑因素。中国生物医学工程学报,2004,34(3):349-360。10.1016 / j.ygeno.2003.11.004。
- 10.
Mockler TC, Ecker JR: DNA平铺阵列在全基因组分析中的应用。中国生物医学工程学报,2005,34(1):1-15。10.1016 / j.ygeno.2004.10.005。
- 11.
朱春华,裴志强,李志强,等AGL15是MADS-box家族的一员。植物学报,2005,41(4):583-594。10.1111 / j.1365 - 313 x.2004.02320.x。
- 12.
Hearn MTW, Acosta D:新型亲和盒方法的应用:肽融合手柄用于重组蛋白的纯化。分子生物学杂志,2001,14:323-369。10.1002 / jmr.555。
- 13.
Lichty JJ, Malecki JL, Agnew HD, Michelson-Horowitz DJ, Tan S:蛋白纯化亲和性标签的比较。中国生物医学工程学报,2005,41(1):98-105。10.1016 / j.pep.2005.01.019。
- 14.
Terpe K:标签蛋白融合概述:从分子和生化基础到商业系统。中国生物医学工程学报,2003,26(5):523-533。
- 15.
Coen ES, Meyerowitz EM:轮生战争:控制花发育的遗传相互作用。自然学报,1997,37(3):331 -37。10.1038 / 353031 a0。
- 16.
费拉里奥,伊明克RGH, Angenent GC:花地保护与多样性。植物学报,2004,7(1):84-91。10.1016 / j.pbi.2003.11.003。
- 17.
Yanofsky MF, Ma H, Bowman JL, Drews GN, Feldmann KA, Meyerowitz EM:拟南芥同源异型基因编码蛋白无性生殖的类似于转录因子。自然科学进展,2000,27(3):357 - 357。10.1038 / 346035 a0。
- 18.
Pelaz S, Ditta GS, Baumann E, Wisman E, Yanofsky MF: B和C花器官身份函数要求SEPALLATAMADS-box基因。自然科学,2000,40(6):344 - 344。10.1038 / 35012103。
- 19.
本间T,后藤K: MADS-box蛋白复合物足以将叶片转化为花器官。自然科学学报,2001,26(4):525-529。10.1038 / 35054083。
- 20.
Mandel MA, Yanofsky MF:拟南芥AGL9 MADS box基因在幼花原基中表达。性植物繁殖,1998,11(1):22-28。10.1007 / s004970050116。
- 21.
李文杰,李志强,李志强,刘志强,刘志强:拟南芥叶片向花瓣的转化。动物学报,2001,11(3):182-184。10.1016 / s0960 - 9822(01) 00024 - 0。
- 22.
陈志强,陈志强,陈志强,杨晓明:植物分生组织结构与分生组织结构的冗余调控FRUITFULL,APETALA1而且菜花.发展,2000,127(4):725-734。
- 23.
顾强,马蒂恩森FRUITFULLMADS-box基因在拟南芥果实发育过程中介导细胞分化。发展,1998,125(8):1509-1517。
- 24.
费兰迪兹,李尔杰格伦,亚诺夫斯基防碎的基因的FRUITFULL在拟南芥果实发育期间。科学通报,2000,29(4):344 - 344。10.1126 / science.289.5478.436。
- 25.
Mandel MA, Yanofsky MF:拟南芥AGL8 MADS box基因在花序分生组织中表达,并受拟南芥AGL8 MADS box基因的负调控APETALA1.中国生物医学工程学报,2004,27(4):344 - 344。10.1105 / tpc.7.11.1763。
- 26.
Skerra A, Schmidt TGM:链霉亲和素肽配体的应用:链标记。生物工程学报,1999,16(1-4):79-86。10.1016 / s1050 - 3862(99) 00033 - 9。
- 27.
Hopp TP, Prickett KS, Price VL, Libby RT, March CJ, Cerretti DP, Urdal DL, Conlon PJ:用于重组蛋白鉴定和纯化的短多肽标记序列。生物/技术。1988, 6: 1 - 4。10.1038 / nbt1088 - 1204。
- 28.
黄晓明,王晓明,王晓明,王晓明。绿色荧光蛋白在基因表达中的应用。科学通报,1994,29(4):344 - 344。10.1126 / science.8303295。
- 29.
赵伟,邓羽羽,曾伟,平野天,小林汉,辛J:转基因GFP在植物中的重要报告。现代生物学报,1996,6(3):325-330。10.1016 / s0960 - 9822(02) 00483 - 9。
- 30.
王志强,王志强,王志强。农杆菌介导植物转化的GATEWAY载体研究。植物科学进展,2002,7(5):193-195。10.1016 / s1360 - 1385(02) 02251 - 3。
- 31.
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥种子ABI5等位基因的筛选与分析。中国生物医学工程学报,2004,27(3):344 - 344。10.1016 / s0014 - 5793(04) 00148 - 6。
- 32.
陈建平,陈建平,陈建平,等。花椰菜花叶病毒35S启动子活性的DNA序列鉴定。自然科学,1995,26(3):344 - 344。10.1038 / 313810 a0。
- 33.
杨晓明,王晓明,王晓明,等。植物CaMV 35S启动子序列的克隆与表达分析。科学通报,1997,27(3):344 - 344。10.1126 / science.236.4806.1299。
- 34.
水上勇,马红:花同源异型基因AGAMOUS在转基因拟南芥中的异位表达改变了花器官的特性。中国生物医学工程学报,1992,71(1):119-131。10.1016 / 0092 - 8674 (92) 90271 - d。
- 35.
Pelaz S, Gustafson Brown C, Kohalmi SE, Crosby WL, Yanofsky MF: APETALA1和SEPALLATA3相互作用促进花发育。植物学报,2001,26(4):385-394。10.1046 / j.1365 - 313 x.2001.2641042.x。
- 36.
Angenent GC, Franken J, Busscher M, Colombo L, van Tunen AJ:矮牵牛花瓣和雄蕊的形成受同源异型基因fbp1的调控。植物学报,1994,4(1):101-112。10.1046 / j.1365 - 313 x.1993.04010101.x。
- 37.
Angenent GC, Franken J, Busscher M, Weiss D, van Tunen AJ:矮牵牛同源异型基因fbp2的共同抑制影响了生殖分生组织的同一性。植物学报,2004,25(1):1 -4。10.1046 / j.1365 - 313 x.1994.5010033.x。
- 38.
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:β -葡萄糖醛酸酶作为高等植物中敏感和多功能的基因融合标记。中国地质大学学报(自然科学版),2007,26(3):391 - 391。
- 39.
Sieburth LE, Meyerowitz EM:分子解剖无性生殖的控制区显示起空间调节作用的顺式元件位于基因内。中国生物医学工程学报,1997,9(3):355- 366。10.1105 / tpc.9.3.355。
- 40.
Kooiker M, Airoldi CA, Losa A, Manzotti PS, Finzi L, Kater MM, Colombo L: BASIC PENTACYSTEINE1,一种GA结合蛋白,诱导同源拟南芥基因调控区域构象变化SEEDSTICK.植物细胞学报,2005,17(3):722-729。10.1105 / tpc.104.030130。
- 41.
Deyholos MK, Sieburth LE:可分离轮特异性表达和负调控的增强子元素在无性生殖的第二个内含子。植物学报,2000,12(10):1799-1810。10.1105 / tpc.12.10.1799。
- 42.
洪秀玲,王志刚,王志刚,王志刚,王志刚:花同源异型基因的调控元件无性生殖的通过系统发育的足迹和阴影识别。植物细胞学报,2003,15(6):1296-1309。10.1105 / tpc.009548。
- 43.
Busch MA, Bomblies K, Weigel D:拟南芥花同源基因的激活。科学通报,1999,29(4):489 - 497。10.1126 / science.285.5427.585。
- 44.
Witte CP, Noel L, Gielbert J, Parker J, Romeis T:利用8氨基酸StrepII表位从植物中快速一步纯化蛋白质。植物分子生物学,2004,55(1):135-147。10.1007 / s11103 - 004 - 0501 - y。
- 45.
Ho Y, Gruhler, Heilbut巴德GD,摩尔L,亚当斯SL,米勒,泰勒P,贝内特K, Boutilier K, L,杨Wolting C,唐纳森,Schandorff年代,Shewnarane J,签证官M, Taggart J, Goudreault M, Muskat B, Alfarano C,杜瓦D,林Z, Michalickova K, Willems AR,天使H,尼尔森PA,拉斯穆森KJ,安徒生JR,约翰森LE,汉森LH, Jespersen H, Podtelejnikov,尼尔森E,克劳福德J,保尔森V,索伦森BD, Matthiesen J, Hendrickson RC,格里森F, Pawson T,莫兰MF, Durocher D,曼M,霍格CWV,张志刚,张志刚,张志刚:植物蛋白复合物的系统鉴定酿酒酵母通过质谱分析。自然科学学报,2002,26(3):344 - 344。10.1038 / 415180。
- 46.
Einhauer A, Jungbauer A: FLAG肽,一种用于纯化重组蛋白的多功能融合标签。生物化学学报,2001,49(1-3):455-465。10.1016 / s0165 - 022 x(01) 00213 - 5。
- 47.
Ferrario S, Busscher J, Franken J, Gerats T, Vandenbussche M, Angenent GC, Immink RGH:矮牵牛MADS box基因的异位表达不剃须的加速开花并以显性-负性方式赋予花器官叶状特征。植物学报,2004,16(6):1490-1505。10.1105 / tpc.019679。
- 48.
Chuang CF, Meyerowitz EM:拟南芥双链RNA特异性遗传干扰。中国科学:自然科学,2000,29(3):389 - 397。10.1073 / pnas.060034297。
- 49.
Rombauts S, Florquin K, Lescot M, Marchal K, Rouze P, van de Peer Y:植物基因组启动子和顺式调控元件的计算方法。植物学报,2003,32(3):339 - 344。10.1104 / pp.102.017715。
- 50.
de Folter S, Shchennikova AV, Franken J, Busscher M, Baskar R, Grossniklaus U, Angenent GC, Immink RGH: A B妹妹矮牵牛和拟南芥MADS-box基因参与胚珠和种子发育。植物学报,2006,47(6):934-946。10.1111 / j.1365 - 313 x.2006.02846.x。
- 51.
陈志伟,张志刚,张志刚,张志刚,张志刚。植物细胞中MADS - box蛋白相互作用的研究。《美国国家科学院学报》上。2002, 99(4): 2416-2421。10.1073 / pnas.042677699。
- 52.
Curtis MD, Grossniklaus U:一种用于植物基因高通量功能分析的网关克隆载体集。植物营养学报,2003,23(2):462-469。10.1104 / pp.103.027979。
- 53.
Clough SJ, Bent AF:花浸法:农杆菌介导转化植物的一种简化方法拟南芥.植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。
- 54.
杨文杰,杨志刚,杨志刚,杨志刚,杨志刚。矮牵牛野生型和突变型MADS盒基因的差异表达。中国生物医学工程学报,2002,23(3):344 - 344。10.1105 / tpc.4.8.983。
- 55.
兰姆RS,爱尔兰VF:功能上的分歧APETALA3 / PISTILLATA花同源基因谱系。自然科学进展,2003,26(3):357 - 357。10.1073 / pnas.0631708100。
确认
我们感谢François Parcy提供了带有三ha标签的短吻鳄2载体,并感谢Anna Shchennikova制作基因组AG)而且富尔语克隆。此外,我们感谢Nayelli Marsch-Martinez对这篇手稿的有益评论。这项工作由荷兰蛋白质组学中心(NPC)赞助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明不存在相互竞争的利益。
作者的贡献
SdF和GA构想并设计了实验。SdF, SU, KK和LvZ进行了实验。SdF和GA起草了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2007_188_moesm1_esm.png
附加文件1:SEP3转基因拟南芥的表达分析。(A-C) GUS的表达模式SEP3启动子格斯(A)花序,(B)角锥状,(C)莲座叶。机汇,胚珠。(png 923 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
德福特,S.,厄巴努斯,s.l.,范祖杰伦,L.G.et al。用于染色质免疫沉淀的MADS结构域蛋白标记。BMC植物生物学7,47(2007)。https://doi.org/10.1186/1471-2229-7-47
收到了:
接受:
发表:
关键字
- 增强绿色荧光蛋白
- 拟南芥野生型植物
- 超表达表型
- 整个基因组区域
- 嵌合版本