- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
环核苷酸门控阳离子通道AtCNGC10通过高尔基囊泡从ER传输到拟南芥根和叶细胞的质膜gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba7gydF4y2Ba,文章号:gydF4y2Ba48gydF4y2Ba(gydF4y2Ba2007gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
环核苷酸门控离子通道(CNGCs)维持植物细胞中多种生理过程中必不可少的阳离子稳态。然而,这些膜蛋白的精确亚细胞位置和运输尚不清楚。这是进一步复杂的信息普遍缺乏的膜蛋白靶向途径在植物。为了调查CNGC的贩运和本地化,我们进行了测量gydF4y2BaAtcngc5gydF4y2Ba而且gydF4y2BaAtcngc10gydF4y2Ba分析原生质体中瞬时表达的AtCNGC10-GFP融合物,对原生质体进行免疫荧光标记,并对高压冷冻叶和根进行免疫电镜分析。gydF4y2Ba
结果gydF4y2Ba
AtCNGC10 mRNA和蛋白水平在根中比叶高2.5倍,而在这些组织中AtCNGC5 mRNA和蛋白水平几乎相等。AtCNGC10-EGFP融合靶向于叶片原生质体的质膜,并轻度标记了几种细胞内结构。用亲和纯化的cngc特异性抗血清进行免疫荧光显微镜观察,发现AtCNGC5和AtCNGC10存在于原生质体的质膜中。免疫电镜观察表明,AtCNGC10与叶肉质膜、叶片栅栏薄壁组织和表皮细胞以及根的分生组织、小柱和帽部细胞有关。在内质网、高尔基池和50 - 150nm大小的囊泡中也观察到AtCNCG10。膜片钳法检测HEK293细胞中表达的AtCNGC10-GFP融合,检测到明显的阳离子电流。gydF4y2Ba
结论gydF4y2Ba
AtCNGC5和AtCNGC10是质膜蛋白。我们假设AtCNGC10通过高尔基体和相关的囊泡从内质网传输到质膜。在根冠分生组织细胞、细胞板和重力感应小柱细胞中阳离子通道AtCNGC10的存在,结合先前报道的向地性降低和细胞增大反应的反义表型,提示AtCNGC10在调节根向地性、细胞分裂和生长所需的阳离子平衡中发挥作用。gydF4y2Ba
背景gydF4y2Ba
阳离子是植物中必需的宏观和微量营养素,在许多细胞过程中起着关键作用,如信号转导、抗病、渗透平衡、生长和发育[综述于[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]]。虽然正常的细胞功能需要阳离子,但不平衡的阳离子会对植物造成有害的影响。为了调节细胞内阳离子的稳态,植物进化出了几种不同的转运蛋白,以促进单价和二价阳离子在细胞膜上的运动。其中一类阳离子转运体是环核苷酸门控离子通道(CNGCs) [gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
最初在大麦中发现[gydF4y2Ba4gydF4y2Ba]并随后在许多植物中发现[gydF4y2Ba5gydF4y2Ba], CNGCs共享一个类似shaker的结构,由六个跨膜结构域(S1-6)组成,其中一个孔位于S5和S6之间(图gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].亲水的c端包含部分重叠的环核苷酸结合(CNBD)和钙调素结合(CaMBD)结构域[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].环核苷酸(cAMP或cGMP)被认为是激活的,而钙调蛋白则抑制阳离子转运[gydF4y2Ba9gydF4y2Ba- - - - - -gydF4y2Ba13gydF4y2Ba].拟南芥CNGC家族由20个成员组成[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].对其中六个成员的电生理、分子和遗传互补研究表明,它们通常是非选择性的、单价和二价的阳离子通道[gydF4y2Ba13gydF4y2Ba- - - - - -gydF4y2Ba17gydF4y2Ba],虽然也观察到阳离子之间的一些区别[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].功能丧失突变体的表型特征表明CNGCs参与了广泛的植物过程[gydF4y2Ba14gydF4y2Ba]包括对重金属的耐受性[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],对各种阳离子应力的敏感性[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]、植物发育及发芽[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]、程序性细胞死亡和抗病[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
拟南芥CNGCs的结构与表达gydF4y2Ba.gydF4y2Ba(一)gydF4y2Ba二维模型的一般CNGC作为定位在膜相对于向内和向外的方向。AtCNGC10和atcngc5特异性抗血清的表位位置如图所示。有6个跨膜结构域(S1-S6)、孔(PR)、环核苷酸结合(CNBD)和钙调素结合结构域(CaMBD)。gydF4y2Ba(B)gydF4y2Ba相对mRNA水平的定量gydF4y2BaAtcngc10gydF4y2Ba而且gydF4y2BaAtcngc5gydF4y2Ba基因的定量RT-PCR。gydF4y2Ba中国兵器gydF4y2BamRNA水平归一化至肌动蛋白mRNA水平。gydF4y2Ba(C)gydF4y2Ba从根(Rt)和叶(Lf)总细胞蛋白中免疫沉淀AtCNGC10和AtCNGC5与阴性对照(Cn,gydF4y2Ba大肠杆菌gydF4y2Ba总蛋白)。蛋白质条带的分子大小以千道尔顿(kDa)表示。黑色箭头表示每个CNGC对应的波段。星号(*)表示在所有样本中检测到的非特定波段。gydF4y2Ba
CNGC定位研究滞后于CNGC活性的生化、电生理和遗传学研究。细胞分裂和分离实验表明烟草同源物NtCBP4与质膜有关[gydF4y2Ba7gydF4y2Ba].瞬时表达时,AtCNGC3-GFP融合蛋白在叶片原生质体的外层区域被检测到[gydF4y2Ba17gydF4y2Ba],也表明AtCNCG3靶向于质膜。然而,目前还没有CNGCs在电子显微镜水平上进行免疫定位分析,也没有关于其在植物细胞内运输的数据。后一点也很重要,因为在植物中,膜蛋白运输到质膜的途径还不完全清楚[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
为了确定不同CNGCs在植物细胞中的功能和阐明它们的细胞内转运机制,我们分析了AtCNGC5和AtCNGC10的表达,并在高空间分辨率下确定了AtCNGC10的亚细胞定位和转运。AtCNGC10在植物多种生长反应中起重要作用[gydF4y2Ba23gydF4y2Ba].它还能调节组织中的钾水平,并能挽救钾摄取突变体gydF4y2Ba大肠杆菌gydF4y2Ba、酵母和拟南芥在低钾培养基上[gydF4y2Ba13gydF4y2Ba].本报告结合AtCNGC10- gfp靶向、免疫荧光和天然蛋白电镜检测的方法,发现AtCNGC10存在于根和叶中多种细胞类型的质膜中。我们还将AtCNGC10定位于内质网池、高尔基堆和囊泡,以及质膜附近的囊泡,这与该转运体在内质网合成并通过高尔基体运输到质膜的概念一致。最后,对异质表达AtCNGC10- gfp融合的HEK293细胞进行膜片钳检测,结果表明AtCNGC10通道转运KgydF4y2Ba+gydF4y2Ba.gydF4y2Ba
结果与讨论gydF4y2Ba
为了研究CNGCs在拟南芥细胞膜中的位置,我们选择了CNGC-GFP靶向和免疫方法相结合的方法。亲和纯化的AtCNGC5-和atcngc10特异性多克隆抗血清是针对合成的来自CNGC家族中较不保守的子区域的独特序列的肽生成的。这些肽在具有代表性的通用CNGC的预测二维结构中的相应位置如图所示gydF4y2Ba1gydF4y2Ba).atcngc10特异性抗血清与第一个跨膜结构域上游的亲水n端结合,而AtCNGC5抗血清与第5个跨膜结构域和孔之间暴露的外环结合(图gydF4y2Ba1gydF4y2Ba).AtCNGC10特异性抗血清对重组AtCNGC10和天然植物蛋白的特异性已经在免疫印迹上得到了详细的描述[gydF4y2Ba23gydF4y2Ba].AtCNGC5抗血清的特异性在这里被确定(附加文件gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
表达水平gydF4y2BaAtcngc5gydF4y2Ba而且gydF4y2BaAtcngc10gydF4y2Ba利用实时RT-PCR在成熟叶和根中进行评估(图gydF4y2Ba1 bgydF4y2Ba)和总细胞蛋白的免疫沉淀(图gydF4y2Ba1 cgydF4y2Ba).丰富的gydF4y2BaAtcngc5gydF4y2Ba根和叶中mRNA表达相似gydF4y2BaAtcngc10gydF4y2Ba根中的mRNA水平高出2.5倍以上。此外,gydF4y2BaAtcngc5gydF4y2BamRNA水平比对照组高3倍gydF4y2BaAtcngc10gydF4y2Ba在叶中,根中则高出20%在我们的免疫沉淀实验中,AtCNGC10和AtCNGC5抗血清分别在75和82 kDa处检测到特异性条带(图gydF4y2Ba1 cgydF4y2Ba),与预测的多肽大小相对应。与我们的实时RT-PCR结果一致,AtCNGC5在两种组织中都比AtCNGC10更丰富。一般来说,CNGC蛋白水平与mRNA水平相关,在蛋白负载相等的基础上,使用相同的抗体剂量(50 kDa重链,图gydF4y2Ba1 cgydF4y2Ba)免疫沉淀试验。gydF4y2Ba
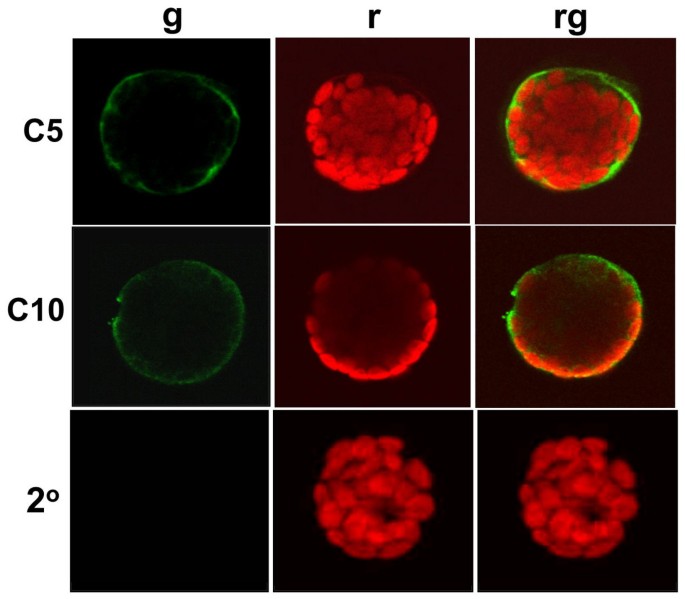
作为在细胞内定位CNGCs的初始方法,我们在拟南芥叶片原生质体中采用了由35S CaMV启动子控制的AtCNGC10-GFP融合的瞬时表达(图gydF4y2Ba2gydF4y2Ba).AtCNGC10序列将GFP定向到质膜,而GFP单独控制在细胞质中被均匀检测到(图gydF4y2Ba2gydF4y2Ba).AtCNGC10-GFP结构物还轻微地标记了一些弥漫性以及几种不同的点状细胞内结构(图gydF4y2Ba2 bgydF4y2Ba).这些结果表明,AtCNGC10序列引导融合的GFP通过分泌途径到达质膜。在另一项研究中,也报道了一些类似的结构被AtCNGC3-GFP标记[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
激光共聚焦显微镜瞬时表达显示AtCNGC10-GFP转运到拟南芥叶片原生质体的质膜上gydF4y2Ba.gydF4y2Ba(一)gydF4y2Ba用两种构建物pBL-35S:AtCNGC10-EGFP (C10-GFP)和pBL-35S:EGFP (GFP)转染叶片原生质体,并与未转染对照(WT)进行比较。图像通过激光扫描共聚焦显微镜获得,包括:(gydF4y2BaggydF4y2Ba)用于GFP的505-525 nm发射滤波器,(gydF4y2BargydF4y2Ba)使用650 nm发射滤光片检测叶绿素自发荧光,以及(gydF4y2BarggydF4y2Ba)合并了GFP和叶绿素自发荧光。gydF4y2Ba(B)gydF4y2Ba白色实箭头标记AtCNGC10-GFP的点状区域,而开放箭头标记囊泡状结构。gydF4y2Ba
为了证实AtCNGC10-GFP融合构建的结果,我们进行了免疫定位实验,以确定细胞中天然CNGC蛋白的定位模式。使用抗atcngc5和抗atcngc10抗血清对化学固定的野生型叶片原生质体进行光镜水平的免疫标记(图gydF4y2Ba3.gydF4y2Ba)和alexafluor488结合抗兔二抗血清。在与质膜重合的原生质体的外边缘处,特异性地检测到荧光(图gydF4y2Ba3.gydF4y2Ba).然而,与抗atcngc5抗血清相比,用抗AtCNGC10抗血清获得强信号需要30分钟的时间,这可能是为了让抗血清穿透原生质体,进入细胞膜胞质侧的表位。阴性对照是用alexaflour488偶联的抗兔二抗单独孵育固定原生质体,无信号产生,这表明抗atcngc5和AtCNGC10在质膜上的免疫定位是一抗定位的结果,而不是二抗的背景结合。gydF4y2Ba
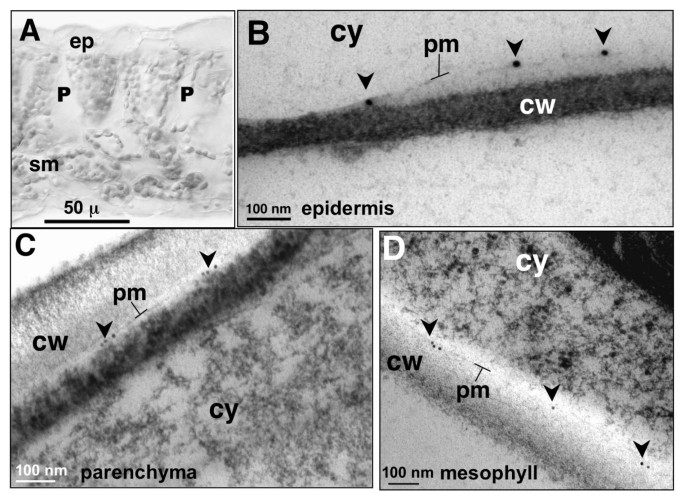
AtCNGC10-GFP靶向的证据(图gydF4y2Ba2gydF4y2Ba)以及AtCNGC5和AtCNGC10在原生质体质膜上的免疫荧光定位(图gydF4y2Ba3.gydF4y2Ba)促使我们进一步利用高压冷冻叶片的电子显微镜进行实验,以获得更高分辨率的免疫定位数据(图gydF4y2Ba4gydF4y2Ba).不幸的是,AtCNGC5抗血清在高压冷冻和丙酮取代的薄组织切片上被证明存在问题。而AtCNGC10抗血清对表皮质膜的标记非常特异性和清晰(图gydF4y2Ba4 bgydF4y2Ba),栅栏薄壁组织(图gydF4y2Ba4摄氏度gydF4y2Ba)和海绵状叶肉细胞(图gydF4y2Ba4 dgydF4y2Ba).表皮细胞轻度质溶(图gydF4y2Ba4 bgydF4y2Ba)导致质膜与细胞壁的分离增加,这进一步强调了免疫标记在质膜中的特异性。gydF4y2Ba
AtCNGC10在不同拟南芥叶细胞质膜上的免疫定位gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)被检叶细胞的亮场切面,ep,表皮;P,栅栏薄壁组织;Sm,海绵状叶肉。(gydF4y2BaBgydF4y2Ba质膜上标记有抗atcngc10抗血清和15 nm金二抗的部分胞浆裂解的表皮细胞(pm,箭头)。栅栏薄壁细胞的质膜(gydF4y2BaCgydF4y2Ba)和海绵状叶肉细胞gydF4y2Ba(D)gydF4y2Ba标记有抗atcngc10抗血清和10 nm金二抗(箭头)。细胞壁,cw,细胞质,cy,表示在每个面板。尺寸条的单位是微米(μ)或纳米(nm)。单独使用二级抗血清的对照组没有信号(数据未显示)。gydF4y2Ba
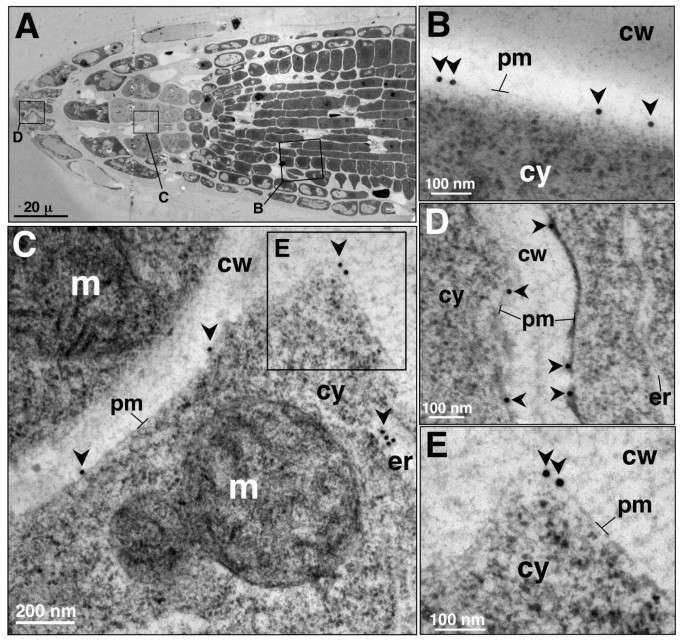
在根尖内各种细胞类型的质膜中也检测到AtCNGC10gydF4y2Ba5gydF4y2Ba).分生区细胞的标记率尤其高(图gydF4y2Ba5 bgydF4y2Ba)、小柱细胞(图gydF4y2Ba5度gydF4y2Ba)和根冠(图gydF4y2Ba5 dgydF4y2Ba).AtCNGC10在重力感应小柱细胞质膜中的检测尤其有趣。的反义线的根gydF4y2BaAtcngc10gydF4y2Ba与野生型对照相比,它们对重力的反应减弱[gydF4y2Ba23gydF4y2Ba].我们认为,AtCNGC10对根重响应的影响可能是通过小柱细胞质膜上的阳离子转运介导的。gydF4y2Ba
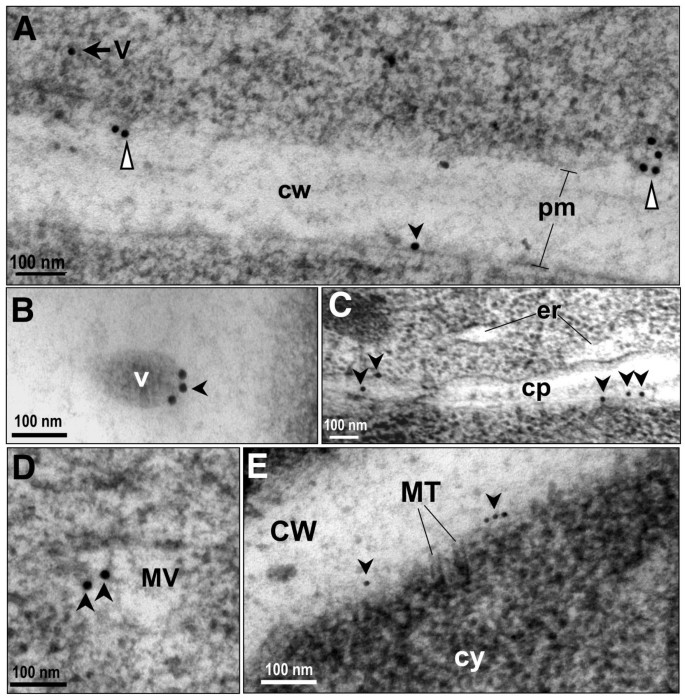
为了鉴定所有含有AtCNGC10的细胞内结构,我们使用抗AtCNGC10抗体进一步分析了高压冷冻根尖细胞的免疫金标记薄片。在内耳池观察到免疫金颗粒(图gydF4y2Ba5度gydF4y2Ba,gydF4y2Ba6gydF4y2Ba)、高尔基堆和新出现的反式高尔基囊泡(图gydF4y2Ba6 b, CgydF4y2Ba)、分泌泡(图gydF4y2Ba7a 7b 7dgydF4y2Ba)和囊泡与质膜合并(图gydF4y2Ba7一个gydF4y2Ba).这种标记模式与假设一致,即AtCNGC10是由er结合的核糖体合成,通过高尔基体,在分泌囊泡中运输到质膜,这是一种被假设为大多数植物质膜蛋白所遵循的途径[gydF4y2Ba22gydF4y2Ba].此外,在分裂细胞的晚期细胞板的质膜上也观察到抗atcngc10标记(图gydF4y2Ba7 cgydF4y2Ba)和皮质微管附着位点附近(图gydF4y2Ba7 egydF4y2Ba).AtCNGC10在形成状态下向细胞板的传递进一步表明,这种离子转运体在根尖细胞分裂过程中对质膜功能具有重要意义。gydF4y2Ba
与囊泡和细胞板相关的AtCNGC10的鉴定gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)细胞质囊泡(V,黑色箭头)和与质膜融合的囊泡pm(白色三角形)的免疫金标记。黑色箭头表示pm中免疫金为15 nm。(gydF4y2BaBgydF4y2Ba) 3个抗atcngc10抗血清标记在囊泡边缘的免疫金颗粒(V);(gydF4y2BaCgydF4y2Ba细胞板(cp)形成,抗atcngc10抗血清标记为黑色箭头。内质网。(gydF4y2BaDgydF4y2Ba)用抗atcngc10抗血清标记的细胞质中存在多个囊泡;(gydF4y2BaEgydF4y2Ba皮质微管(MT)附着体附近的抗atcngc10抗体标记。Cw,细胞壁。尺寸条的单位是纳米(nm)。gydF4y2Ba
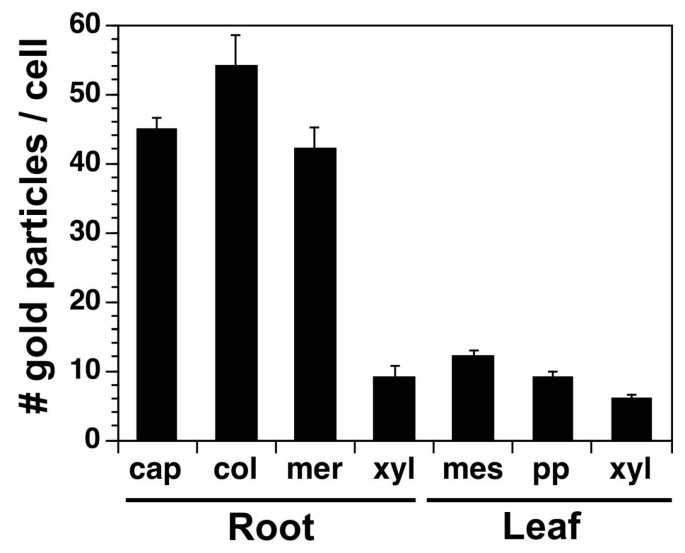
抗atcngc10抗体在叶细胞和根细胞上的整体标记以每个细胞为基础进行定量(图gydF4y2Ba8gydF4y2Ba).根的帽部、分生组织和小柱细胞的标记量是木质部细胞的4倍。这表明AtCNGC10不是根木质部细胞阳离子负载的主要通道。同样,叶子上的标记平均是根尖细胞上标记水平的四分之一。AtCNGC10标记在根中的丰度高于叶片,这与表达分析结果一致(图gydF4y2Ba1 b, cgydF4y2Ba),表明AtCNGC10在根中起主要作用。gydF4y2Ba
检测AtCNGC10介导K的能力gydF4y2Ba+gydF4y2Ba我们在HEK293细胞中瞬时表达AtCNGC10-GFPgydF4y2Ba9gydF4y2Ba).AtCNGC10-GFP清楚地标记HEK293细胞的外周和一些内膜结构,而GFP单独标记细胞则比较统一。免疫沉淀实验表明,这两种结构均有表达,根据SDS-PAGE预测的大小,AtCNGC10与GFP融合。在膜片钳实验中,我们观察到异源表达的AtCNGC10传导显著的向内KgydF4y2Ba+gydF4y2Ba在细胞外记录液中应用二丁基cGMP (100 uM),显示了这些通道的激活[gydF4y2Ba5gydF4y2Ba].我们还观察到显著的向外电流,这可能是由n -甲基- d -葡萄糖胺(一种大型有机阳离子)通过AtCNGC10携带的。因此,还需要进一步研究AtCNGC10对大小阳离子的选择性以及钙调蛋白和环核苷酸在通道调节中的作用。gydF4y2Ba
AtCNGC10-GFP在HEK293细胞中的表达及膜片钳检测gydF4y2Ba.瞬态表达式gydF4y2Ba(一)gydF4y2Ba只有GFP在向量和gydF4y2Ba(B)gydF4y2Ba在荧光显微镜下观察AtCNGC10-GFP在HEK293细胞中的融合。用4%二甲基甲酰胺固定HEK细胞,用碘化丙啶染色(红色荧光)。外周质膜(PM)有明显的GFP标记。免疫沉淀的细胞表达与不诱导四环素(+/-)TET每一结构显示。分别标记了GFP单独和AtCNGC10-GFP融合对应的条带。用于免疫沉淀的抗血清Fc区有标记。用抗flag抗体免疫印迹法检测蛋白。gydF4y2Ba((D)gydF4y2Ba未转染的HEK细胞没有可见电流。gydF4y2Ba(E)gydF4y2Ba转染AtCNGC10-GFP的HEK细胞在由145 K组成的不对称溶液中表现出较大的向内和向外电流gydF4y2Ba+gydF4y2Ba出gydF4y2Ba/ 145 NMDGgydF4y2Ba在gydF4y2Ba.所示为在100 μM二丁基cGMP存在下,由-60至+100 mV的命令电压产生的漏电流。gydF4y2Ba
的能力gydF4y2BaAtcngc10gydF4y2Ba拯救gydF4y2Ba大肠杆菌gydF4y2Ba酵母突变体KgydF4y2Ba+gydF4y2Ba运输(gydF4y2Ba13gydF4y2Ba],结合图中所示的AtCNGC10在多种细胞中的质膜定位和异体HEK293细胞中的阳离子转运,与其通过K调节细胞扩张的作用相一致gydF4y2Ba+gydF4y2Ba运输(gydF4y2Ba23gydF4y2Ba]通过酸的生长机制[gydF4y2Ba24gydF4y2Ba- - - - - -gydF4y2Ba29gydF4y2Ba].反义击倒行gydF4y2BaAtcngc10gydF4y2Ba有更小的薄壁细胞和叶子,并且在根生长和向地弯曲的速度上被破坏[gydF4y2Ba23gydF4y2Ba].因此,提出AtCNCG10参与根和叶细胞质膜的阳离子摄取是合理的。此外,AtCNGC10也可能参与了其被检测到的囊泡膜上的阳离子转运。无法分离出真正的AtCNGC10基因敲除和观察到的单基因缺陷[gydF4y2Ba23gydF4y2Ba],结合本文观察到的细胞生物学数据,进一步支持了我们的观点,即AtCNGC10是植物的必需基因。gydF4y2Ba
结论gydF4y2Ba
AtCNGC5在根和叶中表达相等,而AtCNGC10优先在根中表达。通过免疫荧光显微镜,两个通道均定位于叶片原生质体的质膜,AtCNGC10和GFP之间的翻译融合也定位于质膜,这表明它通过分泌途径靶向。EM水平的高分辨率免疫金标记表明,AtCNGC10存在于根尖、小柱和分生组织细胞的质膜中,也存在于叶表皮、叶肉和栅栏薄壁细胞中。AtCNGC10在ER、高尔基体和囊泡中被发现,我们认为这些囊泡是质膜蛋白分泌途径中的转运中间体。AtCNGC10很可能转运到活跃生长的叶和根细胞以及根的重力感应小柱细胞中。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
实验采用野生型gydF4y2Ba拟南芥gydF4y2Ba哥伦比亚生态型。种子在70%乙醇中表面消毒2分钟,用无菌水冲洗,然后在20%家用漂白剂-0.4%吐温20中悬浮5分钟,然后用无菌水冲洗几次。种子在0.5× MS琼脂板上,4°C黑暗保存1-3天,然后在23°C光照/暗循环14/10小时21-28天,收获前制备原生质体,分离RNA和蛋白质。用于电子显微镜的植物直接在超细发芽培养基上发芽(Farfard, Inc.)。Anderson, SC),并将其暴露在25°C下14/10小时的光/暗循环中21-28天,然后收割进行冷冻固定。gydF4y2Ba
RNA分离和定量RT-PCRgydF4y2Ba
的cDNA序列,生成用于RT-PCR定量分析的引物gydF4y2BaAtcngc10gydF4y2Ba[基因库:AF272002;[gydF4y2Ba13gydF4y2Ba]]和gydF4y2BaAtcngc5gydF4y2Ba[基因库:NM203224]。引物序列被设计为跨越基因外显子/外显子边界(这消除了污染的基因组DNA信号),并与gydF4y2Ba拟南芥gydF4y2Ba数据库确保其基因特异性:gydF4y2BaAtcngc10gydF4y2Ba: 5'-CCTCGATCTCCTCAAGAAAGTACCT-3'和5'-TCTCCTTCACGGATCACGTAACT-3';gydF4y2BaAtcngc5gydF4y2Ba: 5'- atcaagcggcatctctgt -3'和5'- ctttgttccggttcctgt -3';按所述方法分离细胞总RNA [gydF4y2Ba30.gydF4y2Ba].根据用户手册,在25 ul中使用2 ug总RNA和MMLV酶(Promega, Co.)进行逆转录。RT-PCR反应使用SYBR Green PCR Master Mix试剂盒(Applied Biosystems)在带有iCycler光模块的BioRad iCycler热循环仪上进行。gydF4y2Ba
抗血清、蛋白分离、免疫沉淀和免疫印迹分析gydF4y2Ba
由New England Peptide, Inc. (Boston, MA)生成并亲和纯化针对AtCNGC5预测抗原区(Ac-NRAKESVLKSKC-amide)的多克隆抗体。用免疫印迹法检测纯化的抗体对其肽段和重组多肽的特异性(数据补充)。AtCNGC10特异性多克隆抗体的生成和检测已在前面描述[gydF4y2Ba23gydF4y2Ba].表位肽相对于CNGC多肽的位置如图所示(图gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
从21-28日龄的整株植物中提取蛋白质,在液氮中研磨成细粉,然后加入4 vol (w/v)的1×裂解缓冲液(50 mM HEPES-pH 7.4, 75 mM NaCl, 40 mM NaF, 10 mM碘胺,1% IGEPAL, 0.25 mM PMSF, 1 mM Na-orthoVanadate, Calbiochem蛋白酶抑制剂Cocktail Set IV稀释1:1000),混合均匀。样品在冰上保存20分钟,偶尔摇晃,然后在4℃下以4000 × g离心20分钟。取上清,用500 μg蛋白免疫沉淀。在500 μl蛋白提取物中加入2 μg抗atcngc5或AtCNGC10抗体,在4°C的摇轨器上以20转/分的速度旋转2小时。加入蛋白- a -琼脂糖珠(Invitrogen) 15 μl,在4°C下旋转20 rpm 45分钟。琼脂糖珠以9500 × g在4℃下离心30秒,用1 ml 1×裂解液洗涤3次。去除微量缓冲液,重悬于25 μl蛋白负载缓冲液中,95℃加热8 min, 2000 × g轻离心30秒,上清液装入7%变性聚丙烯酰胺凝胶上进行SDS-PAGE。将蛋白质转移到硝化纤维膜上,用1:3000稀释的抗atcngc5或抗atcngc10一抗进行检测,然后用1:3000稀释的抗兔根过氧化物酶偶联二抗进行ECL试剂盒化学发光检测(GE Healthcare, Inc.)。gydF4y2Ba
AtCNGC5和AtCNGC10在拟南芥原生质体中的定位gydF4y2Ba
原生质体是从3-4周龄的野生型叶片中分离出来的,如所述[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].用干净的剃刀将约0.2-1克叶片组织切成薄片。组织在无菌培养皿中0.5 M甘露醇中孵育1小时,然后吸入甘露醇,将20 ml含有1%纤维素酶(MP Biomedicals)和0.25%果胶酶(Calbiochem, Inc.)的酶溶液溶解在(0.5 M甘露醇,8 mM氯化钙中gydF4y2Ba2gydF4y2Ba, pH调至5.5),暗处O/N孵育。通过旋转培养板以从消化的叶片组织中释放细胞来收获原生质体,然后通过离心(200 × g, 5分钟)纯化,并在W5溶液(0.5 M甘露醇,154 mM NaCl, 125 mM氯化钙)中洗涤两次gydF4y2Ba2gydF4y2Ba, 5 mM KCl, 5 mM葡萄糖,pH调至5.8)。原生质体在2 ml Mg/甘露醇溶液(0.4 M甘露醇,15 mM MgCl)中重悬gydF4y2Ba2gydF4y2Ba, 4 mM MES),并使用5 ml 21%蔗糖垫以300 × g离心10分钟纯化。纯化的原生质体从上层取出,在转染或免疫标记前使用血细胞计计数。gydF4y2Ba
一个pcr扩增的35S-gydF4y2BamGFP5gydF4y2Ba二进制载体pCAMBIA1302的-Nos盒式磁带在pBluescript KS(+)的印地二位点和SacI位点之间克隆gydF4y2BamGFP5gydF4y2Ba编码序列(在NcoI和BstEII位点之间)随后被angydF4y2BaEGFPgydF4y2Ba碎片或嵌合体gydF4y2BaCNGC10-EGFPgydF4y2Ba片段生成结构pBL(35S:gydF4y2BaEGFPgydF4y2Ba)和pBL(35S:gydF4y2BaCNGC10-EGFPgydF4y2Ba),分别。35 s -gydF4y2BamGFPgydF4y2Ba-Nos片段用引物35S/HindIII扩增。F (5 ' -CAGTTgydF4y2BaAAGCTTgydF4y2BaCATGGAGTCAAAGATTCA-3'和Nos/SacI。R (5 ' -TAGTTgydF4y2BaGAGCTCgydF4y2BaCCGATCTAGTAACATAGA-3',而非嵌合版本gydF4y2BaEGFPgydF4y2Ba引物为EGFP/NcoI。F (5 ' -TAGTgydF4y2BaCCCATGGgydF4y2BaTGAGCAAGGGCG-AGGA-3')和EGFP/BstEII。R (5 ' -TACAGgydF4y2BaGGTCACCgydF4y2BaTAGCCGAGAGTGATCCCG-3'),以及与引物EGFP/NdeI的嵌合版本。F (5 ' -CACCGACTAGTgydF4y2BaCATATGgydF4y2BaGTGAGCAAGGGCGAG-3')和EGFP/BstEII.R。创建pBL(35S:gydF4y2BaCNGC10-EGFPgydF4y2Ba),gydF4y2BaCNGC10gydF4y2Ba利用引物对CNGC10/NcoI从野生型(Col-0生态型)幼苗的基因组DNA中扩增得到。F (5'- tttcccatggtttttttttaggttcaaagatgaag -3')和CNGC10/NdeI。R(5“-GAGACATATGAGGGTCAGTTGTATGATTGGCGGT-3”)。的反引物序列修改了的终止密码子gydF4y2BaCNGC10gydF4y2Ba他的密码子(CAT)。结扎gydF4y2BaAtcngc10gydF4y2Ba而且gydF4y2BaEGFPgydF4y2Ba片段通过他们设计的NdeI限制位点放置gydF4y2BaEGFPgydF4y2Ba的最后外显子编码序列gydF4y2BaAtcngc10gydF4y2Ba.如所述,用PEG转染原生质体[gydF4y2Ba32gydF4y2Ba],在W5缓冲液中恒定黑暗的RT环境下培养18-20小时,然后用Olympus Fluoview 1000激光扫描共聚焦显微镜进行检查。在488 nm激发和505-525 nm发射过滤器下检测到EGFP,而在543 nm激发和650发射过滤器下观察到叶绿体自身荧光。gydF4y2Ba
为了进行免疫定位实验,在蔗糖垫上纯化的原生质体(上图),然后在15 ml锥形管中以200 × g在4℃下离心5 min。原生质体在5 mls固定液(3.5%甲醛和1%戊二醛在1× PBS中)中重悬,以30转/分钟的速度震动,孵育2小时。固定细胞离心(200 × g, 5分钟),重悬于2ml PBS中。1 × 10gydF4y2Ba5gydF4y2Ba固定细胞加入300 μl 1× PBS,与一抗(1:200)在24孔培养皿中孵育2小时(30-40 rpm)。细胞在500 μl 1× PBS中洗涤5 min,在300 μl 1× PBS中加入二抗(1:100,goat anti-rabbit Alexafluor 488, Molecular Probes, Inc.),孵育1小时。在500 μl 1× PBS中轻轻清洗细胞,在上述设置下通过共聚焦显微镜观察细胞,检测EGFP和叶绿体自身荧光。对于叶片横截面,将叶片外植体放置在含有4% (w/v)多聚甲醛、20% (v/v)、二甲基亚砜、1% (v/v)Tween 20和0.05 M碳酸钠(pH 7.4)的防冻剂/固定剂中。样品在5°C保存,然后在Reichert-Jung crycut 1800冷冻切片机中在-20°C以30 μ低温冷冻切片,随后在Olympus BX51显微镜下观察。gydF4y2Ba
透射和免疫电子显微镜gydF4y2Ba
对于免疫金电子显微镜,拟南芥叶片(3周龄)和根尖(6天龄)用150 mM蔗糖冷冻保护,放入铝样品盒中,并在Baltec 010高压冷冻机中冷冻(RMC Boeckeler Instruments, Tucson, AZ)。在-90°C下,用0.1%的乙酸铀酰/0.25%的戊二醛在无水丙酮中冷冻替换样品5 d。慢温至-60℃3 d后,用丙酮清洗样品,分别用25%、50%、75%(分别为24 h)和100% (4 d) LR-White (EMS, Washington Fort, PA)在丙酮中浸润,60℃UV聚合3 d或100% HM20 (4 d) (EMS, Washington Fort, PA)在丙酮中,-60℃UV聚合3 d。用于免疫标记的薄片处理按[gydF4y2Ba33gydF4y2Ba]抗cngc10抗体在RT下应用1.5小时,抗兔二抗(10 nm和15 nm金,Ted Pella, Inc)应用1.5小时。对照组省略一抗,使用免疫前血清。切片在Philips CM10显微镜下观察(Philips, Hillsboro, OR)。gydF4y2Ba
AtCNGC10-GFP在HEK293细胞中的表达、免疫沉淀和膜片钳检测gydF4y2Ba
全长AtCNGC10 cDNA在pEGFP-N1的HindIII-EcoRI位点上与EGFP融合,得到pNC10kozG(细菌耐卡那霉素,HEK细胞耐新霉素),并在pcDNA5-T/O的AflII-XhoI位点上与EGFP和FLAG表位融合,得到pTGC10F(细菌耐氨青霉素,HEK细胞耐湿霉素)。HEK293细胞在10 cm培养皿中培养至60%合流,用Lipofectamine 2000试剂(Invitrogen)转染20 μg内毒素-free质粒DNA。HEK293细胞也在涂有Poly-D-Lysine的盖玻片上培养。转染48小时后观察eGFP的表达。48小时后检查转染效率,用4%二甲基甲酰胺固定细胞,用碘化丙染色,然后在Olympus IX70荧光显微镜上以20倍和40倍放大观察。用于免疫沉淀,收集细胞并在1× IP缓冲液(50 mM hepe - ph 7.4, 75 mM NaCl, 40 mM NaF, 10 mM碘他胺,1% IGEPAL, 0.25 mM PMSF, 1 mM Na-orthoVanadate, Calbiochem蛋白酶抑制剂鸡尾酒组IV稀释1:1000)中溶解30分钟。在上清中加入抗标志单克隆抗体(2 μg) (Sigma),在4℃下轻轻旋转2 h。加入15 μl预洗蛋白- a琼脂糖,4℃孵育45 min,降低抗体结合蛋白复合物。样品煮沸8 min, 10% PAGE分离。将凝胶电印迹到PVDF膜上,用1 × PBS-5%脱脂干奶封堵,用单克隆FLAG抗体(1:12500)孵育1小时,然后用抗小鼠抗血清(1:300)孵育,并使用ECL试剂盒(GE Healthcare, Inc.)进行观察。gydF4y2Ba
电压钳测量使用EPC-9膜片钳放大器(HEKA Electronics, Germany)和Pulse (HEKA Elektronik)数据采集软件在全细胞配置下进行。然后使用PulseFit (HEKA ElektroniK)和IgorPro (WaveMetrics, Lake Oswego, OR, USA)软件离线分析数据。将硼硅玻璃贴片移液管拉至尖端尺寸,电阻为3-4 MOhm。记录移液管中填充含有(mM: 145 n -甲基- d -葡胺,10 HEPES-H)的溶液gydF4y2Ba3.gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 0.5 MgClgydF4y2Ba2gydF4y2Ba, pH值7.2。细胞保存在浴液中(单位:mM): 145 KCl, 10 HEPES-KOH, 10 d -葡萄糖,0.1 MgClgydF4y2Ba2gydF4y2Ba, 100 μM二丁基cGMP, pH 7.4。电流由命令电压在-160到+100 mV之间以20 mV的增量(从和到VgydF4y2Ba持有gydF4y2Ba0 mV)。采用P/4协议在线减去线性电流和电容电流。所有实验均在25℃下进行。gydF4y2Ba
缩写gydF4y2Ba
- 中国:gydF4y2Ba
-
环核苷酸门控通道。gydF4y2Ba
- CaMBD:gydF4y2Ba
-
钙调蛋白结合域。gydF4y2Ba
- CNBD:gydF4y2Ba
-
环核苷酸结合域。gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网。gydF4y2Ba
- HEK293:gydF4y2Ba
-
人类胚胎肾细胞系293。gydF4y2Ba
- 知识产权:gydF4y2Ba
-
免疫沉淀反应。gydF4y2Ba
- 透射电镜:gydF4y2Ba
-
透射电子显微镜。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
杨晓明,杨晓明,杨晓明:植物阳离子转运的分子生物学研究。植物化学学报,1998,49:669-696。gydF4y2Ba
- 2.gydF4y2Ba
施瑞德,郭建明,郭建明,王伟等:保护细胞信号转导的研究进展。植物化学学报,2001,29(3):344 - 344。gydF4y2Ba
- 3.gydF4y2Ba
Mäser P, Thomine S, Schroeder JI, Ward JM, Hirschi K, Sze H, Talke IN, Amtmann A, Maathuis FJM, Sanders D, Harper JF, Tchieu J, Gribskov M, Persans MW, Salt DE, Kim SA, Guerinot ML:与阳离子转运蛋白家族的系统发育关系gydF4y2Ba拟南芥gydF4y2Ba.中国农业科学,2001,26(4):344 - 344。gydF4y2Ba
- 4.gydF4y2Ba
许志刚,刘志刚,王志刚,王志刚。大麦糊粉质膜钙调素结合转运蛋白的研究。美国国家科学研究院。1998,95: 1944-1949。gydF4y2Ba
- 5.gydF4y2Ba
杨晓明,陈晓明,杨晓明,杨晓明。CNGCs是植物环核苷酸信号的主要靶点。植物科学进展,2003,8:286-293。gydF4y2Ba
- 6.gydF4y2Ba
Varnum MD, Zagotta WN:环核苷酸门控通道激活的域间相互作用。科学通报,1997,27(3):344 - 344。gydF4y2Ba
- 7.gydF4y2Ba
杨晓明,王晓明,王晓明,等。烟草质膜钙调蛋白结合转运蛋白的研究进展gydF4y2Ba2 +gydF4y2Ba公差与铅gydF4y2Ba2 +gydF4y2Ba转基因植物的超敏反应。植物学报,1999,30(4):344 - 344。gydF4y2Ba
- 8.gydF4y2Ba
Köhler C, Neuhaus G:钙调蛋白结合环核苷酸门控离子通道的特性gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2000,27(3):344 - 344。gydF4y2Ba
- 9.gydF4y2Ba
钟海华,邱克伟:钙调素调控环核苷酸激活通道的分子决定因素。美国国家科学研究院。1999, 26(3): 344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
冷青,刘志刚,华广生,王晓明,王晓明,王晓明,王晓明,王晓明:克隆的环核苷酸门控离子通道的电生理分析。中国生物医学工程学报,2002,29(4):344 - 344。gydF4y2Ba
- 11.gydF4y2Ba
Balagué C, Lin B, Alcon C, Flottes G, Malmström S, Köhler C, Neuhaus G, Pelletier G, Gaymard F, Roby D: HLM1是超敏反应中必不可少的信号成分,是环核苷酸门控通道离子通道家族的成员。植物学报,2003,15:366 - 366。gydF4y2Ba
- 12.gydF4y2Ba
华BG, Mercier RW, Zielinski RE, Berkowitz GA:钙调素与植物环核苷酸门控阳离子通道的功能相互作用。植物化学学报,2003,29(4):344 - 344。gydF4y2Ba
- 13.gydF4y2Ba
李x - l, Borsics T, Harrington HM, Christopher DA:gydF4y2Ba拟南芥gydF4y2BaAtCNGC10挽救钾通道突变体gydF4y2Ba大肠杆菌gydF4y2Ba,酵母和gydF4y2Ba拟南芥gydF4y2Ba受钙/钙调蛋白和环GMP的调控gydF4y2Ba大肠杆菌gydF4y2Ba.植物学报,2003,32:643-653。gydF4y2Ba
- 14.gydF4y2Ba
王晓明,王晓明,王晓明,等:植物中环核苷酸门控通道的研究。中国农业科学,2007,27(4):344 - 344。gydF4y2Ba
- 15.gydF4y2Ba
Köhler C, Merkle T, Neuhaus G:假设环核苷酸和钙调素调控离子通道的一个新基因家族的特征gydF4y2Ba拟南芥gydF4y2Ba.植物学报,1999,30(4):344 - 344。gydF4y2Ba
- 16.gydF4y2Ba
王志强,王志强,王志强,等:植物环核苷酸通道在酵母中的表达。中华医学杂志,2006,37(3):344 - 344。gydF4y2Ba
- 17.gydF4y2Ba
Gobert A, Park G, Amtmann A, Sanders D, Maathuis FJM:拟南芥环核苷酸门控通道3形成非选择性离子转运体,参与萌发和阳离子转运。应用物理学报,2006,29(4):531 - 531。gydF4y2Ba
- 18.gydF4y2Ba
冷强,姚伟,王晓明,王晓明,王晓明,王晓明:植物环核苷酸门控阳离子通道的克隆与功能表征。植物科学学报,2004,27(3):344 - 344。gydF4y2Ba
- 19.gydF4y2Ba
Sunkar R, Kaplan B, Bouche N, Arazi T, Dolev D, Talke IN, Maathuis FJ, Sanders D, Bouchez D, Fromm H:烟草NtCBP4基因在转基因植物中的截断表达及同源中断gydF4y2Ba拟南芥gydF4y2BaCNGC1基因赋予PbgydF4y2Ba2 +gydF4y2Ba宽容。植物学报,2000,24:533-542。gydF4y2Ba
- 20.gydF4y2Ba
陈cw, Schorrak LM, Smith RK, Bent AF, Sussman MR:环核苷酸门控离子通道CNGC2对植物发育和钙胁迫适应至关重要。植物科学学报,2003,27(3):344 - 344。gydF4y2Ba
- 21.gydF4y2Ba
吉冈K, Moeder W, Kang H-G, Kachroo P, Masmoudi K, Berkowitz G, Klessig DF:嵌合gydF4y2Ba拟南芥gydF4y2Ba环核苷酸门控离子通道11/12激活多种病原体耐药反应。植物科学学报,2006,30(4):344 - 344。gydF4y2Ba
- 22.gydF4y2Ba
Jürgens G:植物膜贩运。中国生物医学工程学报,2004,30(4):344 - 344。gydF4y2Ba
- 23.gydF4y2Ba
Borsics T, Webb D, Ondzighi C, Staehelin LA, Christopher DA:环核苷酸门控钙调素结合通道AtCNGC10定位于质膜,影响许多生长反应和淀粉积累gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2007,25(3):344 - 344。gydF4y2Ba
- 24.gydF4y2Ba
Rayle DL, Cleland RE:生长素诱导细胞伸长的酸生长理论仍然存在。中国农业科学,2002,27(4):457 - 457。gydF4y2Ba
- 25.gydF4y2Ba
Maathuis FJ, Ichida AM, Sanders D, Schroeder JI:高等植物K的作用gydF4y2Ba+gydF4y2Ba频道。植物科学学报,1997,33(4):344 - 344。gydF4y2Ba
- 26.gydF4y2Ba
李志强,李志强,李志强,等gydF4y2Ba拟南芥KT2/KUP2gydF4y2Ba转运基因影响芽细胞扩张。植物学报,2002,14:119-131。gydF4y2Ba
- 27.gydF4y2Ba
Fuchs I, Philippar K, Ljung K, Sandberg G, Hedrich R:蓝光调节生长素诱导的KgydF4y2Ba+gydF4y2Ba玉米胚芽鞘中的-通道基因。美国国家科学研究院。2003, 30(4): 379 - 379。gydF4y2Ba
- 28.gydF4y2Ba
非常AA, senenac H: K的分子机制和调控gydF4y2Ba+gydF4y2Ba高等植物的运输。植物学报,2003,29(3):349 - 349。gydF4y2Ba
- 29.gydF4y2Ba
Philippar K, Ivashikina N, Ache P, Christian M, Luthen H, Palme K, Hedrich R:生长素激活KAT1和KAT2, 2 KgydF4y2Ba+gydF4y2Ba-通道基因在植物幼苗中的表达gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2004,37:815-827。gydF4y2Ba
- 30.gydF4y2Ba
Christopher DA, Hoffer PH: DET1以发育和组织特异性的方式抑制叶绿体蓝光响应启动子gydF4y2Ba拟南芥gydF4y2Ba.植物学报,1998,14:1-11。gydF4y2Ba
- 31.gydF4y2Ba
光泽J:一种瞬态表达测定方法gydF4y2Ba拟南芥gydF4y2Ba叶肉原生质体。2002年,(gydF4y2Bahttp://genetics.mgh.harvard.edu/sheenweb/gydF4y2Ba]gydF4y2Ba
- 32.gydF4y2Ba
何萍,单林,辛杰:利用原生质体研究先天性免疫反应。植物与病原菌的相互作用,2006,34(1):1-9。gydF4y2Ba
- 33.gydF4y2Ba
合胞型细胞板:一种参与胚乳细胞化的新型细胞板gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2000,29(4):344 - 344。gydF4y2Ba
确认gydF4y2Ba
该研究得到了DAC的美国能源部生物科学项目奖(DE-FG02-03ER15395)的支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
DC构思了这个项目,对组织标本进行了免疫标记,进行了电子显微镜检查,分析了所有数据并撰写了论文。TB分析了植物和HEK293细胞的基因表达,并进行了免疫沉淀试验,构建了用于HEK293细胞表达的AtCNGC10-GFP,并辅助了膜片钳试验。CY在原生质体中创建并检测AtCNGC10-GFP融合的表达。WU对原生质体进行免疫标记。MA进行了膜片钳实验。CAO、BHK对组织进行高压冷冻、置换、包埋、切片。LAS对EM方法学、组织准备和数据分析提供建议。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
电子辅助材料gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
权利和权限gydF4y2Ba
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Christopher, d.a., Borsics, T., Yuen, C.Y.gydF4y2Baet al。gydF4y2Ba环核苷酸门控阳离子通道AtCNGC10通过高尔基囊泡从ER传输到拟南芥根和叶细胞的质膜。gydF4y2BaBMC植物生物学gydF4y2Ba7,gydF4y2Ba48(2007)。https://doi.org/10.1186/1471-2229-7-48gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-7-48gydF4y2Ba
关键字gydF4y2Ba
- HEK293细胞gydF4y2Ba
- 柱状薄壁组织gydF4y2Ba
- 叶原生质体gydF4y2Ba
- 高尔基堆栈gydF4y2Ba
- 小柱细胞gydF4y2Ba