摘要
背景
实时RT-PCR已成为一种监测低丰度mRNA表达的有力技术,是检测感染宿主组织内细菌基因表达的有用工具。然而,对数据的正确评估需要根据内部标准进行准确可靠的归一化。因此,识别在实验过程中表达不发生变化的参比基因是至关重要的。在此,我们提出一项研究,操纵文化生长条件和在足底通过实验验证了植物病原内参候选基因的表达稳定性Pectobacterium atrosepticum,属于家庭肠杆菌科.
结果
在测试的12个参考基因候选中,4个被证明在6种不同的培养生长条件和稳定表达在足底.其中两个基因(recA而且ffh),分别编码重组酶A和信号识别粒子蛋白,被证明是实验条件下最稳定的一组内参基因。此外,基因proC而且gyrA,分别编码吡咯-5-羧酸还原酶和DNA旋回酶,mRNA表达水平也相对稳定。
结论
基于这些结果,我们建议recA而且ffh作为研究植物病原的实时RT-PCR数据的精确归一化的合适候选p . atrosepticum以及潜在的其他相关病原体。
背景
实时逆转录聚合酶链反应(Real-time RT-PCR)已成为研究低丰度mRNA表达的首选方法[1].RT-PCR的高灵敏度和特异性使其成为监测宿主感染过程中病原体基因mRNA表达的一种特别有用和强大的技术,在宿主感染过程中,病原体的表达谱通常被更高浓度的宿主RNA所掩盖。然而,对受感染宿主组织内病原基因表达的研究存在一些问题,因为没有直接的方法来测量病原RNA的总浓度。在感染后的不同时间点,靶转录的增加可能来自转录的上调,或者仅仅来自宿主组织内病原体数量的增加,或者两者都有。因此,将数据与参比基因(即在各种实验条件下表达不发生变化的基因)进行归一化是量化基因表达的重要步骤。参考基因也被用来校正样本之间的差异,如RNA总量的变化和RT-PCR效率的变化。因此,找到稳定表达的内参基因是至关重要的,因为规范化表达数据的可靠性只与内参基因的可靠性一样好。参考基因表达的任何变化原则上都可能掩盖真实阳性,也可能造成假阳性[2- - - - - -5].为了获得可靠的归一化,建议使用多个参考基因[6- - - - - -8].据报道,在大多数实验条件下,典型的原核家务管理基因的表达是高度可变的[9].
Pectobacterium atrosepticum(以前称为Erwinia carotovora亚种atroseptica[10,11])是温带地区马铃薯的一种重要病原菌,它是利用植物细胞壁降解果胶酶、纤维素酶和蛋白酶等外酶的巨大机制,引起植物黑腿病和块茎软腐。细菌在植物或块茎中处于休眠状态,直到适宜感染的条件[12- - - - - -14].最近发表的基因组p . atrosepticum菌株SCRI1043为研究发病机制的不同方面提供了有价值的工具[15].我们自己(未发表)的基于rt - pcr的差异基因表达研究p . atrosepticum在马铃薯侵染过程中发现了与内参基因可靠性有关的问题。因此,我们对内参基因候选基因进行了更广泛的搜索,目的是产生一组内参基因,可以应用于未来的实时RT-PCR实验p . atrosepticum,以及潜在的其他细菌。
我们使用了不同生长介质、温度和生长阶段的组合来测试12个参比基因候选的表达稳定性p . atrosepticum,并在受感染的马铃薯叶片上进行了实验。本研究纳入以下候选内参基因:信号识别粒子蛋白(ffh)、谷氨酰胺合成酶(glnA)、DNA旋回酶(gyrA)、吡咯-5-羧酸还原酶(proC),重组酶A (recA),转录终止因子Rho (ρ)、50S核糖体蛋白L9 (rplI)、50S核糖体亚基蛋白L17 (rplQ)、DNA拓扑异构酶I (topA)、核苷特异通道形成蛋白(tsx)、麦芽糖结合质周蛋白(男性)和16S核糖体RNA (16 s).
结果
选择12个实时RT-PCR内参候选基因
在此基础上p . atrosepticumSCRI1043基因组序列[15],选取12个候选参考基因进行初步实时RT-PCR研究。这些基因是从基因组的不同部分选择的,以尽量减少影响结果的转录偶联的机会。除了核糖体基因外,它们还被选择来编码参与不同代谢活动的蛋白质,以减少全局共调控的机会。核糖体基因16S rRNA是许多实时RT-PCR实验中常用的内参基因,包括前者的研究欧文氏菌物种(16- - - - - -23].GlnA已被用作参考基因链球菌引起的肺炎实时实验[24),gyrA被用于对不同细菌的研究包括最近对植物病原体的研究两pv。番茄[21,25,26].ProC而且ρ在其他细菌的类似研究中被测试为参考基因,尽管据我们所知没有植物病原体[27,28].的基因rplI而且rplQ是一组核糖体蛋白的一部分,最近也被用作原核生物和真核生物实时PCR实验的内参基因[29- - - - - -32].RecA是一种常见的家务管理基因,在各种细菌的研究中被用作内参基因(例如:[20.,27,33- - - - - -35]),最近被发现是某些研究的很好的参考基因p . atrosepticum(I. K. Toth,未发表结果)。的基因ffh,topA,tsx而且男性据我们所知,以前没有作为参考基因的报道。选择后四个基因仅仅是基于它们要么是其他细菌中众所周知的家务管理基因(ffh, topA),或已知在不同生长条件下表达p . atrosepticum(tsx,男) [36].
内参基因候选基因在培养物中的表达分析
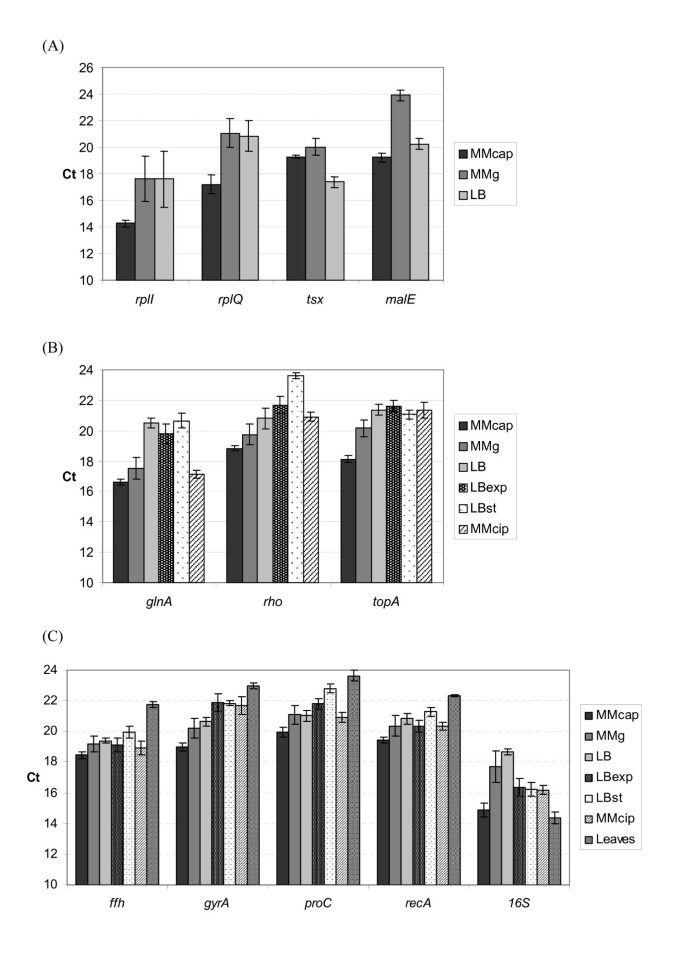
所有选择作为参考基因候选基因表达的初步研究(ffh, glnA, gyrA, proC, recA, rho, rplI, rplQ, topA, tsx, malE, 16S)在15°C下,在三种不同的生长培养基(MMcap, MMg和LB)中进行。的基因rplI, rplQ, tsx而且男性显示在不同的介质中Ct值有很大的变化(图。1),因此被排除在进一步的研究之外。剩下的八个参考基因候选基因(ffh, glnA, gyrA, proC, recA, rho, topA, 16S)进行了第二个实验,测试温度升高(27℃)、不同的果胶(柑橘)和生长阶段(指数型和平稳型)对表达的影响。的基因glnA,ρ,topA而且16 s在不同水平上表达,而参考基因候选ffh, gyrA, proC而且recA在所有培养条件下均相对稳定(图。公元前1).为了对结果进行统计评价,我们使用基于excel的程序BestKeeper分析Ct值[7,37].8个基因在6种不同培养条件下的表达描述性统计见表1.BestKeeper将每个个体基因的Ct范围表示为Ct对几何平均Ct的极值,并给出它们的标准差,从而评估每个参比候选基因的表达稳定性(表1, (min, max) [x-fold]和SD[±x-fold])。在此分析的基础上ffh基因是最稳定的表达和recA作为第二稳定表达的基因,在所有生长条件下。由于他们的标准偏差高(表1, SD[±x倍]),以及它们在所有培养生长条件下的整体变量表达(图。1 b)、候选人glnA,ρ而且topA在随后的测试中被丢弃我们决定包括16 s尽管它具有相当大的Ct范围和较高的标准偏差,因为它通常用作参考基因(如[16,17,21- - - - - -23])。
选定的参考候选基因在受感染植物材料中的表达
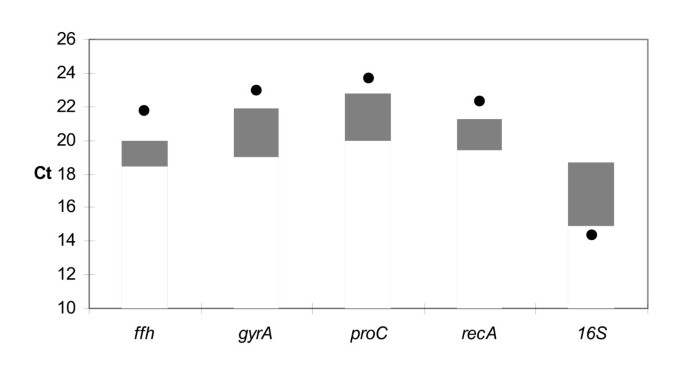
从BestKeeper分析中,四个表达最稳定的参考基因候选基因,ffh, recA, proC而且gyrA,以及16 s对马铃薯离体小叶浸渍后的基因表达进行检测p . atrosepticum.实验中,细菌浸润的小叶21h后出现明显的腐烂症状,而仅用无菌缓冲液浸润的对照小叶则呈现新鲜健康的状态。文化和文化的表达在足底不能直接比较,因为细菌或细菌RNA的起始浓度的数量不能相等,但表达可以与不同基因之间的变异进行比较。对孵育21小时后收集的RNA进行RT-PCR分析表明,4个候选内参基因在所有样本中具有相似的表达水平16 s基因的mRNA表达明显上调(较低的Ct值),与培养物相比,与其他参考基因候选基因相比(图1)。1 c和无花果。2).的16 s引物在未感染的小叶中也显示出微弱的信号(结果未显示)。其他引物对均未在未感染的小叶中产生扩增子,证实无扩增子p . atrosepticum在这些控制中。为了得到候选人的统计评价,我们进行了另一个统计检验,根据表达稳定性对他们进行排名。
geNorm实时RT-PCR数据的统计分析
5个候选参考基因在所有实验生长条件下的表达数据使用geNorm进行统计分析[6,38].该程序确定了一个内参基因与所有其他内参基因的成对变异量,并将内参基因稳定性测量值M定义为某一特定基因与所有其他内参基因的平均成对变异量。M值最低的基因表达最稳定。逐步排除M值最高的基因,得到两个在被测样本中表达最稳定的组成表达参比基因的组合。从这个分析中,基因ffh而且recA的M值最低,因此稳定性最高,而16 s给出M值最高(稳定性最低)(表2).geNorm还计算了两两的变化(Vn / n + 1),以确定归一化所需的最佳内参基因数量。临界值设为V = 0.15,如Vandesompele所建议的,低于临界值不需要加入另一个参比基因等.[6].低(V)n / n + 1)值表明(n+1)个基因的加入无显著影响。V值为0.118(表2),使用两个表达最稳定的基因,ffh而且recA的表达分析中,作为参考基因足以进行可靠的数据归一化p . atrosepticum.
讨论
实时RT-PCR正成为研究宿主-病原相互作用的一项重要技术。然而,由于在宿主-病原体混合样本中,通过总病原体RNA进行规范化通常是不可能的,因此需要适当的和高度可靠的参考基因来进行数据规范化。在这里,我们描述了一组可用于马铃薯病原体基因表达正常化的参考基因Pectobacterium atrosepticum以及潜在的其他相关病原体。我们鉴定了几个基因,它们在一系列生长条件下的表达只有微小的变化。然后使用基于excel的程序BestKeeper进一步分析这些基因的表达。7,37和geNorm [6,38].在最近的几项研究中,这两个程序都被使用了[39- - - - - -44].geNorm要求将数据转换为相对表达式值,而BestKeeper允许输入Ct值。
从统计分析得出结论,有两个基因,recA而且ffh编码重组酶A和信号识别粒子(SRP)蛋白的表达特别稳定。也proC而且gyrA在本研究中使用的条件下相对稳定地表达。另一方面,16 s基因在本研究使用的不同培养条件下表达不稳定。该基因被纳入我们的分析,因为它在一些实时PCR研究中被广泛用作参考基因[16- - - - - -23].虽然这种基因被广泛使用,但一些报告认为它也受到调控[9,45].此外,我们还发现16 s是从未接种病原体的叶子材料中扩增出来的。自16 s基因在不同种类的细菌中是非常保守的,甚至在真核叶绿体和线粒体中,这种“非特异性”扩增可能来自样本中的植物材料,也可能来自叶圈中自然存在的细菌。这个结果表明16 s在非纯培养物(如复杂的宿主-病原样品)分析时,不适合作为参考基因。正常化的另一个缺点16 s核糖体RNA的细胞数量远高于mRNA。这使得有必要在实时分析之前稀释cDNA样本,从而冒稀释错误的风险。此外,尽管mrna可以根据细菌的需要快速翻转,但rRNA只有在特定的应激条件下或分子有缺陷时才会降解[46],因此,rRNA种群与mRNA种群是不可比较的。
参考基因表达可变性的可接受水平的选择取决于每个实验所需的敏感性程度。显然,我们的目标总是努力寻找表达变异性最低的参比基因。然而,即使一个参比基因在实验过程中表现出一些变异,也足以检测出目标基因的表达变异,只要这些变异大于参比基因。一般而言,在一些研究中,geNorm表达稳定性测量值低于1.0的参比基因被认为适合归一化[28,39,44],也低于geNorm的M = 1.5的默认限制[6].在本研究中,5个内参基因ffh,recA,proC,gyrA而且16 s表达式稳定性指标均低于1。
geNorm的分析表明ffh而且recA研究差异基因表达的最佳参考基因集是p . atrosepticum在本研究应用的各种条件下进行实时RT-PCR。这些条件包括两种不同的生长温度、指数生长期和稳定生长期、含有两种不同类型果胶的丰富和最低生长培养基以及渗透的马铃薯叶片。然而,建议至少使用三个内参基因对实时RT-PCR数据进行正确归一化[6].这项研究的结果表明proC可以和?一起用吗ffh而且recA.然而,增加内参基因的数量意味着工作量和成本的增加。此外,应用一个大的参考基因集可能会造成样本可用性有限的问题。使用单一参考基因一般是可以接受的,但该基因在使用前应经过广泛的研究,以确保其稳定性[8].
所有的RNA检测方法都面临着RNA稳定性以及检测灵敏度和特异性的问题[8,47].研究宿主组织内的病原体会带来进一步的复杂性,因为与宿主RNA相比,病原体RNA的数量往往变得微乎其微。虽然也有一些例外(例如:[48- - - - - -50]),在观察宿主组织内的病原体时,目前不可能避免处理真核生物-原核生物混合RNA。因此,从宿主-病原体混合RNA样本中寻找良好的内参基因对实时RT-PCR数据进行规范化是至关重要的。细菌基因的表达是高度多样化的,不可能有一个单一的普遍和稳定表达的原核管家基因。因此,我们支持在任何实时RT-PCR实验中进行检测,然后再决定使用哪些基因作为特定研究的内参基因,以及使用多个内参基因的建议,特别是在研究受感染宿主组织内的病原体表达时[6,8,9,28,39,51,52].
结论
在这里,我们提出了一项研究,其中生长条件的操纵p . atrosepticum目的是为了找到一套可靠的参考基因来监测受感染植物组织中的细菌基因表达。一组有两个参考基因,ffh而且recA,被证明是在所适用的条件下使用的最佳集合。据我们所知,这是首次系统地在植物病原菌中检测用于实时荧光定量PCR研究基因表达的内参基因。本研究中评估的一组基因也可以为研究其他细菌致病菌的mRNA表达提供有价值的参考基因选择指导,特别是来自该家族的肠杆菌科.
方法
马铃薯叶片的培养条件与细菌浸润
Pectobacterium atrosepticum菌株SCRI1043从SCRI菌群中分离得到。细菌在15°C或27°C的不同培养基中生长,如表所示3..在两种培养基中加入果胶、聚半乳糖醛酸和阿拉伯半乳聚糖,以引起不同的反应p . atrosepticum基因转录。使用了两种不同类型的果胶,柑橘果胶(cip)和卷心菜果胶(cap),因为这在原则上会影响细菌的转录反应。15℃的温度是根据参与植物细胞壁分解的关键酶(如果胶和果胶裂解酶)的最佳表达选择的。以27℃为最佳生长温度p . atrosepticum[53].此外,还测试了不同生长阶段的基因表达水平,因为这些在植物感染过程中可能会有所不同。因此,在LB培养基中,细菌从指数相和固定相中取样(表3.).对于叶片渗透,过夜lb -培养p . atrosepticum在27°C下生长的被制成颗粒并在10 mM MgSO中重悬4.来自土豆简历的传单。用10的悬浮液真空渗透Bintje7细菌细胞/毫升,在低真空下使用水泵冲洗15分钟。阴性对照小叶用10 mM MgSO浸润4没有细菌。渗透后,将小叶置于培养皿中湿润的滤纸上(每盘3-5张),18°C孵育。选择这个温度是为了模拟条件p . atrosepticum可引致黑腿及软腐症状[13].样品在渗透21小时后采集,此时叶片出现明显的腐烂症状,在液氮中速冻,-80°C保存,直到RNA提取。
从培养物和受感染的植物材料中分离RNA
细菌培养时,从~1 × 10的培养基中分离出总RNA9细胞使用RNeasy小试剂盒(QIAGEN)。该方案包括使用RNase-Free DNase Set (QIAGEN)的柱上dna酶消化。为了去除DNA,有必要包括使用RQ的额外的DNAse处理1RNase-Free DNase (Promega)。其次是苯酚:氯仿:异戊醇萃取(25:24:1)和乙醇沉淀。RNA颗粒溶解在depc处理过的水中。用TRIzol试剂(Invitrogen)从叶片材料中分离总RNA。然后对RNA进行苯酚:氯仿:异戊醇萃取以提高纯度,之后对样品进行RQ1 RNase-Free DNase (Promega)两次DNase处理,然后进行苯酚:氯仿:异戊醇萃取和乙醇沉淀。植物-细菌混合总RNA用MICROB处理丰富(安必昂),根据制造商的建议。简单地说,宿主-病原体混合总RNA样本与捕获真核聚腺苷化mRNA以及28S和18S rRNA的寡核苷酸一起孵育。然后用磁珠去除寡核苷酸杂交的mRNA和rRNA。富集的细菌RNA被沉淀并重新悬浮在无rnase的水中。所有RNA样本均采用琼脂糖凝胶电泳进行质量评估,并使用GeneQuant分光光度计(GE Healthcare)进行定量。PCR检测结果证实无基因组DNA污染。
逆转录、实时PCR和数据分析
使用SuperScript III逆转录酶(Invitrogen)对1 μg RNA进行逆转录。real-time PCR引物,见表4,采用PrimerExpress (Applied Biosystems)程序设计p . atrosepticumSCRI1043基因组序列[15,54].实时PCR反应混合物为12.5 μl 2×SYBRGreen PCR MasterMix (Applied Biosystems),各引物10 pmol,模板2 μl (10×稀释的培养物cDNA, 3×稀释的叶片样品cDNA),无菌蒸馏水,总体积25 μl。由于16S rRNA的丰度高,分析时cDNA被稀释了100倍以上16 s表达式。热条件为95°C持续10分钟,然后95°C持续15秒,60°C持续1分钟,循环40次。为了检测引物二聚或其他扩增产物,在实时PCR完成后立即进行熔融曲线分析(95°C持续15秒,60°C持续15秒,然后以2%的渐变率缓慢升高温度至95°C,并持续测量荧光)。所有反应均重复进行。每个引物对包含三个非模板控件。基因表达定量使用7900 HT实时PCR系统(Applied Biosystems),实时数据分析使用ABI PRISM 7900 HT软件工具(Applied Biosystems)。所有引物的扩增效率(E)通过所有培养条件的cDNA池稀释序列和相对表达软件工具(REST)进行计算确定[55].这些效率被包括在所有后续的分析中。使用BestKeeper评估结果[7,37和geNorm [6,38].
参考文献
- 1.
Bustin SA, Benes V, Nolan T, Pfaffl MW:定量实时RT-PCR -一个视角。中华分子内分泌杂志,2005,34:597-601。10.1677 / jme.1.01755。
- 2.
butin SA:使用实时逆转录聚合酶链反应测定mRNA的绝对定量。中华分子内分泌杂志,2000,25:169-193。10.1677 / jme.0.0250169。
- 3.
Bas A, Forsberg G, Hammarström S, Hammarström ML:管家基因18S rRNA、β -肌动蛋白和甘油醛-3-磷酸脱氢酶归一化在人T淋巴细胞基因表达实时定量逆转录聚合酶链式反应分析中的应用。中华免疫学杂志,2004,19(4):566-573。10.1111 / j.0300-9475.2004.01440.x。
- 4.
Tricarico C、Pinzani P、Bianchi S、Paglierani M、远远地V、Pazzagli M、Bustin SA、Orlando C:定量实时逆转录聚合酶链反应:对rRNA或单个管理基因的归一化不适用于人体组织活检。生物化学学报,2002,32(3):394 - 394。10.1016 / s0003 - 2697(02) 00311 - 1。
- 5.
Dheda K, Huggett JF, Chang JS, Kim LU, Bustin SA, Johnson MA, Rook GA, Zumla A:使用不合适的内参基因进行实时逆转录PCR数据归一化的意义。生物化学学报,2005,38(4):369 - 369。10.1016 / j.ab.2005.05.022。
- 6.
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F:通过多个内控基因的几何平均对实时定量RT-PCR数据进行精确归一化。中国生物医学工程学报,2002,3 (7):research0034-10.1186/gb-2002-3-7-research0034。
- 7.
Pfaffl MW, Tichopad A, Prgomet C, Neuvians TP:确定稳定的管家基因、差异调节靶基因和样品完整性:基于BestKeeper - excel的工具,使用两两相关。生物技术学报,2004,26:509-515。10.1023 / B: BILE.0000019559.84305.47。
- 8.
Huggett J, Dheda K, Bustin S, Zumla A: Real-time RT-PCR归一化;策略和考虑。基因学报,2005,6(4):279-284。10.1038 / sj.gene.6364190。
- 9.
Vandecasteele SJ, Peetermans WE, Merckx R, Van Eldere J: Taqman定量PCR法测定表皮葡萄球菌管家基因在体外生长和不同条件下的表达。中华微生物学杂志,2001,30(4):394 - 394。10.1128 / jb.183.24.7094 - 7101.2001。
- 10.
Hauben L, Moore ER, Vauterin L, Steenackers M, Mergaert J, Verdonck L, swing J:肠杆菌科植物病原的系统发育位置。应用微生物学报,1998,21:384-397。
- 11.
王丽娟,王丽娟,王丽娟,等:Pectobacterium carotovorum的种级鉴定:atrosepticum Pectobacterium, betavasculorum Pectobacterium和wasabiae Pectobacterium sp. 11 .中华微生物学杂志,2003,32(3):371 - 371。10.1099 / ijs.0.02423-0。
- 12.
Toth IK, Bell KS, Holeva MC, Birch PRJ:软腐羊草:从基因到基因组。植物病理学杂志,2003,4:17-30。10.1046 / j.1364-3703.2003.00149.x。
- 13.
Pérombelon MCM:软腐病引起的马铃薯病害:发病机理综述。植物病理学杂志,2002,51:1-12。10.1046 / j.0032 - 0862.2001。短title.doc.x。
- 14.
Toth IK, Sullivan L, Bierley JL, Avorova AO, Hyman LJ, Broadfoot L, Pérombelon MCM, McNicol J: Erwinia carotovora ssp对马铃薯种子块茎污染的关系。萎缩性疾病,黑腿病的发展和子代块茎污染。植物生理学报,2004,25(4):366 - 366。10.1046 / j.1365-3059.2003.00821.x。
- 15.
Bell KS、Sebaihia M、Pritchard L、Holden MT、Hyman LJ、Holeva MC、Thomson NR、Bentley SD、Churcher LJ、Mungall K、Atkin R、Bason N、Brooks K、Chillingworth T、Clark K、Doggett J、Fraser A、Hance Z、Hauser H、Jagels K、Moule S、Norbertczak H、Ormond D、Price C、Quail MA、Sanders M、Walker D、Whitehead S、Salmond GP、Birch PR、Parkhill J、Toth IK:肠杆菌植物病原体Erwinia carotovora subsp的基因组序列萎缩性细菌及其毒力因子的鉴定。美国国家科学院院刊,2004,101:11105-11110。10.1073 / pnas.0402424101。
- 16.
Venkatesh B, Babujee L, Liu H, Hedley P, Fujikawa T, Birch P, Toth I, Tsuyumu S: Erwinia菊花3937 PhoQ传感器激酶调节几种毒力决定因子。中华微生物学杂志,2006,29(4):369 - 369。10.1128 / jb.188.8.3088 - 3098.2006。
- 17.
Burr T, Barnard AM, Corbett MJ, Pemberton CL, Simpson NJ, Salmond GP:肠道植物病原体Erwinia carotovora毒性中枢群体感应调节剂的鉴定:VirR阻阻剂。中国生物医学工程学报,2006,29(5):533 - 533。10.1111 / j.1365-2958.2005.04939.x。
- 18.
Li D, Renzoni A, Estoppey T, Bisognano C, Francois P, Kelley WL, Lew DP, Schrenzel J, Vaudaux P:环丙沙星亚抑制水平或sigma B转录因子活性对喹诺酮耐药金黄色葡萄球菌中纤维连接蛋白粘附蛋白的诱导是通过两种不同的途径介导的。抗菌药物化学,2005,49:916-924。10.1128 / aac.49.3.916 - 924.2005。
- 19.
Edwards KJ, Saunders NA: Real-time PCR用于测定胁迫诱导铜绿假单胞菌藻酸途径基因表达的变化。中国生物医学工程学报,2001,29(3):326 - 326。10.1046 / j.1365-2672.2001.01339.x。
- 20.
Stevenson DM, Weimer PJ:热细胞梭菌ATCC 27405中17个基因在纤维素或纤维素二糖连续发酵过程中的表达。环境微生物学报,2005,29(4):366 - 366。10.1128 / aem.71.8.4672 - 4678.2005。
- 21.
Eleaume H, Jabbouri S:实时定量RT-PCR两种标准化方法在体外生长过程中跟踪金黄色葡萄球菌基因表达的比较。微生物学报,2004,59:363-370。10.1016 / j.mimet.2004.07.015。
- 22.
Fey A, Eichler S, Flavier S, Christen R, Hofle MG, Guzman CA:建立基于实时pcr的方法,以沙门氏菌为模型生物,精确定量水中细菌RNA靶标。环境科学与技术,2004,24(3):366 - 366。10.1128 / aem.70.6.3618 - 3623.2004。
- 23.
史亮,Jung YJ, Tyagi S, Gennaro ML, North RJ: th1介导的小鼠肺免疫表达诱导结核分枝杆菌非复制持久性转录模式。美国国家科学院院刊,2003,100:241-246。10.1073 / pnas.0136863100。
- 24.
Taylor DL, Ward PN, Rapier CD, Leigh JA, Bowler LD:用cDNA的表征差异分析鉴定uberis链球菌中差异表达的寡肽结合蛋白(OppA2)。中华微生物学杂志,2003,32(5):527 - 527。10.1128 / jb.185.17.5210 - 5219.2003。
- 25.
Ferreira AO, Myers CR, Gordon JS, Martin GB, Vencato M, Collmer A, Wehling MD, Alfano JR, Moreno-Hagelsieb G, Lamboy WF, DeClerck G, Schneider DJ, Cartinhour SW:全基因组表达谱分析定义了紫单胞菌的HrpL调控。番茄DC3000,可以重新重建Hrp顺式基因,并识别新的共调控基因。植物与微生物的分子相互作用。2006,19:1167-1179。10.1094 / mpmi - 19 - 1167。
- 26.
王晓燕,王晓燕,王晓燕,等。肺炎球菌vncrs基因在万古霉素耐药中的作用。中华微生物学杂志,2004,32(4):366 - 366。10.1128 / jb.186.24.8463 - 8471.2004。
- 27.
Holmes DE, Nevin KP, O'Neil RA, Ward JE, Adams LA, Woodard TL, Vrionis HA, Lovley DR:定量表达Geobacteraceae柠檬酸合酶基因的潜力,以评估Geobacteraceae在亚表面和电流收集电极上的活性。环境微生物学报,2005,29(4):369 - 369。10.1128 / aem.71.11.6870 - 6877.2005。
- 28.
Nielsen KK, Boye M:实时定量反转录- pcr分析胸膜肺炎放线菌管家基因在体外生长过程中缺铁条件下的表达稳定性。环境科学与技术,2005,29(6):369 - 369。10.1128 / aem.71.6.2949 - 2954.2005。
- 29.
Laskowski MA, Kazmierczak BI: RetS的突变分析,这是铜绿假单胞菌毒性所需的一种不寻常的传感器激酶响应调控杂交。中华传染病杂志,2006,34(4):369 - 369。10.1128 / IAI.00575-06。
- 30.
Nyberg J、Anderson MF、Meister B、Alborn AM、Strom AK、Brederlau A、Illerskog AC、Nilsson O、Kieffer TJ、Hietala MA、Ricksten A、Eriksson PS:葡萄糖依赖性的嗜胰岛素多肽在成年海马中表达并诱导祖细胞增殖。神经科学杂志,2005,25:1816-1825。10.1523 / jneurosci.4920 - 04.2005。
- 31.
Montes de Oca P, Macotela Y, Nava G, Lopez-Barrera F, de la Escalera GM, Clapp C:催乳素刺激整合素介导的循环单核细胞与内皮细胞的粘附。科学通报,2005,38(5):633-642。10.1038 / labinvest.3700256。
- 32.
吴伟,金姝:铜绿假单胞菌PtrB在DNA损伤应激下抑制III型分泌系统。中华微生物学杂志,2005,37(5):559 - 561。10.1128 / jb.187.17.6058 - 6068.2005。
- 33.
Hufnagel M, Koch S, Creti R, Baldassarri L, Huebner J:粪肠球菌一个新的基因位点上的糖结合转录调控因子与小鼠生物膜的产生和延长菌血症有关。中华传染病杂志,2004,19(4):426 - 426。10.1086/381150。
- 34.
Flatley J, Barrett J, Pullan ST, Hughes MN, Green J, pool RK:在既定的恒化条件下,大肠杆菌对s -亚硝基谷胱甘肽的转录反应揭示了蛋氨酸生物合成的主要变化。中国生物医学工程学报,2005,29(5):561 - 561。10.1074 / jbc.M410393200。
- 35.
李志强,李志强,李志强,等。嗜酸氧化亚铁硫杆菌群感应系统的研究。中国生物医学工程学报,2005,38:283-297。
- 36.
Dellagi A, Birch PRJ, Heilbronn J, Lyon GD, Toth IK:原核植物病原菌Erwinia carotovora差异基因表达的cDNA-AFLP分析。微生物学学报,2000,29(4):447 - 447。
- 37.
BestKeeper软件。[http://www.gene-quantification.de/bestkeeper.html]
- 38.
geNorm软件。[http://medgen.ugent.be/~jvdesomp/genorm]
- 39.
Botteldoorn N, Van Coillie E, Grijspeerdt K, Werbrouck H, Haesebrouck F, Donné E, D'Haese E, Heyndrickx M, Pasmans F, Herman L:实时反转录PCR定量肠沙门氏菌mntH表达作为生长阶段和吞噬体样条件的函数。中华微生物学杂志,2006,26(5):555 - 562。10.1016 / j.mimet.2005.11.003。
- 40.
颜宏宏,刘凤峰:卵菌植物疫病病菌实时定量RT-PCR内控基因的筛选。中国生物医学工程学报,2006,38(4):447 - 447。10.1016 / j.fgb.2006.01.010。
- 41.
Bogaert L, Van Poucke M, De Baere C, Peelman L, Gasthuys F, Martens A:在正常马皮肤和马结节中实时荧光定量PCR中选择一组可靠的内参基因。生物技术,2006,6:24-10.1186/1472-6750-6-24。
- 42.
Olsvik PA, Lie KK, Jordal AE, Nilsen TO, Hordvik I:大西洋鲑鱼实时RT-PCR研究中潜在内参基因的评估。分子生物学,2005,6:21-10.1186/1471-2199-6-21。
- 43.
乔根森,柯兰兰,葛利姆霍特,乔恩,等:大西洋鲑鱼实时聚合酶链反应内参基因的验证。生物技术,2006,8:398-408。10.1007 / s10126 - 005 - 5164 - 4。
- 44.
Spinsanti G, Panti C, Lazzeri E, Marsili L, Casini S, Frati F, Fossi CM:条纹海豚(Stenella coeruleoalba)皮肤活检中定量RT-PCR研究的内参基因选择。分子生物学杂志,2006,7:32-10.1186/1471-2199-7-32。
- 45.
大肠杆菌核糖体RNA转录:对ppGpp、ntp、结构蛋白和聚合酶结合蛋白的调控作用。中华微生物学杂志,2005,55:973-977。10.1111 / j.1365-2958.2004.04455.x。
- 46.
Deutscher MP:细菌中RNA的降解:mRNA和稳定RNA的比较。中国生物医学工程学报,2006,34:659-666。10.1093 / nar / gkj472。
- 47.
德沃夏克Z, Pascussi JM, Modriansky M:信使RNA检测方法的比较。中华医学大学学报(自然科学版),2003,31(4):447 - 447。
- 48.
Grifantini R、Bartolini E、Muzzi A、Draghi M、Frigimelica E、Berger J、Ratti G、Petracca R、Galli G、Agnusdei M、Giuliani MM、Santini L、Brunelli B、Tettelin H、Rappuoli R、Randazzo F、Grandi G:通过DNA微阵列鉴定的B组脑膜炎球菌候选疫苗。中国生物技术,2002,20:914-921。10.1038 / nbt728。
- 49.
Eriksson S, Lucchini S, Thompson A, Rhen M, Hinton JC:用细胞内沙门氏菌的基因表达谱揭示巨噬细胞感染的生物学。中国生物医学工程学报,2003,29(3):354 - 357。10.1046 / j.1365-2958.2003.03313.x。
- 50.
迪切罗F,谢颖,Paul-Satyaseela M, Kim KS:大肠杆菌K1与人脑微血管内皮细胞相互作用的细菌RNA分离和纯化方法。中华临床微生物学杂志,2005,43:4197-4199。10.1128 / jcm.43.8.4197 - 4199.2005。
- 51.
Radonic A, Thulke S, Mackay IM, Landt O, Siegert W, Nitsche A:定量实时PCR内参基因选择指南。生物化学与工程学报,2004,29(4):369 - 369。10.1016 / j.bbrc.2003.11.177。
- 52.
Savli H, Karadenizli A, Kolayli F, Gundes S, Ozbek U, Vahaboglu H: 6个管家基因表达稳定性:铜绿假单胞菌耐药基因实时定量RT-PCR研究的建议医学微生物学杂志,2003,52:403-408。10.1099 / jmm.0.05132-0。
- 53.
Smadja B, Latour X, Trigui S, Burini JF, Chevalier S, Orange N:两个Erwinia carotovora亚种(Pectobacterium spp.)生长的热依赖性和致病性相关的酶活性微生物学报,2004,50:19-27。03号10.1139 - 099。
- 54.
Erwinia carotovora subsp.;atroseptica SCRI1043基因组序列。[http://www.sanger.ac.uk/Projects/E_carotovora]
- 55.
Pfaffl MW, Horgan GW, dempfrle L: real-time PCR中相对表达结果的组间比较和统计分析的相对表达软件工具(REST)。核酸学报,2002,30:e36-10.1093/nar/30.9.e36。
- 56.
Sambrook J, Maniatis T, Fritsch EF:分子克隆:实验室手册。冷泉港,纽约,冷泉港实验室,1989,3 b -2
确认
作者希望感谢SCRI的Pectobacterium小组的建议和持续的合作。挪威研究理事会的财政支持得到了极大的肯定。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称没有利益竞争。
作者的贡献
GWT策划并执行了实验和分析,并编写了初稿。MBB参与了实验策划、总体监督和稿件撰写。IKT提供p . atrosepticum以及选择SCRI1043应变的依据recAGene,以及对手稿的批判性阅读。所有作者已阅读并认可最终稿。
权利与权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
Takle, g.w., Toth, I.K. & Brurberg, M.B.植物病原实时RT-PCR表达研究的内参基因评价Pectobacterium atrosepticum.植物生物学7,50(2007)。https://doi.org/10.1186/1471-2229-7-50
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-7-50
关键字
- 参考基因
- 果胶
- 参考基因候选基因
- 参考基因表达
- 受感染的植物材料