摘要
背景
启发被认为是改进的一项重要战略在体外次生代谢物的产生。在细胞培养中,生物和非生物激发子有效地刺激了植物次生代谢物的产生。然而,激发子信号级联导致植物细胞次生代谢物产生增加的分子基础在很大程度上是未知的。暴露的Catharanthus roseus也叫低剂量UV-B照射下的细胞悬浮培养发现,catharanthine的数量和编码色氨酸脱羧酶的基因转录(Tdc)和strictosidine合成酶(Str)。在本研究中,介导uv - b诱导花青素积累的信号通路c . roseus也叫进行悬浮培养。
结果
在这里,我们研究了细胞表面受体、介质碱化、Ca2 +涌入,H2O2, CDPK和MAPK在UV-B信号传导中发挥了必要的作用,从而促进了花青素的产生c . roseus也叫细胞悬浮培养。c . roseus也叫用各种已知信号成分的激动剂和抑制剂对细胞进行预处理,并研究它们对细胞积累的影响Tdc和Str利用各种分子生物学技术研究了花嘌呤的转录本和产量。研究发现,花青素的积累和转录Tdc和Str经预处理后,各种抑制剂如苏拉明、n -乙酰半胱氨酸、钙通量抑制剂、星孢素等。
结论
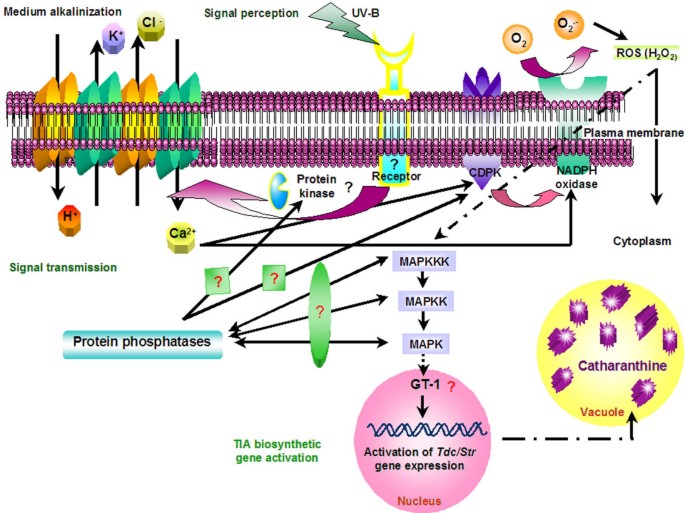
我们的研究结果表明,细胞表面受体(s), Ca2 +内流,中等碱化,CDPK, H2O2和MAPK在UV-B信号传导中发挥重要作用Tdc和Str基因与花青素的积累c . roseus也叫细胞悬浮培养。基于这些发现,我们提出了一个信号转导级联模型。
背景
c . roseus也叫产生萜类吲哚生物碱(TIAs)作为其次级代谢的一部分。TIAs保护植物免受微生物感染、食草动物和非生物环境胁迫,如紫外线照射[1,2]。一些TIAs具有重要的药学意义,如抗肿瘤二聚体生物碱长春新碱和长春碱,以及抗高血压的单体生物碱杨柳碱和蛇纹碱[3.]。抗肿瘤二聚体生物碱,其积累在叶子c . roseus也叫,是由catharanthine和vindoline单体组成,并且只存在于c . roseus也叫植物。在植物中,二聚体生物碱和单体catharanthine的积累量较低,而单体vindoline的积累量相对较高[4,5]。c . roseus也叫细胞培养已被研究作为生产萜类吲哚生物碱的替代方法,但它们未能生产出vindoline [6]。因此,人们认为通过从细胞培养中获得的catharanthine与从栽培植物中获得的vindoline偶联来生产二聚体是可取的。花青素的生产c . roseus也叫细胞培养一直是植物细胞培养中探索最广泛的领域之一,但由于产量低,仍然受到限制[7]。
启发被认为是改进的一项重要战略在体外次生代谢物的产生。在细胞培养中,生物和非生物激发子有效地刺激了植物次生代谢物的产生[8]。真菌激发子已被广泛用于激发多种植物的catharanthine生产c . roseus也叫细胞(5,9]。然而,激发子信号级联导致植物细胞次生代谢物产生增加的分子基础在很大程度上是未知的。众所周知,结合激发子的受体蛋白产生的信号通过不同的组分(如Ca)传递到基因表达位点2 +/离子通量,介质碱化和细胞质酸化,氧化爆发,茉莉酸和一氧化氮等。[8]。许多CDPKs和MAPKs已被确定在防御反应和次生代谢物的产生中发挥作用[10]。
UV-B照射对TIA生物合成基因表达的影响Tdc和Str,而catharanthine的生产先前在c . roseus也叫叶子(11- - - - - -13]。转录因子GT-1结合到的启动子区域体外Tdc。GT-1在诱导Tdc在紫外线下的表达已经通过GT-1结合位点的点突变得到证实[14]。然而,UV-B信号的分子基础级联导致诱导的表达Tdc和Str基因和TIAs的产生在很大程度上是未知的。已经观察到,在紫外线照射下,多肽伤口信号,系统特异性细胞表面受体启动信号转导级联l . peruvianum细胞悬浮培养[15]。在本研究中,介导uv - b诱导的花青素积累的信号通路c . roseus也叫进行悬浮培养。UV-B诱导培养基碱化、过氧化氢的生成、CDPK和MBPK的激活、catharanthine的积累和转录的刺激Tdc和Str研究了基因。配体-细胞表面受体结合抑制剂,蛋白激酶和磷酸酶,钙通量和H2O2来剖析UV-B信号级联。
结果
碱化的c . roseus也叫细胞悬浮介质对UV-B辐射的响应及苏拉明的抑制作用
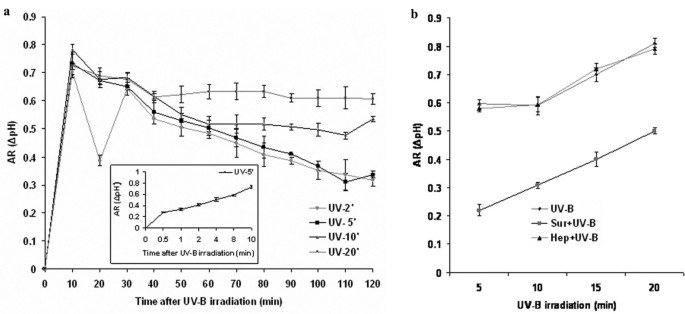
培养基碱化是在激发子处理的植物细胞培养中发生的早期事件,已被用作研究植物细胞中激发子结合位点的激发子反应的标记。16]。介质碱化被认为是由激发剂/应力诱导的质膜去极化和随后的K+/小时+与Ca交换2 +/ Cl涌入-流出(16]。为了确定培养基碱化是否作为早期事件参与了UV-B信号转导,将6天龄的细胞暴露于UV-B照射不同时间段(2、5、10或20分钟),并在细胞悬浮培养基中测量细胞外pH变化120分钟。如图所示1UV-B对培养基碱化的影响不存在剂量依赖性。然而,这种反应的动力学和强度取决于它们各自的暴露时间。c . roseus也叫在UV-B照射后,细胞的pH值在10 min时达到峰值,在5 min时增加了约0.7个单位(图2)1插图)。其他剂量的UV-B照射细胞确实导致AR增加,但在所有情况下,培养基的pH值都下降,但即使在24小时后也从未恢复到基线水平,这可能是由于长时间暴露于UV-B造成的损害(数据未显示)。然而,在用UV-B照射2和5分钟的细胞中,培养基的pH值在300分钟后恢复到基线(数据未显示)。照射24 h后检测细胞活力显示,UV-B照射2 min和5 min均未引起细胞死亡(经双乙酸荧光素/碘化丙啶染色,细胞存活率为98%);然而,照射时间超过5分钟会导致80% - 100%的细胞死亡(数据未显示)。因此,我们使用5分钟的UV-B作为所有进一步实验的标准照射时间。
已知苏拉明与细胞表面成分结合,如系统素受体[17]并干扰信号事件,该系统受到紫外线照射的影响l . peruvianum细胞(15]。由于UV-B照射c . roseus也叫我们研究苏拉明是否能抑制uv - b诱导的培养基碱化。结果表明,苏拉明可以抑制uv - b诱导的碱化(图2)1 b)。在UV-B照射的所有时间内,苏拉明都能抑制生长培养基的碱化。肝素与苏拉明具有相似的聚磺化基团,对UV-B辐照诱导的培养基碱化无影响。
UV-B-induced H2O2在uv - b诱导的H中蛋白激酶的产生和参与2O2生产
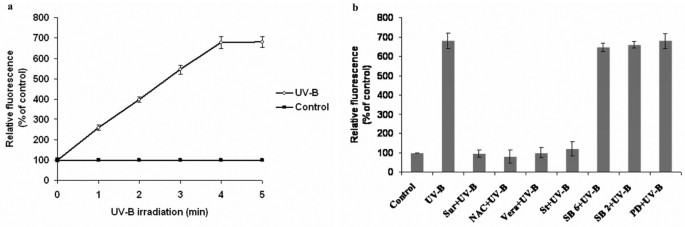
氧化爆发,氧气的快速消耗和活性氧(ROS)的产生,如H2O2,是植物防御反应中典型的早期事件[18,19]。用UV-B照射5分钟c . roseus也叫细胞H2O2与对照细胞相比,产量增加了6倍2)。接下来,我们研究了苏拉明(g蛋白抑制剂的抑制剂)、n -乙酰半胱氨酸(一种假定的ROS清除剂)、维拉帕米(一种钙通道阻滞剂)和staurosporine(一种丝氨酸-苏氨酸激酶抑制剂)、SB 203580(一种P38 MAPK抑制剂)、PD 98059(一种ERKK抑制剂)和SB 600125 JNK抑制剂的作用。UV-B诱导H2O2除MAPK级联抑制剂外,所有抑制剂均抑制其产生(图2)2 b)。这表明,在接收UV-B信号后,假定受体在c . roseus也叫H的诱导需要细胞、钙内流和丝氨酸/苏氨酸激酶的激活2O2生产。然而,MAPK级联的激活发生在H2O2生产。
活性氧的产生c . roseus也叫悬浮培养细胞对UV-B辐射的响应。(一个) UV-B诱导ROS产生的时间过程。用UV-B照射不同时间的6 d细胞悬浮培养物,加入2.5 μM DCFH-DA。15分钟后测量ROS的产生,作为uv - b照射和未处理对照之间荧光强度的差异。柱状图代表平均值±SD (n = 3)。b)各种抑制剂对UV-B诱导的ROS产生的影响。用1 mM苏拉明(Sur)、10 mM n -乙酰半胱氨酸(NAC)、0.5 μM维拉帕米(Vera)、10 nM staurosporine (St)、40 nM SB 600125、JNK抑制剂(SB6)、70 nM SB 203580、P38抑制剂(SB2)和5 μM PD 98059、ERKK抑制剂(PD)处理6 d的细胞悬浮培养,然后在UV-B照射5分钟,并在处理后的培养中加入2.5 μM DCFH-DA。产生的活性氧测量方法如上所述。
UV-B辐照下蛋白激酶的活化c . roseus也叫悬浮细胞培养
已知许多蛋白激酶对生物和非生物胁迫都有反应。两种激酶,MAPKs和CDPKs,被认为在对各种刺激的反应中起关键作用[17,20.]。之前的研究已经证明了这一点c . roseus也叫细胞也通过表达生物合成基因和产生TIAs来响应UV-B照射[13]。为了建立这些过程之间的功能联系,我们首先检查了UV-B照射细胞中MAPK和CDPK的可能激活。众所周知,MBP是一种传统的MAPK底物,MAPK同源物也具有MBP激酶活性[21]。为了确定MAPK是否与UV-B信号有关,研究了MBP激酶的激活
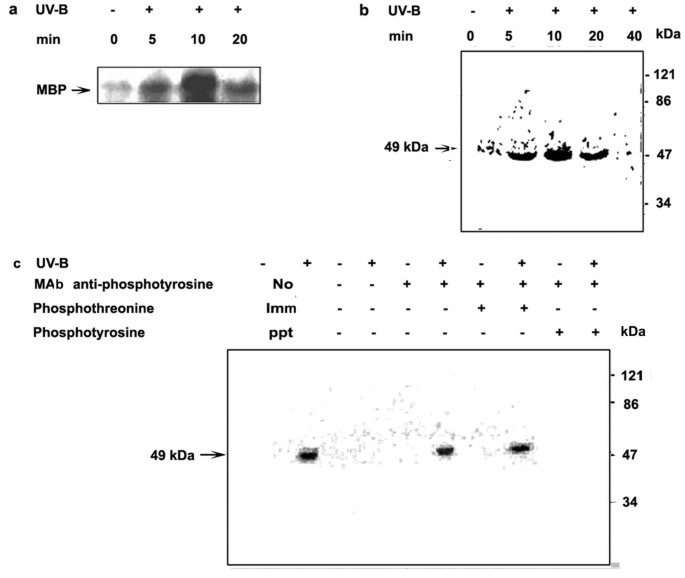
c . roseus也叫将细胞悬液暴露在UV-B照射下5分钟,然后测定不同时间段细胞的MBPK和CDPK活性。在体外对UV-B辐照和对照制备的细胞提取物进行测定c . roseus也叫细胞。数字3表明,UV-B照射后细胞MBPK活性在5分钟内显著升高,并在10分钟达到峰值。辐照后20 min, MBPK活性仍保持较高水平,高于对照水平。为了确定UV-B诱导的MBPK特异性活性,进行了凝胶内激酶试验。数字3 b结果表明,在UV-B照射细胞中,含有MBP的聚丙烯酰胺凝胶可以检测到一种主要蛋白激酶的活性。根据SDS-PAGE过程中MBPK活性带的迁移率,估计该酶的表观分子质量约为49 kDa。与未照射对照相比,UV-B照射使细胞49-kDa MBPK活性增加。在UV-B处理后10 min, MBPK活性达到最大值。在所有的在体外以MBP为底物进行实验,磷酸化在10 min达到峰值;这些结果在不同批次的细胞重复实验时一致得到。因此,在所有进一步的实验中,均在辐照后10分钟测定MBPK活性。
UV-B辐射对髓鞘碱性蛋白激酶(MBPK)活性的激活作用c . roseus也叫悬浮培养细胞。6天大的细胞悬浮培养物用UV-B光照射5min(+)或不照射(-)作为对照。在指定的时间段收获细胞,制备粗提取物,并使用MBP作为底物(如材料和方法所述)检测细胞提取物中的MBPK活性。(一个)用an进行MBPK活性测定在体外磷酸化化验。反应混合物用SDS - 10% (w/v)聚丙烯酰胺凝胶电泳分离,磷酸化的MBP通过放射自显像显示。(b)以MBP为底物,采用凝胶激酶法测定细胞提取物中MBPK的活性。放射自显像表示凝胶内MBP磷酸化。(c)利用抗磷酸酪氨酸抗体检测细胞提取物免疫沉淀中的MBPK活性。Lane 1和Lane 2代表直接进行凝胶激酶试验的细胞提取物,没有免疫沉淀。Lane 3至10表示用磷酸酪氨酸特异性单克隆抗体进行免疫沉淀的细胞提取物,并用凝胶内激酶法检测免疫沉淀物的MBPK活性。磷酸化的MBP通过放射自显像显示。磷酸酪氨酸和磷酸苏氨酸作为竞争底物来证明抗体的特异性。符号(-)和(+)表示未治疗和已治疗的指示治疗。
为了进一步表征UV-B诱导的MBPK活性,采用免疫沉淀法和凝胶激酶法。蛋白提取物用抗磷酸酪氨酸单克隆抗体孵育,用蛋白a -琼脂糖免疫沉淀。免疫沉淀蛋白在含有MBP作为底物的sds -聚丙烯酰胺凝胶上分离,在存在的情况下测定凝胶中的MBPK活性32P - ATP。如图所示3 c,在uv - b照射细胞的免疫沉淀中再次检测到49 kDa的蛋白激酶。与磷酸酪氨酸共孵育可阻止49 kDa蛋白激酶与抗磷酸酪氨酸抗体的免疫沉淀,而与磷酸苏氨酸共孵育则无此作用。这些结果表明,在免疫沉淀过程中,只有磷酸酪氨酸而不是磷酸苏氨酸可以作为竞争对手,表明MBP磷酸化激酶在酪氨酸残基上特异性磷酸化。迄今为止,MAPK是唯一已知的在酪氨酸残基上被磷酸化的植物激酶。
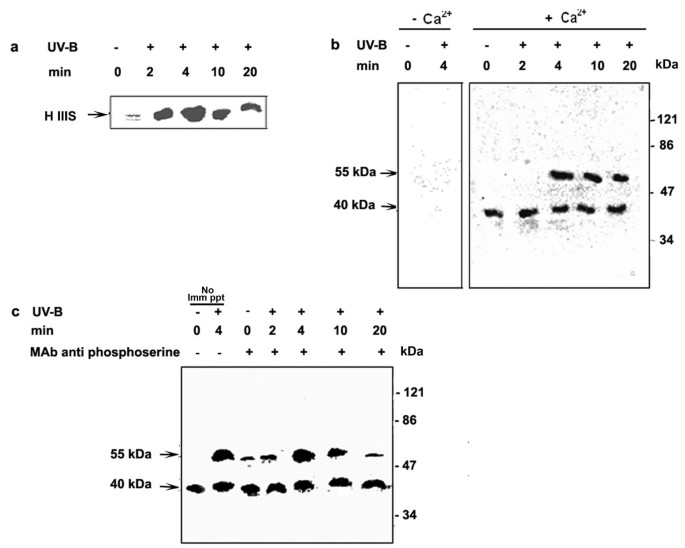
钙依赖性蛋白激酶(CDPKs)属于独特的钙调节激酶家族,组蛋白IIIS是检测CDPKs的最佳外源性底物之一[22]。为了表征UV-B诱导的激酶,我们用组蛋白IIIS作为底物,在UV-B照射细胞和对照组的蛋白质提取物中测定了其活性。以组蛋白IIIS为底物,在钙存在的条件下,对UV-B照射5分钟后的细胞蛋白提取物进行检测,结果表明,在UV-B照射后4分钟,激酶活性显著增加,达到峰值,即使在UV-B照射后20分钟,激酶活性仍保持较高水平(图2)4)。使用组蛋白IIIS作为底物,用凝胶激酶法测定了UV-B照射5分钟细胞的蛋白提取物,在没有钙和存在钙的情况下,组蛋白IIIS的磷酸化在UV-B照射和未照射的细胞中都是钙依赖的(图2)4 b)。在表观分子量分别为55 kDa和40 kDa的两个位点上鉴定出CDPK活性。其中一个活化的CDPK表观分子量为40 kDa,并且是组成型的,因为观察到它在未照射和照射细胞中磷酸化组蛋白IIIS的程度相似,而55 kDa激酶活性表现出对UV-B的依赖性,并在4分钟达到峰值。因此,观察到组蛋白IIIS的磷酸化在体外55 kDa和40 kDa激酶的活性。CDPKs是丝氨酸-苏氨酸激酶,在丝氨酸和苏氨酸残基上都被磷酸化。为了区分我们实验中检测到的MBP激酶和组蛋白IIIS激酶,我们使用抗磷酸丝氨酸单克隆抗体进行免疫沉淀,然后用蛋白a -琼脂糖拉下,并用凝胶内激酶法检测组蛋白IIIS作为底物。数字4摄氏度如图所示,凝胶内激酶试验鉴定的55和40 kDa激酶4 b在丝氨酸残基上都被磷酸化,并且在我们的细胞培养中40kda激酶的活性是组成的。在所有的在体外以组蛋白IIIS为底物进行的实验中,磷酸化在4 min达到峰值。不同批次的细胞重复实验时,结果一致。因此,在所有进一步的实验中,CDPK活性都是在照射后4分钟测定的。
CDPK的活化c . roseus也叫悬浮培养细胞对UV-B辐射的响应。6天大的细胞悬浮培养物用UV-B光照射5min(+)或不照射(-)作为对照。在指定的时间段收获细胞,制备粗提取物,并使用组蛋白IIIS作为底物(如材料和方法所述)检测细胞提取物中CDPK的活性。(一个)用an测定CDPK在体外磷酸化化验。反应混合物用SDS - 10% (w/v)聚丙烯酰胺凝胶电泳溶解,并进行放射自显影。(b)用凝胶激酶法测定细胞提取物中CDPK的活性,以组蛋白IIIS为底物,在存在和不存在钙的情况下。放射自显像表示凝胶内组蛋白IIIS磷酸化。箭头表示两条检测到的CDPK条带的分子质量(c)用抗磷酸丝氨酸抗体检测细胞提取物免疫沉淀中的CDPK活性。Lane 1和Lane 2代表直接进行凝胶激酶试验的细胞提取物,没有免疫沉淀。Lane 3至7表示用磷酸丝氨酸特异性单克隆抗体进行免疫沉淀的细胞提取物,并用凝胶内激酶法检测免疫沉淀物的CDPK活性。磷酸化的组蛋白IIIS通过放射自显像显示。符号(-)和(+)表示未治疗和已治疗的指示治疗。箭头表示两条检测到的CDPK条带的分子质量。
uv - b诱导的MBPK和CDPK活性;Tdc和Str苏拉明抑制基因表达和catharanthine积累
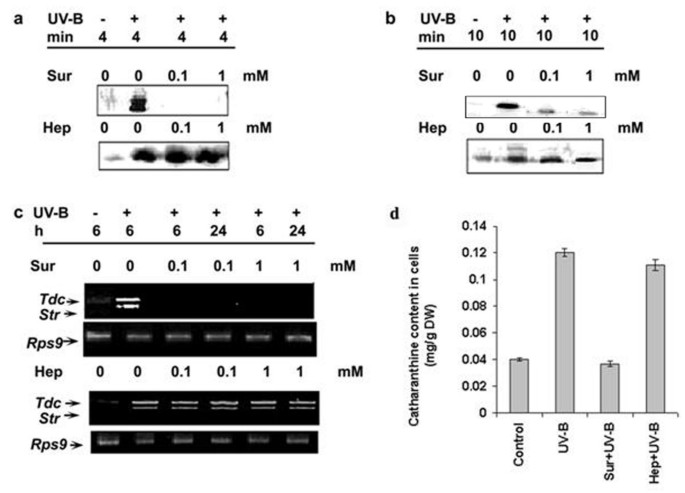
因为uv - b诱导的早期细胞反应即在UV-B诱导的其他与TIAs合成相关的细胞反应中,苏拉明是否也能抑制活性氧的生成。用0.1和1mm浓度的苏拉明预处理10 min后,再用UV-B照射5 min, UV-B诱导的MBPK和CDPK活性、积累量和浓度均显著降低Tdc和Str转录本和catharanthine被强烈抑制(图2)5模拟)。然而,苏拉明不能完全抑制uv - b诱导的MBPK活性。为了排除苏拉明对UV-B引发的反应的抑制作用不是由于其与细胞表面成分的非特异性结合的可能性,我们使用了结构相似的分子肝素即具有与苏拉明相似的磺酸基团的抑制UV-B反应的肝素。数字5模拟结果表明,0.1和1mm浓度的肝素对UV-B介导的任何信号事件都没有影响,这表明苏拉明在UV-B照射条件下的作用是特异性的。这些数据表明苏拉明敏感的细胞表面受体可能参与了UV-B反应。
苏拉明和肝素对uv - b诱导的CDPK活性的影响(一个)、MBPK活性(b),Tdc和Str基因表达(c)和花青素的积累(d)细胞悬浮培养c . roseus也叫。用苏拉明(Sur)或肝素(Hep)按指定浓度对6天的细胞悬浮培养物进行预处理,然后用UV-B照射5分钟。作为对照,一组细胞单独用UV-B照射或不照射,在指定的时间制备所有细胞的粗提取物,并检测H IIIS的磷酸化(一个)及MBP (b)在材料和方法中描述的标准条件下。对第二组细胞进行类似处理,并在指定时间分离总RNA,分析转录水平Tdc和Str通过RT-PCR (c)。第三组细胞用先前使用的最高浓度的抑制剂预处理,然后进行5分钟的UV-B照射。处理48h后收集细胞,采用高效液相色谱法(d)。这些实验一式三次,至少重复两次。误差条表示平均值±SD (n = 3)。
Ca的作用2 +在UV-B诱导的反应c . roseus也叫细胞
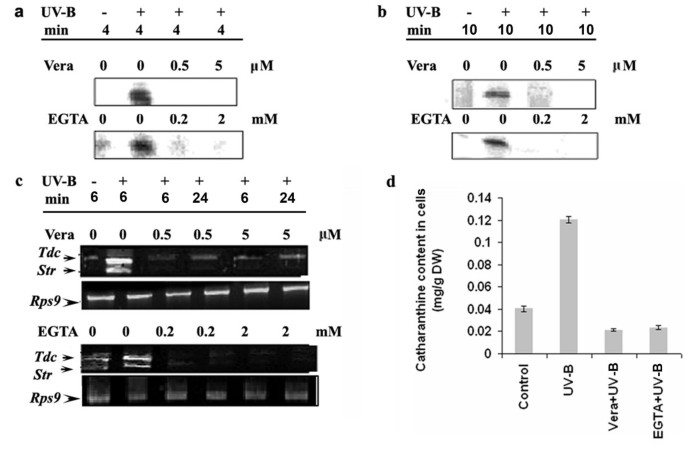
膜通透性的变化和由此产生的离子通量主要是钙离子2 +和H+和K+和Cl-外排是植物细胞对诱导最迅速的反应之一[23,24在这些离子通量中,钙离子的流入2 +在启动子信号的转导和启动子诱导的植物次生代谢物积累中发挥重要作用[25]。评估Ca2 +内流参与了uv - b诱导的导致花青素积累的信号通路c . roseus也叫在UV-B照射前,用特异性钙螯合剂EGTA处理培养细胞,并观察UV-B诱导的反应。因为EGTA不太可能进入细胞,我们预计它会制造细胞外Ca2 +至少部分不能通过螯合进入细胞质。EGTA预处理在很大程度上降低了受UV-B刺激的MBPK和CDPK活性,表明EGTA阻断了UV-B反应(图2)6和6 b)。的水平Tdc和Str随着EGTA浓度的增加,UV-B照射细胞中转录本和花青素含量也逐渐降低(图2)6摄氏度和6 d)。通过研究质膜钙通道阻滞剂维拉帕米对UV-B诱导反应的影响,进一步证实了钙参与了UV-B诱导的catharanthine积累的信号通路。如图所示6和6 b维拉帕米显著抑制了uv - b诱导的MBPK和CDPK活性。紫外线b诱导的积累Tdc和Str维拉帕米治疗后转录本也减少(图2)6摄氏度)。维拉帕米预处理后的细胞catharanthine含量也显著降低(图2)6 d)。这些结果表明,uv - b诱导的catharanthine积累需要细胞质钙水平升高,而这种增加是由细胞外空间的钙流入引起的。
蛋白磷酸化在UV-B诱导反应中的作用c . roseus也叫细胞
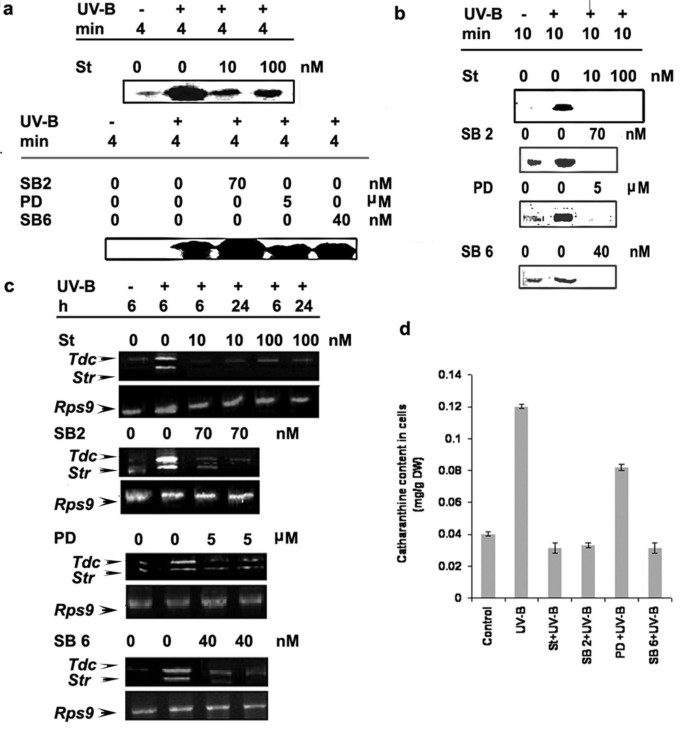
建立了49-kDa的MBPK和55-kDa的CDPK在UV-B照射下被激活c . roseus也叫细胞(无花果3.和4),我们利用这一特性结合蛋白激酶抑制剂来评估这些激酶在UV-B信号通路中可能参与导致catharanthine积累的作用。的c . roseus也叫用蛋白激酶抑制剂和uv - b诱导的反应处理细胞,即.、MBPK和CDPK活性;Tdc和Str检测转录物积累量和花嘌呤含量。Staurosporine是一种有效的丝氨酸-苏氨酸激酶抑制剂,SB 203580是一种P38类MAP激酶抑制剂,PD 98059是MAPKK的ERKK类抑制剂,SB 600125是一种Janus激酶抑制剂,用于评估蛋白质磷酸化在UV-B反应中的作用。如图所示7一个和7 bstausporine、SB 203580、PD 98059和SB 600125处理完全消除了uv - b诱导的MBPK活性,而stausporine不能完全抑制uv - b诱导的CDPK活性,而SB 203580、PD 98059和SB 600125预处理也不能抑制细胞的CDPK活性。staurosporine对MBPK和CDPK活性的抑制作用表明该抑制剂对这两种蛋白激酶具有共同的作用机制,因为它们都属于丝氨酸-苏氨酸激酶家族。正如预期的那样,MAPK级联抑制剂仅抑制uv - b诱导的MAPK样MBPK活性,而不抑制CDPK活性。接下来我们考察了的积累Tdc和Str逆转录聚合酶链反应(RT-PCR)检测蛋白激酶抑制剂处理细胞的mRNA表达。如图所示7 cstaurosporine、SB 203580、PD 98059和SB 600125对uv - b的诱导有抑制作用Tdc和Str记录积累。以类似的方式,上述抑制剂显著降低了uv - b诱导的catharanthine的产生(图2)7 d)表明MBPK和CDPK活性在UV-B诱导的花青素生物合成中的作用。通过免疫沉淀实验和使用MAPK级联特异性抑制剂获得的数据表明,推测的MAPK参与了对UV-B的反应。
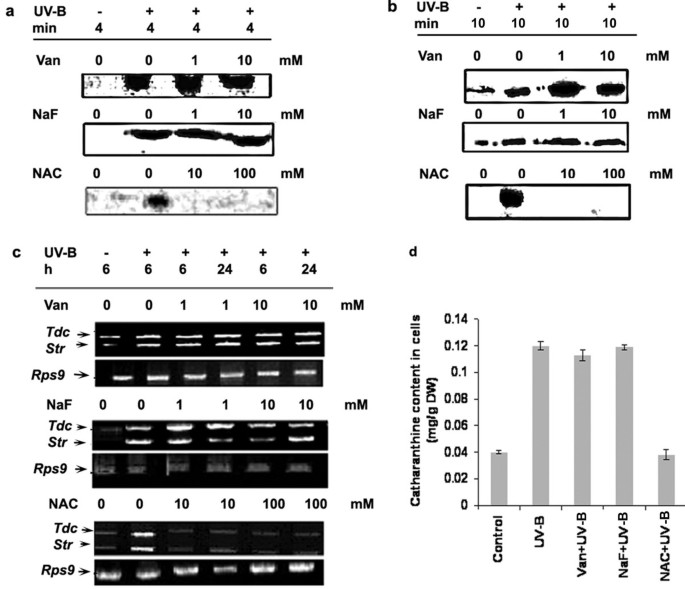
由于蛋白磷酸酶能拮抗蛋白激酶的活性,我们测试了用蛋白磷酸酶抑制剂预处理细胞是否会对uv - b诱导的反应产生相反的作用。有趣的是,加入原钒酸盐,一种已知的酪氨酸磷酸酶抑制剂[26]或氟化钠,一种据报道能强烈抑制丝氨酸-苏氨酸磷酸酶的化合物[27],仅以高于UV-B处理活性的1和10 mM浓度刺激了UV-B诱导的MBPK活性,而CDPK活性不受影响(图2)8 b和8)。与UV-B处理的细胞相比,用正戊酸盐和氟化钠预处理细胞并没有显著增加CDPK活性。为了进一步测试蛋白磷酸酶在uv - b诱导的蛋白磷酸化活性中的作用,我们使用了NAC,已知NAC可以保护磷酸酶的巯基不被失活[26]。NAC预处理细胞在10和100 mM浓度下可抑制uv - b诱导的MBPK和CDPK活性8和8 b)。如图所示8 c结果表明,原钒酸盐或NaF预处理并没有增加Tdc和Str超过单独接受UV-B照射的细胞的水平;另一方面,NAC降低了uv - b诱导的叶绿素积累Tdc和Str记录。在生物碱水平上,我们发现桂花碱在黄芪中的积累c . roseus也叫UV-B照射使细胞数量显著增加(图2)8 d)。前钒酸盐或氟化钠预处理对培养体上方catharanthine的积累无显著影响c . roseus也叫单独用UV-B照射的细胞。NAC对uv - b诱导的细胞凋亡有全面抑制作用Tdc和Str转录水平以及catharanthine的积累。NAC除了保护磷酸酶免于失活外,也是活性氧产生的有效抑制剂。结果如图所示2以及图8表明UV-B信号通路涉及ROS的产生和磷酸酶的失活。
讨论
一些研究已经证明了信号成分的参与,如受体,Ca2 +内流、中等碱化、氧化爆发、蛋白激酶和磷酸酶对激发子的反应,通过增加相关基因的转录来增强次级代谢物的产生[j]。8]。早前在c . roseus也叫非生物激发剂UV-B诱导形成二聚体TIAsTdc和StrmRNA积累量[13]。也有证据表明核因子GT-1在调节Tdc紫外光下基因表达c . roseus也叫[14]。然而,调节转录因子GT-1活性的UV-B信号通路导致Tdc基因表达仍然很模糊。在目前的研究中,我们提出的证据表明,一个假定的受体(s),钙,活性氧,Ca2 +-依赖蛋白激酶,以及推测的MAPK在UV-B信号传导和转录激活中的作用Tdc和Str基因与花青素生物合成c . roseus也叫细胞。
基于苏拉明干扰系统素与其细胞表面受体的结合和紫外线- b反应l . peruvianum细胞(17我们使用苏拉明来评估细胞表面受体在uv - b诱导的TIA生物合成基因表达中的作用。结果如图所示1,2和5结果表明:uv - b诱导的培养基碱化、ROS生成、CDPK和MBPK活性;Tdc和Str苏拉明对catharanthine的基因表达和积累均有抑制作用。苏拉明本身不直接影响介质碱化,但通过受体起作用[17]。这表明苏拉明作用于上述uv - b诱导的反应和uv - b诱导的TIA生物合成的上游。苏拉明对UV-B反应的抑制作用支持了一种假定的细胞表面受体在UV-B信号通路中的作用Tdc和StrmRNA和catharanthine的积累c . roseus也叫细胞。
我们使用Ca2 +螯合剂;EGTA和Ca2 +通道阻滞剂、维拉帕米的作用2 +在UV-B诱导反应中这两种处理都阻断了uv - b诱导的MBPK和CDPK活性的刺激以及uv - b诱导的Tdc和Strmrna和花青素。因为EGTA和维拉帕米不太可能进入细胞,维拉帕米阻断Ca2 +定位于质膜的通道[28,29],我们的数据表明Ca2 +UV-B信号的转导需要来自细胞外介质,而UV-B可能会影响Ca的活性2 +频道。我们的研究不排除钙从细胞内腔室如内质网、高尔基体和液泡中动员的可能性。Ca2 +信令包括并行和/或顺序地使用不同的Ca源2 +在不同的亚细胞位置有不同的通道。在烟草细胞中证实,低渗透休克刺激钙离子2 +以顺序的方式流入,首先来自外部,然后是内部Ca2 +这些流入是由钙介导的2 +渠道(30.]。因此,本研究提供了Ca2 +在参与TIA生物合成的基因激活的UV-B信号转导中作为第二信使。
我们的研究结果还表明,UV-B激活了活性氧的生成c . roseus也叫细胞(图2)。通过氧化爆发产生活性氧被证明是由多种激发子诱导的,例如烟草上的酵母激发子[31,32]、番茄中的几丁质寡糖[33]、红三叶草根中的真菌寡糖[34],以及云杉中的真菌激发子[35]和欧芹细胞悬浮液[36]。使用NAC, Ca2 +通道阻滞剂和广泛的激酶抑制剂staurosporine,我们发现蛋白质磷酸化和细胞内钙水平的增加是UV-B诱导的ROS生成激活所必需的。然而,MAPK级联抑制剂对ROS的产生没有影响,这表明ROS的产生发生在MAPK级联激活的上游。uv - b诱导的ROS产生的最有可能的来源c . roseus也叫是一种膜结合的NADPH氧化酶复合物,它利用分子氧制造超氧化物[37]。在拟南芥悬浮细胞,哺乳动物NADPH氧化酶复合物的催化亚基的同系物,被证明对细菌蛋白激发子harpin的ROS积累有反应[38]。研究表明,马铃薯块茎、云杉和烟草细胞中ROS的产生需要蛋白质磷酸化[39]。蛋白激酶抑制剂staurosporine和Ca的抑制作用2 +通道阻断剂对uv - b诱导的ROS生成的影响c . roseus也叫细胞(图2 b)支持钙依赖性蛋白激酶参与UV-B诱导ROS生成的事实。有一些报道称CDPK激活NADPH氧化酶[40- - - - - -43]。uv - b诱导的ROS是否通过CDPK诱导NADPH氧化酶活性产生仍有待确定。
蛋白质的磷酸化和去磷酸化被认为在植物细胞的激发子信号转导中起着关键作用。这里显示的数据表明辐照c . roseus也叫UV-B光照下的细胞强烈激活49 kDa的推测MAPK,而49 kDa的推测MAPK响应于UV-B的激活与激酶上的酪氨酸磷酸化有关,这是MAPK大家族的一个显著特征。我们得出结论,uv - b激活的49 kDa推测的MAPK可能是MAPK家族的一员。我们的研究结果(图4)也表明Ca2 +-依赖性蛋白激酶(s)或钙调素依赖性蛋白激酶(s)在UV-B反应中的作用。MAP激酶是一组丝氨酸/苏氨酸蛋白激酶的成员,是细胞内信号的重要转导器,通过各种细胞外刺激启动的蛋白磷酸化,参与动物和酵母细胞的增殖、分化和应激反应[qh]44]。本研究的另一个值得注意的方面是,星孢素已被用作各种蛋白激酶的有效抑制剂,完全抑制mapk样蛋白和CDPK活性(图2)7一个和7 b)。值得注意的是,特异性合成MAPKs抑制剂的预处理阻止了uv - b诱导的mapk样酶活性的刺激;然而,没有观察到对CDPK活性的影响(图2)7一个和7 b),这表明CDPK的激活相对于MAPK的激活要早一些。这些数据将MAPK的下游中间体置于细胞反应中,介导花嘌呤的生物合成以响应UV-B,并将CDPK定位在MAPK的上游。UV-B-mediatedTdc/Str基因转录似乎依赖于MAPK和CDPK途径的激活。细胞中MAPK的活性是通过其上游激酶MAPKK和MAPKKK的磷酸化激活以及其负调节因子MAPK磷酸酶/s的去磷酸化失活来控制的。在本研究中,我们发现UV-B诱导的mapk样活性可以被ERKK (MAPKK)抑制剂PD98059抑制,而PD98059与动物细胞相似,在UV-B信号传导中没有作用。使用磷酸酶抑制剂和NAC获得的结果应谨慎解释,因为这些抑制剂不具有特异性。例如NAC既是自由基清除剂又是磷酸酶巯基保护剂[26]。另一方面,磷酸酶抑制剂可以在较高浓度下影响细胞的活力或介导激酶活性的全面上调[45]。我们可以将其归因于紫外线b诱导的磷酸酶抑制剂处理细胞的任何下游活性都没有上调,这可能是由于这些化合物对整个细胞稳态的畸变或毒性作用。事实上,用抑制剂orthovandate或NAF单独处理细胞激活了许多不同的激酶,MBP和H IIIS在凝胶磷酸化试验中检测到(数据未显示)。的Tdc和Str在原钒酸盐或NAF单独处理的细胞中,活性和catharanthine积累再次与UV-B单独处理的细胞相当(数据未显示),这表明对细胞稳态的不平衡影响,或者磷酸酶的下调不是TIA途径上调的唯一事件,TIA生物合成的调节确实存在其他机制。
一个初步的UV-B信号流模型,结合了这些目前和以前的发现,如图所示9。当通过一个假定的受体感知UV-B光时,需要蛋白磷酸化来诱导钙通过质膜通道流入。这导致细胞质钙水平的短暂增加,这是随后激活CDPK所必需的。激活后的CDPK调节质膜内NADPH氧化酶的活化,释放ROS。最后,在ROS生成的下游,uv - b诱导和激活的MAP激酶可能参与了GT-1核因子等调节蛋白的激活,从而导致TIA生物合成基因的转录激活,并增强了catharanthine的产生。
早前有报道,酵母激发子(YE)在c . roseus也叫激活十八烷通路;通过激活钙内流和蛋白质磷酸化级联反应导致茉莉酸(JA)水平增加[9]。JA诱导表达ORCA3基因通过翻译后修饰进一步与Tdc启动子和YE和ja应答的RV片段Str促进基因表达的启动子[46- - - - - -48]。据报道,YE还诱导锌指蛋白的表达,锌指蛋白通过与基因启动子区域内的特定元素结合而表达Tdc和Str可以抑制其基因表达[49]。类似的,ye诱导的CrBPF1表达也被报道参与调控STR透过与广管区相互作用[50]。了解UV-B和YE诱导的TIA通路在信号转导中是否有共同的元件,以及UV-B是否利用YE诱导的任何转录启动物或抑制物来启动TIA通路,将是一件有趣的事情。
方法
化学物质
2', 7'- DCFH-DA, EGTA,肝素,组蛋白IIIS, n -乙酰半胱氨酸,磷苏氨酸,磷酪氨酸,氟化钠,原钒酸钠和维拉帕米购自美国圣路易斯Sigma化学公司。β-甘油磷酸钠和氟化钠来自印度Hi-media实验室。Catharanthine和vindoline来自中国上海康凯生物制品公司。Staurosporine和suramin来自德国MP Biomedicals公司。phospo -serine和phospo -tyrosine单克隆抗体、完整蛋白酶抑制剂混合物和髓鞘碱性蛋白购自美国Upstate实验室。SB 203580 (P38抑制剂)、PD 98059 (ERKK抑制剂)和SB 600125 (JNK抑制剂)是班加罗尔I.I.Sc Anjali Karande教授赠送的礼物。
用UV-B和化学物质进行细胞培养和处理
c . roseus也叫悬浮培养细胞的培养方法如前所述[51]。将3ml的6天龄固定生长期培养物无菌转移到35毫米培养皿上,用UV-B (Minera灯,UVM 57, San Gabriel, California)直接照射,培养细胞与灯之间的距离为2.5 cm,如图所示[51]。对于化学处理,参与其他信号转导途径的效应器的激动剂或拮抗剂在水中稀释到适当的最终浓度,如图图例所示,从按表所述制备的原液中提取1。细胞用不同的化学物质处理10分钟(见表2)1),然后用UV-B照射5分钟,如图图例所示。对照培养物用等量的水、乙醇或二甲基亚砜处理。在处理结束时收获细胞,立即在液体N中冷冻2-80°C保存至使用。
中等碱化反应(AR)试验
为了确定uv - b诱导培养基的碱化程度,在照射5min后,从0到120min测量培养基的pH值。UV-B诱导的培养基碱化反应(AR)计算为未经处理的对照和相应的UV-B照射样品之间的pH差,如下所述[15]。
H的测量2O2生产
H2O2采用细胞渗透性荧光探针2',7'-二氯二氢荧光素二乙酸酯(DCFH- da),通过监测DCFH氧化为DCF(二氯荧光素)的荧光增加来测量产量,如Pauw等人所述。37]。在UV-B照射后立即将2.5 μM DCFH-DA加入细胞悬浮培养中。不同时间UV-B照射后,细胞内H2O2在488 nm激发波长和525 nm发射波长的发光光谱仪(Perkin Elmer LS50B)中监测15 min后荧光的增加。确定抑制UV-B诱导的H2O2在uv - b辐射5分钟之前,加入各种抑制剂10分钟。
细胞提取物的制备
离心收集处理后的细胞悬液,分别在液氮中冷冻,-80°C保存待用。样品解冻至4°C,在含有50 mM HEPES-KOH pH 7.6, 2 mM DTT, 1 mM EDTA, 1 mM EGTA, 20 mM β-甘油磷酸,20%甘油,1 mM Na的缓冲液中超声波(30%振幅,15个脉冲)3.签证官4每50 ml缓冲溶液中加入1 mM NaF和1片完全蛋白酶抑制剂(Upstate) (EDTA和EGTA在钙依赖性激酶试验中被排除在外)。匀浆在4°C下以12,000 rpm离心25分钟。上清立即用作总可溶性蛋白的来源,以测定CDPK和MAPK的活性。上清液中总蛋白用Bradford [52使用BSA作为标准。
蛋白激酶测定
总可溶性蛋白c . roseus也叫根据Putnam-Evans等人的方法测定细胞CDPK和MBPK底物磷酸化活性。[53稍加修改。取等量的蛋白,在总反应量为30 μl的激酶测定缓冲液(25 mM Tris pH 7.5, 5 mM MgCl)中进行反应2, 1 mM EGTA, 1 mM DTT和2 μCi γ32P ATP用于MAPK测定或在含有25 mM Tris pH 7.5, 200 μM CaCl的缓冲液中2, 10 mM MgCl22 μCi γ32P ATP(用于CDPK测定)在室温下保存30分钟。将50 μg髓鞘碱性蛋白(MBP)或组蛋白IIIS (HIIIS)分别加入上述相同的反应缓冲液中,进行底物磷酸化测定。加入电泳样品上样缓冲液终止反应。经12% sds -聚丙烯酰胺凝胶电泳后,经放射自显像显示磷酸化的MBP和HIIIS。
CDPK和MBPK活性分别以组蛋白IIIS和髓鞘碱性蛋白为底物,通过凝胶激酶测定,如前所述[41]。
对于免疫复合物激酶活性测定,采用单克隆抗磷酸酪氨酸抗体和单克隆抗磷酸丝氨酸抗体分别对MBPK和CDPK进行免疫沉淀,方法由Stratmann和Ryan [54]。免疫沉淀用免疫沉淀缓冲液(10 mM Tris, pH 7.5, 150 mM NaCl, 1 mM EDTA, 1 mM EGTA, 1 mM Na)制备总体积为100 μl的可溶性蛋白(200 μg)3.签证官41 mM NaF, 10 mM β-甘油磷酸,1 % [w/v] Triton X- 100, 2 mM DTT和1片完全蛋白酶抑制剂(每50 ml缓冲液),5 μg单克隆抗磷酸酪氨酸或抗磷酸丝氨酸抗体在1.5 ml epppendorf管中,4℃孵育2 h。CDPK试验采用不含EDTA和EGTA的相同免疫沉淀缓冲液。与竞争对手磷酸反应时,抗体与1 mM的磷酸在室温下预孵育30分钟。加入约25 μl包装体积的重组蛋白A,固定在琼脂糖上,在4℃下继续孵育2 h。将免疫沉淀的MBPK和CDPK在12,000 g离心10 min后成球,用免疫沉淀缓冲液洗涤2次。样品煮沸2min,分别在10% SDS凝胶上用MBP或H IIIS电泳分离,凝胶内激酶测定方法如上所述。
RNA分离及RT-PCR分析
细胞的总RNAc . roseus也叫采用Qiazol试剂(Qiagen Inc.)进行分离。德国)按照制造商的说明。用分光光度法在260和280 nM (A260/A280 ~2.0;A260 = 40 μg RNA/ml),琼脂糖凝胶目测。用RNase-free DNase i处理总RNA样品,去除DNA。在20 μl反应中,加入1 μg总RNA, 5 μg寡核苷酸(T)进行反转录。16日至18日引物,MuMLV逆转录酶(40 U), RNasin (20 U), 0.5 mM dNTPs和MuMLV逆转录酶反应缓冲液(250 mM Tris-HCl, pH 8.3, 250 mM KCl, 20 mM MgCl)2和50 mM DTT), 37℃加热1 h, 70℃加热10 min终止。RT反应结束后,进行cDNA PCR反应。引物采用以下对:5'-TGTAGCCATGTCCAATTCTCCAGT-3'为正向引物,5'-ATAAACTCGTCCCGTCGAGTTAAG-3'为色氨酸脱羧酶的反向引物(TdcM25151), 5'-TAAATCCATGATGGCAGTTTTCTT-3'为正向引物,5'-ACCCACAGAGCTATGGAAGAGAC-3'为反向引物(StrX61932)。RT反应用1 μl在含有0.4 U Taq DNA聚合酶(Fermentas)、0.1 mM dNTP (Fermentas)、每个dNTP各200 μM、每个引物100 pM的20 μl反应缓冲液中进行PCR。反应在mini - cycler (MJ Research PTC-150)上扩增共15个循环,94°C变性(1分钟),55°C退火Tdc和Str和52°C退火Rps9(1分钟),72°C拉伸(1分钟),再拉伸5分钟。RT-PCR产物在1%琼脂糖凝胶上电泳分离,溴化乙啶染色,使用Alpha Imager 2200 (Alpha Innotech Corporation, San Leandro, CA)在紫外灯下拍照。核糖体蛋白9 (Rps9)作为对照,检查RNA的完整性和装载的准确性。引物是:Rps9- forward 5'-TTAGTCTTGTTCGAGTTCATTTTGTAT-3',和Rps9-反向5'- gagcaaattaactcaatgataattaac -3',Rps9AJ749993)。得到的RT-PCR产物预期大小分别为1.5、1.2和0.63 kbTdc,Str和Rps9通过测序确认了它们的身份。
高效液相色谱法测定花蓟苷的含量
萜类吲哚类生物碱的提取和花蓟苷的HPLC定量依据Schripseme和Verpoorte [55]。最后以mg g为单位报道了catharanthine的用量1DW(干重)细胞。
缩写
- 基于“增大化现实”技术:
-
碱化反应
- Ca2 +:
-
钙离子
- CDPK:
-
钙依赖性蛋白激酶
- DCFH-DA:
-
2', 7'-二氯荧光素二乙酸酯
- EGTA:
-
乙二醇双(2-氨基乙醚)- N,N,N' -四乙酸
- ERKK:
-
细胞外调节激酶
- 食品药品监督管理局:
-
荧光素醋酸
- 玫瑰:
-
肝素钠
- 高效液相色谱法:
-
高压液相色谱法
- H iii级:
-
组蛋白iii级
- 物:
-
Janus激酶
- MAPK:
-
丝裂原活化蛋白激酶
- MAPKK:
-
有丝分裂原活化蛋白激酶
- MAPKKK:
-
有丝分裂原活化蛋白激酶激酶激酶
- MBP:
-
髓鞘碱性蛋白
- 女士:
-
Murashige和Skoog培养基
- 乙酰天冬氨酸:
-
a-naphthaleneacetic酸
- 南京:
-
n -乙酰半胱氨酸
- 氟化钠:
-
氟化钠
- PD 98059:
-
(2) - 2-amino-3-methoxyphenyl -oxanapthalen-4-one
- ROS:
-
活性氧
- rt - pcr:
-
逆转录和聚合酶链反应
- 某人203580:
-
4-(4-氟苯基)-2-(4-甲基磺基苯基)- 5-(4-吡啶基)1H咪唑
- 某人600125:
-
anthra [1, 9-cd] pyrazol-6——(2 h)
- 圣:
-
Staurosporine
- STR /StrStrictosidine合酶;关于:
-
苏拉明
- TDC /Tdc:
-
色氨酸脱羧酶:萜类吲哚生物碱途径
- uv - b:
-
紫外线B辐射
- 范:
-
原钒酸钠
- 维拉:
-
维拉帕米
- ΔpH值:
-
对照和处理之间的pH值差异
参考文献
- 1.
张建军,张建军,张建军,等。植物生长素对植物根中色氨酸脱羧酶活性的影响Catharanthus幼苗。植物生理学报,2002,26(2):444 - 444。
- 2.
张建军,张建军,张建军,张建军,张建军,张建军。色氨酸脱羧酶、色氨酸酶对白蝇繁殖的影响。植物生理学报,1995,29(3):717-720。
- 3.
Contin A, van der Heijden R, Verpoorte R:悬浮培养液泡中马头草素和牛头草素的积累Catharanthus roseus也叫细胞。植物科学,1999,47(1):177-183。10.1016 / s0168 - 9452(99) 00115 - 6。
- 4.
Misawa M, Goodbody AE:植物细胞培养产生抗肿瘤化合物。编辑:DiCosmos F, Misawa, M. 1996, (CRC, Boca Raton), 123-128。
- 5.
赵军,朱伟,胡强:提高植物花青素产量Catharanthus roseus也叫在摇瓶和生物反应器中联合激发剂处理的细胞培养。生物工程学报,2001,28(2):673-681。10.1016 / s0141 - 0229(01) 00306 - 4。
- 6.
王晓明,王晓明,王晓明,等。芦竹碱合成过程中乙酰氧基吲哚啉羟化酶的克隆及活性研究Catharanthus roseus也叫(l)g .堂。植物生理学报,1997,34(4):935-948。10.1023 /: 1005894001516。
- 7.
徐敏,董军,朱敏:一氧化氮介导真菌诱导剂诱导的金丝桃素生产贯叶连翘通过茉莉酸依赖信号通路的细胞悬浮培养。植物生理学报,2009,35(4):991-998。10.1104 / pp.105.066407。
- 8.
赵军,Davis LC, Verpoorte R .:诱导子信号转导在植物次生代谢产物产生中的作用。生物工程学报,2005,23(3):283-333。10.1016 / j.biotechadv.2005.01.003。
- 9.
陈晓明,陈晓明,陈晓明,等。真菌诱导的萜类吲哚类生物碱合成基因的表达及其调控机制Catharanthus roseus也叫。植物生理学报,1999,19(2):389 - 396。10.1104 / pp.119.4.1289。
- 10.
Morris P:植物MAP激酶信号转导途径。中国生物医学工程学报,2001,31(2):369 - 369。10.1046 / j.1469-8137.2001.00167.x。
- 11.
张建军,李建军,刘建军,刘建军。近紫外光对植物体内生物碱生成的影响Catharanthus roseus也叫植物。植物医学杂志,1993,59:46-50。10.1055 / s - 2006 - 959602。
- 12.
[J] .色氨酸脱羧酶基因启动子响应区域的研究Catharanthus roseus也叫。植物化学学报,1999,19(3):369 - 369。10.1023 /: 1006138601744。
- 13.
王晓明,王晓明,王晓明,等。紫花苜蓿色氨酸脱羧酶基因启动子UV-B光响应区域的研究Catharanthus roseus也叫。植物化学学报,1999,19(4):493 - 493。10.1023 /: 1006321100550。
- 14.
Ouwerkerk PBF, Trimborn TO, Hilliou F, Memelink J:核因子GT-1和3AF1与启动子内的多个序列相互作用Tdc马达加斯加长春花基因GT-1参与紫外光诱导的表达。生物医学工程学报,1999,26(2):663 - 668。10.1007 / s004380050003。
- 15.
杨建军,李建军,李建军,等。紫外光b对脑缺血再灌注系统信号通路的影响Lycopersicon peruvianum悬浮细胞。生物化学学报,2002,27(7):2824 - 2830。10.1074 / jbc.M203844200。
- 16.
植物细胞中微生物信号的化学感知。植物生理学报,1995,26(4):389 - 394。10.1146 / annurev.pp.46.060195.001201。
- 17.
Stratmann J, Scheer J, Ryan CA:苏拉明通过系统蛋白、壳聚糖和β-葡聚糖激发子抑制防御信号的启动Lycopersicon peruvianum细胞。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.97.16.8862。
- 18.
Allen RD:利用转基因植物解剖氧化胁迫耐受性。植物生理学报,1995,31(2):449 - 454。
- 19.
Bolwell GP, Wojtaszek P:植物防御中活性氧的产生机制:一个广阔的视角。植物生理学报,1997,25(5):347-366。10.1006 / pmpp.1997.0129。
- 20.
Hrabak EM, Chan CWM, Gribskov M, Harper JF, Choi JH, Halford N, Kudla J, Luan S, Nimmo HG, Sussman MR, Thomas M, alker-Simmons K,朱建康,Harmon AC:拟南芥CDPK-SnRK蛋白激酶超家族。植物生理学报,2003,32(2):663 - 668。10.1104 / pp.102.011999。
- 21.
丝裂原活化蛋白激酶级联作为应激反应的调节因子。中国农业科学学报,1998,35(5):559 - 561。10.1111 / j.1749-6632.1998.tb08987.x。
- 22.
王晓明,王晓明,王晓明,等。钙调控蛋白在植物细胞内钙信号中的作用。植物生理学报,1992,22(3):559 - 561。10.1146 / annurev.pp.43.060192.002111。
- 23.
马洛·R: Ca2 +植物细胞中的信号传导:大网络!植物学报,1998,5:428-433。10.1016 / s1369 - 5266(98) 80268 - 9。
- 24.
White PJ, Broadley MR:植物中的钙。植物学报,2003,29(2):487-511。10.1093 / aob / mcg164。
- 25.
Smith MAL:来自次级代谢物的大规模生产。植物分子与细胞生物学的最新进展。编辑:Terzi M, Cella R, Falavigna A. 1995, Kluwer学术出版社。多德雷赫特(荷兰,669-674)
- 26.
陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,等。紫外光诱导蛋白酪氨酸磷酸酶失活的研究进展。生物化学学报,1999,27(4):2678 - 2686。10.1074 / jbc.274.37.26378。
- 27.
王鹏,王林,李晓明,李晓明。氟化钠诱导内皮细胞屏障功能障碍的机制:MLC磷酸化的作用。[J] .中华肺外科杂志,2001,28(1):379 - 379。
- 28.
王晓明,王晓明,王晓明,等。钙离子通道抑制剂在植物原生质体中的应用。生物化学,1988,27:764-768。10.1021 / bi00402a041。
- 29.
Knight MR, Smith SM, Trewavas AJ:风诱导植物运动立即增加细胞质钙。美国国家科学院项目。[j] .中国科学:地球科学。10.1073 / pnas.89.11.4967。
- 30.
陈建军,陈建军,陈建军。烟草细胞低渗透休克对钙离子的刺激作用2 +先由外部Ca,然后由内部Ca导出的通量2 +商店。中国生物医学工程学报,1998,27(3):369 - 369。10.1074 / jbc.273.42.27286。
- 31.
刘建军,刘建军,李建军,等。烟草细胞对几丁质寡糖的反应Sinorhizobium meliloti有节的因素。植物学报,1999,21(3):557 - 564。10.1007 / s004250050665。
- 32.
李建军,李建军,李建军,李建军,等。诱导氧化爆发反应的研究进展紫花苜蓿细胞培养Sinorhizobium meliloti脂多糖。中国生物医学工程学报,2001,31(2):597- 596。10.1046 / j.0028 - 646 x.2001.00214.x。
- 33.
李建军,李建军,李建军,等。番茄细胞中甲壳素片段感知系统的脱敏研究。植物生理学报,1998,17(4):643- 649。10.1104 / pp.117.2.643。
- 34.
李春华,李春华,李春华,等。红三叶草根中异黄酮代谢的研究进展。[J] .中国生物医学工程学报,2009,25(2):681-689。
- 35.
[β]-1,3-葡聚糖酶对外生菌根真菌诱导子活性的影响。植物生理学报,1997,26(4):557 - 568。10.1104 / pp.114.3.957。
- 36.
Dietrich A, Mayer JE, Hahlbrock K:真菌激发子触发欧芹细胞悬浮培养的快速,瞬时和特异性蛋白磷酸化。中国生物医学工程学报,2009,26(2):663 - 668。
- 37.
王晓明,王晓明,王晓明,等。酵母诱导子对氧化破裂的激活作用Catharanthus roseus也叫细胞独立于参与生物碱生物合成的基因的激活而发生。植物学报,2004,35(5):797-805。
- 38.
王志强,王志强,王志强,等。体外诱导细胞活性氧生成的研究进展拟南芥是由NADPH氧化酶样酶介导的。生物医学工程学报,1996,32(2):393 - 398。10.1016 / 0014 - 5793(96) 00177 - 9。
- 39.
Schwacke R, Hager H:真菌激发子诱导培养的云杉细胞中依赖Ca的活性氧的短暂释放2 +和蛋白激酶活性。植物学报,1997,18(3):369 - 369。10.1007 / BF00201635。
- 40.
王晓明,王晓明,王晓明,等。植物与病原菌相互作用的早期信号转导途径。植物科学进展,1998,3:342-346。10.1016 / s1360 - 1385(98) 01289 - 8。
- 41.
罗梅斯T, Piedras P, Jones JD:抗性基因依赖的钙依赖性蛋白激酶在植物防御反应中的激活。植物学报,2000,12(2):893 - 896。10.1105 / tpc.12.5.803。
- 42.
邢涛,Higgins VJ, Blumwald E:种族特异性诱导因子枝孢属fulvum促进NADPH氧化酶胞质成分向番茄细胞膜的易位。植物学报,1997,9(9):559 - 559。10.1105 / tpc.9.2.249。
- 43.
邢涛,王晓军,马利克,米基宝林:an的异位表达拟南芥钙调素样结构域蛋白激酶增强番茄原生质体NADPH氧化酶活性和氧化爆发。植物与微生物学报,2001,14(4):1261-1264。10.1094 / MPMI.2001.14.10.1261。
- 44.
魏德曼,李建平,李建平,等。丝裂原活化蛋白激酶的克隆与表达。中国生物医学工程学报,1999,29(3):393 - 398。
- 45.
Viñals F, McKenzie FR, pouysssamugur J:原钒酸钠对生长因子刺激蛋白合成的抑制作用。中国生物医学工程学报,2001,26(2):368 - 368。10.1046 / j.1432-1327.2001.02108.x。
- 46.
Menke FLH, Champion A, Kijne JW, Memelink J:长春花次生代谢物合成基因Str中茉莉酸和诱导子响应元件与茉莉酸和诱导子诱导子ap2结构域转录因子ORCA2的相互作用。中华医学杂志,1999,18(1):455- 463。10.1093 / emboj / 18.16.4455。
- 47.
van der Fits L, Memelink J:茉莉素诱导的AP2/ erf结构域转录因子ORCA3通过与茉莉素响应启动子元件相互作用激活基因表达。植物学报,2001,25(4):444 - 444。10.1046 / j.1365 - 313 x.2001.00932.x。
- 48.
范德菲特,梅梅林,等。茉莉素对植物初级和次级代谢的转录调控因子ORCA3。科学通报,2000,28(2):295-297。10.1126 / science.289.5477.295。
- 49.
paw B, Hilliou FAO, Martin VS, Chatel G, de Wolf CJF, Champion A, Pre M, van Duijn B, Kijne JW, van der Fits L, Memelink J:锌指蛋白在生物碱合成中的转录抑制基因Catharanthus roseus也叫。生物化学学报,2004,29(3):52940-52948。10.1074 / jbc.M404391200。
- 50.
范德菲特,张宏,孟克,陈建军,陈建军Catharanthus roseus也叫BPF-1同源物与次级代谢物生物合成基因Str的激发子响应区相互作用,并通过不依赖于ja的信号转导途径被激发子诱导。植物生理学报,2004,44(4):675-685。10.1023 /: 1026526522555。
- 51.
Shilpa R,博士论文:紫外光b诱导的细胞悬浮培养产生花青素/vindoline的信号转导事件的研究Catharanthus roseus也叫参与色氨酸生物合成的关键酶- 3 -脱氧D -阿拉伯-庚糖酸- 7-磷酸合酶基因的克隆与鉴定。印度科学研究所,班加罗尔,印度。2006
- 52.
利用蛋白质-染料结合原理的一种快速灵敏的微量蛋白质定量方法。生物化学学报,2006,32(2):559 - 564。10.1016 / 0003 - 2697(76) 90527 - 3。
- 53.
王晓明,王晓明,王晓明,等。大豆钙依赖性蛋白激酶的分离纯化及酶活性研究。生物化学,1990,29:2488-2495。10.1021 / bi00462a008。
- 54.
Stratmann JW, Ryan CA:髓鞘碱性蛋白激酶活性在番茄叶片损伤的系统性诱导下,对系统蛋白和低聚糖激发子的反应增加。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.94.20.11085。
- 55.
李春华,李春华,李春华,等。紫菀悬浮培养中吲哚类生物碱产生的相关因子研究Tabernaemontana衣属鸦葱。中国生物医学工程学报,2002,31(2):444 - 444。10.1055 / s - 2006 - 961445。
- 56.
Barr R, Troxel KS, Crane FL: EGTA,一种钙螯合剂,在两个不同的位点抑制菠菜叶绿体光系统II的电子传递。生物化学学报,1998,22(2):526 - 526。10.1016 / 0006 - 291 x(80) 91540 - 5。
- 57.
Felix G, Regenass M, Spanu P, Boller T:蛋白磷酸酶抑制剂calyculin A在植物细胞中模拟激发子作用并诱导特定蛋白的快速过度磷酸化[j]。33P]磷酸。美国国家科学院项目。[j] .中国科学:地球科学。10.1073 / pnas.91.3.952。
- 58.
杨建军,陈建军,陈建军,陈建军,陈建军,陈建军。细胞分裂原活化蛋白激酶对中性粒细胞凋亡的抑制作用。中华外科杂志,1999,26(6):416 -412。
- 59.
张建军,张建军,张建军,等。JNK抑制剂炭疽菌pyrazol-6(2H)-one (SP-600125)对可溶性环化酶α的影响1基因调控和cGMP合成。[J] .中国生物医学工程学报,2009,29(2):387 - 398。10.1152 / ajpcell.00057.2005。
致谢
这项工作得到了印度医学研究委员会和生物技术部(印度政府班加罗尔印度科学研究所基因组学计划)的资助。我们感谢Anjali Karande教授提供MAPK抑制剂,Ramesh Maheshwari教授、Ramasarma教授和Sunil Podder教授对手稿的批判性阅读。我们也感谢Nanda Devi博士在修改手稿时提供的帮助。S.R是CSIR的研究奖学金获得者。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
SR共同参与了研究的构思、实验工作的开展和论文的撰写。CJB参与了这项研究的构思,并参与了手稿的起草或严格修改,并最终批准了即将出版的版本。两位作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Ramani, S, Chelliah, J. uv - b诱导的信号事件导致花青素生产的增加Catharanthus roseus也叫细胞悬浮培养。BMC Plant Biol7,61(2007)。https://doi.org/10.1186/1471-2229-7-61
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-7-61
关键字
- 髓鞘碱性蛋白
- 苏拉明
- Catharanthine
- Vindoline
- 酵母诱导子