- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
植物质膜及质膜相关内质网溶血多糖酰基转移酶/PC酰基转移酶活性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba7gydF4y2Ba文章编号:gydF4y2Ba64gydF4y2Ba(gydF4y2Ba2007gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植物质膜磷脂是在内质网(ER)中合成的。大多数这些脂质到达质膜独立的分泌泡通路。磷脂传递到植物细胞的线粒体和叶绿体也绕过分泌途径。在这里,有人提出溶血磷脂在ER的特定区域和各自的细胞器之间的接触点被运输,然后在目标细胞器中进行溶血磷脂酰化。为了验证在分泌途径外有相应的机制将磷脂运输到质膜,我们研究了植物质膜中是否也发生溶磷脂酰化,以及该膜是否像叶绿体和线粒体一样与ER密切接触。gydF4y2Ba
结果gydF4y2Ba
植物质膜很容易将酰基辅酶a的酰基链结合成磷脂。油酸优于棕榈酸作为底物,酰基主要并入磷脂酰胆碱(PC)。磷脂酶一gydF4y2Ba2gydF4y2Ba刺激反应,如外源性溶血多糖时,给予高于临界胶束浓度。AgNOgydF4y2Ba3.gydF4y2Ba是抑制性的。在ph值较低的培养基中,经过反复的冷冻和解冻循环,可以从分离的质膜上洗掉的膜部分中溶血磷脂酰化反应较高。该部分表现出若干er样特征。当质膜从转基因中分离出来gydF4y2Ba拟南芥gydF4y2Ba用共聚焦显微镜观察到ER腔内表达绿色荧光蛋白,ER起源膜与分离的质膜相关。gydF4y2Ba
结论gydF4y2Ba
我们的结论是溶血多糖酰化活性与植物质膜有关,不能排除PC转酰基酶活性。这种酶很可能存在于ER的一部分,与质膜密切相关,或者两者都存在。我们认为,这部分可能相当于ER起源的线粒体相关膜,它将磷脂运送到线粒体,以及最近分离的ER起源膜部分,它与叶绿体密切接触。的gydF4y2Ba原位gydF4y2Ba溶血多糖酰化/PC转酰基化酶活性的功能尚不清楚,但可能与脂质从内质网到质膜的传递有关。gydF4y2Ba
背景gydF4y2Ba
植物质膜的脂相组成随植物环境的变化而变化。这些调整包括选择性脂质降解、增加某些脂质类别和/或脂质分子种类的掺入,以及可能重新调整膜内的脂质[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba].除了在结构上的作用外,质膜脂还是几种信号通路中的关键中间体[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
新创gydF4y2Ba质膜磷脂的合成主要发生在内质网(ER) [gydF4y2Ba7gydF4y2Ba- - - - - -gydF4y2Ba9gydF4y2Ba].质膜磷脂主要是磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)gydF4y2Ba16gydF4y2Ba和CgydF4y2Ba18gydF4y2Ba酰化的gydF4y2Basn-1gydF4y2Ba而且gydF4y2Basn-2gydF4y2Ba据报道,甘油主干的位置分别独立于囊泡分泌通路运输到质膜[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].脂质运输到植物质膜以外的途径的性质尚待确定,但对于酵母和/或动物细胞,脂质运输已被证明发生在细胞膜接触位点(MCSs),例如ER和线粒体之间,ER和反式高尔基膜之间[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].在酵母中,分离出一个质膜相关的ER区域。该组分记为PAM(质膜相关膜),与大块ER相比,脂质合成更丰富,但脂质转运仍有待证实[gydF4y2Ba12gydF4y2Ba].植物中ER和质膜之间的MCSs未见报道,但悬吊培养的悬吊树细胞的冷冻断裂显微镜观察到这些膜之间的密切接近[gydF4y2Ba13gydF4y2Ba的共聚焦显微镜gydF4y2Ba拟南芥gydF4y2Ba用荧光标记在特定的ER膜蛋白上转化[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
线粒体和叶绿体PC也是ER起源[gydF4y2Ba8gydF4y2Ba].目前,脂质输送到线粒体的最受欢迎的模型是脂质输送在特化ER区(称为MAMs(线粒体相关膜))和线粒体之间的接触带[gydF4y2Ba15gydF4y2Ba].生物化学(gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba19gydF4y2Ba]以及生物物理学[gydF4y2Ba20.gydF4y2Ba有证据表明叶绿体和ER的一个特殊区域之间有相应的接触区,称为PLAMs(质体相关膜)。线粒体(gydF4y2Ba21gydF4y2Ba]和叶绿体[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]都具有高度活性的溶血酶c酰化活性,有人认为,在这两种情况下,溶血酶c是从密切相关的ER运输到各自的细胞器的脂质。gydF4y2Ba
为了研究磷脂在分泌器官外传递到植物质膜可能涉及转运溶血磷脂酰化的可能性,以及ER的一个区域可能涉及的可能性,类似于线粒体和叶绿体的情况,我们检查了分离的质膜和推定的PAM部分的溶血磷脂酰化。我们还提出了PAM部分与质膜相关的证据。gydF4y2Ba
结果gydF4y2Ba
膜分离gydF4y2Ba
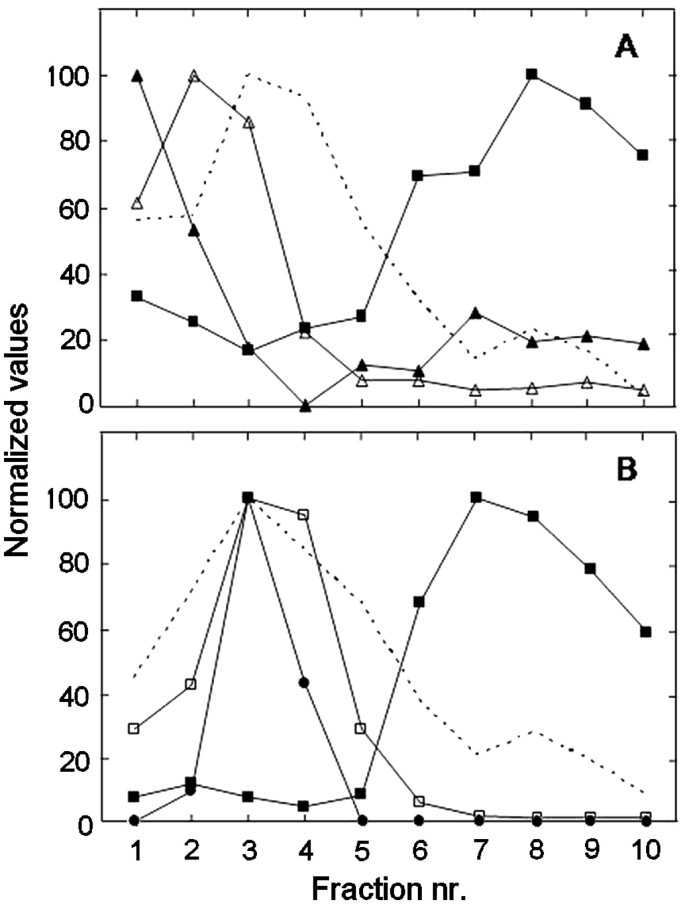
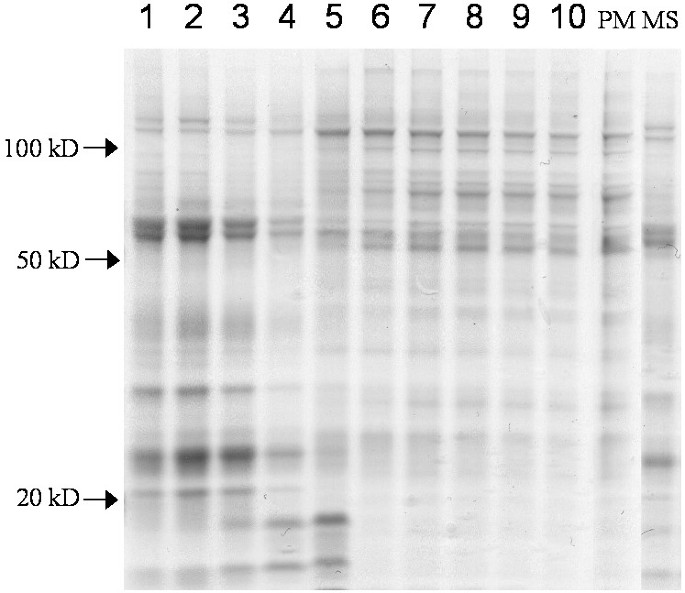
质膜组分的纯度之前已经建立了豌豆(只有ER和叶绿素的痕迹[gydF4y2Ba22gydF4y2Ba])和大豆(95%的质膜,由电子显微镜薄片在低pH下磷钨酸染色后的形态测定法判断[gydF4y2Ba23gydF4y2Ba])。更新标记酶测定验证了分离组分的纯度(结果未显示)。对于豌豆,我们也测定了通过10步水溶液聚合物两相逆流分布对芽微粒体膜进行分馏得到的膜组分上的标记酶活性[gydF4y2Ba24gydF4y2Ba].数字gydF4y2Ba1gydF4y2Ba显示了10个组分间线粒体内膜、内质网、高尔基体、类囊体和质膜的蛋白质和标记物的分布。线粒体内膜、高尔基膜和类囊体在较早的组分中被回收,而质膜主要在组分6-10中被回收。ER标记胆碱磷酸转移酶主要在前两个组分中恢复,第二个小峰与质膜标记共定位,在组分6-10中。这些组分的多肽模式反映了标记物的测定,其中6-10组分与分离的质膜的多肽模式非常相似(图1)。gydF4y2Ba2gydF4y2Ba).组分6-10和质膜突出的> 100kd条带可能代表p型ATP酶,而组分1-3突出的55 - 60kd条带可能分别代表线粒体ATP合酶α链和β链以及ADP/ATP转运体[gydF4y2Ba24gydF4y2Ba].分数1-4中这些条带强度的差异与这些分数中线粒体标记酶比活性的差异有关(参见图gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
豌豆幼苗膜组分中蛋白质和酶活性的分布gydF4y2Ba.微粒体膜组分通过10步水溶液聚合物两相逆流分布进行分馏,并对得到的10个膜组分进行分析。gydF4y2Ba一个gydF4y2Ba胆碱磷酸转移酶对ER(实心三角形;100对应10 pmol·[mg蛋白质]gydF4y2Ba-1gydF4y2Ba·敏gydF4y2Ba-1gydF4y2Ba),线粒体内膜细胞色素C氧化酶(开放三角形;100对应1.46 mmol·[mg蛋白质]gydF4y2Ba-1gydF4y2Ba·敏gydF4y2Ba-1gydF4y2Ba)和1,3-β-葡聚糖合成酶为质膜(固体方格;100对应0.53 μmol·[mg蛋白]gydF4y2Ba-1gydF4y2Ba·敏gydF4y2Ba-1gydF4y2Ba).虚线表示归一化蛋白在各馏分之间的分布。gydF4y2BaBgydF4y2Ba类囊体归一化叶绿素含量(开方格;100对应0.12 mg·[mg蛋白质]gydF4y2Ba-1gydF4y2Ba),将高尔基体单克隆抗-β-COP抗体归一化结合(实心圆;抗体结合只发生在分数2-4,100对应最高结合),1,3-β-葡聚糖合成酶为质膜(固体方格;100对应0.43 μmol·[mg蛋白]gydF4y2Ba-1gydF4y2Ba·敏gydF4y2Ba-1gydF4y2Ba).以及蛋白质在各组分间的归一化分布(虚线)。由于所有参数都不能从单一的10步膜分布的馏分上测定,面板a和B显示了两个独立实验的结果,对质膜标记物和蛋白质分布进行了分析。gydF4y2Ba
质膜脂酰化gydF4y2Ba
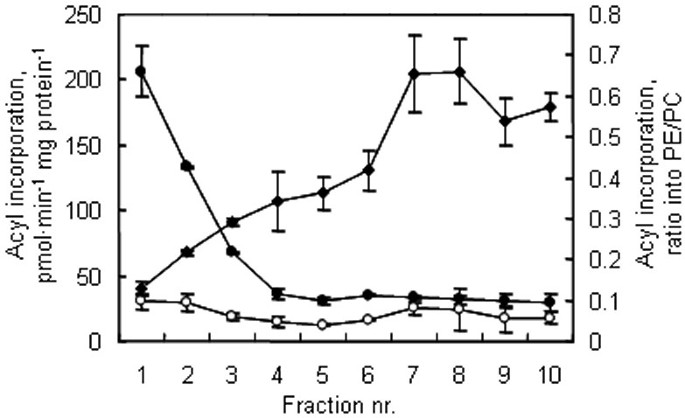
将[1 -gydF4y2Ba14gydF4y2Ba用10步逆流两相分离得到的膜组分对coa转化为原生PC和PE进行了分析。[1-]的合并gydF4y2Ba14gydF4y2BaC]18:1-CoA进入PC中发生在所有10个组分中,但在前两个组分中明显最强(图1)。gydF4y2Ba3.gydF4y2Ba),从而与内质网膜标记胆碱磷酸转移酶共迁移(见图。gydF4y2Ba1gydF4y2Ba).结果与植物ER中含有高活性溶血多糖酰基转移酶的模型一致[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].酰基掺入到PE中也发生在所有组分中,在含有ER和质膜的组分中发生率相似。在质膜组分中(参见图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba)酰基掺入PE的比例最高,在0.4 ~ 0.7之间。gydF4y2Ba
为了更详细地研究脂酰化,我们使用分离的质膜组分。当豌豆质膜与[1-gydF4y2Ba14gydF4y2BaC] 18:1-CoA(无花果。gydF4y2Ba4gydF4y2Ba(1 -)或gydF4y2Ba14gydF4y2BaC]16:0-CoA(结果未显示),放射性标签主要作为游离脂肪酸回收,表明质膜含有高度活性的酰基辅酶a硫酯酶。由于酰基辅酶a在调节酶活性、膜融合和信号转导等细胞过程中发挥重要作用[gydF4y2Ba27gydF4y2Ba],较高的硫酯酶活性可能反映了质膜具有调节其附近酰基辅酶a池大小的能力。gydF4y2Ba
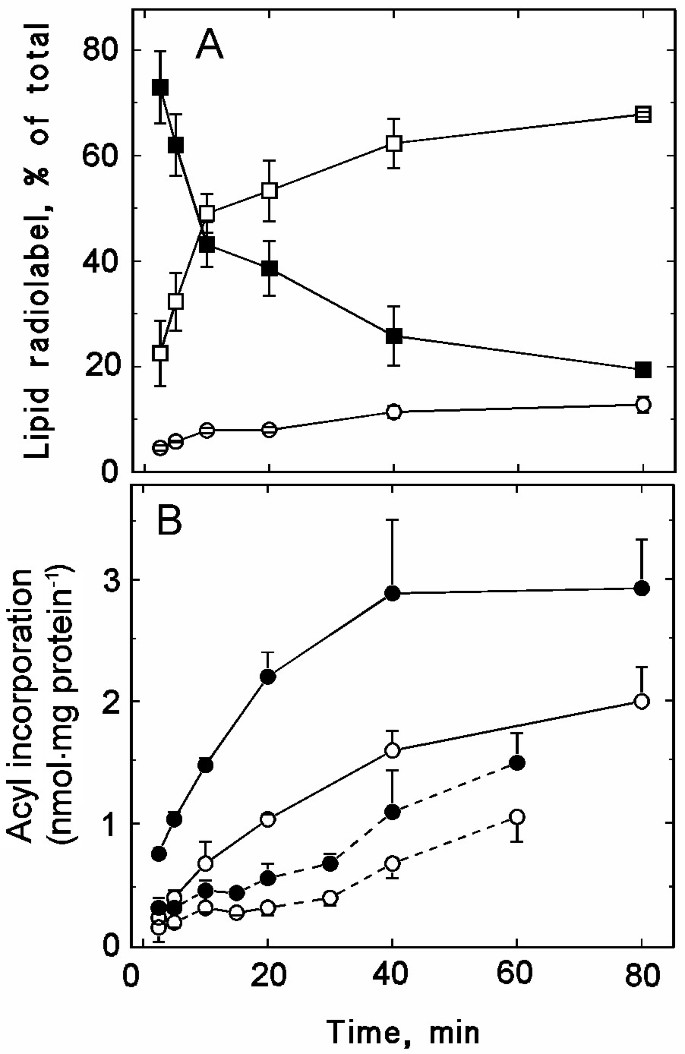
放射性标签并入[的时间依赖性gydF4y2Ba14gydF4y2BaC]酰基辅酶a形成分离的质膜gydF4y2Ba.从豌豆幼苗中分离出的质膜与放射性标记的酰基辅酶a孵育80分钟。每次孵育含有25 μg质膜蛋白。gydF4y2Ba一个gydF4y2Ba,放射性标签在18:1-CoA(实方)、游离脂肪酸(开方)和磷脂(开圆)之间的分布。gydF4y2BaBgydF4y2Ba,将放射性标签纳入PC(填充符号)和PE(开放符号)。要么(gydF4y2Ba14gydF4y2BaC]1 - coa(实线)或[gydF4y2Ba14gydF4y2BaC]16:0-CoA(虚线)作为衬底。数据表示平均值±代表性实验的重复范围。gydF4y2Ba
剩余的酰基辅酶a放射性标记在磷脂中恢复,主要是PC(图。gydF4y2Ba4 bgydF4y2Ba).[1-的标记度较高gydF4y2Ba14gydF4y2BaC]18:1-CoA比与[1-gydF4y2Ba14gydF4y2Bacoa作为底物,表明酰基倾向于掺入gydF4y2Basn-2gydF4y2Ba的位置。用[1-]孵育30分钟后gydF4y2Ba14gydF4y2BaC]18:1-CoA, PC中回收62%的磷脂放射性标签,而PE和磷脂酰肌醇(PI)中分别回收27%和11%(结果未显示)。与[1 -gydF4y2Ba14gydF4y2BaC]16:0-CoA,酰基掺入在这三种脂类之间分布更均匀:孵育30分钟后,PC、PE和PI中分别恢复了39%、35%和26%的磷脂放射性标记(结果未显示)。磷脂酰甘油中从未发现放射性标签。然而,在一些实验中,磷脂酸(PA)中回收了2-5%的酰基辅酶a放射性标签(结果未显示)。当放射性标记的酰基辅酶a底物被相应的放射性标记的游离脂肪酸取代时,没有观察到磷脂的放射性标记,这表明酰基转移酶的底物是酰基辅酶a(结果未显示)。gydF4y2Ba
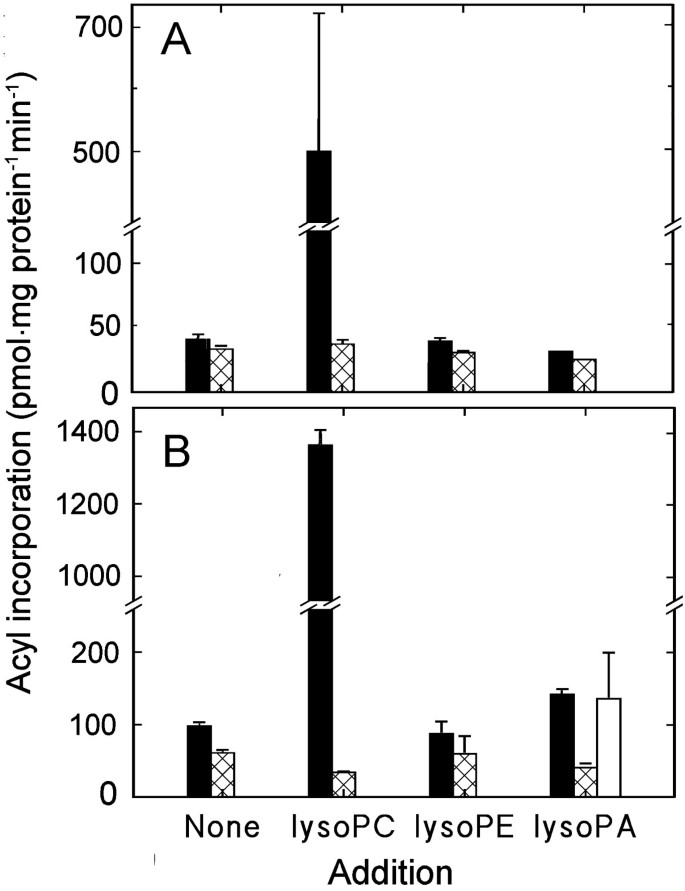
将来自酰基辅酶a的放射性标签合并到磷脂中可以反映相应溶血磷脂的酰化和/或磷脂的重新剪裁。为了研究溶磷脂是否起底物作用,采用了两种方法。在第一种方法中,将不同数量的溶血酶c、溶血酶和溶血酶a以及放射标记的酰基辅酶a纳入检测。浓度稍低于临界胶束浓度(cmc;7 μM for CgydF4y2Ba16gydF4y2Ba-lysoPC,低为lysoPE;[gydF4y2Ba28gydF4y2Ba]),未检测到与磷脂结合的放射性标签增加(结果未显示)。当加入70 μM溶血多糖时,PC与[1-的标记量急剧增加gydF4y2Ba14gydF4y2BaC] 16:0-CoA(无花果。gydF4y2Ba5gydF4y2Ba)和(1 -gydF4y2Ba14gydF4y2BaC] 18:1-CoA(无花果。gydF4y2Ba5gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba).相同浓度的溶血酶a可刺激PA的标记,也可刺激PC的标记。这种刺激明显较小,仅发生在[1-]gydF4y2Ba14gydF4y2BaC] 18:1-CoA。PE的标记不受包含70 μM的lyso衍生物的影响。当质膜与放射性标记的溶血多糖和非放射性标记的酰基辅酶a孵育时,形成了放射性标记的PC,验证了反应(图1)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
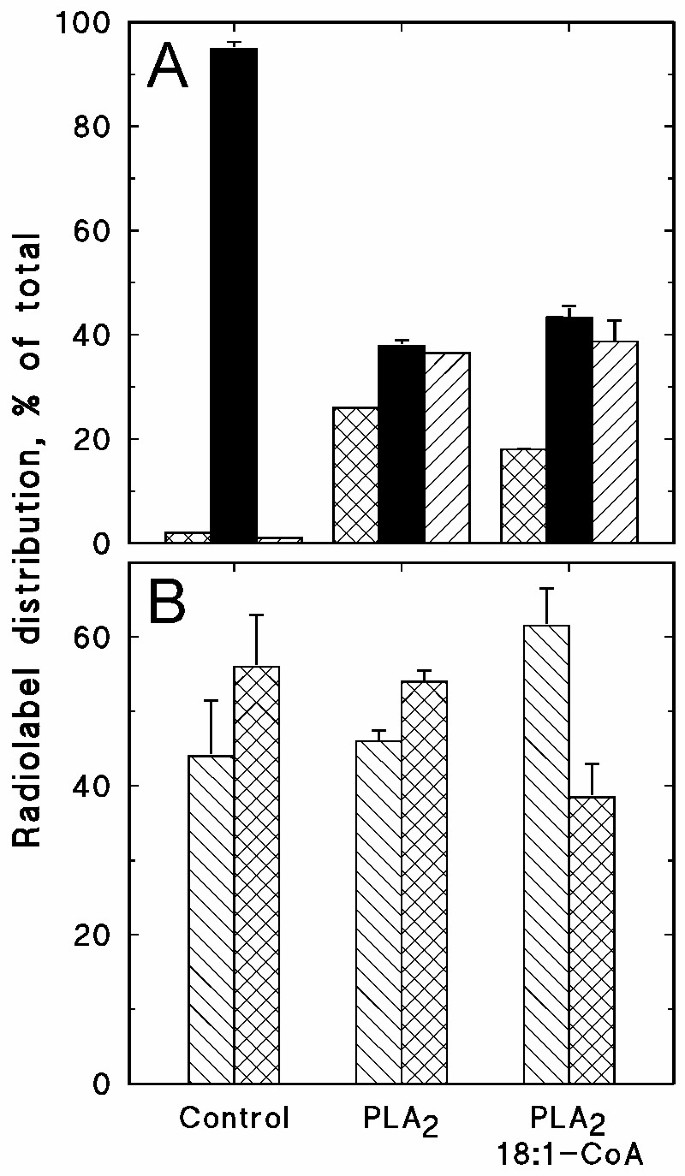
研究溶血磷脂底物作用的第二种方法是研究这些脂质在膜中的刺激形成是否有任何影响。内源性解放军gydF4y2Ba2gydF4y2Ba对外源放射标记的PC活性较低,但对外源PLA活性较低gydF4y2Ba2gydF4y2Ba刺激溶血多糖和游离脂肪酸的形成。gydF4y2Ba7一个gydF4y2Ba).当非放射性标记的18:1-CoA被纳入检测时,与溶血多糖相关的放射性标记比例下降,而与PC相关的放射性标记比例增加(图1)。gydF4y2Ba7一个gydF4y2Ba).结果PC池显示放射标记减少gydF4y2BasngydF4y2Ba-2阵地,说明解放军双方gydF4y2Ba2gydF4y2Ba再酰化反应发生在gydF4y2BasngydF4y2Ba(图2位置。gydF4y2Ba7 bgydF4y2Ba).蜂毒PLAgydF4y2Ba2gydF4y2Ba据推测,它对膜磷脂的作用相当非特异性[gydF4y2Ba29gydF4y2Ba],几个溶血磷脂类的增加将是预期的结果。然而,与聚乳酸同时孵育的质膜gydF4y2Ba2gydF4y2Ba和放射标记的酰基辅酶a,导致只增加PC的放射标记,且只与[1-gydF4y2Ba14gydF4y2BaC]18:1-CoA作为底物(结果未显示),这表明脂肪酶对PC的特异性比一般认为的要高,或者溶固体脂酰化酶强烈偏好溶固体脂酰化酶。gydF4y2Ba
磷脂酶A的作用gydF4y2Ba2gydF4y2Ba(中国人民解放军gydF4y2Ba2gydF4y2Ba)和18:1-CoA对分离质膜中外源性PC代谢的影响gydF4y2Ba.从黑生大豆下胚轴中分离出质膜,用0.25 μM培养gydF4y2Basn-1 2gydF4y2Ba- - - - - - (gydF4y2Ba14gydF4y2BaC]18:1-PC (3.7 GBq/mmol)在含有0.05% (w/v) Triton X-100的缓冲液中浸泡30分钟,不添加或添加指定的添加物(0.001 U蜂毒聚乳酸)gydF4y2Ba2gydF4y2Ba, 100 μM非放射性标记18:1-CoA)。gydF4y2Ba一个gydF4y2Ba溶血酶c(交叉孵化棒)、PC(固体棒)和游离脂肪酸(对角孵化棒)之间的放射性标签分布。gydF4y2BaBgydF4y2Ba放射性标签的分布gydF4y2BasngydF4y2Ba-1(斜孵化条)和gydF4y2BasngydF4y2Ba[的-2个(交叉划线条)位置]gydF4y2Ba14gydF4y2BaC)电脑。数据表示平均值和范围从重复。gydF4y2Ba
质膜相关膜的一部分PAM中的脂酰化gydF4y2Ba
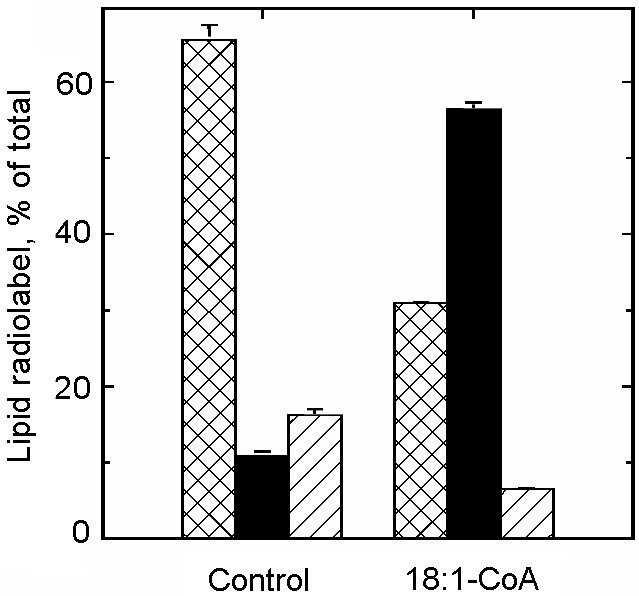
10步逆流膜分馏显示,质膜富集的部分中ER标记胆碱磷酸转移酶是活跃的(图。gydF4y2Ba1gydF4y2Ba),表明在这些馏分中也存在ER。以分离的豌豆质膜为起始材料,我们分离出一个轻的膜组分,称为PAM。我们研究了酰基在起始质膜组分、PAM组分、无PAM质膜组分和第一个富er组分中的PC和PE掺入。酰基由[1-gydF4y2Ba14gydF4y2BaC]18:1-CoA进入PC和PE验证了早期的结果,在富含er的组分中酰基掺入PC比在质膜中更快,而在脂质体中酰基掺入PE则相反gydF4y2Ba1gydF4y2Ba).酰基掺入PC似乎对分馏质膜组分的程序有些敏感,因为在PAM和无PAM的质膜中酰基的活性较低。溶血多糖的添加显著促进了PC中酰基的掺入,其中富er和PAM组分的掺入率最高。这里,质膜组分介于PAM和无PAM质膜组分之间。溶血多糖酰化活性对AgNO敏感gydF4y2Ba3.gydF4y2Ba,一种已知的溶血多糖酰基转移酶抑制剂[gydF4y2Ba30.gydF4y2Ba],表明所观察到的溶血多糖酰化的大部分确实是由这种转移酶催化的。gydF4y2Ba
质膜和PAM多肽gydF4y2Ba
我们用天然凝胶电泳分离了豌豆质膜多肽,并对分离的1毫米切片进行溶血多糖酰化分析。活性表现为一个宽峰与一个更宽的主蛋白峰共迁移(结果未显示)。溶血多糖酰化活性最高的部分进行胰蛋白酶消化和线性离子阱质谱分析。该部分含有大量的多肽,但没有一个与脂质代谢相关的多肽,可能是由于豌豆多肽和大部分脂质相关蛋白的注释不足。gydF4y2Ba
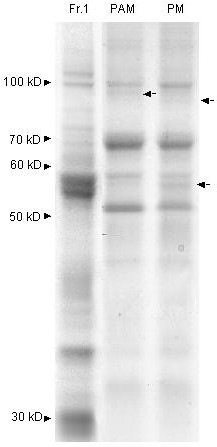
PAM组分的多肽模式与质膜的多肽模式非常相似,但某些多肽带仅针对其中一个组分(图。gydF4y2Ba8gydF4y2Ba箭头)。对上述特定的PAM多肽带的分析到目前为止未能产生任何关于多肽身份的信息。gydF4y2Ba
PAMs的光学证据gydF4y2Ba
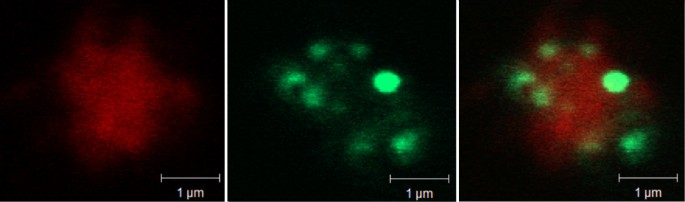
使用转换gydF4y2Ba答:芥gydF4y2Ba,在内质腔内用绿色荧光蛋白(GFP)标记[gydF4y2Ba31gydF4y2Ba],我们先前证明了ER在细胞质中形成了一个网络,并且小的绿色荧光体与分离的叶绿体有关[gydF4y2Ba20.gydF4y2Ba].从该转化植株的叶片中分离出质膜gydF4y2Ba答:芥gydF4y2Ba经过反复的冷冻和解冻来改变囊泡的数量[gydF4y2Ba32gydF4y2Ba].当这些质膜的浓缩悬浮液与用于膜脂的荧光探针FM4-64孵育时,用共聚焦激光束显微镜观察,膜呈现红色(图4)gydF4y2Ba9gydF4y2Ba左面板)。小的荧光绿色体也很明显(图。gydF4y2Ba9gydF4y2Ba当这些图像合并时,很明显er衍生的gfp荧光体与质膜共定位(图。gydF4y2Ba9gydF4y2Ba右面板)。FM4-64明显更倾向于质膜而不是ER,从图片的右下角可以看出,FM4-64和GFP的荧光并没有重叠(图1)。gydF4y2Ba9gydF4y2Ba).我们观察到部分质膜材料与绿色荧光体无关,但绿色荧光体从未单独出现,只与质膜一起出现(结果未显示)。gydF4y2Ba
讨论gydF4y2Ba
溶血多糖的酰化已被证实发生在从植物组织中分离出来的ER、叶绿体和线粒体中。我们在这里报告,植物质膜也催化酰基结合从酰基辅酶a到磷脂,主要产物是PC。将酰基辅酶a的酰基组合到质膜磷脂中可能有一个或几个作用:(i)通过反式酰基化调节质膜磷脂的酰基化模式,参与对改变的外部条件(应激)的响应,(ii)酰基化溶血酚脂,关闭利用PLA的信号系统gydF4y2Ba2gydF4y2Ba和/或(iii)将溶血磷脂酰化,以提供向质膜提供PC的最后一步,类似于报道的线粒体和叶绿体,即ER起源的溶血磷脂酰化。gydF4y2Ba
我们可以清楚地证明溶固体脂酰化。分离的质膜中溶血磷脂的浓度通常被报道为非常低[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba],这与它们拟议的信号和监管角色非常吻合。例如,lysoPC和lysoPE被认为是生长素的第二信使[gydF4y2Ba33gydF4y2Ba并参与受伤植物的系统反应[gydF4y2Ba34gydF4y2Ba].最近有报道称溶血多糖可诱导参与丛枝菌根共生的寄主植物基因[gydF4y2Ba35gydF4y2Ba].lysoPA和lysoPI已被证实能抑制植物磷脂酶D,而lysoPA则能刺激植物磷脂酶D [gydF4y2Ba36gydF4y2Ba].溶固体脂也影响膜融合[gydF4y2Ba37gydF4y2Ba].显然,质膜的溶血磷脂含量受到严格的调控。溶血磷脂酰化活性可能因此起着调节信号-反应级联、酶活性或质膜融合性的作用。gydF4y2Ba
在酰化反应中,18:1-CoA优于16:0-CoA,内源性溶血磷脂可能来源于PLAgydF4y2Ba2gydF4y2Ba催化磷脂降解。这一结论是基于植物质膜磷脂通常含有不饱和CgydF4y2Ba18gydF4y2Ba脂肪中的脂肪酸gydF4y2Basn-2gydF4y2Ba位置,而16:0通常限于gydF4y2BasngydF4y2Ba1的位置(gydF4y2Ba38gydF4y2Ba].外源聚乳酸的加入使溶血磷脂含量增加,酰化活性增加gydF4y2Ba2gydF4y2Ba.解放军的活动gydF4y2Ba2gydF4y2Ba已被证明在添加溶血多糖的阈值浓度时突然增加[gydF4y2Ba39gydF4y2Ba].这种激活被认为反映了膜对PLA的敏感性增加gydF4y2Ba2gydF4y2Ba.在溶血磷脂的阈值浓度下,膜性质的类似变化也可能与目前的情况有关。然而,添加的溶血多糖不仅刺激PLAgydF4y2Ba2gydF4y2Ba活性,因为与放射性标记的溶血多糖孵育显示了它们作为酰化反应的底物的作用。gydF4y2Ba
当提供外源溶血磷脂时,溶血磷脂的质膜酰化活性对溶血磷脂的特异性明显高于其他溶血磷脂。需要大于cmc浓度的溶血多糖来刺激反应,这可能反映酶被激活gydF4y2Ba原位gydF4y2Ba由局部高浓度的底物形成。溶血酶a对溶血酶c酰化的刺激作用可能表明溶血酶a具有调节作用。对AgNO的敏感性gydF4y2Ba3.gydF4y2Ba表明该活性与先前报道的溶血多糖酰基转移酶有关。gydF4y2Ba
在没有添加溶血磷脂的情况下,从酰基辅酶a到磷脂的酰基结合与几种磷脂类发生,而在有外源底物的情况下,只有溶血多糖被酰化。这些结果可能表明植物质膜中存在不止一种溶血磷脂酰基转移酶。另一种解释是,在没有添加溶血磷脂的情况下,酰基由酰基辅酶a并入磷脂代表了酰基化酶的活性。gydF4y2Ba
结果表明,PC和PE与C发生酰化反应gydF4y2Ba16gydF4y2Ba/ CgydF4y2Ba18gydF4y2Ba脂肪酸不依赖于囊泡分泌途径而被运送到质膜[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].研究表明,在酵母中,ER与质膜密切相关[gydF4y2Ba12gydF4y2Ba和植物细胞[gydF4y2Ba13gydF4y2Ba的研究,我们推测溶菌多糖传递到植物质膜可能发生在与ER密切接触的区域。支持这一假设的来源有几个。在10步逆流分离豌豆芽膜过程中,ER标记胆碱磷酸转移酶也有少量随质膜标记迁移(图1)。gydF4y2Ba1gydF4y2Ba).在之前从缺乏磷酸盐的燕麦中分离根膜的10步中[gydF4y2Ba24gydF4y2BaER标记NADPH细胞色素C还原酶呈双峰分布,小峰与质膜共迁移。在较早的一篇5步逆流分离花椰菜花序微粒体膜的报告中[gydF4y2Ba40gydF4y2Ba], NADPH细胞色素C还原酶和胆碱磷酸转移酶活性共同定位于第一个管的一个大峰,以及与质膜标记物共同迁移的一个小峰。此外,我们还观察到,当质膜分离的叶子gydF4y2Ba答:芥gydF4y2Ba在内质网腔内用GFP标记,小的内质网衍生结构与质膜共分离(图。gydF4y2Ba9gydF4y2Ba).细胞膜之间的关联性足够强,可以经受反复的冷冻和解冻过程,从而使部分质膜囊泡倒置。gydF4y2Ba
为了从分离的质膜中分离出已知的ER起源的膜部分,我们改进了为酵母PAMs开发的方法[gydF4y2Ba12gydF4y2Ba].作为水相聚合物两相分割分离细胞质侧-内质膜囊泡[gydF4y2Ba32gydF4y2Ba],假定的PAM将存在于分离的质膜囊泡内。因此,我们必须在降低pH值的酵母协议处理之前翻转质膜囊泡,以将PAMs从质膜分离[gydF4y2Ba12gydF4y2Ba].PAM和质膜组分的蛋白模式基本相似,但有些质膜组分的蛋白在PAM组分中缺失,而另一些蛋白在PAM组分中略有富集。显然,PAM组分被质膜污染了。在PAM分离之前,将质膜囊倒置的冷冻和解冻过程可能导致了与轻的PAM膜囊共分离的小质膜囊的形成。此外,冷冻和解冻过程也可能产生表面特性介于胞质外侧和胞质内侧质膜囊泡之间的囊泡,正如我们之前报道的小麦质膜[gydF4y2Ba41gydF4y2Ba].因此,在目前的情况下,我们不能排除分离过程可能产生混合质膜和PAM起源的囊泡。gydF4y2Ba
在PAM中,与原质膜组分相比,溶血多糖的加入使PC中酰基的掺入增加,而在PAM减少的质膜组分中,酰基的活性远低于原质膜组分。这些差异可能表明质膜及其邻近PAM中存在不同的酰基转移酶或酰基转移酶。另一种解释可能是溶血多糖酰化/PC转酰化实际上驻留在与质膜(PAM)相关的ER区域。如果是这种情况,PAM组分与质膜的污染将稀释较高的PAM相关活性,并且由于所有的PAM可能没有从质膜中被冲走,两个组分之间的酰基化/转酰基化活性的差异将被低估。如果分离质膜的脂酰化/转酰化活性实际上反映了PAM活性,那么这种脂质代谢活性在内质网的分布并不均匀。未来PAM的扩展特性有待于开发一种可以提高馏分收率和纯度的分离协议。gydF4y2Ba
我们没有成功地在溶固体酰化活性最高的质膜肽段中识别出任何酰基转移酶,这可能反映了这些类型的酶没有很好地描述,因此没有注释。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明分离的植物质膜具有磷脂酰化和/或转酰化活性。与内源性底物相比,该活性具有不同的溶血磷脂底物偏好。添加溶血磷脂底物后,两组分均对溶血多糖具有高度特异性。我们还提出了视觉证据和首次试探性分离的植物PAM部分,一个膜部分推定的ER起源与质膜密切相关。溶血多糖酰基转移酶活性在此PAM组分中高于其亲本质膜组分,而在PAM含量降低的质膜中溶血多糖酰基转移酶活性显著降低。我们认为内质网和质膜之间的紧密接触区域,即PAMs,代表了内质网中专门为质膜提供前体以及合成PC的区域,PC在分泌泡泡通路外被运送到质膜。溶血多糖酰基转移酶和/或PC酰基转移酶是否都是质膜的组成部分,还是前者或两者的活性都限于PAM尚不清楚。PE的运输路线仍然难以捉摸。gydF4y2Ba
方法gydF4y2Ba
植物材料和化学品gydF4y2Ba
豌豆(gydF4y2BaPisum一gydF4y2BaL., var Kelvedon Wonder) [gydF4y2Ba16gydF4y2Ba),大豆(gydF4y2Ba大豆gydF4y2Ba(L。)稳定。,var. Folke) [23gydF4y2Ba),gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba]分别培养9 ~ 10天、4天和4 ~ 5周。蜕变的种子gydF4y2Ba答:芥gydF4y2Ba由原西村教授提供[gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
所有化学品和有机溶剂均为分析级。脂质标准、聚乙二醇(PEG)和精细化学品来自Sigma (St. Louis, MO, USA),有机溶剂、薄层色谱板和无机盐来自Merck (Darmstadt, Germany)。放射化学试剂和右旋糖苷T-500来自Amersham Pharmacia生物技术公司(Uppsala,瑞典),荧光探针FM4-64来自Invitrogen,分子探针公司(Eugene, OR, USA)。gydF4y2Ba
膜组分的分离gydF4y2Ba
从微粒体组分中分离出质膜(过滤后的匀浆在6 000离心10分钟gydF4y2BaggydF4y2Ba马克斯gydF4y2Ba,微粒体在65000处成球30分钟gydF4y2BaggydF4y2Ba马克斯gydF4y2Ba),采用一种样品和两种洗涤体系的水聚合物两相分配。这些系统的组成与之前在实验室中对豌豆苗进行的优化一样[gydF4y2Ba22gydF4y2Ba,大豆下胚轴[gydF4y2Ba23gydF4y2Ba),gydF4y2Ba答:芥gydF4y2Ba.分离的质膜悬浮在0.25 M蔗糖,10 mM KCl和10 mM HEPES/KOH, pH 7.0中,直接使用或在液氮中冷冻gydF4y2Ba2gydF4y2Ba在-80°C储存之前。gydF4y2Ba
为了确定ER起源的膜组分是否与质膜相关,分离的豌豆芽质膜被悬浮在10 mM MES/KOH pH 6.0和0.33 M蔗糖中,并在液氮中进行三次循环冷冻然后解冻。由于通过两相分配分离的质膜囊泡主要或完全向内朝向细胞质表面,因此这种处理有必要暴露部分囊泡的细胞质表面[gydF4y2Ba32gydF4y2Ba].由于需要从分离的酵母质膜中分离PAMs,因此使用了较低的pH值[gydF4y2Ba12gydF4y2Ba].在4℃孵育10分钟后,将膜悬浮液上置于相同缓冲液中连续蔗糖梯度(20-50% w/v蔗糖)上。梯度在10万× g的摆出转子中离心60 mingydF4y2Ba马克斯gydF4y2Ba.梯度顶部的条带被采集为质膜相关膜(PAMs)。用30mm HEPES/KOH pH 7.0, 10mm KCl和2.5 mM MgCl稀释这些膜和重悬的质膜颗粒gydF4y2Ba2gydF4y2Ba并以100000 × g成粒gydF4y2Ba马克斯gydF4y2Ba30分钟。gydF4y2Ba
豌豆芽中的微粒体也通过水聚合物两相分割在10步手工逆流过程中进行分离[gydF4y2Ba24gydF4y2Ba].10个体系各重10.00 g,含6.0% (w/w)葡聚糖T500, 6.0% (w/w) PEG3350, 5.0 mmol·kggydF4y2Ba-1gydF4y2BaKPi, pH 7.8, 0.25 mol·kggydF4y2Ba-1gydF4y2Ba蔗糖。膜样品被包含在第一个试管中。经过振荡和相分离,第一管的上相转移到第二管的新鲜下相,并在第一管中添加新鲜上相。重复这个过程,直到原来的上相到达管号10,所有的管都包含上相和下相。所有10个完整的两相体系分别用10 mM HEPES/KOH pH 7.5, 0.25 M蔗糖和10 mM KCl稀释,并在10万× g的浓度下制粒2次gydF4y2Ba马克斯gydF4y2Ba.gydF4y2Ba
从10步分离的第一管中获得了富含ER的膜组分。gydF4y2Ba
酰基掺入和脂质分析gydF4y2Ba
悬浮豌豆质膜,除另有说明外,蛋白含量为25 μg,用26 μM[1-]孵育gydF4y2Ba14gydF4y2BaC]18:1-CoA (2 Gbq/mmol)或[1-gydF4y2Ba14gydF4y2BaC]16:0-CoA (2 Gbq/mmol)在100 μl的0.33 M蔗糖,30 mM HEPES/pH 7.0, 10 mM KCl中。在大豆质膜中,常规使用100 μg蛋白质和2.5 mM mg -醋酸盐。进一步的补充是根据图和表图例。使用前,将溶解的溶血磷脂在氮气下干燥以去除有机溶剂,悬浮在培养介质中超声15分钟。当[gydF4y2Ba14gydF4y2BaC] lysoPC (gydF4y2Basn-1gydF4y2Ba[gydF4y2Ba14gydF4y2BaC]16:0, 2 Gbq/mmol), 0.92 nmol与7.2 nmol未标记的溶血多糖(蛋黄;主要包含16:0或18:0)。标准孵育时间为30 min,加入980 μl冰点氯仿:甲醇:水(体积30:60:15)的混合物停止反应。加入0.5 ml 1.6 M HCl和0.5 ml CHCl后gydF4y2Ba3.gydF4y2Ba,提取脂类[gydF4y2Ba42gydF4y2Ba].除去一部分用液体闪烁计数法测定脂类总放射性,其余部分用薄层色谱法和放射扫描法测定脂类之间的放射性标签分布[gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
其他分析和实验设计gydF4y2Ba
测定了以下标记酶:线粒体内膜细胞色素C氧化酶[gydF4y2Ba43gydF4y2Ba],内质网胆碱磷酸转移酶[gydF4y2Ba44gydF4y2Ba,质膜1,3-β-葡聚糖合成酶[gydF4y2Ba45gydF4y2Ba].测定类囊体膜的叶绿素含量[gydF4y2Ba46gydF4y2Ba]和单克隆抗-β-COP抗体M3A5的结合(Sigma-Aldrich, St. Louis, US;以前已对植物进行验证[gydF4y2Ba47gydF4y2Ba]),测定高尔基膜。简单地说,每个组分都被点染在硝化纤维素膜上。如前所述进行抗体孵育[gydF4y2Ba47gydF4y2Ba除了M3A5被用1:200稀释和含有辣根过氧化物酶偶联物的二抗(Pierce, Rockford, IL, USA)被稀释1:400。在Hyper膜ECL (GE-helthcare, Chalfont, UK)上检测过氧化物酶反应的化学发光,并用Syngene Bio成像系统(Cambridge, UK)对发光强度进行量化。蛋白质浓度测定采用双二酚酸法[gydF4y2Ba48gydF4y2Ba在加入蛋白测定试剂之前,先将膜组分在0.25% Triton X-100中溶解10分钟。如前所述,采用SDS-PAGE、天然凝胶电泳和MALDI-TOF或纳米LC-FTISR光谱法(瑞典Göteborg大学Swegene蛋白质组学中心)进行蛋白质鉴定[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
用于PLA效应的研究gydF4y2Ba2gydF4y2Ba0.001 U蜂毒PLAgydF4y2Ba2gydF4y2Ba与100 μM CaClgydF4y2Ba2gydF4y2Ba.外源添加的放射标记PC是gydF4y2Basn-1 2gydF4y2Ba[gydF4y2Ba14gydF4y2BaC] 16:0-PC。gydF4y2Ba
为了观察质膜相关的ER,我们使用gydF4y2Ba答:芥gydF4y2Ba在内质腔内用GFP转化[gydF4y2Ba31gydF4y2Ba].我们选择内质腔定位的GFP(而不是内质膜定位的GFP),以保持内质腔的原生膜表面,用于膜-膜相互作用的研究。将分离的质膜部分经过冷冻和解冻的循环,使囊泡的数量发生逆转[gydF4y2Ba32gydF4y2Ba].用荧光探针FM4-64观察得到的质膜。共聚焦显微镜图像如图所示[gydF4y2Ba20.gydF4y2Ba使用细胞成像中心(Swegene, Göteborg大学)的设备。gydF4y2Ba
所有的实验设置进行2-5次,每次使用从独立栽培的植物批次中分离的质膜组分(或其他膜组分)。从每个设置的一个代表性实验的数据被提出,因为绝对无线电标签在独立的实验之间是不同的。处理之间的趋势或差异在相同设计的独立实验之间是一致的,除非有特殊情况。gydF4y2Ba
缩写gydF4y2Ba
- 16:gydF4y2Ba
-
0,棕榈酸gydF4y2Ba
- 18:gydF4y2Ba
-
0,硬脂酸gydF4y2Ba
- 18:gydF4y2Ba
-
1, cis-9-octadecenoic酸gydF4y2Ba
- 16:gydF4y2Ba
-
0-CoA, hexadecanoyl-CoAgydF4y2Ba
- 18:gydF4y2Ba
-
1-CoA, cis-9-octadecenoyl-CoAgydF4y2Ba
- 辅酶a:gydF4y2Ba
-
辅酶AgydF4y2Ba
- DAG:gydF4y2Ba
-
甘油二酯gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- FFA:gydF4y2Ba
-
游离脂肪酸gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- 老妈:gydF4y2Ba
-
mitochondria-associated膜gydF4y2Ba
- PA:gydF4y2Ba
-
磷脂酸gydF4y2Ba
- 帕姆:gydF4y2Ba
-
质膜相关膜gydF4y2Ba
- PC:gydF4y2Ba
-
磷脂酰胆碱gydF4y2Ba
- 体育:gydF4y2Ba
-
磷脂酰乙醇胺gydF4y2Ba
- PI:gydF4y2Ba
-
磷脂酰肌醇gydF4y2Ba
- 中国人民解放军gydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
磷脂酶一gydF4y2Ba2gydF4y2Ba
- PLAM:gydF4y2Ba
-
质体膜有关gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Norberg P, Liljenberg C:燕麦根细胞质膜脂质:诱导耐水性的影响。植物生理学报,1998,25(4):366 - 366。gydF4y2Ba
- 2.gydF4y2Ba
Uemura M, Joseph RA, Steponkus PL:拟南芥的冷驯化。对质膜脂质组成及冻伤所致病变的影响。植物生理学报,1998,19(4):347 - 347。gydF4y2Ba
- 3.gydF4y2Ba
李贺仁,Selldén G,王晓峰,王晓燕:臭氧对豌豆叶片质膜脂质组成及动力学特性的影响。植物工程学报,2001,29(5):561 - 561。10.1034 / j.1399-3054.2001.1110206.x。gydF4y2Ba
- 4.gydF4y2Ba
Andersson MX, Stridh MH, Larsson KE, Liljenberg C, Sandelius AS:缺乏磷酸盐的燕麦用半乳糖双半乳糖二酰基甘油取代了质膜磷脂的大部分。中国生物医学工程学报,2003,38(5):533 - 533。10.1016 / s0014 - 5793(03) 00109 - 1。gydF4y2Ba
- 5.gydF4y2Ba
李伟,李敏,张伟,Welti R,王鑫:质膜结合的磷脂酶Dd增强了植物的抗冻性gydF4y2Ba拟南芥gydF4y2Ba.生物技术学报,2004,22:427-433。10.1038 / nbt949。gydF4y2Ba
- 6.gydF4y2Ba
植物中的磷脂信号转导机制。植物生态学报,2004,24(3):366 - 366。10.1146 / annurev.arplant.54.031902.134748。gydF4y2Ba
- 7.gydF4y2Ba
脂质生物合成。植物科学学报,1997,19(3):366 - 366。10.1105 / tpc.7.7.957。gydF4y2Ba
- 8.gydF4y2Ba
莫罗,贝苏勒,孟grand S, Testet T, Vincent P, Cassagne C:植物细胞中的脂质运输。中华医学会杂志,1998,37:371-391。10.1016 / s0163 - 7827(98) 00016 - 2。gydF4y2Ba
- 9.gydF4y2Ba
磷脂转运与膜生物发生。生物化学学报,1994,19(3):347 - 347。gydF4y2Ba
- 10.gydF4y2Ba
Schnabl M, Daum G, Pichler H:酵母脂质膜的多重转运途径。生物化学学报,2005,32(4):339 - 339。gydF4y2Ba
- 11.gydF4y2Ba
Holthuis JCM, Levine TP:脂质流量:软驱和高速公路。自然学报,2005,6:209-220。10.1038 / nrm1591。gydF4y2Ba
- 12.gydF4y2Ba
Pichler H, Gaigg B, Hrastnik C, Achleitner G, Kohlwein SD, Zellnig G, Perktold A, Daum G:酵母内质网的一个亚部分与质膜结合,具有很高的合成脂质的能力。中国生物医学工程学报,2001,29(3):361 - 361。10.1046 / j.1432-1327.2001.02116.x。gydF4y2Ba
- 13.gydF4y2Ba
Staehelin LA, Chapman RL:植物细胞的分泌和膜循环:在超高速冷冻的悬吊培养细胞和胡萝卜细胞中观察到的新型中介结构。植物学报,1987,17(4):449 - 457。10.1007 / BF00395066。gydF4y2Ba
- 14.gydF4y2Ba
Nziengui H, Bouhidel K, Pillon D, Der C, Marty F, Schoefs B:网状样蛋白gydF4y2Ba拟南芥gydF4y2Ba:结构组织和ER本地化。中国生物医学工程学报,2007,38(5):356- 362。10.1016 / j.febslet.2007.06.032。gydF4y2Ba
- 15.gydF4y2Ba
Gaigg B, Simbeni R, Hrastnik C, Paltauf F, Daum G:与酿酒酵母线粒体相关的微粒体亚片段的表征。参与合成和输入磷脂到线粒体。生物化学学报,1995,29(3):354 - 354。10.1016 / 0005 - 2736 (94) 00287 - y。gydF4y2Ba
- 16.gydF4y2Ba
Kjellberg JM, Trimborn M, Andersson M, Sandelius AS:叶绿体包膜磷脂酰化依赖的酰基辅酶a。生物化学学报,2000,30(4):354 - 354。gydF4y2Ba
- 17.gydF4y2Ba
Andersson MX, Kjellberg JM, Sandelius AS:细胞质脂肪酶在叶绿体包膜中磷脂酰胆碱转化为半乳糖合成的底物中的作用。生物化学学报,2004,16(4):449 - 451。gydF4y2Ba
- 18.gydF4y2Ba
Bessoule JJ, Testet E, Cassagne C:从内质网膜导入溶血卵磷脂后叶绿体包膜中磷脂酰胆碱的合成。中国生物医学工程学报,2003,23(5):559 - 561。10.1111 / j.1432-1033.1995.tb20288.x。gydF4y2Ba
- 19.gydF4y2Ba
Mongrand S, Cassagne C, Bessoule JJ:溶解磷脂酰胆碱进入叶绿体可能在真核质体的起源。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.122.3.845。gydF4y2Ba
- 20.gydF4y2Ba
Andersson MX, Goksör M, Sandelius AS:光学操作揭示了内质网和叶绿体之间的膜接触部位有很强的吸引力。中国生物医学工程学报,2007,29(4):379 - 379。10.1074 / jbc.M608124200。gydF4y2Ba
- 21.gydF4y2Ba
试验E, Bessoule JJ, Mongrand S, guilot - salomon T, Cantrel C, Cassagne C:植物线粒体中酰基辅酶a:1-酰基甘油磷酰胆碱酰基转移酶的发生。中国科学(d辑:自然科学版)。10.1016 / s0014 - 5793(96) 01293 - 8。gydF4y2Ba
- 22.gydF4y2Ba
李贺仁,Selldén G,王晓峰,王晓燕:臭氧对豌豆叶片质膜脂质组成及动力学特性的影响。植物工程学报,2001,29(5):561 - 561。10.1034 / j.1399-3054.2001.1110206.x。gydF4y2Ba
- 23.gydF4y2Ba
Harryson P, Morré DJ, Sandelius AS:磷脂酰亚醇在从大豆分离的膜组分之间的细胞自由转移。植物生理学报,2004,25(3):369 - 369。gydF4y2Ba
- 24.gydF4y2Ba
Andersson MX, Larsson KE, Tjellström H, Liljenberg C, Sandelius AS:磷酸限制燕麦:质膜和腺泡体作为磷脂到糖脂替换和质膜中磷脂酶刺激的主要靶点。中国生物医学工程学报,2005,29(3):359 - 359。10.1074 / jbc.M503273200。gydF4y2Ba
- 25.gydF4y2Ba
一原K,美K,佐野Y,田中K: 1-酰基甘油磷胆碱gydF4y2BaOgydF4y2Ba-酰基转移酶在成熟红花种子。植物学报,2003,23(5):555 -557。10.1007 / BF00203655。gydF4y2Ba
- 26.gydF4y2Ba
甘蓝型油菜溶血磷脂酰胆碱酰基转移酶的性质研究。油脂学报,2003,38:651-656。10.1007 / s11745 - 003 - 1110 - 0。gydF4y2Ba
- 27.gydF4y2Ba
Hunt MC, Alexson SEH:酰基辅酶a硫酯酶在介导细胞内脂质代谢中的作用。脂质学报,2002,41:99-130。10.1016 / s0163 - 7827(01) 00017 - 0。gydF4y2Ba
- 28.gydF4y2Ba
Stafford RE, Fanni T, Dennis EA:溶血磷脂的界面性质和临界胶束浓度。生物化学学报,1998,28:513 - 524。10.1021 / bi00438a031。gydF4y2Ba
- 29.gydF4y2Ba
Plücktham A,丹尼斯EA:眼镜蛇毒液磷脂酶A的激活、聚集和产物抑制gydF4y2Ba2gydF4y2Ba并与其他磷脂酶进行比较。中国生物医学工程学报,2004,24(3):379 - 379。gydF4y2Ba
- 30.gydF4y2Ba
Akermoun M, Testet E, Cassagne C, Bessoule JJ:溶素pc酰基转移酶合成巯基肽诱导银、铜、铅和汞合成塑料磷脂酰胆碱的抑制作用。生物化学学报2002,1581:21-28。gydF4y2Ba
- 31.gydF4y2Ba
Mitsuhashi N, Shimada T, Mano S, Nishimura M, Hara-Nishimura I:用GFP可视化烟草by -2细胞中液泡分选途径中的细胞器。植物生理学报,2000,41:993-1001。10.1093 /卡式肺囊虫肺炎/ pcd040。gydF4y2Ba
- 32.gydF4y2Ba
Palmgren MJ, Askerlund P, Fredrikson K, Widell S, Sommarin M, Larsson C:由内而外和由右而外密封的质膜囊泡。形成和分离的最佳条件。植物生理学报,1998,25(4):381 - 381。gydF4y2Ba
- 33.gydF4y2Ba
Roland U, Holk PA, Scherer GFE:脂肪酸和溶血磷脂是生长素作用的潜在第二信使。生长素对悬浮培养的西芹和大豆细胞磷脂酶A2活性的快速激活。植物学报,1998,26(4):371 - 371。10.1046 / j.1365 - 313 x.1998.00333.x。gydF4y2Ba
- 34.gydF4y2Ba
李松,徐松,Kim S, Crain RC, Kwak JM, Nam HG, Lee Y:受伤植物体内磷脂酸和溶血磷脂水平的升高。植物学报,1997,12:547-556。10.1046 / j.1365 - 313 x.1997.00547.x。gydF4y2Ba
- 35.gydF4y2Ba
Drissner D, Kunze G, Callewaert N, Gehrig P, Tamasloukht M, Boller T, Felix G, Amrheim N, Bucher M:溶磷脂酰胆碱是丛枝菌根共生中的信号。科学通报,2007,29(5):561 - 561。10.1126 / science.1146487。gydF4y2Ba
- 36.gydF4y2Ba
Ryu SB, Karlsson BH, Özgen M, Palta JP:脂源性衰老延缓剂溶血磷脂酰乙醇胺对磷脂酶D的抑制作用。美国国家科学研究院。1997年,94:12717 - 12721。10.1073 / pnas.94.23.12717。gydF4y2Ba
- 37.gydF4y2Ba
Chernomordik LV, Kozlov MM:蛋白质-脂质在生物膜融合和裂变中的相互作用。生物化学学报,2003,32(3):394 - 394。10.1146 / annurev.biochem.72.121801.161504。gydF4y2Ba
- 38.gydF4y2Ba
Norberg P, Engström L, Nilsson R, Liljenberg C:燕麦根质膜脂的相行为和分子种类组成。诱导脱水耐受性的影响。生物化学学报,1998,15(3):354 - 354。10.1016 / 0005 - 2736 (92) 90253 - i。gydF4y2Ba
- 39.gydF4y2Ba
Henshaw JB, Olsen CA, Farnbach AR, Nielson KH, Bell JD:溶磷脂和棕榈酸在改变二棕榈酰磷脂酰胆碱双分子层对磷脂酶A2敏感性中的特定作用的定义。生物化学,1998,37:10709-10721。10.1021 / bi9728809。gydF4y2Ba
- 40.gydF4y2Ba
植物质膜的氧化还原过程。分离的质膜囊泡的研究。Ph值D论文。1990年,隆德大学植物生物化学系和植物生理学系gydF4y2Ba
- 41.gydF4y2Ba
埃格,Morré DJ, Selldén G,桑德利乌斯AS:用自由流电泳或两相分离单独或组合分离青小麦叶片质膜组分。植物工程学报,1992,38(4):381 - 381。10.1111 / j.1399-3054.1992.tb08774.x。gydF4y2Ba
- 42.gydF4y2Ba
植物质膜中的磷脂酰肌醇和磷脂酰肌醇磷酸激酶。生物化学学报,1988,29(4):378 - 378。gydF4y2Ba
- 43.gydF4y2Ba
Widell S, Larsson C:用于质膜净化的标记的关键评价。植物质膜。编辑:Larsson C, Moller IM。1990年,柏林,斯普林格-弗拉格,16-43。gydF4y2Ba
- 44.gydF4y2Ba
内质网和核糖体。从植物细胞中分离膜和细胞器。编辑:霍尔JL,摩尔AI。1983年,伦敦,文献出版社,119-134。gydF4y2Ba
- 45.gydF4y2Ba
Fredrikson K, Larsson C: Ca-2+、精胺和纤维二糖对1,3- β -葡聚糖合酶的激活-利用内外等离子膜囊泡定位激活位点。植物工程学报,1999,19(4):369 - 371。10.1111 / j.1399-3054.1989.tb04969.x。gydF4y2Ba
- 46.gydF4y2Ba
Arnon DI:分离叶绿体中的铜酶。甜菜中的多酚氧化酶。植物学报,1994,24:1-15。gydF4y2Ba
- 47.gydF4y2Ba
Couchy I, Bolte S, Crosnier MT, Brown S, Satiat-Jeunemaitre A:参与植物高尔基体形态动力学的β - cop样蛋白的鉴定和定位。科学通报,2003,32(5):557 - 557。10.1093 / jxb / erg230。gydF4y2Ba
- 48.gydF4y2Ba
Smith PK, Krohn RI, Hermanson GT, Mallia AK, Gartner FH, Provenzano MD, Fujimoto EK, Goeke NM, Olson BJ, Klenk DC:用二氯二酚酸测定蛋白质。生物化学学报,2004,25(3):366 - 366。10.1016 / 0003 - 2697(85) 90442 - 7。gydF4y2Ba
确认gydF4y2Ba
Shirin Tavalley-Roodsari女士因大豆质膜的分离而闻名。财政支持来自瑞典农业、环境科学和空间规划研究委员会(Formas,归瑞典科学院)、瑞典皇家农业和林业学院(归瑞典科学院)和Helge Ax:son Johnson基金会(归JMK)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
JMK发起了这项研究,并对大豆膜进行了测定。KEL和ASS设计了豌豆研究,KEL对豌豆膜进行了所有的分离和分析。HT对共聚焦显微镜和高尔基抗体研究有贡献。KEL和ASS撰写了手稿,所有作者阅读并批准了最终版本。gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
拉尔森,k.e.,克尔伯格,j.m., Tjellström。gydF4y2Baet al。gydF4y2Ba植物质膜及质膜相关内质网溶血多糖酰基转移酶/PC酰基转移酶活性。gydF4y2BaBMC植物杂志gydF4y2Ba7,gydF4y2Ba64(2007)。https://doi.org/10.1186/1471-2229-7-64gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-7-64gydF4y2Ba
关键字gydF4y2Ba
- 内质网gydF4y2Ba
- 磷脂酸gydF4y2Ba
- 质膜分数gydF4y2Ba
- 质膜小泡gydF4y2Ba
- 内质网腔gydF4y2Ba