摘要
背景
染色体配对、重组和DNA修复是有性生殖生物减数分裂的重要过程。调查面包小麦(小麦l .)Ph2(P播放h同源基因座已经确定了许多可能在控制这一过程中起作用的候选基因,包括TaMSH7它是DNA错配修复家族的一种植物特异性成员。
结果
三者的排序MSH7位于小麦染色体3A、3B和3D短臂上的基因在氨基酸水平上没有显示出显著的序列差异,这表明同源群之间的功能守恒。的功能分析MSH7利用RNAi技术对二倍体大麦(大麦芽l .)。实时荧光定量PCR检测到多个T0简化线MSH7表达式。两个T的正隔离1详细研究的线条显示减少MSH7表达式与转换后的控件和空分隔符进行比较时。的表达MSH6是错配修复家族的另一个成员,它与MSH7基因,在这些品系中没有显著减少。在这两个T中1在细胞系中,观察到阳性分离的结实率降低。
结论
本文的研究结果首次表明体内MSH7并且表明这种基因的表达对于野生型的生育水平是必要的。这些观察结果表明MSH7在减数分裂过程中有重要的作用,因此仍然是Ph2。
背景
在大多数生物体中,存在着进化上保守的机制,可以将DNA复制过程中引入的错配频率降至最低[1].由于植物缺乏保留的种系,体细胞中发生的突变可以传递给下一代。因此,需要一个有效的复制后DNA修复机制是明显的。错配修复(MMR)系统是这种DNA修复的重要组成部分。
在真核生物中,MMR是由MutS和MutL同源物(MSH和MLH)承担的。MSH和MLH多肽分别形成MSH和MLH异二聚体蛋白,它们共同作用结合错配DNA并启动修复。大多数真核生物都有编码六种MSH蛋白的基因,但在植物中发现了第七种MSH蛋白(MSH7) [2].
除MSH1外,所有MSH蛋白均参与减数分裂期间的DNA修复和/或重组[3.],每个人都有一个特定的但经常重叠的角色。MSH4-MSH5异源二聚体只被报道参与减数分裂重组[4],而其余三种二聚体既参与重组又参与MMR。MSH2-MSH3异源二聚体(MutSβ)结合插入/缺失环,MSH2-MSH6异源二聚体(MutSα)结合碱基错配和小的插入-缺失环[5,6],而MSH2-MSH7异源二聚体(MutSγ)结合碱基错配,但不结合插入-删除环[7].然后这些异源二聚体招募MLH蛋白来启动MMR。
除了在MMR和同源重组中发挥作用外,MSH已知基因参与抑制同源重组[8,9].最近的研究表明,当两个不同的序列进行重组时,一些MSH蛋白在重组中间检测到不匹配,重组事件随后被终止[10].对细菌和酵母的研究支持了这些发现,表明MMR系统的失活导致种间和种内同源重组水平升高和物种屏障的松弛[8,11- - - - - -13].使用酵母(酿酒酵母),达塔等。结果表明,在序列变异小于10%的序列之间,同源重组在MMR失活后增加了70倍[14].在高等真核生物中也观察到这种抑制,对植物和人类的研究表明,参与MMR的蛋白质在抑制同源重组中起着关键作用[15- - - - - -17].在酵母中,MSH2及其两个结合伙伴MSH6和MSH3介导同源重组的抑制[18].在植物中,MSH2也可以抑制同源重组[16,19],暗示植物特异性MSH7参与了这一过程,因为这两种多肽形成了异源二聚体。
支持这一假设的事实得到了加强MSH7已被定位到小麦中一个已知影响同源重组的位点[20.].面包小麦(小麦)基因组包含几个已知参与抑制同源重组的位点。从历史上看,这两个主要的基因位点是Ph1和Ph2(P播放homoeologous)。Ph2表现型。其中之一,ph2a,产生了通过x射线照射,含有一个D基因组缺失[21].另一方面,ph2b是一种化学诱导突变,被认为是单核苷酸多态性(SNP)或小插入或删除(INDEL) [22].的ph2b因此,突变体(特别是)表明Ph2是位于染色体3D短臂上的单个基因[22,23].南方对无染色体-四染色体和二染色体系的分析表明MSH7位于染色体3A、3B和3D的短臂上[20.].此外,杂交的aTaMSH7中国春蚕基因组DNA的研究ph2a线条表明,染色体3D上的拷贝位于dna中缺失的区域ph2a突变体(20.].
鉴于已知的参与MSH抑制同源重组的基因及其定位TaMSH7到Ph2在面包小麦中,该基因是一个很强的基因位点Ph2候选人。理解的作用MSH7在植物减数分裂重组中,对这一重要候选基因的进一步研究是必要的。在更广泛的背景下,加强减数分裂重组将有利于植物育种者,允许从野生作物近缘种到国内育种品系的DNA渗入的新策略[24].
本文的研究分为两个部分。第一部分比较了不同小麦种质和突变体的cDNA序列。特别比较了中国春蚕的D基因组拷贝与中国春蚕的D基因组拷贝ph2b在已知的ORF中是否存在SNPs或小INDELTaMSH7序列。研究的第二部分证明了MSH7功能缺失导致转基因大麦结实率降低(大麦芽)植物,并首次表明MSH7起着必要的作用在活的有机体内这种基因的表达是野生型生育水平所必需的。大麦被用于这项研究,因为它是二倍体,它提供了一个比小麦更简单的模型,并允许评估的作用MSH7小麦同源染色体间的重组过程,无需处理同源和同源染色体的复杂性。
结果与讨论
小麦、拟南芥和玉米(玉米)已确定MSH7是MSH蛋白家族的植物特有成员[1,20.,25].鉴于MSH2-MSH7异源二聚体与其他MSH异源二聚体相比具有不同的结合特异性,我们认为MSH7在植物细胞中具有不同的功能作用[2].本研究调查了MSH7在转基因大麦中比较了三个亚基因组拷贝MSH7以确定是否有snp或INDELs可能解释Ph2之前已经报道过的表型。
测序的TaMSH7从面包小麦
三个不同的MSH7在面包小麦中鉴定出具有代表性的A、B和D基因组拷贝序列。这三个序列均从小麦减数分裂cDNA中获得,表明这三个基因在减数分裂过程中均有表达。序列比对t . tauschii(面包小麦的D基因组祖先)被用来确定属于D基因组的序列,而来自无染色体-四染色体系的序列被用来区分A和B基因组(图2)1)。
概念翻译和随后的对齐TaMSH7核苷酸和蛋白质序列在三个亚基因组拷贝之间显示97.7%的核苷酸序列同源性和95%的氨基酸同源性(图2)1 b)。这三者之间几乎所有的氨基酸都不同助教发现MSH7蛋白序列在其他MSH7和MSH6蛋白中存在不保守的残基(如残基565、572、574、575等)。然而,B基因组共识的残基596是一个极性丝氨酸残基,而其他MSH7和MSH6蛋白都是极性丝氨酸残基电子商务傻瓜(E。杆菌)含有非极性亮氨酸、异亮氨酸或缬氨酸残基(图2)1 b)。这种差异落在MSH7蛋白中被截断的非特异性DNA结合域上。MSH7蛋白已被证明与DNA结合,但其结构域截断的重要性(如果有的话)尚未确定。对MutS蛋白家族的生化研究尚未发现该残基的任何特殊意义[26虽然有可能,但这种氨基酸的变化似乎不太可能导致蛋白质功能的任何重大变化。
的序列MSH7从D基因组ph2b突变体
这两个已知的Ph2面包小麦的突变体,ph2a和ph2b我建议Ph2可能是位于D基因组上的单个基因。董先生及同事[20.以前也曾提出过这样的建议MSH7可能是候选人Ph2。考虑到表型在ph2b突变被认为是一个SNP或小插入/删除的结果,D基因组拷贝MSH7从这个突变体中进行测序以确定是否MSH7可以验证为Ph2基因。
在野生型中国春和野生型中国春之间鉴定出3个snpph2bD基因组拷贝TaMSH7。这些snp在氨基酸水平上导致了两个变化(图2)1 c)。第一个多态性导致477位的丝氨酸向脯氨酸转变。在玉米MSH7同源基因的这个位置发现了脯氨酸,这表明这种变化在功能上是冗余的。第二个多态性导致异亮氨酸与缬氨酸在残基496处发生变化。缬氨酸也存在于水稻MSH7和玉米MSH7的这个位置,这表明这种变化也导致了功能蛋白的产生。考虑到这些变化的性质,不太可能ph2bD基因组拷贝MSH7编码序列包含任何可能导致无功能或功能失调的蛋白质的突变。此外,ph2b的基因组拷贝MSH7在减数分裂cDNA(约三分之一的序列ph2b克隆)表明该基因在减数分裂期间表达。这大大降低了启动子或其他调控元件内突变导致突变的可能性Ph2表现型。
虽然ph2b突变是在中国春天的背景下产生的,两者之间的差异ph2b和亲本序列可能是由于我们和其他人在其他几个位点观察到的中国春天的遗传变异。这些测序工作的结果表明,中国春天有几个不同的“版本”。这里看到的差异也可能是由于中国春的化学诱变引起的背景突变,导致了最初的鉴定ph2b突变体。
转基因大麦生产分析
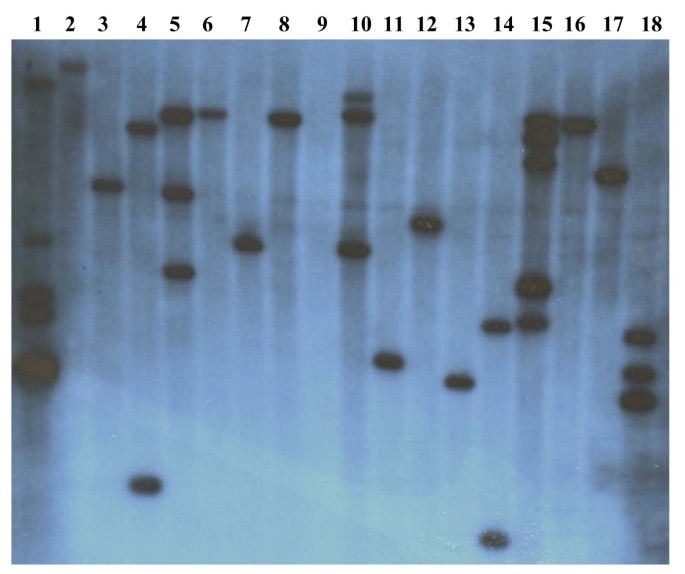
超过55个独立的大麦系,由小麦改造而成MSH7双链RNAi构建体(见方法),转化频率约为11%。与之前发表的大麦转化实验相比[27- - - - - -29使用同一品种(Golden Promise),这里报告的频率要高得多。通过PCR和Southern杂交证实了这些系都是阳性的(图2)2),其中许多插入了一个单拷贝的潮霉素抗性基因(54%的RNAi)MSH7产生转基因品系)。在所有生产的品系中,只有14%插入了4个或更多的抗潮霉素基因拷贝。这是一种具有许多T染色体的特征性表型0与仅含有潮霉素抗性基因的空载体转化的对照相比,通过较低的结实率可以证明,这些品系的育性水平降低。
转基因大麦RNAi功能丧失分析
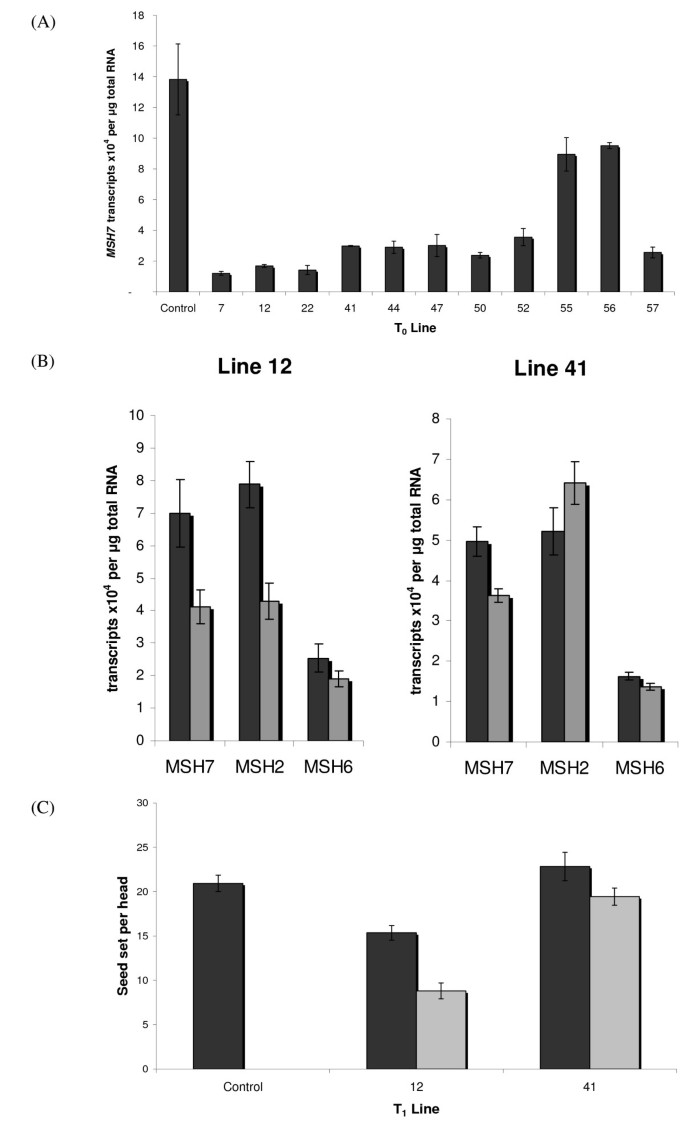
从转基因T0第12行(表11)进行分析MSH7用实时荧光定量PCR (Q-PCR)表达。在大多数这些细胞系中,转基因的表达显著降低(图2)3)。在T里1选择第二代单拷贝插入系(第12和41行)进行进一步的表达分析。这些线是根据它们的T来选择的0表达水平和形态特征也包括降低结实率和花粉活力。这些品系的阳性分离明显减少MSH7表达式与相同行的null分隔符相比(第12行p = 0.009,第41行p = 0.0008)3 b)。的表达的减少MSH2在第12行也观察到,但在第41行没有。阳性分离和阴性分离在MSH6表达式(图3 b)。
基于简化后的MSH2在第12行的表达式中,我们调查了是否MSH2和/或MSH6通过RNAi机制非特异性靶向这些基因可能会影响其表达。为了实现这一目标,RNAi构建体和各种rna之间的序列身份MSH进行基因比较。由于许多大麦的序列信息是不可用的MSH基因、水稻MSH2和MSH6将序列与水稻片段进行比较MSH7与RNAi结构中使用的序列同源。虽然不理想,这被认为是一个适当的近似序列恒等式的存在MSH单子房和双子房的基因都表明了MSH基因出现在水稻/大麦分化之前[2,25].这也得到了先前对拟南芥的研究的支持MSH7背离MSH6真核生物进化早期[2].的MSH7RNAi结构内的片段显示53%和51%的序列同源性MSH6和MSH2,分别。此外,与这两个错配修复基因家族成员中的任何一个100%同源的RNAi构建物所选择的序列的最大片段长度仅为9bp。在植物中,通常需要具有100%序列一致性的~ 21nt RNA才能使RNAi发挥作用[30.,31]),因此RNAi结构不太可能影响到dna的任何其他成员MSH基因家族。
结实率和种子重量
细胞系12和细胞系41的阳性分离表现出较低的育性,这可以从籽粒结实率的降低中看出(图2)3 c)。在第12行,这种差异在95%的置信水平上显著(p < 0.033),在第41行,这种差异在90%的置信水平上显著(p < 0.077)。这些品系(12和41)的阳性分离株和零分离株之间的种子重(1000粒重)差异在90%的置信水平上也具有统计学意义(p < 0.09)。这些结果,连同Q-PCR数据,表明MSH7在决定植物肥力方面起着重要作用。
有两种明显的途径可以导致生育率的降低MSH7表达式。首先,这些植物的MMR水平可能会降低,从而导致更高水平的突变,从而减少可活种子。其次,减少表达可以降低减数分裂过程中同源重组的抑制。已知在细胞分裂过程中,由于易位和不分离,增加的重组会导致染色体不稳定和活配子的减少[8,17,21].
根据报道的T1从转基因角度来看,我们不能排除在第12行观察到的育性水平降低的可能性,这不仅是由于基因表达的减少MSH7基因也是的MSH2基因。事实上,霍夫曼已经发现了与本研究中观察到的相似的表型等。[32谁显示,使用aMSH2T-DNA插入突变,使拟南芥的MMR系统失效,导致一些品系在两代内发生高水平突变并降低生育力。然而,本研究第41行中观察到的生育力降低可归因于MSH7的表达水平无明显变化MSH2成绩单。重要的是,即使在霍夫曼报告的研究中,仍然需要进一步的实验来区分这些可能导致生育率下降的原因等。[32],他们无法证明观察到的表型是由于MMR减少,同源重组减少还是其他机制。
方法
植物材料
面包小麦(小麦简历。中国春天),突变体ph2a和ph2b,T。aestivum零体3B四体3A (N3BT3A)系和T。tauschii在23°C(白天)和15°C(晚上)的温度控制的温室中生长,光周期为14小时。收集了处于前期I期的幼穗。
转化大麦植株(cv。金灿灿(Golden Promise)的植物也像上面那样生长。收集到的成熟叶片和处于前期I期的幼穗0植物和精选T1行。在显微镜下对小麦和大麦的花药南瓜进行了减数分裂阶段的测定。
农杆菌属介导的转换
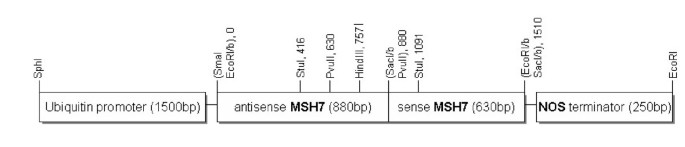
利用630 bp的正义和880 bp的反义分别构建了一个编码RNA茎环结构的结构体TaMSH7序列,包括250 bp的非互补序列,形成环路(图2)4)。RNAi环序列的两侧是一个1500 bp的玉米多泛素(无论在哪里)启动子片段[33]和一个250bp的终止体片段农野碱合成酶(NOS)基因。
然后将Ubi-MSH7RNAi-NOS卡带结扎到Sph我和生态pPG1的RI位点(Paul Gooding博士,未发表的),并使用合成向量进行变换。农杆菌属-介导转化实验采用Tingay开发的程序进行等。[34],经Matthews修改等。[35].愈伤组织诱导培养基含10 μM CuSO4,茎部再生和植株发育培养基中含有1 μM CuSO4。培养基按照Bregitzer所描述的修改后的灭菌程序制备等。[36].
基因分型转化植物
利用转化的潮霉素磷酸转移酶(成基因(引物HvHyg1、GTCGATCGACAGATCCGGTC和HvHyg2GGGAGTTTAGCGAGAGCCTG)和单拷贝大麦内源基因(HvSAP2)(引物GGATCGATCGTCCAGCTACTA和AGAGTGGGTTGTGCTTGAGAT)。HvSAP2作为阳性对照,以确认PCR扩增过程中所用DNA的完整性。
使用Pallotta描述的方法等。[37],从假定的转化体收集的叶片组织中分离基因组DNA。每个PCR反应包含200 ng模板DNA, 0.2 mM dNTPs, 0.4 μM引物,1× Q溶液(QIAGEN, Australia), 2.5 UTaqDNA聚合酶25 μL 1× PCR缓冲液(QIAGEN)。PCR循环条件如下:高压Hyg: 95°C 15分钟,然后35次循环,94°C 1分钟,55°C 30秒,72°C 90秒,最后在72°C下延长10分钟;HvSAP2: 95°C, 5分钟,然后35个循环,94°C, 1分钟,57°C, 30秒,72°C, 45秒,最后延长步骤,72°C, 10分钟。PCR产物在1%琼脂糖凝胶(w/v)上分离。
PCR结果也用Southern杂交进行了验证。基因组DNA (10-15 μg)用生态RV(美国新英格兰生物实验室)。DNA片段在1% (w/v)琼脂糖凝胶上分离,并转移到Hybond™-N上+尼龙膜(Amersham Pharmacia Biotech Ltd, UK),根据制造商的说明,加入0.4 M NaOH。A 1.1 kbXho从质粒pCAMBIA1390中切除DNA片段进行检测成抗潮霉素植物基因组DNA杂交序列。根据制造商的说明,使用Bresa-Clean™核酸纯化试剂盒(Bresatec,澳大利亚)从切除的凝胶片段中分离DNA探针片段。探针用随机引物标记[38使用MegaPrime™DNA标记系统(Amersham)。
在65℃下使用标准条件进行杂交[39].杂交后,用0.1× SSC, 1% (w/v) SDS在65℃下洗涤20分钟,风干后暴露于x射线胶片(RX Fuji Medical x射线胶片;RX-U,日本)-80°C。
cDNA合成及定量PCR
根据制造商的协议,使用TRI-REAGENT (Astral Scientific Pty Ltd., Australia)分离总RNA。RNA用TURBO DNA-处理免费的™(Ambion,美国),详见制造商说明书。根据制造商的说明,使用SuperScript™III逆转录酶(Invitrogen, Australia)从2 μg的总RNA合成cDNA。按照Crismani的描述进行Q-PCR等。[40],引物如表所示2。Q-PCR数据表示为至少7个重复的平均值。为了使表达数据正常化,一个单独的控制基因,高压GAPdH用于单组织,单时间点实验。
PCR扩增TaMSH7和测序
小麦的减数分裂cDNA与大麦相同。每个PCR反应含有100 ng cDNA, 0.2 mM dNTPs, 0.2 μM引物(见表)2), 2mmmgcl2和1u白金®Taq高保真聚合酶(Invitrogen)在50 μL的1倍高保真PCR缓冲液(Invitrogen)中。PCR循环条件为95°C 5分钟,然后在94°C 1分钟、56°C 1分钟、68°C 2分钟进行35次循环,最后在68°C延长10分钟。1%琼脂糖凝胶电泳用于扩增产物的可视化,扩增产物随后使用QIAGEN快速凝胶提取程序(QIAGEN)纯化。
然后将洗脱的产物克隆到pGEM中®-T Easy vector (Promega, Australia)根据制造商的协议。该基因的测序覆盖率约为15倍,确保所有亚基因组拷贝被识别。测序反应的毛细管分离由位于澳大利亚布里斯班的澳大利亚基因组研究机构(AGRF)使用Applied Biosystems荧光系统进行。使用Contig Express (VNTI Suite, Version 8, Informax, USA)生成Contig。在Vector NTI中进行一致序列生成和进一步分析。
结实率和种子重量
成熟的T1从每株植物的十个有代表性的穗上收集种子,在37°C下干燥7至10天。然后测定籽粒平均重,并以此计算千粒重。学生T检验(假设方差不等)用于确定样本在隔离T中的平均值1结实率和千粒重居群差异有统计学意义(Microsoft Office Excel 2003)。使用Microsoft Office Excel 2003编制图表。
参考文献
- 1.
李建平,李建平。植物DNA错配修复研究进展[j]拟南芥预测属于真核MutS同源物的MSH2亚家族的蛋白质的基因。植物生理学报,2009,35(2):833-839。10.1104 / pp.115.2.833。
- 2.
Culligan KM, Hays JB:拟南芥MutS同源物atmsh2, AtMSH3, AtMSH6和一种新的atmsh7形成了三种不同的蛋白质异源二聚体,它们对错配DNA具有不同的特异性。植物学报,2000,12(6):991-1002。10.1105 / tpc.12.6.991。
- 3.
Sia EA, Kirkpatrick DT:酵母MSH1在减数分裂过程中,基因不参与DNA的修复或重组。DNA修复,2005,4(2):253-261。10.1016 / j.dnarep.2004.10.002。
- 4.
诺维克,罗德格。芽殖酵母Msh4蛋白在染色体突触中的功能及交叉分布的调控。遗传学报,2009,35(3):1013-1025。
- 5.
Acharya S, Wilson T, Gradia S, Kane MF, Guerrette S, Marsischky GT, Kolodner R, Fishel R: hMSH2与hMSH3和hMSH6形成特异性错对结合复合物。美国国家科学院院刊,1996,93(24):13629-13634。10.1073 / pnas.93.24.13629。
- 6.
马思奇,刘建军,李建军,等酿酒酵母MSH3和MSH6在msh2依赖性错配修复中的作用。基因与发育,1996,10(4):407-420。10.1101 / gad.10.4.407。
- 7.
吴世文,刘建军,刘建军,等。基于红外光谱的不同错对识别拟南芥dna错配修复蛋白MSH2。MSH6 (MutSα)和MSH2。MSH7(傻瓜γ)。核酸研究,2003,31(20):6027-6034。10.1093 / nar / gkg780。
- 8.
raysiguier C, Thaler DS, Radman M:复合屏障大肠杆菌和鼠伤寒沙门氏菌在错配修复突变体中被破坏。自然科学,1989,32(6):396- 396。10.1038 / 342396 a0。
- 9.
李建军,李建军,李建军,等。错配修复系统对酵母减数分裂不育的影响。生物力学学报,1996,15(7):1726-1733。
- 10.
李建平,李建平,李建平,等。基因重组的基因错配修复蛋白研究。细胞遗传学与基因组学研究,2004,107(3-4):146-159。10.1159 / 000080593。
- 11.
马志军,李建军,李建军,等。细菌物种间基因交换- SOS和错配修复系统在物种进化中的作用。细胞生物学杂志,1995,30(3):507-515。10.1016 / 0092 - 8674(95) 90501 - 4。
- 12.
李建军,李建军,李建军,等。染色体大重复的控制大肠杆菌通过错配修复系统。遗传学报,2001,29(2):327-332。
- 13.
Selva EM, New L, Crouse GF, Lahue RS:错配校正对同源重组的阻碍作用酿酒酵母。遗传学报,1995,39(3):1175-1188。
- 14.
Datta A, Adjiri A, New L, Crouse GF, Jinks Robertson S:错配修复蛋白调控的有丝分裂交叉酿酒酵母。中国生物医学工程学报,1996,16(3):1085-1093。
- 15.
李建平,李建平。基因重组与基因复制保真度的关系。生物化学学报,1996,35(5):1010 - 1013。10.1146 / annurev.bi.65.070196.000533。
- 16.
李丽丽,Jean M, Belzile F .序列分化和DNA错配修复对同源重组的影响拟南芥。植物学报,2006,45(6):908-916。
- 17.
Trouiller B, Schaefer DG, Charlot F, Nogue F:在苔藓中,MSH2对于保持基因组完整性和防止同源重组至关重要Physcomitrella金属盘。核酸研究,2006,34(1):232-242。10.1093 / nar / gkj423。
- 18.
陈建军,陈建军,陈建军。酵母有丝分裂同源重组调控:错配修复和核苷酸切除修复基因的功能。遗传学报,2009,34(1):344 - 344。
- 19.
Lafleuriel J, Degroote F, Depeiges A, Picard G: AtMSH2缺失对大鼠双链断裂诱导重组的影响拟南芥胚组织。植物分子生物学,2007,36(6):833-846。10.1007 / s11103 - 006 - 9128 - 5。
- 20.
董建平,杨建平,李建平,等。DNA错配修复基因的研究进展Ph2小麦的基因座。基因组学,2002,45(1):116-124。10.1139 / g01 - 126。
- 21.
普通小麦的同源配对诱变突变体。中国生物医学工程学报,1997,19(3):585-593。
- 22.
李建军,李建军,李建军,等。小麦减数分裂染色体配对的研究进展。基因工程学报,1997,18(2):391 - 398。
- 23.
苏顿T, Whitford R, Baumann U, Dong CM, Able JA, Langridge P:Ph2小麦配对同源位点(小麦):用比较遗传学方法鉴定候选减数分裂基因。植物学报,2003,36(4):443-456。10.1046 / j.1365 - 313 x.2003.01891.x。
- 24.
Able JA, Langridge P, Milligan AS:在谷物中捕捉多样性:许多选择但很少混杂。植物科学动态,2007,12(2):71-79。10.1016 / j.tplants.2006.12.002。
- 25.
霍瓦特·M,克拉默·W,昆泽·R:语言结构与表达玉米mus同源物Mus1和Mus2。理论与应用,2002,(2):423-430。10.1007 / s00122 - 002 - 0955 - 8。
- 26.
刘建军,陈建军,陈建军,陈建军,陈建军,陈建军。DNA错配修复蛋白MutS与G·T错配结合的晶体结构。自然科学学报,2000,37(6):711-717。10.1038 / 35037523。
- 27.
Shrawat AK, Becker D, Lorz H:根癌土壤杆菌介导的大麦遗传转化(大麦芽l .)。植物科学学报,2007,32(2):391 - 391。10.1016 / j.plantsci.2006.09.005。
- 28.
Murray F, Brettell R, Matthews P, Bishop D, Jacobsen J:比较农杆菌属利用GFP和GUS报告基因介导的四种大麦品种的转化。植物学报,2004,22(6):397-402。10.1007 / s00299 - 003 - 0704 - 8。
- 29.
Travella S, Ross SM, Harden J, Everett C, Snape JW, Harwood WA:粒子轰击和转基因大麦品系的比较农杆菌属介导技术。植物学报,2005,23(12):780-789。10.1007 / s00299 - 004 - 0892 - x。
- 30.
沃森JM, Fusaro AF,王明明,Waterhouse PM:植物RNA沉默平台。生物医学工程学报,2005,35(6):591 - 597。10.1016 / j.febslet.2005.08.014。
- 31.
王晓明,王晓明,王晓明,等。植物RNA沉默途径的研究进展。遗传学报,2006,22(5):268-280。10.1016 / j.tig.2006.03.003。
- 32.
李建军,李建军,李建军,李建军,李建军,李建军,李建军,等拟南芥。基因与发育,2004,18(21):2676-2685。10.1101 / gad.1217204。
- 33.
基于泛素启动子的单子叶植物中选择性和/或可筛选标记基因的高水平表达载体。转基因研究,1996,5(3):213-218。10.1007 / BF01969712。
- 34.
Tingay S, McElroy D, Kalla R, Fieg S, Wang MB, Thornton S, Brettell R:根癌土壤杆菌介导的大麦转化。植物学报,1997,11(6):1369-1376。10.1046 / j.1365 - 313 x.1997.11061369.x。
- 35.
Matthews PR, Wang MB, Waterhouse PM, Thornton S, Fieg SJ, Gubler F, Jacobsen JV:转基因大麦标记基因的共转化与相邻双t - dna的共转化农杆菌属变换向量。分子育种,2001,7(3):195-202。10.1023 /: 1011333321893。
- 36.
李建军,李建军,李建军,等。大麦胚性愈伤组织再生的研究进展。植物学报,1998,17(12):941-945。10.1007 / s002990050514。
- 37.
Pallotta MA, Graham RD, Langridge P, Sparrow DHB, Barker SJ:大麦锰效率的RFLP图谱。遗传学报,2009,31(7):1109 - 1109。10.1007 / s001220051585。
- 38.
Feinberg AP, Vogelstein B: DNA限制性内切酶片段的高特异性活性放射性标记技术。生物化学学报,2003,32(1):6-13。10.1016 / 0003 - 2697(83) 90418 - 9。
- 39.
李建军,李建军,李建军,等。分子克隆技术的研究进展。纽约冷泉港:冷泉港实验室出版社1989。
- 40.
Crismani W, Baumann U, Sutton T, Shirley N, Webster T, Spangenberg G, Langridge P, Able JA:六倍体面包小麦减数分裂和小孢子发生的芯片表达分析。生物医学工程学报,2006,7:
致谢
作者感谢Rohan Singh博士和Konny Beck-Oldach博士制作了RNAiTaMSH7Neil Shirley博士进行了Q-PCR, Margie Pallotta博士进行了无利基(nulli-tetra)系,黄春元博士提供了转基因大麦HvSAP2PCR对照引物。作者感谢分子植物育种合作研究中心(MPB CRC)、澳大利亚植物功能基因组学中心(ACPFG)和粮食研究发展合作组织(GRDC)(项目编号UA00007)对这项研究的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
AHL进行了研究,分析了数据并起草了手稿。ASM, PL和JAA设计了实验,分析了数据并起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Lloyd, a.h., Milligan, a.s., Langridge, P。et al。TaMSH7:一种影响转基因大麦生育力的谷物错配修复基因(大麦芽l .)。BMC Plant Biol7,67(2007)。https://doi.org/10.1186/1471-2229-7-67
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-7-67
关键字
- 面包小麦
- 基因组复制
- RNAi构造
- 金色的承诺
- 转基因大麦