摘要
背景
光和温度是植物基因表达的关键非生物调节因子。本文利用微阵列技术对低温处理下的光效应进行了分析。通过启动子分析,特别关注上调和下调基因。这种方法揭示了基因诱导或抑制背后的转录因子调控网络。
结果
一些氧化应激相关基因的诱导只发生在冷/光处理下,包括编码铁超氧化物歧化酶(FeSOD)及依赖谷胱甘肽的过氧化氢过氧化物酶(GPX).抗坏血酸依赖的水循环基因对冷/光和冷/暗处理无反应。冷/光特异性诱导的基因编码保护分子,如苯丙素和光合作用相关的类胡萝卜素,也参与激素脱落酸(ABA)的生物合成,对冷适应至关重要。如脱氢蛋白所示,增强/抑制的转录水平并不总是反映在各自的蛋白质水平上。
结论
冷/光处理调控的基因数量是冷/暗处理的两倍,只有光和低温结合才增强了几个基因的表达,这些基因在早期被描述为冷响应基因。冷/光诱导基因包括冷响应转录因子和含有锌指、MYB、NAC和AP2结构域的新基因。它们很可能在增强基因表达方面协同作用。在转录因子及其靶基因的启动子区都发现了相似的响应元件,这意味着根据细胞内的代谢/氧化还原状态,可能对环境信号进行了平行调控或放大。
Backround
光通过光感受器对基因表达有显著影响[1特别是在植物的早期光形态发育过程中。光也是光合作用的动力,光合作用反过来调节细胞中的许多代谢过程。这种调节可以通过产生ATP和还原NADPH直接发生,也可以间接发生,如通过氧化还原活性化合物,如硫氧还蛋白和谷胱甘肽(GSH),然后可能对基因表达产生影响[2].核基因的转录也被认为是由光合作用产物调节的[3.,4].
现在有大量的全球基因表达数据可从拟南芥暴露于各种光照处理、低温、盐或脱水处理的植物[5- - - - - -10].基因转录受多种转录因子调控,受到非生物环境因子和各种细胞化合物的强烈影响[7,11- - - - - -15].尽管在最近的一些实验中,光在植物对生物胁迫的反应中起着特定的作用[11,16],光在全球基因表达分析中的作用,特别是当与各种其他非生物胁迫条件相结合时,仍然难以捉摸。事实上,除了通过光感受器发挥作用外,光还通过光合装置对基因表达产生影响,光合装置的功能可受各种环境胁迫条件的强烈调节[17].自然环境中的光和温度变化往往是同时发生的,但光的作用和光合作用机制的功能的解剖,从单一的低温效应开始,仅用有限的一组基因进行研究[18,19].
拟南芥是一种耐寒植物,它的耐寒性随着植物暴露在低温下而增强[20.].此外,在冷驯化过程中,光线需要增强抗冻能力拟南芥叶子(21].在这里,我们对拟南芥在光下或黑暗中或单独光或暗处理后的叶片。光对增加所谓的冷反应基因转录物的数量有深远的影响。更重要的是,寒冷和阳光的条件诱导了一组特定的基因,这显然对抗冻性的发展很重要。基因表达模式的复杂性被发现超过40个差异调控转录因子所强调。这些转录因子及其靶基因在发育过程中的调控作用拟南芥讨论了冷驯化。
结果
感冒治疗的生理后果拟南芥光合作用的装置
八周的老拟南芥植物从正常生长温度(23℃,相对湿度60%)直接转移到正常生长光(100 μmol光子m)下的低温(3℃,相对湿度60%)-2年代-1)或在黑暗中度过8小时。光系统II (PSII)的光化学效率(Fv/Fm)和出氧活性在冷光处理(下称,cold / light或C/L)后下降约10%,但在冷光处理(下称,cold / light或C/D)后没有下降(表1).在我们的北欧联盟项目(NKJ)中,平行实验表明,冷/光处理后,PSI活性损失严重约2.5倍[22],这意味着在我们的冷/光疗法中对PSI有近30%的抑制作用。
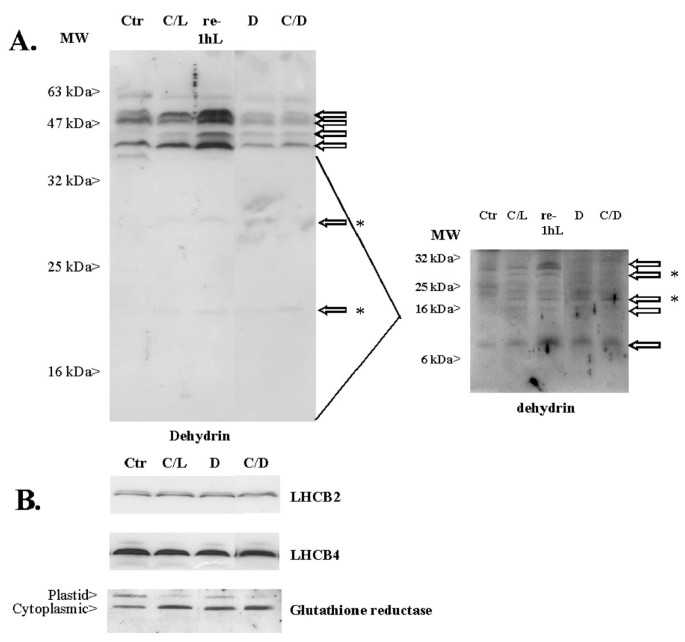
用磷酸苏氨酸-免疫印迹法检测叶绿体中类囊体蛋白的氧化还原状态拟南芥叶子(图1).冷光条件下磷酸化PSII核心蛋白(P-CP43, P-D2, P-D1)的数量增加,表明PSII和PSI之间的质体醌池(PQ池)的还原状态增加[23].另一方面,LHCII蛋白在冷/光条件下部分脱磷,在冷/暗和暗处理后完全脱磷。此外,77 K荧光测量显示,LHCII蛋白附着在PSI (F732)或PSII (F685)上的比例表明,在冷/光条件下,LHCII蛋白附着在PSII (F685)上的比例增加,而在冷/暗条件下,LHCII蛋白附着在PSII (F685)上的比例增加(图)1,在底部)。这反映了叶绿体基质的氧化还原状态以及电子传递链的组成部分的变化。冷光条件下基质中还原态硫醇的积累会导致LHCII激酶的抑制,而在黑暗条件下,LHCII激酶由于电子转移链(以及基质)的氧化而失活[23].
冷/光、冷/暗和八小时暗处理下基因表达变化的综述
cDNA芯片实验是基于拟南芥GEM1克隆组购自美国加利福尼亚州帕洛阿尔托市InCyte Genomics,包含约8000个ESTs,对应约6500个独特基因[4].值得注意的是,这个cDNA微阵列只包含了全部注释基因的三分之一拟南芥基因组。设计了微阵列实验,以便所有处理与对照植物从控制环境室(100 μmol光子m-2年代-1, 23°C),与处理过的植物收获的时间相同;因此,在昼夜节律对基因表达的影响方面,光照和低温处理具有可比性。
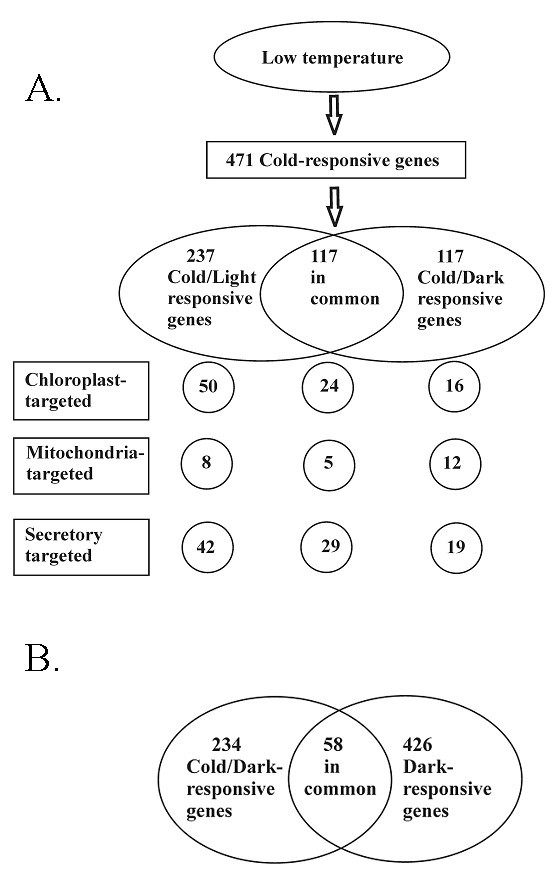
为了确定基因的上调或下调,我们使用两倍表达变化作为截止值(处理植物与对照植物的比较),并使用学生t检验来确定每个基因在不同处理中的统计显著性(p值小于0,05,包括错误发现率(FDR))。结果得到471个冷响应基因(图2和附加文件1),其中只有117个是冷/光和冷/暗处理中常见的。这些基因中有许多是对寒冷敏感的基因。此外,237个基因只对冷/光处理有反应,117个基因只对冷/暗处理有反应。作为冷/暗处理的对照,需要研究正常生长温度下8小时的黑暗(以下称为Dark或D)对基因表达的调节作用。如图所示2 b在美国,234个基因被认为是冷/暗响应基因,但更多的基因(426个)被证明仅是暗响应基因。其中,只有58个基因在两种黑暗处理中受到相似的调控。
冷反应基因也被分析为可能的细胞器靶向信号(图2而且3.).根据TargetP预测,冷/光诱导61个和抑制13个叶绿体靶向信号基因[24].其中,41个和9个基因分别只在冷/光处理中有特异性反应(图3.).事实上,只有少数具有叶绿体靶向信号的冷/暗特异性基因。另一方面,在23°C的8小时暗处理,改变了大量编码叶绿体靶向蛋白的基因的表达;40例上调,54例下调。
已建立的冷响应基因在冷/光和冷/暗条件下的表达
当植物从正常生长温度转移到低温时,许多特征良好的冷响应基因上调,这意味着植物开始了冷驯化/脱水过程。几个典型的冷反应基因的表达在冷/光条件下比在冷/暗条件下更高2和其他文件2而且4).这些基因包括编码低温诱导蛋白(LTIs)的基因,如干2/LTI30 (At3g50970), LTI78/RD29A (At5g52310), ERD10(脱水早期反应,At1g20450), ERD3 (At4g19120), KIN1 (At5g15960),两个半乳糖醇合成酶(At1g56600和At1g09350)和脱氢蛋白RAB18 (At5g66400)。还发现了其他几个低温响应基因,但无论在光照下还是在黑暗中低温处理,它们的表达没有差异。
编码类囊体功能相关蛋白的基因差异表达
编码多种LHCII (LHCB)蛋白的基因在冷/光条件下表达明显增强,而在冷/暗条件下表达不增强(表2)2).相反,PSII或PSI复合体的核心蛋白编码的核基因表达只有少数差异。没有一个公安局PSII蛋白编码基因在冷/光或冷/暗处理后上调或下调了两倍以上。而在冷/光条件下略有上调(小于的截止值)PsbW(At2g30570)和PsbP(At1g77090)和这些信息在8小时暗处理后也显著下调(数据未显示)。此外,两个编码与PSI密切相关的蛋白质的基因,PSI-N(At5g64040)和硫氧还蛋白(At1g08570)上调,但仅在冷/光处理下上调2).许多这些微阵列的结果是通过使用北方印迹分析验证的(图4).
在对照(Ctr)、冷/光(C/L)、冷/暗(C/D)和暗(D)四种不同处理后,用北方印迹分析验证部分微阵列结果.用编码4个光系统II光捕获蛋白(LHCB)和早期光诱导蛋白(ELIP1)的基因进行杂交;两个光系统I相关(PSI)蛋白,PSI- n和质体青蛋白(PC);两个碳水化合物代谢蛋白,一个塑料果糖二磷酸醛缩酶(Pl-FBA)和一个丙酮酸脱羧酶(PDC1);参与玉米黄质和ABA生物合成的ZEP蛋白;4个参与氧自由基清除的叶绿体靶向蛋白和3个细胞质或过氧化物酶体过氧化氢酶(CAT);一个冷反应蛋白(LTI78/RD29A)和编码myb样蛋白(CCA1)和三个AP2转录因子的基因。16S rRNA探针与总RNA的杂交如图底部所示。
我们还研究了这里应用的实验条件是否对叶绿体基因组编码基因的表达有任何影响(图5).为此,一北墨分析PsbA,PsaC而且PetB基因,编码PSII、PSI和Cytb的核心成分6分别进行F复合体。然而,这些叶绿体基因的表达在不同处理之间没有差异。
记录了几种核编码蛋白酶的不同基因表达变化,其功能与类囊体蛋白复合物密切相关。三个FTSH基因(At5g42270, At1g50250和At1g06430)在冷/光条件下表达上调2).这些基因编码参与PSII反应中心d1蛋白降解的蛋白酶[25,也可能是lhcb蛋白[26].另外,一个Zn金属蛋白酶(At1g49630)基因在冷/光条件下被高度诱导。该基因编码一种蛋白酶,类似于At3g19170的基因产物,需要在叶绿体和线粒体靶向蛋白中切割信号肽[27].两个编码atp依赖性CLP蛋白酶的基因也存在差异表达,其中一个基因表达上调(At1g09130,ClpR3),另一种表达下调(At5g51070,CLPD / ERD1)冷/光处理后。
ROS清除酶相关基因在冷/光、冷/暗和暗条件下的差异表达
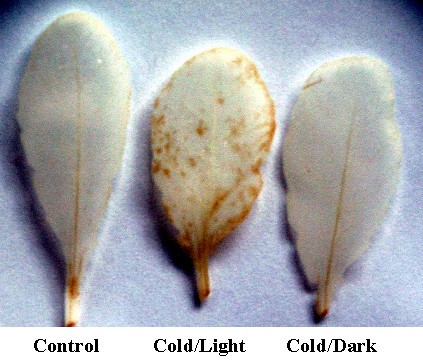
通过对冷处理叶片进行das染色,监测氧化应激相关化合物的积累(图6).冷/光处理植株的叶片显示出一些氧化DAB的红褐色沉淀,表明氧化胁迫,而冷/暗处理植株的叶片没有检测到这种沉淀。此外,还观察到一些编码叶绿体靶向酶的基因的诱导作用,特别是在冷/光条件下2,图4).其中包括铁超氧化物歧化酶(FeSOD, At4g25100)和两个依赖谷胱甘肽的磷脂过氧化氢过氧化物酶(At4g11600和At2g25080)。FeSOD蛋白似乎没有叶绿体靶向信号,但实验表明它位于叶绿体中[28].此外,一个编码叶绿体靶向谷胱甘肽还原酶(GR)在冷/光条件下上调了两倍以上。
值得注意的是,编码抗坏血酸-谷胱甘肽循环酶、单脱氢抗坏血酸还原酶(MDHAR)和脱氢抗坏血酸还原酶(达哈),位于细胞质或叶绿体中的,要么下调,要么保持不变2,图4).同样,胞质过氧化氢酶或过氧化物酶体过氧化氢酶的表达也没有变化(CAT1, At1g20630)或向下调节(CAT3, At1g20620)与过氧化氢酶2 (CAT2, At4g35090)作为例外,在冷/光、冷/暗和暗三种处理条件下,其明显上调。
参与光合作用相关类异戊二烯生物合成的几个基因[29- - - - - -31]也存在差异表达(表2).香叶酰香叶酰二磷酸(GGPP)是产生类胡萝卜素、叶绿素叶绿醇尾、质体醌、叶醌和生育酚(具有抗氧化活性的脂溶性化合物)的关键化合物[30.].香叶酰香叶酰还原酶(CHLP, At1g74470),一个编码蛋白质的基因,催化GGPP加氢为phytyl二磷酸(PhyPP)和一个编码基因生育酚环化酶(SXD1, At4g32770)参与维生素E(生育酚)的生物合成[32],在冷/光处理下转录水平显著诱导。此外,玉米黄嘌呤环氧化酶基因(LOS6 / ABA1, At5g67030, [33]),参与导致脱落酸(ABA)生物合成的类胡萝卜素途径,仅在冷/光条件下上调(几乎4倍)。有趣的是,具有相反功能的基因紫黄嘌呤深氧酶(NPQ1, At1g08550)对吸收激发能的散热很重要,在冷/光条件下,吸收激发能没有上调。
3个叶绿素生物合成基因:谷氨酰胺- trna还原酶1 (HEMA1, At1g58290), mg -螯合酶(CHLH, At5g13630)和二羧酸二铁蛋白(CRD1, At3g56940)(表格2).其中,只有HEMA1基因在冷/暗条件下也有诱导作用,但诱导量是冷/光条件下的3倍。
苯丙素途径是另一种复杂的途径,它产生类黄酮和花青素等酚类化合物,具有缓解氧化应激的能力[34,35].其中两个差异表达基因编码叶绿体靶向蛋白,nadph -铁蛋白还原酶(ATR2, At4g30210)和UDP葡萄糖类黄酮3-o-糖基转移酶(At5g17050),其中后者在Cold/Light条件下上调了10倍以上(表4)2).编码类黄酮生物合成蛋白的其他基因位于细胞质中。除两个黄酮醇合成酶基因(At2g38240和At5g05600)外,这些基因在冷/光处理后的诱导程度普遍高于冷/暗处理。此外,有两个基因仅在冷/光条件下显著上调,即肉桂酰辅酶a还原酶(At1g15950)和咖啡酰辅酶a 3-O甲基转移酶(At4g34050),它们与类黄酮生物合成无关,但编码重建细胞壁成分的蛋白质,如木质素、木素、羟基肉桂酸、亚蛋白、孢粉素和皮蛋白[36].
编码碳代谢蛋白的基因在冷/光或冷/暗处理中没有下调
尽管人们普遍认为低温会降低低温敏感植物的碳固定(还原碳循环)并使卡尔文循环酶失活,但在耐寒植物中可能并非如此[37,38].结果表明,在冷/光处理和冷/暗处理中均未发现卡尔文循环基因的下调。然而,经过8小时的暗处理后,这些转录本明显下降(见附加文件)4).
编码两种糖转运蛋白的基因,ERD6, (At1g08920)和一个三磷酸/磷酸盐转运子(At3g01550)在冷/光条件下比冷/暗条件下上调,反之亦然,另外两个糖转运子,一个蔗糖/质子转运子(SUC1At1g71880)和At4g36670仅在冷/暗条件下上调(表2)2).所有这些糖转运蛋白都是具有7 ~ 12个跨膜螺旋的膜蛋白,但不具有叶绿体靶向信号。胞质型果糖-二磷酸醛缩酶基因(At4g26530)仅在冷/光处理后上调,而相应的可塑性果糖-二磷酸醛缩酶基因(At4g38970)在冷/光处理和冷/暗处理均上调。此外,参与生物合成(淀粉合成酶,At1g32900)和淀粉降解(α-淀粉酶,At1g69830;β-淀粉酶At4g17090和淀粉磷酸化酶At3g46970),其中淀粉合成酶和β-淀粉酶在冷/光处理下的上调幅度均大于冷/暗处理,而α-淀粉酶和淀粉磷酸化酶在冷/暗和暗处理下的上调幅度均大于冷/暗处理。
有趣的是,我们发现三个与无氧碳代谢相关的基因,在冷光条件下明显上调,即嘌呤酸脱羧酶(PDC1, At4g33070),醇脱氢酶(抗利尿激素, At1g77120)和l -乳酸脱氢酶(LDH, At4g17260)基因(表2).
转录因子的差异表达
结果如表所示3.描述与对照条件相比差异表达的48个转录因子。13个转录因子仅在冷/光条件下显著上调,17个在冷/光和冷/暗条件下均上调,少数(6)个在冷/暗条件下表现最好,12个仅在黑暗条件下上调。差异表达的转录因子中最大的一组(14)属于各种类型的锌指家族转录因子。
其中一些转录因子已被证明与氧化应激有关,如ZAT12 At5g59820 [39]或在盐胁迫下,如STO (At1g06040)和STZ/ZAT10 (At1g27730 [40])。第二大组由ap2结构域转录因子(8)组成,其中包括两种DRE结合蛋白DREB1B (CBF1, At4g25490)和DREB2A (At5g05410),它们分别在调节冷响应基因和脱水响应基因中具有很好的特征[7,41].在这两个基因中,DREB2A (At5g05410)在冷/光处理中的诱导作用明显大于冷/暗处理3.,图4),尽管低温是这些转录本的主要调节因子[42].此外,在光照和黑暗条件下,均可诱导低温响应ap2转录因子RAV1 (At1g13260)的表达[43].与对照条件相比,其他类型的转录因子基因也被发现有差异表达,如6个成员MYB转录因子家族,3个同源盒子相关的转录因子,3个bZip类转录因子AtbZip35(ABRE / ABF1, At1g49720)和两个编码叶绿体靶向转录因子bZip家族的基因(ATB2 / AtbZIP11、At4g34590和Hy5, At5g11260), 2个成员WRKY转录因子家族的3个成员bHLH转录因子家族,两个南汽转录因子-结构域家族成员和转录因子DNA结合家族的其他11个基因。一些转录因子基因的表达,三个成员的AP2和一个成员的MYB转录因子家族(CCA1, At2g46830)使用northern blot分析进行验证(图4).尽管一般情况下转录因子的表达量较低,但我们发现北方印迹和微阵列结果之间有很好的相关性(表3.).
由于我们正在研究光在冷驯化过程中的影响,所以我们有兴趣找出昼夜节律和/或光敏色素/隐色素相关的光敏感过程的相关基因是否也受到了同样的影响。然而,我们没有发现冷/光处理和冷/暗处理在编码光敏色素/隐色素相关转录因子、光调节因子或光受体基因的转录表达上有任何差异(数据未显示)。相反,我们发现在Dark处理后,这些光受体响应基因的表达有明显的差异。
评价转录物与蛋白质水平之间的相关性
一些在转录水平上表达变化较大的基因也通过western blotting在蛋白质水平上进行分析(图7).这一分析仅限于低温诱导脱氢酶,如sdry 2和ERD10,以及一些光合作用相关基因,特别是在冷/光条件下,这些基因被强烈上调。数字7一个描述受控、冷/光、冷/暗和暗条件下的脱氢蛋白及其相对数量。在转录水平上有较强的上调,冷/光和冷/暗条件下均未在蛋白水平上发生上调。相反,在冷/暗条件下,蛋白质含量下降。然而,有趣的是,当植物在正常生长温度(re-1hL)下恢复一小时时,蛋白质的数量确实增加了。同样,尽管加强了监管奇迹与谷胱甘肽还原酶转录物相比,叶绿体靶向LHCB蛋白和谷胱甘肽还原酶蛋白水平在冷/光和冷/暗处理过程中基本保持不变(图1)。7 b).另一个谷胱甘肽还原酶基因(At2g24170)在我们的cDNA序列中不存在,它编码一个细胞质蛋白,该蛋白在冷/光和冷/暗条件下都显示出增加的数量。基于这些少量的蛋白质分析,很明显转录上调并不一定反映在蛋白质含量的增加上;事实上,在黑暗中脱氢蛋白可能发生相反的情况。我们目前正在进行一项蛋白质组学研究,以明确高反应基因的转录水平如何与各自的蛋白质水平相关。
转录因子根据其表达水平与相应的响应元件结合
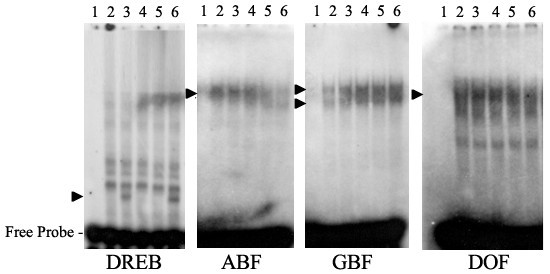
电泳迁移率转移试验(电泳迁移率转移试验,EMSA)用于研究低温/光响应基因启动子区DNA结合蛋白(即假定的转录因子)与相应响应元件之间的相互作用。为此,从不同光照和低温处理的莲座中分离出mRNA进行翻译在体外并测试了蛋白质与四种DNA响应元件的结合(图8).以来,在体外翻译混合物包含多种不同的DNA结合蛋白;有可能几个转录因子结合在同一个反应元件上。如图所示8,在体外来自冷/光或冷/暗样品的翻译蛋白混合物含有对DRE响应元件的特异性结合活性,因此极有可能含有低温诱导的DRE结合(DREB)蛋白。有趣的是,在冷/光处理后的生长温度下,仅一个小时的恢复就足以消除这种dna -蛋白质相互作用(图8),与编码DREB蛋白的mRNA减少有关(数据未显示)。转译蛋白混合物中也含有与ABA和DOF响应元件结合的蛋白,但在植物的冷/光处理或冷/光处理及随后的1h恢复处理中均未观察到与这些元件结合的活性增加。然而,当植物在黑暗或冷/暗条件下处理8小时时,转录因子与这些元素的结合较少。相比之下,绑定的增加在体外与对照相比,在所有处理下都出现了翻译到gbf元素的蛋白质。
讨论
光照对植物低温暴露过程中转录因子的表达有显著影响
这里提出的工作第一次解决光在冷驯化过程中的作用拟南芥在转录水平上使用微阵列技术。在这方面,转录因子的诱导及其在冷反应基因转录激活中的作用是非常重要的3.而且4).大约1700个转录因子已被鉴定拟南芥其中只有一小部分具有遗传特征的基因组[44].
先前的研究表明,冷驯化涉及到编码CBF转录激活因子的基因的快速上调[7]和其他ERF/AP2结构域蛋白,也称为DRE结合(DREB)蛋白[45].值得关注的是,两个编码AP2域转录因子的基因(DREBA2 (At5g05410)和一个先前未被描述的AP2-区域转录因子(At2g23340)在冷/光环境中的表达明显高于在冷/暗环境中的表达3.),与已建立的冷反应基因类似的增强上调调控是一致的2,图4).我们的转录谱分析和启动子分析(表4,附加文件5和图8)表明低温和光照共同作用于几个对寒冷敏感的基因的上调调控。
我们还鉴定了一些仅在冷/光条件下诱导的转录因子基因,尽管在植物转向低温时光强度没有改变。因此,我们预计,来自叶绿体的信号,经低温修饰[19],对这些基因的调控很重要。它们包括编码两个NAC结构域蛋白的基因(ANAC102, At5g63790和ATAF2, At5g08790), 3个AP2/ erf结构域蛋白(At2g23340, At5g05410和At4g23750), 5个锌指蛋白(At2g47890, At5g04340, At1g06040, At1g51700和At5g54470),一个同源盒子(At4g08150),一个TCP家族(At4g18390),一个bZIP家族(At4g34590)和一个myb家族(At5g44190)的转录因子。这些基因中只有三个(At5g63790, At4g28140和At4g23750)似乎不受各种光处理的调节,正如genev调查者计划所揭示的那样,[10].可以想象,这些转录因子基因响应光合机制功能的变化和叶绿体氧化还原条件的相关变化和/或CO衍生的不同代谢物的产生2固定(4].这些转录因子又可能诱导冷/光特异性核编码转录本(见表2而且3.),其中许多具有叶绿体靶向信号的特征,并参与不同的保护功能,包括类胡萝卜素的生物合成、活性氧清除酶和苯丙烷途径的成分以及ABA的产生。
环境条件通过相同的响应元件调节转录因子基因及其靶基因的表达
当检查转录因子基因及其靶基因的近端启动子区域的响应元件时,发现了一个重要的事实4,附加文件5).这两个基因组的启动子区有相似的反应元件。因此,环境条件似乎通过信号/代谢级联调控转录因子基因及其靶基因的表达。在某种程度上,这是意料之中的,因为微阵列数据将产生在类似胁迫条件下具有相似表达模式的基因信息。在表4我们选择并分析了一些在冷/光或冷/光和冷/暗条件下调控最高的基因的启动子元素。很明显,在高表达的冷/脱水反应基因中,DRE结合元素的数量不断增加(XERO2,RD29A而且ERD10)与它们独立于光的转录效率有关(表2,图8).这些元素也有望在光依赖性调节光合作用相关基因以及其他光调节基因中发挥重要作用。
可以想象的是,光和/或aba响应元件还参与了许多冷响应转录因子基因的转录调控,因为它们不包含任何DRE结合元件(见表3.).事实上,值得注意的是,转录因子基因的转录调控缺乏正反馈循环,因为它们似乎在启动子区域没有自己的响应元件(除了ADOF1).不同基因的启动子区见表4还包含一些其他响应元素,能够根据细胞的昼夜节律、热、钙、盐或碳状态进行转录调控。因此,似乎环境线索通过细胞和代谢过程驱动的信号事件对转录网络有直接影响。对这些信号作出反应的转录因子基因,连同它们的靶基因一起,就有能力特异性地放大这些靶基因的表达。
推测的光信号通路参与低温调节基因表达
一个明显的问题是,光是如何影响低温信号级联,涉及转录因子及其靶基因的诱导。早期的研究已经指出,光敏色素B介导的C-repeat/脱水响应元件在低温下诱导基因的必要性[46].这一机制可能与DREB/CBF和相关转录因子有关[43,与冷/暗条件相比,冷/光条件下其表达明显增强。
myb相关转录因子CCA1 (At2g46830)是另一种特征明确的光敏色素B相关因子,此前曾被描述参与编码叶绿体靶向蛋白的基因的光调节,如光收获(LHCII)、ELIP1和叶绿素生物合成(如HEMA1)蛋白[47].然而,我们的结果表明,冷/光和冷/暗条件都诱导CCA1基因,而积累了几个奇迹而且ELIP1转录只在冷/光处理时发生3.而且4).因此,CCA1蛋白可能只在冷/光环境下通过CKII激酶诱导的磷酸化被转录后修饰,这已被证明可以刺激CCA1与靶DNA调控区域的结合活性[48,49].
结果表明,ABA生物合成基因是在冷光处理下特异诱导的。一个明显的迹象是ABA生物合成中第一个基因的诱导,玉米黄质环氧化酶(齐柏林飞艇)基因[31,33].在之前使用aba处理的植物(100 μM)进行的微阵列实验中,诱导了22个编码转录因子的基因[6],其中许多在我们的冷/光实验中表现相似。我们的研究和上面的研究表明,ABA可能通过诱导bZip (ABRE, ABF, G-box), MYC (bHLH),同源域亮氨酸拉链(HD-Zip)和MYB转录因子发挥化学信号的作用(表4,图8和附加文件5).此外,ABA水平的增加已被证明能增加例如表达奇迹基因的微阵列实验,类似于我们的冷/光处理[5,6].aba标记基因(列在Nemhouser等人的补充材料中。[50]),并与我们在冷/光和冷/暗条件下的双上调和下调基因列表进行了分析。在我们的阵列中存在的119个ABA标记基因中,有12个基因的上调是特定于冷/光条件的,9个基因的上调是两种条件下共同的,只有两个是特定于冷/暗条件的(另见附加文件)6).ABA生物合成的最初步骤发生在叶绿体中;只有后三步是胞质性的[31,33].因此,ABA可能在通过ABA响应转录因子诱导转录方面具有光依赖作用,但在黑暗中也会降低ABA响应转录因子编码基因的转录(图1)8).有趣的是,表中的启动子分析4结果表明,几乎所有仅经Cold/Light诱导的基因都含有ABRE、AHBP (HD-Zip)和G-box DNA结合基序。这一结果进一步得到了以下事实的支持:在那些仅在冷/光或冷/光和冷/暗条件下明显上调的基因中发现了这些启动子基序的显著过度表达,而在那些仅在冷/暗条件下上调的基因中没有发现这些启动子基序5).ABA/Light诱导这些转录因子基因上调的确切机制还有待进一步研究。
我们还考虑了类囊体电子载体的还原状态和H2O2在叶绿体中作为冷/光诱导胁迫信号通路[51].物理表征拟南芥植物(图6,[22]]和我们的微阵列数据表明,在冷/光条件下,叶绿体中一些ROS物种的产生被诱导,一些编码ROS清除蛋白的基因被打开(表2).我们发现,只有在冷/光处理下,三个编码叶绿体ROS清除蛋白的基因(一种铁超氧化物歧化酶(FeSOD)及两种依赖谷胱甘肽的过氧化物酶(GPX) [52)(表2).然而,在冷/光处理中似乎有ROS信号的特异性。事实上,没有谷胱甘肽-抗坏血酸循环基因的诱导2),如抗坏血酸过氧化物酶、单脱氢抗坏血酸过氧化物酶或脱氢抗坏血酸过氧化物酶,已知在过度光胁迫下会被诱导[11,53- - - - - -56在冷/光处理时记录。因此,很明显,我们的冷/光处理并没有诱导像Huner和同事在早期实验中报道的那样高的PSII激发压力[19],其中采用高光强处理或低温处理与中等光强相结合。尽管我们的冷/光处理诱导了可检测到的活性氧物种的水平,可能来自叶绿体,但暴露在冷/光下的植物有可能能够清除大部分这些氧自由基。我们之前的微阵列实验拟南芥[4]排除了PSII激发压力在450 μmol光子m光强范围内调控基因表达的作用-2年代-1.这种中度强光条件诱导的基因表达模式与冷/光条件非常相似,特别是光合作用和氧化应激相关基因(见Piippo等人,2006年的补充材料[4]、Table2).除了冷/光和中强光诱导基因之间有许多相似之处外,主要的差异是在表达奇迹基因。在中等强光条件下,除ELIP1基因外,其余基因均表达下调,而在冷光条件下,其余基因表达下调奇迹基因明显上调。
冷/光条件诱导PQ池和PSI还原侧基质电子受体的还原,这可以从磷苏氨酸印迹图中推断出来(图1, (23])。经常有人认为,几个核基因对PQ池的氧化还原状态作出反应,以调节光系统的化学计量学和光收集能力以及抗氧化清除系统[57- - - - - -60].然而,我们的结果与这一假设的差异,证明了强有力的上调调控奇迹在冷/光条件下诱导PQ库减少的基因。
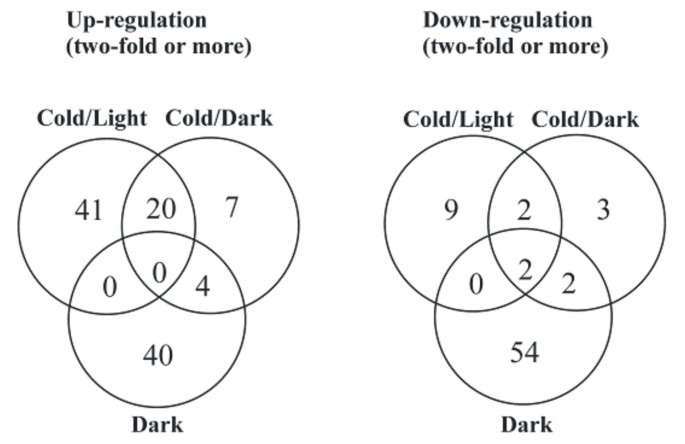
糖代谢/信号是调控核基因的另一个潜在来源[4,15,61- - - - - -63并且很可能在冷/光、冷/暗和暗处理之间引起基因表达的剧烈变化。从光合作用到呼吸糖代谢的转变可能是基因表达变化的原因。例如,在正常生长温度下,暗处理诱导的基因数量是冷/暗处理的两倍2 b,其他文件7而且8).淀粉的合成在冷/光条件下是明显的2),而可溶性糖则在冷/暗条件下增加,尤其是在暗条件下。信号糖分子对核基因表达的影响可能是通过转录因子基因及其靶基因中都存在的DOFF或WRKY (SPF1)元件发挥作用的3.).
结论
获得抗寒性和抗冻性拟南芥植物通过低温处理而增强,特别是在光照下而不是在黑暗中进行时。本研究表明,低温诱导的若干转录因子和参与代谢途径的基因的转录表达确实需要光,这些转录因子和基因对抗寒性的发展至关重要。叶绿体产生氧化还原活性分子和光合作用最终产物产生的几种光信号通路可能与各种纯低温诱导通路发生交叉作用,而这些光信号通路又可能依赖钙的变化2 +穿过细胞膜的流出[64],从而达到最大程度的冷适应[65].光被证明可以增强已知的冷反应基因的表达2),这与几个冷诱导基因的启动子区存在多个ABRE和DOF响应元件相一致(table3.而且4).除了增强冷响应转录因子及其靶基因的表达外,Cold/Light还具有独特的作用。最明显的是,为了优化它们在低温下的功能,冷和光的结合尤其需要上调几个编码酶的基因,这些酶与激素(ABA)和各种其他化合物的生物合成有关,这些化合物对清除活性氧、保护膜和重组类囊体膜中参与电子转移反应的成分至关重要。
方法
植物材料和生长条件
拟南芥生态型col0种子在50%蛭石/50%土壤中萌发,在23℃、100 μmol光子m的可控环境中生长-2年代-1(8小时光周期)持续8周。为了防止抽苔(花芽形成),使植株保持营养生长,采用了较短的白天光周期。相对湿度在生长和低温处理期间均控制在60%左右。在3°C(使用数字热电偶从叶子底部测量)下冷处理8小时。允许完全产地来源证2处理前同化,光照期开始2小时后植株直接从生长温度转移到低温处理。冷处理在光(100 μmol光子m)下进行-2年代-1)或在黑暗中。光照期开始2小时后再进行23℃暗处理8小时。冷/光、冷/暗和暗样品在23°C的光(100 μmol光子m-2年代-1)同样的8小时。结果的内部变异由从生长条件中收集的叶材料的Blanc杂交控制(在表中指定为对照)2而且3.).处理后,从4-6株植物中收集2 - 3g叶片材料,直接冷冻在液氮中。
PSII活动测量
荧光测量拟南芥用PAM2000荧光计(Walz,德国)对经过不同光照和温度处理的叶片进行了测定。分离的叶片在黑暗中放置30分钟,然后检测可变(Fv)和最大(Fm)荧光。用Hansatech DW1 O测量稳态析氧速率2电极和饱和光强度存在1毫米2,5-二甲基p-苯醌(DMBQ)作为人工电子受体,Chl浓度为10 μg Chl mL-1.类囊体膜根据[66].叶绿素含量按[67].
Western blot分析
植物经过特殊处理后,叶子被分离并立即在液氮中冷冻。根据生产说明,使用TriZol试剂(Invitrogen公司,美国)同时分离总蛋白和RNA。蛋白质样品(总蛋白25 μg /孔)在6m尿素Laemmli缓冲液中溶解,并在6m尿素SDS-PAGE中运行。使用脱氢蛋白抗体(应激原生物试剂,加拿大)、特异性LHCB2和LHCB4抗体(Agrisera,瑞典)和谷胱甘肽还原酶抗体(Helen Reynolds/Philip Mullineaux,英国John Innes Norwich研究所赠送)检测蛋白质。
所有用于类囊体膜分离的缓冲液均含有10 mM NaF。每道1 μg Chl对应的类囊体样品在SDS-PAGE中检测,用磷苏氨酸抗体(New England Biolabs)免疫检测类囊体磷蛋白,使用化学发光检测(ECL, Amersham biosciences, UK)。
77k荧光
用配有反射探头的二极管阵列分光光度计(S2000,海洋光学公司,达尼丁,美国佛罗里达州)测量了类囊体膜的77k荧光发射光谱。荧光在低于500 nm的光下激发(用LS500S和LS700S滤波器定义,Corion Corp., Holliston, MA),发射记录在600到800 nm之间。
用3,3'-二氨基联苯胺(DAB)摄取法检测氧化应激
DAB法检测氧化应激[68].来自对照、冷/光和冷/暗的叶片样本被真空放置在含有1% DAB (w/v)的10 mM Mes (pH 5.8)的溶液中1小时。叶片在乙醇(96%)中沸腾5分钟。氧化应激产物可见为红褐色。
RNA分离和cDNA标记
根据制造商的建议,首先使用TriZol-reagent (Invitrogen, USA)分离总RNA,并使用Dynabeads mRNA纯化试剂盒(Dynal, Biotech, Norway)进一步分离mRNA。250 μg总RNA产生2.5 ~ 5 μg mRNA。对于Cy3(对照)和Cy5(处理)cDNA标记(在染料交换中亦然),1 μg poly(A) mRNA用(dT)标记12 - 18引物(Amersham Biosciences, UK)使用Superscript II逆转录酶直接结合Cy3或Cy5 dUTP (Invitrogen, USA)。用Microcon对RNA进行降解,并进一步纯化标记的cDNA产物®YM30柱(Millipore,美国)。使用Nanodrop ND-1000分光光度计(Nanodrop Technology’s, USA)测量标记cdna的数量,并在TAE (Tris/Acetate/EDTA)缓冲液中制备的1%琼脂糖凝胶中检查质量。
微阵列杂交和扫描
冷/光、冷/暗和暗样品与正常生长条件下保持相同8小时的样品进行杂交。另外,对不同个体的叶片进行对照杂交拟南芥植物在10小时后开始光照期。拟南芥cDNA微阵列载片基于GEM1克隆集(8000 ESTs),从美国加利福尼亚州帕洛阿尔托市InCyte Genomics购买[4].8 k cDNA阵列在载玻片上被发现为3个重复,每次杂交允许进行3次技术复制。玻片采用uv交联(90 mJ/cm)-2),用1%牛血清白蛋白(V份)在5 × SSC中预杂交,0.1% SDS在50℃下杂交30分钟,用2 × SSC和0.2 × SSC洗涤3分钟。离心(500 × g 10秒)后,同一天使用载玻片进行杂交。将标记的cdna (10 ~ 20 pmol的标记Cy3和Cy5 cdna)组合在80 μl (3 × SSC, 0.65× Denhardt's和0.3% SDS)的总体积中。杂交在65°C的封闭室(美国康宁公司)中进行。在室温下0.5 × SSC/0.1% SDS洗涤15 min, 2次0.5 × SSC/0.01% SDS洗涤5 min, 2次0.06 × SSC洗涤1 min,微阵列离心干燥10秒。使用ScanArray Express 5000设备(GSI Lumonics, USA)扫描切片,并使用同一设备提供的软件(Scan Array Express Microarray Analysis System 2.0, perkins - elmer, USA)量化光斑强度。排除了阵列上视觉不良的点或区域和低强度点。
微阵列数据分析
光斑强度数据传输到genesspring GX 7.3软件(Agilent Technologies, USA)。从每张载片的三次技术重复中,取中位数强度值,用于进一步计算每张载片(low less, Per Spot和Per Chip)的强度依赖性归一化。生物实验包括三到四个独立的生物重复(每个生物重复从一个新的集合开始)拟南芥种植一套新植物的种子)。对照组和冷/光处理设4个生物重复,冷/暗和暗处理设3个生物重复。生物重复之间的相关系数从0.6到0.8不等,这被认为与这种分析相关。对Lowess归一化数据,genspring程序计算基因上调或下调调控的比例。接下来,对上调或下调基因的归一化值进行统计可信度测试。基因的诱导或抑制应与genspring中学生t检验确定的1.0比率有统计学显著差异(称为质量控制)。经过多次检测的Benjamini和Hochberg错误发现率(FDR)校正后,错误发现率≤0.05被认为具有统计学意义。此外,还计算了表中每个归一化比率值的平均值的标准误差(即n = 3或4)。所有原始数据包含标准化的平均数比率,平均数的标准误差和t检验p值(质量控制),可以在附加文件中找到2来4而且7来10.为了了解冷/光处理和冷/暗处理之间的基因表达差异是否有统计学意义,进行了学生t检验。风险水平设定为0.05 (p < 0.05,表中为*)2而且3.).拟南芥基因编码的蛋白质可能靶向不同的细胞隔层,如叶绿体,线粒体或分泌通路,在genspring使用基于TargetP的MIPS数据库搜索[69].我们的微阵列分别包含1260、649和1133个可能靶向叶绿体、线粒体和分泌途径的基因。所有原始数据已按照MIAME微阵列数据发布原则提交并接收到ArrayExpress (EBI)数据库(提交登录号:E-MEXP-1068)。
北方印迹分析
RNA从拟南芥叶片(2-3 g)使用TriZol-reagent方法,根据制造商(Invitrogen, USA)的说明。总RNA样品(每道10 μg)使用乙二醛在50°C下变性1小时,用1.2%琼脂糖凝胶分离,并用尼龙滤网吸附。Blots在65°C下与先前用于cDNA载片斑点的cDNA片段制备的探针杂交过夜。探针的放射性标签32使用Prime-a-Gene Kit (Promega, USA)进行P-dCTP。印迹最后在50°C, 1 × SSC, 0.1% SDS下洗涤,放射自显像。使用计算机图像分析扫描仪(chemicimager™8000,Alpha Innotech Corp, USA)分析和量化mRNA表达水平。
电泳迁移率转移试验(EMSA)
根据Kvietikova等人,1995 [70].我们没有使用核提取物,而是使用翻译后的蛋白质在体外来自于微阵列实验中使用的相同mRNA。在体外根据小麦胚芽提取技术手册(L4380) (Promega, USA)进行翻译。翻译的效率和质量在体外翻译检查使用35用二维凝胶电泳和放射自显影(结果未显示)对新合成的蛋白质进行标记。用于生产非放射性物质在体外翻译蛋白,1 mM l -甲硫氨酸。制备了5个双链寡核苷酸探针:DREB 5'tgactaCCGAcatgagttcc3'、ABF 5' ccttgccacgtgtatcatc3 '、DOF 5'atcttatatAAAGcaccatt3'和GBF 5' cttgccacgtgtatcatca3 '。这些双链寡核苷酸探针使用T4多核苷酸激酶(Fermentas, Litauen)用32P-γ-ATP末端标记。dna -蛋白质结合反应在10°C 30分钟,总体积为20 μl含在体外翻译混合物(100 μg蛋白),包括新译蛋白,0.5 × 104cpm寡核苷酸探针,100 ng聚(dI-dC) (Amersham Biosciences, USA)作为非特异性竞争对手在10 mM Tris/HCl pH 7.5, 50 mM KCl, 50 mM NaCl, 1 mM MgCl21mm EDTA, 5mm DTT, 5%甘油。dna -蛋白质样品在5%非变性聚丙烯酰胺凝胶中分离,使用TBE作为缓冲液,在150v下分离2小时。然后将凝胶干燥,在-80°C下暴露于放射自显影48小时。
参考文献
- 1.
Duek PD, Fankhauser C: bHLH类转录因子在光敏色素信号传递中处于中心地位。植物科学进展,2005,10:51-54。10.1016 / j.tplants.2004.12.005。
- 2.
Pfannschmidt T:叶绿体氧化还原信号:光合作用如何控制自己的基因。植物动态,2003,8:33-41。10.1016 / s1360 - 1385(02) 00005 - 5。
- 3.
Blasing OE, Gibon Y, Gunther M, Hohne M, Morcuende R, Osuna D, Thimm O, Usadel B, Scheible WR, Stitt M:糖和昼夜节律调节在拟南芥基因日表达的全局调控中起着重要作用。植物学报,2005,17:357 - 357。10.1105 / tpc.105.035261。
- 4.
Piippo M, Allahverdiyeva Y, Paakkarinen V, Suoranta UM, Battchikova N, Aro EM:光胁迫下拟南芥叶绿体介导的核基因调控。中国生物医学工程学报,2006,29(4):447 - 447。10.1152 / physiolgenomics.00256.2005。
- 5.
Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在aba信号通路中起转录激活作用。植物学报,2003,15:63-78。10.1105 / tpc.006130。
- 6.
Seki M、Ishida J、Narusaka M、Fujita M、Nanjo T、Umezawa T、Kamiya A、Nakajima M、Enju A、Sakurai T、Satou M、Akiyama K、Yamaguchi-Shinozaki K、Carninci P、Kawai J、Hayashizaki Y、Shinozaki K:用全长cDNA微阵列检测ABA处理下约7000个拟南芥基因的表达模式中国生物医学工程学报,2002,26(2):381 - 381。10.1007 / s10142 - 002 - 0070 - 6。
- 7.
Fowler S, Thomashow MF:拟南芥转录组分析表明,在冷驯化过程中,除了CBF冷反应通路外,还有多个调控通路被激活。植物学报,2002,14:1675-1690。10.1105 / tpc.003483。
- 8.
ooono Y、Seki M、Nanjo T、Narusaka M、Fujita M、Satoh R、Satou M、Sakurai T、Ishida J、Akiyama K、Iida K、Maruyama K、Satoh S、Yamaguchi-Shinozaki K、Shinozaki K:利用ca 7000全长cDNA微阵列监测拟南芥脱水后复水过程中基因表达谱。植物学报,2003,34:868- 871。10.1046 / j.1365 - 313 x.2003.01774.x。
- 9.
Seki M、Narusaka M、Ishida J、Nanjo T、Fujita M、ooono Y、Kamiya A、Nakajima M、Enju A、Sakurai T、Satou M、Akiyama K、Taji T、Yamaguchi-Shinozaki K、Carninci P、Kawai J、Hayashizaki Y、Shinozaki K:用全长cDNA微阵列检测7000个拟南芥基因在干旱、寒冷和高盐胁迫下的表达谱植物学报,2002,31(4):369 - 371。10.1046 / j.1365 - 313 x.2002.01359.x。
- 10.
Zimmermann P, Hirsch-Hoffmann M, Hennig L, Gruissem W:基因研究者。拟南芥微阵列数据库和分析工具箱。植物生理学报,2004,24(3):369 - 369。10.1104 / pp.104.046367。
- 11.
穆林诺,卡尔平斯基:响应过度光的信号转导:走出叶绿体。植物学报,2002,5:43-48。10.1016 / s1369 - 5266(01) 00226 - 6。
- 12.
崔浩,洪杰,哈杰,康杰,金青云:aba响应元素结合因子家族。中国生物医学工程学报,2000,29(3):369 - 369。10.1074 / jbc.275.3.1723。
- 13.
Liu Q, Kasuga M, Sakuma Y, Abe H, Miura S, Yamaguchi-Shinozaki K, Shinozaki K:两个具有EREBP/AP2 DNA结合域的转录因子DREB1和DREB2分别分离了拟南芥干旱和低温响应基因表达中的两条细胞信号转导通路。植物科学学报,1998,10:1391-1406。10.1105 / tpc.10.8.1391。
- 14.
Sakamoto H, Araki T, Meshi T, Iwabuchi M:拟南芥Cys(2)/His(2)型锌指蛋白基因家族在水分胁迫下的表达。基因学报,2000,48:23-32。10.1016 / s0378 - 1119(00) 00133 - 5。
- 15.
肖伟,张锦江:己糖激酶在植物糖信号转导和生长发育中的作用。植物生物学杂志,2000,44:451-461。10.1023 /: 1026501430422。
- 16.
卡尔平斯基,加布瑞斯H,马特奥A,卡尔平斯卡B, Mullineaux PM:植物病害防御信号的光感知。植物生态学报,2003,23(6):369 - 369。10.1016 / s1369 - 5266 (03) 00061 - x。
- 17.
Ensminger I, Busch F, Huner NPA:光停滞和冷驯化:通过光合作用感知低温。植物生理学报,2006,26(4):344 - 344。10.1111 / j.1399-3054.2006.00627.x。
- 18.
Gray GR, Chauvin LP, Sarhan F, Huner N:冷适应和抗冻性(光与温度的复杂相互作用)。植物生理学报,1997,19(4):469 - 471。
- 19.
Ndong C, Danyluk J, Huner NP, Sarhan F:生长温度、光照和激发压力变化对冬黑麦基因表达的影响。植物生物学杂志,2001,27(3):381 - 381。10.1023 /: 1010684719225。
- 20.
Uemura M, Joseph RA, Steponkus PL:拟南芥冷驯化(对质膜脂组成和冻害的影响)。植物生理学报,1998,19(4):347 - 347。
- 21.
王晓峰,王晓燕,王晓燕:拟南芥的抗寒性。植物生理学报,2004,24(3):381 - 381。10.1104 / pp.120.2.391。
- 22.
张松,张文华,张文华:拟南芥光系统I在低温下的光抑制及其后续恢复。植物生理学报,2004,25(4):369 - 369。10.1093 /卡式肺囊虫肺炎/ pch180。
- 23.
Aro EM, Ohad I:类囊体蛋白磷酸化的氧化还原调节。抗氧化氧化还原信号。2003,5:55-67。10.1089 / 152308603321223540。
- 24.
Emanuelsson O, Nielsen H, Brunak S, von Heijne G:基于蛋白质n端氨基酸序列的亚细胞定位预测。中华分子生物学杂志,2000,30(3):359 - 361。10.1006 / jmbi.2000.3903。
- 25.
Yu F, Park S, Rodermel SR:拟南芥FtsH金属蛋白酶基因家族:叶绿体低聚物亚基的互换性。植物学报,2004,32(4):366 - 366。10.1111 / j.1365 - 313 x.2003.02014.x。
- 26.
Zelisko A, Garcia-Lorenzo M, Jackowski G, Jansson S, Funk C: AtFtsH6参与强光适应和衰老过程中光收集复合体II的降解。中国生物工程学报,2005,29(3):369 - 369。10.1073 / pnas.0503472102。
- 27.
Moberg P, Stahl A, Bhushan S, Wright SJ, Eriksson A, Bruce BD, Glaser E:一种新的锌金属蛋白酶参与降解线粒体和叶绿体中的靶向肽。植物学报,2003,36:616-628。10.1046 / j.1365 - 313 x.2003.01904.x。
- 28.
Kliebenstein DJ, Monde RA, Last RL:拟南芥中的超氧化物歧化酶:一个具有不同调控和蛋白质定位的折衷酶家族。植物工程学报,2004,24(3):366 - 366。10.1104 / pp.118.2.637。
- 29.
Rodriguez-Concepcion M, forres O, Martinez-Garcia JF, Gonzalez V, Phillips MA, Ferrer A, Boronat A:在拟南芥幼苗发育过程中,不同的光介导途径调节类异戊二烯前体的生物合成和交换。植物学报,2004,26(4):344 - 344。10.1105 / tpc.016204。
- 30.
Tanaka R, Oster U, Kruse E, Rudiger W, Grimm B:在表达香叶酰香叶酰还原酶反义RNA的转基因烟草植株中,香叶酰香叶酰还原酶活性降低导致叶绿素和生育酚的损失和部分香叶酰香叶酰化的叶绿素。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.120.3.695。
- 31.
徐明,郭世波,王晓燕。植物中ABA合成的复杂调控。植物科学进展,2002,7:41-48。10.1016 / s1360 - 1385(01) 02187 - 2。
- 32.
Hofius D, Sonnewald U:维生素E生物合成:生物化学遇见细胞生物学。植物科学进展,2003,8:6-8。10.1016 / s1360 - 1385 (02) 00002 - x。
- 33.
熊玲,李宏,石谷明,朱建军:拟南芥LOS6/ABA1基因座对渗透胁迫响应基因表达的调控。中国生物医学工程学报,2002,27(4):588- 596。10.1074 / jbc.M109275200。
- 34.
永田T, Todoriki S, Masumizu T, Suda I, Furuta S, Du Z,菊池S:拟南芥中活性氧种类的水平受抗坏血酸和花青素的控制。农业化学学报,2003,51:2992-2999。10.1021 / jf026179 +。
- 35.
Landry LG, Chapple CC, Last RL:缺乏酚类防晒霜的拟南芥突变体表现出增强的紫外线- b损伤和氧化损伤。植物生理学报,2003,21(3):366 - 366。10.1104 / pp.109.4.1159。
- 36.
Costa MA, Collins RE, Anterola AM, Cochrane FC, Davin LB, Lewis NG:拟南芥苯丙类途径代谢网络的基因功能和组织及其局限性。植物化学学报,2003,34(4):394 - 394。10.1016 / s0031 - 9422 (03) 00517 - x。
- 37.
链A, Hurry V, Henkes S, Huner N, Gustafsson P, Gardestrom P, Stitt M:拟南芥低温发育叶片的适应。细胞质体积的增加伴随着卡尔文循环和蔗糖-生物合成途径中酶活性的增加。植物生理学报,2004,24(3):378 - 378。10.1104 / pp.119.4.1387。
- 38.
链A、Hurry V、Gustafsson P、Gardestrom P:拟南芥叶片在低温条件下发育,尽管积累了可溶性碳水化合物,但释放了光合作用和光合基因表达的抑制。植物学报,1998,15(3):366 - 366。10.1046 / j.1365 - 313 x.1997.00605.x。
- 39.
李丽娟,张晓燕,张晓燕,等:氧化胁迫下拟南芥抗坏血酸过氧化物酶1表达与锌指蛋白Zat12有关。中国生物医学工程学报,2004,29(4):394 - 394。10.1074 / jbc.M313350200。
- 40.
Lippuner V, Cyert MS, Gasser CS:两类植物cDNA克隆对酵母钙调神经磷酸酶突变体有差异补体作用,提高野生型酵母的耐盐性。中国生物医学工程学报,1996,29(4):359 - 366。10.1074 / jbc.271.22.12859。
- 41.
Nakashima K, Shinwari ZK, Sakuma Y, Seki M, Miura S, Shinozaki K, Yamaguchi-Shinozaki K:两个拟南芥DREB2基因的组织和表达,编码DREB2结合蛋白,参与脱水和高盐反应基因的表达。植物生物学杂志,2000,42:657-665。10.1023 /: 1006321900483。
- 42.
Zarka DG, Vogel JT, Cook D, Thomashow MF:拟南芥CBF基因的冷诱导包括多个ICE (CBF表达诱导子)启动子元件和一个低温下不敏感的冷调节电路。植物生理学报,2003,31(3):381 - 381。10.1104 / pp.103.027169。
- 43.
Fowler SG, Cook D, Thomashow MF:拟南芥CBF1, 2和3的低温诱导受生物钟控制。植物生理学报,2005,37(4):366 - 366。10.1104 / pp.104.058354。
- 44.
李晓明,李晓明,李晓明:拟南芥转录因子与花期调控:基因组视角。分子生物学杂志,2002,4:77-91。
- 45.
Sakuma Y, Liu Q, Dubouzet JG, Abe H, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥DREBs的ERF/AP2结构域的dna结合特异性,脱水和冷诱导基因表达的转录因子。生物化学学报,2002,29(5):593 - 593。10.1006 / bbrc.2001.6299。
- 46.
金海杰,金玉奎,朴金勇,金杰:光敏色素介导的光信号在拟南芥C-repeat/脱水响应元件(C/DRE)介导的冷诱导基因表达中发挥重要作用。植物学报,2002,29(4):394 - 394。10.1046 / j.1365 - 313 x.2002.01249.x。
- 47.
McCormac AC, Terry MJ:在拟南芥叶绿体发育过程中导致HEMA1和Lhcb协同表达的光信号通路。植物学报,2002,32:549-559。10.1046 / j.1365 - 313 x.2002.01443.x。
- 48.
Daniel X, Sugano S, Tobin EM:在拟南芥中,CCA1的CK2磷酸化是其昼夜节律振荡功能所必需的。中国生物工程学报,2004,29(4):359 - 359。10.1073 / pnas.0400163101。
- 49.
李志强,李志强,李志强,等。光敏色素调控种子植物Lhcb mRNA表达的研究进展。植物生理学报,2001,29(3):366 - 366。10.1104 / pp.126.4.1609。
- 50.
王晓燕,王晓燕,王晓燕,等:不同植物激素通过转录反应调节相似的过程。细胞科学。2006,126:467-475。10.1016 / j.cell.2006.05.050。
- 51.
Beck CF:从叶绿体到细胞核的信号通路。植物学报,2005,32(5):563 - 566。10.1007 / s00425 - 005 - 0021 - 2。
- 52.
Rodriguez Milla MA, Maurer A, Rodriguez HA, Gustafson JP:拟南芥中谷胱甘肽过氧化物酶基因普遍存在,并通过多种信号通路受到非生物胁迫的调控。植物学报,2003,36:602-615。10.1046 / j.1365 - 313 x.2003.01901.x。
- 53.
Fryer MJ, Ball L, Oxborough K, Karpinski S, Mullineaux PM, Baker NR:过氧化氢和叶片水分状态对抗坏血酸过氧化物酶2表达的控制揭示了拟南芥叶片的功能组织。植物学报,2003,34(4):371 - 371。10.1046 / j.1365 - 313 x.2003.01656.x。
- 54.
Mittler R, Vanderauwera S, Gollery M, Van Breusegem F:植物活性氧基因网络。植物生态学报,2004,29(4):489 -498。10.1016 / j.tplants.2004.08.009。
- 55.
Karpinski S, Escobar C, Karpinska B, Creissen G, Mullineaux PM:光合电子传输调节拟南芥在过度光胁迫下胞质抗坏血酸过氧化物酶基因的表达。植物科学学报,1997,16(3):327 - 327。10.1105 / tpc.9.4.627。
- 56.
Chang CC, Ball L, Fryer MJ, Baker NR, Karpinski S, Mullineaux PM:在拟南芥损伤叶片中诱导抗坏血酸过氧化物酶2的表达不涉及已知的损伤信号通路,但与光合作用的变化有关。植物学报,2004,38(4):369 - 371。10.1111 / j.1365 - 313 x.2004.02066.x。
- 57.
Maxwell DP, Laudenbach DE, Huner N:盐藻采光复合体II和cab mRNA丰度的氧化还原调控。植物生理学报,1998,19(4):378 - 378。
- 58.
Pfannschmidt T, Schutze K, Fey V, Sherameti I, Oelmuller R:叶绿体氧化还原控制核基因表达——细胞器间通讯中一类新的质体信号。抗氧化氧化还原信号。2003,5:95-101。10.1089 / 152308603321223586。
- 59.
Escoubas JM, Lomas M, LaRoche J, Falkowski PG: cab基因转录的光强度调节是由质体醌池的氧化还原状态发出的信号。中国科学:地球科学,1995,29(5):557 - 557。10.1073 / pnas.92.22.10237。
- 60.
杨德华,Andersson B, Aro EM, Ohad I:质体醌池的氧化还原状态控制着光驯化过程中捕光叶绿素a/ B结合蛋白复合物II (LHC II)的水平。科学通报,2001,29(5):557 - 557。10.1023 /: 1011849919438。
- 61.
周亮,张锦江:糖作为信号分子。植物学报,1999,2:410-418。10.1016 / s1369 - 5266 (99) 00014 - x。
- 62.
溶质转运蛋白是细胞质和质体间质之间的连接元素。植物生态学报,2004,7:247-253。10.1016 / j.pbi.2004.03.008。
- 63.
王晓燕,王晓燕,王晓燕,等。植物对糖的信号转导作用。植物细胞学报,2002,14增刊:S185-S205。
- 64.
Plieth C, Hansen UP, Knight H, Knight MR:植物的温度感知:信号感知和钙反应的主要特征。植物学报,1999,18:491-497。10.1046 / j.1365 - 313 x.1999.00471.x。
- 65.
杨阳,杨玉华,郭丽丽,等:脱落酸信号通路的调控与传递。植物生态学报,2003,23(6):476 - 476。10.1016 / s1369 - 5266(03) 00090 - 6。
- 66.
Baena-Gonzalez E, Barbato R, Aro EM:磷酸化在光系统修复周期和低聚结构中的作用II。植物学报,1999,29(4):366 - 366。10.1007 / s004250050550。
- 67.
Porra RJ, Thompson WA, Kriedemann PE:用四种不同溶剂测定叶绿素a和b的精确消光系数的确定和联立方程:用原子吸收光谱法验证叶绿素浓度。生物化学学报,1998,25(3):394 -394。10.1016 / s0005 - 2728(89) 80347 - 0。
- 68.
任东,杨宏,张松:MAPK介导的拟南芥细胞死亡与过氧化氢生成相关。中国生物医学工程学报,2002,27(4):559-565。10.1074 / jbc.M109495200。
- 69.
MIPS数据库。2008年,(http://mips.gsf.de/proj/thal/db/tables/targetp.html]
- 70.
Kvietikova I, Wenger RH, Marti HH, Gassmann M:转录因子ATF-1和CREB-1与缺氧诱导因子-1 (HIF-1) DNA识别位点构成结合。核酸学报,1995,23:4542-4550。10.1093 / nar / 23.22.4542。
- 71.
O'Connor TR, Dyreson C, Wyrick JJ: Athena:一个快速可视化和系统分析拟南芥启动子序列的资源。生物信息学,2005,21:4411-4413。10.1093 /生物信息学/ bti714。
- 72.
Fowler SG, Cook D, Thomashow MF:拟南芥CBF1, 2和3的低温诱导受生物钟控制。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.104.058354。
- 73.
Soderman E, Hjellstrom M, Fahleson J, Engstrom P: HD-Zip基因ATHB6在拟南芥发育中的叶、根和心皮中表达,并在水分亏缺条件下表达上调。植物生物学杂志,1999,30(4):394 - 394。10.1023 /: 1006267013170。
- 74.
Himmelbach A、Hoffmann T、Leube M、Hohener B、Grill E:同源域蛋白ATHB6是拟南芥中蛋白磷酸化酶ABI1的靶点,调节激素反应。中国科学(d辑:自然科学版)。10.1093 / emboj / cdf316。
- 75.
Donald RG, Cashmore AR:不管是G box还是I box序列的突变都深刻影响着拟南芥rbcS-1A启动子的表达。中国科学(d辑:自然科学版)。
- 76.
Rook F, Weisbeek P, Smeekens S:光调节拟南芥bZIP转录因子基因ATB2编码一种具有异常长亮氨酸拉链结构域的蛋白质。植物生物学杂志,1998,37:171-178。10.1023 /: 1005964327725。
- 77.
Nagano Y, Inaba T, Furuhashi H, Sasaki Y:具有特异性的两种不同顺式元件的三螺旋dna结合蛋白,这两种元件对高等植物中光下调和暗诱导的基因表达都很重要。中国生物医学工程学报,2004,24(3):356 - 356。10.1074 / jbc.M102474200。
- 78.
Ayadi M, Delaporte V, Li YF, Zhou DX:对GT-3a的分析发现了拟南芥中一个独特的三螺旋dna结合转录因子亚群。中国生物医学工程学报,2004,32(4):359 - 361。10.1016 / s0014 - 5793(04) 00222 - 4。
- 79.
Martinez-Hernandez A, Lopez-Ochoa L, Arguello-Astorga G, Herrera-Estrella L:光敏色素、隐色素和质体信号激活的最小rbc光响应单元的功能特性和调节复杂性。植物生理学报,2004,25(3):366 - 366。10.1104 / pp.010678。
- 80.
McCormac AC, Fischer A, Kumar AM, Soll D, Terry MJ:光敏色素和质体信号对拟南芥去黄化过程中HEMA1表达的调控。植物学报,2001,25:549-561。10.1046 / j.1365 - 313 x.2001.00986.x。
- 81.
Stracke R, Werber M, Weisshaar B:拟南芥R2R3-MYB基因家族。植物生态学报,2001,27(4):447-456。10.1016 / s1369 - 5266(00) 00199 - 0。
- 82.
Nover L, Bharti K, Doring P, Mishra SK, Ganguli A, Scharf KD:拟南芥与热应激转录因子的世界:我们需要多少热应激转录因子?细胞应激伴侣的研究。2001,6:177-189。10.1379 / 1466 - 1268 (2001) 006 < 0177: AATHST > 2.0.CO; 2。
- 83.
Panikulangara TJ, Eggers-Schumacher G, Wunderlich M, Stransky H, Schoffl F:半乳糖醇合成酶1。拟南芥棉子糖家族低聚糖热诱导合成的新热冲击因子靶基因。植物生理学报,2004,24(3):369 - 369。10.1104 / pp.104.042606。
- 84.
杨涛,Poovaiah BW:植物钙调素结合/CGCG盒子dna结合蛋白家族参与多种信号通路。中国生物医学工程学报,2004,27(4):449 - 458。10.1074 / jbc.M207941200。
- 85.
坂本H, Maruyama K, Sakuma Y, Meshi T, Iwabuchi M, Shinozaki K, yamaguchi Shinozaki K:拟南芥Cys2/ his2型锌指蛋白在干旱、寒冷和高盐胁迫条件下发挥转录抑制因子作用。植物生理学报,2004,24(3):344 - 344。10.1104 / pp.104.046599。
- 86.
Davletova S, Schlauch K, Coutu J, Mittler R:锌指蛋白Zat12在拟南芥活性氧和非生物胁迫信号转导中发挥核心作用。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.105.068254。
- 87.
Kang HG, Foley RC, Onate-Sanchez L, Lin C, Singh KB: Dof转录因子OBP3的靶基因包括水杨酸诱导的新型基本螺旋-环-螺旋结构域蛋白。植物学报,2003,35:362-372。10.1046 / j.1365 - 313 x.2003.01812.x。
- 88.
Tran LS, Nakashima K, Sakuma Y, Simpson SD, Fujita Y, Maruyama K, Fujita M, Seki M, Shinozaki K, yamaguchi Shinozaki K:拟南芥胁迫诱导的NAC转录因子的分离和功能分析,该转录因子与脱水胁迫早期响应启动子1中干旱响应顺式元件结合。植物学报,2004,16:2481-2498。10.1105 / tpc.104.022699。
- 89.
Kagaya Y, Ohmiya K, Hattori T: RAV1是一种新型的dna结合蛋白,通过高等植物中独特的两个不同的dna结合结构域与双部识别序列结合。核酸学报,1999,27:470-478。10.1093 / nar / 27.2.470。
- 90.
Toledo-Ortiz G, Huq E, Quail PH:拟南芥基本/螺旋-环-螺旋转录因子家族。植物科学学报,2003,15:1749-1770。10.1105 / tpc.013839。
- 91.
timm O, Blasing O, Gibon Y, Nagel A, Meyer S, Kruger P, Selbig J, Muller LA, Rhee SY, Stitt M: MAPMAN:一种用户驱动的工具,将基因组数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004,37:914-939。10.1111 / j.1365 - 313 x.2004.02016.x。
确认
这项工作得到了NKJ、北欧农业研究联合委员会、芬兰农业部和芬兰科学院的支持。Ulla-Maija Suoranta女士在cDNA克隆的扩增和纯化方面给予了极大的帮助。生物技术中心(图尔库,芬兰)因发现微阵列芯片和通过测序验证cDNA克隆而得到认可。我们感谢Virpi Paakkarinen培养了拟南芥工厂和Eveliina Aro的优秀技术支持。CSC因提供genesspring GX 7.3(安捷伦技术公司)和genome atix Suite软件而获得认可。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
AJS进行了从植物材料到数据分析的微阵列实验;Fv/Fm测量,Western和Northern blot分析,emsa和文章的撰写。MP参与技术支持。YA对叶片进行了氧化应激测定、磷苏氨酸免疫印迹法、77k和氧析出测定。NB参与了微阵列幻灯片的制作。E-M A参与了实验的策划,阅读和修改手稿。所有作者阅读并批准了最终稿件。
电子补充材料
12870 _2007_221_moesm1_esm.tiff
附加文件1:所有基因在三种不同条件下的聚类(冷/光和冷/暗处理显示三个生物重复,暗处理显示两个)。颜色的亮度表示基因的表达水平;洋红色表示聚集基因的上调调控,绿色表示下调调控。(tiff 2mb)
12870 _2007_221_moesm2_esm.xls
额外资料2:冷/光和冷/暗反应基因的上下调节至少两倍(p值至少在条件下小于0.05)(XLS 58 KB)
12870 _2007_221_moesm3_esm.xls
额外资料3:冷/光反应基因的上下调节至少两倍(p值至少在一种条件下小于0.05)(XLS 104 KB)
12870 _2007_221_moesm4_esm.xls
附加文件4:含有叶绿体靶向信号的冷/光、冷/暗和暗响应基因的下调(p值至少在一种条件下小于0.05)(XLS 46 KB)
12870 _2007_221_moesm7_esm.xls
附加文件7:至少两倍的暗响应基因的上调或下调调控(至少在一种条件下p值小于0.05)(XLS 178kb)
12870 _2007_221_moesm8_esm.xls
额外资料8:冷/暗反应基因的上下调控至少两倍(p值至少在一种条件下小于0.05)(XLS 60kb)
12870 _2007_221_moesm9_esm.xls
额外资料9:对冷/暗和8小时暗反应基因的上下调节至少两倍(p值至少在条件下小于0.05)(XLS 37 KB)
12870 _2007_221_moesm10_esm.xls
含有叶绿体靶向信号的冷/光、冷/暗和暗响应基因(p值至少在一种条件下小于0.05)的上调调控(XLS 64 KB)
权利与权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
Soitamo, a.j., Piippo, M, Allahverdiyeva, Y。et al。光在调制中起着特殊的作用拟南芥低温下的基因表达。植物生物学8,13(2008)。https://doi.org/10.1186/1471-2229-8-13
收到了:
接受:
发表:
关键字
- 电泳迁移率迁移试验
- 转录因子基因
- 黑暗的治疗
- DMBQ
- LHCII蛋白质