摘要
背景
许多商业香蕉品种缺乏抗病虫害的来源,不育的后果,缩小遗传背景。肥沃野生近缘种,相比之下,具有更大的可变性,并代表的抗病基因的潜在来源(R-基因)。的植物R基因已知的最大家族编码蛋白质与核苷酸结合位点(NBS)和C-末端富含亮氨酸的重复(LRR)结构域。在不同的植物品种,例如基因保守序列提供了一种用于香蕉候选基因的分离,其可能参与了植物防御。
结果
建立了单子叶植物r基因NBS和LRR结构域及同源基因的无偏保守基序发现方法。以野生品种为材料,对保守基序的简并PCR引物进行了检测穆萨acuminata亚普。burmannicoides,var。Calcutta 4,其抵抗许多真菌病原体和线虫。扩增一百七十四种抗性基因类似物(RGA)并组装成52个连续序列。目前的图案是非TIR NBS-LRR RGA亚家族的典型。用连续开放阅读框架(ORF)与RGA一起具有连续开放阅读框架(ORF)的33 RGA的推导氨基酸序列的系统发育分析拟南芥蒂利亚纳和水稻分组的最穆萨单子叶植物特有的分支内的RGA。RFLP-RGA标记被开发,与parentals 12显示不同的多态性和F1子代二倍体的M.尖锐湿疣映射人口。鉴定了八十八个BAC克隆M.尖锐湿疣加尔各答4,M.尖锐湿疣大Naine,和M. Balbisiana.Pisang Klutuk Wulung BAC文库与两个RGA探针杂交。多拷贝RGAs在BAC克隆中很常见,可能代表了新的r基因特异性进化的变异储层。
结论
这是我国首次对NBS-LRR RGAs进行大规模分析M.尖锐湿疣加尔各答4.重叠群序列,在GenBank和分配编号ER935972 - ER936023。RGA序列和孤立的BAC是R基因的发现一个宝贵的资源,在未来的应用将提供洞察的NBS-LRR R基因的组织和进化穆萨A和B基因组中。在发达的RFLP,RGA标记适用于遗传图谱的发展和分子标记辅助选择定义的性状,如抗病虫害。
背景
商业香蕉品种,主要来自穆萨acuminata阿胶,M. Balbisiana.科拉,栽培遍布热带和亚热带130多个国家,产生超过100万吨年产量,并显著粮食安全作出贡献[1].易患50个真菌病原体,以及许多细菌病原体,线虫,病毒和虫害,对全球香蕉生产的最大威胁目前目前由真菌病原体引起球腔菌属fijiensis黑条斑病的致病有机体(BLSD),和尖孢镰刀菌F。sp。张开第4种,引起枯萎病。农用化学方法防治BLSD可能在社会经济和环境上不合适,需要综合策略以避免病原菌对杀菌剂产生抗性。然而,在枯萎病的情况下,化学防治是无效的。因此,抗病新品种的开发对小麦的抗病育种至关重要穆萨行业。虽然在水稻,小麦和玉米后的生产价值方面排名第四最重要的食品商品,但遗传改善穆萨受到了限制。品种已经从二倍体,三倍体和四倍体野生物种进化M.尖锐湿疣(基因组)和M. Balbisiana.(B基因组)。虽然野生物种普遍肥沃,但今天的许多商业品种是无菌三倍体或二倍体,通过Parthenocarpy具有果实开发。这转化为无籽水果,或含有大多数不行种子的果实。由于这种品种在很大程度上通过无性营养繁殖繁殖而发展,因此它们的遗传基础是狭窄的,依赖于体细胞突变的多样性。这种有限的遗传变异导致商业作物缺乏对害虫和疾病的抵抗力,如Gros Michel和Grande Naine等品种所观察到的[2].
由于对病原体的抗性来源存在于种质资源中穆萨属,的R基因基因渗入感病品种报价潜力克服与常规育种电流约束。抗性植物的基因型可以通过“基因用于基因”防御机制,其在最简单的模型中,通过组成型抗性(R)基因产物和特定活体营养病原体无毒之间的直接或间接的相互作用引发防止病原体进入(AVR)基因产物,或诱发剂[3.].这种识别被认为是触发一系列信号转导事件,导致防御机制的激活,如超敏反应(HR),抗菌蛋白和代谢产物的合成,细胞壁增厚和血管堵塞。在过去的15年里,超过40个r基因已经从模式植物和重要作物物种中被鉴定出来[4],赋予对多种致病菌。尽管广泛认可病原体类群,共享显著序列相似性和结构基序,这表明在信令在植物防御反应的事件常见的蛋白质 - 蛋白质相互作用的受体系统和共同作用的部件R基因编码的蛋白质。
到目前为止,基于保守的蛋白质结构域,已经确定了五类主要的r基因(回顾见[4])。最丰富的一类是胞浆核苷酸结合位点-富亮氨酸重复序列(NBS-LRR)蛋白[5].其他类包括锚定到一个跨膜(TM)结构域(受体样蛋白[RLPS]),细胞质丝氨酸 - 苏氨酸(丝氨酸/苏氨酸)受体样激酶(RLKs)与胞外LRR的,细胞质与细胞质外LRR的(eLRRs)蛋白丝氨酸/苏氨酸激酶无个LRR,和具有稠合到一个卷曲螺旋(CC)结构域的膜锚蛋白。公共NBS-LRR蛋白质编码目前包括来自不同植物物种超过20功能上证实R基因[6,7].研究集中在这个家庭,因为它的唯一已知函数的日期是在抗病[8,9].基因产物组成的保守的N末端NBS和可变长度C末端LRR的10结构域的40个短LRR基序[10.].NBS结构域对ATP结合和水解很重要,并且被认为参与信号转导,通过病原体存在引发[11.- - - - - -13.].LRR结构域很可能是参与蛋白质 - 蛋白质相互作用,识别病原体诱导子分子[14.,15.].高突变率在LRR有助于遗传变异,必需特异性识别的多样的病原体[16.].NBS-LRR R蛋白基于n端基序存在两个亚家族。TIR NBS亚家族R蛋白在n端氨基酸基序与受体结构域之间具有同源性果蝇收费和基础哺乳动物白细胞介素(IL)1种动物的免疫因素[17.].非tir NBS亚家族R蛋白可以包含一个n端螺旋(CC)基序,其中一个子集编码亮氨酸拉链序列(LZ)。TIR亚家族NBS-LRR蛋白似乎仅限于双子叶植物。正如在裸子植物中报道的那样,草可能已经失去了这种类型的r基因家族[18.,19.].相比之下,非tir亚家族NBS-LRR蛋白同时存在于单子叶植物和双子叶植物中[6].保守氨基酸基序已经在这些亚家族[在NBS结构域描述20.,其中包括磷酸结合环或' p -环'(也称为激酶1)、激酶2 [21.,22.],GLPL(也称为激酶3)和RNBS-A,B,C和d基序6].激酶2基段的最后氨基酸通常可以揭示TIR和非TIR类型之间的差异,在TIRs中有天冬氨酸残基,在非TIRs中有色氨酸[6].
以保守基序为靶点的简并引物已被用于扩增来自不同植物类群(如大豆)的抗性基因类似物(RGAs) [23.],答:芥[24.], 白饭 [25.]和花生[26.],除其他外(综述参见[27.])。许多RGAs与已知的r基因在系统发育上相关,许多研究已经显示了与r基因位点(例如[23.,24.),这就提供了证据,证明这些基因组区域可能编码了抗药性。在穆萨在RGA表征进步最近开始,用(2007年访问日)只有九个NBS-LRR抗病样目前在GenBank蛋白质序列。一些非TIR NBS的RGA已经在野外被放大M.尖锐湿疣和M. Balbisiana.种质工交,Xinyiyejiao,以及在栽培种Zhongshandajiao,蕉和Williams [28.].其他组描述了CF.白斑鱼GF的直系亲属[29.], 和美国专利商标局家庭的RGA在M.尖锐湿疣cv Tuu Gia [30.].NBS RGA的表征最近也扩展到穆萨物种M. Ornata.,m . schizocarpa,M. Textilis., 和M.Velutina[31].
鉴于到目前为止研究的序列可能只代表了这些抗性基因家族的一小部分穆萨这项研究的目的是确定NBS-LRR的RGA,并探讨其多样性M.尖锐湿疣亚普。burmannicoides4.《初恋50次》这种野生二倍体品种已广泛用于育种计划,提供了对重要的真菌病原体和线虫的抗性。我们描述了一种发现基序的计算策略,使NBS和LRR域内的目标基序进行PCR扩增,并可能适用于不同的单子叶物种。结合通用TIR和非TIR靶向nbs的简并引物,首次对RGAs进行了大规模分析M.尖锐湿疣加尔各答4。两者之间的进化关系穆萨序列和RGAs来自答:芥和o .漂白亚麻纤维卷确定,并确定了多态RFLP-RGA标记M.尖锐湿疣绘制人口父母。所选序列用于鉴定抗抵抗基因基因座M.尖锐湿疣加尔各答4,M.尖锐湿疣大Naine和M. Balbisiana.Pisang Klutuk Wulung Bac图书馆。
结果
简并引物设计
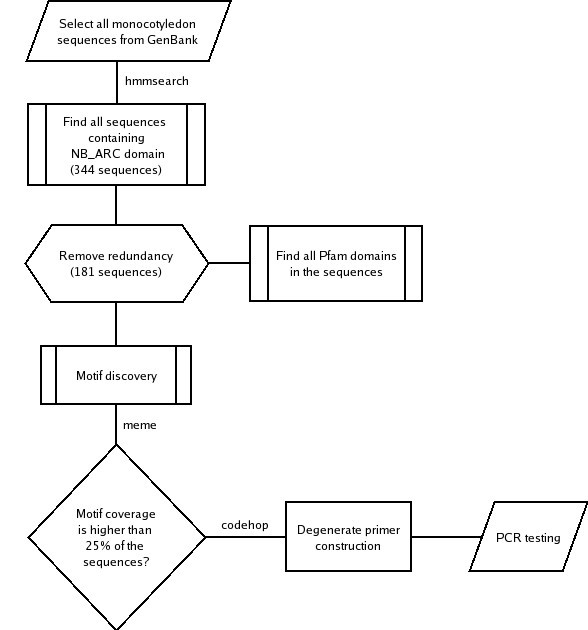
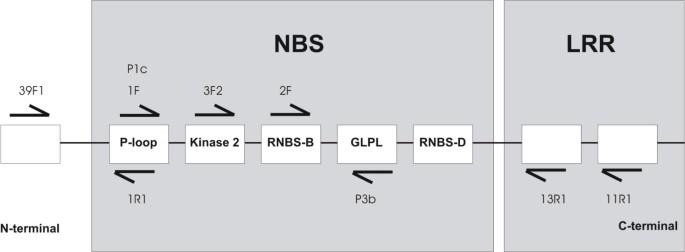
目前的公共数据库仅包含非常有限的数量穆萨R-Gene或RGA序列。为了丰富RGA候选人的一小部分穆萨通过PCR可恢复在Silico.协议被设计以促进单子叶植物从序列和靶向NBS和额外结构域的简并引物的设计。数字1描述了这一过程,首先从包含r -基因共享特征域的GenBank中选择单子叶序列(Pfam id: NB-ARC)。在去除冗余序列(使用95%身份阈值)后,得到181个RGA候选序列。基于这一子集,使用程序MEME [32].NBS家族基序(P-loop, Kinase-2, GLPL, RNBS-D)在整个序列中被观察到,并且在NBS结构域外发现了新的保守基序,其中大部分位于LRR结构域内。所有被鉴定的保守基序都可以作为简并引物设计的候选,附加的约束条件是基序或接近的变异必须存在于至少25%的序列中(基序覆盖范围)。引物设计使用CODEHOP程序[33].
NBS-LRR RGA的孤立
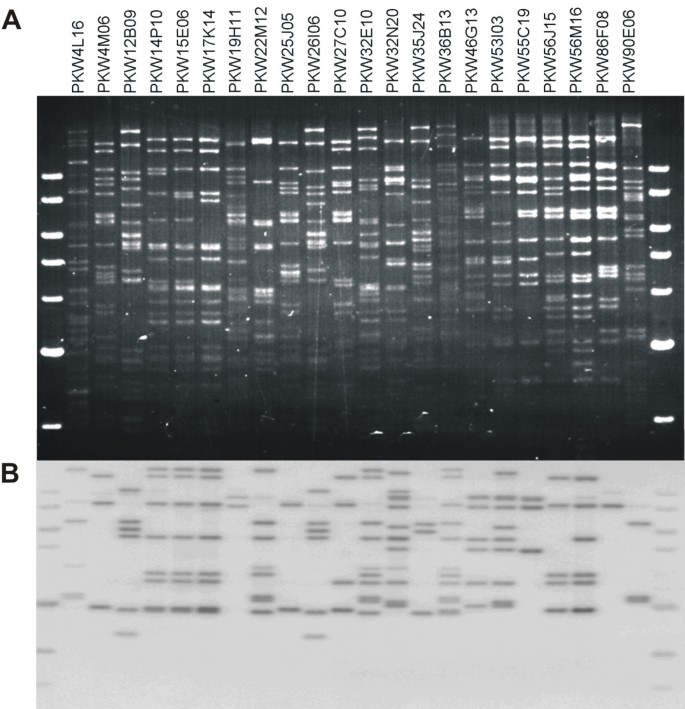
共有860个高质量序列从含有插入片段的重组质粒,其中174显示显著相似已知产生答:芥R基因和同源物(E-值≤10-5),基于使用BLASTX程序的搜索。这些序列是用两组不同的引物组合进行PCR扩增获得的:23.,26.,34]和引物在本研究中设计的。通用TIR和非TIR NBS-LRR靶向引物组合1-7(表1)得到预期大小的PCR产物,用P-回路GLPL引物对产生大约650碱基对的单个DNA带,并且P-环路RNBS-d引物组合的产物接近700bp的。从168点不同的克隆,产生了高质量的序列,其中,在与含有NBS-蛋白在修剪和矢量掩蔽,36(21.43%)表现出相似性的答:芥.不同引物组合对RGAs表现出相似度的克隆百分率不同,范围为0-68%2).
引物组合8-14,将其从计算管道导出在图中描述1,靶向保守在单子叶植物和双子叶植物的植物的非TIR NBS-LRR序列的氨基酸基序(表1).组合8个(39F1-1R1)、10个(P1c-P3b)、12个(3F2-11R1)、13个(2F-13R1)和14个(2F-11R1)均未扩增出可重复性PCR产物。相比之下,11个(3F2-13R1)和9个(1F-P3b)引物组合一致扩增出约650 bp大小的产物,138个序列与RGAs相似答:芥.组合11的效率更高,54%的克隆与r基因或RGAs同源(见表)2).
大多数非RGAs序列与逆转录因子相似。这些可以构成植物基因组的很大一部分[35],许多r基因座已被报道含有分散的转座元件[36,37].由于其在反应开始时的高拷贝数,也可以预期相当大的逆向放大的放大[38],即在PCR期间导致竞争,即使底漆匹配差。
组装RGA序列的分析
组件174个的所有RGA序列生成62个重叠群,具有下列选择的克隆的重测序引物52个之间的完整序列。三十3重叠群表明编码的RGA不间断的开放阅读框(ORF),与含提前终止密码子余数,和/或移码。这些后面的序列是有可能从假,PCR突变体或衍生假象。完全翻译穆萨NBS编码序列产生了相同数量的非冗余蛋白序列。修剪完整序列的平均大小(不含RGA引物)为610bp,平均每共有4.6个序列覆盖率。这些序列的最大和最小尺寸分别为1365 bp和273bp。使用p环和絮凝物靶向引物分离最大的contig(marga41)(引物组合3)。glpl主题序列是罕见的变体GSPL;也许是因为这一点,基于GLPL的底漆没有与该网站绑定,而是对3'-远端部位,这可以解释该产品的较大和意外的大小。有趣的是,还观察到出于完全相同的原因的异常大RGA的分离arachis.[26.].据报道,蒂拉德NBS类RGA在单圈基因组中缺席[19.,在这项研究中穆萨个RGA符合非TIR NBS级带最终色氨酸残基存在于激酶2基序。
系统发育分析
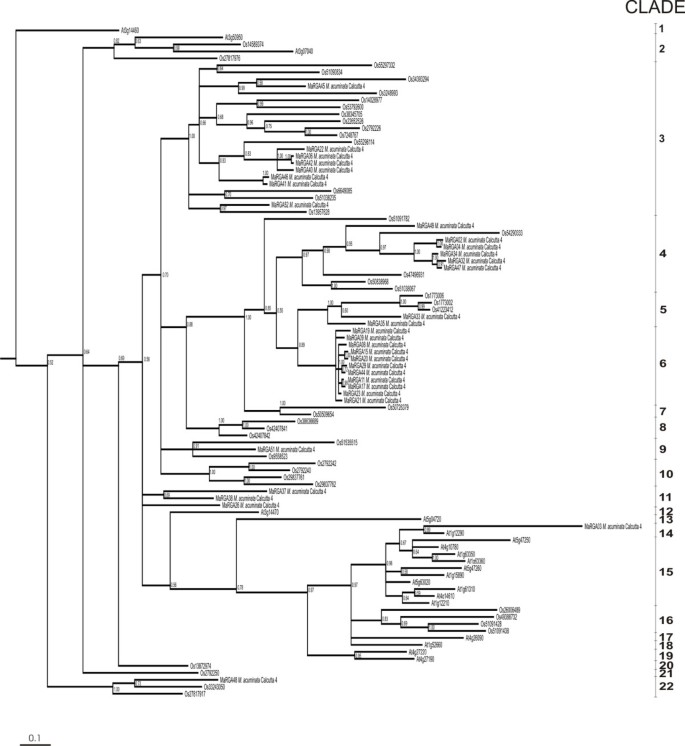
在33个全长中进行了NBS激酶2和GLPL基序之间的对齐氨基酸序列的贝叶斯系统发育分析穆萨具有连续的ORF序列,其中21代表非TIR NBS-LRR类从序列一起答:芥和43o .漂白亚麻纤维卷(图2).乔木分化显著,共有22个分支。这种变异性已经在之前的非红外NBS序列中进行了描述[10.].穆萨序列是发散的,表明存在具有NBS-LRR结构域的蛋白质的各种基因系列。虽然依赖于样本大小,但两种曲线含有似乎特定的序列M.尖锐湿疣加尔各答4(演化支6和11)。相反,在单子叶中也观察到一些可能扩展的序列类型M.尖锐湿疣加尔各答4个序列与多个从分组在一起o .漂白亚麻纤维卷(进化支3、4、5、9和22)。穆萨RGAs也与其他来自答:芥(枝14),表明保守序列的扩增可能存在于整个被子植物中。
RFLP,RGA标记
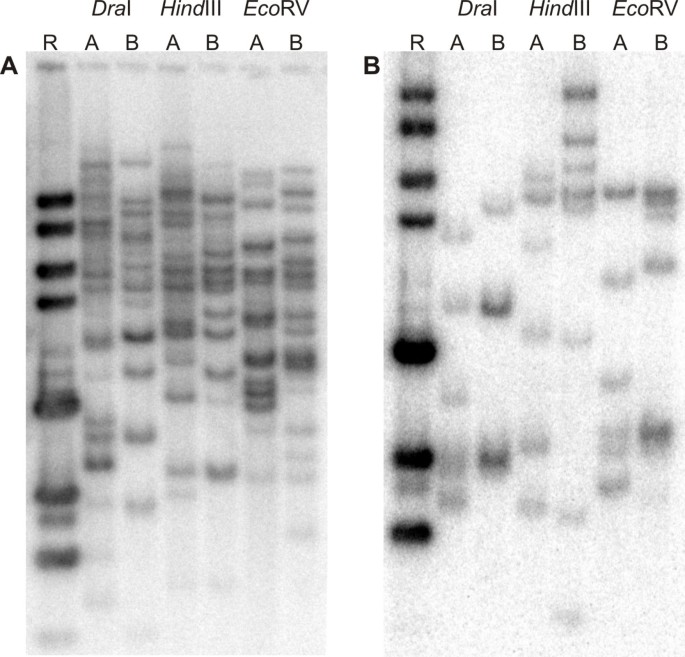
总数为33穆萨RGA评估为具有限制基因组DNA的RFLP标记,来自绘制群体父母M.尖锐湿疣婆罗洲和Pisang Lilin,30显示单个基因座或多个基因座在括号上,至少有一个限制酶(表3.).在使用酶时观察到横跨观察到的多态性,观察到12种不同的指纹类型德我和后III。RGA探针MaRGA04,MaRGA07,MaRGA08,MaRGA12,MaRGA13,MaRGA14,MaRGA16,MaRGA22,MaRGA37,MaRGA41,MaRGA43和MaRGA46表示的每个多态性模式。数字3.显示了限制性亲本DNA与探针MaRGA08和MaRGA37杂交的Southern blots中观察到的多个位点多态性的例子。图中描述了根据孟德尔比值在该定位群体的F1代后代中所选择的多态带的分离4.
物理分布穆萨的RGA
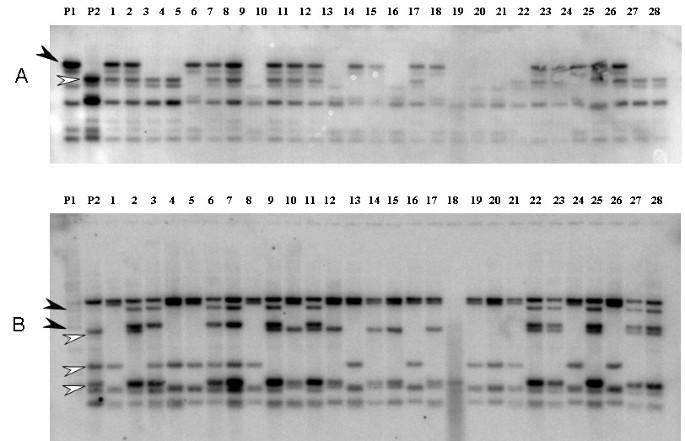
穆萨个RGA被用来从野生型物种的屏幕BAC文库M.尖锐湿疣加尔各答4(AA),M. Balbisiana.毗桑克鲁图克乌隆(PKW) (BB)和商业三倍体M.尖锐湿疣格兰德Naine (AAA)。为了最大限度地鉴定含有靶标RGA位点的BAC克隆,根据蛋白结构域、基元和系统进化分支的差异,选择MaRGA08和MaRGA37作为探针。在使用探针MaRGA08进行筛选时,三个基因组通过高密度过滤器共识别到62个BAC克隆,使用探针MaRGA37进行筛选时识别到43个克隆。然后对这些克隆进行指纹鉴定,并与相应的探针杂交,验证在第一次筛选中鉴定的阳性坐标,并提供NBS和NBS- lrr序列在三者之间的拷贝数数据穆萨基因组。当杂交到它们各自的探针共有88选自105个克隆进行了验证,只用17个克隆不能产生上Southern印迹可见条带(表4).由于鉴定BAC过滤器上的错误坐标而产生假阳性,BAC质粒制剂的故障,DNA印迹中的问题,或由于探针标记或杂交失败而导致。Marga08作为单一副本和作为三个基因组的验证BAC的多个副本,与M.尖锐湿疣加尔各答4 BAC克隆大多含有单拷贝RGAs,而Grande Naine和PKW的BAC分别含有9个和11个拷贝。数字5的情况下将显示M. Balbisiana.该RGA的高密度BAC克隆。在三个基因组的验证BACs中,MaRGA37也以多个拷贝的形式存在M.尖锐湿疣加尔各答4个BAC克隆携带多达6份,PKW BAC克隆两个副本,并含有多达9份大Naine的BAC。因此,这两个显然多基因家族的成员,总的MaRGA08的232份和MaRGA37的183份中在3个BAC文库鉴定阳性克隆观察到。
讨论
与大多数商业穆萨品种,遗传多样性通常由植物繁殖,性活性繁殖M.尖锐湿疣Calcutta 4是跨品种转移新基因的重要来源。我们报道了该品种NBS-LRR RGAs的首次大规模分析,利用简并引物设计策略设计了针对单子叶基因组的RGA扩增。考虑到r基因通常位于基因组间的集群中,具有大量的同源序列副本,穆萨鉴定含有RGA的BAC作为针对候选基因的资源,并促进我们对R基因演进的理解。多晶型RGA遗传标记也通过标记辅助选择策略提供了遗传改善的潜力。
的RGA的表征
采用PCR方法在单子叶植物中发现RGA是有效的M.尖锐湿疣Calcutta 4.所有174个克隆的RGA属于预期的非TIR NBS-LRR亚家族,在氨基酸水平观察到相当大的发散(图2).从52完全NBS编码蛋白质序列CONDIG,33个非冗余序列包含连续ORF,这是一个相当数量,给出了157个推定基因拟南芥NBS型抗性蛋白的代码,30%的基因组是非TIR类[39].然而,我们的总数可能仍然只反映了一小部分NBS-LRR序列M.尖锐湿疣,因为在水稻中大约有600个这样的序列[40].全部穆萨RGAs编码的蛋白质具有预期的氨基酸基元,并与假定的r基因和功能r基因具有同源性,如在答:芥,类似于r基因RPS5.,它提供了抵抗两.的穆萨RGAs具有连续的orf,因此,有些RGAs可能作为功能性r基因候选基因对抗多种病原体。大量的假基因也被共同扩增。这些可能是通过点突变、插入或核苷酸缺失而产生的,作为变异的宿主,并提供r基因等位基因或同源基因之间的重组或基因转换的潜力[16.].总共七个引物组扩增RGA,三个靶向通用TIR和非TIR NBS基序(引物对1,3和4),以及四个靶向非TIR NBS基序(引物对5,6,9和11)。许多因素可能导致引物的成功率。我们的单圈子的设计策略考虑了序列中的退化性,引物长度,核苷酸组合物,退化位置,分析序列中的推定靶标的患病率。用于DICOT序列的TIR和非TIR NBS基序的通用引物组合是相对效率的,并且当用引物组合扩增时,最多29%对RGA同源的序列1.使用非TIR靶向引物进行扩增最有效,具有具有引物组合6和11的引物组合6和11分别扩增的67.74%和54.18%,显示与R-Genes和RGA的显着相似之处。
系统发育分析显示有相当多的多态性穆萨个RGA分离为八个不同的分支,与多个限定穆萨特定的演化支。考虑到非TIR NBS-LRR序列通常比TIR亚科在植物分类系统中的异质性更大,这种变异可能是预料之中的[10.].用引物靶向非TIR基序产生的序列比那些具有通用引物靶向基序通用于TIR和非TIR亚科产生更加多样化。更高程度的多态性存在于NBS-LRR家族的R基因和同源物LRR结构域,如多样化选择压力的结果[16.].因此,针对该区域的引物很可能促进不同RGAs的扩增。引物对11是唯一同时针对NBS和LRR motif的引物组合,不仅是RGA扩增效率第二高的引物组合,而且是扩增多种RGA的引物对,分布在多个进化支。文献表明,NBS结构域存在于两种植物抗病基因中,以及激酶或ATP/ gtp依赖酶的编码基因中。相比之下,同时包含NBS和LRR结构域的蛋白迄今为止只在植物抗性基因中被描述过。由于引物组合11产生了从NBS激酶2到LRR结构域内的一个保守基序的扩增子,因此抗病靶点的扩增效率可能更高。
观察到的多样性穆萨RGAs表明对植物的进化适应性有贡献。r基因和病原菌Avr基因都在不断的进化压力下,病原菌发生突变导致植株失去抗性。了解r基因的进化机制对于确定植物如何保持对病原体的抗性至关重要[21.,41].植物r基因遗传变异和进化的潜在遗传机制包括重组、基因转化、不平等交叉、转座元件和点突变,而点突变被认为是主要的进化机制[16.].总体上,序列间相似性较高穆萨每个进化枝内的序列,表明最近的进化分歧。不过,鉴于穆萨含进化枝包含相对少的RGA重叠群序列,树形拓扑可以仅是近似的,因为采样不足的结果。正如我们在含有NBS-LRR结构域单子叶植物 - 衍生的序列的至少25%的基序靶向存在,我们也许还偏置到这样的序列。非TIR NBS-LRR序列在充分综合分析M.尖锐湿疣将需要多个引物集,以及更详尽的扩增子测序。虽然我们的研究没有报道TIR NBS-LRR RGAs的扩增,但这与TIR亚科仅限于双子叶类群的假设一致[41, TIR motif的存在目前已被报道在水稻基因组中,尽管数量减少[18.,19.].缺乏检测穆萨因此,单子叶基因组可能反映了PCR扩增的局限性。
RGA在映射中的应用程序
为了支持这一假设的的基因赋予阻力定量可以示出同源性的R基因,如最初由提议[42],许多RGAs已被定位到基因组区域,寻找与抗性相关的数量性状位点(例如[23.,43])。在我们的研究中,RGAs表现出单位点或多位点多态性M.尖锐湿疣父母的。利用RGAs作为RFLP探针在水稻中也观察到类似程度的多态性[43].与SSR和DART标记一起,我们的RGA已被列入正在开发的参考遗传地图上。作为大多数映射程序穆萨面临着大量种群的生产和维持问题,主要是由于使配子形成和分离复杂化的易位事件[44,45,最新的尝试涉及到两者的交叉M.尖锐湿疣SPP。Microcarpa“Bordeo”和穆萨acuminataSPP。据报道,MalAccensis“pisang lilin”只携带一个易位事件。此映射项目将作为开发核心标记集的基础,以便在香蕉上将映射项目中的摄取。需要对我们的RGA标记进行测绘,以抵抗对生物应力的抵抗力的群体,以确定RGA和R-Gene Loci之间的联系。这种R-基因标记在标记辅助选择计划中是有价值的特质选择。在高分辨率遗传映射中使用,RGA标记也可以作为基于地图的克隆的有效方法穆萨R-基因。
物理分布穆萨的RGA
多拷贝R基因家族和RGAs的聚类在植物基因组中很常见[39,43高达60%的r基因聚集在一起[46],这是由于平行序列的串联重复[47].随着RGA经常在此类基因座周围群集,因此它们可以作为跨越BAC文库的R-Gene发现的有用候选者。鉴于它们通常是大型基因家族的成员,八十八个RGA阳性克隆被重新衰退,预期为R-基因。用探针MARGA08和MARGA37观察到没有共杂交。这也可能是预期的,因为探针序列是文学性不同的,并且使用靶向不同基序的引物组扩增。鉴于NBS-LRR R-基因的LRR结构域预期更大的多态性,两个RGA探针之间的BAC命令数量的比较支持了这一想法。用底漆对靶向退化激酶2和LRR基序的引物对扩增,并且探针与大量克隆杂交而不是MARGA37,其靶向更保守的NBS P环和GLPL基序。重新验证的BAC克隆中RGA拷贝数分析(表4和图5)显示,除了在三个基因组中占据潜在的多个位点,多个拷贝在两个RGA探针的阳性BACs中也很常见。针对NBS- lrr序列的探针MaRGA08在每个BAC中显示的拷贝数通常比只针对NBS结构域的探针MaRGA37多。考虑到LRR基序中更大的多样性,也许多样化选择通过基因复制导致了NBS-LRR RGA拷贝数的增加。在这样的RGA簇中,可能存在大量的r基因,赋予对特定病原体的不同菌株或不同病原体类群的抗性[48].这种基因组组织还可以代表变形储层,其新的R基因特异性可能会出现。
给定33个连续的穆萨在我们的研究中确定了RGA,进一步测试了额外的探针,代表独特的曲线穆萨BAC文库可能会在这三个基因组中鉴定出更多假定的抗性位点。正在进行鸟枪测序从每个穆萨BAC文库将有助于我们理解NBS-LRR抗性基因区域的组织和进化机制,通过比较每个基因组内的等位基因和三个基因组的同源性,并将为遗传标记的开发提供额外的基础。
结论
考虑到商业上存在的低遗传多样性穆萨近年来,随着真菌病害的迅速传播,基因的发现进展缓慢穆萨,进行这种保守的直译序列(COS)标记探讨R-基因发现的方法,以通过标记辅助选择,遗传育种和基因工程提供遗传改善的潜在机会。这项工作,以及报告RGA多样性的第一个大规模分析M.尖锐湿疣加尔各答4,描述了用于跨基因组的单子叶NBS-LRR的RGA和用于遗传作图发达RFLP-RGA标记物的引物设计策略。含RGA-BAC克隆将作为图位克隆的一个资源,将有助于我们的NBS-LRR R基因的组织和进化的理解穆萨A和B基因组。
方法
植物材料和DNA提取
M.尖锐湿疣加尔各答4植物[穆萨种质信息系统(MGIS)登录号NEU0017,属节EUMUSA] [49)被传播体外和温室里的植物。基因组DNA提取使用标准CTAB方法,嫩叶组织浸泡使用Bio 101 Thermo Savant FastPrep®FP 120电池欠压器(Qbiogene,Irvine,CA,USA)。对于RFLP-RGA标记开发,基因组DNA从幼叶中提取M.尖锐湿疣作图群体parentals婆罗洲(NEU 0028 - ITC 0253)和香蕉甜酒立林(NEU 0063 - ITC001),用F1子代一起,使用改良的混合烷基三甲基溴化铵(MATAB)的程序[50].
简并引物组
本研究设计了9个简并引物(图)6、表1).七人基于在非TIR NBS-LRR结构域的单子叶植物来自Genbank获得的序列保守基序设计(引物39F1,1F,3F2和2F [所有向前],和1R1,13R1和11R1 [所有反向])。引物P1C和P3B靶向在双子叶植物的非TIR NBS-LRR蛋白质基序,设计以下番茄PRF(GI:1513144)抗性的蛋白质的比对,番茄I2C-1(GI:2258315),答:芥RPS2(GI:548086)和RPS1(GI:963017),以及秀丽隐杆线虫细胞死亡蛋白质4.附加通用引物靶向TIR和非TIR NBS-LRR R蛋白也进行了测试,其中先前从保守基序设计(表1)存在于几种双子叶植物RGAs (拟南芥,亚麻属,茄属植物lycopersicon,烟草需和Solanum Tuberosum.).通用正向引物由P1A,P1B [26.],以及LM638 [23.],反向引物P3A, P3D [26.]和RNBSD-rev [34].共有14出来的16个可能的引物组合进行了测试(表2).
PCR扩增
每个PCR反应在25μl的体积中进行,含有50ng模板的基因组DNA,2.5毫摩尔MgCl2,0.2毫摩尔dNTP,0.5μM的每种引物,1.25U的Taq聚合酶(Phoneutria,贝洛奥里藏特,MG,巴西),和1×IB Taq聚合酶缓冲液(Phoneutria,贝洛奥里藏特,MG,巴西)。温度循环用下面的程序进行:96℃5分钟;的96℃的35个循环,1分钟,45℃1分钟,和72℃1分钟;加在72℃下的10分钟的额外伸长周期。
克隆和测序
电泳后,使用Qiagen QIAquick PCR纯化试剂盒(Qiagen, Valencia, Ca, USA)对预期大小的PCR产物进行纯化。克隆产品使用pGEM-T-Easy (Promega, Madison, WI, USA)或pCR2.1TOPO (Invitrogen, Carlsbad, CA, USA)。连接用微孔透析膜(0.02 μM)和DH5α脱盐大肠杆菌细胞通过使用GenePulser II(Bio-Rad公司,赫拉克勒斯,CA,USA)设为2.5千伏和200Ω的电穿孔转化的任一,或通过标准热休克协议。选择和操纵的重组质粒克隆下列标准方案[51].正向和反向测序克隆的ABI 377年和3700年进行DNA测序仪(美国应用生物系统公司,培育城市,CA),使用,对于每个各自的音序器,DYEnamic ET终结者循环测序工具包(美国新泽西州Amersham生物科学,皮斯卡塔韦)和ABI BigDye终结者循环测序工具包(应用生物系统公司,促进城市、钙、美国)。
序列分析
处理序列以使用Staden序列分析软件包去除载体和质量差的序列[52].重叠群组件使用CAP3执行的处理53]并通过手动编辑。使用Program Blastx基于序列相似度识别RGA [54,根据当地的数据库答:芥r基因和同系物,如[26.].通过检查Pfam NB-ARC域得到进一步的确认[12.],这是一种植物抗性基因的蛋白质结构域特征,使用程序Hmmer [55].只有NBS结构域激酶2和GLPL基序(所有生成的contigs的共同序列)之间的完整阅读框架被保留。利用MUSCLE程序获得衍生蛋白序列比对[56,包括21个具有代表性的非tir NBS-LRR序列答:芥和43o .漂白亚麻纤维卷.使用MrBayes v.3.1.2程序进行贝叶斯系统发育推断[57],根据琼斯+伽玛模型,使用6-平行蒙特卡罗链106几代人。树形拓扑结构的可靠性是由自举1000倍,施工最后多数一致树的测试。
RGA多态性遗传标记的鉴定
穆萨RGA在父母的限制基因组DNA上杂交M.尖锐湿疣小果属婆罗洲和槟榔里林。使用限制性内切酶调查试验印迹鉴定揭示多态性的探针/酶组合穆萨RGA克隆代表的33个重叠群作为候选RFLP探针。亲本的基因组DNA(91微克)用1040 u各自酶的消化分别德一世,生态房车,后III,接着除去蛋白质和盐。RFLP消化(20微升)通过电泳分离在1%琼脂糖凝胶在30伏在1×TAE缓冲液中的1kb梯运行过夜,一起(Invitrogen公司,卡尔斯巴德,加利福尼亚州,美国)和拉乌尔标记(Appligene,伊尔基希,法国).Southern印迹到Hybond N +膜(Amersham Biosciences公司,皮斯卡塔韦,新泽西州,美国)中的溶液通过用0.25N的HCl脱嘌呤溶液,0.4N的NaOH中和溶液,并0.4N的NaOH溶液调毛细管转移进行的,根据标准方案。试验印迹膜置于预杂交缓冲液(20×SSPE,20%SDS,Denhart的50×,大肠杆菌tRNA (10 mg/ml)),在烤炉中65°C孵育过夜。RGA探针95℃变性5 min, 5 μl标记4 μl (α-32P的dCTP)通过随机六核苷酸使用Megaprime™DNA标记系统RPN 1607(Amersham公司Biosciences公司,新泽西州皮斯卡塔韦,USA)涂底漆DNA合成。探针加入到20ml的杂交溶液(20×SSPE,20个%SDS,Denhart的50×,大肠杆菌tRNA [10 mg/ml], 50%右旋糖酐/H2O),再次在65°C孵育过夜。为了去除杂交后的非特异性背景,在65℃下洗涤20 min,洗涤液1 (5 × SSPE)洗涤2次,洗涤液2 (1 × SSPE和0.1 × SDS)洗涤1次,洗涤液3 (0.1 × SSPE和0.1 × SDS)洗涤1次。在无膜自放射线照相Storm 820成像系统(Amersham Biosciences, Piscataway, NJ, USA)和使用自放射线照相胶片和增强屏在室温下曝光7天后,薄膜风干并观察杂交指纹。检测每个RGA探针/限制性内切酶组合的可评分片段长度多态性。
物理分布穆萨的RGA
两个RGA探针杂交到表示以前构造的BAC文库的高密度集落过滤器M.尖锐湿疣加尔各答4 (AA) [58],M.尖锐湿疣格兰德奈恩(AAA) [59], 和M. Balbisiana.毗桑克鲁图克乌隆(PKW) (BB) [60].探针标记、杂交、洗涤和暴露程序如前所述。对所有积极的BAC克隆鉴定,3μl每个克隆的甘油股票被接种到3毫升的2×欧美介质含有氯霉素(12.5μg / ml),和生长在37°C 14 h。BAC DNA进行了隔离使用标准碱裂解过程试剂盒生物机器人9600(美国试剂盒,瓦伦西亚,CA)。DNA样品(500 ng)用40 U的酶切过夜后III或生态RI (New England BioLabs, Ipswich, MA, USA),加载到1%凝胶和碎片上,在40 V下通过过夜电泳分离。在高密度滤膜上初步鉴定的BAC克隆通过与初始BAC滤膜筛选中使用的相应RGA探针重新杂交验证,使用RGA遗传标记研究中描述的印迹和探针杂交程序。
参考
- 1。
《世界上香蕉的经济、社会和营养重要性:1998年11月10日》。编辑:C. Picq, E. Fouré和E. a . Frison。喀麦隆的杜阿拉,Int