摘要
背景
作物和模式豆科植物的根顶端分生组织Medicago truncatula干细胞系统与被广泛研究的模式植物物种的干细胞系统有显著不同吗拟南芥.在这项研究中,我们使用了AffymetrixMedicagoGeneChip®比较分生组织和非分生组织根的转录组,以鉴定根分生组织特异性候选基因。
结果
利用来自根分生组织和非分生组织的mRNA,我们能够从两个区域鉴定出324和363个差异表达的转录本。利用生物信息学工具开发功能注释Medicago通过基因组测序,我们可以发现在分生根和非分生根中,代谢、信号传导和55个转录因子的差异表达发生了显著变化。
结论
这是第一次全面的分析m . truncatula利用该基因组阵列的根分生组织细胞。这一数据将有助于绘制参与植物开放根分生组织的调节和代谢网络m . truncatula并提供了功能分析的候选。
背景
根和茎尖分生组织(RAM和SAM)在胚胎发生期间建立,并作为植物生长和器官发生的干细胞来源[1].RAM通过高度明确的细胞分裂模式产生初级根的所有组织[2].由分生组织产生的细胞被称为细胞首字母,当它们被添加到不同细胞类型的文件时,它们经历增殖细胞分裂,它们的命运由位置信息决定[3.,4].根中的干细胞生态位由一小群被称为静止中心(QC)的细胞维持。5,6], QC抑制周围细胞分裂,通过生长素外排载体PIN积累生长素产生并维持;在拟南芥的基因PLETHORA1,PLETHORA2,稻草人而且短的根都是QC形成所必需的[6- - - - - -9].生长素和细胞分裂素的相互作用控制RAM的大小,细胞分裂素的作用涉及控制细胞从根分生组织的出口[10,11].
已经发表了几项研究,描述了根分生组织细胞中的基因表达。研究拟南芥已使用绿色荧光蛋白标记的细胞类型和细胞分选,通过微阵列对特定细胞类型和根发育的不同区域的基因表达进行表征[12- - - - - -14].在玉米中也进行了根组织特异性基因表达研究(玉米),在Affymetrix水稻基因组阵列上对近端分生组织、QC和根冠进行显微解剖,并测量基因表达[15].然而模式豆科植物的根Medicago truncatula提出了一个与植物根系发育研究截然不同的系统拟南芥或玉米。在细胞水平上,的根m . truncatula有显著不同的RAM拟南芥.大多数豆科植物的根,不像拟南芥根有一个基本开放的根分生组织[16].开放分生组织与封闭分生组织差异显著;在开放式RAM中,首字母不明显,这表明两种类型RAM之间的调节细胞分裂和分化可能存在差异。Hamamoto驾等.[17]的研究表明,具有开放分生组织的根比具有封闭分生组织的根产生独立的活边界细胞和更多的边界细胞。边缘细胞对于菌根和微生物的相互作用,包括豆科和根瘤菌的共生很重要[18和环境感应。
在根器官发生方面,两者差异最为明显m . truncatula和其他模范植物一样,是有能力的m . truncatula根瘤与根瘤菌结合形成不确定的根结节结瘤具有侧根器官发生的几个方面,优点是它是可诱导的,器官发生的部位是可预测的。根器官发生也可诱导m . truncatula在组织培养中加入生长素1-萘乙酸(NAA)。NAA培养7天后根的形成是不可逆的[19]且不需要乙烯感知[20.].因此,形态上的差异m . truncatula根和其他模式种的根,以及对该物种作为根和结节发展模型的兴趣,促使我们进行了我们在这里提出的研究。
结果与讨论
的m . truncatula根分生组织
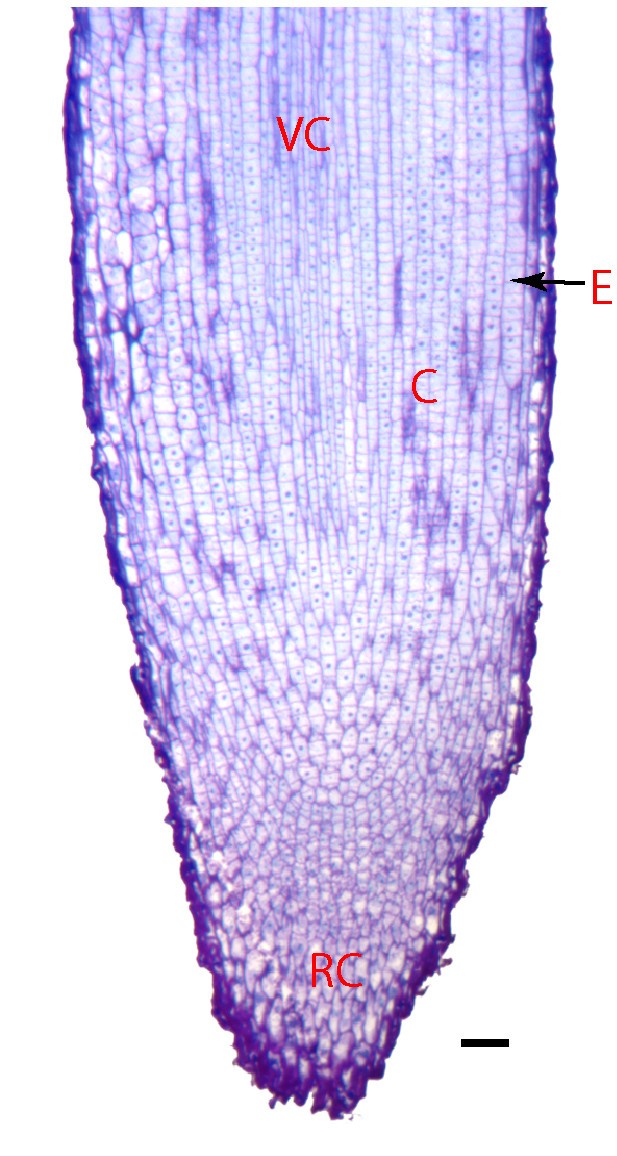
的m . truncatulaRAM显示了基本的开放根分生组织(图1).在细胞分裂的区域,不可能在根尖紧密堆积的新生细胞和伸长细胞中区分首字母。离根尖3毫米处的分生组织部分由一大群未分化的细胞组成,周围环绕着一些分化组织,包括边缘细胞、根冠和细长细胞,这些细胞将形成维管束、中柱鞘、内皮层、皮层和表皮。我们的非分生组织部分,与分生组织相邻一厘米,只包含特征的根组织层;根毛发生在该区域,根瘤菌感染和侧根起根发生在该区域。选择这些部分是为了与早期的蛋白质组学工作相对应Medicago根分生组织[21],因为没有描述特定细胞类型的标记Medicago根分生组织,可用于创建用于细胞类型分析的转基因植物。
研究植物分生根和非分生根的转录组特征m . truncatula我们从发芽后4天独立生长的三组植物的根的分生组织和非分生组织中提取了RNA。使用Affymetrix对三个生物重复进行分析Medicago基因组数组。在Medicago基因组阵列基因芯片的52,000多个植物基因探针中,平均51%(269610个探针组)在与生物素标记的cRNA杂交时产生“当前”信号m . truncatula根源与早期报告一致[22].在GCRMA归一化后,我们鉴定出324个转录本在分生组织中超表达超过2.0倍,363个转录本在非分生组织中超表达。完整的数据集已存入基因表达Omnibus数据库,作为登录GSE8115;规范化数据集可在附加文件中获得1.
虽然我们的分生组织样本由多种细胞类型组成,包括干细胞、伸长和分化细胞以及一些分化的细胞类型,但蛋白质组和转录组数据表明,该材料含有相当比例的干细胞。之前我们通过蛋白质组学分析表明,根分生组织积累的肌动蛋白和微管蛋白明显多于非分生组织,这与分生组织中的细胞增殖一致[21].数组数据还显示了对正交正交的转录m .漂白亚麻纤维卷细胞周期素A2,Medsa; cycA2; 2(Mtr.44839.1.S1_at)在分生根切片中表达大于2倍。细胞周期蛋白A2在细胞周期向DNA合成和复制阶段的过渡中很重要,并在细胞进入有丝分裂时被破坏2在发育过程中,2局限于指定分生组织形成的增殖细胞;基因的表达由生长素直接激活[23,24].因此,高水平的周期蛋白A2转录本可以作为根分生组织中干细胞活性的良好指标。
数组验证
采用实时荧光定量RT-PCR方法检测阵列中10个转录本的表达水平,见表1.分析的转录本是基于同源基因在植物干细胞中已证实或预测的作用,或出于普遍兴趣而选择的;下面将更详细地讨论qRT-PCR验证的转录本的功能意义。
对于所有探测集,表达式比显示与数组数据相同的表达式模式。低丰度转录本在2.0倍处无差异表达(Mtr.32712.1。qRT-PCR结果显示,S1_at和metro .20966.1.S1_at)均有显著表达。虽然qRT-PCR和微阵列表达率在数值上存在差异,其中qRT-PCR显示转录本表达的倍数变化更大,但数据集的Pearson相关系数为0.704 (n = 10)。Morey对这些差异的实验原因进行了回顾等[25].这些结果有助于确认我们在这里提出的微阵列数据的一般准确性。
差分表示探针集的功能分类
的Medicago基因组阵列不包含整个基因组m . truncatula基因组,它是基于一个不完整的基因组序列和来自Medicago truncatula基因指数(MtGI)。在实验过程中,我们注意到包含了国际探测集Medicago基因组注释组(IMGAG)基因预测和相应的EST导致数据重复,并且在制造芯片时MtGI中缺乏一些共识的EST(数据未显示)。基因组阵列上探针集的注释在质量上也有很大差异。
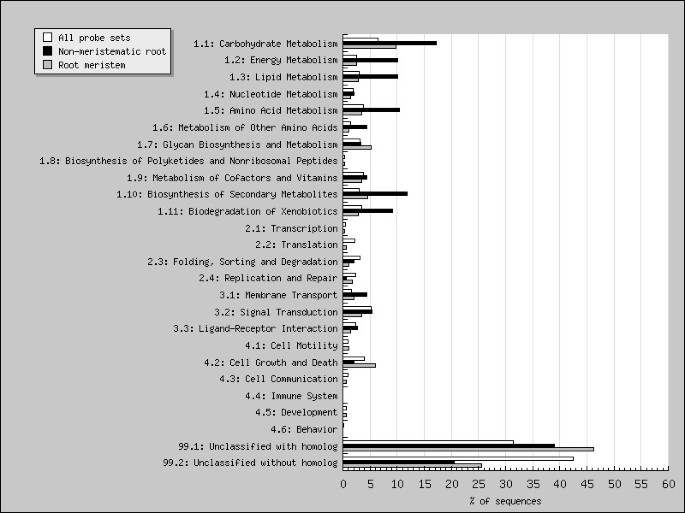
为了解释基因表达结果,我们使用genebin来分配基因差异表达的转录本之间的关系Medicago基于KEGG本体的层次功能分类[26,27].该分析表明,根分生组织和非分生组织的代谢在两段间差异显著,见图2.大约28%的差异表达探针集可以用genebin进行功能分类;值得注意的是,差异表达的转录本分别有7%和3.3%参与碳水化合物代谢和次生代谢产物的生物合成。25.5%的差异表达转录本没有同源物,然而到目前为止,在我们的分析中表达显著改变的最大一类探针集没有同源物。这一结果促使我们使用其他生物信息学策略来注释基因组阵列上的探针集。
进一步细化代谢探针集的功能分类和注释Medicago我们使用PathExpress [28].使用该数据库,我们能够识别分生组织根和非分生组织根中代谢途径在统计学上的显著过度表达,如表所示2.四种代谢途径在分生组织中显著过度表达,10种代谢途径在非分生组织根中过度表达。
我们还通过将数据集与拟南芥信息资源维护的拟南芥基因家族信息数据库进行比较,对芯片进行了注释[29].截至2007年4月,该数据库包含996个基因家族和8331个基因。使用BLAST,我们能够对3159个进行分类Medicago调查这些家庭。分别有69个和71个来自分生组织和非分生组织的差异表达探针集被归为基因家族;在这两个部分中,没有一个家庭的比例明显过高(附加文件)2).最后,基于拟南芥转录因子数据库(Database of Arabidopsis transcription factors, DATF),利用同源关系预测基因组阵列上的转录因子[30.].该分析表明,基因组阵列上的2932个探针集与所描述的植物tf具有序列同源性3.).
碳水化合物代谢与细胞壁生物合成
分生组织和非分生组织根之间最显著的代谢差异是碳代谢,碳在非分生组织根中固定,而糖在分生组织中代谢。patheexpress表明,碳代谢途径的酶转录本在非分生根中显著过表达;它们包括甘油醛-3-磷酸脱氢酶(NADP+) (Mtr.22603.1)。S1_at Mtr.52116.1。S1_at, Mtr.47901.1.S1_x_at),果糖1,6-二磷酸磷酸酶(Mtr.37533.1.S1_at), sedoheptulose 1,7-二磷酸酶(mtr . 40431 .S1_at), RuBisCO小亚基(Mtr.12203.1. S1_at)。S1_at Mtr.19517.1。S1_at Mtr.12202.1。S1_at, Mtr.19516.1.S1_at), 5-磷酸酮糖激酶(Mtr.10464.1.S1_at)和磷酸烯醇丙酮酸羧化酶(Mtr.8683.1.S1_at)。paxpress分析还表明,糖代谢酶转录物在分生组织中过表达,包括ADP葡萄糖热磷酸化酶(mtr .22751. s1_at)、纤维素1,4- β -纤维素生物苷酶(Mtr.45092.1.S1_at)、β -葡萄糖苷酶(Mtr.35316.1.S1_at)、纤维素合成酶(dp -forming) (Mtr.5728.1。S1_at, Mtr.35544.1.S1_at),聚半乳糖醛酸酶(Mtr.45925.1。S1_s_at, mt . 18904.1.s1_at),果胶酯酶(mt .28556.1。葡聚糖内-1,3- β - d -葡萄糖苷酶(Mtr.18873.1);S1_at Mtr.44762.1。S1_s_at Mtr.13666.1。S1_at, Mtr.44304.1.S1_at),二磷酸肌醇-聚磷酸二磷酸酶(Mtr.43946.1.S1_at)。
除了基本的细胞能量需求外,根分生组织中至少有两个过程具有重要的能量需求。向地性需要淀粉在根冠中积累,这是我们的根分生组织样本的组成部分,在被称为静止细胞的细胞器中。拟南芥根中淀粉缺乏或淀粉积累减少的植物对重力的反应较弱[31];静止细胞的重力信号和其他信号转导途径导致根冠生长素在重力响应下的重新分配[32].分生组织中糖代谢的另一个sink是细胞壁生物合成和修饰,最近关于植物细胞壁多糖生物合成的综述见Lerouxel等.[33].paxpress分析表明,参与二苯乙烯、香豆素和木质素生物合成的酶在两个根段均显著过量表达;然而,在这两种情况下,所涉及的酶是血红素过氧化物酶、含有单加氧酶的细胞色素P450和β -葡萄糖苷酶的多种亚型。这些酶包含常见的催化结构域,并可能参与许多活性氧产生和解毒的细胞过程,如抗坏血酸和赤氨酸代谢以及戊糖和葡萄糖醛酸的相互转化,在PathExpress分类中,它们在非分生根中也有过多的表达。更具体地说,与细胞壁生物合成有关的纤维素合成酶在分生根中上调。细胞壁可塑性也是分裂和延长细胞所必需的[34,35],我们还发现了细胞壁修饰果胶酯酶、聚半乳糖醛酸酶和扩张素的转录本(mt .20976.1。S1_at Mtr.22752.1。S1_s_at Mtr.47780.1。S1_at、Mtr.9830.1.S1_at)在分生根中含量显著高于前者。
RAM和SAM都不是光合作用,因此它们的状态和碳水化合物的吸收是值得注意的。棱角等[36]将碳水化合物代谢与分生组织细胞形成叶子的最早阶段联系起来。他们发现,在形成叶原基的细胞区域,分生组织细胞表达ADP葡萄糖焦磷酸化酶转录物,并以更高的频率积累淀粉。根据他们的数据,他们还提出糖可能调节分生组织中编码酶的基因的表达,这些酶可以影响糖代谢。我们的分生组织转录数据显示,ADP葡萄糖焦磷酸化酶的表达量超过2倍,蔗糖合成酶的表达量超过1.5倍。数据从格斯-蔗糖合酶报告在m . truncatula证明了蔗糖合酶在根和根瘤分生组织以及通过与根瘤菌和内生菌根结合而被激活分裂的细胞中的表达[37].糖在RAM基因表达修饰中的作用及其与生长素的关系值得进一步研究。
类黄酮
黄酮类化合物在植物根瘤发育的某些方面具有重要作用m . truncatula,对查尔酮合酶(催化类黄酮途径第一步的酶)的rnai -敲除分析表明,在缺乏内源类黄酮的情况下,植物可以保持活跃的根和侧根分生组织,但不能启动根瘤[38].这项工作还表明,缺乏黄酮类化合物的根具有更高的极性生长素运输速率(PAT),并表明黄酮类化合物是生长素运输的调节剂,与它们作为内源性生长素运输抑制剂的报道一致[39,40].
我们的数据表明类黄酮及其衍生物在非分生根中的作用,其中PathExpress显示类黄酮生物合成途径显著过度表达。异黄酮还原酶(Mtr.24228.1.S1_at)在非分生根中过表达大于2.0倍,在非分生根中形成侧根,可与根瘤菌共生;我们还证明了该蛋白在非分生组织中的显著积累[21].异黄酮已被证明可以抑制根的形成在体外在m . truncatula[19],在氮缺乏的情况下会诱导产生[41],它们是与根瘤菌建立共生关系所必需的[42].黄酮3',5'-羟化酶(mt .44207.1. s1_at)和二氢山萘酚4-还原酶(mt .31382.1. s1_at)都有助于花青素的产生,也在非分生组织根中大量表达。分析anthocyanninless2突变体的拟南芥提示在根的下表皮组织中花青素的组织特异性积累与根组织的维持有关[43].花青素沉积与根系生长素极性转运之间的关系尚未得到验证。
荷尔蒙和细胞间的通讯
在我们对植物基因家族的分析中,我们可以识别出探针集,这些探针集表明,在分生组织和非分生组织根中,细胞间的通信和对激素的反应存在显著差异。生长素在RAM中的运输是通过一个来自PIN家族的生长素外排载体蛋白系统,已在m . truncatula[44].PIN蛋白以不对称的分布定位于它们控制PAT的细胞基底侧或根尖侧[45],它们的表达和重组对于产生局部生长素梯度也是必不可少的,这在植物发育的许多方面都是必需的。在m . truncatula根,MtPIN2我们的数据还显示了该基因(metro .45124.1. s1_at)的表达,该基因在根分生组织中特异性上调,与报道的AtPIN2蛋白的定位一致,其定位指导生长素从根尖流向伸长区,并在介导向地性反应中起关键作用[46].我们的阵列数据经qRT-PCR证实也表明了这一点MtPIN9(Mtr.49764.1.S1_at)优先表达于非分生根。多药耐药/ p -糖蛋白型ABC转运蛋白也作为生长素外排载体,我们的数据显示三个同源转录本(Mtr.23681.1)过表达。S1_x_at Mtr.23679.1。S1_x_at, mt .43342.1. s1_at)在非分生组织中与强C-末端蛋白序列与拟南芥多药耐药样(凋亡),MDR4,两种转运蛋白最近分别在分生组织近端介导顶瓣和基瓣生长素转运[47].
细胞分裂素也有助于RAM的建立和维持,最近有研究表明,细胞分裂素通过双组分受体组氨酸激酶-转录因子信号通路控制分生细胞分化的速率,决定RAM的大小[48].在RAM中细胞分裂素被检测拟南芥组氨酸激酶3,这导致的表达拟南芥反应调节器转录因子。在我们的根分生组织切片中,我们能够检测到与拟南芥组氨酸激酶5(Mtr.30157.1.S1_at);AHK5在乙烯和脱落酸通过乙烯受体ETR1抑制根伸长的信号通路中扮演负调节因子[49].
受体样激酶(RLKs)在植物发育过程中的许多发育信号通路中都有涉及。我们发现三种RLKs在分生组织中的表达存在显著差异(Mtr.5784.1。S1_at Mtr.1137.1。S1_s_at, mt .413.1. s1_at)和非分生组织中的一个(mt .50901.1. s1_at)。Mtr.1137.1。S1_s_at是CLAVATA1,富含亮氨酸的RLK负责通过与CLAVATA3肽的相互作用来规范SAM。一个类似clavata的通路涉及到RAM的维护,根特异性rlk已经在拟南芥CLAVATA3/ esr相关19肽(CLE19)是一种可能的配体,但由于这一大激酶家族中的冗余性,该途径尚未完全描述[50,51].
在微阵列数据中,我们确定了几种可能的肽激素转录本在根分生组织中高度表达。探针组(Mtr.16722.1.S1_at),经qRT-PCR证实表达1)具有较强的蛋白质序列相似性拟南芥基因魔鬼19是DVL基因家族的一员。一些DVL肽已被证明在叶片发育过程中抑制细胞增殖[52,53,它们的受体是未知的。我们还发现与快速碱化因子(RALF)同源的转录本在分生组织中高度表达(mt . 183001)。S1_at和mt .35639.1. s1_s_at);ralf已被证明在烟草和烟草中起肽激素作用拟南芥[54].这些肽可能有作用m . truncatula分生组织维护。
转录因子
在基因组阵列上的2957个探针集与所描述的植物tf序列同源,37个预测tf在分生组织中上调,18个tf在非分生组织细胞中上调至少2倍(附加文件)3.).在DATF数据库中预测的64个TF家族中,只有21个在分生组织根和非分生组织根中有差异表达3.).其中,9个家族在上调探针组中显著超代表(p≤0.05),非分生组织中没有TF家族超代表。在分生组织中上调的家族有碱基/螺旋-环-螺旋(bHLH)、碱基亮氨酸拉链(bZIP)、生长调节因子(GRF)和GRF相互作用因子(GIF)、APETALA2和乙烯响应元件结合蛋白(AP2/EREBP)、生长素响应蛋白/吲哚乙酸诱导蛋白(AUX/IAA)、GATA因子(C2C2-GATA)、生长素反应因子(ARF)和植物富at序列和锌结合蛋白(PLATZ)。除了bHLH、bZIP和C2C2-GATA结构域含有TF外,显著上调的TF基因家族是植物特异性的。我们使用qRT-PCR方法证实了一些在分生组织中显著积累的tf的表达(表1).
包含分生根表达的tf的FiveAP2/EREPB结构域,包括婴儿BOOM1(BBM) (Mtr.21627.1.S1_at)和2个已描述拟南芥同源体。Mtr.23155.1。S1_at是PLETHORA1和Mtr.45360.1。S1_at是的正交正交向量拟南芥ANTIGUMENTA-LIKE.串联AP2结构域转录因子与植物发育密切相关,而excess和BABY BOOM与根发育密切相关,它们最近被证明是根干细胞鉴定和维持的剂量依赖调节因子[55].这些抄本的积累Medicago根分生组织和分化根中表达的缺失与上述结果一致。
生长素是植物基因表达的关键调控因子,AUX/IAA和ARF转录因子是生长素反应的重要调控因子。AUX/IAA TFs抑制生长素激活基因的表达,直到它们被SCF降解TIR1E3泛素连接酶复合物存在的IAA。在生长素存在时,ARFs可以通过与生长素反应元件结合来激活或抑制转录。两个AUX/IAA转录本在分生组织中高度表达,分别为mtr . 22901 . s1。在地铁16803.1. s1。它们是同源的拟南芥IAA33而且IAA30分别;两者都没有在根中描述的功能作用,但是IAA30在根QC和胚胎成熟过程中表达[12,56].的RAM中有两个arf高度表达m . truncatula, Mtr.13650.1。S1_at和39233地铁。S1_at与的开放阅读框架有相似之处拟南芥ARF8而且ARF10分别。在拟南芥ARF 8已被证明通过调节IAA偶联GH3酶的表达,参与通过负反馈环控制游离IAA的水平[57].ARF10已被证明可以限制蒸馏根中干细胞生态位的大小,从而导致根冠细胞的分化,它由IAA和miR160共同调节[58].
还筛选了与在分生组织中具有描述作用的转录因子不相似的转录因子,包括两个包含基因的基本螺旋-环-螺旋结构域(Mtr.49495.1)。S1_at, mt .24270.1. s1_s_at), PLATZ域(mt .46508.1.S1_at)和AT HOOK域(mt .20966.1.S1_at) tf;PLATZ和AT HOOK含有tf,以前没有发现在植物干细胞中表达。定量RT-PCR证实,所有这些tf都在分生组织中大量积累(表1).
尽管在非分生组织中没有明显的TF家族过度表达,但值得关注的是,在本节中有两个GRAS结构域的TF显著表达。已知一些包含tf的GRAS结构域在根中起作用,最具特征的是拟南芥肝基因稻草人(可控硅)结合短的根是质量控制和内真皮规格所要求的[59],两个包含tf的GRAS结构域也被证明是在Lotus对虾[60].我们的分析表明,GRAS转录本(mtr . 1481 . s1_at)在非分生组织中积累。它是的正交正交向量拟南芥基因侧抑制器(拉斯维加斯);拉斯维加斯已显示抑制辅助分生组织的形成在拟南芥时,该mRNA也显示在根中积累,但未描述突变对侧根发育的影响[61].它可能有抑制侧根形成的作用。
结论
我们描述了根分生组织和非分生组织转录组之间的差异。值得注意的是,它们包括碳和类黄酮代谢、生长素和细胞分裂素信号传递、细胞间通信和基因调控的显著变化。这些数据将有助于绘制参与根分生组织建立和维持的调节和代谢网络,并可能导致更好地理解根干细胞m . truncatula以及其他具有开放分生组织的物种,其中必须有不同的机制来控制分生组织的大小和细胞命运拟南芥.
方法
植物材料
的种子m . truncatula加入A17后,用6%次氯酸盐溶液表面消毒,用无菌蒸馏水冲洗7次。种子在无氮的Fåhraeus培养基上在黑暗的培养皿中发芽24 - 30小时。为了为切片提供完整的主根,将没有任何明显微生物污染迹象的发芽种子转移到新的培养皿中,每个培养皿中有14至16棵幼苗,并在生长室中进一步生长3天,直到根长到3至4厘米,然后出现侧根。每次RNA提取至少需要150株植物。
培养皿垂直放置,每个培养皿的下半部分用Nescofilm r密封,在孵育期间在培养皿之间插入一块黑色薄片,使光线远离根部。在培养皿的盖下放置了一个铝箔隔板,以便进行气体交换。在20℃的生长室中培养,光周期为16小时,光子通量密度为100 mmol m-2年代-186%的相对湿度。
为了比较分生组织和非分生组织的根组织,从3天大的植株上采集根切片。收集距离根尖3mm处含有分生细胞的组织和距离根1cm处含有非分生细胞的组织。所有收获的植物材料立即冷冻在液氮中,并保存在-80°C。
为了进行结构分析,将根固定在磷酸缓冲液和戊二醛中,通过乙醇脱水系列,然后嵌入alalite [62].1.5 μM厚的切片用Leica Ultracut切割,用甲苯胺蓝染色,用Zeiss Axioskop观察。
RNA分离、杂交及数据预处理
使用Qiagen RNeasy植物迷你试剂盒(Qiagen, Valencia, CA, USA)从植物组织中提取和纯化总RNA。总RNA用NanoDrop ND-1000分光光度计定量;吸光度A的RNA260/一个280使用安捷伦2100生物分析仪对> 2.0进行质量检测。
cRNA的制备、杂交和Test3阵列的扫描MedicagoGeneChip®根据制造商的方案(Affymetrix, Santa Clara, CA, USA)进行(在ANU JCSMR生物分子资源中心)。简而言之,从每个RNA样本中提取5 ~ 8 μg,通过寡核苷酸T合成双链cDNA7——(dT)24引物介导的逆转录。使用Enzo BioArray试剂盒(Affymetrix)生成生物素标记的cRNA,使用RNeasy旋转柱(Qiagen)纯化,然后用分光光度计定量。每个生物素标记的cRNA碎片样品取15 ~ 20 μg制备300 μL杂交混合物。将每个样品(100 μL)等分在Test3阵列上杂交(200 μL),以检测样品的质量Medicago基因组数组。用优化的洗涤方案洗涤阵列,用链大卫素/藻红菊酯染色,然后进行抗体扩增,用安捷伦GeneArray扫描仪(Affymetrix)扫描。
为了从微阵列中去除某些系统偏差,原始Affymetrix数据(。用GCRMA (GC content - Robust Multi-Array Average, GC content - Robust Multi-Array Average)算法(ver。2.2.0)包括分位数归一化和方差稳定[63],使用affybioconductor软件包[64].然后以2为基底对重复的归一化平均值进行对数变换,以减小随机误差与信号强度之间的比例关系。差异表达的探测集通过评估日志来识别2与一个标准相关联的两个条件之间的比率t以及(65].所有与a相差超过2倍的探测集t-test p≤0.05为差异表达。
基因组阵列数据分析
功能类别与上调和下调序列显著相关(p≤0.05,使用Bonferroni校正校正),使用GeneBins识别,该数据库提供了基于KEGG本体建模的层次功能分类[66]表示在Affymetrix数组上的探测集序列[67].我们使用PathExpress [68],基于KEGG配体数据库的web工具[69],以检测与代谢途径或子途径相关的探针集是否在差异表达序列集中有统计学上的过代表(p≤0.05)。
此外,Affymetrix的探测集Medicago基因组阵列被分配到TAIR数据库中描述的基因家族(Rhee等, 2003)和拟南芥转录因子数据库(Database of Arabidopsis transcription Factors)提供的转录因子家族[30.]基于它们的序列相似性拟南芥蛋白质。BLASTXx [70]来寻找最佳匹配(E≤108)表示每个探针集的序列(即从公共UniGene集群中最多5'到最多3'探针派生的序列)。将差异表达的序列集与每个基因家族的组成进行比较,以确定某个类别是否在统计上过度代表。对于每个测试,aP-value,表示上调或下调的探针集列表与属于给定基因家族的探针集列表偶然发生交集的概率,使用超几何分布[71].
利用BLAST和多重序列比对分析感兴趣的序列,以识别序列相似的基因和蛋白质拟南芥.在…中识别正交线拟南芥使用AffyTrees [72,73], AffyTrees根据系统发育树自动检测序列直方图。
实时定量PCR
总RNA从3个生物重复序列的组织中分离m . truncatula如上所述,使用Qiagen RNeasy MINI套件(Qiagen)。RNeasy试剂盒方案被修改为使用DNase旋转柱(Qiagen)进行DNase治疗。cDNA合成使用SuperScript™III逆转录酶(Invitrogen),每个样本使用2 μg总RNA,使用寡聚(dT18)引物。对于无逆转录酶对照,添加水代替SuperScript III。对于实时逆转录聚合酶链反应(RT-PCR),使用Primer Express软件设计基因特异性引物(Applied Biosystems, Foster City, CA, USA),并从Sigma Genosys订购。PCR总体积为10 μL,每个引物0.3 μM, 1 × SYBR绿色PCR主液(Applied Biosystems)。反应扩增如下:95°C 10分钟,然后95°C 15秒,60°C 1.5分钟,40个循环。扩增在384孔透明光学反应板(应用生物系统)中进行,使用ABI PRISM 7900序列检测系统(在ANU生物分子资源设施,JCSMR),使用SDS 2.2.2版本软件(应用生物系统)分析原始数据。用0.5% μg mL的3%琼脂糖凝胶电泳和分离曲线分析证实了PCR扩增的基因组DNA和非特异性副产物的缺失-1溴化乙锭。正如Searle所描述的那样进行了正常化等.[74];通过计算MtUBQ10基因之间的差异CT目标基因和CT计算泛素10的相对基因表达量。
定量RT-PCR检测表达水平的转录本如下:
Mtr.20966.1。S1_at (AT HOOK), FP, 5'-TCG AGT AAT CGG AGG TGC TGT -3', RP, 5'-ATG AAG CTC CCC ACT ACA ATT TG-3'。
Mtr.16722.1。S1_at (DVL like), FP, 5'-TCA AAA CTT GAA GTA CAA GCA AGG A-3', RP, 5'-CAC AAC GAC GAA CGA TGT AGA GA-3'。
Mtr.46508.1。S1_at (PLATZ), FP, 5'-TTG CAC TAG TAT TTG TCC TCA TTG C-3', RP, 5'-TGA TAA ACA TAA CGA CGA ACT TGA AGA-3'。
Mtr.32712.1。S1_at (LOB), FP, 5'-TTG CAC TAG TAT TTG TCC TCA TTG C-3', RP, 5'-AGG GCA TTC CTC AGC ACA TC-3'。
Mtr.49764.1。S1_at (MtPIN9), FP, 5'-CCA CTC TTC GCC TTC GAG TT-3', RP, 5'-TGT CCG CGC CTA TAA ATA AGA AGT-3'。
Mtr.49495.1。S1_at (bHLH), FP, 5'-GTC TCC AAG TTG CAG CAA CTT CT-3', RP, 5'-GCA ATA CCC TCG AAG CTG AAA-3'。
Mtr.21627.1。S1_at (AP2/EREBP), FP, 5'-TTG TTG CAT GAA TAG ATG ATT TGA GA-3', RP, 5'-CCT TCT TCA AGA TAC ATG CCA ATG-3'。
Mtr.24270.1。S1_s_at (bHLH), FP, 5'-GAC CAA AGC TGC CAT AGC TGA T-3', RP, 5'-GTC CTG GTC TTG TCC TAG TGA GAA TT-3'。
Mtr.39218.1。S1_at (GIF), FP, 5'-GAG GAA GGG ACA CGC AGT TC-3', RP, 5'-TCT TGT CTC TCA CTC TGC AAC GTT-3'。
Mtr.50542.1。S1_at (GFR), FP, 5'-AGG CAC TGA CAT CAA GTC AAC AA-3', RP, 5'-CTA GCC AGG AAT CTG TGT TCT TTG-3'。
内控基因为UBQ10 (TC100142), FP, 5'-GAA CTT GTT GCA TGG GTC TTG A-3', RP, 5'-CAT TAA GTT TGA CAA AGA GAA AGA GAC AGA-3'。
每个基因在3个生物重复上进行qRT-PCR,每个生物重复重复,不进行RT对照。确定每个样本的相对转录水平,使用UBQ10 cDNA水平归一化,并在三个重复中求平均值,并以2为基底进行对数转换,以减少随机误差与信号强度之间的比例关系。内部控制的显著变化是使用t-test, p≤0.05为差异表达。
参考文献
- 1.
Scheres B, Wolkenfelt H, Willemsen V, Terlouw M, Lawson E, Dean C, Weisbeek P:拟南芥初生根和根分生组织首字母的胚胎起源。发展,1994,120(9):2475-2487。[http://dev.biologists.org/cgi/content/abstract/120/9/2475]
- 2.
Weigel D, Jurgens G:形成茎的干细胞。自然科学学报,2002,26(3):344 - 344。
- 3.
van den Berg C, Willemsen V, Hage W, Weisbeek P, Scheres B:定向信号通路决定拟南芥根分生组织的细胞命运。自然科学学报,1995,27(3):344 - 344。10.1038 / 378062 a0。
- 4.
van den Berg C, Weisbeek P, Scheres B:拟南芥根的细胞命运和细胞分化状态。植物学报,1998,20(4):483-491。10.1007 / s004250050347。
- 5.
van den Berg C, Willemsen V, Hendriks G, Weisbeek P, Scheres B:拟南芥根分生组织细胞分化的短程控制。自然科学,1997,37(3):357 - 357。10.1038/36856。
- 6.
Sabatini S, Heidstra R, Wildwater M, Scheres B:稻草人参与拟南芥根分生组织中干细胞生态位的定位。基因开发,2003,17(3):354-358。10.1101 / gad.252503。
- 7.
Blilou I, Xu J, Wildwater M, Willemsen V, Paponov I, Friml J, Heidstra R, Aida M, Palme K, Scheres B: PIN生长素外排促进网络控制拟南芥根系的生长和模式。自然科学进展,2005,37(4):344 - 344。10.1038 / nature03184。
- 8.
Friml J, Vieten A, Sauer M, Weijers D, Schwarz H, Hamann T, Offringa R, Jurgens G:拟南芥外源生长素梯度的建立自然科学学报,2003,26(6):344 - 344。10.1038 / nature02085。
- 9.
Sabatini S, Beis D, Wolkenfelt H, Murfett J, Guilfoyle T, Malamy J, Benfey P, Leyser O, Bechtold N, Weisbeek P, Scheres B:拟南芥根中模式和极性的生长素依赖远端组织者。光子学报,1999,29(5):463-472。10.1016 / s0092 - 8674(00) 81535 - 4。
- 10.
Werner T, Motyka V, Laucou V, Smets R, Van Onckelen H, Schmulling T:缺乏细胞分裂素的转基因拟南芥植株表现出多种发育改变,表明细胞分裂素在调节茎和根分生组织活性方面具有相反的功能。植物学报,2003,15(11):2532-2550。10.1105 / tpc.014928。
- 11.
Beemster GTS, Baskin TI:发育不良的植物1介导细胞分裂素对拟南芥根细胞分裂和扩张的影响,而不是生长素。中国农业科学,2004,18(4):357 - 357。10.1104 / pp.124.4.1718。
- 12.
Nawy T, Lee JY, Colinas J, Wang JY, Thongrod SC, Malamy JE, Birnbaum K, Benfey PN:拟南芥根系静止中心的转录谱分析。植物细胞学报,2005,17(7):1908-1925。10.1105 / tpc.105.031724。
- 13.
Birnbaum K, Shasha DE, Wang JY, Jung JW, Lambert GM, Galbraith DW, Benfey PN:拟南芥根系基因表达图谱。科学通报,2003,29(6):528 - 528。10.1126 / science.1090022。
- 14.
Brady SM, Orlando DA, Lee JY, Wang JY, Koch J, Dinneny JR, Mace D, Ohler U, Benfey PN:揭示显性表达模式的高分辨率根时空图。科学通报,2007,29(6):528 - 528。10.1126 / science.1146265。
- 15.
蒋凯,张树生,李松,蔡国强,金凯,黄海燕,朱涛,李娟:玉米根冠功能的转录谱分析。植物学报,2006,30(3):343- 353。10.1007 / s11103 - 005 - 4209 - 4。
- 16.
Groot EP, Doyle JA, Nichol SA, Rost TL:双子叶被子植物根顶端分生组织的系统发育分布和进化。中国植物学报,2004,26(1):379 - 379。10.1086/380985。
- 17.
Hamamoto L, Hawes MC, Rost TL:双子叶被子植物根冠边缘细胞的产生和释放与根顶端分生组织类型有关。学报学报,2006,97(5):917-923。10.1093 / aob / mcj602。
- 18.
朱艳,Pierson III LS, Hawes MC:植物根缘细胞中微生物基因的诱导作用。植物营养学报,2004,27(4):379 - 379。10.1104 / pp.115.4.1691。
- 19.
杨晓明,吴涛,王晓明,王晓明,王晓明,王晓明。截叶紫花苜蓿根系形成的相关因素。实验植物学报,2007,58(3):439-451。10.1093 / jxb / erl224。
- 20.
王晓东,王晓东,王晓东,罗菲BG:截叶苜蓿组织培养的根分生组织是由维管源性原形成层样细胞在乙烯调控下形成的。应用实验学报,2006,57(10):2227-2235。10.1093 / jxb / erj187。
- 21.
贺建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,陈建平,等。中国生物医学工程学报,2006,29(3):339 - 344。10.1021 / pr0600677。
- 22.
Tesfaye M, Silverstein KAT, Bucciarelli B, Samac DA, Vance CP: Affymetrix Medicago GeneChip®阵列适用于苜蓿(Medicago sativa)的转录本分析。植物学报,2006,33(8):783-788。10.1071 / FP06065。
- 23.
康多罗西E, Redondo-Nieto M,康多罗西A:泛素介导的蛋白水解。在结节发育过程中,在正确的时间出现在正确的位置。植物营养学报,2005,27(4):379 - 379。10.1104 / pp.105.060004。
- 24.
Roudier F, Fedorova E, Lebris M, Lecomte P, Gyorgyey J, Vaubert D, Horvath G, Abad P, Kondorosi A, Kondorosi E:紫花苜蓿种a2型周期蛋白是生长素调控的,参与分生组织形成,但在endoreduplase相关发育过程中是不可或缺的。植物营养学报,2003,31(3):344 - 344。10.1104 / pp.102.011122。
- 25.
Morey JS, Ryan JC, Dolah FMV:微阵列验证:影响寡核苷酸微阵列与实时PCR相关性的因素。生物工程学报,2006,8:175-193。10.1251 / bpo126。
- 26.
Goffard N, Weiller G: GeneBins:用于分类基因表达数据的数据库。[http://bioinfoserver.rsbs.anu.edu.au/utils/GeneBins/]
- 27.
Thimm O, Blasing O, Gibon Y, Nagel A, Meyer S, Kruger P, Selbig J, Muller L, Rhee S, Stitt M: MAPMAN:一种用户驱动的工具,可以将基因组学数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004,37:914-939。10.1111 / j.1365 - 313 x.2004.02016.x。
- 28.
Goffard N, Weiller G: PathExpress:一种基于web的工具,以识别基因表达数据中的相关途径。[http://bioinfoserver.rsbs.anu.edu.au/utils/PathExpress/]
- 29.
拟南芥基因家族信息。[http://www.arabidopsis.org/browse/genefamily/index.jsp]
- 30.
郭安,何坤,刘东,白松,顾霞,魏林,罗娟:拟南芥转录因子数据库DATF。生物信息学,2005,21(10):2568-2569。10.1093 /生物信息学/ bti334。
- 31.
Kiss JZ, Guisinger MM, Miller AJ, Stackhouse KS:拟南芥淀粉缺失突变体下胚轴向性降低。植物细胞生理学杂志,1997,38(5):518-525。
- 32.
王勇,王建林,王志强,马森,王志强,王志强,王志强,王志强,王志强,马森,王志强,王志强,王志强。学报学报,2005,96(5):737-743。10.1093 / aob / mci227。
- 33.
Lerouxel O, Cavalier DM, Liepman AH, Keegstra K:植物细胞壁多糖的生物合成——一个复杂的过程。植物科学进展,2006,29(6):339 - 344。10.1016 / j.pbi.2006.09.009。
- 34.
Lamport DTA:细胞壁后的生命:失去范式,重新获得范式。中国生物医学工程学报,2001,29(3):344 - 344。10.1007 / PL00000782。
- 35.
Blamey FPC:果胶在控制细胞膨胀中的作用。土壤与营养学报,2003,29(6):357 - 357。
- 36.
杨晓东,王晓明,王晓明,等:植物叶片发育早期碳水化合物代谢的空间调控机制。植物学报,2001,25(6):663-674。10.1046 / j.1365 - 313 x.2001.01002.x。
- 37.
Hohnjec N, Perlick AM, Puhler A, Kuster H:截断紫花苜蓿蔗糖合成酶基因MtSucS1在根瘤感染区和丛枝菌根真菌定殖的根皮层均被激活。分子植物与微生物的相互作用,2003,16(10):903-915。10.1094 / MPMI.2003.16.10.903。
- 38.
Wasson AP, Pellerone FI, Mathesius U:阻断截叶苜蓿黄酮通路抑制根瘤菌对生长素运输的调控。植物细胞学报,2006,18(7):1617-1629。10.1105 / tpc.105.038232。
- 39.
van Noorden GE, Kerim T, Goffard N, Wiblin R, Pellerone FI, Rolfe BG, Mathesius U:长生素对截叶紫花苜蓿蛋白质组变化的影响。植物科学进展,2007,29(2):344 - 344。10.1104 / pp.107.099978。
- 40.
Peer WA, Bandyopadhyay A, Blakeslee JJ, Makam SN, Chen RJ, Masson PH, Murphy AS:拟南芥生长素转运改变类黄酮突变体中生长素外排促进蛋白PIN家族的表达变化及蛋白定位。植物细胞学报,2004,16(7):1898-1911。10.1105 / tpc.021501。
- 41.
Coronado C, Zuanazzi JAS, Sallaud C, Quirion JC, Esnault R, Husson HP, Kondorosi A, Ratet P:氮对紫花苜蓿根类黄酮产生的调控。植物营养学报,2004,18(2):344 - 344。
- 42.
萨勃拉曼尼亚,史泰西,于O:大豆与日本慢生根瘤菌共生的关键是内源异黄酮。植物学报,2006,48(2):261-273。10.1111 / j.1365 - 313 x.2006.02874.x。
- 43.
Kubo H, Peeters AJM, Aarts MGM, Pereira A, Koornneef M:影响拟南芥花青素分布和根系发育的同源箱基因花青素less2。植物细胞学报,1999,11(7):1217-1226。10.1105 / tpc.11.7.1217。
- 44.
杨晓明,张晓明,张晓明,等。截叶苜蓿生长素转运基因的PIN和LAX家族。分子遗传学与基因组学杂志,2004,32(4):432 -432。10.1007 / s00438 - 004 - 1057 - x。
- 45.
Gälweiler L,管c, Müller A, Wisman E, Mendgen K, Yephremov A, Palme K: AtPIN1对拟南芥维管组织生长素转运的调控。科学通报,1998,29(4):344 - 344。10.1126 / science.282.5397.2226。
- 46.
Abas L, Benjamins R, Malenica N, Paciorek T, Wisniewska J, Moulinier-Anzola JC, Sieberer T, Friml J, Luschnig C:拟南芥生长素外排促进因子PIN2的胞内转运和蛋白水解参与根向地性。自然细胞生物学,2006,8(3):249-256。10.1038 / ncb1369。
- 47.
Lewis DR, Miller ND, Splitt BL, Wu G, Spalding EP:拟南芥多药耐药样ABC转运体基因突变对植物向地性的影响。植物学报,2007,19:1838-1850。10.1105 / tpc.107.051599。
- 48.
Dello Ioio R, Linhares FS, Scacchi E, Casamitjana-Martinez E, Heidstra R, Costantino P, Sabatini S:细胞分裂素通过控制细胞分化决定拟南芥根分生组织大小。当代生物学,2007,17(8):678-682。10.1016 / j.cub.2007.02.047。
- 49.
Iwama A, Yamashino T, Tanaka Y, Sakakibara H, Kakimoto T, Sato S, Kato T, Tabata S, Nagatani A, Mizuno T: AHK5组氨酸激酶通过etr1依赖的脱落酸和乙烯信号通路调控拟南芥根伸长。植物细胞生理学报,2007,48(2):375-380。10.1093 /卡式肺囊虫肺炎/ pcl065。
- 50.
Casamitjana-Martinez E:受体激酶信号在拟南芥根分生组织的维持。乌得勒支大学发育遗传学学系;2003年,103 -
- 51.
许娟,刘春梅,刘春梅,刘春梅,刘春梅。拟南芥根分生组织维持调控中CLE19基因的表达与调控。现代生物学,2003,13(16):1435-1441。10.1016 / s0960 - 9822(03) 00533 - 5。
- 52.
Narita NN, Moore S, Horiguchi G, Kubo M, Demura T, Fukuda H, Goodrich J, Tsukaya H:拟南芥小肽ROTUNDIFOLIA4过表达抑制细胞增殖和改变叶片形状。植物学报,2004,38(4):699-713。10.1111 / j.1365 - 313 x.2004.02078.x。
- 53.
温俊杰,李志刚,李志刚:拟南芥小多肽过表达对植物发育的影响。植物学报,2004,37(5):668-677。10.1111 / j.1365 - 313 x.2003.01994.x。
- 54.
Pearce G, Moura DS, Stratmann J, Ryan CA: RALF是植物中普遍存在的一种抑制根系生长发育的多肽。美国国家科学院。2001, 32(3): 344 - 344。10.1073 / pnas.201416998。
- 55.
Galinha C, Hofhuis H, Luijten M, Willemsen V, Blilou I, Heidstra R, Scheres B:拟南芥根系发育中过量蛋白的剂量依赖性调控。《自然》第449卷(7165期),自然出版集团;2007年:1053-1057。10.1038 / nature06206。
- 56.
Braybrook SA, Stone SL, Park S, Bui AQ, Le BH, Fischer RL, Goldberg RB, Harada JJ:叶状子叶don2直接调控的基因为胚胎成熟和体细胞胚胎发生的控制提供了新的视角。美国国家科学院。中国农业科学,2006,39(4):344 - 344。10.1073 / pnas.0511331103。
- 57.
Tian C, Muto H, Higuchi K, Matamura T, Tatematsu K, Koshiba T, Yamamoto KT:拟南芥生长素反应因子8基因的破坏和过表达影响下胚轴伸长和根系生长习惯,提示其可能参与光照条件下生长素稳态的调控。植物学报,2004,40(3):333-343。10.1111 / j.1365 - 313 x.2004.02220.x。
- 58.
王金文,王丽娟,毛玉斌,蔡文军,薛华文,陈晓霞:microrna靶向生长素响应因子对拟南芥根冠形成的控制。植物细胞学报,2005,17(8):2204-2216。10.1105 / tpc.105.033076。
- 59.
崔h, Levesque MP, Vernoux T, Jung JW, Paquette AJ, Gallagher KL, Wang JY, Blilou I, Scheres B, Benfey PN:植物内胚层的一种进化保守机制。科学通报,2007,29(3):344 - 344。10.1126 / science.1139531。
- 60.
Heckmann AB, Lombardo F, Miwa H, Perry JA, Bunnewell S, Parniske M, Wang TL, Downie JA: Lotus japonicus结瘤需要两个GRAS结构域调控因子,其中一个在非豆科植物中功能保守。植物生理学报,2006,42(4):379 - 379。10.1104 / pp.106.089508。
- 61.
Greb T, Clarenz O, Schafer E, Muller D, Herrero R, Schmitz G, ther K:拟南芥LATERAL SUPPRESSOR基因的分子分析揭示了腋生分生组织形成的保守控制机制。基因开发,2003,17(9):1175-1187。10.1101 / gad.260703。
- 62.
Hayat MA:透射电子显微镜的基本技术。学术出版社;1986
- 63.
吴z, Irizarry RA, Gentleman R, Murillo FM, Spencer F:基于模型的寡核苷酸表达阵列的背景调整。技术报告约翰霍普金斯大学生物统计系工作论文,巴尔的摩,MD;2004
- 64.
Gentleman RC, Carey VJ, Bates DM, Bolstad B, Dettling M, Dudoit S, Ellis B, Gautier L, Ge Y, Gentry J, Hornik K, Hothorn T, Huber W, Iacus S, Irizarry R, Leisch F, Li C, Maechler M, Rossini AJ, Sawitzki G, Smith C, Smyth G, Tierney L, Yang JY, Zhang J: Bioconductor:计算生物学和生物信息学的开放软件开发。中国生物医学工程学报,2004,5 (10):R80-10.1186/gb-2004-5-10-r80。
- 65.
Callow MJ, Dudoit S, Gong EL, Speed TP, Rubin EM:微阵列表达谱识别hdl缺陷小鼠中表达改变的基因。中国生物医学工程学报,2000,30(4):344 - 344。10.1101 / gr.10.12.2022。
- 66.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M:破译基因组的KEGG资源。Nucleic Acids Res. 2004, 32(数据库issue): D277-80。10.1093 / nar / gkh063。
- 67.
Goffard N, Weiller G: GeneBins:用于分类基因表达数据的数据库,应用于植物基因组阵列。中国生物医学工程学报,2007,30(4):457 - 457。
- 68.
Goffard N, Weiller G: PathExpress:一种基于web的工具,以识别基因表达数据中的相关途径。核酸决议2007
- 69.
Goto S, Okuno Y, Hattori M, Nishioka T, Kanehisa M:配体:生物途径中化合物和反应的数据库。中国生物医学工程学报,2002,30(1):402-404。10.1093 / nar / 30.1.402。
- 70.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ:基本的局部对齐搜索工具。中华分子生物学杂志,1999,15(3):403-410。
- 71.
赵瑞杰,黄敏,Campbell MJ,董H, Steinmetz L, Sapinoso L, Hampton G, Elledge SJ, Davis RW, Lockhart DJ:人类细胞周期的转录调控与功能。植物学报,2001,27(1):48-54。10.1038/83751。
- 72.
Frickey T, Benedito VA, Udvardi M, Weiller G: AffyTrees:促进Affymetrix植物微阵列芯片的比较分析。植物科学学报,2008,29(3):377- 388。10.1104 / pp.107.109603。
- 73.
Frickey T, Weiller G: AffyTrees。[http://bioinfoserver.rsbs.anu.edu.au/utils/affytrees/]
- 74.
Searle IR, Men AE, Laniya TS, Buzas DM, Iturbe-Ormaetxe I, Carroll BJ, Gresshoff PM: clavata1样受体激酶指导下的结瘤长距离信号。科学通报,2003,29(3):357 - 357。10.1126 / science.1077937。
确认
本研究由澳大利亚研究委员会卓越项目中心(CE0348212)资助。PH获得了澳大利亚研究生奖的支持。我们感谢澳大利亚国立大学电子显微镜组的Lily Shen在显微镜方面的协助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
PH负责所有实验并起草手稿。NG和GFW进行了统计学和生物信息学分析。BGR和NI参与了研究的设计,并协助完成了手稿的准备工作。
电子辅助材料
12870 _2007_229_moesm1_esm.txt
附加文件1:的微数组表达式比率m . truncatula根分生组织(RM)和非分生组织(NMR)。所有定量数据均以log表示2(分生组织:非分生组织)表达率。(txt 6mb)
12870 _2007_229_moesm3_esm.xls
附加文件3:根据拟南芥转录因子数据库成员的同源关系预测,转录因子差异表达≥2.0倍(xls 58 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
霍姆斯,P.,戈法德,N.,威勒,G.F.et al。转录谱分析Medicago truncatula分生根细胞。BMC植物生物学8,21(2008)。https://doi.org/10.1186/1471-2229-8-21
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-21
关键字
- 根分生组织
- 基因组的数组
- 静止中心
- 定量逆转录聚合酶链反应
- 根干细胞