摘要
背景
ABC蛋白是在所有生物体中发现的最大的转运蛋白家族之一。在拟南芥在美国,已经鉴定出120个编码ABC转运体的基因。在这里,MRP子类的一个成员,AtMRP6是描述。
结果
这个基因位于3号染色体上,与AtMRP3和AtMRP7.使用实时定量PCR(RT-Q-PCR)和GUS报告基因,我们发现该基因基本上在早期幼苗发育期间表达,在次级分类和二次根的起始点,特别是在颧骨 - 相对的截面中侧面根引发的细胞。表达水平AtMRP6在镉(Cd)处理后,基因表达显著上调。在索尔克研究所的3个T-DNA插入系中,有2个敲除突变体,ATMRP6.1.和ATMRP6.2.是无效的AtMRP6基因。Cd对突变体叶片发育的影响大于野生型植株,而根伸长和分枝的影响与野生型植株相当。
结论
的位置AtMRP6在3号染色体上,旁边还有两个MRP(所有这些都是由Cd诱导的)表明AtMRP6是涉及金属耐受的集群的一部分,尽管Planta中的其他功能不能被丢弃。
背景
农业和工业活动造成的土壤污染,特别是重金属污染,是影响人类健康的一个主要问题。近年来,植物净化(植物修复)已成为人们深入研究的课题。一些重金属,如铜、铁和锌,是植物生长所必需的低含量元素,但它们在浓度较高时可能会有毒。相反,镉(Cd)、铅和汞等非营养性金属即使在极低剂量下也具有潜在的毒性。尽管如此,它们的毒性因植物种类而异。例如,耐金属植物能够在高度污染的土壤中生长。人们开始了解植物吸收和储存重金属的机制[1].首先在从土壤中动员金属离子后,通过或多或少的特异性通道和/或转运蛋白,将重金属的吸收发生在根细胞中[2- - - - - -4].在发生在细胞质中的第二阶段,金属离子与氨基酸、有机酸、谷胱甘肽或更长的谷胱甘肽衍生肽、植物螯合素(PCs)相结合。当植物接触到Cd时,pc的合成就会增加,这些pc参与根和茎的Cd转运[5].在第三阶段,谷胱甘肽和pc - cd复合物被各种转运体从细胞质中排除到空泡或胞外隔间,其中包括ABC转运体[6,7].
atp结合盒(ABC)超家族是生物体中最大的转运体家族,从细菌到人类[8- - - - - -10].在人类中,ABC转运体受到了相当多的关注,因为它们的缺陷或突变与囊性纤维化和糖尿病等严重疾病相关[11,12]这些转运蛋白能够携带各种基质,包括离子、碳水化合物、脂质、外源性物质、药物和重金属[11,13- - - - - -18].在拟南芥120个编码ABC蛋白的基因已被确认[10]但对于大多数人来说,他们的功能和基板仍然是未知的。最近有多种ABC转运蛋白的特征在于养肝和叶绿素分子转移[19- - - - - -23,病原体和抗生素抗性[24- - - - - -27]、重金属解毒[6,7,28,29,以及控制水的压力通过阴离子和钙通道调节[30.,31].
拟南芥ABC转运蛋白的十五个成员属于多药抗性相关蛋白(MRP)亚家族[32].MRP蛋白显示两个疏水结构域(TMD),包含六个膜跨和两个亲水性,胞质,核苷酸结合结构域(NBD)成双排列。在大多数MRP蛋白中,一个额外的疏水结构域(TMD)0,包括3到5跨膜)存在于转运体的n端部分。在大多数ABC转运体中,ATP在其NBD处的结合和随后的水解提供了底物跨膜转运所需的能量。从结构上看,每个NBD都有一个“Walker A”和一个“Walker B”基序,这两个基序由所有ABC成员和其他atp结合蛋白赋予,以及一个高度保守的C基序或ABC转运蛋白签名,位于两个Walker序列之间,这是特定于ABC转运蛋白的。到目前为止,该亚类的5个成员(AtMRP1到AtMRP5)已被鉴定,AtMRP1、AtMRP2和AtMRP3已被发现具有谷胱甘肽s -共轭转运活性[19,33].在AtMRP2和AtMRP3的情况下,报道了一种附加的叶绿素分解代谢物运输活性[19,20.]有趣的是,AtMRP3还能够补充YCF1的缺失,YCF1是一种ABC转运蛋白,参与酵母中的镉解毒[20.].在足底,AtMRP3由CD治疗上调[28,34,但AtMRP3是cd转运体的证据尚未获得,据我们所知,也没有任何描述Atmrp3在文献中突变到现在。此外,ATMRP4和ATMRP5涉及对气孔运动的控制。更精确的ATMRP5参与水分损失的控制通过阴离子和钙通道的调节[30.,31,35- - - - - -37].在这里,我们报告的表达模式AtMRP6哪一个是三个一组的一部分MRP分离出两个T-DNA插入突变体,在这两个品系的早期发育阶段,观察到对Cd的敏感性增加。
结果
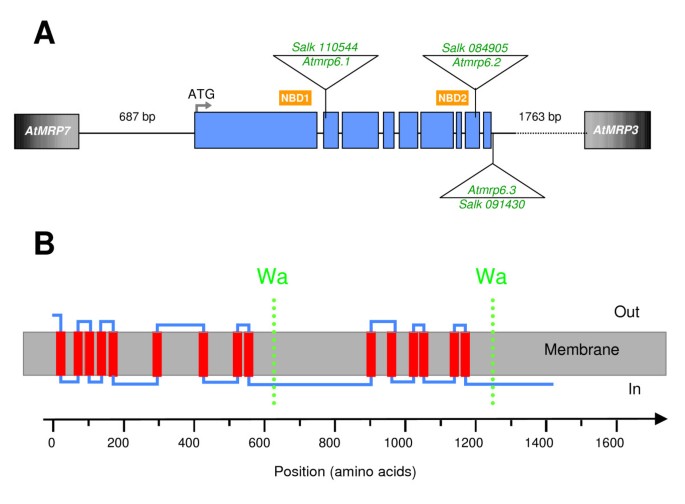
cDNA的分离和蛋白质的组织
AtMRP6(根据Martinoia和col.提出的命名法[32]),采用MR06-NotStart和MR06R-StopNot寡核苷酸引物,RT-PCR直接克隆(表1), cDNA全长4398 bp (GenBank AY052368)。将该cDNA与III号染色体的基因组序列(5200 bp)进行比对,可以推断该基因的基因组结构。AtMRP6在一个5.2 KB的片段上扩展,并间隔成9个外显子。(图1).该cDNA在细胞内是不稳定的大肠杆菌这就要求细菌在30°C的温度下生长,以避免突变。MRP家族的另外两个成员,AtMRP7和AtMRP3,旁边的AtMRP6基因的5'-和3'-端。它们都朝着相同的转录方向。AtMRP7和AtMRP3最接近的基因是什么AtMRP6这一簇可能是由于连续两次基因复制的结果[38].与AtMRP7和AtMRP3相比,AtMRP6的氨基酸同源性平均百分比分别为79.5%和64.0%。这AtMRP6cDNA包含一个开放阅读框,编码1466个氨基酸的多肽,预测分子量为164.4 kDa。基于使用ProtScale的Kyte和Doolittle水动力学图,并根据用于跨膜跨度预测的软件,AtMRP6显示了11 (PredTmr算法)到16 (PHDhtm算法)跨膜螺旋。在使用Aramemnon时,比较了16种不同的算法,提出了跨膜跨度为12的共识序列。然而,在这个预测中,在第一个核苷酸结合域的下游,蛋白质的后半部分只有4个跨膜螺旋,而通常有6个跨膜跨度。HMMTop_V2(非常著名,适合分析ABC转运体)和Phobius提出了一个15个跨膜螺旋的模型。考虑到以下事实i) ABC转运体应该具有内部对称;ii)两种NBD应可接近胞质溶胶;iii)两个NBD不应重叠跨膜区域,我们认为最可能的模型是图中所示的模型1 b,至少有15个跨膜螺旋,6个跨膜螺旋的两半和一个TMD0至少有3个跨膜跨度。
AtMRP6能在哺乳动物细胞中表达,但不能在酵母中表达
为了研究ATMRP6传输MRPS蛋白的经典底物的能力,在酵母和哺乳动物细胞(HEK-293细胞)中实现了cDNA的异源表达。
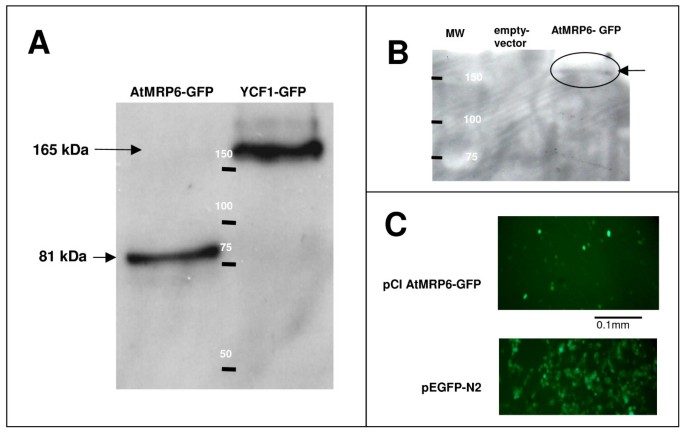
在AtMRP6的c端融合EGFP以定位其在两种表达系统中的表达。由于质粒的不稳定性,特别关注质粒的完整性AtMRP6在大肠杆菌.如图所示2在HEK-293细胞中观察到全尺寸转运体的弱表达。在酵母中,质粒是完整的,但蛋白质经历了一个成熟步骤,导致转运体的截短版本(图1)2).在这些条件下,Δycf1突变体的AtMRP6-GFP(数据未显示)。在HEK-293细胞中,AtMRP6-GFP被完全翻译(图2 b),但由于转染量和细胞表达量较低,表达水平较低(图)2摄氏度),比较例如GFP控制(数据未显示)。在培养基中发生外源Cd存在的细胞存活实验不允许我们区分载体转化的细胞与表达ATMRP6的细胞(未显示的数据)。
AtMRP6在酵母和哺乳动物细胞中的异体表达.(一)三氯乙酸法提取的酵母总蛋白采用western-blot免疫检测GFP。AtMRP6-GFP和YCF1-GFP代表从pYES2转化的酵母细胞中提取的蛋白质AtMRP6-GFP和pYES2YCF1-GFP,分别。阳性对照为YCF1-GFP (165 kDa)。只有AtMRP6的c端部分被保存为表观分子量为81 kDa的多肽(GFP的理论质量为192 kDa)。(B)通过western-blot分析RIPA缓冲液(50 mM Tris-HCl pH 7.4, 150 mM NaCl, 1 mM EDTA, 1% triton,抗蛋白酶鸡尾酒)提取的HEK-293细胞蛋白,免疫检测GFP。空载体和AtMRP6-GFP通道分别代表jetPEI转染pCi和pCi AtMRP6-GFP后HEK-293细胞提取的总蛋白。(C)荧光显微镜下观察到HEK-293细胞中表达AtMRP6-GFP的相应细胞(激发在488 nm,发射在510 nm)。作为对照,仅表达GFP (pEGFP-N2)的细胞显示在下图中。
AtMRP6启动子 - GUS融合基本上在幼苗中表达
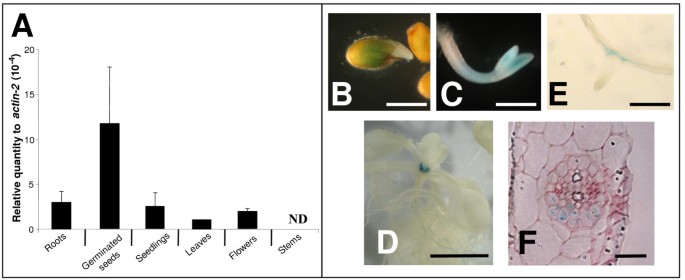
AtMRP6RT-Q-PCR检测基因在不同组织中的表达。如图所示3,AtMRP6与肌动蛋白-2基因相比,在幼苗中,在幼苗中检测到转录物,但与肌动蛋白-2基因相比非常低。在根,叶子和鲜花中也发现表达,但缺乏茎。通过在两种不同启动子区的控制下分析表达β-葡糖醛酸酶报告基因的独立纯合转基因的自然纯合转基因。AtMRP6,一个对应于代苯基区域(687pb)的一个,另一个对应于2.5kb启动子区域重叠的orfAtMRP7.表达这两种结构的转基因植物表现出相同的表达模式。在发芽的种子中观察到GUS报告基因(图)3 b),主要是在子叶中(图3 c),更发达的幼苗在叶基部和顶端分生组织(图3 d).在侧根原序中也检测到表达(图3 e)限于横向根引发的侧面的木琴杆对截面细胞(图3 f).
AtMRP6H2O2和Cd暴露
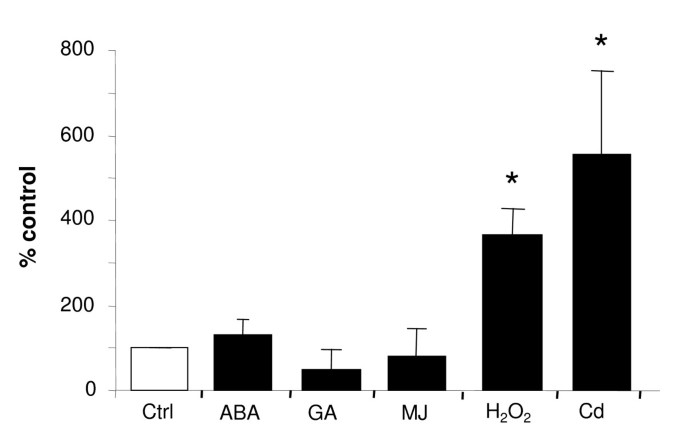
为了确定哪个过程AtMRP6可以参与其中,在拟南芥植物中通过RT-Q-PCR研究了其表达水平的响应许多应力。重大变化AtMRP6在过氧化氢处理后观察到表达水平,但不响应激素(芸苔类固醇,脱硅酸和类似化合物,甘草酸或茉莉酸甲酯,图4)或盐或冷应激(数据未显示)。同时通过CD调节基因的转录组分析[39,我们观察到这一点AtMRP6是诱导最多的ABC转运体基因之一。这种由Cd引起的上调被RT-Q-PCR证实,AtMRP6在30小时阐述5μmcd后在根中上调(图4).
分离和表征Atmrp6迷人的植物
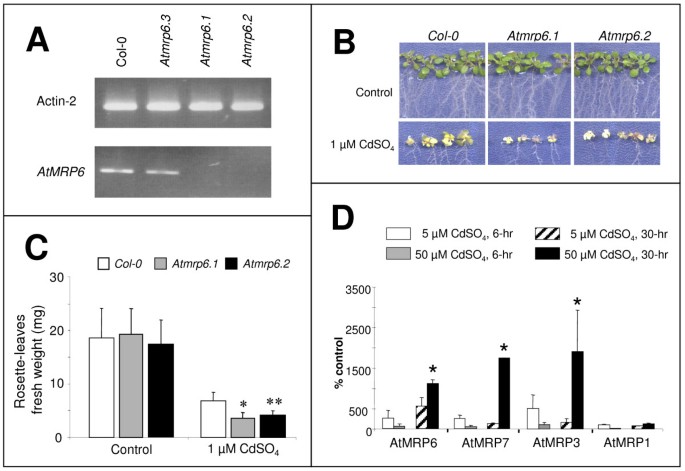
为了说明的功能AtMRP6,三个T-DNA插入敲除线(图1)从SALK研究所收集的标本中分离得到:ATMRP6.1.(索尔克# 110544),ATMRP6.2.(索尔克# 084905)ATMRP6.3.它们位于终止密码子(SALK#091430)的下游。因为在这两种基因中均未检测到全长mRNAATMRP6.1.或ATMRP6.2.,他们被挑选出来进行进一步的分析。采用RT-PCR方法扩增全基因ATMRP6.3.突变体(图5A).
分离,表型特征AtMRP6淘汰植物和协同调控AtMRP3 6 7基因簇.(一)检测AtMRP6不同T-DNA插入系中的转录本通过RT-PCR实验确定,该实验使用插入下游的特异性引物,从不同基因型的根中分离总RNA。(作为对照,RT-PCR使用肌动蛋白-2引物进行。)(B)野生型(Col-0)的生长,Atmrp6.1和Atmrp6.2突变株,在发芽后21天,在存在/不存在1μM CdSO4(C)的情况下,以莲座叶鲜重测量Atmrp6.1和Atmrp6.2突变株的镉敏感性。条形图对应于四个独立实验中八个琼脂平板培养皿的平均值(±SEM)。在每个琼脂平板中(含镉或不含镉),对每个基因型的15株植物进行了分析AtMRP1、3、6和7基因在根中响应镉的比较表达。根据标题中给出的时间和浓度,在水培条件下用硫酸镉处理植物。提取mRNA,并使用针对簇的三个不同基因(AtMRP3、AtMRP6、AtMRP7)的特异引物进行RT-Q-PCR以AtMRP1(At1g30400)作为对照。(C-D)来自独立实验的值表示为对照(未处理植物)的百分比。(**:P<5e-3,*P<8e-3,t检验)。
野生型植物及T-DNA KO植物的生长发育(ATMRP6.1,ATMRP6.2.在糖胁迫、氧化胁迫(H2O2)、激素(油菜素内酯、1-萘乙酸、脱落酸、水杨酸)、持续光照或黑暗,或已知干扰镉进入植物的钙通道抑制剂(数据未显示,[4])。在水培条件下为野生型哥伦比亚生态型(Col-0),ATMRP6.1.和ATMRP6.2.KO突变植物暴露于5或50μmcdso4,引发上调的条件AtMRP6(图4)。对于所有植物基因型,通过ICP-AES分析发现根和叶中的镉含量相似,以及通过HPLC测定的GSH、γ-EC和植物螯合素含量相似。最后,所有基因型在根生长和发育方面表现出同等的抗镉性(数据未显示)。由于AtMRP6基本上是在幼苗中发音的(图3 c - d), Cd效应的调查评价ATMRP6.1.和ATMRP6.2.当种子直接播种在受cd污染的培养基上时,就会产生幼苗。在没有或存在1-5 μM CdSO的情况下,种子萌发3周后,根伸长和分枝4在所有植物基因型中是相同的。然而,ATMRP6.1.幼苗比对照植株受影响更大,特别是在茎水平(图)5B.).在没有Cd的情况下,新鲜重量ATMRP6.1.,ATMRP6.2.与野生型莲座幼苗叶片相似(分别为20.4±5.1 mg、19.5±2.9 mg和19.6±5.0 mg)。相反,经乳糜泻处理后,鲜重ATMRP6.1.和ATMRP6.2.幼苗显著低于野生型(分别为3.7±1.2,4.3±0.8和6.9±1.6)(图)5C;4个独立实验的平均值,每个实验2个重复)。突变体鲜重的下降并不伴随着Cd、GSH、γ-EC和植物螯合素含量的变化。
因此,可以得出无效的结论AtMRP6增加幼苗的CD敏感性。最终功能冗余的可能性AtMRP3 / AtMRP6 / AtMRP7集群了。因为它已经被证明AtMRP3是由镉诱发的[28,在野生型植物中比较了属于该簇的三个MRP基因的表达水平AtMRP1作为一个控制。如图所示5D, 3个基因在植物根中的表达均被Cd上调,而在植物根中的表达水平AtMRP1保持不变。可能的基因复制的基础AtMRP3 / AtMRP6 / AtMRP7簇 [38的表达水平AtMRP3和AtMRP7在里面Atmrp61突变体苗期发育的遗传背景。无论有无乳糜泻,两者之间没有显著差异AtMRP3和AtMRP7观察表达水平。因此,失效AtMRP6没有与过度表达相关联AtMRP3或AtMRP7.
讨论
ABC转运体,特别是来自MRP亚家族的转运体,经常参与各种外生物质的解毒,其中,重金属被发现。在这里,我们试图破译一个以前没有特征的功能A. Thaliana.的基因,AtMRP6它的两侧是另外两个MRPS.染色体III上的基因AtMRP3和AtMRP7.
分析AtMRP6通过RT-Q-PCR和启动子GUS分析表明,该基因表达弱,表达模式有限,主要在萌发的种子和幼苗中。AtMRP6的亚细胞定位在足底是通过两种不同的方法尝试的。首先,CaMV35s转基因植物表达AtMRP6-GFP是生成的。引人注目的是,空向量和AtMRP6反义植物容易获得,但义的构建却不是这样,这可能表明该基因产物在过表达条件下具有毒性。作为解决转运体定位的另一种方法,在叶肉细胞原生质体中转染AtMRP6-GFP采用经典聚乙二醇法。在这些条件下没有观察到荧光,而在单独表达GFP的对照细胞中,在细胞质和细胞核中检测到荧光。然而,AtMRP6的亚细胞定位还不能确定,我们的实验强调了在使用该基因时的困难。此外,酵母中转运体的异体表达是筛选各种突变体互补以及用放射性标记化合物进行通量实验的一种优雅方法。如果是AtMRP6,没有δ的互补ycf1在本研究中可以获得突变体:AtMRP6被截断(图2)我们假设这种蛋白质的截短可能是由于转运体对宿主的毒性。这种宿主毒性的发展也与细菌在37°C时发生的相应质粒的几乎系统性突变一致。在寻找AtMRP6的替代表达系统时,HEK-293细胞被转染。如图所示2 c,成功获得了ATMRP6表达。然而,尽管许多努力(具有各种质粒的测定,如PCI,PCDNA6或PEGFP,Kozak序列的优化,使用不同的阳离子脂转染试剂),表达的产率过于弱,以引发任何助焊剂实验。
本研究通过RT-Q-PCR得到的结果(图5D),并在先前的转录组分析范围内[39),证明AtMRP65 μM Cd在30小时内在根中表达上调AtMRP6,但该基因簇的三个成员也在Cd展示后上调。这些结果与两者的增强水平相一致AtMRP3和AtMRP6转录本,先前在cDNA微阵列实验中报道[34].它已经报告过AtMRP3可以在Cd的解毒中起到重要作用,因为它的异体表达被剥夺了ycf1恢复Cd容忍度[20.].然而,在拟南芥中,尽管cd相关的诱导AtMRP3与短时间接触金属后镉的吸收有关[28],ATMRP3是否参与CD运输或在金属应力等待未来研究后产生的有毒化合物的解毒。如果是AtMRP7,关于其组织表达的数据非常少[38],其功能仍然未知。第四个基因位于MRP簇的上游,也通过Cd处理在根中上调:它编码线粒体定位的丝氨酸乙酰转移酶SAT3或serat2.2 (At3g13110;[40])。该酶催化L-Ser和acetyl-CoA生成O-acetyl-Ser,用于半胱氨酸的合成,半胱氨酸是谷胱甘肽的重要成分。烟草中细菌酶的表达导致半胱氨酸和谷胱甘肽含量增加[41]此外,SAT的高活性与土壤的耐镍性有关菥镍hyper-accumulators [42表明SAT在重金属抗性中起主要作用。最近,SAT3已经在烟草中实现了表达;然而,没有人做过与镉[43].所有这些结果表明,这四个基因(AtMRP3、AtMRP6 AtMRP7和SAT3),在III染色体上具有相同的转录方向,是cd响应簇的成员。这一假设也得到了以下事实的支持:所有这些基因都通过Cd处理在同一器官(根)和同一时间尺度(SAT3 24小时,[40];3个MRP基因需要30小时)。这种镉响应元件的鉴定将有助于植物修复策略,无论是驱动镉转运体或报告基因的表达,这可能被用作污染土壤的生物传感器。
从这个基因的表达模式来看(图3.), T-DNA KO株系在根水平上有一个表型。我们不能排除邻近的MRP基因可能弥补缺失AtMRP6.出于这个原因,表达水平AtMRP3和AtMRP7在野生型和Atmrp6遗传背景。在存在或没有镉的情况下检测到它们的表达水平没有显着差异(数据未显示)。因此,如果发生基因补偿机制Atmrp6在植物中,它涉及到除AtMRP3和AtMRP7或者基础的表达水平AtMRP3/7是否足以弥补缺憾AtMRP6.或者,这两个基因可以在表达的几种细胞中上调AtMRP6而不显著影响其整体根表达水平。筛选几十种条件来观察一种表型Atmrp6KO植物允许我们证明,在Cd存在的情况下,缺失AtMRP6对初生叶的发育有微小但显著的影响,而根的伸长和分枝不受影响。这种表型在3- 5周的植株中消失,可能是因为在这个发育阶段,从根到茎的Cd易位要低得多,正如已经报道的AtMRP3 [34].
结论
我们已经证明了AtMRP6,AtMRP3和AtMRP7,以及SAT3是cd调控基因簇的一部分。窄表达式的侧面AtMRP6植物中的基因基本上在幼苗发育的第一步中,可以解释在T-DNA KO线中观察到的离散表型,并且与植物生长/发育中该转运蛋白的功能更一致,而不是CD排毒。如果我们的结果表明了这一点AtMRP6是一个与金属耐受性有关的基因簇的一部分,并且该基因的失效会导致幼苗对金属耐受性更高,该转运体在植物中的确切功能仍有待确定。
方法
植物材料、生长条件及处理
拟南芥T-DNA插入敲除突变体AtMRP6(At3g13090)来源于Salk研究所图书馆(Salk #110544, Salk #091430和Salk #084905),来源于英国国家园艺协会(NASC)欧洲拟南芥种质中心(Nottingham, GB)。
将表面无菌种子(70%乙醇含0.04% SDS)镀在含有805 μM Ca(NO . 4)的琼脂固化营养液上3.)2,2毫米Kno3., 60 μm k2HPO4, 695 μm kh2阿宝4, 1.1 mM MgSO4, 20 μM FeSO4, 20 μM Na2EDTA, 74nm (NH4)莫7O24, 3.6 μM MnSO4, 3 μM ZnSO4, 9.25 μm h3.薄3.,785 nm cuso4,添加1%蔗糖和0.8%琼脂(SNS溶液)。4°C光照2 ~ 3 d后,23°C (150 μmol m .)光照8小时培养琼脂平板-2年代-1) -在19°C(相对湿度70%)下16小时的黑暗时间。
表达系统中的cDNAISolation和亚克隆
通过TrizoL TM方法提取来自拟南芥植物的总RNA。根据制造商的说明(Amersham),通过使用第一链cDNA合成试剂盒合成互补DNA。使用具有不同引物MR06-NOTSTART的高保真TAQ聚合酶和MR06R-STOPTNOT在表格中显示出PCR1.在Invitrogen公司的PCR - xl - topo中克隆得到noti侧翼PCR产物®并测序。这AtMRP6cDNA序列已保存在GenBank中,登录号为AY052368。为了对AtMRP6进行定位,用GFP对cDNA的c末端进行表位标记。质粒pEGFP-N2(来自BD Biosciences®)和PCR-XL-ATMRP6用于通过已描述的“通过重叠延伸拆分”技术产生ATMRP6-EGFP-N2融合[44].为此,使用的引物有AtMRP6-GFP_A、AtMRP6-GFP_C、AtMRP6-GFP_B和Rev_fin_GFP+NotI(表)1).从PCR-XL-TOPO ATMRP6-GFP到酵母载体PYES2的不同子克隆(Invitrogen®)和哺乳动物表达载体pCI (Promega®)是通过NotI的单一限制实现的。
一代的AtMRP6::格斯线
两个AtMRP6对应于开始密码子上游的基因因子(687bp)和2511bp序列的启动子在基因组DNA上使用特异性引物(表1),插入SbfI和XmaI酶切位点,并与PyroBest taq聚合酶(Takara)结合。PCR产物在pGEM-T easy载体中克隆,测序验证。然后将SbfI-XmaI片段插入用相同酶打开的pBI101植物载体中。拟南芥利用col0转化植株农杆菌肿瘤术.选择幼苗在30μm的卡那霉素板上选择,选择六个拟合具有相似GUS图案的每个结构的六根型线。
GUS染色
植物或幼苗在90%的冰冷丙酮中预固定20分钟,用水清洗,然后用pH 7.2的50 mM磷酸钠缓冲液。组织在染色液(50 mM磷酸钠缓冲液,pH 7.2, 0.1% Triton ×-100, 0.5 mM亚铁氰化钾,0.5 mM铁氰化钾,含2 mM 5-溴-4-氯-3-吲哚基-β-D-glucuronide (X-Gluc))中37°C孵育过夜。染色样品在室温下FAA(50%乙醇,5%乙酸,3.7%甲醛)中固定1小时,并逐步脱水。断面取自Technovit 7100 (Kulzer, Wertheim, Germany)的脱水样品。
鉴定Atmrp6敲除突变体
纯合子T-DNA插入敲除突变体AtMRP6(At3g13090)从SALK #110544 (ATMRP6.1.), Salk #084905 (ATMRP6.2.)及salk# 091430 (ATMRP6.3.)种子获得自NASC(诺丁汉,GB)。在T-DNA杂合子插入突变体谱系中,每个突变体都有对应的野生型,以下标记为Col-0。通过DNA测序确定T-DNA插入位点。通过Southern-blot和在30 μM卡那霉素上的分离分析,鉴定出只有一个T-DNA插入位点。
实时定量rt - pcr
使用Trizol从叶、根、茎、花、幼苗和发芽种子中提取总RNA®根据制造商的说明书(Invitrogen)。用Dnase I (Ambion)从样品中提取基因组DNA。使用第一链cDNA合成试剂盒(Amersham)和oligo-dT引物进行逆转录。pcr使用SYBR Green Mix (Takara)在光学96孔板中进行,使用ABI PRISM 7900HT序列检测系统(应用生物系统)。利用LightCycler Probe Design软件(Roche)为每个基因设计特异性引物。每个PCR反应中都有一个扩增子,通过解离曲线和琼脂糖凝胶加载来证实。标准曲线是由与actin-2(At5g09810)特异性引物和一系列稀释的cDNA模板。每个RNA样本中分析的转录物的相对数量标准化为标准曲线,并从三到四个独立的重复计算平均值。
乳糜泻的治疗
对于早期的Cd暴露,种子直接播种在含有1 μM或5 μM CdSO的琼脂平板上4.使用4天的较长春化期,并在14小时的光照、21°C、10小时的黑暗、18°C循环中生长幼苗21天。收获叶片并测定鲜重。分别通过ICP-AES和HPLC测量镉和硫醇含量。
Cd处理后期,在23°C/19°C相同的光/暗条件下,水培条件下转移3-4周龄的沙土植株,250 μmol.m-2.年代-175%的相对湿度。添加5 μM或50 μM CdSO进行Cd处理4如前所述,在营养液中放置6、24或30小时[39].茎和根分别收获,用ICP-AES(6小时和30小时)定量Cd或用HPLC(30小时)测定硫醇。
镉含量的测定
从CD处理和未处理的植物的新鲜叶片,根和幼苗在50℃下将72小时最小干燥,并在70%HNO中矿化3.使用电感耦合等离子体光学发射光谱(ICP-AES Vista MPX)测定溶液中的Cd浓度。浓度根据样品的干重归一化。
谷胱甘肽、γ-EC和植物螯合素水平
cd处理和未处理根和叶中GSH、γ-EC和PC水平的变化ATMRP6.1.和ATMRP6.2.并且通过如前所述的单溴胺标记的化合物的HPLC分析使用50μg植物材料测定相应的野生型植物。如前所述[45]GSH、γ-EC和PC被量化为硫醇当量的nmol。
参考
- 1.
Clemens S,Palmgren Mg,Kramer U:前方很长途:了解和工程植物金属积累。趋势植物SCI。2002,7:309-315。10.1016 / S1360-1385(02)02295-1。
- 2.
Korshunova YO, Eide D, Clark WG, Guerinot ML, Pakrasi HB:拟南芥IRT1蛋白是一种具有广泛底物范围的金属转运蛋白。植物学报,1999,40:37-44。10.1023 /: 1026438615520。
- 3.
拟南芥IRT2基因编码根外周铁转运蛋白。植物学报,2001,26:181-189。10.1046 / j.1365 - 313 x.2001.01018.x。
- 4.
Perfus-Barbeoch L,Leonhardt N,Vavasseur A,Forestier C:重金属毒性:镉通过钙通道渗透并扰乱植物水状态。工厂J. 2002,32:539-548。10.1046 / J.1365-313x.2002.01442.x。
- 5。
龚建民,李达,施瑞德吉:拟南芥中镉和植物螯合素的根-茎长距离运输。美国国家科学院学报。2003年,100:10118 - 10123。10.1073 / pnas.1734072100。
- 6。
AtATM3与拟南芥的重金属抗性有关。植物营养与肥料学报,2006,30(4):457 - 461。10.1104 / pp.105.074146。
- 7.
Kim DY, Bovet L, Maeshima M, Martinoia E, Lee Y: ABC转运体AtPDR8是一种具有重金属抗性的镉挤压泵。植物学报,2007,50:207-218。10.1111 / j.1365 - 313 x.2007.03044.x。
- 8.
希金斯CF: ABC转运体:从微生物到人。细胞生物学杂志,1992,8:67-113。10.1146 / annurev.cb.08.110192.000435。
- 9.
范维埃HW,Konings Wn:来自细菌的多药运输车给人类:结构和功能的相似之值。Semin癌症Biol。1997,8:183-191。10.1006 / SCBI.1997.0064。
- 10.
陈志强,陈志强,陈志强,等:水稻和拟南芥atp结合盒(ABC)系统的研究进展。中国生物医学工程学报,2004,33(3):449 - 457。10.1016 / j.jmb.2004.07.093。
- 11.
ABC蛋白转变氯离子通道,氯离子通道失效导致囊性纤维化。自然科学进展。2006,44:477-483。10.1038 / nature04712。
- 12.
胰岛β细胞K基因的突变三磷酸腺苷通道亚基Kir6.2 (KCNJ11)和SUR1 (ABCC8)在糖尿病和高胰岛素症中的作用。《嗡嗡Mutat》,2006,27:220-231。10.1002 / humu.20292。
- 13.
Ehrmann M,Ehrle R,Hofmann E,Boos W,SchlösserA:ABC麦芽糖运输车。mol microbiol。1998年,29:685-694。10.1046 / J.1365-2958.1998.00915.x。
- 14.
脂质转运中的ABC转运体。生物化学学报。2000,1486:128-144。
- 15。
Pighin JA, Zheng H, Balakshin LJ, Goodman IP, Western TL, Jetter R, Kunst L, Samuels AL:植物表皮脂质出口需要ABC转运体。中国科学(d辑:地球科学)。10.1126 / science.1102331。
- 16。
哺乳动物atp结合盒型多药耐药蛋白的跨膜转运。中国生物医学工程学报,2006,26(6):449 - 499。10.1152 / physrev.00035.2005。
- 17。
Piddock LJ:多药耐药外排泵-不仅仅用于耐药。微生物学报,2006,4:629-636。10.1038 / nrmicro1464。
- 18.
Sipos G, Kuchler K:耐药和解毒中的真菌atp结合盒(ABC)转运体。药物靶标。2006,7:471-481。10.2174 / 138945006776359403。
- 19.
陆玉萍,李志生,李志生:AtMRP2,一种能够转运谷胱甘肽S缀合物和叶绿素分解物的拟南芥ATP结合盒转运体:与AtMRP1的功能比较。植物学报。1998,10:267-282。10.1105 / tpc.10.2.267。
- 20.
Tommasini R,Vogt E,Fromenteau M,Hortensteiner S,Matile P,Amrhein N,Martinoia E:拟南芥的ABC转运蛋白同时具有谷胱甘肽结合物和叶绿素分解代谢转运活性。Plant J.1998,13:773-780.10.1046/J.1365-313X.1998.00076.x。
- 21.
聊聊,Blakeslee JJ,布沙尔R,李或者Vincenzetti V, Bandyopadhyay, Titapiwatanakun B,同行佤邦,Bailly,理查兹EL, Ejendal KF,史密斯美联社,Baroux C, Grossniklaus U,穆勒,Hrycyna CA, Dudler R,墨菲,Martinoia E:细胞生长素催化的射流拟南芥MDR / PGP运输车AtPGP1。植物学报,2005,44:179-194。10.1111 / j.1365 - 313 x.2005.02519.x。
- 22.
Lin R, Wang H:两个同源atp结合盒转运蛋白AtMDR1和AtPGP1通过介导生长素极性转运调控拟南芥光形态发生和根系发育。植物营养与肥料学报。2005,32(4):449 - 454。10.1104 / pp.105.061572。
- 23.
Terasaka K, Blakeslee JJ, tiapiwatanakun B, Peer WA, Bandyopadhyay A, Makam SN, Lee OR, Richards EL, Murphy AS, Sato F, Yazaki K: PGP4, ATP结合卡式p -糖蛋白,催化拟南芥根中生长素的运输。acta botanica sinica, 2017, 36(5): 772 - 772。10.1105 / tpc.105.035816。
- 24.
connii C, Humphry ME, Hartmann HA, Livaja M, Durner J, Westphal L, Vogel J, Lipka V, Kemmerling B, Schulze-Lefert P, Somerville SC, Panstruga R:白粉病发病机制中植物宿主细胞蛋白的保守需求。《自然》,2006,38:716-720。10.1038 / ng1806。
- 25.
拟南芥质膜ABC转运体AtPDR8的缺失导致病原菌感染后细胞超敏性死亡。植物营养与肥料学报。2006,27(4):429 - 434。10.1093 /卡式肺囊虫肺炎/ pcj001。
- 26.
拟南芥PEN3/PDR8是一种ATP结合盒状转运体,它有助于对通过直接渗透进入的不适当病原体产生非寄主抗性。acta botanica sinica, 2017, 36(6): 741 -746。10.1105 / tpc.105.038372。
- 27。
MenteWab A,Stewart CN:拟南芥的过度表达拟南芥ABC转运蛋白对转基因植物的抗性。NAT BIOTECHNOL。2005,23:1177-1180。10.1038 / NBT1134。
- 28。
植物ABC转运体可能参与镉解毒:cDNA亚微阵列方法。环境科学与技术,2005,31(4):423 - 427。10.1016 / j.envint.2004.10.011。
- 29。
李志刚,李志刚,李志刚:AtPDR12对拟南芥铅抗性的影响。植物营养与肥料学报。2005,32(4):427 - 434。10.1104 / pp.104.058107。
- 30.
Klein M, Perfus-Barbeoch L, Frelet A, Gaedeke N, Reinhardt D, Mueller-Roeber B, Martinoia E, Forestier C:植物多药抗性ABC转运体AtMRP5参与保卫细胞激素信号和水分利用。植物学报,2003,33:119-129。10.1046 / j.1365 - 313 x.2003.016012.x。
- 31.
Suh SJ, Wang YF, Frelet A, Leonhardt N, Klein M, Forestier C, muller - roeber B, Cho M, Martinoia E, Schroeder J: ATP结合盒转运体AtMRP5调节阴离子和Ca2+通道活性在拟南芥中保卫细胞。中国生物医学工程杂志。10.1074 / jbc.M607926200。
- 32.
Martinoia E, Klein M, Geisler M, Bovet L, Forestier C, Kolukisaoglu U, Muller-Rober B, Schulz B:植物ABC转运体的多功能——不仅仅是解毒剂。植物学报。2002,32(4):457 - 461。10.1007 / s004250100661。
- 33.
关键词:拟南芥,AtMRP1基因,谷胱甘肽s -共轭泵,功能分析美国国家科学院学报。1997年,94:8243 - 8248。10.1073 / pnas.94.15.8243。
- 34.
Bovet L,Eggman T,Meylan-Bettex M,Polier J,Krammer P,Marin E,Feller U,Martinoia E:AtmRP的转录水平:ATMRP3的诱导。植物细胞环境。2003年,26:371-381。10.1046 / J.1365-3040.2003.00968.x。
- 35.
Leonhardt N,VavasSeur A,Forestier C:ATP绑定盒式调节器控制脱落酸调节慢性阴离子通道在保护单元中。植物细胞。1999,11:1141-1151。10.1105 / TPC.11.6.1141。
- 36.
Gaedeke N, Klein M, Kolukisaoglu U, Forestier C, Muller A, Ansorge M, Becker D, Mamnun Y, Kuchler K, Schulz B, Mueller-Roeber B, Martinoia E:拟南芥ABC转运体AtMRP5调控根系发育和气孔运动。中国海洋大学学报(自然科学版),2001,20:1875-1887。10.1093 / emboj / 20.8.1875。
- 37.
Klein M, Geisler M, Suh SJ, Kolukisaoglu HU, Azevedo L, Plaza S, Curtis MD, Richter A, Weder B, Schulz B, Martinoia E: AtMRP4(一种保卫细胞质膜abcc型ABC转运体)的破坏导致气孔开放放松,增加干旱敏感性。植物学报,2004,39:219-236。10.1111 / j.1365 - 313 x.2004.02125.x。
- 38.
李志刚,李志刚,李志刚:家族企业:拟南芥多药耐药相关蛋白(MRP) ABC转运体基因。植物学报。2002,26(6):457 - 461。10.1007 / s00425 - 002 - 0890 - 6。
- 39。
Herbette S,Taconnat L,Hugouvieux V,Piette L,Magniette Ml,Cuine S,Auroy P,Richaud P,Forestier C,Bourguignon J,Renou JP,Vavasseur A,Leonhardt N:早期镉反应的基因组转录组分析拟南芥根和射击。生物chimie。2006,88:1751-1765。10.1016 / J.Biochi.2006.04.018。
- 40.
川岛CG, Berkowitz O, Hell R, Noji M, Saito K:拟南芥硫同化途径关键步骤丝氨酸乙酰转移酶基因家族的特性和表达分析。植物营养与肥料学报。2005,32(4):429 - 434。10.1104 / pp.104.045377。
- 41.
Harms K, von Ballmoos P, Brunold C, Höfgen R, Hesse H:转基因马铃薯植株中细菌丝氨酸乙酰转移酶的表达导致半胱氨酸和谷胱甘肽水平的增加。植物学报,2000,22:335-343。10.1046 / j.1365 - 313 x.2000.00743.x。
- 42.
谷胱甘肽生物合成的增加在thlaspi镍超蓄积体的镍耐受性中起作用。acta botanica sinica(云南植物研究),2004,16(6):593 - 598。10.1105 / tpc.104.023036。
- 43.
转基因烟草中半胱氨酸合酶蛋白复合物的显性负性修饰揭示了其调控功能。acta botanica sinica, 2017, 36(5): 762 - 762。10.1105 / tpc.106.043125。
- 44.
研究结果表明,拟南芥原生质体中锑盐的转运与人多药耐药相关蛋白1 (MRP1/ABCC1)的表达有关。中国海洋大学学报(自然科学版),2006,33(3):457 - 461。10.1016 / j.febslet.2006.11.051。2006年11月29日。
- 45.
Sauge-Merle S, Cuine S, Carrier P, Lecomte-Pradines C, Luu DT, Peltier G:表达拟南芥植物螯合酶的工程细菌细胞中有毒金属积累的增强。应用环境微生物学报,2003,19(4):489 -494。10.1128 / aem.69.1.490 - 494.2003。
- 46.
Tusnady GE, Simon I: HMMTOP跨膜拓扑预测服务器。生物信息学。2001,17:849-850。10.1093 /生物信息学/ 17.9.849。
致谢
作者希望感谢ICP分析的ICP分析P. Soreau和P.Ireoy(CEA Cadarache,法国的P.Irichaud博士,以及HPLC测量的S.Cuine(CEA Cadarache,France),以及A. Clayton(英语中心,马赛,法国)纠正英语。该工作得到了法国委员会àl'lecergieatomique的部分支持,由欧洲委员会Marie Curie研究培训网络和859次成本为欧洲委员会的“毒素核查核心环境”计划。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
SG进行了分子生物学研究、GUS报告系的分离和分析。他进行了突变体的分离、表型表征和统计分析。HJ进行了酵母和哺乳动物细胞研究,并进行了cDNA克隆。AV参与了研究设计。NL carri与SG共同完成转基因植物的分子分析和原生质体的瞬时转染。CF负责研究的设计和协调。SG、HJ和CF共同撰写了手稿。所有作者阅读并批准了最终手稿。
作者的原始提交的图像文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介中不受限制地使用、分发和复制,前提是原作被正确引用。
关于这篇文章
引用这篇文章
盖拉德,S.,雅凯,H.,瓦瓦瑟,A.。et al。AtMRP6/ATABCC6., atp结合盒转运基因在幼苗发育早期表达,在镉胁迫下表达上调拟南芥.BMC植物BIOL.8,22(2008)。https://doi.org/10.1186/1471-2229-8-22
收到了:
接受:
出版:
关键字
- 跨膜螺旋
- 核苷酸结合域
- 跨膜跨度
- 拟南芥植株
- Phytochelatin内容