摘要
背景
关于植物对坏死性病原体抗性的遗传基础的知识是不完整的,并且在相对较少的病理系统中有特征。本研究从细胞学和遗传学两方面对春黑茎叶斑病引起的抗性进行了研究Phoma medicaginis是一种经济上重要的坏死性病原体Medicago在豆科植物模型中进行了研究m . truncatula.
结果
从宏观上看,SA27063的抗性反应表现为接种后出现小的超敏样斑点,而与A17和SA3054的敏感相互作用表现为坏死病变和扩散的黄化。在早期感染(<48小时)期间,除了SA27063的病原体生长仅限于一个或几个宿主细胞外,抗性基因型和易感基因型之间没有观察到独特的细胞学差异。在这两种相互作用中都产生活性氧中间体和酚类化合物,并发生细胞死亡。两个F2在SA27063与两个易感品系A17和SA3054之间建立了抗春黑斑病群体。SA27063与A17的杂交范围比SA27063与SA3054的杂交范围更广,表现为较高的遗传多态性、较低的育性和异常表型2后代。在SA27063 × A17 F2群体中存在极显著的数量性状位点(QTL, LOD = 7.37;P< 0.00001)命名r抵抗necrotrophPhoma米edicaginis一个(rnpm1)基因定位于连锁群4 (LG4)的上臂。rnpm1解释了人群对1-5级感染反应中33.6%的表型方差,并与标记AW256637紧密相关。第二个高度显著QTL (LOD = 6.77;P< 0.00001),rnpm2,在SA27063 × SA3054地图中,位于LG8的下臂。rnpm2标记h2_16a6a和h2_21h11d之间的距离为0.8 cM,解释了29.6%的表型方差。rnpm1与Toll/白介素1受体-核苷酸结合位点-富白氨酸重复序列(TIR-NBS-LRR)基因和抗病蛋白样基因紧密相连,而在参考接入A17的基因组序列中没有明显的抗性基因类似物(RGAs)rnpm2轨迹。
结论
感染后易感相互作用中防御反应和细胞死亡的诱导p . medicaginis提示该病原体不受这些反应的负面影响,并可能促进它们。在两个群体中分别发现了抗性QTL。这两个位点本质上都是隐性的,对于两个独立qtl的存在,最简单的解释是宿主基因型特异性易感位点的出现,可能与未确定的位点相互作用p . medicaginis毒力因子。
背景
Phoma medicaginis是苜蓿春黑茎叶斑病的致病因子(紫花苜蓿),是温带和地中海地区的主要饲料和饲料作物。在美国东北部四个州的研究表明,主要是叶面坏死p . medicaginis,导致估计平均产量损失超过13%。对于发生重大减产的收成,这一数字上升到19%以上[1].
p . medicaginis也会导致模型豆科植物的疾病Medicago truncatula,或桶装药,在澳大利亚用于轮作以提高土壤氮素[2].据报道,在敏感品种中,种子和牧草产量减少,几乎完全落叶和过早死亡[3.,4],受感染品种的种子重量平均减少37.3% [5].化学和培养控制叶面坏死菌p . medicaginis已被证明既昂贵又低效[1],因此需要新的抗真菌品种或更有效的抗真菌控制剂。
自20世纪90年代初以来,抗各种病原体和害虫的抗性基因(R基因)已从大麦、番茄和水稻等重要作物物种中分离出来[Hammond-Kosack et al.综述]。6]],尽管目前已知的大部分R基因都是从模式植物拟南芥中分离出来的。这些倾向于代表与简单孟德尔遗传学相关的定性显性抗性。在真菌病理系统中,这些基因赋予了对生物营养体和半生物营养体的抗性。相比之下,对坏死真菌病原体的抗性通常是定量的。不足为奇的是,人们对耐药的遗传基础了解甚少,研究出的耐药基因相对较少。已报道的那些涉及与宿主选择性毒素的特定相互作用(HSTs, Wolpert等人综述。[7]),在本质上主要是隐性的(即易感性是显性的),可能是由于编码HST靶标的基因的丢失或改变。有证据表明,HST可能通过抵抗基因导致细胞死亡,从而促进超敏反应[8,9].相比之下,在迄今为止分离出的两个坏死抗性基因中,种族是特异性的Hm1玉米解毒基因[10是显性的,而Asc-1番茄长寿保证基因同源性研究[11,12是半显性的。
克隆和表征R基因的遗传工具在大多数豆科植物中都不存在,这使得研究豆科植物抗病的分子基础变得困难。Medicago truncatula紫花苜蓿的近亲,是一个模型系统,拥有一个小的二倍体基因组,目前正在测序,自交配遗传和各种转化系统。的意义m . truncatula在于它对一系列半生物营养体和坏死营养体的敏感性,因此越来越多地被用于研究对诸如丝囊霉属euteiches[13,14],晶状体壳二孢,葡萄孢菌而且b . fabae[15],炭疽菌trifolii[16],球腔菌属pinodes[17],Phoma medicaginis[18),而疫霉medicaginis[19].
抗药性的来源p . medicaginis已在不同的紫花苜蓿属中发现。[20.],以及基因多样化的南澳大利亚研究与发展研究所(SARDI)m . truncatula核心收藏[21].单种子SARDI核心集合m . truncatula筛选了对三种西澳大利亚毒株的抗性p . medicaginis结果表明,SA27063对该菌株具有抗性p . medicaginisOMT5,而A17和SA3054高度敏感[18].在这项研究中,我们从宏观上和细胞学上描述了这些细胞的疾病反应特征。抗性的遗传基础p . medicaginis在m . truncatula与两个不同定位群体中赋予抗性的主要位点的遗传图谱位置一起确定。
结果
抗性和易感种质的宏观表型
Medicago truncatulaSARDI核心系列的入选之前筛选了他们对三个的反应p . medicaginis隔离。入世SA27063耐p . medicaginis而A17和SA3054对OMT5敏感[18].对3周龄SA27063植株叶片进行点接种,真菌局限于接种部位,7-10天后未见霉变或坏死(dpi,图1).在易感相互作用中,真菌成功地穿透宿主细胞并扩散到接种部位以外,并在感染区前面伴随一圈褪绿晕。7-10 dpi时,感染的叶片完全褪绿或坏死,明显的脓毒症(图1 b, e).喷洒接种后也观察到类似的症状:抗性SA27063 (10 dpi;数字1 c);在易感相互作用中,疾病症状在7 dpi时肉眼可见。p . medicaginis在周围的植物组织中定植,导致叶片和茎上肉眼可见的坏死斑点,周围分布着褪绿病(10 dpi;数字1 d).早在10 dpip . medicaginis在易受感染的叶子上产生虫病。
显微疾病症状P. medicaginis OMT5
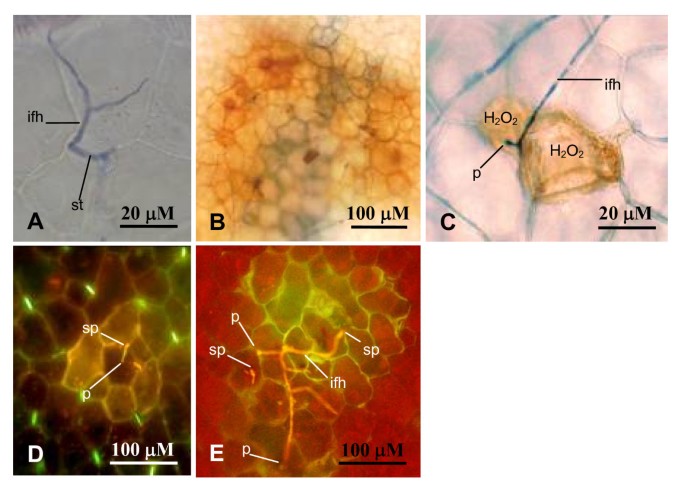
使用台潘蓝或DiOC6进行组织学染色,以检查细胞水平上耐药和易感接种之间感染过程的差异(图2 a e).接种后,p . medicaginis孢子早在接种后6小时就在叶片表面萌发,并能成功穿透寄主细胞。在这两种交互中,穿透尝试通过三种路径发生;直接通过气孔,然后穿透下面的叶肉细胞(图2),直接透过表皮细胞(图2摄氏度),或在表皮细胞之间(图二维).渗透后,真菌在易感接种SA3054和A17上快速定植,而在抗性接种SA27063上菌丝发育局限于单个或少数表皮细胞。红褐色双氨基联苯-四盐酸(DAB)染色检测内源性H2O2在接入SA27063中观察到穿透部位或周围细胞的产生(图2)2 b, c).然而,H2O2与渗透企图不一致,在易感接种中也很明显。在易感和耐药相互作用中,也观察到感染部位周围的自发荧光,表明产生了酚类物质(图2 d, e).
抗加入SA27063Phoma medicaginisOMT5在两个不同的映射种群中
将SA27063与易感品系A17和SA3054杂交,得到2个F2映射的人口。F1两个杂交的个体都有表现p . medicaginisOMT5疾病症状相当于易感亲本,提示隐性抗性。F2在SA27063 × A17 (n = 92)和SA27063 × SA3054 (n = 94)群体中筛选个体的疾病表型。两个种群均与正态分布有显著差异(PW< 0.0001;基于夏皮罗和威尔克检验[22],检验给定样本来自正态分布总体的零假设)。
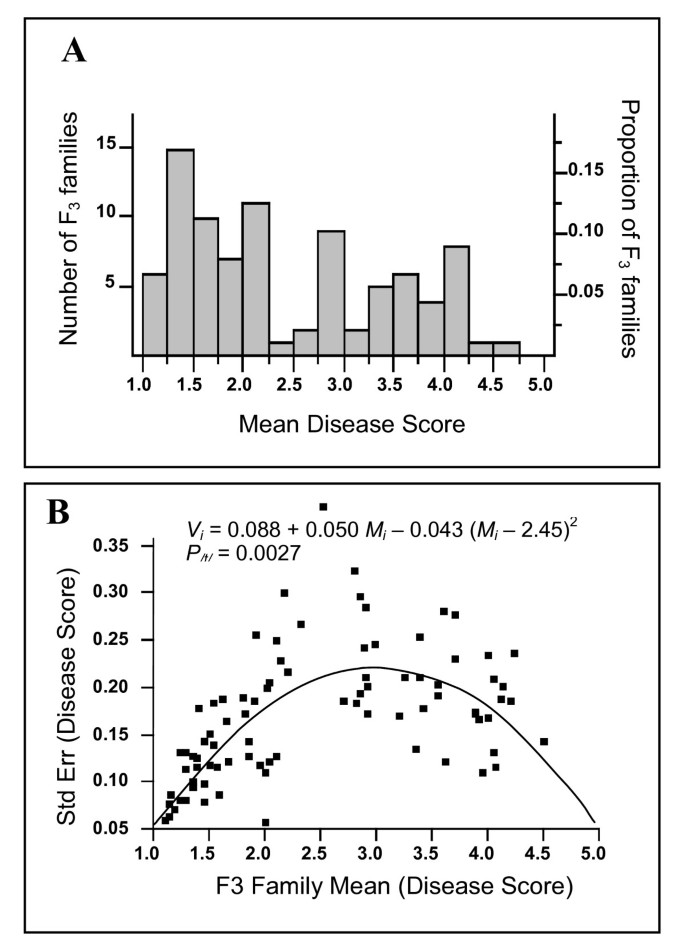
SA27063 × A17群体由于生育力差,加上A17中4号染色体和8号染色体之间存在相互易位,未被选择用于进一步的遗传研究[23],畸变F2个人(表1).在SA27063 × SA3054的杂交中,F3.家族(每个家族的个体数≥16)表型确认个体F2表型。当同样的F3.不同试验间各家庭接种,平均疾病评分无显著变化,表明表型分型方法可靠且可重复。SA27063 × SA3054 F的比例3.按平均疾病得分分布的家庭(图3)与正态分布(PW< 0.0001)。图中描述了每个家庭的均值和方差之间的关系3 b.这种关系是用Fain's检验来评估的,Fain's检验预测了当至少涉及一个具有主要影响的位点时,中间家族的最大变异性模式[24,25].F分析3.家庭疾病评分Fain检验显示二次项极显著(P/t/= 0.0027;数字3 b),表明一个或几个具有主要影响的基因座参与了抗性p . medicaginis.
遗传连锁定位
利用基因标记和微卫星标记建立了SA27063 × SA3054和SA27063 × A17定位群体的遗传图谱。标记最初选择均匀分布在每个连锁组,并从几个已发表的来源获得[26- - - - - -30.].SA27063 × SA3054群体共鉴定出115个标记(n = 94), SA27063 × A17群体鉴定出78个标记(n = 92)。
SA27063 × SA3054和SA27063 × A17分别有46个和58个标记为单核苷酸多态性。这些snp大多转化为裂解扩增多态序列[CAPS, [31]]。用SNapShot (AB)单荧光核苷酸延伸法对不能作为CAPS检测的snp进行基因分型。在SA27063和A17之间有53%的标记有多态性,在SA27063和SA3054之间有35%的标记有多态性。已经提供了SA27063 × SA3054和SA27063 × A17标记的标记多态性数据、引物序列和参考文献[见补充文件]1而且2].
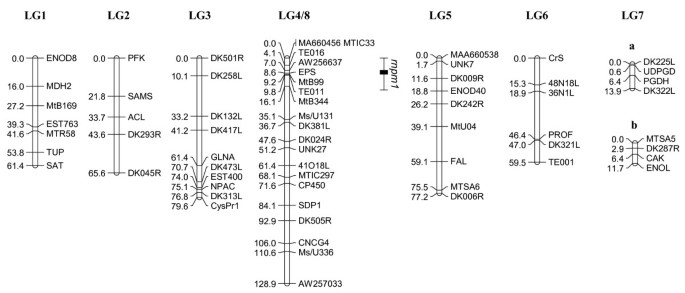
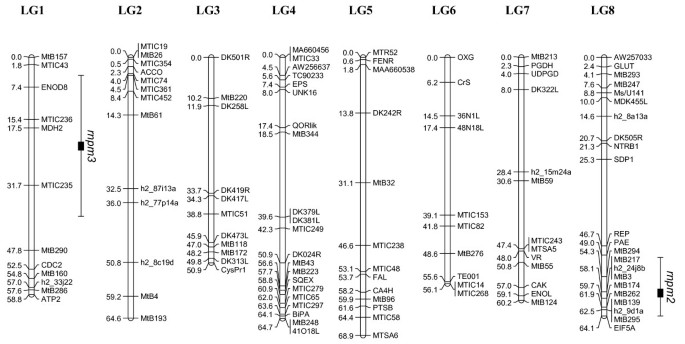
SA27063 × A17和SA27063 × SA3054的遗传图谱如图所示4而且5,分别。正如预期的那样,SA27063 × SA3054图谱由8个连锁基团组成,与染色体的基本数目一致m . truncatula(x = 8)。该地图的总跨度为488.3厘米,标记之间的平均距离为4.2厘米。SA27063和SA3054之间很少有已发表的标记在连锁群2的下半部分有多态性。
与SA27063 × SA3054图谱相比,SA27063 × A17图谱被组织成7个连锁群,LG4和LG8组成一个连锁群(图2)4).这些连锁群以前曾被报道为单一连锁群[29,30.,32].在LG4和LG8之间建立了新的连锁关系,结合A17杂交种的半不育性观察,提供了强有力的证据,证明A17具有相互易位,这与其他杂交种不同m . truncatula登记入册。这种相互易位涉及4号染色体的下臂和8号染色体的下臂[23].所有公开的LG7中间的标记都是单态的,因此LG7被分为两个小的连锁群,分别命名为LG7a和LG7b。SA27063 × A17遗传图谱全长497.8 cM,标记间平均距离6.4 cM。本文所述遗传图谱的连锁群与先前发表的图谱长度相似[29,30.], LG3除外。SA27063 × SA3054中DK501R与CysPR1的距离为50.9 cM, SA27063 × A17中DK501R与CysPR1的距离为79.6 cM。
春黑茎叶斑病抗性的QTL定位m . truncatula
抗性的两个主要数量性状位点(qtl)p . medicaginisOMT5被鉴定出来,每个映射群体中有1个。在SA27063 × A17中,QTL (d= 1.4)与0 (P< 0.00001;Lod = 7.37)。这个位点被命名为r抵抗necrotrophPhoma米edicaginis一个(rnpm1),并位于LG4(图4),与AW256637紧密相连。rnpm1解释了33.6%的人群对感染反应的表型变异p . medicaginisOMT5,基于1-5的范围[18].在SA27063 × SA3054中,QTL效应(d= 1.46)与0 (P< 0.00001;Lod = 6.77)。这个位点被命名为r抵抗necrotrophPhoma米edicaginis两个(rnpm2),并位于LG8(图5),与MtB262紧密相连。rnpm2解释了29.6%的表型变异。在SA27063 × SA3054中,第二个QTL,rnpm3位于连锁群1上。该位点在统计学上不太显著(P= 0.04;LOD = 3.37),影响较小(d= 1.1),解释了总表型方差的19.4%。
良好的映射rnpm2
开始精细的映射rnpm2在8号染色体的长臂上,额外的434个F2在标记MtB294、MtB174和MtB139之间8.2 cM的间隔内进行了重组筛选(共524个)5).F3.从所选重组F2个体具有表型特征。如上所述,轨迹rnpm2解释了人群对真菌感染反应总方差的29.6%,当以1-5级测量时。然而,显示出SA27063样(抗性)表型的重组家族与SA27063纯合等位基因相关rnpm2在78.5%的例子中。耐药亲本始终表现出很少或没有可见的坏死症状,而易感亲本的疾病进展是可变的,范围为2.5 - 4.5。因此,在杂合子F中,疾病评分的方差部分是平均定量易感疾病评分和疾病评分总和的连续函数3.家庭。因此,利用重组断点分析进行精细映射rnpm2从38个信息性F3.族与进一步的多态标记结合以解决重组断点。地点rnpm2标记h2_16a6a和h2_21h11d之间的距离为0.8 cM(图6).
讨论与结论
这项研究的主要目的是检查疾病表型的差异和抗性的遗传基础p . medicaginis在m . truncatula.抗性表型的宏观特征是存在小的超敏反应样斑点,而易感种质则表现出典型的茎和叶病变,在这些病变中形成虫体或子实体。在抗性加入SA27063中,虫病不明显,或在出现虫病后2-3周出现,主要发生在衰老的叶片上。在显微镜下,除了真菌生长局限于一个或几个植物细胞外,在抗性和敏感种质之间的渗透尝试中没有观察到差异,并且没有明显的与抗性相关的独特变化。H的生产2O2在抗sa27063感染的叶片中观察到,但在易感SA3054和A17中也检测到。H2O2已被报道在涉及过敏反应的耐药性中发挥重要作用[33,34].活性氧(ROS)的积聚通常在具有半生物营养或生物营养生活方式的真菌渗透后观察到[16,35],从而导致对这些真菌的抗性,而坏死性病原体可能会刺激ROS的产生和随后的细胞死亡,以促进随后的感染[36].接种叶片组织的检查也显示,在抗性和易感相互作用中,自荧光酚类化合物在感染部位周围积累。酚类化合物,如类黄酮和异类黄酮,是豆科植物防御的重要方面[37],有充分的证据表明,它们的积累是对真菌病原体的反应Medicago物种(38- - - - - -42].Mt16kOLI1plus芯片在12 hpi的先导转录分析[43]显示了与氧化破裂、细胞壁增强、脂质代谢和导致异黄酮产生的苯丙类途径相关的诱导基因的显著变化(L. Kamphuis,未发表数据)。然而,在抗性和易感相互作用中都发生了相似水平的诱导。本文报道的细胞学相似性在燕麦中得到了支持,在敏感基因型中观察到细胞死亡和防御相关反应的诱导,以响应HST维克多林(Sweat等人,2007年综述)[9]),在大麦中,在感染后期观察到易感特异性的第二次ROS爆发[44].详细的表达和代谢分析可能有助于识别HR反应的差异以及防御相关化合物的丰度和组成及其在限制中的作用p . medicaginis殖民。
SA27063 × SA3054的多态创客比例较低,表明该杂交比SA27063 × A17窄。SA27063 × SA3054的总图谱长度(488.3 cM)小于先前报道的遗传图谱[29,30.,32]和SA27063 × A17地图。在LG3上,标记DK501R与CysPR1的遗传距离明显小于SA27063 × A17。LG3对应于染色体3,最大的染色体m . truncatula[45].对这种现象的一种解释可能是SA27063和SA3054是同域的[21],并且可能在第三条染色体上有很长的同源性,导致缺乏可检测到的重组。
数量性状位点(QTL)分析常用于鉴定和表征赋予抗性的位点。QTL映射允许特定的角色R-位点有待描述,可评估部分抗性基因的种族特异性,并分析抗性基因、植物发育和环境之间的相互作用[46].QTL分析p . medicaginisSA27063 × A17抗性定位群体在第4染色体上发现一个QTL (rnpm1在SA27063 × SA3054群体中,8号染色体上有一个QTL (rnpm2),两者都是隐性的。正如结果中所解释的,尽管rnpm2QTL解释了F .菌株中sa27063样或耐药个体的总计算方差(29.6%)2定位群体与SA27063等位基因纯合的个体相关rnpm2在约。80%的例子。在F中3.用于精细定位和预测耐药基因型的家庭,这一比例保持不变,允许rnpm2通过重组断点分析,将标记h2_16a6a与h2_21h11d之间的距离映射为0.8 cM。抗性纯合子SA27063的比例rnpm2个人建议rnpm2上位性是一个或几个顺式或反式作用基因或调节元件,可能位点rnpm3LG1。由于在分离群体中小qtl的检测和准确性很大程度上取决于图谱质量和群体规模,因此增加表达qtl的初始作图群体规模或全基因组分析[47]可能揭示其他次要qtl,并将使相互作用的彻底检查rnpm2而且rnpm3.
我们没有进行精细的绘图rnpm1在SA27063 × A17杂交中,由于育性差和F2后代(表1),这可能会导致特定配子基因型的偏代表。此外,接入体A17进行了相互易位,涉及4号和8号染色体,并表现出花粉活力降低[23].全部已出版m . truncatula遗传图谱使用A17系或一个密切相关系J6作为亲本之一。SA27063 × SA3054遗传图谱是中国第一张遗传图谱m . truncatula不涉及A17作为亲本系,因此有助于在A17衍生的遗传图谱中确定放置不明确的标记的正确位置。倒数易位涉及远端标记rnpm2大约30 cM或更小,因此不太可能影响该QTL在SA27063 × A17子代中的检测。
对于涉及同一抗性亲本的两个杂交后代中存在两个单独的qtl,最简单的解释是基因型特异性易感位点可能与未确定的位点相互作用p . medicaginisOMT5毒力因子或HSTs。的rnpm1该位点与BAC AC144658上的标记AW256637紧密相连,该标记位于一个包含TIR-NBS-LRR和抗病蛋白样基因簇的contig中[48],而在参考接入物A17的基因组序列中没有明显的RGAsrnpm2轨迹。的隐性宿主基因型特异性rnpm1而且rnpm2与特定种族相似Pyrenophora tritici-repentis小麦中毒素不敏感qtl [49],其中多个隔离特异性HSTs与给定的宿主基因型相互作用产生敏感表型。到目前为止,没有p . medicaginis植物毒素已被鉴定在活的有机体内在感染。但是,黄化症状的存在是易感的m . truncatula接种的接种物p . medicaginis在真菌的菌丝形成之前,会产生大量其他毒素Phoma物种表明,易感植物与Rnpm1而且Rnpm2对毒素和这些基因变异敏感(rnpm1而且rnpm2)导致缺乏敏感性。
未来的工作将针对进一步的精细映射和隔离rnpm2,结合基因表达研究,以确定控制抗性的基因和候选基因rnpm2在感兴趣的区域。此外,将鉴定真菌植物毒素在感染过程中可能参与的作用,并评估它们与抗性QTL的相互作用。
方法
生长条件和种群分布图
为了确保种子均匀发芽,用研钵和研杵用沙子打磨种子,转移到铺有吸墨纸的培养皿中,并用无菌水灌溉。种子在4℃下保存48 h,室温下过夜发芽。幼苗播种在虫石中(Richgro Garden Products, Jandakot,西澳大利亚6164),每周使用Optigrow肥料施肥两次(生长技术,O'Connor,西澳大利亚6163),并在温度控制的温室中自然光下生长(白天22°C,晚上18°C)。
父母的m . truncatula从疾病表型筛选中鉴定出的遗传资源被描述为抗(SA27063)或易感(SA3054和A17)p . medicaginisOMT5 [18].SA27063与A17或SA3054之间的杂交作为花粉供体,通过人工杂交程序获得[32].F1收集种子,利用亲本间多态的遗传标记进行杂合度验证。
接种程序和抗性评价
p . medicaginisOMT5接种体通过在麦粉琼脂板(WMA, 12 g麦粉粉,12 g琼脂和1升蒸馏水)上培养分离物制备。U/V下,22℃孵育28-42天。分生孢子用10毫升毫升水孵育板20分钟,悬浮液用玻璃棉注射器过滤。在三叶第四期进行接种。接种方法有两种:用喷枪喷洒至径流(2 × 106孢子/ml, 0.05%吐温20),使用旋转平台,以确保均匀分布在植物表面;用10 μl孢子悬液(1 × 106孢子/ml, 0.05%吐温20),每株5片叶子。这是单叶,第一个三叶的两个小叶,和第二个三叶的两个小叶。模拟接种第2、3三叶第3小叶。为了保证高湿度刺激分生孢子萌发,将植物放置在密封的繁殖盘中48小时。
F2对个体进行定点接种,并在接种后7天(dpi)进行宏观评估,然后在10 dpi重新进行评估,以确认更耐药的疾病反应,如Ellwood等人描述的1(耐药)- 5(易感)量表。[18].F3.每个家庭使用最低16华氏度的喷雾接种3.每个家庭的个体和一个随机的plot设计有两个代表性的F3.每个家庭每个地块。根据Salter和Leath设计的1-5量表,在7和10 dpi时评估疾病症状[50].所有接种均加入亲代控制。
细胞学m . truncatula-P。medicaginispathosystem
用三种不同的染色方法研究m . truncatula- - - - - -p . medicaginis显微镜下的交互:
1)用荧光染料3’3-二己基夏碳氰化物(DiOC6)染色观察真菌浅表生长(3)Sigma-Aldrich)。全叶或部分叶样品浸泡在荧光染料3 DiOC6的新鲜水溶液中(3)50 mg mL-1,由DiOC6制备(3)乙醇原液(0.5 mg mL-1,如Duckett和Read所述,储存在-20°C [51].在2-3分钟的暴露之间,通常会有足够程度的污渍吸收。然后将样品放在载玻片上,用组织从边缘轻轻抽出多余的染色溶液。样品在带有epifluorescence filter B2A (450-490 nm激发过滤器和520 nm阻隔过滤器)的Olympus BH-2荧光显微镜下进行紫外检测。菌丝呈亮黄色,孢子孢子随着年龄的增长呈亮绿色至黄色,表现出超敏反应的植物细胞呈深棕色或深绿色,健康细胞由于完整叶绿体的自身荧光呈现深红色。在紫外光下还能观察到酚类化合物的黄色自发荧光。
2)台盼蓝染色观察真菌浅表生长和细胞内生长。叶子在农民液中固定,直到完全清除。将清除后的叶片浸泡在0.03%台潘蓝染色浓缩液中,与等体积的100%乙醇混合30分钟,然后用2.5 g/mL水合氯醛染色,在Olympus BH-2光学显微镜下观察。
3) H .的生产可视化2O2作为对p . medicaginis渗透时,使用DAB(四盐酸二氨基联苯)染色液[34].将叶柄置于DAB染色液(1 mg DAB/mL H2O pH 3.8, Sigma) 48小时。将叶片固定并在乙醇:氯仿(v/v 4:1)和0.15% TCA的溶液中清除2-3小时。DAB染色后用台盼蓝染色液染色5-10分钟。染色的叶子在奥林巴斯BH-2光学显微镜下进行了观察。
对抗病数据进行统计分析
对疾病评分分布的偏离正态性进行了测试W夏皮罗和威尔克检验[22].Fain检验用于评价F3家庭的均值与家庭内方差之间的关系[25].该测试假设,如果抗性是由一个或几个具有较大影响的基因决定的,那么具有最极端表型的家族很可能是纯合的,在家族内表现出低方差。具有中间表型的家族更有可能是杂合的,在每个家族内表现出较大的差异(对于抗性)。家族之间的关系可以用二次方程来描述,其中一个显著值(P/t/< 0.05)表示存在一个(或几个)主基因。以上所有数据的统计分析均采用jp - in 5.1软件(SAS Institute, Cary, NC)进行。
多态性DNA标记的鉴定
采用不同类型的PCR标记鉴定多态性标记;基于est的内含子靶向标记[30.];内含子中的微卫星[28];BACs测序微卫星[52]及其他已出版的资料[26,29].
采用温度梯度PCR方法,利用标准参比接入确定每个引物对的最佳退火温度m . truncatulaA17作为阳性对照。使用以下基本PCR方案,略有变化:50 ng基因组DNA模板,1 × PCR反应缓冲液,2 mM MgCl2,每个dNTP 0.25 mM,每个引物10 pmol, 1单位Taq DNA聚合酶。热循环条件(略有变化)为:在94°C初始变性2分钟,然后94°C 30秒36次循环,标记特定的退火温度30秒,72°C 60秒,然后在72°C最后延长5分钟。在没有长度或已发表的限制性内切酶多态性的情况下,使用BigDye 3.1终止器周期测序Ready Reaction Mix(应用生物系统公司[AB],福斯特城,加利福尼亚)对具有单个扩增子的PCR产物直接测序,产品在AB Prism 3730 DNA测序仪上运行。DNA序列的多态性通过在Vector NTI Suite 9.0 (Invitrogen, Carlsbad, California)中比对序列进行鉴定。在有识别DNA序列差异的限制性内切酶的情况下,标记作为共显性CAPS [31].使用SNaPshot (AB)检测无限制性内切酶的单核苷酸多态性(SNPs),并使用GeneMapper v. 3.7 (AB)分析。用琼脂糖凝胶电泳分析大片段大小的多态性,并用溴化乙锭染色观察。小片段大小的多态性通过天然聚丙烯酰胺凝胶电泳或AB Prism 3730毛细管测序仪进行分析,使用荧光标记引物和GeneScan™500 LIZ®尺寸标准(AB)
基因分型和连锁分析
来自父母和F2如前所述,个体被提取[21]和多态性标记的基因分型如上所述。应用Pearson卡方分析检验了F . F .杂种共显性遗传的亲本等位基因的分离比与预期的孟德尔分离比2总体,1:2:1,去除高度扭曲的标记。使用Multipoint v1.2软件计算标记顺序和地图距离[53]使用最大重组分数(rf)为0.210和Kosambi映射函数。为了测试每个连锁群(LG)的标记序的稳定性,采用Jackknife重采样方法进行5000次迭代。违反rfs单调增加的标记(即一个标记与其后续邻居之间的rf预期增加的偏差)被检测出来并使用单调函数控制去除。如果概率大于0.90,则接受标记指令。在最可能拟合的时间间隔内(例如,重组事件数量的最小增加),被移除的标记重新附着在遗传图谱上。
QTL分析
采用MultiQTL v2.5进行QTL分析[53]通过应用Lichtenzveig等人所描述的一般区间映射和标记恢复方法[54].假设一个基因座或两个连锁基因座对抗性有影响p . medicaginis进行了评估。首先,假设染色体上的一个位点对抗病性有影响(H1)和零假设(H0基因位点对抗病性无影响。其次,在假设单个位点与两个连锁位点相比对抗病性有影响的前提下,进行了3000次排列试验。LOD得分最高的模型被拟合到QTL中,当模型没有显著差异时,选择更简单的模型(“一个位点-一个性状”)。运行5000个自举样本来评估主要参数的估计值和标准偏差(SD):位点效应、其染色体位置、其LOD评分和解释变异比例(PEV)。
参考文献
Nutter FR, Guan J, Gotlieb AR, Rhodes LH, Grau CR, Sulc RM:量化爱荷华州、俄亥俄州、威斯康星州和佛蒙特州叶片疾病引起的苜蓿产量损失。植物保护学报,2002,26(3):366 - 366。10.1094 / PDIS.2002.86.3.269。
Crawford EJ, Lake AWH, Boyce KG:澳大利亚南部半干旱条件下的一年生紫花苜蓿育种。王志强。2004,29(3):389 - 397。
Barbetti MJ:牧草豆科植物叶片真菌病。J Agric (W Aust)。1983, 1: 10-12。
Barbetti MJ, Nichols PGH:苜蓿和三叶细螺旋藻对一年生紫花苜蓿牧草和种子产量及香豆酚含量的影响。中国植物科学,1998,23:334 - 334。
田间条件下,一年生紫花苜蓿品种对牧草上黄斑蚜和三叶细螺旋藻的抗性研究。中国农业科学,2003,26(3):349 - 349。10.1071 / EA9950209。
Hammond-Kosack KE, Parker JE:破译植物-病原体传播:分子抗性育种的新视角。生物技术学报,2003,14(2):177-193。10.1016 / s0958 - 1669(03) 00035 - 1。
Wolpert TJ, Dunkle LD, Ciuffetti LM:宿主选择性毒素和毒性决定因素:名字中包含什么?植物病理学杂志,2002,40(1):251-285。10.1146 / annurev.phyto.40.011402.114210。
马亚山,鲍丁,杨晓明,陈晓明,王晓明,王晓明:燕麦Pc-2基因对小麦抗冠锈病敏感性的影响及其与燕麦中avenalumin积累的关系。植物病理学杂志,1995,26(4):344 - 344。10.1006 / pmpp.1995.1021。
Sweat TA, Wolpert TJ:拟南芥CC-NBS-LRR基因介导的victorin敏感性需要硫氧还蛋白h5。植物细胞学报,2007,19(2):673-687。10.1105 / tpc.106.047563。
Johal GS, Briggs SP:玉米HM1抗病基因编码的还原酶活性。科学通报,2002,27(4):389 - 397。10.1126 / science.1359642。
Brandwagt BF, Mesbah LA, Takken FLW, Laurent PL, Kneppers TJA, Hille J, Nijkamp HJJ:番茄的长寿保证基因同源物介导了对番茄互孢霉毒素和伏马菌素B1的抗性。中国科学院学报,2000,97(9):4961-4966。10.1073 / pnas.97.9.4961。
sse SD, Gilchrist DG:番茄F8配对系asc位点与番茄互疫病和aal毒素的相互作用。植物病理学杂志,1987,27(3):344 - 344。10.1094 /发朵- 77 - 80。
Colditz F, Braun HP, Jacquet C, Niehaus K, Krajinski F:蛋白质组学分析揭示了Medicago truncatula增加Aphanomyces euteices -耐受性的分子背景。植物分子生物学,2005,59(3):387-406。10.1007 / s11103 - 005 - 0184 - z。
黄志刚,黄志刚,黄志刚:截叶紫花苜蓿对共生隐菌种的反应。植物病理学与植物保护学报,2004,37:59-67。10.1080 / 03235400410001662148。
Ellwood S, Kamphuis LG, Pfaff T, Oliver RP, Samac DA, Foster-Hartnett D, Tivoli B, Onfroy C, Moussart A, Villegas AM, Sillero JC, Rubiales D:叶片病原真菌的接种与生长。截叶苜蓿手册。编辑:Mathesius U. 2006, Ardmore,塞缪尔·罗伯茨诺布尔基金会,[http://www.noble.org/MedicagoHandbook/pdf/InoculationGrowth_FoliarPathogenic.pdf]
Torregrosa C, Cluzet S, Fournier J, Huguet T, Gamas P, Prosperi JM, Esquerre-Tugaye MT, Dumas B, Jacquet C:用细胞学、遗传学和分子分析来描述剪叶苜蓿和三叶炭疽之间的相容和不相容相互作用。植物与微生物相互作用,2004,17(8):909-920。10.1094 / MPMI.2004.17.8.909。
Moussart A, Onfroy C, Lesne A, Esquibet M, Grenier E, Tivoli B:截叶苜蓿(Medicago truncatula)对豌豆(Pisum sativum)和苜蓿(Medicago sativa)三种主要病原体感染的寄主状态和反应。中国植物病理学杂志,2007,27(1):357 - 357。10.1007 / s10658 - 006 - 9071 - y。
Ellwood SR, Kamphuis LG, Oliver RP: Medicago truncatula SARDI核心种质对药蚜抗性来源的鉴定及分离株的多基因分化。植物病理学杂志,2006,29(3):344 - 344。10.1094 /发朵- 96 - 1330。
紫花苜蓿A, Tivoli B, Samac DA, D 'Souza N:截叶苜蓿对卵菌的抗性。截叶苜蓿手册。编辑:Mathesius U. 2006, Ardmore,塞缪尔·罗伯茨诺布尔基金会,[http://www.noble.org/MedicagoHandbook/pdf/OomycetesResistance.pdf]
O'Neill NR, Bauchan GR, Samac DA:紫花苜蓿核心种质资源对药蚜的反应。植物保护学报,2003,27(5):557-562。10.1094 / PDIS.2003.87.5.557。
Ellwood SR, D’souza NK, Kamphuis LG, Burgess TI, Nair RM, Oliver RP:对Medicago truncatula SARDI核心收集的SSR分析显示了整个地中海盆地的大量多样性和不寻常的基因型散布。应用理论与实践,2006,29(5):379 - 379。10.1007 / s00122 - 005 - 0202 - 1。
夏皮罗SS,威尔克MB:正态性方差分析检验(完全样本)。生物计量学学报,2004,27(3):366 - 366。
Kamphuis LG, Williams AH, D’souza NK, Pfaff T, Ellwood SR, Groves EJ, Singh KB, Oliver RP, Lichtenzveig J:截断紫花苜蓿参考位点A17染色体结构异常。植物保护学报,2007,29(2):379 - 379。10.1111 / j.1469-8137.2007.02039.x。
李丹伟,张洪波,张洪波,张晓明,张晓明:鹰嘴豆抗性遗传的生物特征分析。植物病理学杂志,2002,32(4):417-423。10.1094 / PHYTO.2002.92.4.417。
Lynch M, Walsh B:数量性状的遗传学和分析。1997年,美国桑德兰,Sinauer Associates
杨晓明,李志强,李志强,李志强,等:豆科植物微卫星位点的研究进展。Mol Ecol Notes, 2001, 1-3。10.1046 / j.1471-8278.2000.00001.x。
崔坤,文俊华,金金杰,朱红,白纪明,Mudge J, Roe B, Ellis N, Doyle JJ, Kiss GB, Young ND, Cook DR:作物和模式豆科植物的基因组保护。《美国国家科学院学报》上。2004, 41(4): 379 - 379。10.1073 / pnas.0402251101。
Gutierrez MV, Vaz Patto MC, Huguet T, Cubero JI, Moreno MT, Torres AM:截叶苜蓿微卫星在三种主要脉冲作物上的跨种扩增。应用理论,2005,11(7):1210-1217。10.1007 / s00122 - 005 - 1951 - 6。
Mun JH, Kim DJ, Choi HK, Gish J, Debellé F, Mudge J, Denny R, Endré S, Saurat O, Dudez AM, Kiss GB, Roe B, Young ND, Cook DR: Medicago truncatula基因组中微卫星分布:整合遗传和物理图谱的遗传标记资源。中国生物医学工程学报,2006,27(3):344 - 344。10.1534 / genetics.105.054791。
Choi HK, Kim D, Uhm T, Limpens E, Lim H, Mun JH, Kalo P, Penmetsa RV, Seres A, Kulikova O, Roe BA, Bisseling T, Kiss GB, Cook DR:基于序列的截叶苜蓿遗传图谱及其与苜蓿的标记共线性比较。遗传学杂志,2004,166(3):1463-1502。10.1534 / genetics.166.3.1463。
Konieczny A, Ausubel FM:利用共显性生态型特异性pcr标记绘制拟南芥突变图谱。植物学报,1993,4(2):403-410。10.1046 / j.1365 - 313 x.1993.04020403.x。
Thoquet P, Gherardi M, Journet EP, Kereszt A, Ane JM, Prosperi JM, Huguet T:模式豆科植物Medicago truncatula分子遗传连锁图谱:豆科植物比较基因组学和农艺重要基因分离的重要工具。中国生物医学工程学报,2002,22 (1):1 epub -10.1186/1471-2229- 1- 1。
Huckelhoven R, Dechert C, Kogel KH:大麦的非寄主抗性与过氧化氢在小麦白粉病真菌试图渗透部位的爆发有关。分子植物病理学,2001,2(4):199-205。10.1046 / j.1464-6722.2001.00067.x。
Huckelhoven R, Fodor J, Preis C, Kogel KH:白粉病真菌侵袭大麦的超敏细胞死亡和乳突形成与过氧化氢有关,而与水杨酸积累无关。中国农业科学,2004,27(4):457 - 457。10.1104 / pp.119.4.1251。
Glazebrook J:对比生物营养性和坏死性病原体的防御机制。植物病理学杂志,2005,43(1):205-227。10.1146 / annurev.phyto.43.040204.135923。
马志刚,马志刚,唐志刚:活性氧信号通路对病原体的响应。植物营养学报,2006,26(2):373-378。10.1104 / pp.106.079467。
Dixon RA:天然产品和植物抗病性。自然科学,2001,411:843-847。10.1038 / 35081178。
Deavours BE, Liu CJ, Naoumkina MA, Tang Y, Farag MA, Sumner LW, Noel JP, Dixon RA:模型豆科植物紫花苜蓿异黄酮和异黄酮o -甲基转移酶家族成员的功能分析。中国生物医学工程学报,2006,29(3):344 - 344。10.1007 / s11103 - 006 - 9050 - x。
刘佳杰,王玲,刘佳杰,王玲:苯丙素通路与植物防御的基因组学研究。分子植物病理学,2002,3(5):371-390。10.1046 / j.1364-3703.2002.00131.x。
何晓忠,Dixon RA: 7- o -甲基化异黄酮转移酶基因调控增强了紫花苜蓿4'- o -甲基化异黄酮抗病性的生物合成。植物学报,2000,12(9):1689-1702。10.1105 / tpc.12.9.1689。
刘俊杰,胡曼D,苏纳LW,狄克逊RA:紫花苜蓿细胞色素P450 81E酶对异黄酮的区域特异性羟基化作用。植物学报,2003,36:471-484。10.1046 / j.1365 - 313 x.2003.01893.x。
一年生紫花苜蓿属植物对药蚜和三叶细螺旋藻的抗性及其与诱导产生植物雌激素的关系。植物保护学报,2007,29(3):344 - 344。10.1094 / pdi - 91 3 - 0239。
Kuster H, Hohnjec N, Krajinski F, El Yahyaoui F, Manthey K, Gouzy J, Dondrup M, Meyer F, Kalinowski J, Brechenmacher L, van Tuinen D, Gianinazzi-Pearson V, Puhler A, Gamas P, Becker A:基于cdna的Mt6k-RIT宏微阵列的构建和验证,以探索模型豆科植物Medicago truncatula的根内共生。生物技术学报,2004,38(4):531 - 531。10.1016 / j.jbiotec.2003.11.011。
活性氧在大麦对坏死性病原体反应中的作用。中国生物医学工程学报,2003,29(1):457 - 457。10.1007 / s00709 - 002 - 0064 - 1。
Kulikova O, Gualtieri G, Geurts R, Kim DJ, Cook D, Huguet T, de Jong JH, Fransz PF, Bisseling T:截叶苜蓿FISH粗线和遗传图谱的整合。植物学报,2001,27(1):49-58。10.1046 / j.1365 - 313 x.2001.01057.x。
植物的QTL定位和定量抗病性。植物病理学杂志,1996,34:479-501。10.1146 / annurev.phyto.34.1.479。
Luo ZW, Potokina E, Druka A, Wise R, Waugh R, Kearsey MJ:基于affymetrix阵列的SFP基因分型具有鲁棒性,但主要用于检测顺式作用的表达调控因子。中国生物医学工程学报,2007,26(2):339 - 339。10.1534 / genetics.106.067843。
朱红,杨nd, Cook DR:截叶苜蓿TIR和非TIR NBS-LRR抗性基因家族的系统发育和基因组组织。植物微生物相互作用,2002,15(6):529-359。10.1094 / MPMI.2002.15.6.529。
Friesen TL, Meinhardt SW, Faris JD:小麦滞孢病病原系统涉及多种蛋白质宿主选择性毒素和相应的宿主敏感性基因,它们以反向基因对基因的方式相互作用。植物学报,2007,51(4):681-692。10.1111 / j.1365 - 313 x.2007.03166.x。
Salter RM, Leath KL:春背茎和叶斑病抗性。阿尔法法品种特性的标准试验。编辑:Fox CC, Berberet R, Gray FA, Grau CR, Jessen DL, Petersen MA。1992年,北美阿尔法法改进会议,贝茨维尔,马里兰州,第3届
Duckett JG, Read DJ:使用荧光染料3,3'-二己基夏碳氰化物,对与地苔根和ericoid菌根相关的子囊菌真菌进行选择性染色。植物科学学报,1998,18(3):344 - 344。10.1111 / j.1469-8137.1991.tb00976.x。
截叶苜蓿测序资源。[http://www.medicago.org/genome/]
MultiQTL -最好的QTL绘图软件。[http://www.multiqtl.com/]
李丹伟,张洪波,张海波,杨晓明,等:鹰嘴豆花期和抗疫病力的数量性状位点分析。应用理论与实践,2006,29(3):357- 369。10.1007 / s00122 - 006 - 0390 - 3。
确认
这项研究由澳大利亚谷物研究与发展公司(GRDC)资助。我们感谢梅根·乔丹和安吉拉·威廉姆斯的技术援助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
SE和RPO设计了研究。LK和SE进行疾病筛选、表型分型、多态性发现、基因分型和遗传作图。JL提供了统计分析方面的建议。LK, JL和SE分析了数据。
电子辅助材料
12870 _2007_238_moesm1_esm.doc
附加文件1:用于生成F2SA27063和SA3054之间的种群(DOC 276 KB)
12870 _2007_238_moesm2_esm.doc
附加文件2:用于生成F2SA27063和A17之间的种群(DOC 162 KB)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
坎普伊斯,l.g.,利希滕兹维格,J.,奥利弗,R.P.et al。两个交替的隐性数量性状位点影响春黑茎和叶斑病的抗性Medicago truncatula.BMC植物生物学8日,30(2008)。https://doi.org/10.1186/1471-2229-8-30
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-30
关键字
- 数量性状位点
- 数量性状位点分析
- 叶斑病
- 相互易位
- 疾病的分