摘要
背景
杂种优势是F1相对于亲本表型的杂交后代。玉米在很多性状上都表现出杂种优势,但杂种优势的大小取决于亲本的选择和所测量的性状。我们使用表达谱来确定在具有不同水平遗传多样性或杂种优势的玉米杂交种中,非加性基因表达的水平或类型是否有所不同。
结果
结果表明,25个玉米杂交种的优良亲本杂种优势在不同性状间的分布总体上不存在显著的相关性。其中6个杂种的表达谱分析揭示了遗传多样性和转录变异之间的相关性,这些杂种被选择来代表基因型多样性和杂种优势反应。在6个不同杂交品种中,大多数差异表达基因表现出加性表达模式,约25%的差异表达基因表现出统计学上显著的非加性表达模式。在非加性谱中,~80%表现出亲本水平之间的杂交表达水平,~20%表现出亲本水平内的杂交表达水平,~1%表现出亲本范围外的杂交表达水平。
结论
我们发现玉米自交系遗传多样性与转录变异相关。然而,幼苗组织取样表明,在一系列杂交种中,加性和非加性表达模式的频率非常相似。这些发现表明,杂种优势可能不是高水平加性或非加性表达的结果,而可能与亲本之间的转录差异有关。不同性状的亲本杂种优势水平之间缺乏相关性,表明特定基因组的转录多样性可能影响不同性状的杂种优势。
背景
杂种优势是F1杂交种表现出优于其亲本的表型[1,2]。植物育种家在没有充分了解杂种优势的分子基础的情况下,利用杂种优势培育了许多重要作物品种的高产品种。研究人员经常讨论特定杂交品种的产量杂种优势的大小。在玉米中,不同的自交系已根据籽粒产量的杂种优势水平划分为“杂种优势群”[3.]。一般来说,杂种优势组内杂交的产量杂种优势低于组间杂交。然而,杂种优势群体被用作一般工具,而不是作为杂种优势反应的精确预测因子[4]。粮食产量杂种优势与遗传多样性之间存在相关性,遗传多样性的增加,粮食产量杂种优势水平的提高[5]。然而,当父母变得高度多样化时,这种关系就不复存在了[3.,6]。
虽然杂种优势在作物植物中最常被讨论的是产量方面,但许多其他表型性状也表现出杂种优势。玉米在根系生长、株高、穗节、叶宽、幼苗生物量等性状上均表现出较高的杂种优势[j]。7–11]。在一个给定的杂交种中,不同性状的杂种优势的数量变化很大[9,12]。
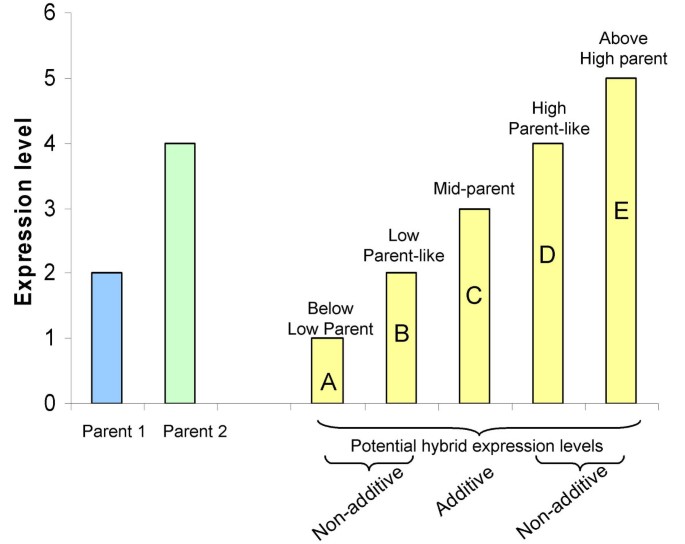
虽然人们普遍认为亲本遗传多样性是杂种优势的基础,但遗传多样性的具体方面以及这些方面如何促成杂种优势表型仍有待确定。驱动杂种表型的分子机制仍然是一个广泛关注和争论的主题[12,13]。高通量基因表达谱技术的可用性使研究人员能够研究杂交植物相对于近交系亲本的基因表达谱[11,14–21]。总的来说,这些研究大多集中在单个杂种杂种与两个亲本相比的基因表达模式特征上。这些研究中有许多都讨论了关于基因表达和杂种优势的类似主题,例如杂交中加性和非加性表达水平的相对频率。当杂交表达水平与中间父级值相等时,就会出现可加性表达,而当杂交表达水平偏离中间父级时,就会出现非可加性表达(图1)1).值得注意的是,非加性表达表型可以包括中间亲本和亲本值之间的表达水平,相当于亲本之一的表达水平或亲本范围之外的表达水平。在这些研究中,在亲本范围之外表现出杂交基因表达水平的基因的身份和频率特别令人感兴趣。
杂交表达谱研究利用了多种表达谱平台、实验设计和组织。几项研究发现,大多数(约75%)基因在杂交中表现出加性表达,只有少数非加性表达基因表现出亲本范围以外的表达水平[11,15,17]。其他研究发现了更高水平的非加性表达,以及许多在亲代范围之外表达的例子[21–23]。目前尚不清楚这些差异是由组织之间的生物学差异、基因型还是表达谱平台的差异引起的。
在本研究中,我们研究了一组具有不同亲本遗传多样性水平的玉米杂交种的杂种优势和基因表达谱。此外,使用几种不同的技术进行基因表达谱分析,以评估通常表现出较低杂种优势水平的杂种是否表现出较低的非加性表达水平或亲本范围外的表达水平。
结果
不同的玉米杂交种表现出不同性状的杂种优势反应
本研究的主要目的是鉴定和比较几种不同杂种优势水平的玉米杂交种的非加性基因表达水平。对玉米杂交种籽粒产量的杂种优势水平进行了大量的前期研究。然而,我们的表达谱分析是在幼苗组织中进行的,这种组织可能与籽粒产量表型没有直接关系。因此,我们对玉米自交系和杂交种进行了监测,以评估b埃特尔p透明h在5种不同表型中,包括2种不同的幼苗表型。BPH表示为相对于更好的亲本表型的杂交表型增加的百分比(见BPH方程的方法)。我们的目标是确定不同杂交基因型的杂种优势水平在各种性状之间是否相关,从而使我们能够确定哪些杂种表现出更高或更低的“总体”杂种优势。
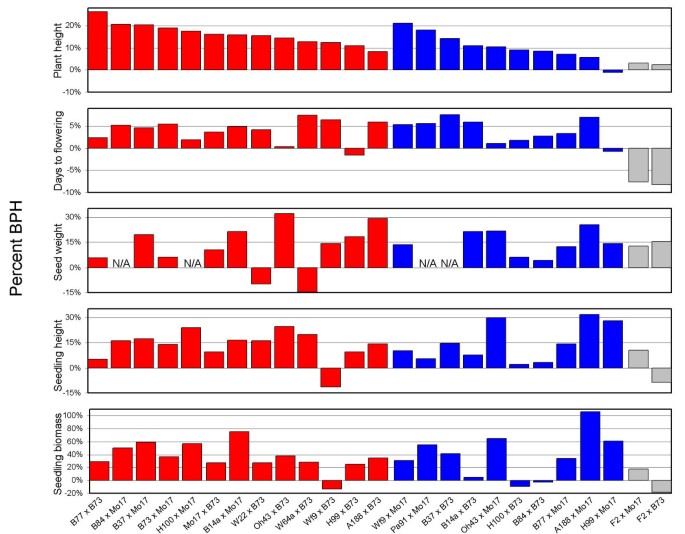
测定了不同杂交品种的成熟株高、50粒重、开花期、幼苗株高和幼苗生物量BPH水平。所有杂交种均以自交系B73或Mo17为父本。所有五个性状的每个重复的表型值在附加文件中提供1及BPH值见图1和附加文件2.不同性状的相对BPH水平差异很大(图2)2).例如,Oh43 × B73在种子重量方面的BPH最高,但开花前几天的BPH倒数第五(图2)2;参见附加文件2).我们测试了任何两个性状的BPH水平在杂交种之间是否存在相关性(见附加文件)3.]。幼苗高度与幼苗生物量呈较强的相关性(p< 0.0001),而株高与开花天数的相关性较弱,但显著(p= 0.013)。其他8个性状的比较没有显示出显著的相关性。因此,一般来说,一个性状的BPH杂种优势水平不能很好地预测另一个性状的杂种优势水平。
非产量性状的杂种优势.BPH百分比显示了本研究中所有性状和所有杂交种的得分。数值BPH值可在附加文件2.红色条表示SS和NSS自交系之间产生的杂交种的BPH,蓝色条表示SS和NSS自交系之间产生的杂交种的BPH,灰色条表示来自混合来源自交系的杂交种的BPH (F2)。
我们评估了杂种优势群体的概念,它是作为一种工具发展起来的,可以使粮食产量育种[4],可以预测其他性状的杂种优势水平。杂种优势群体的概念预示着杂种优势群体内的杂交通常比杂种优势群体间的杂交表现出更少的杂种优势。在我们监测的所有5个性状中,有多个杂种内群体杂交比几个杂种间群体杂交表现出更高的杂种优势水平。例如,虽然B37 × B73是一个内杂种群杂交,但它在性状上的杂种优势水平与距离较远的亲本基因型之间的杂种群杂交相似,有时甚至优于后者(图3)2,3.).值得注意的是,杂种优势群体并不完全是根据杂种优势来定义的,而是经常受到亲缘关系和其他因素的影响[4]。
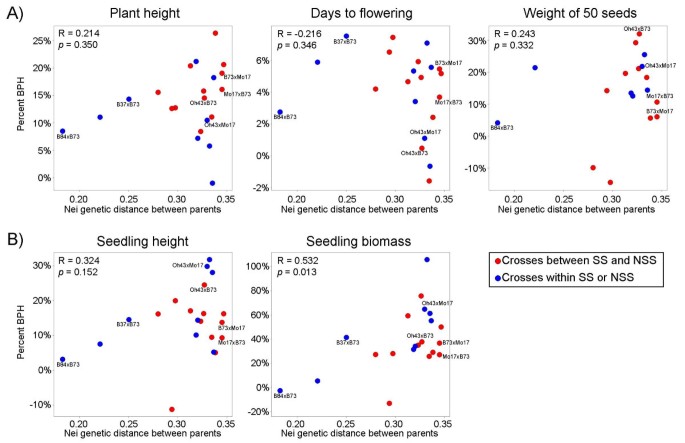
我们研究了BPH水平与遗传距离之间的相关性(基于Hamblin等人计算的Nei SNP遗传距离)。24])在5个性状的亲本系之间。5个性状中有4个性状呈显著正相关,但只有幼苗生物量呈显著正相关(p= 0.013)。开花天数与表型呈不显著负相关。亲本遗传多样性最低的杂交种B84 × B73始终表现出较低的相对BPH水平(图2)3.).然而,亲本遗传多样性中高水平的品系杂种优势水平与遗传距离之间的相关性并不一致。
利用6个杂交基因型进行基因表达谱分析。这些杂交种代表了杂种内和杂种间的群体杂交,亲本之间的遗传多样性范围从低到高,并表现出大量的BPH表型(这六个杂交种的数据点在图中标记3.).杂交种B84 × B73和B37 × B73是硬秆合成杂种群成员之间的杂交,Oh43 × Mo17是非硬秆自交系之间的杂交。另外3个杂种(Oh43 × B73、B73 × Mo17和Mo17 × B73)是由两个杂种群体亲本杂交而成的杂种。这些杂交种代表了一系列遗传多样性(基于Hamblin等人测量的847个snp)。24])。B84-B73亲本遗传多样性水平较低,B37-B73亲本遗传多样性水平中等。其他杂种,B73-Mo17, Oh43-B73和Oh43-Mo17,都具有更高水平的遗传多样性[24[参见附加文件。2]。
差异表达基因的鉴定
从杂种B84 × B73、B37 × B73、Oh43 × B73、Oh43 × Mo17及其近交系的地上11天苗组织中分离总RNA。收集RNA样本进行三次生物重复,并使用Affymetrix玉米18k基因芯片平台进行微阵列分析。18 K玉米Affymetrix阵列包含17,622个探针集,用于检测13,495个基因的表达。一些基因由多个探针组代表,用于检测正义和反义表达或替代转录本的表达。先前获得的基因型为B73、Mo17、B73 × Mo17和Mo17 × B73的11天苗Affymetrix微阵列数据[17]被纳入下游分析以进行比较。通过对自交系B73和Mo17的表达谱进行比较,结果表明,两个实验获得的表达谱具有相当的可比性。
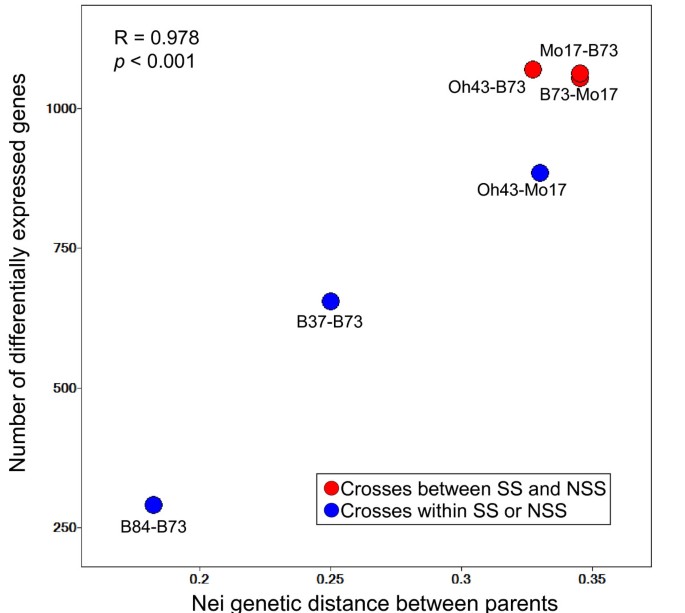
基于方差分析FDR < 0.05(最小信号和折叠变化滤波器),在每个自交系杂交组中鉴定基因型之间的差异表达基因(DE);见的方法)。DE基因数量在自交系杂交种组间存在差异(表2)1).DE基因数量与亲本间遗传距离水平有很强的相关性(图2)4).自交系B84、自交系B73和杂交系B84 × B73共鉴定出290个DE基因,数量最少。自交系B37、自交系B73和杂交系B37 × B73共鉴定出655个DE基因,其余鉴定出885 ~ 1071个DE基因(表1)1;数字4).
使用微阵列表达谱进行种内比较可能会因不同自交系中序列多态性的存在而变得复杂[25]。通过使用两种独立的方法验证微阵列数据,我们评估了Affymetrix数据集中DE基因假阳性的频率。首先,利用Sequenom MassArray平台对不同自交系间的差异表达调用进行验证。我们之前使用MassArray平台测量了一组约300个基因的等位基因特异性表达水平,使用的是与Affymetrix分析中使用的相同的RNA样本[26]。MassArray平台可以检测亲本rna混合物中给定基因的相对等位基因比例。每个等位基因检测到的相对比例可以与基于Affymetrix数据预测的比例进行比较,如Stupar和施普林格[17]。对Affymetrix数据中的56个DE基因进行MassArray验证(其中包括两个不同近交系杂交组中的6个DE基因,从而对62个DE谱进行验证分析)。Affymetrix和MassArray数据之间的相关性很强,62个示例中有58个在两个平台中显示出相似的偏置表达方向性(图2)5).统计分析表明,74%(46/62)的基因在MassArray数据集中表现出显著的差异表达。其次,我们利用玉米70-mer寡核苷酸微阵列平台[27]来验证在Affymetrix数据集中观察到的DE基因。将同一组RNA样品标记并杂交到包含约43,000个特征的70-mer寡核苷酸芯片上。我们在这个平台上确定了一组13,874个功能,这些功能有望检测到与Affymetrix平台相同的转录本。对于存在于70 mer寡核苷酸微阵列上的所有Affymetrix DE基因,我们比较了日志2亲本自交系在两个平台上的表达差异(图2)5 b).Pearson R值显示所有的比较都有显著相关性(p < 0.0001) (B84与B73的R = 0.697;B37对B73的R = 0.679;Oh43对B73的R = 0.720;Oh43对Mo17的R = 0.750)。70 mer寡核苷酸微阵列平台证实了Affymetrix鉴定的绝大多数基因亲本近交基因型之间表达差异的方向性(图1)5 b;与B73相比,B84为91%;与B73相比,B37为84%;Oh43与B73的比值为84%;Oh43与Mo17的比值约为91%)。虽然在一些例子中,差异表达仅使用其中一种平台检测到,但大多数基因在两种微阵列平台中表现出相似的差异表达。Sequenom MassArray和70-mer寡核苷酸微阵列分析表明,使用Affymetrix微阵列识别的大多数DE谱都是有效的。
使用MassArray和70-mer平台验证差异表达.将基于Affymetrix数据的自交系之间的差异表达量与使用MassArray平台和70-mer微阵列平台检测到的差异表达量进行比较。在Affymetrix平台上鉴定为差异表达的基因子集(FDR < 0.05)和附加的质量控制过滤器;见方法)用于这些分析。数据点的颜色编码表示近交基因型比较。(A)将用于Affymetrix微阵列分析的相同自交系RNA样本以1:1的成对比例混合,并进行MassArray相对等位基因定量[25]。MassArray比例和Affymetrix数据集(近交1个信号除以两个近交信号的总和)计算的比例之间的相关性显示。每个点代表一个等位基因在近交-近交比较中的比例。采用B73和Mo17序列snp设计实验,因此这种比较在本分析中最具代表性。(B)在Affymetrix数据集中被确定为差异表达的许多基因也存在于70-mer微阵列平台上。 The correlation of the inbred expression fold-differences on the 70-mer oligonucleotide microarray and the Affymetrix microarray are shown. Each spot represents the fold-differences of one gene per inbred-inbred comparison. The 70-mer microarray data validated the directionality of the Affymetrix microarray patterns in 84–91% of the differentially expressed profiles (see main text).
杂交表达可加性的评价
我们比较了这一系列6个杂交基因型的加性和非加性表达水平。利用聚类热图表达谱进行的初步视觉评估表明,与亲本基因型相比,这6个杂交种表现出加性或近加性表达水平(见附加文件)4]。为了评估统计上加性和非加性表达模式在杂交种中的比例,我们进行了t-所有DE基因的杂交表达值与自交系中亲本表达值的比较。DE基因有相当一部分表现为非加性表达模式,但6个不同杂交种间的比例非常相似(23.2 ~ 30.3%;表格1).亲本遗传多样性与非加性表达之间没有明显的变化趋势。事实上,遗传多样性最少的杂交种B84 × B73的非加性基因比例最高,为30.3%。
我们进一步评估了这些玉米杂交种中所表现出的特定类别的非加性表达。非加性基因的表达水平可能在统计上介于中亲本和高亲本值或低亲本值之间(以下称为“亲本之间非加性”表达),表达水平相当于高亲本(HP)或低亲本(LP)值,或高于高亲本(AHP)或低于低亲本(BLP)的水平(图1)1).我们评估了6个杂交种中每一个非加性表达基因子集内亲本样(HP或LP)、AHP和BLP杂交表达模式的数量(表1)1).当杂种的表达水平与高亲本或低亲本没有显著差异时(基于双尾),表达谱被分配到类亲本类别t测试,P< 0.05)。当杂种表达水平显著高于高亲本或低于低亲本时,分别将表达谱分配到AHP或BLP类别(单侧)t以及,P< 0.05)。其余非加性表达基因表现为亲本之间的非加性表达水平。6个杂交种中有15个基因为AHP或BLP。非加性表达基因的较大比例(18.7%)表现出亲本样表达水平。多数非加性表达基因(约80.1%)表现在亲本非加性表达水平之间,即这些基因的表达水平介于亲本和亲本之间,但与中亲本和亲本水平有统计学差异。应用更自由的标准对AHP和BLP模式的评估将在下面的部分中提出父代范围之外的杂交表达模式.
除了使用统计测试来确定非加性表达的类型和频率外,我们还使用了各种使用d/a值的图来可视化杂交表达值相对于亲本表达水平的分布。在我们应用d/a计算(在方法部分中描述)时,d/a值为0表示加性杂交表达,d/a值为1或-1表示杂交表达水平等于亲本之一,d/a值为> 1或<-1表示亲本范围之外的杂交表达水平。
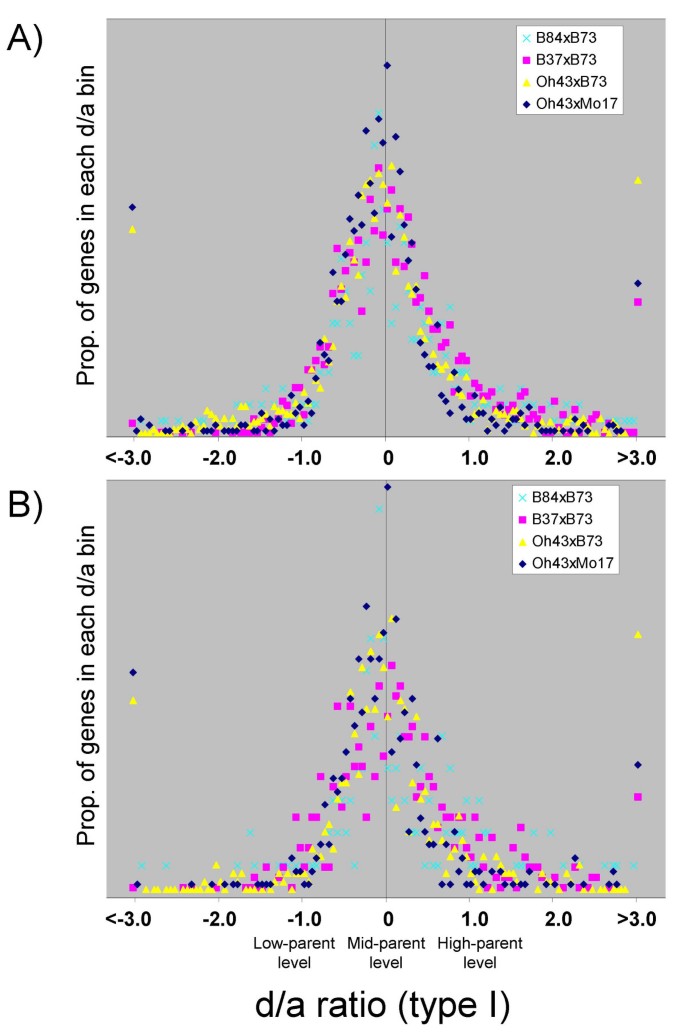
我们以两种不同的方式执行d/a计算(有关计算细节,请参阅Methods)。第一个d/a计算(以下称为“d/a型I”)评估了每个基因相对于高亲本和低亲本的杂交表达水平。第二个d/a计算(以下称为“d/a II型”)评估相对于母本和父本的杂交表达水平,从而确定母本或父本对杂交基因表达的影响。6个不同自交系杂交组的d/a值分布惊人地相似(图2)6 a - b).所有六个杂交种的d/a I型分布都以接近零为中心,分布尾部在亲本范围内(在-1.0和1.0之间)一致变平(图1)6).我们确实注意到,d/a I型分布的中心略微向低亲本倾斜。我们怀疑d/a I型值与中亲本水平的轻微偏差可能是由技术因素而不是生物学因素引起的。我们发现低表达信号的基因比高表达信号的基因表现出更大的零偏差(见附加文件)5]。在所有6个杂交种中,至少有一个基因型信号> 10000个单位的基因的d/a I型分布没有偏离零5]。这些发现表明,技术因素,如微阵列信号强度较低的稍微非线性动态范围,可能会导致稍微倾斜的分布。
与d/a I型的结果相似,d/a II型的分布在六种杂交模式中也表现出非常一致的分布,因为它们在亲本范围内的峰值都接近于零,尾部变平(图1)6 b).没有证据表明d/a II型分布存在偏态,表明杂交表达并不总是有利于母本或父本。先前的一项研究发现了一种有趣的转录亲代效应,从16个不同杂交品种的未成熟耳朵中收集的杂交组织普遍表现出类似父本的基因表达模式,这些基因在母本中比父本中表达得更高[15]。在父本中较高表达的基因在杂交后代中往往表现为中亲本表达模式[15]。我们试图重复郭等人的研究。[15在Affymetrix数据集上使用'd/a type II'计算进行分析[参见附加文件]5]。在我们的数据集中没有观察到这种单向倾斜;两个基因亚群均向各自的低亲本水平倾斜,这只是图中观察到的低亲本倾斜的反映6.这两项研究之间的差异可能是因为使用的组织不同,未成熟的耳朵[15对比幼苗(本研究)。
非加性基因子集的d/a II型分布呈双峰分布,波谷位于加性d/a值为零附近(图2)6摄氏度).分布表明,大多数非加性表达基因在亲本水平之间表现出杂交表达值,只有一小部分基因在亲本d/a -1.0 ~ 1.0范围之外(图1)6摄氏度).这种分布证实了基于上述统计检验的结论。
我们还鉴定了DE基因,并使用70-mer寡核苷酸微阵列数据计算了d/a I型值(参见统计分析的详细方法)。70 mer寡核苷酸微阵列数据的d/a图分布与Affymetrix数据生成的图非常相似(图2)7一个).所有四种混合动力车的d/a I型分布形状相似,都以接近零为中心(图2)7一个).然而,70 mer寡核苷酸微阵列d/a图表明,相当一部分基因在亲本范围之外具有杂交表达水平。事实证明,许多基因表现出大于1.0或小于-1.0的d/a型I值(图1)7一个).总的来说,在70个核苷酸芯片数据中,20.6%的DE模式显示的d/a值超出亲代范围。相比之下,Affymetrix的d/a分布在这些值之外几乎是平坦的,只有1.3%的DE模式在父值范围之外显示d/a值(图1)6).
目前尚不清楚为什么两种微阵列平台在亲代范围外的d/a值基因比例上表现出差异。我们考虑了两种平台上不同的基因组可能导致不同比率的非加性谱的可能性。为了解决这个问题,我们仅使用也在Affymetrix平台上表示的DE特征,生成了70个聚寡核苷酸微阵列数据的d/a图(类型I)7 b).得到的d/a分布与所有DE基因产生的d/a分布非常相似(图2)7一个),表明平台特征偏差不会导致微阵列平台之间观察到的非加性概况的差异。
重要的是要记住,这些d/a值是多个生物重复的组合,它们不包括变异估计。对d/ A值高于1.0或低于-1.0的几个基因的仔细检查显示,虽然平均d/ A值在亲代范围之外,但它们通常没有统计学意义。我们通过比较每个基因型内生物重复的信号强度变化来估计每个平台内的变异程度。对于每个DE基因,我们用三个生物重复的标准差除以三个生物重复的平均值。这些计算表明,与Affymetrix平台相比,70 mer寡核苷酸微阵列数据在重复之间产生的信号变化大约是其两倍(见附加文件)6]。这种更高水平的信号变化可能导致图中观察到的d/a值分布更广7.
总体而言,Affymetrix数据d/a图表明,所有6个杂交种的杂交表达分布相似,峰值约为零,很少有基因表现出杂交表达模式超出亲本范围(d/a bbb1.0或<-1.0)(图1)6).这与聚类热图非常一致[见附加文件]4]和可加性的统计分析(表1)1).总体上,杂交种表现为加性表达,非加性表达的大部分基因仍表现为亲本范围内的表达水平。
父代范围之外的杂交表达模式
上一节描述的Affymetrix微阵列数据分析采用了相对严格的统计显著性参数。Affymetrix结果在6个杂交组合的亲本和杂交种中鉴定出5020种基因表达模式,但只有15种杂交基因表达模式明显超出亲本范围。其他几个研究小组报告说,在亲本范围之外观察到更高频率的杂交表达[21–23]。在本节中,我们对Affymetrix数据应用了更自由的统计显著性和fold-change阈值,以便识别在应用严格的统计标准时可能错过的亲代范围之外的杂交表达模式。
当方差分析FDR < 0.15(与表中0.05相反)时,DE基因的数量显著增加1).在6个杂交种中共鉴定出13280种DE模式(表2)2和3.).然后,我们确定了表现出高于(318)或低于(538)亲本范围的表达模式的数量。所有DE模式中只有6.4%的表达水平超出亲本范围。在856个父级范围之外的表达例子中,只有221个模式在统计上与近父级水平不同(表1)2和3.).这221个模式代表213个基因(6个近亲杂交群体中的2个有8个基因表现出AHP或BLP)。这些基因中的大多数与近亲本的差异小于1.1倍,并且依次较高的倍数变化严格阈值迅速过滤了剩余的基因;只有9个基因在亲本范围外发生了2倍以上的变化(表2)2和3.).这些数据表明,对于绝大多数AHP和BLP基因,与近亲本水平的表达差异相对较小。使用了几种方法来验证这些AHP和BLP表达模式。我们首先比较了Affymetrix数据中221例AHP或BLP表达的d/a值与70 mer寡核苷酸微阵列数据中这些基因的d/a值[见附加文件]7]。70-mer寡核苷酸微阵列数据支持127个基因中53个(42%)的AHP或BLP表达。因此,70-mer寡核苷酸微阵列数据验证了AHP或BLP表达的一些例子,但也表明其中一些谱可能是假阳性。定量实时PCR分析验证了8个测试基因中6个的AHP或BLP表达(选择这8个基因是因为有良好的序列和设计基因特异性引物的能力)[见附加文件]7]。我们还注意到,213个AHP或BLP基因中的许多在多个杂交种中往往表现出低水平的AHP或BLP表达,这表明AHP或BLP模式可能具有保守性7和8]。我们的结果表明,在杂交玉米幼苗中,一小部分基因表现出显著的AHP和BLP表达。此外,对不同自交系杂交组合的比较提供了证据,表明这些基因中的许多在不同杂交系的亲本范围外一致表达。
基因本体分析
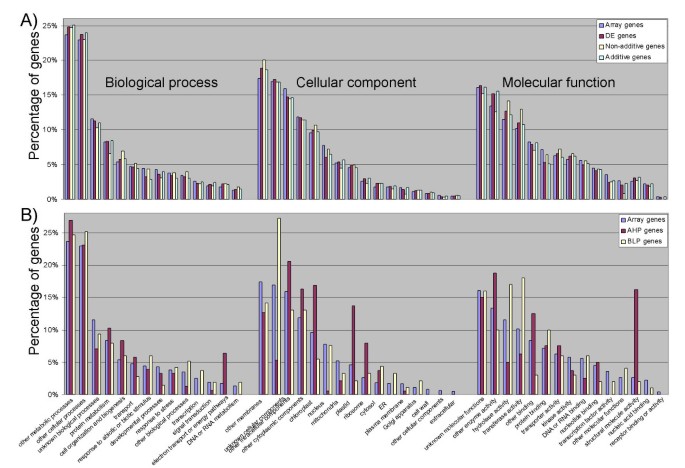
我们比较了DE基因的基因本体(GO)类别的相对表示与Affymetrix微阵列上存在的探针集的总数。对于本分析,DE基因来自严格的Affymetrix分析(FDR < 0.05),并采用最小信号和折叠变化滤波器;(见方法)由6个自交系杂交群体组合而成。我们没有发现DE基因中任何特定GO注释的任何实质性差异或过度代表(图2)8).我们还测试了加性或非加性表达的全套基因,在这些基因列表中没有发现任何GO注释的富集(图2)8).每个类别的相对比例大致与微阵列上的比例相匹配,这表明所有功能类型的基因的差异表达和可加性都以相同的速率发生。
我们还比较了AHP和BLP基因的GO表示与Affymetrix微阵列上存在的探针集总数。在这种情况下,我们确实确定了一些明显的代表性过高和代表性不足的类别(图5)8 b).最明显的是,AHP基因似乎被电子传递和能量途径过程、质体和核糖体成分以及结构分子功能所过度代表。AHP基因在细胞核成分和一些分子功能类别(包括转录因子活性)中代表性不足。一般来说,与AHP基因相比,BLP基因表现出较少的过度或不足表征。过度代表的BLP类别包括水解酶和转移酶分子功能。
AHP和BLP的生物学意义尚不清楚。这些基因类的功能在杂种优势的形成中可能特别重要。然而,由于AHP和BLP基因的数量相对较少(仅占微阵列特征总数的1.6%),这些基因的频率分析更容易受到抽样和随机效应的影响。
讨论
链接玉米遗传多样性和转录变异
特别重要的是要认识到自然变异的遗传和转录评估采用不同的实验程序和分析工具。基于序列的遗传多样性研究利用稳定的特征来评分变异,通常是DNA序列多态性。研究转录多样性涉及测量一种不稳定的单位,mRNA,它会根据发育和环境因素而发生变化。基因表达数据集的多种变异来源可能会增加重复之间的测量方差,从而降低统计能力。
在本研究中,我们比较了6个不同的玉米自交系组合的转录多样性。我们发现,根据基于snp的序列分析,每个自交系-杂交系中鉴定出的DE基因数量与自交系之间的遗传多样性密切相关[23]。对10对可能的自交系基因型的DE基因数量的比较也揭示了转录和遗传多样性之间的强烈相关性(数据未显示)。我们之前使用等位基因特异性表达分析的工作表明,玉米种内转录变异主要是由独联体-变异的作用源[17,26]。与基因相关的序列多态性水平的增加可能至少是在遗传距离较远的近亲中观察到的较高转录变异性率的部分原因。事实上,玉米基因组的基因间空间在自交系中是高度多态的[12,28],这些结构和核苷酸多态性可能驱动某些玉米基因的转录变异。
非加性表达模式的含义
我们也对确定转录谱和杂种优势表现之间的可能联系感兴趣。在亲缘关系较远的自交系杂交组合中,差异表达基因的数量较多。自交系亲本遗传多样性越高的杂交种,其加性和非加性基因表达模式的数量越多。然而,6个杂交种DE基因中非加性杂交种表达谱的比例相似。此外,6个杂交种中不同类型非加性表达基因的相对比例相似。这些数据表明,非加性表达在幼苗组织中的流行程度与不同的杂种优势水平无关。
我们很容易推断,非加性杂交表达模式暗示着新的杂交调控或可能与杂种优势有关。然而,考虑非加性表达模式包括可预测模式和不可预测模式是很重要的。使用“表达水平”作为表型,我们可以用显性术语描述非加性表达模式。亲本间非加性表达的基因为部分显性,HP或LP表达的基因为显性。经典遗传学提供了许多F基因部分或完全显性的例子1杂交和在许多情况下,这种遗传类型的分子机制已经确定。在我们的研究中,即使我们采用自由的统计标准来鉴定DE基因,也有大约98%的非加性表达基因表现出可以被描述为部分显性或完全显性的表达表型。
许多种内F的研究1杂交基因表达的重点是鉴定在亲代范围之外表达水平的基因,包括对果蝇的研究[29]、拟南芥[14]和牡蛎[30.]等。这种模式(在本研究中称为AHP或BLP)通常被描述为过支配或欠支配。这些是不可预测的杂交表达模式,可能是由新的杂交特异性调控机制引起的。AHP或BLP表达模式在杂种优势中的重要性尚不清楚。AHP或BLP的表达模式可能在杂种优势中起作用。然而,AHP或BLP表达模式也有可能是杂种优势的结果,而不是原因。
Swanson-Wagner等人先前的研究[11]文献证据表明,虽然加性表达是最常见的,但在B73 × Mo17杂交种中观察到所有潜在的杂交基因表达模式。在这项研究中,我们报告了类似的发现,并将这一分析扩展到表现出不同遗传多样性水平的其他杂交种。在玉米杂交表达谱中报道的AHP或BLP基因的数量从基本上没有变化很大[17]到一小部分基因[11,15]与更大比例的基因[18,23]甚至高达50%的DE基因[21]。对于这种差异,有几种可能的解释。这可能是不同组织或发育阶段AHP和BLP表达水平不同所致。或者,可能是不同的表达谱技术、采样方法或实验设计影响了AHP和BLP表达模式的发现,如Cui等人所描述的那样。[31]以及罗特沙伊特和哈尔[32]。事实上,在不同的平台上使用相同的RNA样本,我们发现70-mer寡核苷酸微阵列平台上的AHP和BLP模式比Affymetrix平台上的AHP和BLP模式要多得多。然而,实时PCR很少验证70-mer寡核苷酸微阵列AHP和BLP模式(2/12基因;数据未显示),但更频繁地验证Affymetrix AHP和BLP模式(6/8基因)。如果我们假设AHP和BLP表达模式非常罕见,那么表达谱平台中更大程度的技术变化可能导致更多的假阳性AHP或BLP观察结果。
预测杂种优势的并发症
研究了25个不同品种玉米的杂种优势反应1杂种具有5个不同的性状:株高、开花天数、种子重、幼苗高和幼苗生物量。我们的目的是确定某一特定性状的杂种优势是否能预测另一性状的杂种优势。此外,我们还想观察各性状的杂种优势与亲本遗传距离的关系。
本研究的主要目的是比较不同杂种优势水平杂交中观察到的表达变异类型。为了进行这个实验,我们想确定某些杂交种对各种性状的杂种优势水平是高还是低。然而,我们发现不同性状间的杂种优势水平普遍缺乏相关性。少数杂交种在性状间一致表现出高或低的相对杂种优势。这表明杂种优势不是一种有机体普遍存在的现象,而是性状特异性的,可能是由不同性状的部分非冗余基因控制的。
以往的研究发现,近交亲本之间的遗传距离与玉米产量杂种优势在亲本亲缘关系较近时存在相关性,而在亲本亲缘关系较远时这种相关性不存在[5]。我们对相对少数杂交基因型的非产量性状的分析与前人关于产量杂种优势与遗传距离关系的研究相一致。我们发现遗传距离是一个不一致的杂种优势预测因子。5个性状中只有1个(幼苗生物量)与遗传距离和杂种优势有显著相关。一般来说,亲缘关系近的亲本杂种优势水平相对较低。然而,亲缘关系较远的杂交种表现出一系列的杂种优势反应,包括高和低BPH值。正如在产量杂种优势的研究中一样,这意味着遗传距离通常可以用来预测表现不佳的杂交种,但预测优良杂交种的能力很弱。Hamblin等。[24]表明,预测亲缘关系较远的亲本杂交表现的困难,可能部分是由于难以准确评估亲缘关系较远的近亲的遗传距离。
结论
本研究表明,玉米自交系遗传多样性与转录变异之间存在较强的相关性。然而,近交系亲本之间的遗传或转录变异程度似乎是一个不一致的杂种优势预测因子,这取决于感兴趣的性状。非加性杂交种表达谱的频率和模式在不同杂交种之间似乎是相似的。综上所述,这些数据表明玉米杂交杂种优势可能更多地受到转录变异的加性互补而不是新的非加性表达状态的影响。
方法
植物生长和表型
2006年夏天,在圣保罗校园农业实验站种植了15个自交系和25个杂交种。每个基因型在两个随机完整区各种植一行;块植期间隔12天。所有达到完全成熟的植株都对三个性状进行评分;株高,开花时间和50粒种子的重量。在雄穗发育后每天对植株进行监测,记录每株植株的开花日期为雄穗脱落花粉的第一天。然后,用从地面到穗顶的距离来测量成熟植株的高度。从每棵植物上收获开放授粉的穗子并将其干燥;采集50粒种子,每穗称重,测量平均种子质量。计算每个生物重复内每个基因型各性状的平均值; 70% trimmed means were used for the height and days to flowering traits to control for outliers. The trait means and standard deviations were calculated from the two biological replicate means and were subsequently used to calculate the percentage heterosis for each trait. The percentage better parent heterosis (BPH) was calculated for each biological replicate as:

根据两个生物重复%BPH值计算总体BPH平均值和标准差。杂种优势在开花前的天数被认为是早熟的衡量标准,因此BPH代表杂交植物在开花较早的亲本之前开花的时间百分比。
相同的基因型种植在7 1/2英寸的杜鹃花花盆中,并在标准温室条件下生长11天。每个生物重复共培养18株幼苗(每3盆6株)。花盆被随机放置在温室内。本试验连续种植3个生物重复。生长11天后,通过测量从植株基部到最长延伸叶的尖端,对幼苗的地上植物高度进行评分。此外,地上的幼苗组织收获,干燥,然后称重生物量测量。计算每个生物重复中每个基因型的株高和生物量的平均值。如上所述,利用生物重复的平均值计算BPH百分比。
BPH测量是根据每个杂交的内或间杂种群体状况和每个杂交亲本之间的遗传距离绘制的。根据Flint-Garcia等人的分类,对每个杂交的杂种内或杂种间群体状态进行了分类。[33]。Nei遗传距离值基于847个SNP标记的数据[24]。
Affymetrix微阵列分析
从5个玉米自交系(B37、B73、B84、Mo17和Oh43)和4个杂交系(B37 × B73、B84 × B73、Oh43 × B73和Oh43 × Mo17) 11 d龄玉米苗的地上组织中分离到RNA。在标准温室条件下培养3个生物重复(蒸压土壤与MetroMix 1:1混合;16小时光照,8小时黑暗;白天温度为30°C,夜间温度为22°C),并于11日采样th种植后第二天早上8点到9点之间。植株在最高支根以上立即扦插,收集地上组织和分生组织。每个生物重复由来自8个相同基因型的不同幼苗的汇集组织组成。总RNA样品使用TRIzol (Invitrogen, Carlsbad, CA)分离,使用RNeasy系统(QIAGEN, Valencia, CA)纯化。采用Nanodrop分光光度计(Nanodrop Technologies, Montchanin, DE)和琼脂糖凝胶电泳检测RNA的数量和质量。
利用玉米基因芯片对每个基因型的三个生物重复样本的RNA样本进行Affymetrix微阵列杂交。RNA收集、标记和杂交遵循已发表的方法[17]。Affymetrix微阵列数据保存在Gene Expression Omnibus (GEO)中,登录号为GSE10236。先前采用相同实验设计对基因型B73、Mo17、B73 × Mo17和Mo17 × B73生成的Affymetrix微阵列数据[17] (GEO登记号GSE8174)纳入分析,以便进一步比较。
对各亲本杂交组进行微阵列统计分析。如对6个不同亲本杂交群体的B37、B73和B37 × B73基因型进行归一化分析,对Oh43、B73和Oh43 × B73基因型进行归一化分析等。使用GC-RMA对微阵列之间的数据进行归一化,并使用genesspring version 7.2软件对结果值进行逐基因归一化。基因型中差异表达的基因是通过使用参数检验对标准化数据进行单向方差分析来确定的,没有假设方差相等。采用错误发现率(FDR) 0.05对多重检验进行Benjamini和Hochberg校正。我们移除了那些没有表现出至少一种基因型且平均微阵列信号大于50个单位的基因,以及在三种基因型中的任何两种之间没有表现出至少1.2倍变化的基因。这些过滤器被用来去除表达差异很小的基因或表达证据很少的基因。因此,FDR < 0.05并通过最小信号和倍数变化阈值的基因被确定为差异表达。
对差异表达基因的后续分析侧重于评估杂交基因型与亲本基因型的表达水平。利用genesspring软件对基因表达谱进行分层聚类。通过比较近交系亲本和杂交亲本的表达水平,进行非加性杂交表达水平的统计检验。一种双尾同方差t所有基因均为P< 0.05为非加性表达。
使用两种不同的方法计算所有差异表达基因的d/a比率,为了澄清起见,我们将其称为I型和II型。I型d/a值按Stupar等人的描述计算。[20.],并用于比较每个基因相对于高亲本和低亲本的杂交表达。简而言之,为了计算I型d/a, d值计算为混合信号减去双亲平均信号,a值计算为高亲本信号减去双亲平均信号。d/a值为0.0的基因与亲本相比表现出加性表达。d/a值为1.0或-1.0的基因分别表现为高亲本(HP)或低亲本(LP)的杂交表达水平。d/a值大于1.0或小于-1.0的基因分别表示杂种表达水平高于高亲本(AHP)或低于低亲本(BLP)。AHP或BLP模式的统计确认由单侧均方差确定t-分别对高亲本和低亲本的杂交表达值进行检验;基因与P< 0.05被认为是有效的AHP或BLP呼叫。II型d/a值用于比较每个基因相对于母本和父本的杂交表达。计算II型d/a时,将d值计算为杂交信号减去双亲的平均信号,将a值计算为父本信号减去双亲的平均信号。d/a值为0.0的基因与亲本相比表现出加性表达。d/a值为1.0或-1.0的基因分别表现出与父本或母本相同的杂交表达水平。d/a值大于1.0或小于-1.0的基因表明其杂交表达水平在亲本范围之外。
第二组分析是在Affymetrix数据上进行的,以方便我们搜索具有混合AHP或BLP表达模式的基因。如上所述进行方差分析,但采用FDR阈值0.15来识别差异表达基因。同方差的一个反面t测试(P采用AHP或BLP模式分别鉴定高亲本或低亲本杂交基因的表达水平< 0.05。通过计算杂种相对于高亲本或低亲本的折叠变化来估计AHP和BLP表达模式的大小。
DE、AHP和BLP基因子集的基因本体分析按照Makarevitch等人的描述进行。[34]。
70聚体寡核苷酸微阵列分析
将5个玉米自交系(B37、B73、B84、Mo17和Oh43)和4个杂交种(B37 × B73、B84 × B73、Oh43 × B73和Oh43 × Mo17)的相同RNA样本也与亚利桑那大学开发的玉米70-mer寡核苷酸芯片进行杂交。27]。该阵列包含43,537个独特的70-mer寡核苷酸特征。根据参考设计对每个基因型的三个生物重复进行双色微阵列杂交。70-mer寡核苷酸微阵列数据保存在GEO中,登录号为GSE10542。
杂交靶采用[35]类似于Eberwine [36],利用含有T7病毒启动子的寡核苷酸dT引物,通过体外转录线性增加mRNA浓度。目标扩增方案使用Ambion Aminoallyl Message Amp II试剂盒(目录# 1751,Ambion, Austin TX),该试剂盒已经过优化以利用减少的反应体积。样本rna用Cy3染料标记,汇集的参考样本用Cy5染料标记。在杂交之前,按照Gardiner等人先前的描述制备载玻片。27]。70个分子阵列在Tecan 4800 HS Pro杂交站(Tecan Services Inc., Durham, NC)上杂交,该杂交站能够在一次杂交运行中处理12个阵列。杂交后立即在Axon 4100 AL扫描仪(Molecular Devices Corporation, Sunnyvale, CA)上进行扫描。使用GenePix 6.0软件包(Molecular Devices Corporation, Sunnyvale, CA)从生成的TIF图像生成原始表达数据。
进行初始微阵列统计分析,以比较Affymetrix和70-mer寡核苷酸微阵列结果。(中位数-中位数背景)Cy3 70-mer微阵列信号强度使用每个芯片归一化到50与每个亲本杂交组进行归一化th在genesspring version 7.2软件中,百分位数和每个基因归一化到中位数参数。我们确定了与Affymetrix数据集中差异表达探针集匹配的70个微阵列特征。对于这些基因来说,就是原木2在两个微阵列平台上计算近交基因型之间的折叠变化表达比。这些比率通过Affymetrix和70个微阵列数据集进行比较,以确定平台之间的相关性。
第二组统计分析对70个片段的寡核苷酸微阵列数据进行,以确定每个亲本杂交组中基因型之间差异表达的基因。对于这些分析,如果观察到以下任何情况,则标记原始数据中的光斑值:任一通道中30%的像素饱和,任一通道中光斑直径< 70 um,或者扫描软件未发现光斑。在至少两种基因型的任何生物重复中发现标记的基因从进一步的分析中删除。此外,在最强烈的基因型中,平均原始信号强度< 200单位的基因也被去除。经过这些过滤步骤后,每个亲本杂交组保留了约40%的斑点特征。使用每个芯片归一化到50对这些剩余特征的数据进行归一化th在genesspring version 7.2软件中,百分位数和每个基因归一化到中位数参数,如上所述。基因型中差异表达的基因是通过使用参数检验对标准化数据进行单向方差分析来确定的,没有假设方差相等。使用0.10的错误发现率(FDR)对多重检验进行Benjamini和Hochberg校正。在三种基因型中的任何两种之间没有表现出至少2倍变化的基因从进一步的分析中删除。此外,在Cy5参考通道中表现出统计学上显著变化(FDR < 0.10)或在Cy5参考通道中表现出高度变化((信号标准差)/(信号平均值)> 0.50)的特征也被删除。通过这一系列的统计检验和质量控制措施,在70-mer寡核苷酸芯片上发现基因型间差异表达的特征如下:亲本杂交组B37、B73、B37 × B73: 1555;B84、b73、B84 × b73: 430;Oh43, B73, Oh43 × B73: 1847;Oh43, Mo17, Oh43 × Mo17: 1183。这些基因的d/a比的计算方法如上所述Affymetrix微阵列分析部分。
使用Real-Time qPCR进行表达验证
用于微阵列分析的相同RNA样本也用于实时qPCR,试图验证一些AHP和BLP表达模式。从Affymetrix分析中选择了一组8个AHP或BLP表达水平在亲本范围外至少1.5倍的基因(具体基因在附加文件中指出)7).在Oh43 × B73杂交种的70 mer寡核苷酸芯片分析中,还选择了12个AHP或BLP表达水平在亲本范围外至少1.5倍的基因。这些基因的选择是基于我们为实时qPCR分析设计有效的、基因特异性引物的能力。2.5 μg的总RNA用RQ1 DNase (Promega, Madison, WI)处理,按照制造商的说明去除污染的DNA。rna在DNAse酶切后立即在冰上冷却,与1 μg寡核苷酸dT (Promega)混合,加热至70°C 10分钟,然后在冰上加热1分钟。采用1 μl M-MLV逆转录酶,按照生产商说明书(Promega)进行首链cDNA合成。该反应在42℃下孵育50分钟,然后在70℃下孵育15分钟。实时qPCR反应以1 μl cDNA为模板,其中含有10 μl 2xsybr Green PCR Master Mix (Applied Biosystems, Foster City, CA),正、反向引物各1 μl,水7 μl。使用7900HT Real-Time PCR系统(Applied Biosystems)进行反应,循环参数如下:95°10',40个循环,95°30 ',60°30 ',72°30 ',然后是解离阶段(熔化曲线分析)。根据观察到的所有引物的线性扩增阶段经验确定阈值。 Sample cycle threshold (Ct) values were standardized for each template based on a GAPC control primer reaction, and the comparative Ct method [37]来确定每个基因的相对转录丰度。
参考文献
东EM:玉米近亲繁殖。Rep Connecticut agriculture Exp Stn. 1908, 1907: 419-429。
玉米田的组成。美国育种协会,2008,4:296-301。
Melchinger AE:遗传多样性和杂种优势。杂种优势与作物的遗传与开发。编辑:Coors JG, Staub JE。1999,麦迪逊,威斯康星:美国作物科学协会,99-118。
王丽娟,马文德,等。玉米带凹型玉米杂种优势格局的历史和生物学基础。植物育种:Arnel Hallauer国际研讨会。编辑:Lamkey K, Lee M. 2006, Ames, IA: Blackwell Pub, 219-233。
Melchinger AE, Gumber RK:农艺作物杂种优势及杂种优势作物综述。作物杂种优势植物的概念与育种。编辑:Lamkey KL, Staub JE。1998,麦迪逊,威斯康星:美国作物科学协会,29-44。
Moll RH, Lonnquist JH, Fortuno JV, Johnson EC:玉米杂种优势与遗传分化的关系。遗传学报,2009,32(2):559 - 564。
zzanoni U, Dudley JW:对改良优良玉米杂交种有用的不同自交系鉴定方法的比较。作物科学,1989,29:577-582。
李春华,李春华,李春华,等。玉米产量杂种优势的生理基础。作物科学,2004,44(4):2086-2094。
奥格·戴立民,彼得·EM,伯奇勒·贾安:玉米杂种优势调控因子赤霉素的基因检测。中国生物医学工程学报,2009,25(6):614-617。
Hoecker N, Keller B, pipho HP, Hochholdinger F:早期玉米(Zea mays L.)根系发育杂种优势表现。理论与应用,2006,(12):421-429。
Swanson-Wagner RA, Jia Y, DeCook R, Borsuk LA, Nettleton D, Schnable PS:在玉米F1杂交及其近交系亲本基因表达的全球比较中观察到所有可能的基因作用模式。美国国家科学促进会。[j] .中国科学:地球科学。
[10]李建平,李建平。玉米等位基因变异与杂种优势:两半如何大于一个整体?中国生物医学工程学报,2007,17(4):369 - 369。
李建军,李建军,李建军,等。杂种优势的分子基础研究。植物学报,2003,15(5):2236-2239。
王晓明,王晓明,王晓明,等。拟南芥基因表达的遗传分析。遗传学报,2005,17(1):1267-1275。
郭明,马鲁佩,杨晓霞,克拉斯塔·奥,Zinselmeier C, Smith OS, Bowen B:玉米杂交种的全基因组转录分析:等位基因加性基因表达与产量杂种优势。理论与应用,2006,13(3):831-845。
黄燕,张丽,张军,袁东,徐超,李旭,周东,王松,张强:基于9198个est基因芯片分析的水稻杂种优势与基因表达多态性。植物学报,2006,32(2):579-591。
Stupar RM,施普林格NM:玉米自交系B73和Mo17的顺式转录变异导致F1杂交种的加性表达模式。遗传学报,2006,33(3):391 - 391。
豌豆G, Ferron S, Gianfranceschi L, Krajewski P, Enrico Pè M:杂种杂种F1未成熟穗基因表达的非加性。植物科学,2008,(4):17-24。
宋松,曲华,陈晨,胡松,于军:基于SAGE数据的杂交水稻优良品种及其亲本差异基因表达。植物学报,2007,27 (7):479 - 479
李建军,李建军,李建军,等。玉米胚乳基因的克隆与表达分析[j]。植物生理学报,2009,35(4):557 - 557。
吴晓明,刘建军,刘建军,刘建军,等。玉米近交杂三联体的分生组织表达分析。植物生理学报,2007,32(3):391 - 391。
Auger DL, Gray AD, Ream TS, Kato A, Coe EH, Birchler JA:玉米二倍体和三倍体杂交种的非加性基因表达。遗传学报,2005,32(2):389-397。
Meyer S, Pospisil H, Scholten S:受精后6 d玉米胚杂种优势相关基因表达呈现加性、显性和超显性模式。植物生理学报,2007,31(3):381-391。
Hamblin MT, Warburton ML, Buckler ES:简单序列重复和单核苷酸多态性在玉米多样性和亲缘性评估中的经验比较。科学通报,2007,22 (2):563 - 567
王晓明,王晓明,曾志波,王晓明。桉木质部分化过程中转录水平变异的遗传结构。中国生物医学工程学报,2009,32(2):559 - 563。
[10]王晓明,王晓明,王晓明,等。杂交玉米等位基因特异性表达模式及其胚胎特异性亲本来源效应。植物学报,2007,19(2):391- 392。
Gardiner JM, Buell CR, Elumalai R, Galbraith DW, Henderson DA, Iniguez AL, Kaeppler SM, Kim JJ, Smith A, Zheng L, Chandler VL:玉米长寡核苷酸芯片的设计、生产和应用。中国生物医学工程学报,2005,25(5):425-436。
梅辛J,杜纳H:玉米基因组的组织和变异。植物生物学进展。2006,9:157-163。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。遗传学报,2004,32(2):591 - 599。
Hedgecock D, Lin J, DeCola S, Haudenschild CD, Meyer E, Manahan DT, Bowen B:太平洋牡蛎(长牡蛎)幼体生长优势的转录组学分析。中国科学d辑,2007,35(4):559 - 563。
崔晓霞,李建军,李建军,吴勇,邱志刚。F1杂交小鼠转录因子水平的遗传模式。遗传学报,2006,34(4):627-637。
Rottscheidt R, Harr B:基因表达的广泛可加性区分家鼠亚种。遗传学报,2007,37(2):563 - 567。
flist - garcia SA, Thuillet AC, Yu J, Pressoir G, Romero SM, Mitchell SE, Doebley J, Kresovich S, Goodman MM, Buckler ES:玉米群体数量性状位点分析的高分辨率平台。植物学报,2005,44(4):1054-1064。
Makarevitch I, Stupar RM, Iniguez AL, Haun WJ, Barbazuk WB, Kaeppler SM,施普林格NM:表观遗传控制下玉米染色体甲基化酶Zmet2等位基因自然变异。遗传学报,2007,37(2):749- 756。
玉米微阵列杂交方案。[http://www.maizearray.org/maize_protocols.shtml]
Van Gelder RN, von Zastrow ME, Yool A, Dement WC, Barchas JD, Eberwine JH:从有限数量的异质cDNA中合成扩增RNA。美国国家科学促进会。[j] .中国科学:地球科学。
Livak KJ, Schmittgen TD:利用实时定量PCR和2-ΔΔCT方法分析相关基因表达数据。方法,2001,25:402-408。
致谢
Peter J. Hermanson, Anna K. Bredsten和Anne Bergmark为田间和温室的表型测量提供了帮助。作者感谢明尼苏达大学微阵列设备执行Affymetrix微阵列化学。明尼苏达超级计算研究所提供了用于数据分析的软件包。本工作由NSF DBI 0421619向NMS提供支持。Robert Sandoval在70 mer微阵列实验中提供了帮助,该实验由NSF DBI 0321663向VLC提供支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
RMS构思本研究,参与其设计,收集杂种优势表型数据,进行Affymetrix微阵列杂交,进行所有微阵列数据分析并起草手稿。AGO进行了杂种优势表型数据的收集和分析。WJH进行实时PCR分析。VLC和JMG负责70粒微阵列杂交和扫描,并帮助起草稿件。NMS构思了这项研究,参与了它的设计,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2008_241_moesm2_esm.xls
附加文件2:自交系间的遗传距离和杂种的BPH值。21个自交系两两比较显示了内SNP遗传距离值。5个性状的BPH值在21个相应的杂交种和4个其他杂交种组合中也有显示。(xls22kb)
12870 _2008_241_moesm4_esm.pdf
附加文件4:差异表达基因的聚类分析。聚类分析比较近交系与杂交系的表达模式。(pdf 186kb)
12870 _2008_241_moesm5_esm.pdf
附加文件5:特定子组的d/a比率分布。特定基因亚群的d/a分布比较。(pdf 53kb)
12870 _2008_241_moesm6_esm.xls
附加文件6:Affymetrix和70-mer寡核苷酸微阵列平台上每个基因型生物重复之间的微阵列信号变化的估计。(xl18kb)
12870 _2008_241_moesm7_esm.xls
附加文件7:使用自由标准在至少一个杂交中鉴定为AHP或BLP的基因型之间的d/a值。6种杂交基因型中每一种的d/a值显示了在至少一种杂交中表现出AHP或BLP的基因。根据Affymetrix的数据,该显示用于识别杂交后代中AHP或BLP表达模式一致的基因。交叉验证数据从斑点微阵列和实时PCR平台也显示。(xl77kb)
12870 _2008_241_moesm8_esm.pdf
附加文件8:AHP和BLP基因的聚类分析。不同杂交基因型AHP和BLP谱的比较。(pdf 59kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
斯图塔尔,r.m.,加德纳,j.m.,奥尔德,A.G.et al。不同水平杂种优势玉米自交系和杂交种基因表达分析。BMC Plant Biol8,33(2008)。https://doi.org/10.1186/1471-2229-8-33
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-33
关键字
- 不同的表达
- 差异表达基因
- 其组
- 父母的范围
- 转录变异