摘要
背景
的拟南芥外胚珠被皮是一个简单的双细胞层状结构,生长在发育中的胚周围,发育为种皮的外层。由于种皮的功能之一是保护植物胚,所以胚珠外被皮是一个需要精确调控形态发生的植物器官。
结果
为了更好地描述外胚珠被的形态发生,我们分离了一些标记线显示绿色荧光蛋白在这个器官中的表达我们已经使用这些细胞系来识别外被皮中不同的细胞类型,并证明叶片和外被皮之间的相似性。使用共聚焦显微镜,我们显示细胞大小和形状之间的两层细胞的外层被。的表达KNAT1在外被层中导致额外的细胞分裂,特别是在外被层的外层。这是由该层细胞体积的减少来补偿的,因此表明存在控制适当的胚珠被形态发生的机制。
结论
的拟南芥胚珠外胚珠被可以作为研究植物器官形态发生基本原理的良好模型系统。这项工作为其发展提供了新的见解,并为识别植物器官生长过程中调节细胞分裂和伸长的因素提供了新的可能性。
背景
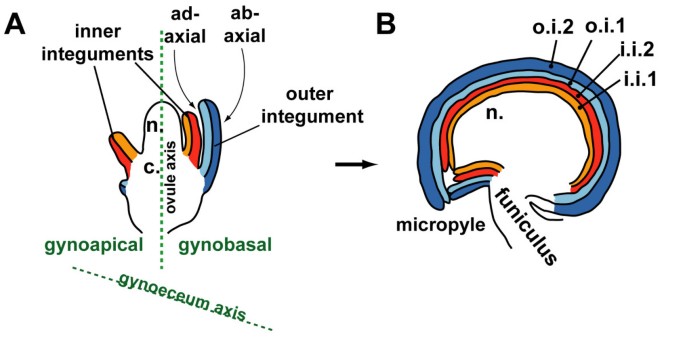
受精卵发育成包含植物胚胎的种子。在拟南芥,沿着胚珠原基的近端-远端轴可以识别出三个不同的区域(图1).原基最近的结构是梭状突起,它连接原基和胎盘。原基的远端有珠心,大孢子母细胞在珠心发育。原基中心区的合束产生两个珠被,每个珠被由两个细胞层组成[1,2].在胚珠发育过程中,两种珠被围绕珠心生长,受精后发育成包覆胚珠的种皮(图1).内胚珠最初发育为围绕着珠心的放射状对称结构,而外胚珠原基仅从面向心皮基部的一侧(雌蕊基侧)生长[1,2].在整个种子发育过程中,外层被皮保持双细胞层状[1,2].在种子发育的后期,外被皮的背面(外层)细胞最终分化为含有多糖黏液的高度特化种皮细胞[3.,4].
珠被是胚珠产生的唯一的外侧器官。珠被的进化起源仍然是一个有争议的问题。端粒理论认为,胚珠起源于不育或可育分支(端粒)的融合[5,6].一般认为内被和外被是独立产生的。内胚珠极有可能直接起源于端粒或孢子囊粒的融合,而外胚珠则被认为是后来从杯胞发展而来,杯胞是围绕着一个或多个胚珠的叶状结构[7,8].
的发展拟南芥胚珠外胚珠被皮与其他显性侧部植物器官(如叶子)的形成过程相同。胚珠外胚珠被膜是一种具有特定生长和形态的器官,其中细胞分裂和伸长的速率和方向需要被精确调节。非对称生长和分化也是其发展的基本特征。对于胚珠来说,适当的形态发生尤其重要,因为不适当的弯曲或闭合会导致种子的胚胎得不到充分保护。然而,被膜的延伸似乎对细胞分裂或细胞扩张的改变相对敏感。突变短INTEGUMENTS2(SIN2),例如,由于细胞数量减少,会导致被毛变短[9].突变的结果SIN1 / DCL1另一方面,由于缺乏细胞膨胀,被膜尺寸减小[1,10,11].
外被由于其简单的两层结构,是研究植物形态发生基本原理的理想器官。为此,需要更好地描述外被皮生长和细胞在被皮内的命运。为了解决这个问题,我们已经确定拟南芥绿色荧光蛋白(GFP)基因在外被膜不同区域特异性表达的增强陷阱系。这些细胞系为外被膜发育过程中细胞增殖和分化的特征提供了良好的标记。KNAT1是一种常在茎尖分生组织(SAM)中表达的同源结构域蛋白,在叶片中异位表达时会改变叶片形态[12,13].Misexpression的KNAT1导致外被膜背轴层细胞分裂增加,说明外被膜存在补偿机制,以保证其正常的形态发生。
结果
一种用于研究外皮发育的标记线筛
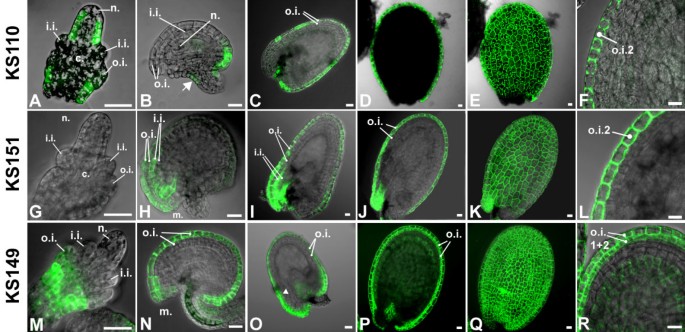
为获得研究外胚珠被发育的标记,以400个群体为研究对象拟南芥C24增强阱线[14被筛选为绿色荧光蛋白外层胚珠被皮的表达。6条线表现出稳定的绿色荧光蛋白组织中的表达。在含有拐杖阶段胚胎的种子种皮中,绿色荧光蛋白3个细胞系(KS059、KS110、KS151)在外被膜外层均有表达,1个细胞系(KS149)在外被膜两层均有表达,2个细胞系(M214、M237)均有表达绿色荧光蛋白表达仅限于外被膜外层的珠孔端。选择其中的4个(KS110, KS151, KS149, M237)进行更详细的分析绿色荧光蛋白共聚焦激光扫描显微镜观察胚珠和种子发育过程中的表达模式(三个独立植物的胚珠和种子,n≥5个/期)。
来描述绿色荧光蛋白我们将遵循斯金纳等人最近的建议。[15].我们将用“雌蕊基”一词来指胚珠原基面对心皮基部(花托)的那一面,用“雌蕊尖”一词来指面对心皮顶端(柱头)的那一面。术语“背面”和“正面”是指胚珠侧面器官,即珠被的极性(见图)1).
外被膜正面和背面极性的标记
绿色荧光蛋白KS110株系胚珠的表达仅限于外胚珠的背面(外层)(o.i.2)。在珠柄表皮生长之前就开始表达了(图2).随着外皮的生长,绿色荧光蛋白首先只在合点端表达(图2 b).在早期胚胎发生,绿色荧光蛋白表情贯穿整个o.i.2。在种皮发育的后期,表达持续在这一层(图2摄氏度来2 f).在胚珠发育早期,在珠心L1层也发现了GFP(图2).外被膜背面层的表达类似于的表达伊诺[16,17].不像伊诺然而,KS110标记也在女性根尖侧表皮层的一小部分细胞中表达(图中箭头所示)2 b).
共聚焦激光扫描图像绿色荧光蛋白增强诱捕系KS110、KS151和KS149在胚珠和种子发育过程中的表达模式.(一)来(F)绿色荧光蛋白KS110行中的表达式。(一),(B)胚珠发展:绿色荧光蛋白表达于外胚珠被皮的背面层和珠柄区雌蕊尖侧的细胞亚群中(箭头)。(C)来(F)种子发展:绿色荧光蛋白表达在整个o.i.2中。(G)来(左)绿色荧光蛋白KS151行中的表达式。(G)没有绿色荧光蛋白表达在胚珠发育早期可见。(H)受精后,在两胚珠的珠孔端均可见到GFP。(我)来(左)后期种子发展:绿色荧光蛋白在i.i.2的珠孔端和整个i.i.2表达。(M)来(右)绿色荧光蛋白KS149行中的表达式。(M),(N)绿色荧光蛋白最初只在o.i.2中表达。(O)来(右)在种子的发展过程中,绿色荧光蛋白在o.i.1中也可以看到表达。的箭头(O)显示o.i.1中表达的开始。(E),(K),(问)叠加投影图像(D),(J),(P),分别。(F),(左),(右)Scalebars: 20 μm。
行KS151也出现了绿色荧光蛋白o.i.2中的表达。表达开始于受精前后。与KS110行相比,绿色荧光蛋白最初仅在珠孔端表达(图2 h).后来可以在整个外被膜的外层看到它(图2我来2 l).此外,KS151线也有展出绿色荧光蛋白内胚珠背面细胞层的表达,在整个种子发育过程中表达一直局限于珠孔端。
与KS110和KS151株系相比,KS149株系表达了绿色荧光蛋白在两个外被膜层。在紧挨点下方的区域被皮生长之前观察到GFP荧光(图2米).在胚珠发育的早期阶段,绿色荧光蛋白只有在o.i.2中才有表情(图2 n).在种子发育早期,在o.i.1中也检测到GFP荧光。的表达绿色荧光蛋白在种皮发育后期,保留在两外层被皮中。微弱的绿色荧光蛋白在内皮细胞层也可见表达(图2 p, R).
该标记还可标记芽组织中正面和背面的细胞层
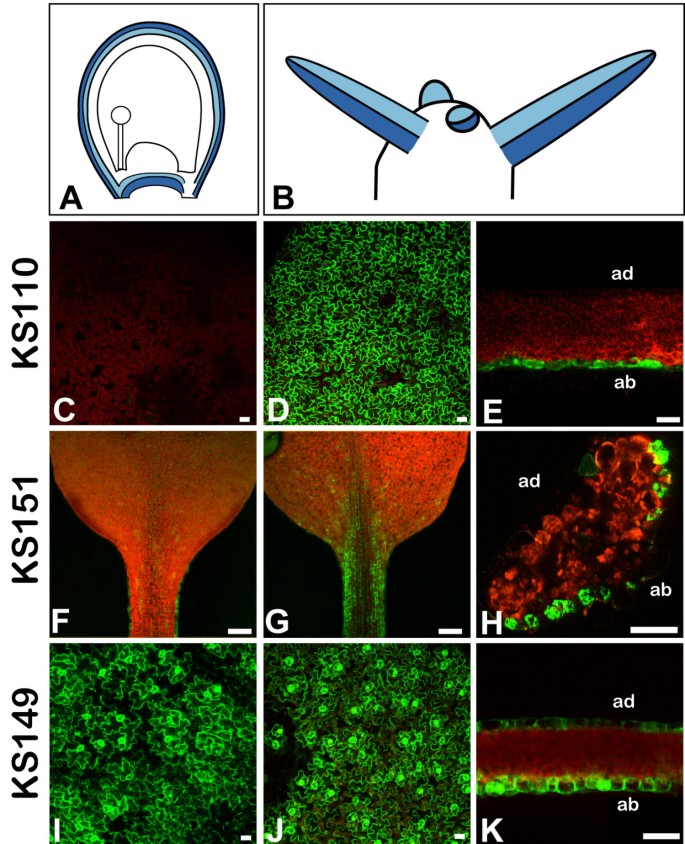
品系KS110、KS151和KS149表达绿色荧光蛋白在其他外侧器官中具有与外被皮相同的轴向偏好。在KS110植株的叶片和花瓣中表达绿色荧光蛋白局限于下表皮(图3 c来3 e).行KS151显示绿色荧光蛋白表达主要在叶柄中。同样,表达只存在于下表皮(图3 f来3 h)与不稳定的个别细胞表达绿色荧光蛋白在正面。在KS149的叶子和花瓣中,绿色荧光蛋白在表皮中表达强烈。与外部胚珠被皮一样,它没有表现出任何轴向偏好(图3我来3 k).
共聚焦激光扫描图像绿色荧光蛋白强化陷阱系KS110、KS151和KS149的叶片表达模式与胚珠表达相似.(一)外被膜的背面(深蓝色)和正面(浅蓝色)结构域。(B)茎尖分生组织外侧器官的背面和正面区域(颜色编码如(一)).(C)来(E)绿色荧光蛋白在KS110株系中仅在侧器官的后轴结构域表达。(C)没有绿色荧光蛋白在KS110叶片的正面表皮(红色为叶绿素自荧光)可见到表达。(D),(E)强大的绿色荧光蛋白在叶背面表皮可见表达。(F)来(H)绿色荧光蛋白在KS151株系中仅在侧器官的背轴结构域表达。(F)叶柄的正面表皮显示没有绿色荧光蛋白表达式。(G),(H)叶柄具的背面表皮绿色荧光蛋白表达式。(我)来(K)绿色荧光蛋白KS149系的表达标记了侧器官的前后轴结构域。近轴的(我)和轴外的(J)叶表皮显示绿色荧光蛋白表达式。(C),(D),(F),(G),(我),(J)显示表面视图,而(E),(H),(K)显示部分通过(E),(K)叶板或(H)标记线的叶柄比例尺:20 μm, in(F)而且(G): 100μm。
背面外被膜细胞层的远端区域的标记物
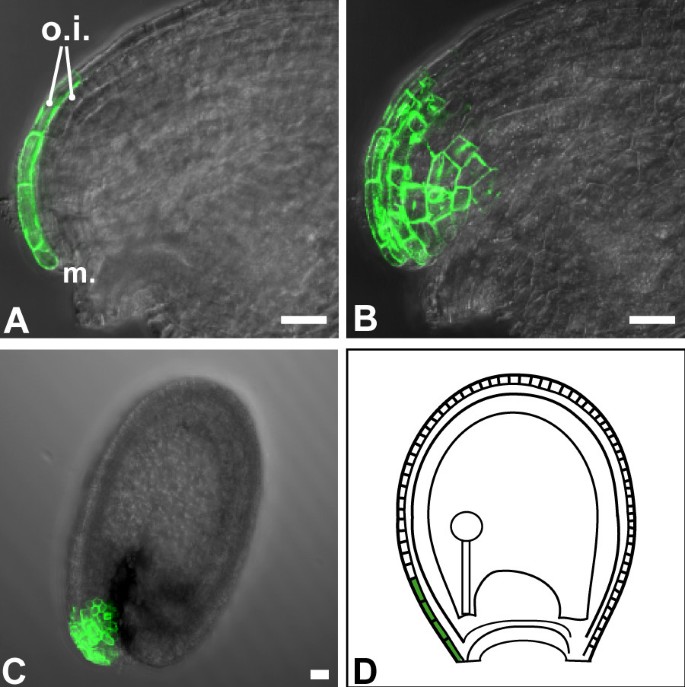
外被皮远端(珠孔端)的细胞明显拉长,因此与被皮其余部分的细胞不同。M0237细胞系的GFP荧光首先在受精前后被检测到,并且在整个种子发育过程中仅限于这些细胞(图4).因此GFP在细胞系M0237中的表达特异性地标记了这种细胞类型。M0237标记在叶片和花瓣中均未表达。
外被正面和背面细胞层的细胞大小和形状不同
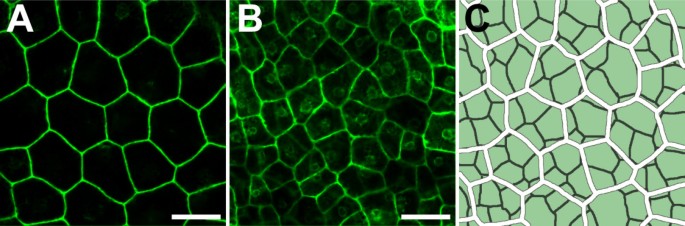
我们利用了共聚焦显微镜的优势,这使得在不需要物理组织切片的情况下对单个细胞层成像成为可能。细胞系KS149显示GFP在两层外被膜细胞中表达,用来观察o.i.1和o.i.2中的细胞。对球形期(4 ~ 8细胞期)胚种子进行了分析。的图片绿色荧光蛋白分别取o.i.1和o.i.2表达细胞(图5 a、B).在分析的3种种皮中,o.i.2的细胞面积显著(p≤0.0001)大于o.i.1的细胞面积[见附加文件]1].此外,外层的大部分细胞是7面的,而内层的细胞更多是6面的[见附加文件]1].
异位表达KNAT1在胚珠外胚珠被形成过程中引起额外的细胞分裂,揭示了一种代偿机制
KNOX同源结构域蛋白的过表达导致正常确定器官的不确定性,如叶片[12,13,18].异位表达KNAT2在胚珠中导致珠心同型转变为腕皮结构兰茨贝格erecta(l)背景(Pautot等.2001)。目的:研究植物胚珠的发育KNAT1过度表达的植物,KNAT1将cDNA翻译融合到黄色荧光蛋白YFP的基因上,置于CAMV 35S启动子的控制下[19].为了确保KNAT1的核定位,从SV40 t抗原中提取的核定位序列(NLS) [20.被添加到KNAT1-YFP融合。二十独立拟南芥获得C24生态型株系。其中11个株系表现出先前描述过的特征性裂叶表型KNAT1过度表达植物(12,13].选择3个叶片叶裂较强的品系对T3和T4代(品系13、41和51)进行进一步分析。细胞核定位的KNAT1-YFP荧光在这些细胞系胚珠的所有细胞中均可见,贯穿整个发育阶段(未显示)。
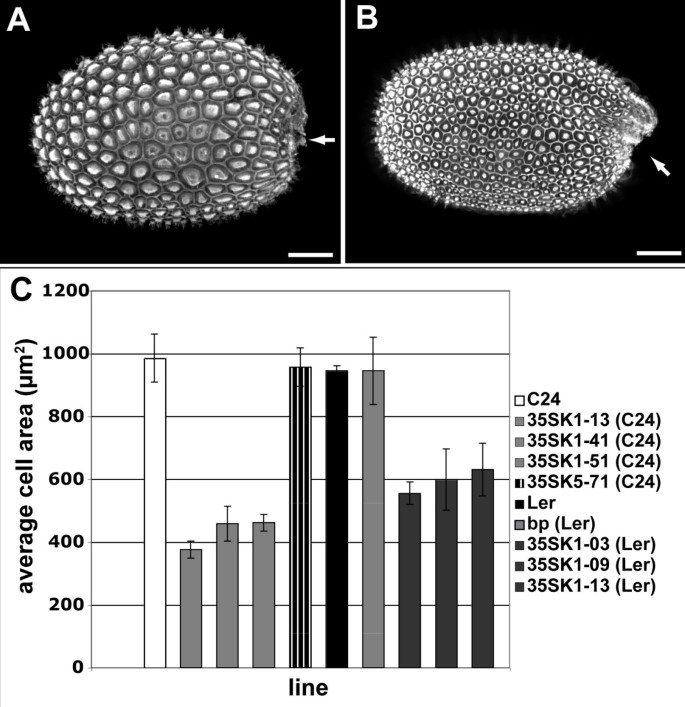
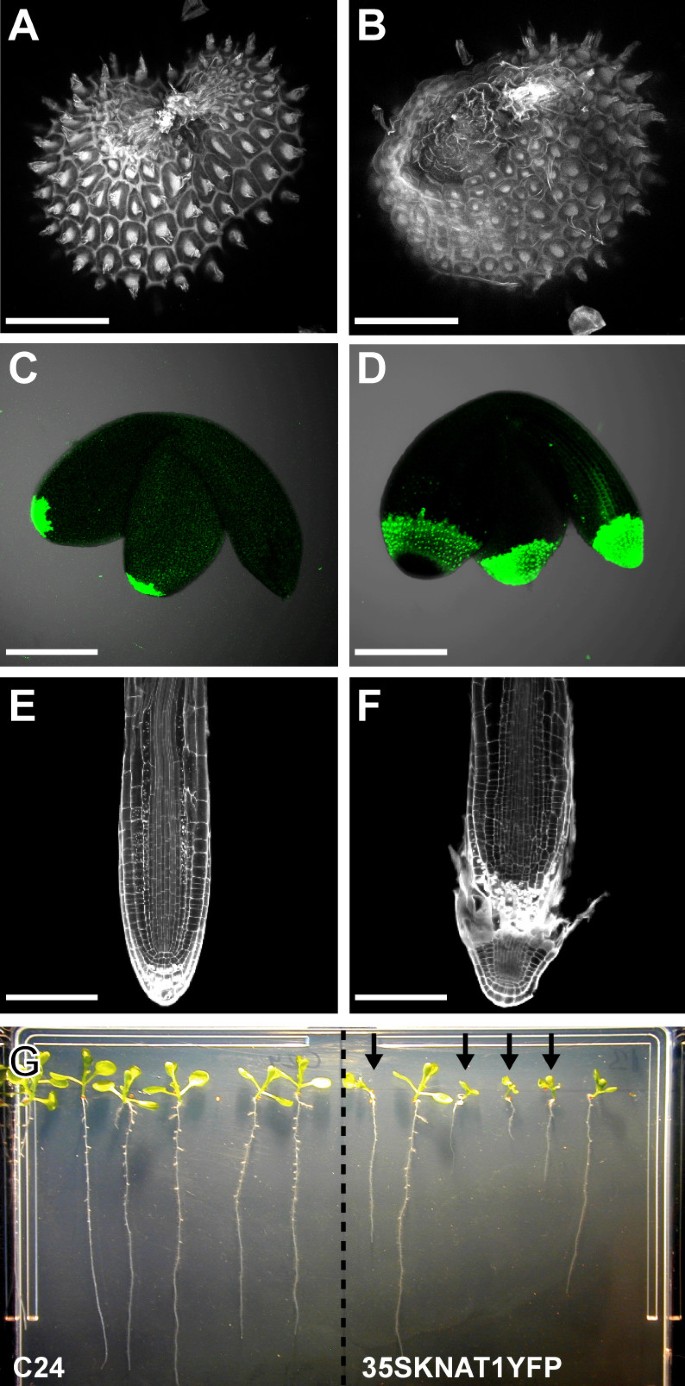
用荧光染料红素O对种子进行染色,用共聚焦显微镜观察种子形态。种子的KNAT1过表达植物与野生型C24种子在形态学上有两个明显的差异:
1) an的形状拟南芥野生型种子像一个椭球体,两极位于珠柄附着的一侧或对面。野生型种子的珠被与种子的珠柄约在种子的珠柄侧的中间闭合。在的种子KNAT1过表达者这种闭合向雌蕊基侧转移(见图中箭头)6 a、B).
- 2)
种皮细胞大小明显减小KNAT1过度表达行(图6 a、B).三种种子的种皮细胞面积(n≥25)KNAT1测定过表达系,并与野生型进行比较。种皮内的细胞区KNAT1过表达的细胞株大约是野生型细胞面积的一半6摄氏度).差异极显著(p值:35SK1-13: 0.0025, 35SK1-41: 0.0052, 35SK1-51: 0.0036)。由于种子大小的野生型和KNAT1错误表达的线条均无差异(未显示),异位表达KNAT1因此在种皮外层形成了大约两倍的细胞。
细胞大小的减小并不是癌症的普遍特征KNAT1过表达。测定成熟花瓣表皮的背面和正面层的细胞面积(每个花瓣的细胞数≥22个,分析3个植株的6个花瓣)。两种植物的花瓣细胞面积大小没有差异KNAT1过度表达和野生型(未显示)。
比较KNAT1过表达表型与表型报告的过表达KNAT2,我们还介绍了35 s: KNAT1-YFP-NLS构建成一个l背景。与在C24背景中观察到的类似的种皮细胞大小的减少被检测到6摄氏度),但未观察到同种异体转化。
转a基因的植物种皮正常35 s: KNAT5-YFP-NLS构造(C24背景)(图6摄氏度;[21])。因此,我们可以排除YFP在细胞核中干扰正常细胞增殖的正式可能性。
额外的细胞分裂KNAT1过表达植株主要发生在受精后外被皮的背面
跟踪种皮的发育KNAT1在过表达植物中,我们跨越了增强子陷阱系M0237、KS110、KS149和KS151,以及组成表达质膜定位形式的绿色荧光蛋白[22,23)到KNAT1过度表达。作为比较,标记线也回交叉到C24。分析了F1代发育的胚珠和种子。
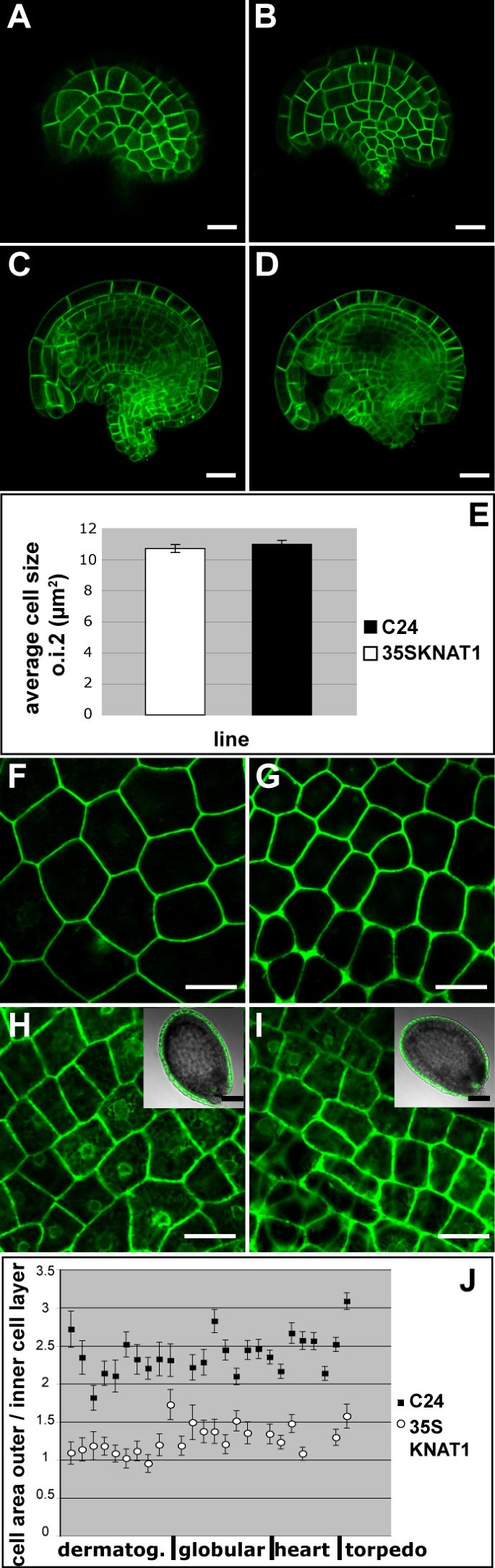
膜标记系的杂交后代KNAT1在施肥前,用过表达植株分析背面层(o.i.2)的细胞面积大小。野生型和野生型外被膜外层细胞大小一致KNAT1过度表达植物(图7一个来7 e).
野生型和野生型的外被皮细胞区KNAT1不同发展阶段的错误表达.(一)来(E)受精阶段胚珠种皮细胞大小表现为GFP与膜定位蛋白的融合。(一)野生型胚珠的外层被皮。(B)胚珠的外层被皮KNAT1misexpressing植物。(C)而且(D)是光学部分(一)而且(B),分别。(E)o.i.2细胞的细胞面积测量结果显示野生型(黑色)和野生型之间的细胞面积没有差异KNAT1在这个阶段错误表达(白色)植物。(F)来(J)受精后胚珠种皮细胞面积大小。(F)来(我)种子具球状期胚。(F)o.i.2和(H)KS149行的o.i.1。(G)o.i.2和(我)o.i.1的KNAT1过表达的植株跨越到KS149株系。细胞在o.i.2KNAT1表达错误的植物明显更小。(J)野生型和野生型的o.i.2细胞面积与o.i.1细胞面积的比值KNAT1在种子发育的不同阶段表达错行。所示为与胚胎发育阶段相关的单个发育种子的被皮细胞面积(n = 25 - 30)的测量值。黑色方块:野生型。白圈:KNAT1misexpressing线。比例尺:20 μm,插入100 μm。
通过与KS149系的杂交,分析了胚珠受精后两外层细胞的大小。拍摄了不同发育阶段种子的两层细胞图像。细胞面积测定结果表明,只有外被膜背面层的细胞KNAT1过表达植株比野生型植株小。从胚胎发育早期开始,在野生型背景下,背轴细胞面积与正面细胞面积之比为2.4(+/- 0.328):1,在野生型背景下为1.27(+/- 0.194):1KNAT1过度表达的背景(图7 f来7 j)(任意选择的3个数据点的p值:≤0.0001)。这些数字表明,平均而言,细胞在o.i.2进行了一次额外的细胞分裂KNAT1在受精前后或受精后不久过度表达植物。因此,在KNAT1过表达系外被膜背面细胞层与正面细胞层细胞大小相近。
我们可以排除不同的反应KNAT1外被膜两层细胞中的错误表达是由用于的35S启动子的不同活性引起的KNAT135S启动子在胚珠发育过程中表达一致[见附加文件]2].
异位表达KNAT1导致标记基因表达改变
KS110线交叉到KNAT1过表达系导致植株表达量显著降低绿色荧光蛋白o.i.2。绿色荧光蛋白仅在随机细胞的一个子集中表达,表达的结果稍后与绿色荧光蛋白在KS110线路中回交叉到C24(图8 e, F).相比之下,KNAT1-YFP-NLS融合在整个o.i.2中正常表达,不包括荧光蛋白基因的共抑制(未显示)。这显示了细胞背面细胞层命运的改变。KS110标记的下调是在被皮中特异性的,而在叶中没有观察到KNAT1过度表达植物。
外层被膜细胞的过度增殖导致更明显的被膜低发育
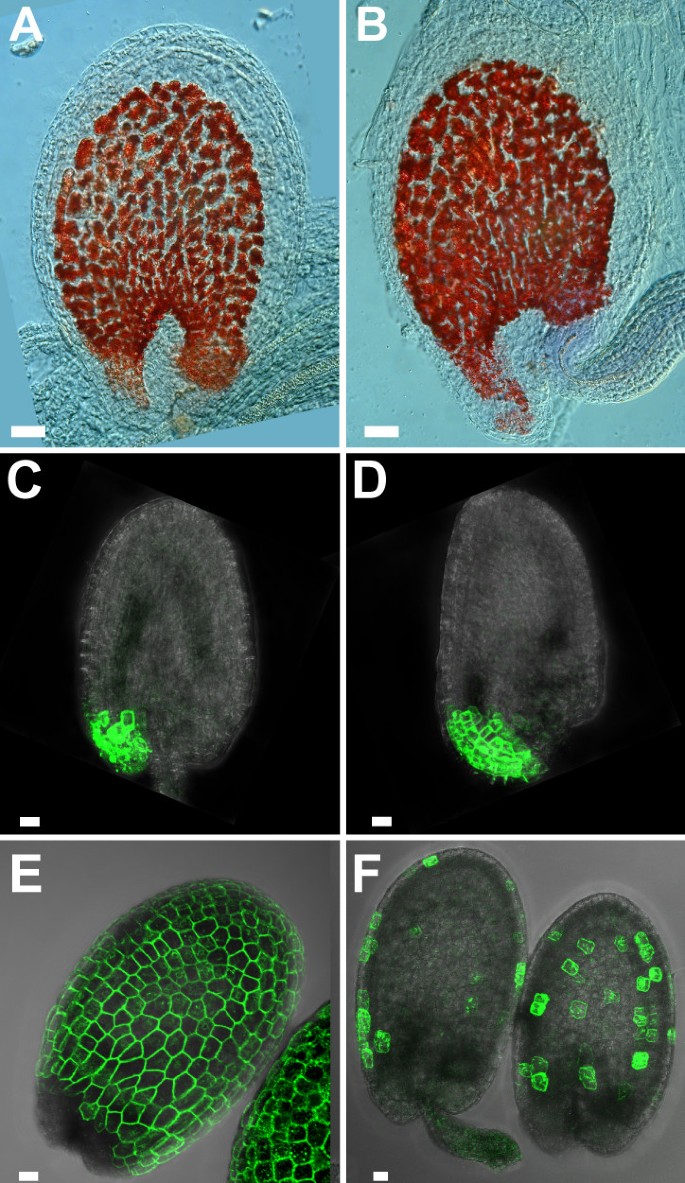
在野生型种子的发育过程中,珠孔端和合点端几乎是水平的。这反映在内皮的形状上。数字8 a、B显示野生类型和种子KNAT1胚胎发育早期的过表达者。内皮细胞积累原花青素,因此可以选择性地用香兰素染色。与野生型不同,在过表达植株的胚珠中,珠孔端位于合点端下方KNAT1.
在被交叉到的M0237行中也看到了同样的情况KNAT1过度表达植物。异位表达KNAT1的区域。绿色荧光蛋白M0237在被皮珠孔端的表达向雌蕊基侧转移。此外,绿色荧光蛋白由于表达的细胞较多,表达域较野生型长绿色荧光蛋白在珠孔端(图8 c, D).与其他被膜不同的是,珠孔末端的细胞似乎不能通过缩小它们的大小来完全补偿额外的细胞分裂。因此,更多大小正常的细胞表达绿色荧光蛋白标记。
总之,虽然细胞伸长的减少在很大程度上补偿了异位表达的植物o.i.2中额外的细胞分裂KNAT1,更明显的低发育性生长的被膜仍然明显。种子的形状KNAT1过表达的植株有轻微的扭曲,被的闭合向雌蕊基侧转移(见图)6 a、B).由于胚珠弯曲,更多的组织暴露在没有种皮保护的珠索端(见图)9 a、B).
在成熟的拟南芥种子:胚弯曲,根尖在珠孔端,子叶尖在种子的合点端[24].因此,根尖最靠近无保护的部位KNAT1过度表达植物种子。我们注意到幼苗KNAT1过表达系通常在根生长中受损,并在更早的阶段形成次生根(图9克).这些幼苗似乎在胚胎根尖有局部组织损伤,有时也在子叶尖端(图9 c来9 f).为了量化我们的观察,种子(n = 30)的C24和KNAT1对过表达系进行萌发,并统计根系生长不良的幼苗数量。野生型根生长正常,有3.5%(第41行)和7.1%(第13行)KNAT1过度表达者表现为生长受损。次氯酸钠处理通常用于种子表面杀菌,可显著增加根系生长严重受损的幼苗数量。次氯酸钠处理5分钟,根尖受损率分别为20%和36%(野生型对照为3.5%)。暴露30分钟后,两种转基因株系中90%以上的幼苗根尖不活(野生型对照:6.6%)。因此,种皮KNAT1过度表达的植株对漂白剂溶液的保护效果较差,且珠被闭合部位的细胞最容易受到损伤。
讨论
外被膜的基因表达域
我们选择了四种拟南芥enhancer-trap线(14]用于胚珠外被膜基因表达域的研究。这些线表示绿色荧光蛋白在内源性增强子的控制下,取决于增强子陷阱结构插入植物基因组。本研究中获得的谱线可用于胚珠发育的分析,正如这里所示的分析KNAT1misexpressing胚珠。
的研究可以得出两点绿色荧光蛋白1) o.i.1和o.i.2细胞的不同细胞特性是在早期被皮发育时确定的,并得到维持。行KS110和KS149显示绿色荧光蛋白在受精前胚珠发育外被膜的外被膜2中表达,而在外被膜1中不表达。伊诺也显示了类似的表达式模式[16,17].在珠被中极性的建立可能对珠被的生长很重要,就像叶子一样(最近的综述见[25])。相比伊诺,绿色荧光蛋白KS149和KS110的表达不表现出对雌蕊轴的轴向偏好。行KS110和KS151显示绿色荧光蛋白外被膜外层的表达也贯穿整个种子发育过程。o.i.1和o.i.2之间的差异在种皮发育后期变得明显,此时只有o.i.2的细胞分化为含有种皮细胞的粘液[3.,4].
2)两种种子被珠孔末端的细胞与其余的被珠孔细胞不同。这些细胞也表现出明显的形态差异,它们明显长于一般的被皮细胞[1].此外,他们对KNAT1misexpression。形态上的差异反映在被皮其他部分不存在的标记的表达上。M0237系在受精后和种子发育过程中特异性标记了o.i.2的珠孔端细胞。KS151系标记了两个被毛外层细胞的这个区域。在珠孔末端的细胞很可能具有特定的功能,如保护从珠孔末端生长出来的胚胎。此外,该区域包括在被皮生长过程中最早伸长的细胞。这些细胞的不同扩张可能有助于使组织弯曲,形成胚珠的特征性形状。
叶和外层被皮极性相似
我们标记系的表达模式支持了一个理论,即外部被膜是由叶状结构发展而来的[7,8].而KS110、KS149和KS151与绿色荧光蛋白外胚珠的表达不显示内胚珠的表达,但均显示绿色荧光蛋白在叶子和其他叶状结构中也有表达,如花瓣。此外,表达在外被皮背面的标记(KS110和KS151)在叶片中也表现出相同的极性表达。到目前为止,还没有发现只在o.i.1中表达的基因。到目前为止,我们还没有确定一个增强陷阱行显示绿色荧光蛋白仅在o.i.1中表达(未发表的结果)。令人惊讶的是,最近的研究表明PHABULOSA(的PHB),是一种在叶片正面表达的同源域基因[26,27,在内被皮中表达[28].这就引发了人们的猜测,认为这两种观点是对的拟南芥胚珠可能是由一个单体前体的一个被皮分裂而产生的。28].然而,根据这一点,我们可以预期绿色荧光蛋白第KS149行中的表达式可以在两个串中找到,如绿色荧光蛋白在本系所有叶细胞层均有表达。为了澄清这些相互矛盾的发现,我们需要在整个植物水平上研究更多胚珠表达基因的表达模式。
KNAT1超表达表型
许多在SAM发育中起作用的基因对胚珠的发育也很重要反之亦然.虽然KNAT1通常在胚珠中不表达[13,29,30.,很有可能KNAT1,当在胚珠中表达时,可与SAM中正常KNAT1相互作用伙伴的其他蛋白质相互作用。此外,其他诺克斯基因可在胚珠中表达,并参与胚珠发育过程中分生组织活动的调控。在许多情况下,基因家族的成员由于表达模式的改变而在功能上变得多样化,但它们的活动仍然是可互换的。例如,YABBY家族的一些成员可以恢复在ino-1突变体。然而,只有胚珠表达伊诺对超人(SUP)规定的限制敏感吗伊诺在胚珠原基雌蕊基侧的表达[17,31].因此,KNAT1可能部分采用另一个KNOX同源结构域蛋白的作用,但对适当的调控机制不敏感。
在拟南芥SAM、KNAT1和STM1一起在过渡区发挥作用,在过渡区通过维持干细胞子细胞在被器官形成消耗之前的分生组织特性,允许干细胞子细胞的扩增[32].根据其在SAM中的作用,KNAT1叶片中过表达表型被解释为生长特性从确定向不确定转变的结果[12,13,33].此外,KNAT1功能丧失的突变brevipedicellus(英国石油公司)显示节间和花梗的细胞分裂缺陷,表明在这些器官中维持不确定状态也需要KNAT1 [29,30.].花梗内的细胞分化、伸长和生长英国石油公司突变体在植株的后轴侧受影响较前轴侧严重,导致花梗生长角度发生变化。
的表达KNAT1在胚珠珠被中触发异位细胞分裂,这与KNAT1在维持不确定性中的作用一致。目前我们无法解释为什么KNAT1的存在只在o.i.2中有可见的影响。然而,表型英国石油公司花梗的背面似乎比正面更受KNAT1的影响。也有可能表达KNAT1在被皮内引起了外被皮的一定程度的正面化,因此o.i.2会采用o.i.1的特征。两个观察结果支持这种解释。首先,表达KNAT1在被膜中,oi.2细胞的分裂频率与oi.1细胞的分裂频率大致相同。第二,通常在o.i.2中表达但在o.i.1中不表达的一种标记在KNAT1表达胚珠。由于没有仅在o.i.1中表达的标记可用,我们无法测试相反的情况。
外被膜形态发生过程中细胞增殖的调节
我们发现外被膜的两层细胞大小有明显差异。o.i.2的细胞面积是o.i.1的2.4倍,这表明在被皮发育过程中,正面层的细胞比背面层的细胞多分裂大约1次。
Misexpression的KNAT1几乎消除了两层细胞面积大小的差异。正式地说,是指在被皮的o.i.2中发现的数目较多的小细胞KNAT1过表达的植物可能是细胞伸长受损或细胞分裂增加的结果。KNAT1更有可能促进了细胞分裂,因为在额外的细胞分裂已经发生后,o.i.2的细胞仍然能够拉长。在o.i.2中存在着一种补偿机制,它限制了细胞的扩张,因此也限制了相对正常大小和形状的外被膜的发育。
在叶片形态发生过程中,存在着补偿细胞分裂或扩张缺陷的机制(综述见[34,35])。一般来说,细胞数量的减少或细胞伸长的增加可以分别通过细胞膨胀的增加或细胞分裂的减少来补偿。到目前为止,只有少数例子表明细胞分裂数量增加或细胞扩张减少,如图所示KNAT1在o.i.2中的表达,可能导致类似的补偿机制[35,36].据我们所知,特定细胞层细胞分裂增加,这将更准确地对应KNAT1过表达表现型,目前还没有实现。因此,KNAT1胚珠的过表达表型首次描述了一种代偿机制,该机制涉及细胞伸长的减少,以补偿特定细胞层中细胞分裂的增加。在整个器官水平上对被膜大小的严格控制和oi.1和oi.2之间的细胞-细胞通讯必须被假定。
为拟南芥研究表明,胚乳的生长与被皮细胞的伸长有相互作用,从而控制胚乳的生长拟南芥种子大小(37].此外,我们发现,两层外被膜细胞的生长是精确和独立调控的,以实现协调的被膜形态发生。因此,外被膜是研究导致植物器官最终形状的协调细胞增殖机制的一个很好的系统。
结论
这项工作表明,过去没有认识到的代偿机制的存在,以确保正确的胚珠被形态建成。此外,我们还证明了胚珠外胚珠被可以作为研究植物器官形态发生基本原理的良好模型系统。外部被膜是一个简单的两细胞层状结构,仅由几种不同的细胞类型组成,并且很容易通过共聚焦显微镜观察到。标记线,表示绿色荧光蛋白在两层外被皮中,我们可以测量发育中的两层外被皮的细胞面积拟南芥野生型种子,可用于高通量筛选被皮细胞分裂模式改变的突变体。Misexpression的KNAT1在胚珠中产生一种清晰和容易看到的表型,可用于识别在器官水平上参与调节细胞分裂和伸长的因素。
方法
转基因线
GAL4-GFP增强子陷阱线[14KS110, KS149, KS151和M0237可从诺丁汉拟南芥股票中心(证券交易所)[38]分别为股票编号N9260、N9266、N9267和N9339。其他从NASC获得的转基因株系:bp-1(NW30)。
转基因植物的构建
的产生KNAT1过表达式结构已被描述[21].质粒被电穿孔根癌土壤杆菌GV3101 [39].拟南芥生态型C24和Ler通过花浸转化[40].在含50 mg/l卡那霉素的培养基上选择转基因植株。
生长条件
在光照16 h、暗光周期8 h的条件下,在含0.5× Murashige和Skoog盐混合物(MS)、0.5 g/l pH为5.7的2-(N-morpholino)乙磺酸(MES)和0.7%琼脂的培养基上萌发生长。为了分析胚珠发育,将植物在温室恒定条件下的土壤上生长。
共焦激光扫描显微镜
共聚焦激光扫描显微镜使用徕卡TCS NT/SP显微镜。激发波长GFP为488 nm, YFP为514 nm。
种皮染色
用藏红花O染色成熟种皮,种子在1:10培养基中培养5在室温下稀释藏红花O(分子探针,尤金,美国)15分钟。用激发波长为488 nm、采集窗口为540 - 600 nm的共聚焦激光扫描显微镜对种子进行成像。按照Nesi等人的方法用香兰素对内皮细胞进行染色。[41].
细胞面积测量
为了测量种皮细胞的面积,用共聚焦激光扫描显微镜通过外胚珠被皮进行光学切片。细胞面积测量在一台Macintosh计算机上使用公共领域NIH图像程序(由美国国立卫生研究院开发,可在互联网上获得]进行。42])。
为了测量花瓣细胞面积,用水合氯醛清除花瓣,用数码相机在显微镜下拍摄图像。花瓣细胞面积的测量如上所述。
次氯酸钠处理
为了对种子进行杀菌,并作为种皮的功能测试,将种子浸泡在2.4%活性次氯酸钠的溶液中(培养时间见结果部分)。种子用无菌水冲洗2次后,镀于培养基上。
参考文献
- 1.
robinsen - beers K, Pruitt RE, Gasser CS:野生型拟南芥的胚珠发育和两个雌性不育突变体。植物生态学报,2004,22(4):369 - 369。10.1105 / tpc.4.10.1237。
- 2.
作者:王晓东,王晓东,王晓东。拟南芥野生型胚珠发育的光学显微镜研究。植物学报,1995,7(5):731-749。10.1046 / j.1365 - 313 x.1995.07050731.x。
- 3.
Western TL, Skinner DJ, hengn GW:拟南芥种皮粘液分泌细胞的分化。植物生理学报,2004,22(2):356 -356。10.1104 / pp.122.2.345。
- 4.
Windsor JB, Symonds VV, Mendenhall J, Lloyd AM:拟南芥种皮发育:外被皮的形态分化。植物学报,2000,22(6):493 -493。10.1046 / j.1365 - 313 x.2000.00756.x。
- 5.
JM先生:胚珠的起源。植物学报,1995,82(4):547-564。10.2307 / 2445703。
- 6.
Zimmermann W:“端粒理论”的主要结果。古植物学家,1952,1:456-470。
- 7.
Stebbins GL:开花植物:物种层次以上的进化。马萨诸塞州剑桥,哈佛大学贝尔纳普出版社1974年。
- 8.
王晓燕,王晓燕,王晓燕。胚珠发育的遗传分析。植物生理学报,1998,19(4):347 - 347。10.1146 / annurev.arplant.49.1.1。
- 9.
Broadhvest J, Baker SC, Gasser CS: SHORT被丝2在拟南芥生殖发育过程中促进生长。中国生物医学工程学报,2000,32(2):369 - 371。
- 10.
Golden TA、Schauer SE、Lang JD、Pien S、Mushegian AR、Grossniklaus U、Meinke DW、Ray A: SHORT INTEGUMENTS1/SUSPENSOR1/CARPEL FACTORY是拟南芥胚胎发育所需的母体效应基因。植物生理学报,2004,25(2):366 - 366。10.1104 / pp.003491。
- 11.
Ray A, Lang JD, Golden T, Ray S: SHORT INTEGUMENT (SIN1)是拟南芥胚珠发育所需的基因,也控制着开花时间。科学通报,1996,29(6):633 - 636。
- 12.
KNAT1在拟南芥中过表达时诱导异位分生组织的裂叶。植物生态学报,2004,22(4):369 - 369。10.1105 / tpc.8.8.1277。
- 13.
Lincoln C, Long J, Yamaguchi J, Serikawa K, Hake S:拟南芥中一个knotted1-like同源异构体基因在营养分生组织中表达,在转基因植物中过表达会显著改变叶片形态。植物生态学报,2004,25(6):369 - 369。10.1105 / tpc.6.12.1859。
- 14.
用于活细胞多光谱成像的GFP变体。方法细胞生物学杂志1999,58:139-151。
- 15.
Skinner DJ, Hill TA, Gasser CS:胚珠发育的调控。植物细胞,2004,16增刊:S32-45。10.1105 / tpc.015933。
- 16.
Balasubramanian S, Schneitz K:喷嘴在拟南芥胚珠发育过程中调节近端-远端模式形成、细胞增殖和早期孢子发生。中国科学(d辑:自然科学版)。
- 17.
Meister RJ, Kotow LM, Gasser CS: SUPERMAN减弱拟南芥胚珠外胚珠正内NO自调节以维持胚珠外胚珠极性发育。科学通报,2002,29(3):369 - 369。
- 18.
王晓燕,王晓燕,王晓燕:植物叶片发育的遗传与分子分析。中国生物医学工程学报,1994,29(4):447 - 448。
- 19.
欧德尔·JT,纳吉·F,蔡新华:花菜花叶病毒35S启动子活性所需DNA序列的鉴定。自然学报,1985,313(6005):810-812。10.1038 / 313810 a0。
- 20.
Kalderon D, Roberts BL, Richardson WD, Smith AE:一种短氨基酸序列,能够确定核位置。中国生物医学工程学报,2004,39 (3 Pt 2): 399 -509。10.1016 / 0092 - 8674(84) 90457 - 4。
- 21.
Truernit E, Siemering KR, Hodge S, Grbic V, Haseloff J:拟南芥根中KNAT基因的表达图谱。植物生物学杂志,2006,60(1):1-20。10.1007 / s11103 - 005 - 1673 - 9。
- 22.
Cutler SR, Ehrhardt DW, Griffitts JS, Somerville CR:随机GFP::cDNA融合使拟南芥细胞亚细胞结构的可视化在高频率。中国科学:地球科学,2000,29(6):369 - 369。10.1073 / pnas.97.7.3718。
- 23.
库鲁普,罗尤斯,柯勒,拉普拉泽,霍奇,哈瑟洛夫J:活体组织细胞谱系的标记。植物学报,2005,42(3):444-453。10.1111 / j.1365 - 313 x.2005.02386.x。
- 24.
拟南芥:形态学和发育图谱。柏林和纽约,Springer-Verlag 1993。
- 25.
Byrne ME:叶子发育中的网络。植物学报,2005,8(1):59-66。10.1016 / j.pbi.2004.11.009。
- 26.
拟南芥叶片极性和分生组织的形成。发展与发展,1998,25(5):359 - 359。
- 27.
麦康奈尔,Emery J, Eshed Y, Bao N, Bowman J, Barton MK: PHABULOSA和PHAVOLUTA在枝条径向模式决定中的作用。自然学报,2001,38(4):359 - 361。10.1038 / 35079635。
- 28.
王晓燕,王晓燕,王晓燕,王晓燕,等。拟南芥胚珠发育过程中胚珠模式的形成。中国生物医学工程学报,2004,29(3):369 - 369。10.1016 / j.ydbio.2004.05.037。
- 29.
Douglas SJ, Chuck G, Dengler RE, Pelecanda L, Riggs CD: KNAT1和ERECTA调控拟南芥花序结构。植物学报,2004,14(3):547-558。10.1105 / tpc.010391。
- 30.
Venglat SP、Dumonceaux T、Rozwadowski K、Parnell L、Babic V、Keller W、Martienssen R、Selvaraj G、Datla R:同源框基因BREVIPEDICELLUS是拟南芥花序结构的关键调控基因。中国生物工程学报,2004,22(3):379 - 379。10.1073 / pnas.072626099。
- 31.
Meister RJ, Oldenhof H, Bowman JL, Gasser CS: YABBY蛋白在生殖发育过程中的多个蛋白区域参与了其差异活性。植物生理学报,2004,25(2):366 - 366。10.1104 / pp.104.055368。
- 32.
Byrne ME, Simorowski J, Martienssen RA:不对称LEAVES1揭示了拟南芥knox基因的冗余。发展,2002,129(8):1957-1965。
- 33.
Frugis G, Giannino D, Mele G, Nicolodi C, Chiappetta A, Bitonti MB, Innocenti AM, Dewitte W, Van Onckelen H, Mariotti D:莴苣中KNAT1的过表达使叶片的确定生长转变为与异戊烯基型细胞分裂素积累相关的芽状不确定生长。植物生理学报,2001,26(4):369 - 369。10.1104 / pp.126.4.1370。
- 34.
器官的形状和大小:叶片形态发生研究的一个教训。植物生物学杂志,2003,6(1):57-62。10.1016 / S1369526602000055。
- 35.
Tsukaya H:叶子形状:遗传控制和环境因素。中国生物医学工程杂志,2004,23(5):547-555。10.1387 / ijdb.041921ht。
- 36.
贺iguchi G, Ferjani A, Fujikura U, Tsukaya H:拟南芥(Arabidopsis thaliana)细胞增殖和细胞膨胀的协调作用对叶片大小的控制。植物保护学报,2006,26(1):37-42。10.1007 / s10265 - 005 - 0232 - 4。
- 37.
Garcia D, Fitz Gerald JN, Berger F:拟南芥被皮细胞伸长的母系控制和胚乳生长的合子控制协调决定种子大小。植物细胞学报,2005,17(1):52-60。10.1105 / tpc.104.027136。
- 38.
- 39.
Koncz C: TL-DNA基因5的启动子控制由一种新型农杆菌二元载体携带的嵌合基因的组织特异性表达。中国生物医学工程学报,2004,25(4):369 - 369。10.1007 / BF00331014。
- 40.
Clough SJ, Bent AF:花浸渍:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 41.
Nesi N, Jond C, Debeaujon I, Caboche M, Lepiniec L:拟南芥TT2基因编码一个R2R3 MYB结构域蛋白,该蛋白在种子发育过程中起着原花青素积累的关键决定作用。植物科学学报,2001,13(9):2099-2114。10.1105 / tpc.13.9.2099。
- 42.
确认
我们感谢M. Bauch和K. Siemering在生成M0237、KS110、KS149和KS151标记线方面的协助。感谢A. Navid, J. Stolz, W. Dewitte, J. c。帕劳基,J. Murray和V. Pautot寻求有用的建议。这项工作得到了盖茨比慈善基金会和BBSRC的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
ET负责实验的设计、协调和实施,并起草了手稿。JH参与了实验的协调和手稿的起草。所有作者阅读并批准了最终稿件。
电子辅料
外层胚珠被皮细胞的大小和形状
附加文件1:。(一)球形胚种子的o.i.2和o.i.1细胞面积测定结果显示,两层间细胞大小有显著差异。(B)外层两层细胞形态分布。(JPEG 152 KB)
12870 _2008_243_moesm2_esm.jpeg
附加文件2:35S启动子在胚珠中的活性是均匀的。在35S启动子的控制下,胚珠发育在质膜中表达GFP的直线中可见。35S启动子在整个发育阶段表达一致。Scalebars: 20μm。(JPEG 662 KB)
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
E.特鲁尼特,J.哈瑟洛夫。拟南芥外胚珠被皮形态发生:异位表达KNAT1揭示了补偿机制。BMC植物杂志8日,35(2008)。https://doi.org/10.1186/1471-2229-8-35
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-35
关键字
- 绿色荧光蛋白
- 种皮
- 技条顶端分生组织
- 绿色荧光蛋白表达
- 外层覆盖物