摘要
背景
三个突变拟南芥哥伦比亚-应变cpr1,snc1,落下帷幕-映射到RPP5基因座,包含一群疾病电阻基因。在这些突变体中观察到的相似表型、基因表达模式和遗传相互作用与病原体防御信号的本构激活有关。然而,这些突变等位基因对不同条件的反应不同。暴露于诱变剂,如乙基甲烷磺酸盐(EMS)和γ-照射,可引起高频表型不稳定落下帷幕等位基因。此外,一小部分落下帷幕而且cpr1等位基因分开落下帷幕×cpr1F1杂交种也表现出表型不稳定的迹象。为了进一步了解其表型不稳定性的机制落下帷幕而且cpr1突变,我们系统地比较了这些不寻常的等位基因的行为和错误的功能获得snc1等位基因对DNA损伤或通过F1杂种的反应。
结果
我们发现cpr1等位基因类似于落下帷幕EMS突变后其不稳定行为的等位基因。为落下帷幕而且cpr1突变体中,在M1代ems处理的植株中观察到超过10%的表型不稳定。此外,在M2代中发现了简单孟德尔遗传的例外。就像cpr1×落下帷幕F1混合动力车,cpr1×snc1F1混合动力车和落下帷幕×snc1F1杂种表现为矮化形态。而只有矮秆植株F2落下帷幕×snc1F1杂种约产生10%的F2野生型后代cpr1×snc1F1混合动力车,以及cpr1×落下帷幕混合动力车。偏析分析表明cpr1等位基因的cpr1×snc1杂交株在F1代后期至F2代早期发生失稳。
结论
暴露于EMS或不同的F1杂交环境,表型不稳定是诱导的落下帷幕而且cpr1等位基因,但不是snc1等位基因。我们的结果表明RPP5位点可采用不同的亚稳态遗传或表观遗传状态,其稳定性极易受突变和不同等位基因配对的影响。
背景
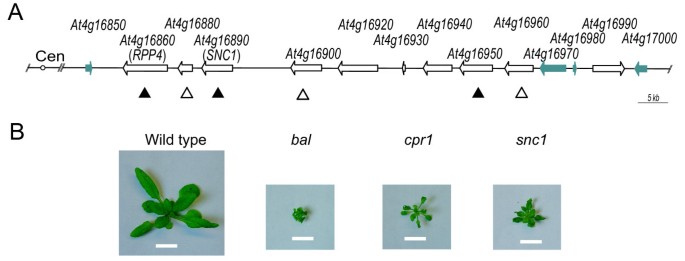
的拟南芥RPP5(寄生蜂的识别)的基因座由7个组成电阻(R)与植物固有免疫有关的基因(图1) [1].R该位点上的基因编码含有n端的蛋白质果蝇Toll/哺乳动物白细胞介素-1受体(TIR)结构域、核苷酸结合位点(NBS)和亮氨酸富重复序列(LRR)结构域与大多数动物编码的结构域相似R基因的拟南芥基因组(2].的两个R基因座中的基因,RPP4(At4g16860),SNC1(At4g16890)已经被证明可以调节对病原体的耐药性。例如,RPP4指定对两种真菌病原体的抗性Hyaloperonospora parasitica(原霜霉属parasitica) [3.].的激活SNC1(npr1-1抑制因子,本构1)导致电阻h . parasitica细菌病原体两[4].另一个R基因座上的基因,At4g16950的序列相似性最高RPP5的创始成员RPP5轨迹R兰茨伯格菌株的基因[2].的功能At4g16950可能不同于RPP5这是承认一个种族的必要条件h . parasitica[5].RPP5轨迹R基因受到积极和消极的协调调节[6].RPP4,SNC1,At4g16950一起可通过水杨酸积累介导的正反馈扩增在转录上激活[6,7].此外,低丰度的小RNA物种可以靶向多个RPP5轨迹R基因存在于野生型植物中,转基因过表达SNC1能诱发这些副相的共同抑制吗R基因(6].
三个突变的等位基因,cpr1,snc1,落下帷幕,导致相似的矮化表型和协同激活RPP5轨迹R基因,映射到RPP5轨迹(图1和额外的文件1) [8- - - - - -10].这三种突变体防御信号的本构激活都需要水杨酸的积累和EDS1(疾病易感性增强1) [9- - - - - -12].的snc1功能获得等位基因是由NBS和LRR结构域之间区域的错义突变引起的,该突变导致SNC1活性升高[4].另一个突变的等位基因,cpr1,为乙基甲磺酸盐(EMS)诱变后分离的隐性等位基因[11].相反,是半显性的落下帷幕等位基因是在近亲繁殖中自发产生的ddm1(DNA甲基化的减少)突变背景,即遗传和表观遗传改变在数代中累积[13].没有突变或表观遗传修饰负责表型和基因表达的变化的报道cpr1或落下帷幕等位基因。三个突变体都表现出稳定状态下多重转录水平的升高RPP5轨迹R基因,包括RPP4,SNC1,At4g16950,可能是通过积极的反馈放大SNC1激活(6].与更严重的表型一致落下帷幕变异体,稳态表达水平较高SNC1在落下帷幕与cpr1而且snc1突变体(6].
激活齿槽5轨迹R基因导致相似的表型落下帷幕,cpr1,snc1突变体.(A)组织RPP5在哥伦比亚单倍型的位点。的R基因和相关的TIR-NBS基因,At4g16990,用开箭头表示,而非R-基因用填充箭头表示。R三个突变体中上调的基因用向上的箭头表示。额外的R基因上调落下帷幕变体用打开的向上箭头表示(附加文件1及未显示的资料);这些基因的表达尚未确定cpr1而且snc1.转座子相关序列未显示。岑:着丝粒。(B) 3周龄的表型落下帷幕,cpr1,snc1纯合突变体与野生型植物。比例尺:1厘米。
许多基因外抑制突变已被鉴定为snc1快中子处理后的等位基因[14- - - - - -18].Zhang和Li从约150000 M2植物中分离出15个抑制互补组中的50个隐性突变snc1端依赖防御信号。相比之下,观察到高程度的表型不稳定性落下帷幕EMS处理或γ-照射后的等位基因[9].在M2一代中,超过10%的落下帷幕植株表现出表型抑制的迹象,这与稳定表达水平的下降有关RPP5轨迹R基因。研究中调查的所有5条独立的M2线都携带了映射回RPP5表明其主要机制可能是由基因内抑制等位基因或回归等位基因引起的。此外,杂化诱导的不稳定性被报道落下帷幕而且cpr1两种等位基因在F1杂交中通过遗传杂交结合在一起后,F2群体中的等位基因[8].按照分子标记的分离连接落下帷幕或cpr1等位基因,我们确定cpr1等位基因的不稳定程度远远高于落下帷幕F1杂交环境中的等位基因。虽然这些结果揭示了条件表型的不稳定性落下帷幕而且cpr1等位基因,至少有三个问题没有得到解答。首先,表型不稳定是什么时候引起的落下帷幕变体?第二,可以表型不稳定cpr1是EMS诱变引起的,以及在F1杂种中?第三,是不寻常的行为落下帷幕而且cpr1F2代的等位基因是否仅限于F1杂交后代中这两种可能的表观遗传等位基因之间的特定相互作用?换句话说,表型的不稳定性cpr1或落下帷幕等位基因被诱导进来cpr1×snc1或落下帷幕×snc1F1杂交?
在这里,我们报告cpr1等位基因表现出高度的表型不稳定性,类似于所看到的落下帷幕等位基因,而snc1等位基因不。我们观察到,早在ems治疗的M1代中,表型就不稳定了落下帷幕而且cpr1突变体。我们还发现表型的不稳定性cpr1等位基因被诱导进来cpr1×snc1F1杂交,其中cpr1等位基因与定义明确的遗传等位基因相互作用。可能的机制来解释影响基因的异常行为RPP5轨迹。
结果
表型的不稳定落下帷幕而且cpr1在EMS处理后的M1代中首次观察到突变
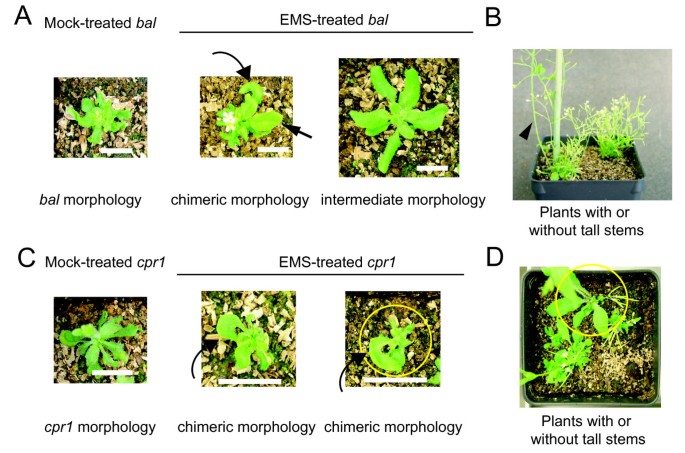
我们之前的研究表明落下帷幕等位基因对EMS处理的反应高度不稳定,这可以从M2代中看到的高频率表型抑制中得到证明,这是由EMS处理种子衍生的M1植株自花授粉产生的[9].然而,表型抑制事件的遗传特征无法进行详细研究,因为在我们最初的研究中检测的每个M2池都来自约20个M1个体。为了获得更多关于不稳定性的信息落下帷幕表型对EMS治疗的反应,我们调查了表型抑制首次建立的时间。的落下帷幕变种的特征是在营养发育过程中叶片小且严重卷曲,在发育后期的身材矮小(图2而且2 b) [13].我们发现141例经ems处理的病例中有17例落下帷幕M1植株嵌合部分的形态与杂合子相似落下帷幕植物,符合反转单落下帷幕等位基因。在同一批模拟或30毫米电磁处理落下帷幕我们发现超过三分之一(38%:141个植物中的53个,包括17个显示嵌合部分的植物)经过ems处理落下帷幕M1植株的茎部高于5厘米,这是在后期发育中表型抑制的另一个迹象,而在任何模拟处理的M1对照植株中都没有观察到高茎(115株中0%:0)(图)2 b).从五种以上独立的EMS治疗中观察到类似的结果。在两种情况下,整个M1植株表现出杂合子的表型特征落下帷幕EMS处理后植株无明显扇形。转基因标记的纯合子状态我们已经渗透到落下帷幕背景分析证实这些罕见的M1植株不是杂合子的落下帷幕因花粉污染而产生的植物(数据未显示)[19].
在ems处理的M1代中建立了表型抑制落下帷幕而且cpr1突变体.(A)模拟处理和ems处理的叶片表型落下帷幕变体。直箭头和弯箭头分别表示中间卷曲的叶和月牙形叶。(B)两个ems处理的表型落下帷幕花发育阶段的变种。箭头表示在ems处理中粗高茎的一个例子落下帷幕变体。注意,右侧经过ems处理的兄弟植物没有长出高大的茎。(C)模拟处理和ems处理的叶片表型cpr1突变体。弯曲的箭头表示月牙形的叶子。黄圈中的植物后来发展为野生型扇区,如D图所示。(D) ems处理的表型cpr1在花发育阶段具有或不具有野生型部分的突变体。黄圈内的植物与c面板黄圈内的植物相同,刻度条:1厘米。A组和C组植株:3.5周龄。B、D组植株:5周龄。
我们发现EMS处理也在很高的频率上破坏了叶片狭窄和轻微卷曲的表型cpr1等位基因(图2摄氏度).大约10%的ems治疗cpr1植物(13/98,5/56和6/46在三个独立的实验中),我们观察到月牙形的叶片,这可能代表表型抑制仅在一侧cpr1叶(图2摄氏度而且二维).野生型茎叶多发育于月牙形莲座叶区。对后代表型的分离证实,只有在ems处理下才观察到受抑制的叶片表型cpr1M1代的突变确实是由遗传变化引起的(图3.).
表型抑制在M2代中比预期的更为频繁
我们确定了表型被抑制的M2植株是否仅仅来自于先前表现出表型变化迹象的M1植株。13个独立国家落下帷幕在M2家族中,我们发现了多种表型抑制植物。其中6个M2家族来源于M1植物落下帷幕表型,而其余7个科来自M1植物显示抑制表型(表1).我们总共绘制了8个ems处理的表型抑制的变化落下帷幕行-本研究中的3行(数据未显示)和上一份报告中的5行[9],并发现每种情况下的变化对应于RPP5轨迹(9].我们的结果表明,大多数ems处理落下帷幕单株植物携带抑制的等位基因落下帷幕表型和认为这些等位基因是逆转等位基因,基因内抑制突变,或显性的基因外抑制突变紧密相连落下帷幕等位基因。
我们还测试了负责表型抑制的等位基因从M1代晚期到M2代是否有丝分裂和减数分裂稳定。我们使用从高5 cm以上茎秆的角果上收集的种子进行ems处理,确定了表型的分离比落下帷幕植物。拟南芥有两个遗传上有效的细胞,它们是分生组织细胞,有助于生殖谱系。因此,假设具有杂合基因型的M1大扇区有望产生M2后代,其孟德尔分离比为1:2:1或5:2:1(矮子:中间:正常)[9,13,20.,21].然而,在研究的7个来自M1大扇区的M2家族中,只有两个家族符合预期的分离比率(表2)1;家庭b9和b11)。在剩下的5个M2家族中,有2个(b7和b8)拥有比预期更多的野生型M2植物1).此外,抑制落下帷幕表型是明显的,甚至在来自双亲的6个品系中,在M1代中没有表型变化的迹象(表1;b3-b6, b14,和b15)。遗传模式,以及表型抑制的频率,证明了这一点落下帷幕表现型极其不稳定。
在cpr1M2植株,M2野生型子代鉴定cpr1在M1代观察到嵌合形态的所有测试系中,都有类似的兄弟姐妹。我们观察到偏析比偏离了1:3或5:3cpr1和野生型形态在M2代中,无论抑制突变的潜在联系RPP5轨迹(表2;家庭c5)。植物与非cpr1形态来源于表现出来的M1亲本cpr1形态(图3 b和表2;c3, c4和c9家族)。我们的结论是,ems处理的表型抑制cpr1突变体,落下帷幕变异并不局限于具有嵌合形态的M1植株。
落下帷幕,cpr1,snc1单倍型在F1杂种中表现出协同作用
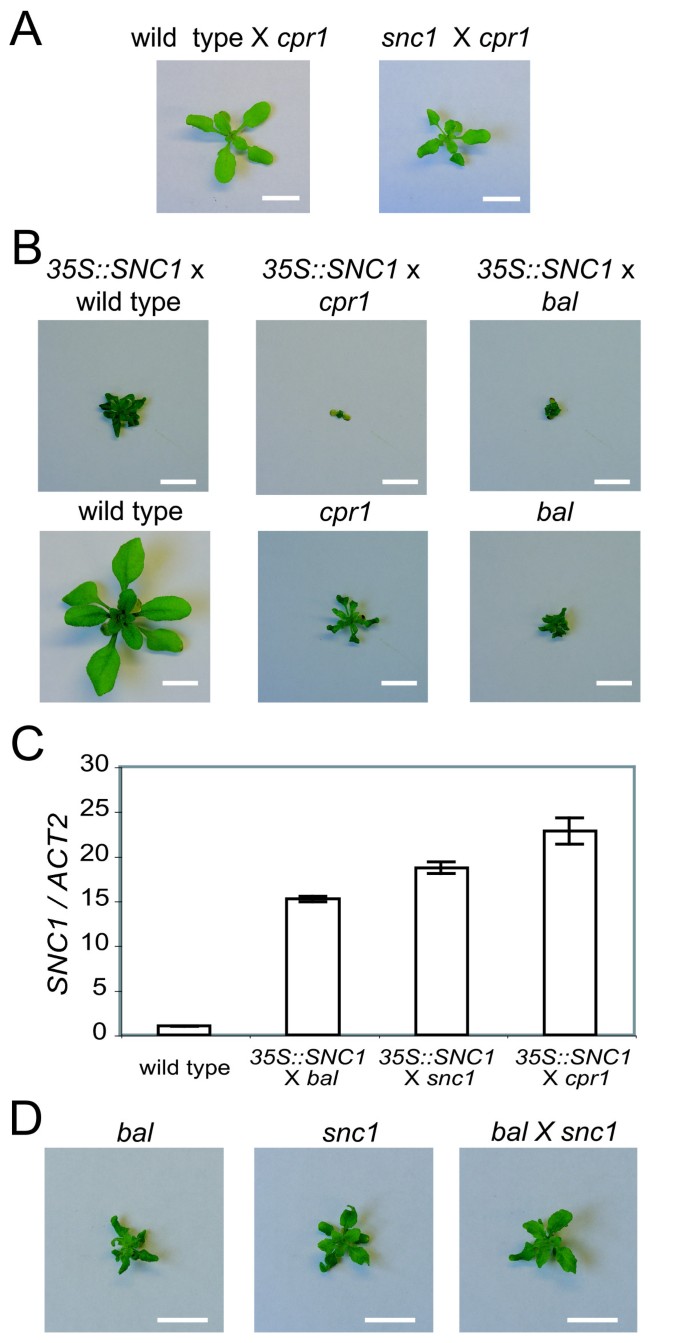
以前,我们发现表型在落下帷幕×cpr1F1型杂交种比杂合子型更为严重落下帷幕植物(落下帷幕×CPR1) [8].这一结果表明,表型间的相互作用落下帷幕而且cpr1单倍型具有协同作用cpr1等位基因在形态学表型和防御信号激活方面相对于野生型等位基因是隐性的。我们假设这种协同作用是转录激活的结果RPP5轨迹的cpr1单倍型为半显性落下帷幕等位基因(6].我们通过结合cpr1单体型的snc1单体型或SNC1转基因背景。的SNC1转基因在本构控制下35个年代启动子(35 s:: SNC1)和snc1等位基因分别在转录水平和蛋白质水平影响SNC1活性,导致防御信号以显性方式激活[4,6,9,10].F1混合动力车cpr1单倍型比野生型(CPR1)单倍型,与我们的假设一致(图4和图4 b).的稳态表达水平SNC1在cpr1突变体比较落下帷幕变体(6].因此,归纳较强SNC1表达的35 s: SNC1×cpr1和F1混合动力车相比35 s: SNC1×落下帷幕杂交是意料之外的,这表明SNC1表达水平35 s: SNC1×cpr1不是可添加的(图4 b,图4摄氏度,及附加文件2) [6].此外,落下帷幕×snc1F1杂种也表现出侏儒症和卷曲的叶片表型与他们的亲本相当(图4 d).我们的结果表明表型特征落下帷幕,cpr1, snc1等位基因在杂交环境中增强。
诱发失稳cpr1配对后的等位基因snc1F1杂交种中的等位基因
除了EMS治疗,相互作用之间落下帷幕而且cpr1杂交环境中的单倍型会导致表型不稳定,产生具有中间型和野生型形态的F2植株[8,9].我们测试了是否落下帷幕×snc1而且cpr1×snc1F1杂交种也可以产生表型正常的F2后代。虽然落下帷幕×snc1杂交一代表现出类似的矮化形态相比落下帷幕×cpr1F1杂交种,全部342个F2子代落下帷幕×snc1无论杂交方向如何,F1杂种均表现为矮化表型3.额外的文件3.).F2植株形态正常cpr1×snc1F2后代(图5和表3.).我们对35株野生型F2植株进行了基因分型cpr1×snc1杂交来确定哪个等位基因与表型抑制相关。在35家工厂中的17家cpr1- - -snc1-连锁标记被检测到,而在其余植株中只有cpr1检测到-链接标记。缺乏snc1/snc1野生型F2子代的基因型分析表明,F2子代不稳定cpr1等位基因与F2代野生型形态相关。我们对4个表型正常的F2植株的F3后代测试支持这一想法,这些植株含有不稳定的cpr1等位基因(CPR1F1)不再诱导cpr1杂交后的突变表型(表4).snc1而且cpr1F3代具有特征表型的突变体完全来自F2亲本,其推测的基因型为CPR1F1/snc1而且CPR1F1/cpr1,分别。
讨论
在这里,我们报告了三种不同的遗传行为答:芥映射到RPP5轨迹R哥伦比亚菌株的基因簇。这三种突变都具有相似但不相同的矮化表型,并伴有卷曲的叶子。有趣的是,只有snc1等位基因在表型稳定性方面表现得像传统突变,正如预期的那样,这种等位基因已知的分子性质。相比之下,落下帷幕而且cpr1暴露于EMS和F1杂交环境后,等位基因表现出高度的表型不稳定性。
表型抑制是由EMS处理引起的在M1代落下帷幕而且cpr1突变体
两者的不稳定性的一个证明落下帷幕而且cpr1等位基因是M1代非亲本表型的高发生率(图2).超过1/3的人接受了ems治疗落下帷幕植物和10%的ems处理cpr1植物在M1代中携带至少一个抑制或逆转等位基因(图2、表1和表2).在我们的ems处理中观察到的表型抑制的频率落下帷幕而且cpr1M1植株比预期的M1突变频率~10至少高出一个数量级-2到103(附加文件4) [22,23].我们先前报道了在ems处理的M2人群中表型抑制的高频率落下帷幕变体(9].现在,我们扩展了这些发现,证明逆转或抑制突变的频率恢复在M2代cpr1突变也远远高于EMS突变后隐性功能丧失突变的预期频率(约占M2人群的0.1%)(表2).
以下观察结果表明EMS处理会破坏落下帷幕等位基因并产生回归物落下帷幕或抑制落下帷幕EMS不再诱导矮化和卷曲叶表型的等位基因。首先,抑制突变落下帷幕M1植株的表型与RPP5轨迹(9,这表明该菌株携带一种回复性物质落下帷幕,一种基因内抑制因子落下帷幕EMS等位基因,或一个相关的显性抑制因子。然而,F1后代的稳定真育种表型回归和落下帷幕变异表现为杂合子的形态落下帷幕/落下帷幕植物,反对任何抑制突变都与显性突变紧密相关的可能性RPP5轨迹(数据未显示)。其次,李和他的同事回收了不到0.1%(约15万中的50)的snc1M2植物携带隐性突变被抑制snc1-依赖表型,而超过10%的落下帷幕M2植株在我们的实验中表现出非亲本形态[9,14].如果表型抑制植物恢复的主要机制是基因外抑制,假设可能的基因外抑制突变谱是相似的,那么这种巨大的差异是不可能的落下帷幕而且snc1突变。
我们考虑了两种不同的机制来解释其中的原因落下帷幕而且cpr1EMS突变后表型被高频抑制。一种可能性是落下帷幕而且cpr1是条件亚稳态外等位基因。具体来说,通过DNA损伤引起的DNA修复来消除和重置表观遗传改变(如.,经EMS处理)可能抑制表型。的RPP5基因座是转座因子和串联排列的同源基因的复杂混合物,是小RNA物种的靶点。具有这种组织类型的基因组区域经常是表观遗传调控的目标[24,25].尽管如此,在许多M1植物中观察到的表型的分割表明,通过RNA沉默的表型抑制,其作用是系统的,不能轻易解释ems处理的表型不稳定性落下帷幕而且cpr1突变体(26].另一种假设是RPP5轨迹的cpr1而且落下帷幕突变体是升高的。这种情况可能发生,如果组成活性状态或可能的异常表观遗传修饰RPP5基因座有助于表型抑制的高频率,可能是通过使基因座在EMS处理时更容易发生突变。我们注意到snc1突变诱导转录RPP5轨迹R基因通过正反馈机制[6],这可能与操作在落下帷幕而且cpr1突变体。
在这两种EMS-treated落下帷幕而且cpr1植株(M1),非亲本表型更多见于发育后期。这种趋势可以用三种不同的方式来解释。首先,发育后期产生器官的分生组织初始细胞数量逐渐减少拟南芥[27,28].在叶片发育阶段,8-9个初始细胞中的一个变异细胞的表型抑制作用很容易被更多的未受影响的初始细胞所掩盖。然而,由于花序仅由一个或两个初始细胞产生,因此在后期的花序发育阶段很容易受到抑制。其次,表型抑制细胞可能在分生组织的干细胞生态位中具有选择性优势,随着时间的推移会超过那些没有抑制突变的细胞。该竞争选择模型与大脑防御信号本构激活的研究结果一致cpr1突变体在营养生长中具有适应度代价[29].第三,抑制落下帷幕在过度表达的转基因植物中,RNA沉默的类表型在发芽后仅两周就变得明显SNC1[6].不考虑导致表型抑制高频率发生的机制落下帷幕而且cpr1突变体,在ems处理的M2群体中观察到的体大小和叶卷曲度的表型梯度可能与新遗传或表观遗传变异的产生平行RPP5自然环境中的轨迹。
不稳定的cpr1等位基因在F1代晚期和F2代早期之间被诱导落下帷幕或snc1等位基因
在F1杂交种中,所有可能的等位基因组合落下帷幕,cpr1,snc1导致与他们的父母相似的侏儒表型(图4) [8].观察到较强的表型35 s: SNC1×cpr1混合动力汽车相比35 s: SNC1×落下帷幕或35 s: SNC1×野生型杂种。增强的表现型不太可能是由等位基因的相加相互作用引起的,因为落下帷幕等位基因是半显性的,表现出比隐性更强的表现型cpr1等位基因。因此,我们认为表型的增强是由等位基因之间的协同作用引起的RPP5轨迹,RPP5基因座范围的转录激活SNC1在这些互动中扮演着重要的角色。
出乎意料的非矮化表型在F2子代中分离cpr1×落下帷幕而且cpr1×snc1十字架(图5和表3.) [8].F2代的基因分型结果显示,在大多数情况下cpr1等位基因与这些意想不到的表现型相关(表3.) [8].考虑到非矮秆植株F2的恢复频率(~1/10)和特异不稳定性cpr1等位基因,不太可能是隐性的抑制等位基因cpr1表型从落下帷幕或snc1背景。相反,数据与一种类似参数的机制最为一致cpr1等位基因和其他两个等位基因RPP5位点偶诱发形成CPR1F1的导数cpr1不再导致矮化和卷叶表型的等位基因。与我们在EMS实验中注意到的表型逆转相反,没有观察到嵌合发展的迹象cpr1×落下帷幕或cpr1×snc1杂交植株在F1代。
杂交诱导的表型不稳定性可以用两种并不相互排斥的模型来解释。在第一个模型中,RNA沉默SNC1和其他可能R基因在独联体导致表型抑制。先前,我们发现21-24个核苷酸小RNA物种与许多副同源互补R基因的RPP5基因座的生成,并证明过表达SNC1能诱导这些协同抑制吗R基因(6].在这个模型中,优先失稳cpr1等位基因的稳态表达水平与观察结果一致SNC1是高35 s: SNC1×cpr1混合动力汽车相比35 s: SNC1×落下帷幕或35 s: SNC1×snc1混合动力车(图4摄氏度).表达的SNC1以及可能存在未配对的DNA,这可能是由副同源的串联重复之间的失域减数分裂配对形成的RPP5轨迹R基因是RNA沉默的潜在触发因子。在减数分裂过程中未配对DNA的沉默导致稳定的表观遗传状态可以遗传给后代拟南芥[30.].在第二个模型中,同源重组(如在减数分裂过程中,基因的转换或不平等的交叉)破坏了细胞的增殖cpr1等位基因或产生单倍型,没有任何突变等位基因。与不平等交叉机制一致,我们在F2群体中恢复了极端矮小和幼苗致死植物,如从RPP5轨迹R基因扩增,以及野生型植物(附加文件3.).涉及的类似机制有优先权R其他植物的基因。Cf-4而且Cf-9两个同源R基因位于不同的基因位点Lycopersicon物种(31,32].虽然这两个基因在纯合子中减数分裂稳定,但单倍型都不携带Cf-4也不Cf-9以约1/2000的频率在a反式杂合子(Cf-4×Cf-9).此外,最近有报道称,针对人类男性种系的减数分裂特异性、染色质内的同源重组优先消除同源序列之间的DNA [33].我们也不能排除伴随重组的DNA修复过程可能会移除导致基因上调的表观遗传改变的可能性RPP5轨迹R基因或沉积物沉默标记,如胞嘧啶甲基化[34].减数分裂重组之间cpr1和其他单倍型可能是由组成性活跃的转录状态或异常的表观遗传改变RPP5轨迹。这些结果表明,稳定性cpr1等位基因可受遗传相互作用的影响cpr1单体型的落下帷幕或snc1单倍型,尽管其中的机制仍有待确定。
结论
我们的结果表明,EMS处理诱导表型不稳定cpr1变种人,以及在落下帷幕变体。在超过10%的ems处理的M1代中观察到表型抑制落下帷幕而且cpr1突变体。此外,从M1代到M2代的简单孟德尔遗传都有例外。我们还发现表型的不稳定性cpr1等位基因被诱导进来cpr1×snc1F1混合动力车,除了cpr1×落下帷幕如先前报道的F1杂交品种。然而,在F2后代中未观察到表型不稳定性落下帷幕×snc1F1杂交。我们得出这样的结论:落下帷幕,cpr1,snc1表型相似的等位基因在EMS诱变和杂种形成后的表型稳定性方面可以进行区分。表型高度不稳定落下帷幕而且cpr1突变表明亚稳态,这与本构性过表达有关RPP5轨迹R这些突变体中的基因,可以促进遗传或表观遗传变异RPP5轨迹。
方法
植物和生长条件
我们先前描述了落下帷幕变体(8,9].cpr1而且snc1的资料。董新年,李欣[10,11].点突变在snc1等位基因破坏一个Xba限制性内切酶位点SNC1编码区(4].Xba对5'-GTGGAGTTCCCATCTGAACATC-3'和5'-CCCATTTTGATTGCTGGAAAG-3'扩增的PCR产物进行I切割,使我们能够区分snc1从其他等位基因(Xin Li,个人沟通)。除了在附加文件中显示的植物外,所有的植物都是在之前描述的长日条件(16小时光照)的土壤生长室中生长的2,在较短的日照条件下生长(8小时光照)[9].如前所述,采用8小时30 mM EMS处理进行EMS诱变[9].
核酸分离
用TRIzol试剂(Invitrogen)从2周龄植物的地上部分分离出用于构建第1链cDNA文库的总RNA。使用尿素裂解微型prep协议分离用于基因分型的基因组DNA [35].
表达分析
的稳态表达水平SNC1如前所述,采用实时荧光定量PCR方法检测2周龄植物[6].PCR反应中使用的引物和Taqman MGB探针(Applied Biosystems)的信息如下所示。5'-TCGGTGGTTCCATTCTTGCT-3', 5'-GCTTTTTAAGCCTTTGATCTTGAGAG-3',和5'-NED-AGCACATTCCAGCAGATGTGGATCTCCAA-3'Actin2.5'-GCCGGATATGATCTTCGGAA-3', 5'-CGGCAAGCTCTTCAATCATG-3',和5'-6FAM-TGGCCTAGTGAAGCA-3'SNC1.
参考文献
Noel L, Moores TL, van Der Biezen EA, Parniske M, Daniels MJ, Parker JE, Jones JD:拟南芥RPP5复合体抗病位点存在明显的种内单倍型分化。植物生态学报,2004,25(4):369 - 369。10.1105 / tpc.11.11.2099。
Meyers BC, Kozik A, Griego A, Kuang H, Michelmore RW:拟南芥nbs - lrr编码基因的全基因组分析。植物科学学报,2004,15(4):809-834。10.1105 / tpc.009308。
van der Biezen EA, Freddie CT, Kahn K, Parker JE, Jones JD:拟南芥RPP4是TIR-NB-LRR基因RPP5多基因家族的成员,通过多个信号成分提供霜霉抗性。植物学报,2004,29(4):439-451。10.1046 / j.0960-7412.2001.01229.x。
张颖,Goritschnig S,董鑫,李鑫:植物抗病基因功能获得突变导致npr1-1抑制子下游信号转导通路的本构激活。植物学报,2003,15(11):2636-2646。10.1105 / tpc.015842。
Parker JE、Coleman MJ、Szabo V、Frost LN、Schmidt R、van der Biezen EA、Moores T、Dean C、Daniels MJ、Jones JD:拟南芥霜霉病抗性基因RPP5与N和L6的toll和白介素-1受体有相似之处。植物生态学报,2004,25(6):369 - 369。10.1105 / tpc.9.6.879。
易华,Richards EJ:拟南芥中的抗病基因簇受转录激活和RNA沉默的协同调控。植物细胞学报,2007,19(9):2929-2939。10.1105 / tpc.107.051821。
李艳,杨松,杨红,华娟:TIR-NB-LRR基因SNC1在转录水平受多因素调控。植物学报,2007,20(11):1449-1456。10.1094 / mpmi - 20 - 11 - 1449。
张文华,张文华,张文华:拟南芥两个组成性致病反应等位基因的诱导不稳定性。美国国家科学研究院。科学通报,2002,23(6):792- 796。10.1073 / pnas.112040999。
王晓燕,王晓燕,王晓燕,等。拟南芥抗病的表观遗传变异。基因学报,2002,16(2):171-182。10.1101 / gad.952102。
Li X, Clarke JD, Zhang Y,董鑫:snc1突变体中eds1介导的r -基因通路的激活导致了npr1独立的本构病原耐药性。植物生态学报,2001,14(10):1131-1139。10.1094 / MPMI.2001.14.10.1131。
Bowling SA, Guo A, Cao H, Gordon AS, Klessig DF, Dong X:一种导致系统获得性抗性的拟南芥突变。植物学报,1994,6(12):1845-1857。10.1105 / tpc.6.12.1845。
Clarke JD, Aarts N, Feys BJ, Dong X, Parker JE:拟南芥突变体cpr1和cpr6的组成性抗病需要EDS1,而cpr5则部分依赖EDS1。植物学报,2001,26(4):409-420。10.1046 / j.1365 - 313 x.2001.2641041.x。
Kakutani T, Jeddeloh JA, Flowers SK, Munakata K, Richards EJ:与DNA低甲基化突变相关的发育异常和表观突变。美国国家科学研究院。科学通报,2004,23(6):633 - 636。10.1073 / pnas.93.22.12406。
张颖,李霞:一种假定的核孔蛋白96在基础防御和由npr1-1,本构1抑制因子介导的本构抵抗反应中都是必需的。植物学报,2005,17(4):1306-1316。10.1105 / tpc.104.029926。
张颖,程东涛,毕D, Palma K,李欣:MOS2是一种含有G-patch和KOW基序的蛋白质,是拟南芥固有免疫所必需的。中华微生物学杂志2005,15(21):1936-1942。10.1016 / j.cub.2005.09.038。
Goritschnig S,张颖,李雪:拟南芥的泛素通路是先天免疫所必需的。植物学报,2007,29(3):349 - 351。10.1111 / j.1365 - 313 x.2006.02978.x。
Palma K, Zhang Y, Li X:一种重要的α同源物MOS6在植物先天免疫中起着重要作用。植物生物学杂志,2005,15(12):1129-1135。10.1016 / j.cub.2005.05.022。
Palma K,赵强,程东涛,毕东,Monaghan J,程伟,张颖,李鑫:植物和动物王国保守复合体中3个蛋白对植物固有免疫的调控。基因学报,2007,21(12):1484-1493。10.1101 / gad.1559607。
杨文华,李文华,李文华,等:拟南芥中染色体间单体和同源体间重组的研究。植物学报,2004,16(2):342-352。10.1105 / tpc.019042。
Page DR, Grossniklaus U:基因筛选的艺术和设计:拟南芥。科学通报,2002,3(2):124-136。10.1038 / nrg730。
Li SL, Rédei GP:自交二倍体的突变率估计。辐射植物学杂志,1996,9:125-131。10.1016 / s0033 - 7560(69) 80079 - 7。
Kovalchuk I, Kovalchuk O, Hohn B:转基因植物体细胞突变频率的全基因组变异。中国生物工程学报,2004,19(4):369 - 369。10.1093 / emboj / 19.17.4431。
Van der Auwera G, Baute J, Bauwens M, Peck I, Piette D, Pycke M, Asselman P, Depicker A:拟南芥中C:G-to- t:A转变和同源重组的新构建及其应用。植物生理学报,2008,26(1):322 - 331。10.1104 / pp.107.105213。
陈伟军,陈伟军,陈伟军,等:大豆查尔酮合成酶基因簇介导的组织特异性基因沉默。植物学报,2004,16(4):819-835。10.1105 / tpc.021352。
Della Vedova CB, Lorbiecke R, Kirsch H, Schulte MB, Scheets K, Borchert LM, Scheffler BE, Wienand U, Cone KC, Birchler JA:来自玉米的显性抑制查尔酮合成酶等位基因C2-Idf(抑制剂扩散)通过内源性RNA沉默机制起作用。中国生物医学工程学报,2004,17(4):369 - 369。10.1534 / genetics.105.043406。
Voinnet O:非细胞自主RNA沉默。中国生物医学工程学报,2005,29(5):569 - 571。10.1016 / j.febslet.2005.09.039。
叶蕨茎尖分生组织的细胞命运拟南芥.《发展》1992,115:755-764。
爱尔兰VF,苏塞克斯IM:命运地图拟南芥胚芽顶端分生组织。《发展》1992,115:745-753。
Heidel AJ, Clarke JD, Antonovics J,董雪:拟南芥系统获得性抗性途径突变的适应度成本。中国生物医学工程学报,2004,38(4):369 - 369。10.1534 / genetics.104.032193。
王晓燕,王晓燕,王晓燕:转化拟南芥T-DNA等位基因状态与染色体整合区DNA甲基化的关系。植物生理学报,2004,25(3):369 - 369。10.1007 / s11103 - 005 - 4808 - 0。
伍尔夫,Thomas CM, Parniske M, Jones JD: EMS诱变和株内重组诱导番茄Cf-4/Cf-9位点的遗传变异。中国生物医学工程学报,2004,26(1):359 - 359。10.1534 / genetics.167.1.459。
Parniske M, Wulff BB, Bonnema G, Thomas CM, Jones DA, Jones JD:在番茄1号染色体短臂的多个位点上存在Cf-9抗病基因(Hcr9s)的同源物。植物与微生物的相互作用。1999,12(2):93-102。10.1094 / MPMI.1999.12.2.93。
Turner DJ, Miretti M, Rajan D, Fiegler H, Carter NP, Blayney ML, Beck S, Hurles ME:导致几种基因组紊乱的新生减数分裂缺失和复制的种系率。植物学报,2008,40(1):90-95。10.1038 / ng.2007.40。
Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Pardo AD, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV: DNA损伤,同源定向修复和DNA甲基化。科学通报,2007,3 (7):e110-10.1371/journal.pgen.0030110。
球茎SM,球茎KC: Pl-Bh,玉米花青素调节基因,导致杂色色素沉着。中国生物医学工程学报,2004,25(2):366 - 366。
确认
我们感谢Hye Ryun Woo, Travis Dittmer和Ashley Galant对手稿的有益评论,以及Mike Dyer和温室工作人员对植物的照顾。种子是Xinnian Dong、Barbara Hohn和Xin Li慷慨的礼物。这项工作得到了美国国家科学基金会(MCB-0321990和MCB-0548597)对E.J.R.的资助。丹佛斯基金会提供了额外的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
HY和EJR构思了这项研究。HY进行分子遗传学研究和表达分析。HY和EJR起草了手稿。所有作者阅读并批准了最终稿件。
电子辅料
12870 _2008_244_moesm1_esm.pdf
额外的文件1:稳态表达水平很多RPP5轨迹R基因在落下帷幕变体.采用RT-PCR比较不同菌株的稳态转录水平R基因的RPP5轨迹。两个基因位于RPP5轨迹,肌动蛋白2(ACT2),磷酸果糖激酶β亚基(PFKβ),用作加载控制。-RT和+RT:第1链cDNA在不使用或使用逆转录酶(RT)的情况下构建。落下帷幕:野生植物;落下帷幕:落下帷幕变体。(PDF 248 KB)
12870 _2008_244_moesm2_esm.pdf
额外的文件2:表型相互作用SNC1转基因的cpr1而且落下帷幕等位基因短天.请注意,落下帷幕而且cpr1等位基因在短日照条件下比长日照条件下表现出更温和的表型。(PDF 3 MB)
12870 _2008_244_moesm3_esm.pdf
额外的文件3:在某些F2后代中观察到极其严重的侏儒症cpr1×snc1交叉.植物表现出严重侏儒症植物的代表性表型。这些植物是图中所示植物的兄弟姐妹4.比例尺:1厘米。(PDF 330 KB)
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
易,H.,理查兹,e.j拟南芥影响疾病的等位基因电阻基因簇。BMC植物杂志8日,36(2008)。https://doi.org/10.1186/1471-2229-8-36
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-36
关键字
- 抑制突变
- 水杨酸积累
- 表型抑制
- 表型不稳定
- 霜霉属Parasitica