摘要
背景
像许多其他植物物种一样,拟南芥使用精氨酸(Arg)作为氮的储存和运输形式,而脯氨酸(Pro)作为一种兼容的溶质来防御引起水分剥夺的非生物胁迫。精氨酸分解代谢在线粒体内产生鸟氨酸(Orn),它被争议地讨论为Pro生物合成的前体,替代谷氨酸(Glu)。
结果
我们在这里表明,鸟氨酸-δ-转氨酶(δOAT, At5g46180),将Orn转化为吡咯啉-5-羧酸(P5C)的酶,定位于线粒体,是精氨酸分解代谢所必需的。野生型植物能够分解供体的精氨酸和Orn,并将这些氨基酸作为唯一的氮源。δ缺失突变体燕麦但添加精氨酸或Orn时,尿素循环中间产物积累较多,不能充分利用以精氨酸或Orn提供的氮。在δ完全缺失的T-DNA插入突变体中,尿素的利用和胁迫诱导的Pro积累不受影响燕麦表达式。
结论
我们的研究结果表明,δOAT只将P5C送入Pro代谢的分解代谢分支,从而产生Glu作为最终产物。将氮转化为谷氨酸是回收作为精氨酸储存或运输的氮的重要途径。拟南芥中Pro生物合成主要或完全通过Glu途径发生,不依赖于Arg和Orn分解代谢产生的Glu。
背景
氨基酸是蛋白质生物合成所必需的,但也有额外的功能,如氮的储存和运输。脯氨酸(Pro)和非蛋白源性γ-氨基丁酸也被用作许多植物在缺水时积累的相容渗透液[1].精氨酸(Arg)和富含精氨酸的蛋白质在许多植物中,特别是在种子中,是有机氮的重要储存形式[2- - - - - -4].此外,精氨酸(Arg)或鸟氨酸(ornithine, Orn)是合成精胺、亚精胺及相关多胺的前体,这些多胺对有性生殖至关重要,并在抗应激中发挥重要作用[5,6].因此,氨基酸的生物合成和降解嵌入在一个复杂的代谢和调节网络中,使植物能够满足生长和环境适应的所有要求。
植物中氨基酸生物合成和降解的主要途径主要是通过鉴定与原核或真菌模型系统同源的基因或酶活性来推断的。然而,植物细胞内不同区域内代谢途径的定位仍未得到满意的阐明[7].尽管使用了共同的代谢物,但在多酶复合物中底物通道的可能性可能会导致其他并发症。
精氨酸生物合成似乎主要定位在质体中,细胞质中酶的一些模糊定位预测[3.].精氨酸脱羧酶(ADC1和2)是拟南芥中多胺合成的提交酶,在细胞质或叶绿体中有预测的定位(SubCellular Proteomic数据库[8]),而精氨酸分解代谢则通过精氨酸酶在线粒体内进行[9].精氨酸酶产生尿素,尿素在细胞质中被脲酶进一步降解,而Orn可以从线粒体输出,重新进入精氨酸生物合成[10].通过酵母Arg11突变体的互补,发现了两种基本氨基酸转运蛋白,可介导Arg和Orn在线粒体内膜上的交换。11,12].
Pro主要在细胞质中由谷氨酸(Glu)经吡咯-5-羧酸(P5C)在P5C合成酶(P5CS)和P5C还原酶(P5CR)的顺序作用下合成。在拟南芥中,存在两种P5CS亚型,P5CS2作为管家亚型,P5CS1负责在应激反应中Pro的积累[13,14].为了响应渗透胁迫,P5CS1重新定位到质体[14].为了降解,Pro被导入线粒体,在线粒体中通过Pro-脱氢酶(ProDH)和p5c -脱氢酶(P5CDH)转化回Glu [15,16].也有证据表明有一条从Orn合成Pro的途径,并且Orn-δ-转氨酶(δOAT)与该途径有关[17].δOAT将Orn的δ氨基转移到α-酮戊二酸或相关的α-酮酸,从而形成谷氨酸-5-半醛(GSA)和谷氨酸。该反应的平衡远在GSA/Glu一侧[17].GSA与环P5C处于自发平衡状态,环P5C是Pro生物合成和降解的常见中间体。假设Orn中GSA/P5C的形成是Pro合成和积累的另一条途径,以Arg或Orn代替Glu作为前体[18].
从蚕豆cDNA文库中克隆了一个植物δOAT基因大肠杆菌原营养不良菌株缺乏Glu向P5C的转化[18].与哺乳动物和细菌酶序列相似,表明该基因编码δOAT而非αOAT。近年来,蚕豆δOAT在蚕豆中的异源表达大肠杆菌发现其活性被丝氨酸、异亮氨酸和缬氨酸抑制,而Pro [19].拟南芥的δ燕麦基因At5g46180在幼苗中表达上调,并对盐胁迫有应答作用[20.].然而,在包括线粒体在内的11个亚细胞定位预测程序中,都强烈预测δOAT蛋白靶向线粒体,并在Phe16之后有一个假定的转运肽切割位点[21,22].将δOAT定位到线粒体强烈表明P5C被送入Pro降解途径,而不是进入Pro生物合成。此外,外源Orn的示踪实验表明,由Orn形成的Pro保留了δ-氨基,而α-氨基损失了[23].后者表明,Orn向Pro的转化是通过αOAT进行的。
另一方面,转基因烟草和水稻植株过度表达拟南芥δ燕麦基因中Pro含量增加,抗逆性增强,支持了Orn转化有助于Pro积累的观点[24,25].使用gabaculine作为δOAT的有效抑制剂表明,在萝卜子叶中,Orn转化有助于盐诱导的Pro积累,而在水稻叶片中,这一途径可能不太重要或根本没有活性[26,27].目前发表的研究都没有直接研究δOAT的亚细胞定位,也没有提供有力的证据证明δOAT在非转基因植物中Pro合成中的生理功能。
本研究分析了δOAT在拟南芥中的生理功能。我们使用δOAT- gfp融合蛋白提供了预测δOAT在线粒体中的定位的实验证实。通过使用功能丧失的T-DNA插入突变体,我们证明了δOAT对于Arg的氮循环是必不可少的,而它似乎对Pro生物合成没有贡献。
结果
鸟氨酸-δ-转氨酶定位于线粒体
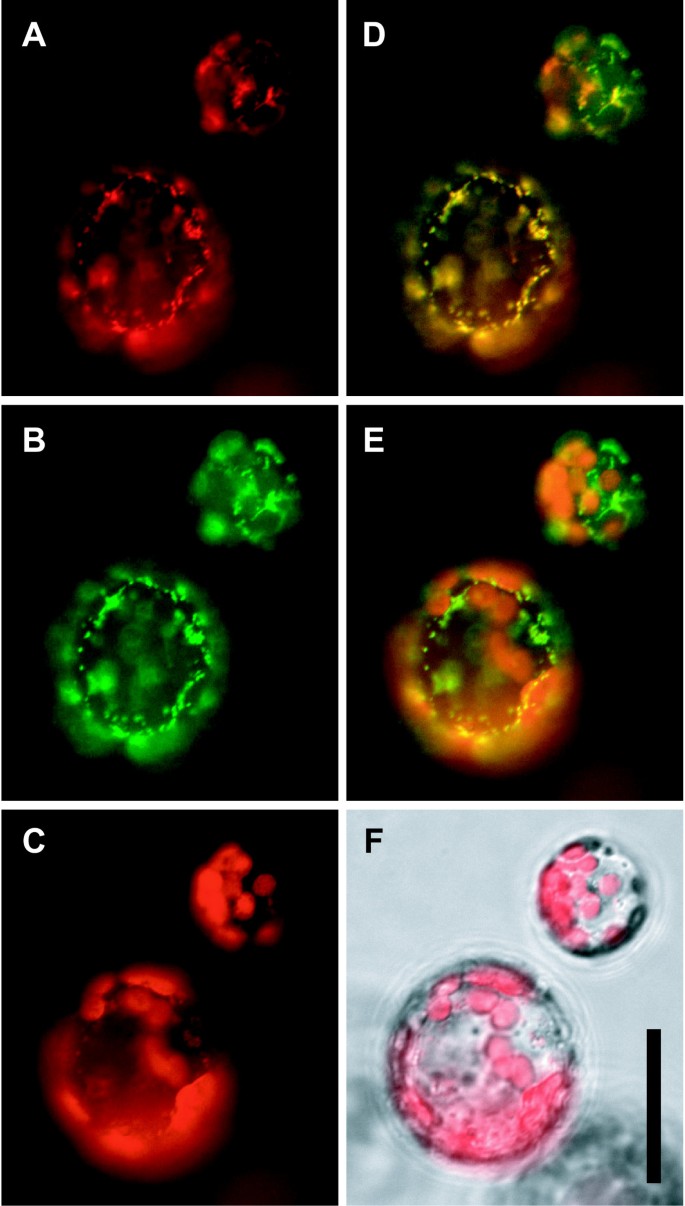
作为确定δOAT生理功能的第一步,我们确定了该酶的亚细胞定位。我们融合了的cDNAδ燕麦在拟南芥和拟南芥中表达融合蛋白烟草benthamiana.稳定转化或瞬时转化拟南芥植物的完整细胞和原生质体n benthamiana叶片的δOAT在细胞内呈明显的点状分布(图;1,附加文件1,数据未显示)。用MitoTracker对叶片切片染色不成功,因此对原生质体进行了双重标记。在原生质体中,gfp信号与MitoTracker的橙色荧光共定位清楚地识别了δOAT-GFP包含的区室为线粒体,证实了基于序列的亚细胞定位预测。
鸟氨酸-δ-转氨酶不促进胁迫诱导的脯氨酸积累
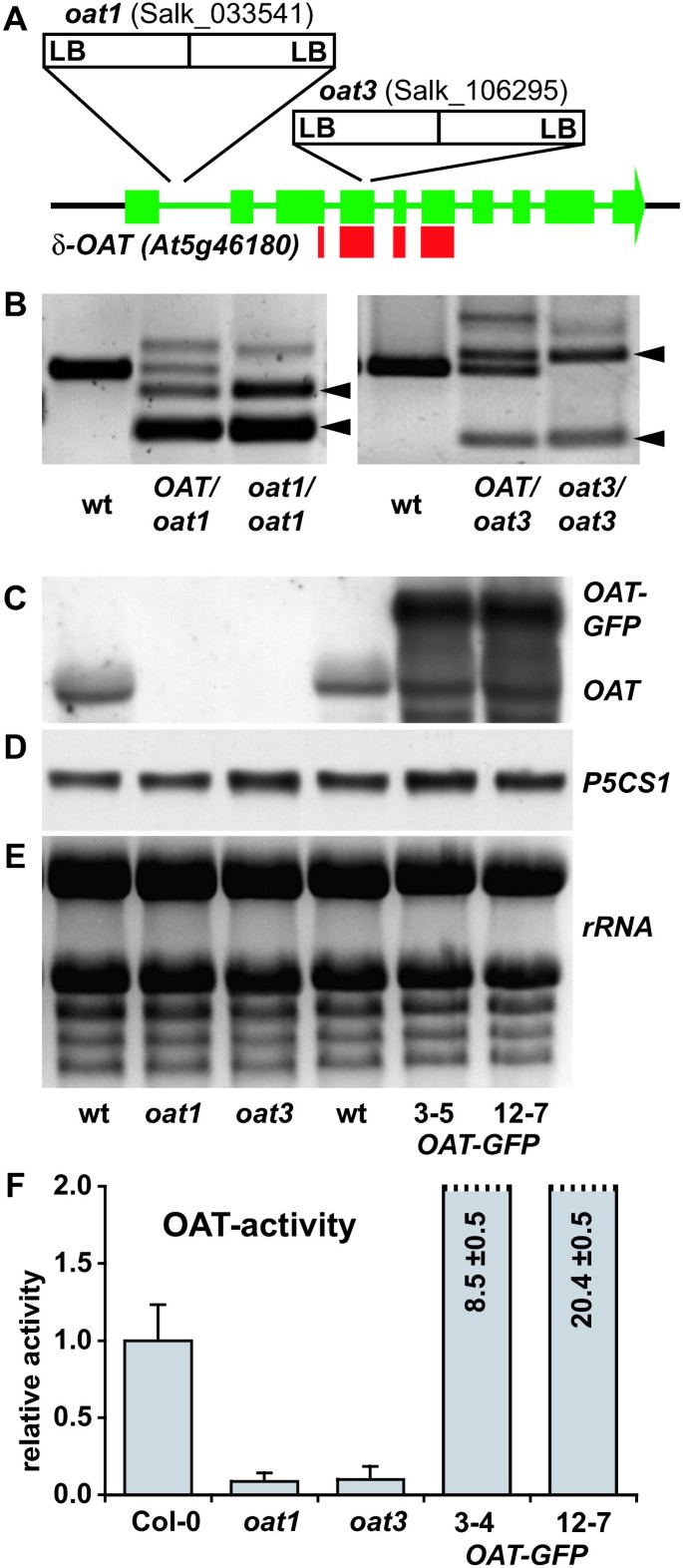
δOAT的线粒体定位表明它不参与Pro的形成,因为ProDH的反向反应在能量上是不利的。由于GSA/P5C的化学不稳定性,这种中间体输出到细胞质并因此对Pro合成的贡献似乎不太可能。为了获得δOAT生理功能的直接证据,我们鉴定并鉴定了功能缺失的T-DNA插入突变体。我们发现T-DNA插入线SALK_033541 (oat1)及SALK_106295 (oat3)携带T-DNA的反向串联重复序列圣内含子和4th外显子的δ燕麦,分别(图;2).分离分析证实没有进一步的T-DNA插入oat1而且oat3重复回交到wildtype Col-0(数据未显示)。在基因组DNA上通过PCR鉴定T-DNA插入的纯合子植株。2 b).在这两种细胞系中,T-DNA的插入导致转录本积累的完全丢失,如northern blot分析所示(图2)。2 c - d).所使用的探针覆盖了351 bp的吡啶醇依赖性转氨酶保守区域,并且没有检测到任何原生或截断的转录本,因此排除了任何活性蛋白的翻译δ燕麦基因(图。2和附加文件1).在转基因系中表达δOAT-GFP核聚变结构δ燕麦探针检测到原生mRNA和与之对应的分子量较高的条带δOAT-GFP成绩单。的表达P5CS1,该基因负责应激诱导的Pro生物合成燕麦突变体,δOAT-GFP转基因植物(图;二维).第三行,SALK_010095 (oat2),携带在转录起始位点上游4 bp的插入位点,该位点由[20.].δ燕麦检测到原生大小的转录本oat2,尽管与野生型Col-0相比,它们的丰度略低(数据未显示)。因此,oat2突变体未纳入进一步研究。
的分子和生化特征燕麦敲除突变体.一个δ的外显子-内含子结构示意图燕麦(At5g46180), T-DNA插入点在oat1而且oat3.粗绿条表示外显子,细绿条表示内含子。粗大的红色条形图显示的是mRNA中用于检测北方印迹的部分。B:用两个基因特异性引物和一个与T-DNA左缘互补的引物PCR鉴定纯合子植株。两条T-DNA特异性条带的出现(箭头所示)表明T-DNA的反向串联重复。C:北方印迹与δ燕麦- wildtype上的特定探测,燕麦突变体和δOAT-GFP转基因植物。D:同一膜用a重新探测P5CS1您调查。E:对相应rna -凝胶进行EtBr染色,显示负载相等。F:全植物提取物中的OAT活性。OAT活性以20分钟内每毫克总蛋白产生P5C的任意单位表示。误差条表示三次重复测定的SD,整个实验重复,独立样本的结果相似。
基因组序列分析显示,拟南芥中没有其他燕麦候选基因。尽管如此,分析OAT在人体中的活性还是很重要的oat1而且oat3敲除突变体。在2周大的野生型幼苗的全植物提取物中,检测到微弱但显著的OAT活性(图2)。2 f).在oat1而且oat3提取物中,OAT活性与对照值相比没有显著增加,最多占野生型活性的1/10。两个δOAT-GFP表达系的OAT活性分别是野生型的8.5倍和20.4倍。两者的纯合子植物oat1而且oat3在温室条件下,突变系与野生型没有明显的表型差异,说明δ oat活性对拟南芥的正常生命周期不是必需的(数据未显示)。
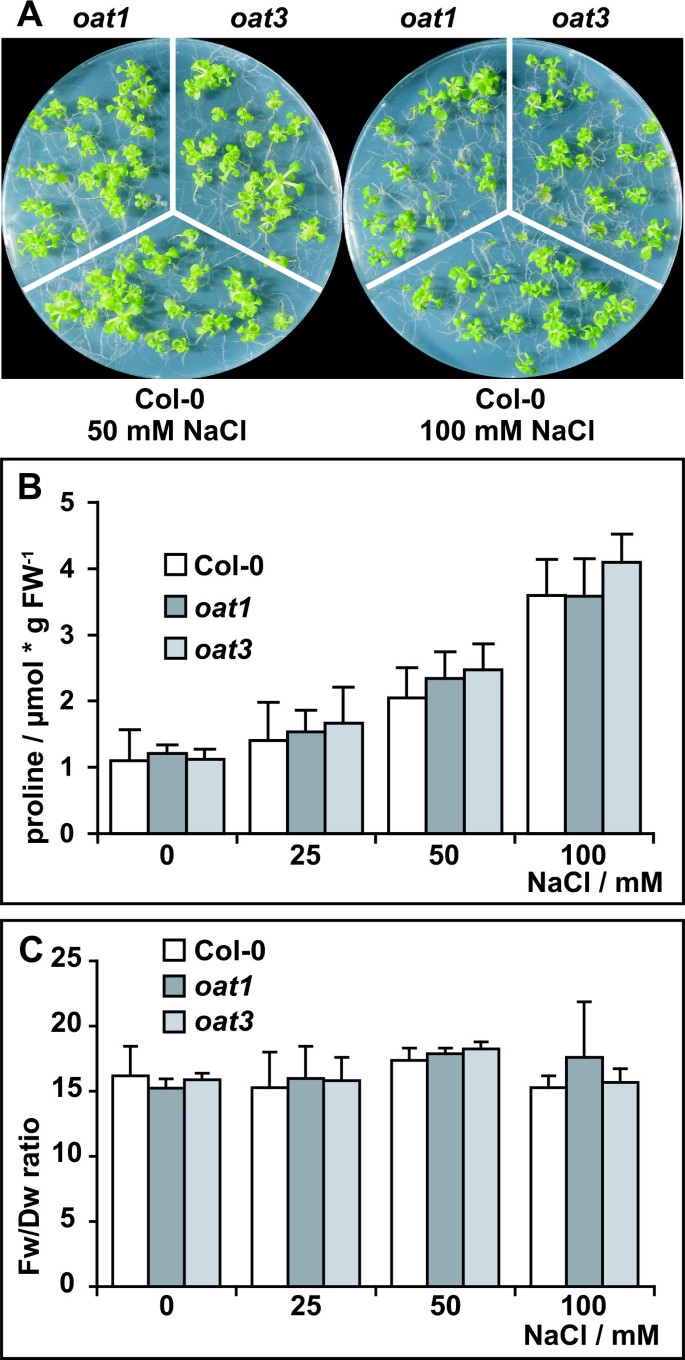
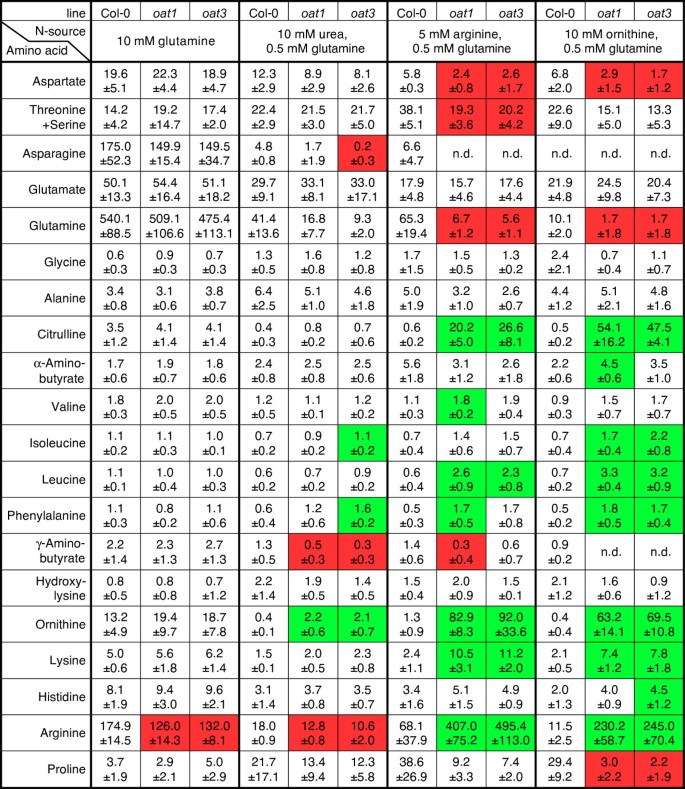
为了研究δOAT在胁迫诱导的Pro积累中的潜在作用,我们培养了野生型,oat1而且oat3在无菌培养基中增加NaCl含量(图;3).突变体对NaCl表现出相似的敏感性,在添加超过100 mM的NaCl后,野生型和三种基因型的幼苗几乎完全被阻断。3周龄植株中游离Pro含量的定量分析显示,野生型和野生型之间无显著差异燕麦无论是在对照条件下,还是在盐胁迫后(图2)。3 b).在所有三个基因型中,添加100 mM NaCl后,游离Pro含量增加了约3倍。相似的Fw/Dw在野生型和燕麦在所有盐浓度下的突变体进一步支持了两种基因型的同等耐受力(图。3 c).这些结果表明,δOAT对胁迫诱导的Pro生物合成没有显著贡献在活的有机体内在盐胁迫下。反对orn衍生P5C直接进入Pro生物合成的其他证据来自BAR e-northern web工具分析的公开微阵列表达数据[28,29].在大量的压力实验中,δ燕麦mRNA水平与P5CDHmRNA而不是P5CRmRNA(数据未显示)。
精氨酸和鸟氨酸的利用需要鸟氨酸δ-转氨酶
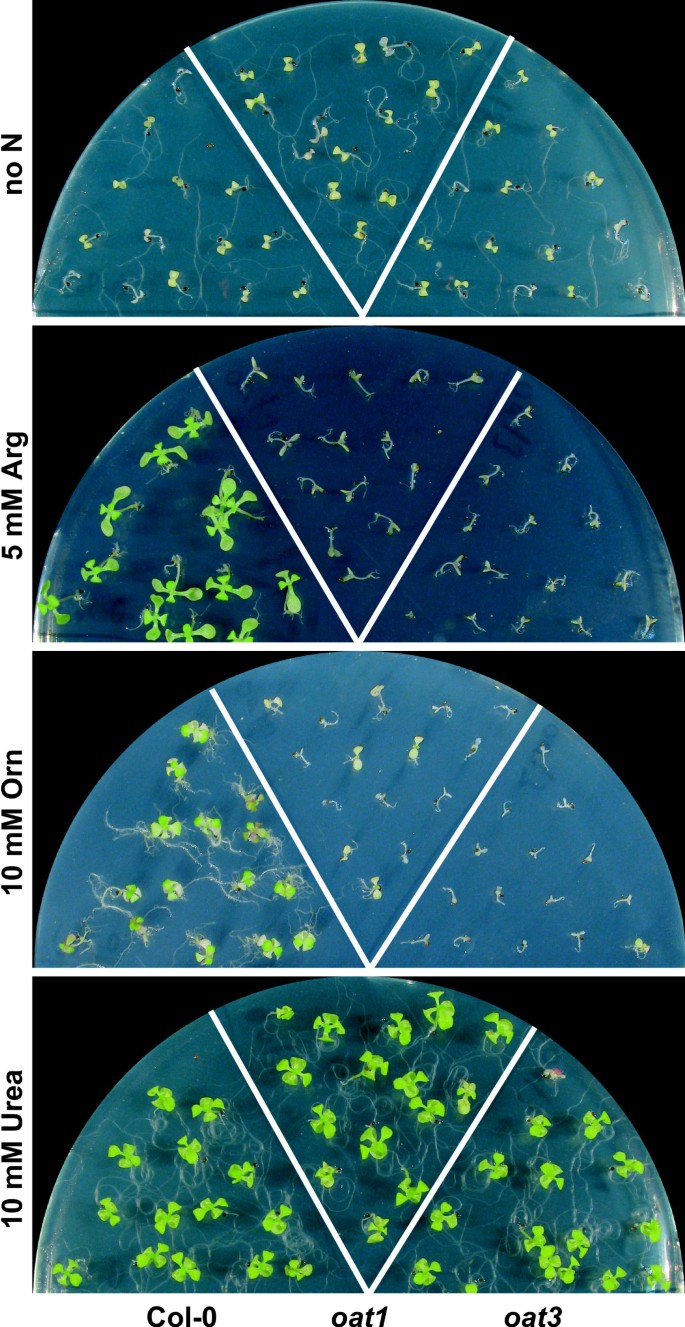
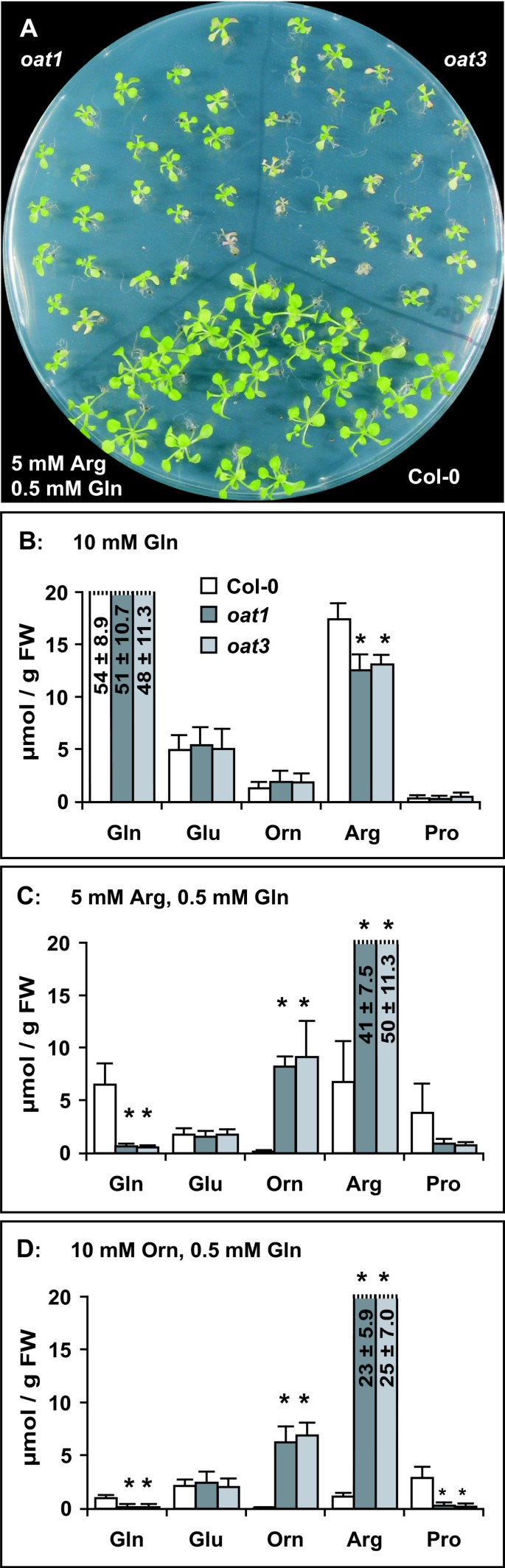
由于δOAT的主要功能显然不在Pro生物合成中,我们考虑了该酶的替代代谢功能。在线粒体中与精氨酸分解途径的共同定位表明δOAT在以精氨酸储存的氮的循环利用中具有推定的功能。为了测试δOAT是否在精氨酸分解代谢中起作用,我们培养了野生型和燕麦在不育培养中,Arg、Orn或尿素作为唯一的氮源(图2)。4).在没有任何外部氮的情况下,野生型和突变型都表现出根的生长和扩大,去黄化的子叶,但进一步发育是不可能的。Arg支持野生型的生长,尽管与在正常MS矿物培养基上生长的植物相比,植物的生长速度较慢。燕麦在5 mM精氨酸作为唯一的氮源时,突变体发芽,但不能去黄化,不能启动根系生长或长出真叶。以10 mM的Orn为唯一氮源时,野生型的生长更加迟缓燕麦突变体的发育与在含精的培养皿中相同。尿素在三种分析的基因型上均能得到很好的利用。这些发现表明燕麦突变体不能利用精氨酸或Orn作为氮源进行生长。与无氮条件下的幼苗相比,Arg或Orn的供应抑制了幼苗体内氮储备的建立和利用燕麦突变体。
单氨基酸对植物细胞生长的一般抑制作用早前已被观察到,在精氨酸的情况下,添加谷氨酰胺(Gln)可消除这种抑制作用[30.].事实上,将0.5 mM Gln添加到5 mM Arg中可以促进野生型和野生型的生长和发育燕麦突变体(无花果。5).然而,燕麦突变体仍然处于褪绿状态,并且比单独存在0.5 mM Gln时生长得更糟(数据未显示)。10 mM Gln作为唯一的氮源,比5 mM Arg或10 mM Orn(分别添加0.5 mM Gln)的拟南芥生长快得多。燕麦突变体在10 mM Gln上的生长情况与野生型相同。这些结果表明,Gln可以克服Orn和Arg的抑制作用燕麦突变体不能或只能很差地利用精氨酸或Orn作为氮源。
燕麦当提供精氨酸时,突变体积累尿素循环中间产物
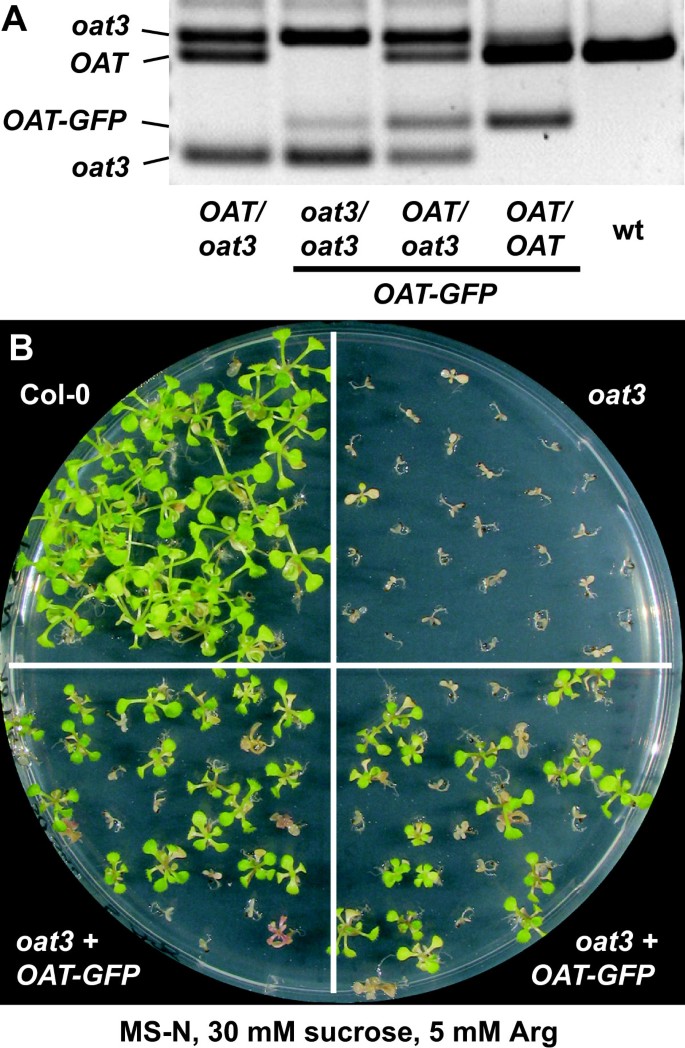
决定外部供应的精氨酸和精氨酸的命运燕麦以Gln、Arg、Orn和尿素为氮源,测定了突变体和野生型幼苗的游离氨基酸库。以支持形成足够数量的生物量燕麦所有平板均添加0.5 mM Gln。正如预期的那样,在10 mM谷氨酰胺上培养的植物中,游离谷氨酰胺积累,而大多数其他氨基酸的存在水平与在20 mM矿物氮上培养的植物相似(图2)。5 b,无花果。6,数据未显示)。Arg含量略微降低是与野生型的唯一显著差异燕麦突变体在10 mM Gln上。以尿素、精氨酸或Orn为主要氮源时,游离谷氨酰胺水平逐渐降低,且氮含量降低燕麦突变体的Gln含量始终低于野生型,尽管差异仅在5 mM精氨酸上显著(图2)。5 c, D和无花果。6).以Orn为主要氮源,燕麦尽管培养基中存在0.5 mM的Gln,突变体的Gln消耗几乎达到检测限。有趣的是,在所有分析的条件和所有基因型中,Glu水平几乎是恒定的。天冬酰胺和天冬氨酸水平基本反映了Gln和Glu含量的变化趋势,且水平较低。以10 mM尿素为主要氮源时,游离氨基酸水平普遍较低。类型之间的显著差异燕麦只观察到γ-氨基丁酸,精氨酸(两者都在低燕麦突变体)和Orn(更高的燕麦突变体)。野生型和燕麦当外源Arg或Orn时,观察到突变体。在这些条件下,燕麦突变体积累了Orn、瓜氨酸(Cit)和Arg。Cit和Orn水平比对照组高34到163倍燕麦而Arg则增加了6 ~ 21倍。亮氨酸、异亮氨酸、苯丙氨酸和赖氨酸也有显著的增加,尽管幅度较小。Gln,天冬氨酸和Pro是唯一的氨基酸水平显著降低观察燕麦在Orn或Arg上培养的突变体。根据这些氨基酸谱,我们得出结论,δOAT是氮从Orn或Arg中主要且可能是唯一的出口途径。Cit的积累表明,Orn和Arg在摄取后代谢,很可能是由尿素循环的酶。
燕麦突变体通过δOAT-GFP融合蛋白的表达获救
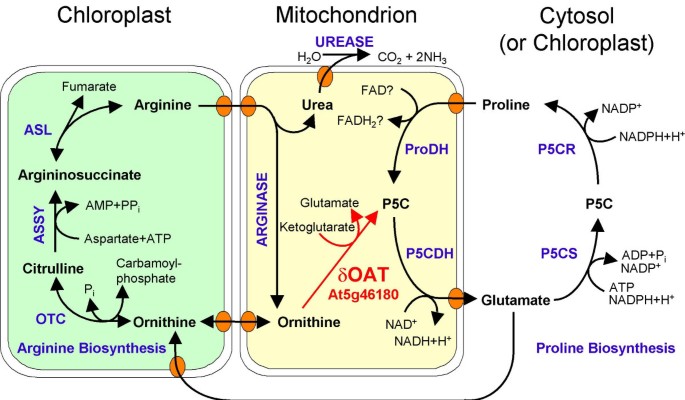
证明了该突变体的表型燕麦敲除突变体仅仅是基于δOAT活性的缺乏,我们跨越了oat3在T2代和T3代中均可见到GFP表达的δOAT-GFP转基因系。利用PCR技术对杂交后的F2代进行基因分型鉴定oat3-T-DNA额外携带δOAT-GFP构造(图。7一个).在纯合子的后代中oat3植物杂合子为δOAT-GFP通过扩展、去黄化子叶和真叶形成,70株幼苗中有39株Arg分解代谢呈阳性(图2)。7 b).39例均有明显的GFP表达。在31株Arg敏感苗中,18株未表现出任何GFP荧光,13株表现出GFP荧光,其中GFP表达细胞和不表达细胞呈斑块状分布。纯合子植物的后代oat3而δOAT-GFP构建的GFP表达细胞更少,不能以Arg作为唯一的氮源生长,这表明Arg和Arg的组合激活了基因沉默oat3δ插入OAT-GFP过度表达(数据未显示)。救援燕麦GFP融合蛋白的突变表型提供了额外的证据,证明氮循环Arg的降解需要线粒体δOAT活性。
讨论
在盐胁迫诱导的脯氨酸生物合成中,δOAT不是必需的
像目前分析的大多数植物一样,拟南芥通过渗透调节和Pro积累来应对高盐度胁迫。Pro的积累是通过特定的Pro转运蛋白诱导生物合成、减少降解和细胞间重新分配的累积结果[16,31].胁迫诱导Pro生物合成的主要来源是Glu通过GSA/P5C的胞质途径,涉及酶P5CS和P5CR。
在细菌和哺乳动物中,Orn的转胺化是GSA/P5C和随后Pro形成的另一种途径[17].给植物喂食标记的Orn后放射性Pro的恢复导致了在高等植物中存在类似途径的概念[17,25].然而,确切的生化途径和贡献酶是有争议的争论。虽然大多数出版物假设δOAT从Orn中产生GSA,自发形成P5C,然后由P5CR转化为Pro,但这一假设忽略了两种酶在不同区域的定位(图5)。1和无花果。8).过度表达δOAT的转基因植株Pro含量较高[24,25].到目前为止,Pro在这些δOAT过表达子中积累的确切来源尚未确定。我们在这里证明了两个T-DNA插入突变体缺乏检测δ燕麦在全苗蛋白提取物中,Orn和α-酮戊二酸P5C表达不显著。这两个燕麦在胁迫或非胁迫条件下,突变体Pro积累不受影响。
此外,之前已经预测了δOAT的线粒体定位,并在本研究中通过分析表达δOAT- gfp融合蛋白的植物证实了这一点。线粒体内δOAT产生的P5C很可能通过线粒体P5CDH进一步转化为Glu。由于GSA/P5C的化学不稳定性,从线粒体输出似乎不太可能,但目前还不能完全排除。P5C刺激O2提取分离的完整线粒体,但很少有P5C是从Orn或Pro中产生的[32].只有在低渗透压缓冲液中线粒体肿胀后,才能测量到Orn-或pro依赖的P5C产生和P5C依赖的NAD减少,这归因于ProDH-P5CDH和δOAT-P5CDH酶复合物的破坏。肿胀对P5C线粒体膜渗透性的影响未被分析。在δOAT过表达的植物中,不复杂的δOAT确实可以导致P5C从线粒体释放,随后由细胞质P5CR转化为Pro。或者,使用拟南芥δ燕麦基因在烟草或水稻中的过表达可能导致不完全导入线粒体,从而导致细胞质δ oat活性。
证明δOAT在Orn向Pro转化中的作用的证据已经来自使用差异标记的追踪实验14C /3.H-Orn [23].只有当Orn的δ-氨基被标记为3.H,大量3.H活性可在Pro组分中恢复。这些发现与假设的α-转氨酶的活性一致,该酶可以作为中间体产生吡咯-2-羧酸酯,或orn -环脱氨酶的活性可以直接产生Pro。但由于孵育时间较长,且可能存在同位素鉴别效应,不能完全排除δOAT的参与[17].3.标记为Pro的H也可以由3.δOAT将标记的氨基转移到α-酮戊二酸时形成的H Glu。以放射性Arg或Orn饲喂对照或枯萎大麦叶片表明,水分亏缺并没有促进Orn向Pro的转化,Arg的c骨架对累积Pro的贡献最大可达1% [33,34].这些发现与我们的观察相一致,δOAT缺失突变体在盐胁迫诱导的Pro积累中保持不变的水平。2).我们认为,在正常生理条件下,Orn只能通过Glu转化为Pro,而这种转化对应激诱导的Pro积累没有实质性的贡献。此外,燕麦突变体提供了一个很好的工具来研究线粒体Orn(例如Arg降解)或外部供应的Orn是否可以通过其他途径转化为Pro。在我们的OAT实验中没有明显的颜色发展燕麦突变体提取物表明,这种替代途径不是由可溶性蛋白质催化的,也不需要不同的底物和辅助因子。或者,在幼苗中表达过低。
δOAT是尿素循环中氮的重要出口途径
在否定了δOAT生理功能的最流行假设之后,我们开始分析精氨酸降解中的另一种功能。Arg被拟南芥根有效地从培养基中提取,并分配到地上器官,可能是通过LHT的转运蛋白,而不是广泛特异性氨基酸的AAP亚家族[35,36].精氨酸分解的第一步是精氨酸酶裂解成Orn和尿素,精氨酸酶定位于植物的线粒体[9].尿素可被胞质脲酶进一步降解,尿素支持其生长燕麦突变体和野生型同样良好(图。4).目前没有关于从线粒体输出尿素的资料[10].然而,精氨酸酶的第二产物Orn的进一步分解代谢似乎依赖于δOAT活性,因为Arg和Orn都不支持生长燕麦突变体。相反,尿素循环的中间产物积累到很高的数量,这表明δOAT是精氨酸分解代谢和氮循环所必需的。5和无花果。6).精氨酸可以产生的其他代谢物是多胺,但显然,这些代谢物没有进一步代谢,或者这一途径的能力太低,无法提供足够的氮来满足生长的需求燕麦突变的幼苗。
使用BAR eFP-Browser对微阵列表达数据进行评估,显示出最强的表达δ燕麦在衰老的莲座叶、花器官和成熟和吸收的种子中[37].在发育中的胚胎中,强壮δ燕麦在子叶中进行表达检测。这些数据进一步支持了δOAT在幼苗早期发育期间的储存动员和衰老期间的氮恢复中的功能。
氨基酸的相互转化和分布
与Arg相比,Orn对野生型拟南芥幼苗生长的支持效果较差,这体现在以Orn为主要氮源培养的植株氨基酸含量普遍较低(图2)。4和无花果。6).精氨酸供应的这种差异可能是由于Orn的摄取率较低或细胞内或细胞内分布受损造成的。Orn在质体中合成,在质体中它也进一步转化为精氨酸,而精氨酸降解过程中Orn的产生发生在线粒体中。因此,在自然条件下,细胞内的高Orn运输率和细胞质中高浓度Orn的发生是不可能发生的。线粒体载体蛋白家族的两个成员,AtBac1和AtBac2,被证明与其他碱性氨基酸一起介导Arg和Orn的转运[11,12].这两种转运蛋白都能够补充线粒体Orn/Arg转运蛋白Arg11缺失的酵母菌株,这表明线粒体也存在于植物中。高水平的Cit和Arg燕麦在Orn上培养的突变体提示Orn导入到质体中(图。5和无花果。6).精氨酸酶的反向反应在热力学上是不利的,即使在高浓度的Orn和尿素存在的情况下,纯化的酶制剂也不能观察到[38].之前在纯化的线粒体中观察到Orn到Cit的转换,这可能构成了将Orn导入质体的另一种途径[39].精氨酸饲喂后Cit含量高燕麦突变体表明源于Arg分解的Orn在线粒体内最终转化为Cit或从线粒体转移到质体。由于质体中的焦磷酸盐水平较低,不太可能通过精氨酸琥珀酸合成酶反应从精氨酸生物合成途径中大量生产Cit [40,41].从Orn合成精氨酸需要每个Arg分子两个氮原子,因此需要在Orn喂养的情况下净n输入。这与极端的Gln消耗是一致的燕麦喂食Orn的突变体(图;5和无花果。6).
不论所提供的氮源如何,燕麦突变体的Orn含量增加,表明Arg的分解代谢在野生型植物中起组成性作用。令人惊讶的是精氨酸含量的下降燕麦在谷氨酰胺或尿素上生长的突变体(图;5和无花果。6).精氨酸生物合成受到最终产物n -乙酰谷氨酸激酶水平的反馈抑制,它催化精氨酸生物合成的关键调控步骤[3.].Arg介导的n -乙酰谷氨酸激酶抑制可通过可塑性PII蛋白缓解,但这种相互作用在调节Arg生物合成中的确切作用尚不清楚[42].在线粒体精氨酸分解代谢中的阻断燕麦突变体可能导致质体中碳氮比的改变或精氨酸浓度的局部增加,这反过来又可能降低精氨酸生物合成的总速率。最近开发了一种用于Arg的基因编码纳米传感器,可用于报告野生型和野生型中细胞质、线粒体或塑性Arg水平燕麦不同营养条件下的突变体[43].
欧氨酸饲料中亮氨酸、异亮氨酸、苯丙氨酸和赖氨酸含量显著增加,精氨酸饲料中也有部分增加。燕麦突变体提示氨基酸代谢紊乱。所有增加的氨基酸都有较高的碳氮比,与缺乏症一致燕麦从Orn和Arg中动员氮的突变体。
精氨酸酶、δOAT和P5CDH对精氨酸的完全降解,每分子精氨酸生成2分子Glu。尽管野生型和野生型之间的线粒体Glu产生存在巨大差异燕麦在Arg或Orn上生长的突变体中,两种基因型的Glu水平相同(图2)。5和无花果。6).在许多关于氮营养、环境胁迫或突变分析的研究中观察到类似的Glu稳态,并被认为表明Glu水平具有特殊的调节功能[44].Glu水平对δOAT缺失的不敏感性可能是其容量不变的前提燕麦突变体在应激条件下积累Pro。
结论
几十年的生化分析为我们理解植物的初级代谢奠定了基础,现在又有了基因组学、蛋白质组学和代谢组学的方法作为补充。尽管如此,代谢过程对特定细胞器或蛋白质超复合物的分隔还远未被完全揭示。确定特定酶在植物细胞代谢和调节网络中的确切作用仍然需要仔细和彻底的基因分析。我们在这里表明,Arg和Pro分解代谢在线粒体中共定位,并在GSA/P5C的形成中汇合,GSA/P5C进一步被P5CDH代谢为Glu。拟南芥中Pro水平不变的检测燕麦突变体提供了强有力的证据,证明从Arg分解代谢到Pro合成的捷径绕过了Glu和细胞质P5CS活性。其他植物是否有一个以上的基因还有待研究P5CDH或燕麦基因具有不同的定位异构体,因此存在其他代谢可能性。
方法
植物材料和生长条件
拟南芥(拟南芥(l)Heynh。生态型Col-0)和T-DNA插入系SALK_033541 (oat1), salk_010095 (oat2)及SALK_106295 (oat3)是从NASC获得的。通过PCR和T-DNA侧翼序列测序验证T-DNA的存在和等位基因状态。基因特异性引物为:燕麦-f: 5'agtcttggattaacttaggagag,燕麦-r: 5'gtcccatatagttgagccattc foroat1而且oat2;燕麦-f2: 5'gctttcatggacgtacattag,燕麦-r2: 5'caagtatcaccatgtcaggac foroat3;T-DNA左缘特异引物为5'ttcggaaccaccatcaaacag。3个突变系均未表现出明显的卡那霉素抗性。所有生理实验均采用植物纯合子回交3次进行Col-0.植物在9厘米的培养皿中轴向培养,培养皿中有商业MS培养基(Duchefa, Netherlands)或自制MS培养基,其中KNO3.和NH4没有3.用20mm氯化钾[45].培养基中添加蔗糖和含氮化合物,并使用8 g/l纯化琼脂固化(BD biosciences, San Jose, CA, USA)。用70% (V/V)乙醇和1% (W/V) NaOCl/0.01% (V/V) Triton-X-100依次处理种子表面消毒,在4°C的0.1% (W/V)琼脂糖中春化24小时。在空调室内栽培,白天光照时间短(9 h),光强为110 μmol光子*s-1*米-2来自混合荧光管(欧司朗,德国),恒温22°C。为了测定OAT活性,植物在添加60mm蔗糖的MS液体培养基中,在持续搅拌和24小时弱光下培养。为了生产种子,植物被保存在温室中,光照时间至少为16小时。烟草benthamiana多明属植物是在温室的长期日照条件下,在商业园艺土壤上栽培的。
δOAT-GFP构造和成像
δ的开放阅读框燕麦PCR从EST克隆H4E5 (GenBank W43737;引物5'ctggatccgactctaatggcagccaccac和5'ctggatccgcatagaggtttcttccac。由此产生的PCR产物通过引入的BamHI位点克隆到载体pEZT-NL中(Dave Erhardt, [46])。根癌土壤杆菌用应变LBA4404进行瞬态变换n benthamiana拟南芥叶片与花浸转化[47,48].从转化叶片中获得原生质体,用纤维素酶和显微酶孵育一夜(Serva,海德堡,德国),并在Axiovert 200 M荧光显微镜下观察(Carl Zeiss, Oberkochen,德国)。用于GFP、MitoTracker orange和叶绿素的滤波器组分别为38HE(激发470±20 nm,发射525±25 nm)、43HE(550±12.5/605±35)和45(560±20/630±32.5)。GFP和MitoTracker的交叉检测可以忽略不计。使用AxioCam MRm单色数码相机拍摄图像。使用AxioVison软件对图像进行虚假着色和覆盖。
RNA分离与检测
用Trizol试剂(Invitrogen, USA)从两周龄的轴向培养的幼苗中提取总RNA。RNA通过变性琼脂糖凝胶电泳分离,并通过毛细管转移转移到带正电的尼龙膜上。δ燕麦以引物燕麦-f2和燕麦-r2为引物,克隆cDNA为模板,用dig标记的PCR产物杂交检测转录本,然后用碱性磷酸酶偶联抗dig抗体和化学发光底物CDP-star检测(Roche, Switzerland)。P5CS1从基因组DNA中扩增和亚克隆了185 bp的5'UTR片段,检测到转录本。
OAT活性测定
该分析程序是[描述的方法的组合]49]和[50].液体培养的新鲜幼苗用蒸馏水简单冲洗,吸干,用5 μl/mg Fw冰水萃取缓冲液(100 mM KHPO4, 10 mM β-MSH, 1 mM EDTA, 0.2 mM吡哆醛5'磷酸盐,pH 7.9)。提取液在桌面离心机中以16400 rpm、4°C离心15分钟,并在与提取缓冲液平衡的5 ml HiTrap柱中脱盐(GE healthcare, UK)。将25 mM Orn、25 mM α-酮戊二酸酯和100 μl植物提取物混合在总体积为500 μl的提取缓冲液中,在37℃下孵育20 min,加入150 μl 3 M HClO终止反应4.P5C用100 μl 2% (W/V)茚三酮水溶液检测,96℃加热6 min。水不溶性反应产物用1 ml甲苯提取,在520 nm最大吸光度处测定。对于空白,HClO4在提取物之前加入,并进行相同的处理。当省略Orn或提取物时,均未检测到P5C。脯氨酸产生的产品在540 nm处吸光度最大,这在检测中没有观察到。通过Bradford法测定提取物的蛋白质浓度,并将P5C的量归一化,P5C进一步转换为任意活性单位,其中野生型活性设置为1。
脯氨酸和氨基酸测定
Free Pro的定量方法由[51叶料在N液中研磨2以10% (W/V)磺基水杨酸3 μl/mg Fw解冻。在冰上提取至少30 min后,离心取250 μl上清液,加入150 μl HAc和150 μl酸性茚三酮试剂(125 mg茚三酮加入2 ml 6 M正磷酸和3 ml HAc), 96℃反应20 min。在冰上冷却混合物,用1毫升甲苯提取红色反应产物。在520 nm处读取甲苯上清液的吸光度,用与样品处理方法相同的0 - 10 mM Pro标准曲线计算Pro浓度。在本实验中,已知Orn具有与Pro相同的吸收值,但在NaCl胁迫或非胁迫野生型或野生型中,Orn水平低于Pro水平的2%燕麦在正常矿物氮源上培养的突变体(数据未显示)。
甲醇/水提取的氨基酸采用柱后茚三酮衍生化的高效液相色谱法定量,如[52].
数据库挖掘
亚细胞定位预测数据取自ARAMEMNON数据库[22,53].利用TargetP预测转运肽切割位点[21,54].微阵列表达数据使用BAR提供的网络工具进行分析(the Bio-Array Resource for Arabidopsis Functional Genomics [29])
缩写
- 参数:
-
精氨酸
- 美国手语:
-
argininosuccinate裂合酶
- 装配:
-
argininosuccinate合成酶
- Cit:
-
瓜氨酸
- Dw:
-
干重
- 弗兰克-威廉姆斯:
-
鲜重
- Gln:
-
谷氨酰胺
- Glu:
-
谷氨酸
- GSA:
-
glutamate-5-semialdehyde
- δ燕麦:
-
鸟氨酸-δ转氨酶
- 内在的:
-
鸟氨酸
- 场外:
-
鸟氨酸氨甲酰基转移酶
- P5C:
-
pyrroline-5-carboxylate
- P5CDH:
-
P5C脱氢酶
- P5CR:
-
P5C还原酶
- P5CS:
-
P5C合成酶
- 正方观点:
-
脯氨酸
- ProDH:
-
箴脱氢酶。
参考文献
- 1.
杨建平,王志刚,王志刚:植物生物化学与分子生物学研究。马里兰州罗克维尔,美国植物生理学家协会2000年。
- 2.
de Ruiter H, Kollöffel C:发育和发芽的豌豆种子子叶中的精氨酸分解代谢。植物营养学报,2003,27(3):344 - 344。
- 3.
植物精氨酸生物合成的基因、酶和调控。植物理化,2005,43(8):729-745。10.1016 / j.plaphy.2005.06.007。
- 4.
范妮婷,王晓明,王晓明,王晓明。200种被子植物种子营养成分及氨基酸组成的研究。农业食品化学,1996,11(5):399-410。10.1021 / jf60129a016。
- 5.
Alcázar R, Marco F, Cuevas JC, Patron M, Ferrando A, Carrasco P, Tiburcio AF, Altabella T:多胺在植物非生物胁迫响应中的参与。生物技术通报,2006,28(23):1867-1876。10.1007 / s10529 - 006 - 9179 - 3。
- 6.
Imai A, Matsuyama T, Hanzawa Y, Akiyama T, Tamaoki M, Saji H, Shirano Y, Kato T, Hayashi H, Shibata D, Tabata S, Komeda Y, Takahashi T:亚精胺合成酶基因对拟南芥的生存至关重要。中国农业科学,2004,29(3):344 - 344。10.1104 / pp.104.041699。
- 7.
植物代谢中的区室化。实验学报,2007,58(1):35-47。10.1093 / jxb / erl134。
- 8.
张晓东,王晓明,王晓明,王晓明。拟南芥亚细胞数据库的研究进展。核酸研究,2007,35(数据库issue): D213-218。10.1093 / nar / gkl863。
- 9.
杨晓明,王晓明,王晓明,等。精氨酸酶降解大豆幼苗子叶线粒体中精氨酸的研究。植物学报,2000,20(4):652-658。10.1007 / s004250050056。
- 10.
Kojima S, Bohner A, von Wirén N:植物尿素转运的分子机制。中国生物医学工程学报,2006,29(2):344 - 344。10.1007 / s00232 - 006 - 0868 - 6。
- 11.
Hoyos ME, Palmieri L, Wertin T, Arrigoni R, Polacco JC, Palmieri F:拟南芥基本氨基酸线粒体转运体在酵母中的功能重建和互补。植物学报,2003,33(6):1027-1035。10.1046 / j.1365 - 313 x.2003.01685.x。
- 12.
Catoni E, Desimone M, Hilpert M, Wipf D, Kunze R, Schneider A, Flügge UI, Schumacher K, Frommer WB:拟南芥核编码线粒体精氨酸-鸟氨酸易位基因的表达模式。中国生物医学工程学报,2003,3:1-10.1186/1471-2229-3-1。
- 13.
Strizhov N, Abraham E, Okrész L, Blickling S, Zilberstein A, Schell J, Koncz C, Szabados L:拟南芥盐胁迫下两个控制脯氨酸积累的P5CS基因的差异表达需要ABA,并受ABA1、ABI1和AXR2的调控。植物学报,1997,12(3):557-569。10.1046 / j.1365 - 313 x.1997.00557.x。
- 14.
Székely G, Abrahám E, Cséplo A, Rigó G, Zsigmond L, Csiszár J, Ayaydin F, Strizhov N, Jásik J, Schmelzer E, Koncz C, Szabados L:拟南芥复制P5CS基因在胁迫调节和脯氨酸生物合成发育控制中起着不同的作用。植物学报,2008,53(1):11-28。
- 15.
Deuschle K, Funck D, Hellmann H, Däschner K, Binder S, Frommer WB:编码线粒体delta -吡罗啉-5-羧酸脱氢酶的核基因及其在脯氨酸毒性保护中的潜在作用。植物学报,2001,27(4):345-356。10.1046 / j.1365 - 313 x.2001.01101.x。
- 16.
Yoshiba Y, Kiyosue T, Nakashima K, Yamaguchi-Shinozaki K, Shinozaki K:水分胁迫下脯氨酸作为渗透剂的调节水平。植物生理学报,1997,38(10):1095-1102。
- 17.
亚当斯E,弗兰克L:脯氨酸和羟脯氨酸的代谢。生物化学学报,2000,19(4):344 - 344。10.1146 / annurev.bi.49.070180.005041。
- 18.
Delauney AJ, Hu CA, Kishor PB, Verma DP:乌头维尼亚鸟氨酸delta-氨基转移酶cDNA的克隆及其对脯氨酸生物合成的调控。中国生物医学工程学报,2003,26(4):457 - 457。
- 19.
Sekhar PN, Amrutha RN, Sangam S, Verma DP, Kishor PB:植物脯氨酸生物合成中重要酶——鸟氨酸delta-氨基转移酶的生物化学表征、同源性建模和对接研究。Mol图模型,2007,26(4):709-719。10.1016 / j.jmgm.2007.04.006。
- 20.
鲁森森,吴晓明,张晓明,杨晓明,等:拟南芥鸟氨酸- δ -氨基转移酶cDNA的分离及其对盐胁迫的影响。植物营养学报,2004,27(1):344 - 344。10.1104 / pp.117.1.263。
- 21.
Nielsen H, Engelbrecht J, Brunak S, von Heijne G:原核和真核信号肽的鉴定及其切割位点的预测。蛋白质学报,1997,10(1):1-6。10.1093 /蛋白质/大家。
- 22.
Schwacke R, Schneider A, van der Graaff E, Fischer K, Catoni E, Desimone M, Frommer WB, Flügge UI, Kunze R: ARAMEMNON,拟南芥整体膜蛋白数据库。植物科学进展,2003,31(1):1 - 6。10.1104 / pp.011577。
- 23.
Mestichelli LJ, Gupta RN, Spenser ID:鸟氨酸到脯氨酸的生物合成途径。中国生物医学工程学报,1997,26(3):344 - 344。
- 24.
杨晓明,李志刚,李志刚,李志刚,李志刚:转基因植物超表达鸟氨酸- δ -氨基转移酶对脯氨酸生物合成和渗透耐受性的影响。分子育种,2002,9(2):73-80。10.1023 /: 1026791932238。
- 25.
吴玲,范忠,郭玲,李勇,陈志林,曲丽娟:水稻细菌nhaA基因的过表达增强了水稻的耐盐耐旱能力。植物科学学报,2005,26(2):357 - 357。10.1016 / j.plantsci.2004.05.033。
- 26.
王晓明,王晓明,王晓明,等。nacl胁迫下萝卜子叶脯氨酸积累与鸟氨酸氨基转移酶的关系。植物学报,1995,18(2):205-210。10.1111 / j.1365-3040.1995.tb00354.x。
- 27.
杨春春,高春春:鸟氨酸-δ-氨基转移酶对水分胁迫下离体水稻叶片脯氨酸积累的重要性。植物生长调控,1999,27(3):191-194。10.1023 /: 1006226732574。
- 28.
Toufighi K, Brady SM, Austin R, Ly E, Provart NJ:植物阵列资源:E - northern,表达角度和启动子分析。植物学报,2005,43(1):153-163。10.1111 / j.1365 - 313 x.2005.02437.x。
- 29.
BAR拟南芥功能基因组学生物阵列资源。[http://bbc.botany.utoronto.ca/]
- 30.
Bonner CA, Williams DS, Aldrich HC, Jensen RA: l -谷氨酰胺对烟草悬浮培养中其他氨基酸毒性和生长抑制的拮抗作用。植物科学学报,1996,15(1):1 -5。10.1016 / 0168 - 9452(95) 04284 - 9。
- 31.
Grallath S, Weimar T, Meyer A, Gumy C, Suter-Grotemeyer M, Neuhaus JM, Rentsch D: AtProT家族。相容的溶质转运体具有相似的底物特异性,但表达模式不同。植物营养学报,2005,37(1):344 - 344。10.1104 / pp.104.055079。
- 32.
Elthon TE, Stewart CR:玉米线粒体中的脯氨酸氧化:NAD的参与,与鸟氨酸代谢的关系,和内膜的偏侧。植物营养学报,2002,27(2):366 - 366。
- 33.
Boggess SF, Stewart CR:水胁迫对放射性前体脯氨酸合成的影响。植物科学进展,2003,23(3):398-401。
- 34.
精氨酸对水分胁迫大麦叶片脯氨酸积累的贡献。植物科学进展,2003,27(6):379 - 379。
- 35.
李永华,陈杰,李永华,李志强,李志强,李志强,李志强。拟南芥AAP1基因在根系中转运不带电荷的氨基酸。植物学报,2007,50(2):305-319。10.1111 / j.1365 - 313 x.2007.03045.x。
- 36.
Hirner A, Ladwig F, Stransky H, Okumoto S, Keinath M, Harms A, Frommer WB, Koch W:拟南芥LHT1是根表皮和叶叶肉中细胞氨基酸吸收的高亲和转运蛋白。植物细胞学报,2006,18(8):1931-1946。10.1105 / tpc.106.041012。
- 37.
Schmid M, Davison TS, Henz SR, Pape UJ, Demar M, Vingron M, Scholkopf B, Weigel D, Lohmann JU:拟南芥发育的基因表达图谱。植物学报,2005,37(5):501-506。10.1038 / ng1543。
- 38.
Reczkowski RS, Ash DE:大鼠肝脏精氨酸酶:动力学机制,替代底物和抑制剂。中国生物工程学报,1994,31(1):1- 7。10.1006 / abbi.1994.1276。
- 39.
Taira M, Valtersson U, Burkhardt B, Ludwig RA:拟南芥gln2编码谷氨酰胺合成酶对叶片线粒体和叶绿体的双靶向作用。植物细胞学报,2004,16(8):2048-2058。10.1105 / tpc.104.022046。
- 40.
王志强,王志强,王志强,等:叶片焦磷酸盐和碱性焦磷酸酶的亚细胞区室化。生物化学与生物物理学报。1987,39(1):1 -10。
- 41.
Farré EM, Tiessen A, Roessner U, Geigenberger P, Trethewey RN, Willmitzer L:用非水分离方法分析马铃薯块茎中糖酵解中间体、核苷酸、糖、有机酸、氨基酸和糖醇的区隔。植物营养学报,2001,27(2):379 - 379。
- 42.
Chen YM, Ferrar TS, Lohmeier-Vogel EM, Morrice N, Mizuno Y, Berenger B, Ng KK, Muench DG, Moorhead GB:拟南芥PII信号转导蛋白与质体N-乙酰谷氨酸激酶形成精氨酸调控复合物。中华生物化学杂志,2006,28(9):5726-5733。10.1074 / jbc.M510945200。
- 43.
鲍格纳M,吕德维格U:利用特定的fret -传感器可视化精氨酸流入植物细胞。荧光杂志,2007,17(4):350-360。10.1007 / s10895 - 007 - 0192 - 2。
- 44.
Forde BG, Lea PJ:植物中的谷氨酸:代谢,调节和信号。应用实验学报,2007,58(9):2339-2358。10.1093 / jxb / erm121。
- 45.
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修订培养基。中国生物医学工程学报,2002,29(3):344 - 344。10.1111 / j.1399-3054.1962.tb08052.x。
- 46.
卡内基细胞成像项目。[http://www-ciwdpb.stanford.edu/research/research_ehrhardt.php]
- 47.
Clough SJ, Bent AF:花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。
- 48.
杨晓明,王晓明,李晓明,等:农杆菌介导的烟草叶片瞬时基因表达系统的优化。生物化学学报,2006,53(2):289-298。
- 49.
李建平,李建平,李建平,李建平,等。氨基己烯酸对植物鸟氨酸转氨酶的抑制作用。植物化学,1993,34(5):1231-1234。10.1016 / 0031 - 9422 (91) 80006 - m。
- 50.
金洪亮,李文敏,李文敏,李文敏,李文敏,丁二醇对鸟氨酸氨基转移酶的影响。中国生物医学工程学报,1994,23(2):379 - 379。10.1006 / abio.1994.1574。
- 51.
Bates LS, Waldren RP, Teare ID:水分胁迫研究中游离脯氨酸的快速测定。植物与土壤学报,2003,39(1):205-207。10.1007 / BF00018060。
- 52.
Pilot G, Stransky H, Bushey DF, Pratelli R, Ludewig U, Wingate VP, Frommer WB:谷氨酰胺DUMPER1的过表达导致拟南芥湿藻(Hydathodes of Arabidopsis)叶片谷氨酰胺分泌过多。植物细胞学报,2004,16(7):1827-1840。10.1105 / tpc.021642。
- 53.
植物膜蛋白数据库。[http://aramemnon.botanik.uni-koeln.de]
- 54.
TargetP 1.1服务器。[http://www.cbs.dtu.dk/services/TargetP/]
确认
我们非常感谢康斯坦茨大学的园丁提供了优秀的植物护理和种子收获。我们感谢Tanja Sikler, ZMBP植物栽培,提供n benthamiana种子和防治害虫的有用建议。ZMBP分析公司的Mark Stahl和康斯坦茨大学的Matthias Langhorst分别因高效液相色谱故障诊断和显微镜帮助而获得认可。我们非常感谢意大利费拉拉大学的Giuseppe Forlani和Davide Petrollino对OAT检测的建议,并提供了P5C作为阳性对照。Tanja Güntert和Nina Kaczmarek为实验室和预备实验提供了帮助。我们要感谢Iwona Adamska, Karen Deuschle和Pitter Huesgen对手稿的批判性阅读。此外,三位匿名审稿人在第一版手稿中发现了严重的错误,并提出了有价值的补充意见。Iwona Adamska和康斯坦茨大学为这项研究提供了物质和资金支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
DF设计了这项研究,并进行了大部分实验;BS和WK进行了氨基酸分析,并帮助编译和解释数据。所有作者均已阅读并批准最终稿
电子辅助材料
12870 _2007_248_moesm1_esm.pdf
附加文件1:2个补充图。补充图1说明了δOAT-GFP融合蛋白在完整的拟南芥细胞中的定位。补充图2显示了北部斑点的全图,也显示在图中。2摄氏度,以证明截断δ的缺失燕麦您记录。(pdf 1mb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Funck, D., Stadelhofer, B. & Koch, W.鸟氨酸-δ-转氨酶是精氨酸分解代谢所必需的,但不是脯氨酸生物合成。BMC植物生物学8日,40(2008)。https://doi.org/10.1186/1471-2229-8-40
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-40
关键字
- 精氨酸酶
- 野生型植物
- 氮循环
- 蛾豆
- 主要氮源