摘要
背景
在拟南芥中,我NDOLE-3 -BUTYRIC酸RESPONSE5 (IBR5)是一种公认的双特异性蛋白磷酸酶,是生长素反应的正向调节因子。突变IBR5导致株高降低,维管束发育不良,叶片锯齿增加,侧根减少,对植物激素生长素和脱落酸产生抗性。然而,IBR5影响生长素反应的途径还不完全清楚。
结果
我们分析了双突变体ibr5与其他抑制生长素反应的突变体结合发现ibr5用生长素受体突变体,tir1与亲本或亲本相比,生长素抗性增强。与其他生长素反应突变体一样,生长素反应报告细胞的积累在ibr5.与其他抗生长素突变体不同,Aux/IAA抑制因子报告蛋白AXR3NT-GUS在突变体中不稳定ibr5.同样,Aux/IAA抑制因子IAA28在小鼠中含量较低ibr5与野生型相比。ibr5缺乏催化半胱氨酸残基的IBR5突变体的过表达并不能完全挽救缺陷。
结论
我们的遗传和分子证据表明,IBR5是一种促进生长素反应的磷酸酶,包括生长素诱导的转录,与TIR1生长素受体不同,并且不会破坏Aux/IAA抑制蛋白的稳定。我们的数据与生长素响应转录可以被tir1介导的抑制因子降解下游调节的可能性相一致。
背景
植物激素生长素是植物生长发育的关键,通过调节细胞分裂和伸长来调节维管发育、顶端优势、向性反应和器官模式[1,2].基因表达的变化是对生长素最早的分子反应之一。许多生长素反应转录本分为三类:GH3有关的,辅助在/我NDOLE-3 -一个CETIC一个CID(辅助/ IAA),年代购物中心一个UXIN -UPRNA(阿富汗二月)抄本[3.- - - - - -8].许多这些生长素反应基因的共同之处在于上游调控区的序列,称为辅助在- - - - - -ResponsiveE克莱门特。(AuxRE;[9])。
一个UXINRESPONSEFACTOR (ARF)蛋白是结合AuxREs的转录因子(在[10])。根据中心结构域的性质,ARF家族成员可以激活或抑制转录[11,12].ARF蛋白可以形成同型二聚体,与其他ARF蛋白形成二聚体,或与转录抑制的Aux/IAA蛋白形成二聚体[13,14].许多Aux/IAA蛋白通过与激活ARF蛋白相互作用直接阻止转录激活[12,15].
许多Aux/IAA转录抑制因子不稳定[5]并且在施用生长素后会更快地降解[16,17].Aux/IAA在生长素刺激下的快速降解被认为是将激活的ARF蛋白从抑制中释放出来,允许生长素响应性基因表达。对生长素敏感性降低的突变体筛选发现了几种具有稳定突变的Aux/IAA蛋白(在[18])。从生长素反应筛选中还分离出反式作用突变,同样稳定Aux/IAA蛋白,揭示了这些抑制因子的降解机制。一些抗生长素突变体在SCF中存在缺陷TIR1E3泛素连接酶复合物,及其调控成分(综述于[2])。
TRANSPORT我NHIBITORRESPONSE1 (TIR1)和其他一个UXIN信号F-BOX (AFB)家族成员是SCF复合物的底物识别组分,结合生长素并促进Aux/IAA抑制蛋白的降解[19- - - - - -21].生长素被一个相互作用的Aux/IAA蛋白困在TIR1的生长素结合袋中[22].Aux/IAA蛋白随后的26S蛋白酶体降解缓解了ARF蛋白的抑制,允许生长素响应性转录[16,17,23].这种新的受体-配体相互作用允许一个非常短的信号转导链,可能促进对生长素的快速转录反应。此外,RUB (R得意洋洋的,乌兰巴托IQUITIN)修饰SCF的CULLIN亚基TIR1是生长素反应所必需的[24,25].突变AXR1而且ECR1,编码rubb激活酶的亚基[26,27],导致生长素反应降低,同时Aux/IAA蛋白降解减慢[16,25,28- - - - - -30.],可能是因为SCF降低了TIR1靶向这些蛋白质降解的功效。
正常的生长素反应需要生长素通过植物的主动运动,这是由专门的流入和流出载体控制的(综述在[31])。辅助IN RESISTANT1 (AUX1)是一种生长素流入载体蛋白,允许某些生长素进入细胞[32- - - - - -35].突变AUX1产生对IAA和2,4-二氯苯氧乙酸(2,4- d)的抗性[34],它们是AUX1转运蛋白的底物[35].
多种天然和合成生长素和生长素前体在生长素生物测定中具有活性[2].基因突变IB一个RESPONSE5(IBR5)在对生长素前体吲哚-3-丁酸(IBA)抑制根系生长的抗性筛选中被鉴定出来[36].随后的分析显示,ibr5突变体不仅对IBA不敏感,而且对所有测试形式的生长素和植物激素脱落酸(ABA)也不敏感[37].IBR5编码一个假定的双特异性蛋白磷酸酶,和ibr5-1突变导致过早的终止密码子,从而导致缺少保守磷酸酶结构域的截断产物[37].在这里,我们研究了IBR5作为磷酸酶的作用在活的有机体内通过表达IBR5的突变版本,预测在催化活性ibr5并发现磷酸酶活性可能是IBR5功能完整所必需的。通过双突变体分析,我们发现ibr5增强的最tir1的缺陷和子集axr1而且aux1缺陷。进一步,我们证明了ibr5在生长素处理后,生长素反应报告细胞的积累存在缺陷。由于该报告在Aux/IAA转录抑制因子降解后积累,我们检查了该报告的影响ibr5对Aux/IAA稳定性报告蛋白和表位标记的Aux/IAA蛋白进行了损伤,有趣的是,我们发现这些报告蛋白并不稳定ibr5.
结果
ibr5增强了tir1auxin-response缺陷
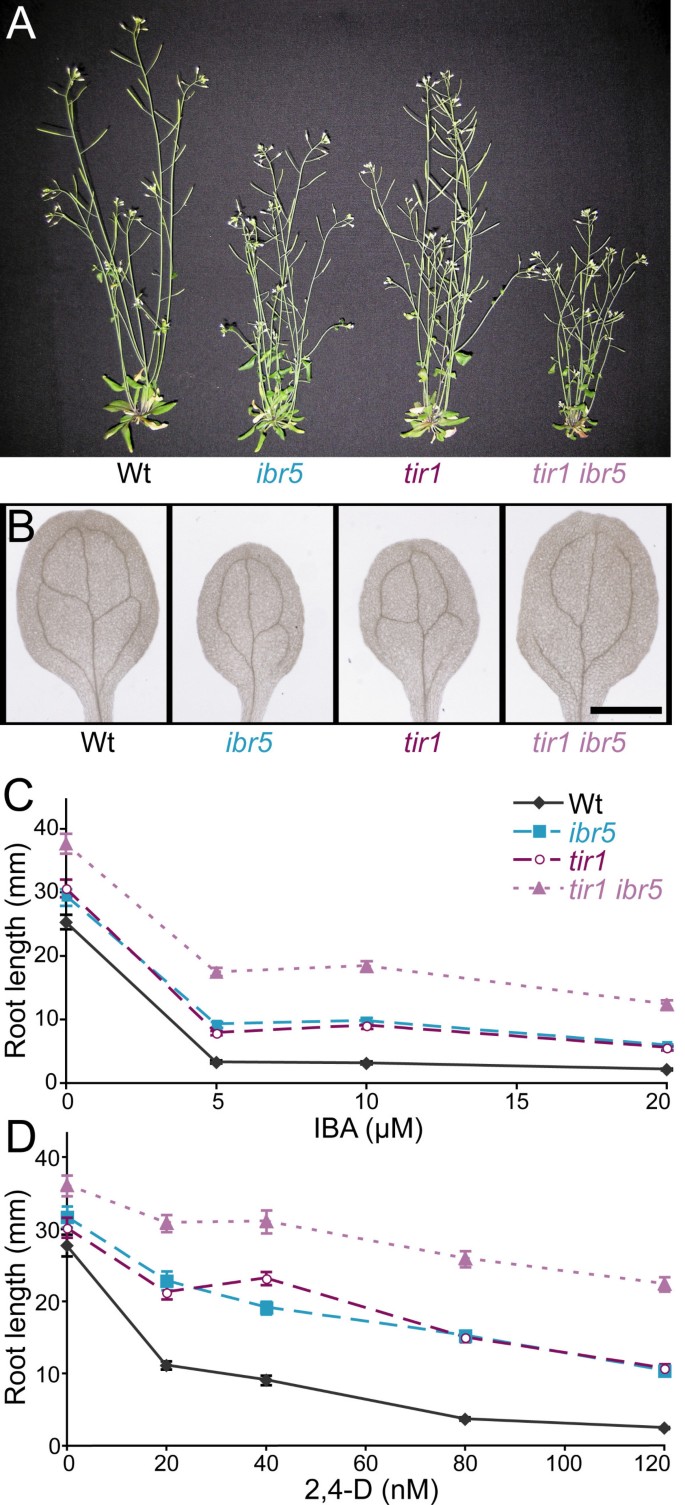
的tir1突变体,如ibr5[37],在主根伸长抑制和侧根形成试验中对生长素的反应较弱[38].来检查基因之间的相互作用ibr5而且tir1,我们穿过tir1-1来ibr5-1并检查由此产生的双突变体的表型。我们发现tir1 ibr5植株比亲本或亲本均短(图1).ibr5子叶的血管化缺陷有时被轻度增强tir1(图1 b).此外,tir1 ibr5双突变体对2,4- d和IBA根系伸长抑制的抗性增强(图1 c而且1 d,附加文件1),对IBA治疗反应的侧根更少(图2),在黑暗中对IBA抑制下胚轴伸长的抵抗力更强(图2 b,附加文件2)。
tir1 ibr5形态表型与生长素反应.(A)野生型成虫形态;ibr5,tir1,tir1 ibr5植物。6周龄Col-0 (Wt),ibr5-1,tir1-1,tir1-1 ibr5-1在连续的光照下生长。(B)血管图案缺陷。8日龄Col-0 (Wt)清除子叶,ibr5-1,tir1-1,tir1-1 ibr5-1展示的是幼苗。比例尺= 1毫米。(C, D)tir1-1 ibr5-1auxin-response缺陷。在22°C的黄滤光下,在添加了不同浓度IBA (C)或2,4-D (D)的培养基上生长的8天大幼苗的初生根的长度。tir1 ibr5根明显长于tir1而且ibr5对照培养基上的根和所有测试的生长素上的根(P≤0.001)int-假设方差不等的测试。误差柱表示均值的标准误差(n≥18)。
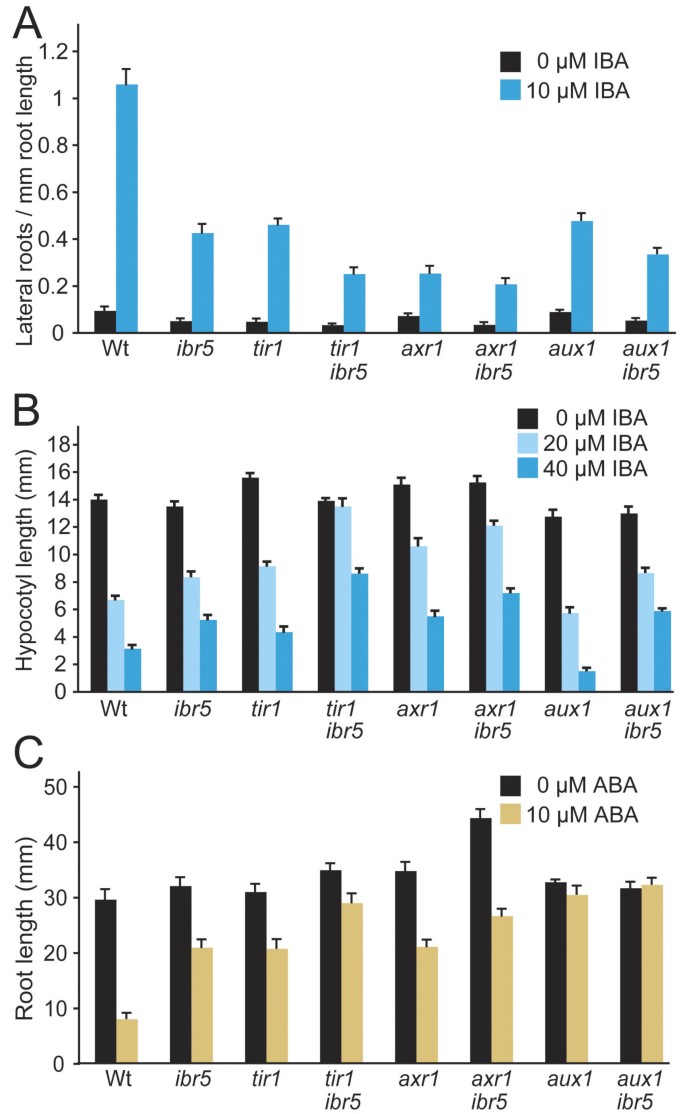
IBA诱导侧根、IBA抑制下胚轴伸长和ABA抑制根伸长的生长素响应突变体缺陷.Col-0 (Wt)的激素反应,ibr5-1,tir1-1,tir1-1 ibr5-1,axr1-3,axr1-3 ibr5-1,aux1-7,aux1-7 ibr5-1被检查。(A)将4天大的幼苗转移到添加0(乙醇对照)或10 μM IBA的培养基上4天后,计数侧根。从主根生出的原基计为侧根。误差柱表示均值的标准误差(n≥14)。tir1 ibr5对IBA反应的侧根明显比两者都少tir1或ibr5(P双尾≤0.001t-假设方差不等的测试)。(B)将1天大的幼苗移栽到暗处4天后,测量下胚轴的长度。误差柱表示均值的标准误差(n= 20)。tir1 ibr5下胚轴明显长于tir1而且ibr520或40 μM IBA上的下胚轴(P双尾≤0.0001t-假设方差不等的测试)。axr1 ibr5下胚轴明显长于axr1而且ibr520号(P≤0.01)或40 μM IBA (P≤0.001)t-假设方差不等的测试。(C)将4天大的幼苗转移到添加0 μM(乙醇对照)或10 μM ABA的培养基上4 d后初生根的长度。tir1 ibr5根明显长于tir1而且ibr5ABA上的根(P≤0.001)t-假设方差不等的测试。axr1 ibr5根明显长于axr1而且ibr5根跟随控制(P≤0.001)或ABA (P≤0.01)处理t-假设方差不等的测试。误差柱表示均值的标准误差(n≥14)。
除了生长素抗性,ibr5突变根对植物激素ABA有抗性[37].我们发现tir1也表现出ABA抗性,并且tir1 ibr5根比任何单一突变体都更耐ABA(图2摄氏度,附加文件2).因为ibr5-1很可能是一个空等位基因[37],这些结果支持IBR5和TIR1分别作用影响生长素和ABA反应性的模型。
ibr5提高某些axr1auxin-response缺陷
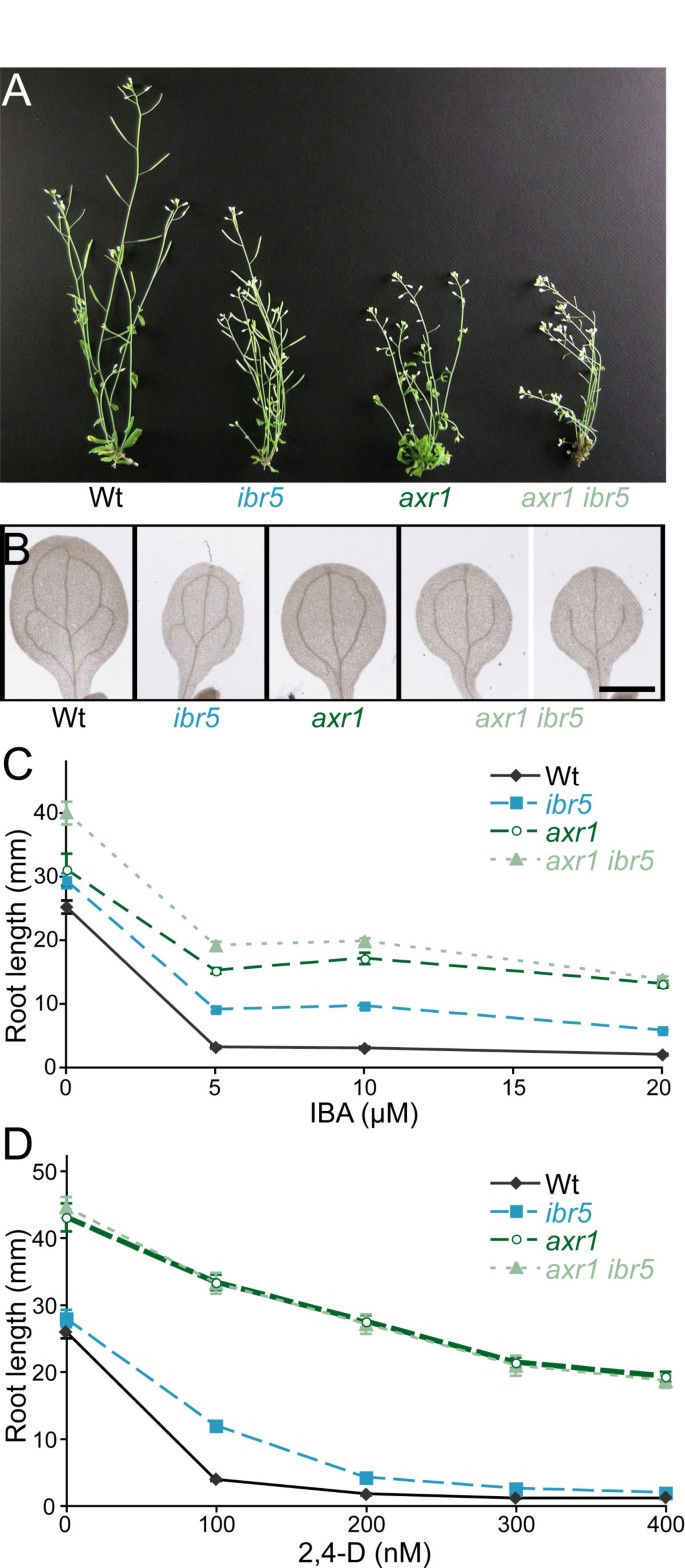
的axr1突变体表现出更极端的生长素反应缺陷tir1或ibr5,植株高度受限,顶端优势降低,明显的血管化缺陷,显著的生长素抗性,在未补充的培养基上根比野生型长[29].来检查基因之间的相互作用axr1而且ibr5,我们穿过axr1-3来ibr5-1.双突变体株高相近axr1-3(图3),但叶片偏上(数据未显示)和子叶维管缺陷(图3 b)的观点更为极端axr1 ibr5与父母任何一方相比。此外,axr1 ibr5在未补充培养基上的根比亲本中的任何一种都长(图3 c),与对内源生长素抗性增强的可能性相一致。双突变体对生长素2,4- d和IBA的抗性没有明显增强(图2)3 c而且3 d,附加文件1).此外,axr1 ibr5并没有显示出对iba诱导的侧根形成的增强抗性(图2,附加文件2),但在黑暗中对IBA抑制下胚轴伸长的抗性略有增强(图2 b,附加文件2).就像ibr5,axr1能抵抗ABA对根伸长的抑制[37),而axr1 ibr5具有与双亲相似的ABA抗性(图2摄氏度,附加文件2).
axr1 ibr5形态表型与生长素反应.(A)野生型成虫形态;ibr5,axr1,axr1 ibr5植物。6周龄Col-0 (Wt),ibr5-1,axr1-3,axr1-3 ibr5-1在连续的光照下生长。(B)血管图案缺陷。8日龄Col-0 (Wt)清除子叶,ibr5-1,axr1-3,axr1-3 ibr5-1展示的是幼苗。比例尺= 1毫米。(C, D)axr1-3 ibr5-1auxin-response缺陷。在22°C的黄滤光下,在添加不同浓度IBA (C)或2,4-D (D)的培养基上生长的8天大(C)或9天大(D)幼苗的初根长度如下图所示。axr1 ibr5根明显长于axr1而且ibr50时(P≤0.01),5 (P≤0.001),10 (P≤0.001)μM IBA双尾t-假设方差不等的测试。axr1 ibr5根与axr1在2,4- d浓度上的根。误差柱表示均值的标准误差(n≥15)。
ibr5增强了aux1根部伸长缺陷
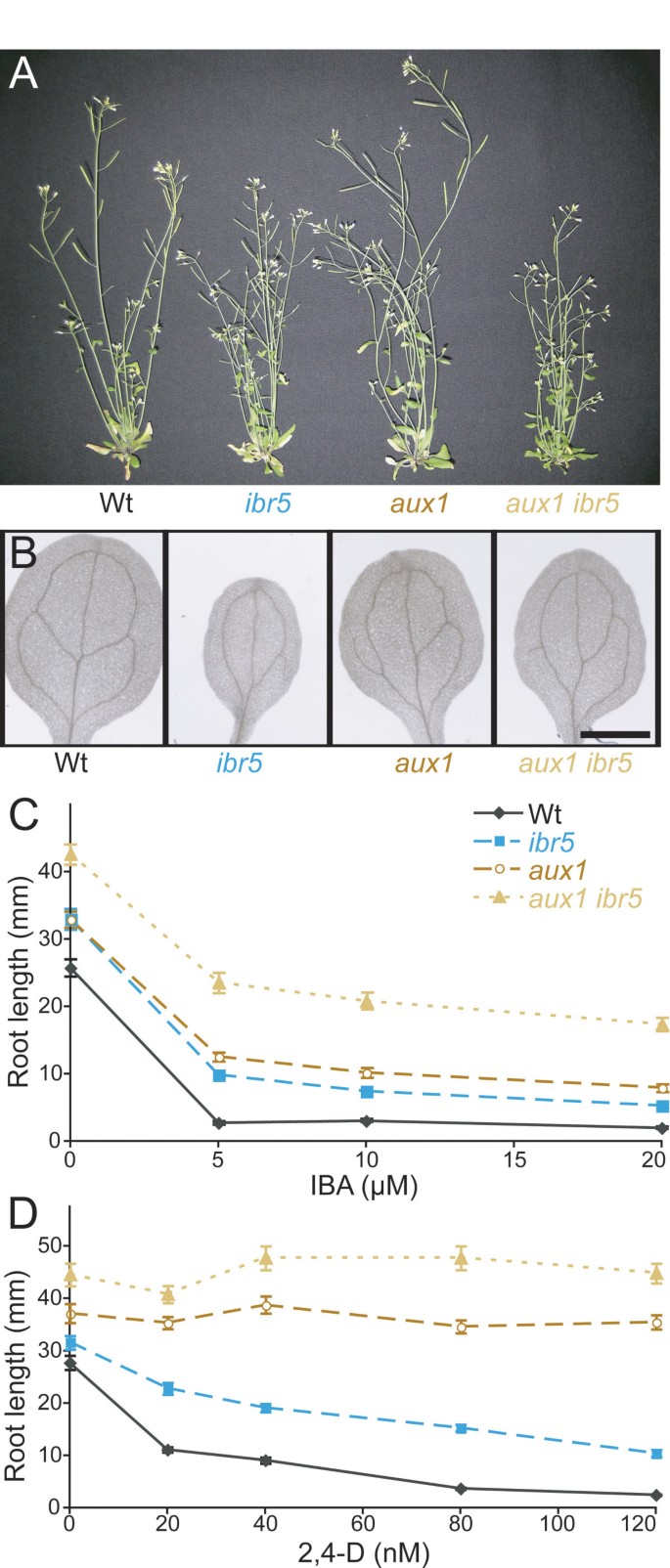
的aux1突变体对AUX1转运体带入细胞的生长素,如2,4- d和IAA显示出明显的抗性[33,34,39],但对1-萘乙酸(NAA)反应正常,而NAA不是由AUX1运输的[33- - - - - -35].虽然IBA似乎不是AUX1底物[35,40),aux1突变体中等抗IBA [36],可能是因为进入细胞的IBA转化为IAA。aux1突变根在无补充培养基上比野生型根长,且具有自律性[39),但aux1空中部分类似野生型。来检查基因之间的相互作用aux1而且ibr5,我们穿过ibr5-1来aux1-7.虽然aux1植物达到正常高度,成虫aux1 ibr5植株比亲本或亲本均短(图4).此外,aux1 ibr5在未补充培养基上,幼苗的根比亲本中的任何一种都长(图4摄氏度).双突变体对生长素2,4- d和IBA的抗性没有明显增强aux1到2,4- d测试的浓度(图4摄氏度而且4 d,附加文件1).我们检查了侧根的产生aux1 ibr5发现aux1并没有明显增强ibr5缺陷(图2,附加文件2).类似地,ibr5子叶维管发育缺陷似乎没有被增强aux1(图4 b).黑色生长的下胚轴aux1对IBA的反应像野生型,而且aux1 ibr5他们的反应与ibr5(图2 b,附加文件2).aux1对测试的ABA浓度无反应(图2摄氏度,附加文件2);因此我们不能确定是否ibr5增强aux1ABA的阻力。
aux1 ibr5形态表型与生长素反应.(A)野生型成虫形态;ibr5,aux1,aux1 ibr5植物。6周龄Col-0 (Wt),ibr5-1,aux1-7,aux1-7 ibr5-1在连续的光照下生长。(B)血管图案缺陷。8日龄Col-0 (Wt)清除子叶,ibr5-1,aux1-7,aux1-7 ibr5-1展示的是幼苗。比例尺= 1毫米。(C, D)aux1-7 ibr5-1auxin-response缺陷。在22°C的黄滤光下,在添加了不同浓度IBA (C)或2,4-D (D)的培养基上生长的8天大幼苗的初生根的长度。aux1 ibr5根明显长于aux1而且ibr5在5、10和20 μM IBA (P≤0.001)t-假设方差不等的测试。aux1 ibr5根明显长于aux1而且ibr5根在20 (P≤0.01),40 (P≤0.01),80 (P≤0.0001),120 (P≤0.001)nM 2,4- dt-假设方差不等的测试。误差柱表示均值的标准误差(n≥16)。
ibr5显示生长素响应报告器积累减少
ibr5在未添加的培养基上生长的幼苗显示出减少的积累DR5:格斯[37],其中GUS报告子由合成生长素响应启动子驱动[13].我们比较了野生型和ibr5DR5:浅色幼苗根系和深色幼苗下胚轴GUS生长素的响应。用各种生长素处理2小时可增加野生型根的DR5:GUS活性5)和下胚轴(图5 b).相比之下,ibr5显示生长素处理后根和下胚轴DR5:GUS活性诱导降低(图5而且5 b).
这种减少DR5:GUS活性的诱导表明ibr5至少有一些生长素调控转录错误。因此,我们检测了内源性植物的基础水平和生长素反应性IAA1,IAA2,GH3.3野生型转录本和ibr5幼苗。尽管我们检测到基础水平的轻微下降IAA1而且IAA2记录在ibr5在一些试验中(数据未显示),我们没有发现这些实验有显著差异。无论如何,IAA1,IAA2,GH3.3转录本最终在野生型和野生型中达到相似的最大值ibr5(数据未显示),表明对高生长素水平的完全反应不需要IBR5。
ibr5是否积累了AXR3/IAA17报告蛋白
稳定任何Aux/IAA蛋白的功能获得性突变可授予显性生长素抗性(综述于[18])。此外,Aux/IAA抑制蛋白或Aux/IAA报告融合蛋白在许多其他抗生长素突变体中稳定,包括tir1[16),axr1[16),ecr1[28),afb1,afb2,afb3[21),cul1[41),eta2 / cand1[42),eta3 / sgt1b[43),而aar1[44].
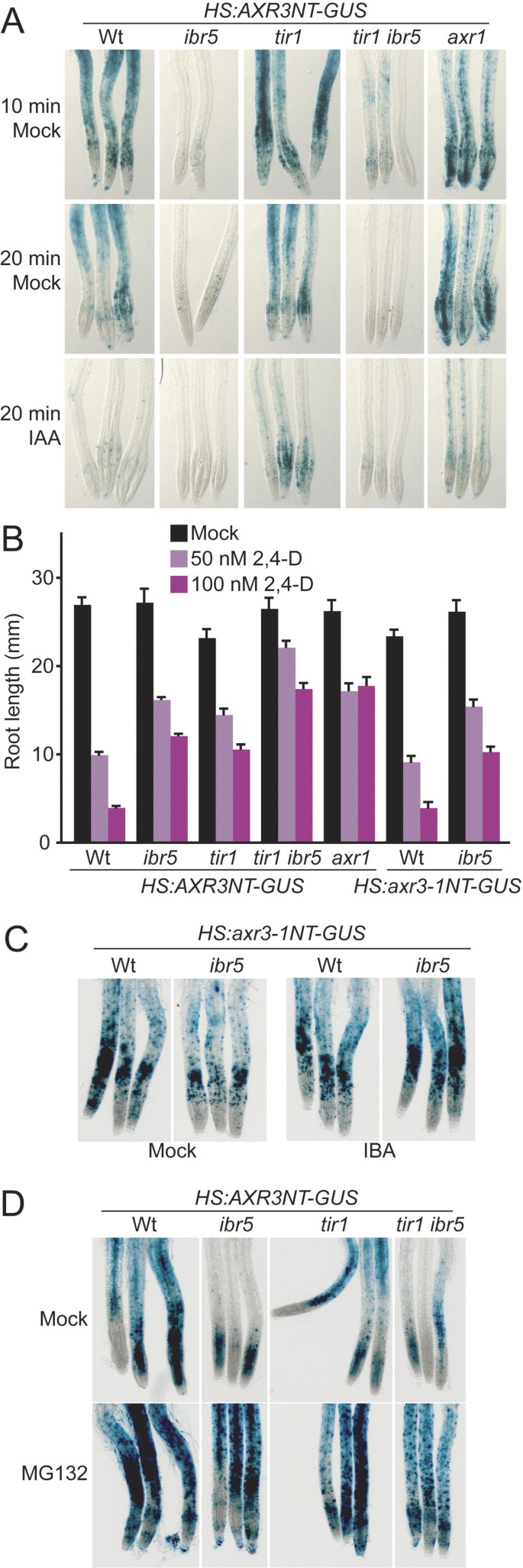
因为生长素反应转录减少ibr5,我们试图分析Aux/IAA的稳定性ibr5突变体。我们走过ibr5-1在大豆热休克启动子的驱动下,表达AXR3/IAA17 Aux/IAA蛋白n端degron区融合β-葡萄糖苷酶(海关:AXR3NT-GUS;[16])。将8天大的幼苗热休克诱导报告基因转录,然后进行模拟处理或生长素处理。在生长素信号通路完整的幼苗中,生长素诱导的AXR3NT-GUS活性的消失反映了该报告子靶向26S蛋白酶体降解[16].有生长素反应缺陷的突变体,比如tir1而且axr1,显示诱导后报告活性增加,生长素处理后AXR3NT-GUS的不稳定性降低[16],与axr1生长素处理后生长素反应转录本积累正常水平的缺陷[45,46].有趣的是,与先前描述的生长素反应突变体不同,我们没有检测到AXR3NT-GUS活性增加ibr5.事实上,AXR3NT-GUS在ibr5在热休克10或20分钟后,野生型根的生长速度比野生型根快6).AXR3NT-GUS活性的降低在tir1 ibr5,这表明ibr5,虽然增强tir1根系伸长对生长素的抗性(图1 c, D,6 b),抑制tir1AXR3NT-GUS积累(图6).对2,4- d的响应与预期一致tir1 ibr5(海关:AXR3NT-GUS)显示出与亲本或亲本的中间抗性相比抗性增强(图6 b).
ibr5不累积AXR3NT-GUS.(A) 8天大的Col-0 (Wt),ibr5-1,tir1-1,tir1-1 ibr5-1,axr1-3幼苗携带海关:AXR3NT-GUS将[16]热休克2小时,用模拟乙醇或100 nM IAA处理指定时间,然后对GUS活性进行染色。(B)生长素反应缺陷海关:AXR3NT-GUS行。在22°C的黄滤光下,在添加了不同浓度2,4- d的培养基上生长的8天大幼苗的初生根的长度。误差柱表示均值的标准误差(n= 20)。(C) 8日龄Col-0 (Wt)和ibr5-1携带海关:axr3-1NT-GUS对[16]进行热休克2小时、模拟(乙醇)处理或10 μM IBA处理40分钟,然后对其GUS活性进行染色。(D) 8日龄Col-0 (Wt),ibr5-1,tir1-1,tir1-1 ibr5-1携带海关:AXR3NT-GUS[16]被热休克2小时。在2小时热休克过程中,开始DMSO(模拟)或50 μM MG132处理。回到室温2小时后,对幼苗进行GUS活性染色。单独的实验表明,在热休克期间,DMSO的加入(作为MG132载体在D图中被包含)导致了更强烈的AXR3NT-GUS染色(l.c.s.,未发表),这可能是D图中GUS活性高于A图的原因。
AXR3NT-GUS活性降低ibr5用于诱导报告基因表达的2小时热休克后立即明显(数据未显示)。由于热响应启动子驱动AXR3NT-GUS结构,我们测试了缺乏AXR3NT-GUS活性是否在ibr5可以解释为突变体对热的转录反应降低了。我们引入了一个包含稳定的axr3-1突变的结构(海关:axr3-1NT-GUS;[16))ibr5-1跨越。axr3-1中脯氨酸到亮氨酸的取代[47]通过减少axr3-1NT-GUS与SCF的相互作用而赋予报告器稳定性TIR1[16].我们在野生型和野生型中发现了类似的axr3-1NT-GUS活性ibr5使用或不使用生长素处理(图6摄氏度),表明转基因基因在热刺激下得到了有效的转录,且在热刺激下,AXR3NT-GUS活性降低ibr5不是由热休克后转录降低引起的。此外,用蛋白酶体抑制剂MG132处理恢复了AXR3NT-GUS的活性ibr5而且tir1 ibr5降至接近野生型水平(图6 d),再次表明ibr5AXR3NT-GUS活性的缺陷不是由于转基因转录的降低。
ibr5不积累IAA28报告蛋白
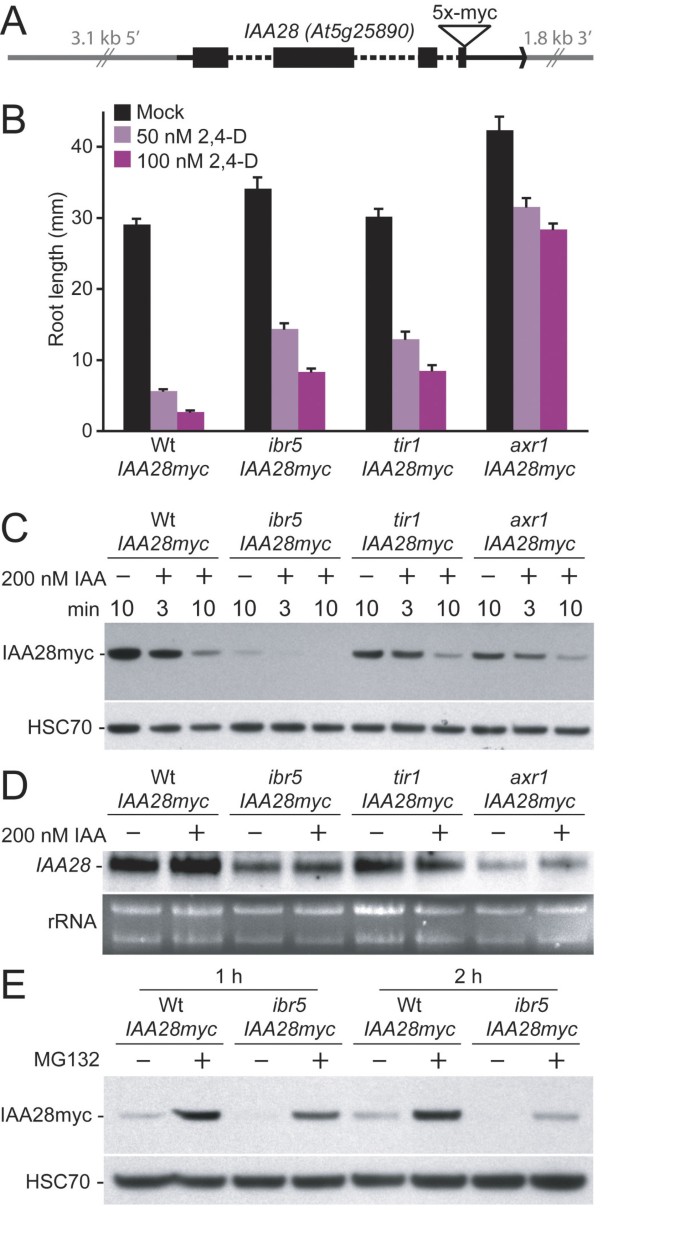
IAA28最初被确认是因为iaa28-1功能获得性突变赋予生长素抗性并阻碍侧根产生[48].与典型的Aux/IAA蛋白一样,IAA28也有一个转录抑制域[15],并可使生长素增强荧光素酶报告基因的不稳定性[49].检验AXR3NT-GUS是否缺乏稳定性ibr5对其他Aux/IAA蛋白也有稳定性影响,我们在ibr5-1,tir1-1,axr1-3到携带c-Myc表位标记版本的IAA28的野生型系IAA28调节序列(图7一个)和分离的携带报告基因的纯合突变体。这些细胞系对2,4- d的反应与预期一致(图7 b).因为IAA28主要表达在根[48],我们检测了IAA28myc在模拟或生长素处理10日龄幼苗后野生型和突变型根中的积累。正如预期的那样,我们发现野生型在生长素处理后IAA28myc迅速消失(图7 c).我们发现IAA28myc水平较低ibr5比野生型在未添加生长素的情况下;这种蛋白在生长素处理后迅速消失,在处理10分钟后没有检测到(图7 c).虽然我们预期IAA28myc稳定在tir1而且axr1,我们发现IAA28myc水平与野生型水平相似,在生长素处理后下降(图7 c),这与观察到的这两种突变体对生长素都不完全不敏感相一致(例如,图7 b).我们检查了IAA28这些细胞系的mRNA水平降低IAA28转录水平axr1在较小的程度上,在tir1(图7 d).转录水平与IAA28蛋白水平并不完全相关,这表明这些突变体的蛋白质稳定性存在差异。MG132处理增加了野生型和小鼠IAA28myc蛋白水平ibr5(图7 e),提示野生型IAA28myc通过26S蛋白酶体降解,与野生型IAA28myc通过26S蛋白酶体降解的可能性相一致ibr5.然而,MG132无法将IAA28myc完全恢复到野生型水平ibr5(图7 e)表明减少了IAA28mRNA水平ibr5(图7 d)有助于减少IAA28myc在该突变体中的积累(图7 c).明显缺乏AXR3NT-GUS和IAA28myc的稳定性ibr5是否与生长素调控的转录减少的可能性一致ibr5通过一种不涉及Aux/IAA蛋白稳定的机制。
ibr5不累积IAA28myc.(A)对IAA28myc构造。的区域IAA28转录本以黑色显示,内含子用虚线指定,编码序列用黑盒子显示。(B)生长素反应缺陷的指示突变体携带IAA28myc构造。在22°C的黄滤光下,在补充了指定浓度2,4- d的培养基上生长的8天大幼苗的初生根的长度。误差柱表示均值的标准误差(n= 17)。(C) IAA28myc在野生型和生长素反应突变体中的积累。抗myc(上面板;Santa Cruz Biotechnology)和抗hsc70抗体(底部面板;用应激原生物反应器)对10天龄轻生长的Col-0 (Wt)的根制备的蛋白质进行免疫印迹,ibr5-1,tir1-1,axr1-3表达IAA28myc的种子经模拟(乙醇)处理10分钟或用200 nM IAA处理3或10分钟。(D)IAA28野生型和生长素反应突变体的mRNA积累。从模拟(乙醇)处理或用200 nM IAA处理10分钟的幼苗中提取总RNA,通过电泳(底部面板,溴化乙粒染色凝胶)分离,转移到膜上,并用探针检测IAA28探针(顶部面板)。IAA28而且IAA28myc转录本之间不能相互解析,因此被视为单个频带。(E) IAA28myc积累对MG132处理的响应。抗myc(上面板)和抗hsc70(下面板)抗体用于3日龄轻生长Col-0 (Wt)和蛋白质的免疫印迹ibr5-1以模拟DMSO处理和300 μM MG132处理1 ~ 2h表达IAA28myc的幼苗为对照。
一种IBR5取代变体(IBR5C129S)并不能完全拯救ibr5缺陷
双特异性蛋白磷酸酶(DSP)蛋白同时去磷酸化蛋白的苏氨酸和酪氨酸残基,从而使其失活(在[50])。DSP蛋白含有一个保守的天冬氨酸残基和一个单独的高度保守的VxVHCx特征基序2GxSRSx5半胱氨酸和精氨酸残基与保守的天冬氨酸参与催化。这个特征的半胱氨酸通过亲核攻击磷酸酪氨酸或磷酸苏氨酸底物的磷原子开始去磷酸化过程。因此,破坏这种保守的半胱氨酸会导致许多DSP蛋白的催化活性丧失(在[51]),包括IBR5亲缘蛋白DsPTP1 [52].
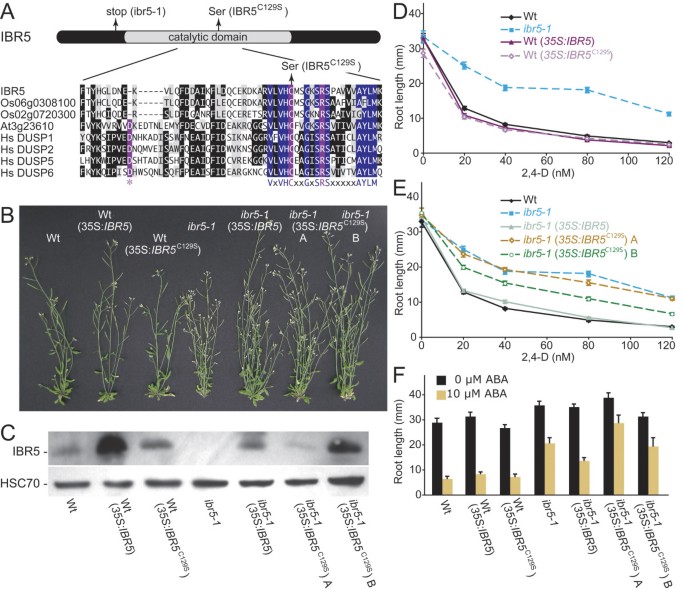
DSP主动式站点motif VxVHCx2GxSRSx5AYLM存在于IBR5中(图8),使我们能够识别IBR5中推测的活性位点半胱氨酸(C129)。测试IBR5磷酸酶活性是否为正常生长素反应所必需在活的有机体内,我们生成了转基因Wt和ibr5-1表达IBR5的Cys129→Ser129 (C129S)取代变体(IBR5C129S)在强35S病毒启动子的控制下。我们预料到了35 s: IBR5C129年代不会拯救ibr5-1如果需要IBR5磷酸酶活性来促进生长素的反应性。我们检测ibr5-1(35 s: IBR5C129年代)表示低(线A)和高(线B) IBR5C129S突变表型挽救水平(图10C)。野生型和ibr5-1过表达未修饰IBR5的线(35 s: IBR5;[37)进行比较。
一个IBR5C129S替换变体不能完全拯救ibr5缺陷.(A)显示IBR5 -1过早终止密码子相对于保守催化结构域的位置的示意图,以及拟南芥IBR5的部分磷酸酶催化结构域和几个假定和确认的DSP蛋白的排列。显示的序列是来自水稻的最接近的IBR5同源物(Os06g0308100和Os02g0720300),来自拟南芥的IBR5亲缘物,具有显示的DSP活性(At3g23610/DsPTP1;[52])和三种人(Hs) DSP酶。使用CLUSTAL W方法将序列与MegAlign程序(DNAStar, Madison, WI)进行比对。紫色为催化残基,蓝色为保守的DSP特征残基,黑色为至少四个序列中相同的残基,灰色为相似残基,虚线表示为了最大限度地对准而引入的间隙。(B) 6周龄Col-0 (Wt), Wt (35 s: IBR5), Wt (35 s: IBR5C129年代),ibr5-1,ibr5-1(35 s: IBR5),ibr5-1(35 s: IBR5C129年代)直线A,和ibr5-1(35 s: IBR5C129年代)在连续光照下生长的线B。(C)使用抗ibr5抗体[37]进行免疫印迹分析;上图)和抗HSC70抗体(Stressgen Bioreagents),该抗体是由图b所示系的2日龄幼苗制备的蛋白质。(D) Wt (35 s: IBR5)和Wt (35 s: IBR5C129年代)表现出与Wt相似的2,4- d响应。在22°C的黄滤光下,在添加不同浓度2,4- d的培养基上生长的8日龄幼苗的初根长度如下图所示。误差柱表示均值的标准误差(n≥18)。(E)ibr5-1(35 s: IBR5C129年代)直线A,和ibr5-1(35 s: IBR5C129年代线路B未能完全抢救ibr5-12,4 - d的阻力。幼苗的测量方法如(D)所示。误差条表示均值的标准误差(n≥17)。(F)将4天大的幼苗转移到0(乙醇对照)或10 μM ABA培养基中4 d后初生根的长度。误差柱表示均值的标准误差(n≥8)。
我们发现IBR5或IBR5C129S过表达没有明显改变野生型成虫形态(图8 b).此外,IBR5或IBR5C129S在野生型中过表达不改变任何激素反应表型(图8 d, F).不出所料,我们发现了ibr5-1(35 s: IBR5)植株恢复到野生型高度(图8 b),且根系对生长素和ABA的反应正常(图8 e, F).ibr5-1(35 s: IBR5C129年代A(低表达系)株高恢复,叶偏上性与低表达系相似ibr5-1,而ibr5-1(35 s: IBR5C129年代)行B(高表达)显示抢救ibr5-1株高(图8 b)和叶片偏上性的部分挽救(数据未显示)。对2,4- d和ABA对根伸长的抑制作用的抗性没有得到拯救ibr5-1(35 s: IBR5C129年代) A行,仅部分恢复ibr5-1(35 s: IBR5C129年代) B行(图8 e, F).缺乏饱满ibr5-1IBR5的救援C129年代与IBR5磷酸酶活性是完全生长素和ABA反应性所必需的可能性相一致。部分ibr5-1观察救援情况IBR5C129年代积累到高水平表明某些IBR5功能不需要磷酸酶活性。例如,IBR5C129S可结合并隔离其底物,从而抑制正常底物活性。
讨论
功能丧失突变IBR5,编码一种假定的双特异性蛋白磷酸酶(DSP),导致生长素和脱落酸反应降低[37].DSP蛋白通常调控丝裂原活化蛋白激酶(MAPK)蛋白。拟南芥有20个预测的MAPK蛋白[53],但只有5个预测了DSP蛋白,这表明一些DSP酶可能调节不止一个MAPK。在拟南芥中,5个预测的拟南芥DSP蛋白中的2个已被证明可以调节MAPK活性。DsPTP1 (At3g23610)去磷酸化MPK4 [52),而米美联社KPHOSPHATASE2 (MKP2;At3g06110)脱磷酸化MPK3和MPK6 [54].
虽然IBR5调控的MAPK还没有报道,但MAPK信号在生长素和ABA反应中都有涉及,这两种途径在IBR5中都有缺陷ibr5.例如,组成型活性MAPK激酶激酶蛋白ANP1或烟草同源物NPK1在原生质体中的瞬时表达导致AtMPK3和AtMPK6的生长素响应性转录和激活降低[55,56], MKP2磷酸酶的靶点[54].此外,生长素处理激活了拟南芥中的~44-kD MAPK [57].IBR5的失败C129S完全恢复ibr5-1突变表型表明IBR5磷酸酶活性是完全生长素和ABA响应性所必需的,并且了解与激素响应性有关的MAP激酶是否为IBR5底物将是很有趣的。部分救援ibr5IBR5时观察到的缺陷C129S过表达可能与IBR5有关C129S蛋白与IBR5底物结合,从而隔离IBR5底物,正如催化活性低的MAPK磷酸酶Pyp1的过表达所建议的那样C470S,这导致表型类似于MAPK Spc1底物的功能丧失等位基因粟酒裂殖酵母[58,59].
为了阐明IBR5影响生长素反应的途径,我们研究了两者之间的遗传相互作用ibr5还有生长素反应突变体tir1,axr1,aux1.TIR1 F-box蛋白作为生长素受体与Aux/IAA蛋白共同作用[19,20.,22].tir1似乎增强了ibr5检查生长素相关的生理表型,包括对应用天然和合成生长素的反应缺陷(图1 c, D)和生长素转运抑制剂(数据未显示)。此外,tir1 ibr5突变体显示较长的主根(图1 c, D),且在无补充培养基上比任何单一突变体的侧根都少(图2),表明该双突变体对内源性生长素的抗性也增强了。
除了影响生长素反应外,IBR5还调节某些ABA反应[37].我们发现不仅如此tir1增强ibr5ABA抗性,还有tir1其本身在根伸长试验中表现出大量的ABA抗性(图2摄氏度).虽然tir1以前没有报道其对ABA抗性,其特征是对葡萄糖抗性[60],是许多aba抗性突变体共同的表型(在[61,62])。因为tir1 ibr5显示对生长素和ABA的抗性增强,因为ibr5-1等位基因可能是null [37],这些结果与TIR1和IBR5相互独立促进生长素和ABA反应的可能性一致。
AXR1是参与CULLIN蛋白RUB修饰的RUB激活酶的一个亚基。CULLIN是拟南芥600多个已知SCF复合物的主干[63],包括SCFTIR1[64];因此,axr1突变体具有多效表型,包括生长素抗性。唯一被检查的表型似乎是附加的axr1 ibr5在未补充的中膜上有较长的主根,血管发育异常(图3.).不像ibr5,tir1-1增强根系抗伸长能力axr1-12到2,4- d [38].的多效性axr1缺陷和极端的生长素抗性axr1单个突变体使我们的结果的解释复杂化。不管怎样,有趣的是axr1而且ibr5突变体对生长素对根伸长的抑制作用不太敏感,但似乎对AXR3NT-GUS的稳定性有相反的影响(图6;[16])。
的双突变体ibr5与aux1,在生长素流入载体中缺陷的突变体[32,34,35].的嫩枝aux1 ibr5突变体与ibr5的词根aux1 ibr5最接近于aux1.因为aux1缺乏芽表型和大多数aux1根表型比ibr5根缺陷,这些结果与预期的结果从加性缺陷,虽然极端抵抗aux12,4- d和ABA使我们无法确定aux1 ibr5对这些激素的反应有附加缺陷。
ibr5在未添加的培养基上生长时DR5:GUS活性降低[37],在本研究中,我们发现生长素诱导的DR5:GUS活性在特定组织中存在缺陷(图5).微阵列分析7日龄小鼠mRNA积累情况ibr5野生型幼苗在分析中没有显示出任何戏剧性的(> 2.5倍)转录本变化[37].这些结果表明,任何基因的表达变化ibr5可能是微妙的或局部的,如在DR5:GUS分析中,因此在整个幼苗RNA中不明显。
由于生长素反应转录本受Aux/IAA蛋白稳定性的调控,我们试图分析Aux/IAA的降解ibr5.生长素通过介导这些抑制因子与SCF的相互作用促进Aux/IAA蛋白的降解TIR1[19- - - - - -21,65].一些抗生长素突变体表现出稳定的Aux/IAA蛋白或Aux/IAA报告基因,包括生长素受体TIR1缺陷突变体[16]以及相关的AFB1、AFB2和AFB3 F-box蛋白[21];其他SCF组件,如CUL1 [41];以及修饰SCF活性的蛋白质,如AXR1 [16], ecr1 [28], ETA3/SGT1b [43],以及ETA2/CAND1 [42].这种稳定可能解释了在许多这些突变体中报告的生长素响应转录本水平的降低[21,25,42,45,46,66].就像之前描述的生长素反应突变体一样,ibr5显示生长素反应的积累减少DR5:格斯记者。然而,与这些其他突变体不同的是,AXR3NT-GUS的活性并没有增加ibr5.IAA28myc蛋白含量较低ibr5如果Aux/IAA蛋白通常稳定,这是不可能的,这也表明IBR5在不稳定Aux/IAA蛋白的情况下调节生长素反应性转录。当然,有29个拟南芥辅警/IAA家族成员[7],而且仍有可能ibr5特异性地稳定某些Aux/IAA家族成员,以减少转录激活,而不影响AXR3/IAA17或IAA28的稳定性。
不管Aux/IAA蛋白是否被稳定在ibr5,ibr5是唯一被检测的生长素反应突变体[16,21,28,41- - - - - -44],不表现出AXR3NT-GUS稳定性。这种表型分岔可能有助于剖析额外的生长素反应突变体的作用。最近的实验表明,MYB77转录因子促进生长素反应,并可与ARF蛋白二聚[67].研究Aux/IAA蛋白是否稳定于myb77一旦Aux/IAA阻遏物被降解,IBR5是否调节这个或其他促进生长素反应性转录所需的因子。其中一种可能的情况是IBR5通常会去磷酸化并失活一个MAPK,该MAPK负调控生长素反应所需的转录因子,提供了一种在不调节Aux/IAA稳定性的情况下调节生长素反应的机制。
结论
IBR5类似于双特异性磷酸酶,在这项工作中,我们提供了证据,证明IBR5磷酸酶活性是完全生长素和ABA反应性所必需的。双突变体之间的分析ibr5-1和其他几个生长素反应突变体显示IBR5似乎独立于TIR1生长素受体影响生长素反应。由于Aux/IAA蛋白降解可以缓解生长素反应基因的转录抑制,我们检测了两种Aux/IAA报告基因的稳定性ibr5发现这些蛋白质并不稳定ibr5这表明IBR5作用于SCF识别生长素的下游TIR1 /空军基地辅助/ IAA复合物。未来对IBR5底物的测定可能会更详细地了解这种明显的双特异性磷酸酶是如何在不破坏Aux/IAA蛋白的情况下促进生长素反应的。
方法
植物材料和生长条件
拟南芥哥伦比亚(Col-0)是所有实验使用的野生型。的ibr5-1该突变体在IBR5 42氨基酸上含有无义突变,导致缺少催化结构域的截断产物[37].的aux1-7突变体含有错义突变,导致甘氨酸459被天冬氨酸取代[32].的tir1-1突变体包含错义突变,导致甘氨酸147被天冬氨酸取代[38].的axr1-3突变体包含错义突变,导致半胱氨酸154被酪氨酸取代[26].
Surface-sterilized [68]种子镀于PNS(含0.5% [w/v]蔗糖的植物营养培养基)[69用0.6% (w/v)琼脂固化。使用的激素分别来自0.1-、1.0-或100-mM的乙醇储备,以补充乙醇的培养基作为对照,所有处理均归一化至相同的乙醇含量(小于0.1 μL乙醇/mL培养基)。幼苗在22°C连续光照下生长。除非另有说明,培养皿置于黄色长通过滤器下孵育,以减缓吲哚化合物的分解[70].在土壤中种植植物(Metromix 200;scott, Marysville, OH)在22至25°C下,在冷白色荧光灯的持续照明下(Sylvania, Danvers, MA)。
IBR5C129S构造
伊斯兰公正福利党IBR5C结构[37]采用寡核苷酸定向诱变技术进行突变[71使用引物5'-CTTTCCCAGACAT将129位的推定催化半胱氨酸改变为丝氨酸CGAATGCACAAGAAC-3'(标记有改变的残基)Taq1α酶切位点。然后用不I和亚克隆到植物转化载体35SpBARN [72]菜花花叶病毒35S启动子和号终结者。35 s:IBR5C129S质粒电穿孔[71到根癌土壤杆菌GV3101,用于转化野生型Col-0和ibr5-1.白光照射10 d后,在添加10 μg/mL BASTA的PNS培养基上鉴定转化产物。通过检测BASTA抗性模式,在后代中鉴定了纯合子系。
IAA28myc构造
的IAA28: IAA28myc构造(73]包含IAA28基因组区,包括3.1 kb的DNA 5'IAA28编码序列,亚克隆到pBIN19植物转化载体中。的最后外显子IAA28在该结构中已被修改为编码c-Myc表位的5个拷贝IAA28终止密码子。的IAA28: IAA28myc质粒电穿孔[71到根癌土壤杆菌GV3101,用于转化野生型Col-0。转化苗在白光下生长后,在添加12 μg/ml卡那霉素的PN培养基上进行鉴定。纯合子单插入系通过检测后代卡那霉素抗性模式来鉴定。ibr5-1,tir1-1,axr1-3与野生型(Col-0)单插入线交叉,生成ibr5,tir1,axr1带着IAA28: IAA28myc构造。
表型分析
所有试验至少进行了三次,结果相似。为了进行生长素反应性根系伸长试验,幼苗在具有指示生长素浓度的PNS上生长8或9天,然后从琼脂中取出,测量主根的长度。为了进行ABA响应伸长试验,幼苗在PNS上生长4天以使其有效发芽,然后转移到添加乙醇或ABA的PNS上。在额外的4天生长后,测量初级根的长度。
侧根实验中,幼苗在PNS上生长4天,然后转移到添加乙醇或10 μM IBA的PNS上,再生长4天,之后在解剖显微镜下观察侧根。从主根生出的原基计为侧根。
下胚轴伸长试验中,种子镀于添加乙醇或20 μM IBA的培养基上。光照1天后,用铝箔包裹板,在黑暗中再孵育4天,之后将幼苗从琼脂中取出,并测量下胚轴的长度。
为了检测子叶维管模式,幼苗在PNS上生长8天。用乙醇系列去除叶绿素,在室温下水合氯醛溶液(80 g水合氯醛,20 mL甘油,10 mL水)中培养一周,清除幼苗。清理干净的幼苗被安装并通过解剖显微镜拍照。
双突变体分离
的ibr5-1突变体被杂交到aux1-7[39),axr1-3[30.),而tir1-1[38],所有都在Col-0加入。通过对F2植株的PCR分析,鉴定出两个突变体。放大的AUX1AUX1-3 (5'-CATGGGTCAACAAAGCTTTGGATTTTGTCC-3')和AUX1-4 (5'-TTCGTGACTTTTACTCCCTTCACGTATACG-3')生成464 bp的产物Dpn限制地点分为野生型和三种aux1-7.放大的AXR1利用衍生的裂解扩增多态性序列引物[74,75] AXR1 -Acc1 (5 ' -AAACCAACTTAACGTTTGCATGTCG-3 ';AXR1-15 (5'- tctcatatgtacttttcctcgtcctcttccac -3')生成一个185 bp的产物Acc野生型限制位点1个,无野生型限制位点axr1-3.放大的TIR1TIR1-3 (5'- ttgaagagataaggctgaagaggaggg -3')和TIR1-4 (5'- tacaccaccgttaaataagacccaccagagaaag -3')生成488 bp的产物DpnII限制场地在野生型和二限制场地tir1-1.基于pcr的鉴定ibr5-1如前所述[37].
北部的分析
Surface-sterilized [68种子被镀在滤纸衬里的PNS上,在持续光照下生长。6天后,从琼脂表面揭下育苗滤纸。幼苗在添加mock(乙醇)或200 nM IAA的PN液体中漂浮10分钟。收集幼苗,用研钵和杵在液氮中研磨。根据制造商的说明,使用TriReagent (Sigma)提取RNA。总RNA (10 μg)在含0.37 M甲醛的1%琼脂糖凝胶上电泳[71]并在20× SSC中使用毛细管作用转移到带正电荷的尼龙66膜上(Roche Applied Science, Indianapolis, IN)。DIG标记探针在DIG Easy Hyb缓冲液(Roche)中杂交,在50°C下过夜,并根据制造商的说明以中等强度洗涤。探针检测使用碱性磷酸酶偶联抗dig抗体(Roche)在Blocking Buffer中稀释1:2万(Roche),然后使用稀释1:200的CDP-Star (Roche)进行显像。
DIG-labeledIAA28探针是根据cDNA模板的制造商说明,使用PCR DIG探针合成试剂盒(Roche)通过PCR扩增合成的[48]使用T1N24-20 (5'-CCATCGAACTGATGATTTTGGCC-3')和T1N24-21 (5'-CCTCCTTGTCACCAATTCACTTCC-3'),得到525 bp的产物。
免疫印迹分析
为了观察IBR5,在白光下用0.1%琼脂培养的2天大的完整幼苗中提取蛋白质,方法是用研棒研磨冷冻组织,并添加一体积NuPAGE 2X LDS缓冲液(Invitrogen, Carlsbad, CA)。将碎片离心4分钟制成颗粒。上清液加热至100°C 5分钟。蛋白质提取物通过sds -聚丙烯酰胺凝胶电泳在Cruz标记物旁分离(Santa Cruz Biotechnology, Santa Cruz, CA),使用NuPAGE 10% Bis-Tris凝胶和MES运行缓冲液(Invitrogen)。
使用NuPAGE转移缓冲液(Invitrogen)在24 V下将蛋白质转移到Hybond ECL硝化纤维膜(Amersham Pharmacia Biotech, Piscataway, NJ) 35分钟。在8%的奶粉中堵塞1小时后,Tween tris缓冲盐水(TTBS;[71]),用亲和纯化的IBR5抗体在4℃孵育过夜[37稀释成1:20的缓冲液。然后用TTBS冲洗三次,用酶标山羊抗兔二抗(Santa Cruz Biotechnology) 1:2000稀释1小时,再次冲洗,然后使用LumiGLO试剂(Cell Signaling, Beverly, MA)进行显像。膜随后与菠菜抗体孵育(菠菜oleraceaHSC70 (Stressgen Bioreagents SPA-817)稀释1:5000,然后用酶标山羊抗小鼠二抗(Santa Cruz Biotechnology)稀释1:2000,并使用LumiGLO试剂(Cell Signaling)进行显像。
为了观察IAA28myc,将10天大的幼苗从PNS培养基中取出,漂浮在添加乙醇(mock)或200 nM IAA的PN液体中。在指定的时间点,切除根系并提取蛋白质。MG132处理中,将3天大的幼苗从PNS培养基中取出,悬浮在含有DMSO (mock)或300 μM MG132的水中。1 ~ 2小时后,从整株幼苗中提取蛋白质。在这两个实验中,蛋白质通过sds -聚丙烯酰胺凝胶电泳分离,并转移到如上所述的膜上。在8%的TTBS奶粉中阻塞1小时后,用稀释为1:500的单克隆9E10抗C- myc抗体(Santa Cruz Biotechnology SC-40)和稀释为1:25万的抗hsc70抗体(Stressgen Bioreagents SPA-817)在阻塞缓冲液中孵育4℃过夜。然后用TTBS冲洗三次,并用1:2000稀释的hrp偶联山羊抗小鼠二抗(Santa Cruz Biotechnology)孵育4小时,按上述方法再次冲洗,然后使用LumiGLO试剂(Cell Signaling)进行显像。
海关:AXR3NT-GUS分析
野生型(Col-0)线携带海关:AXR3NT-GUS而且海关:axr3-1NT-GUS而且axr1-3携带海关:AXR3NT-GUS已在前面描述[16].为了获得携带这些记者的额外线路,ibr5-1转到野生型携带了吗海关:AXR3NT-GUS和野生型携带海关:axr3-1NT-GUS.tir1 ibr5转到野生型携带了吗海关:AXR3NT-GUS获得tir1-1 HS: AXR3NT-GUS而且tir1 ibr5 HS:AXR3NT-GUS.通过对F2植株的PCR分析鉴定突变体,如上所述。存在海关:AXR3NT-GUS或海关:axr3-1NT-GUS对卡那霉素进行耐药检测,GUS染色证实。
为了进行组织化学分析,将8天大的轻生长的幼苗从PNS板中取出,漂浮在12孔板中含有6倍稀释水(用于激素反应测定)或无菌水(用于MG132测定)的0.5 mL液体PN培养基中。每孔中加入2毫升预热的(37°C) 1 / 6液体PN或预热的水,在37°C下孵育2小时。在激素反应测定中,将幼苗转移到室温下20分钟,然后进行10分钟和20分钟模拟(乙醇)或100 nM IAA处理,或40分钟模拟(乙醇)或10 μM IBA处理。MG132实验中,幼苗在黑暗中孵育,热处理1小时后,每个孔中加入DMSO (mock)或MG132(至50 μM)。热处理后,将板材转移至室温2小时。如前所述,对幼苗进行GUS活性染色[76].
参考文献
Davies PJ:介绍。植物激素。编辑:Davies PJ第二版。杜德雷赫特,Kluwer学术出版社,1995:1-38。
Woodward AW, Bartel B:生长素:调控,作用和相互作用。学报学报,2005,95(5):707-735。10.1093 / aob / mci083。
杨建平,杨建平,杨建平,等:大豆下胚轴生长素响应型poly(A)+ rna克隆cdna的分离。美国国家科学研究院。1982, 29(4): 457 - 457。10.1073 / pnas.79.23.7185。
黄海燕,黄海燕,黄海燕。大豆下胚轴和下胚轴的生长素调控基因表达。植物学报,2004,26(4):457 - 457。10.1007 / BF00410211。
黄志刚,黄志刚,黄志刚,李志刚,李志刚。美国国家科学研究院。1994, 29(3): 326- 326。10.1073 / pnas.91.1.326。
刘颖,刘志刚,刘志刚,刘志刚,刘志刚,刘志刚:拟南芥sar - ac1基因的分子遗传学研究。植物营养学报,2004,27(2):357 - 357。10.1104 / pp.104.2.777。
A:早期基因与生长素作用。植物科学学报,1996,16(3):344 - 344。10.1104 / pp.111.1.9。
麦克卢尔,王志强,王志强,王志强,王志强。大豆生长素调控基因簇的转录、组织和序列研究。植物科学学报,1998,12(3):344 - 344。10.1105 / tpc.1.2.229。
黄丽丽,王丽丽,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。豌豆(Pisum sativum)吲哚乙酸诱导基因ps - ia4 /5中生长素响应元件AuxRE的鉴定。中华分子生物学杂志,1993,233(4):580-596。10.1006 / jmbi.1993.1537。
陈志强,李志强,李志强:植物激素应答转录因子ARF家族的研究进展。细胞生物学与生物工程学报,1998,29(4):344 - 344。10.1007 / s000180050190。
黄志刚,张志刚,张志刚:生长素反应因子对转录的激活和抑制作用。美国国家科学研究院。1999, 26(3): 344 - 344。10.1073 / pnas.96.10.5844。
黄志刚,李志刚,李志刚:植物生长素应答因子域在植物生长素应答转录中的作用。植物学报,2003,15(2):533-543。10.1105 / tpc.008417。
Ulmasov T, Murfett J, Hagen G, Guilfoyle TJ: Aux/IAA蛋白抑制含有天然和高活性合成生长素反应元件的报告基因的表达。《植物科学》,1997,9:63- 66。10.1105 / tpc.9.11.1963。
黄志刚,张志刚,张志刚,等:生长素反应因子的二聚化和DNA结合。植物学报,1999,29(4):349 - 349。10.1046 / j.1365 - 313 x.1999.00538.x。
Tiwari SB, Hagen G, Guilfoyle TJ: Aux/IAA蛋白含有有效的转录抑制结构域。植物学报,2004,16(2):533-543。10.1105 / tpc.017384。
Gray WM, Kepinski S, Rouse D, Leyser O, Estelle M:生长素调控Aux/IAA蛋白scftir1依赖性降解自然科学,2001,414:271-276。10.1038 / 35104500。
陈志刚,李志刚,李志刚,李志刚,李志刚J:生长素对Aux/IAA蛋白降解的调控作用。美国国家科学研究院。2001, 29(3): 379 - 379。10.1073 / pnas.211312798。
Reed JW: Aux/IAA蛋白在拟南芥中的作用和活性。植物科学进展,2001,6:420-425。10.1016 / s1360 - 1385(01) 02042 - 8。
Dharmasiri N, Dharmasiri S, Estelle M: F-box蛋白TIR1是一种生长素受体。自然科学学报,2005,35(4):344 - 344。10.1038 / nature03543。
Kepinski S, Leyser O:拟南芥F-box蛋白TIR1是生长素受体。自然科学学报,2005,35(4):344 - 344。10.1038 / nature03542。
Dharmasiri N, Dharmasiri S, Weijers D, Lechner E, Yamada M, Hobbie L, Ehrismann JS, Jürgens G, Estelle M:植物发育受生长素受体F盒蛋白家族调控。生物工程学报,2005,9(1):109-119。10.1016 / j.devcel.2005.05.014。
谭欣,李德龙,夏伦,郑c,鲁斌CV, Estelle M,郑娜:TIR1泛素连接酶对生长素的感知机制。自然科学学报,2007,38(6):644 - 644。10.1038 / nature05731。
Tiwari SB, Wang XJ, Hagen G, Guilfoyle TJ: Aux/IAA蛋白是一种活性抑制因子,其稳定性和活性受生长素调控。植物科学学报,2001,13:2809-2822。10.1105 / tpc.13.12.2809。
del Pozo JC, Estelle M:拟南芥cullin AtCUL1被泛素相关蛋白RUB1修饰。美国国家科学研究院。1999, 96(26): 15342-15347。10.1073 / pnas.96.26.15342。
del Pozo JC, Dharmasiri S, Hellmann H, Walker L, Gray WM, Estelle M: RUB1依赖于axr1 - ecr1偶联拟南芥Cullin AtCUL1是生长素反应的必要条件。植物细胞学报,2002,14(2):421-433。10.1105 / tpc.010282。
Leyser HMO, Lincoln CA, Timpte C, Lammer D, Turner J, Estelle M:拟南芥生长素抗性基因AXR1编码泛素激活酶E1相关蛋白。自然科学学报,1993,29(3):344 - 344。10.1038 / 364161 a0。
王晓燕,王晓燕,王晓燕,王晓燕,王晓燕。拟南芥泛素相关蛋白RUB1的表达及其对植物生长素的影响。科学通报,1998,28(3):357 - 357。10.1126 / science.280.5370.1760。
Woodward AW, Ratzel SE, Woodward EE, Shamoo Y, Bartel B: e1偶联酶相关1的突变降低与泛素偶联相关,并改变生长素的反应和发育。植物科学进展,2007,32(2):379 - 379。10.1104 / pp.107.100404。
Lincoln C, Britton JH, Estelle M:拟南芥axr1突变体的生长发育。中国生物医学工程学报,2000,27(2):366 - 366。10.1105 / tpc.2.11.1071。
Estelle MA, Somerville C:形态改变的拟南芥抗生长素突变体。中国生物医学工程学报,1997,26(3):344 - 344。10.1007 / BF00333575。
杨晓明,王晓明,王晓明,等。植物生长素转运介导植物生长发育的分子生物学研究进展。植物科学进展,2007,12(4):160-168。10.1016 / j.tplants.2007.03.006。
Bennett MJ, Marchant A, Green HG, May ST, Ward SP, Millner PA, Walker AR, Schultz B, Feldmann KA:拟南芥AUX1基因:一种根系向地性的量测调控基因。科学通报,1996,27(3):344 - 344。10.1126 / science.273.5277.948。
Yamamoto M, Yamamoto KT: 1-萘乙酸、吲哚-3-乙酸和2,4-二氯苯氧乙酸对拟南芥抗生长素突变体aux1根系向地性反应的差异影响。植物生理学报,1998,39:666 -664。
Marchant A, Kargul J, May ST, Muller P, Delbarre A, Perrot-Rechenmann C, Bennett MJ: AUX1通过促进根根尖组织吸收生长素调控拟南芥根向地性。中国农业科学,1999,30(4):457 - 457。10.1093 / emboj / 18.8.2066。
杨艳,刘志刚,刘志刚,刘志刚,杨艳,刘志刚,陈志刚,陈志刚:植物生长素的高亲和性转运。动物学报,2006,16(11):1123-1127。10.1016 / j.cub.2006.04.029。
Zolman BK, Yoder A, Bartel B:拟南芥吲哚-3-丁酸反应的遗传分析揭示了4类突变体。中国生物工程学报,2000,29(3):344 - 344。
门罗-奥古斯都M, Zolman BK, Bartel B: IBR5是调节拟南芥生长素和脱落酸反应的双特异性磷酸酶样蛋白。植物科学学报,2003,29(3):344 - 344。10.1105 / tpc.017046。
Ruegger M, Dewey E, Gray WM, Hobbie L, Turner J, Estelle M:拟南芥TIR1蛋白在生长素应答中的作用及其与人SKP2和酵母Grr1p的关系。基因工程学报,1998,12:198-207。10.1101 / gad.12.2.198。
Maher EP, Martindale SJB:拟南芥对生长素和重力反应改变的突变体。生物化学学报,1980,18:1041-1053。10.1007 / BF00484337。
刘志刚,刘志刚,刘志刚,刘志刚。拟南芥中吲哚-3-丁酸和吲哚-3-乙酸两种天然生长素在拟南芥中的转运。植物营养学报,2003,26(2):344 - 344。10.1104 / pp.103.022582。
张伟,陈志伟,陈志伟,陈志伟:SCF泛素连接酶CUL1/AXR6亚基温度敏感等位基因的研究。植物学报,2005,43(3):371-383。10.1111 / j.1365 - 313 x.2005.02449.x。
Chuang HW, Zhang W, Gray WM:拟南芥ETA2在SCFTIR1泛素连接酶介导的生长素反应中是必需的,它是人类culin相互作用蛋白CAND1的同源物。植物细胞学报,2004,16(7):1883-1897。10.1105 / tpc.021923。
Gray WM, Muskett PR, Chuang HW, Parker JE:拟南芥SGT1b在scftir1介导的生长素应答中是必需的。植物细胞学报,2003,15(6):1310-1319。10.1105 / tpc.010884。
Rahman A, Nakasone A, Chhun T, Ooura C, Biswas KK, Uchimiya H, Tsurumi S, Baskin TI, Tanaka A, Oono Y:一种小酸性蛋白1 (SMAP1)介导拟南芥根对合成生长素2,4-二氯苯氧乙酸的反应。植物学报,2006,47(5):788-801。10.1111 / j.1365 - 313 x.2006.02832.x。
Abel S, Nguyen MD, Theologis A:拟南芥早期生长素诱导mrna的ps - iaa4 /5样家族。中华分子生物学杂志,1995,26(4):533-549。10.1006 / jmbi.1995.0454。
Timpte C, Lincoln C, Pickett FB, Turner J, Estelle M:拟南芥AXR1和AUX1基因在不同的生长素反应通路中发挥作用。植物学报,2004,28(4):366 - 366。10.1046 / j.1365 - 313 x.1995.8040561.x。
Rouse D, Mackay P, Stirnberg P, Estelle M, Leyser O: AUX/IAA基因突变对生长素反应的影响。科学通报,1998,29(3):349 - 349。10.1126 / science.279.5355.1371。
王志强,王志强,王志强,等。IAA28基因的功能获得性突变抑制了侧根发育。植物学报,2001,13:465- 468。10.1105 / tpc.13.3.465。
Dreher KA, Brown J, Saw RE, Callis J:拟南芥Aux/IAA蛋白家族在降解和生长素反应上存在多样性。植物细胞学报,2006,18(3):699-714。10.1105 / tpc.105.039172。
Farooq A, Zhou MM: MAPK磷酸酶的结构和调控。手机信号,2004,16(7):769-779。10.1016 / j.cellsig.2003.12.008。
Neel BG, Tonks NK:蛋白酪氨酸磷酸酶在信号转导中的作用。中国生物医学工程学报,1997,9(2):193-204。10.1016 / s0955 - 0674(97) 80063 - 4。
黄艳,黄艳,栾珊:拟南芥MAP激酶双特异性蛋白磷酸酶的鉴定。植物学报,1998,16(5):581-589。10.1046 / j.1365 - 313 x.1998.00327.x。
Ichimura K, Shinozaki K, Tena G, Sheen J, Henry Y, Champion A, Kreis M, Zhang S, Hirt H, Wilson C, Heberle-Bors E, Ellis B, Morris PC, Innes RW, Ecker JR, Scheel D, Klessig D, Machida Y, Mundy J, Ohashi Y, Walker JC:植物中丝裂原激活蛋白激酶级联:一个新命名法。植物科学进展,2002,7:301-308。10.1016 / s1360 - 1385(02) 02302 - 6。
Lee JS, Ellis BE:拟南芥MAPK磷酸酶2 (MKP2)正向调节氧化应激耐受性,并使MPK3和MPK6 MAPKs失活。中国生物医学工程学报,2007,28(4):529 - 529。10.1074 / jbc.M701888200。
赵丽玲,曾文文,张晓明,张志刚:MAPK级联对植物生长素信号转导的抑制作用。自然科学学报,1998,29(3):344 - 344。10.1038/27240。
张志刚,张志刚,张志刚,张志刚:植物氧化胁迫诱导的丝裂原活化蛋白激酶级联的功能分析。美国国家科学研究院。2000, 37(4): 457 - 457。10.1073 / pnas.97.6.2940。
Mockaitis K, Howell SH:生长素诱导拟南芥幼苗根系有丝分裂活化蛋白激酶(MAPK)的活化。植物学报,2000,24:785-796。10.1046 / j.1365 - 313 x.2000.00921.x。
王志刚,王志刚,王志刚:细胞外环境对分裂酵母细胞周期的影响。自然科学,1995,26(1):1 -7。10.1038 / 378739 a0。
刘志刚,李志刚,李志刚,等。pyp1和pyp2突变体对核裂变酵母有丝分裂的影响。中国科学:自然科学,2004,29(2):344 - 344。10.1073 / pnas.91.21.10084。
Moore B, Zhou L, Rolland F, Hall Q,程文华,刘玉霞,Hwang I, Jones T, Sheen J:拟南芥葡萄糖传感器HXK1在营养、光和激素信号通路中的作用。科学通报,2003,29(3):332- 332。10.1126 / science.1080585。
Fedoroff NV:脱落酸信号中的串扰。科学的抽烟可以。2002, 2002 (140): RE10-10.1126/stke.2002.140.re10。
Gazzarrini S, McCourt P:植物激素信号的相声:拟南芥突变体告诉我们什么。植物学报,2003,29(3):344 - 344。10.1093 / aob / mcg064。
Gagne JM, Downes BP, Shiu SH, Durski AM, Vierstra RD:拟南芥SCF E3复合体的F-box亚基由一个不同的超家族基因编码。美国国家科学研究院。2002, 99(17): 11519-11524。10.1073 / pnas.162339999。
Gray WM, del Pozo JC, Walker L, Hobbie L, Risseeuw E, Banks T, Crosby WL, Yang M, Ma H, Estelle M:拟南芥生长素反应的SCF泛素连接酶复合体的鉴定。中国生物医学工程学报,1999,29(3):344 - 344。10.1101 / gad.13.13.1678。
Kepinski S, Leyser O:生长素诱导的SCFTIR1- aux /IAA相互作用涉及到SCFTIR1复合物的稳定修饰。美国国家科学研究院。2004, 32(3): 389 - 397。10.1073 / pnas.0402868101。
张伟,赵艳,戴晓霞,张伟,陈晓明,张晓明:拟南芥CULLIN 1突变体对激素和光照反应的影响。中国植物学报,2007,26(2):344 - 344。10.1104 / pp.106.091439。
沈璐,李志刚,李志刚,李志刚,李志刚,李志刚。拟南芥转录因子MYB77在植物生长素信号转导中的调控作用。植物细胞学报,2007,19(8):2440-2453。10.1105 / tpc.107.050963。
最后一个RL, Fink GR:植物拟南芥色氨酸需求突变体。科学通报,1988,30(3):344 - 344。10.1126 / science.240.4850.305。
C:拟南芥抗磺酰脲突变体。中国生物医学工程学报,2006,30(4):344 - 344。10.1007 / BF00331020。
Stasinopoulos TC, Hangarter RP:通过长通滤光片防止培养基中的光化学反应改变培养组织的生长。中国农业科学,2000,29(3):349 - 349。
Ausubel F, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K:分子生物学的当前协议。1999,纽约,Greene出版协会和willey - interscience
LeClere S, Bartel B:拟南芥35S-cDNA文库的研究。植物化学学报,2001,46:695-703。10.1023 /: 1011699722052。
拟南芥中抑制侧根发育和介导生长素反应的基因IAA28的克隆和鉴定。生物化学与细胞生物学,2001,休斯顿,莱斯大学,211-
Neff MM, Neff JD, Chory J, Pepper AE: dCAPS,单核苷酸多态性遗传分析的简单技术:在拟南芥遗传学中的实验应用。植物学报,1998,14(3):387-392。10.1046 / j.1365 - 313 x.1998.00124.x。
Michaels SD, Amasino RM:一种通过PCR检测单核苷酸变化作为多态标记的稳健方法。植物学报,1998,14(3):381-385。10.1046 / j.1365 - 313 x.1998.00123.x。
Bartel B, Fink GR:拟南芥生长素产生硝化酶基因家族的差异调控。美国国家科学研究院。1994, 91: 6649-6653。10.1073 / pnas.91.14.6649。
确认
我们感谢Luise Rogg的野生类型转换与IAA28: IAA28myc构造,Ottoline Leyser和Stefan Kepinski的野生型和axr1-3行着海关:AXR3NT-GUS而且海关:axr3-1NT-GUSNatasha Raikhel为c-Myc表位标记质粒,Mark Estelle为axr1-3而且aux1-7, ABRC为tir1-1和cDNA克隆,玛丽·艾伦·莱恩用于显微镜,克里斯汀·罗杰斯和艾琳·贝斯纳提供技术援助,马修·林加德,纳希利·马丁内斯和安德鲁·伍德沃德对手稿提出批评意见。本研究得到了美国国家科学基金会(IBN-0315596)、Robert A. Welch基金会(C-1309)和美国国立卫生研究院(F32-GM075689 to LCS)的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
LCS分离鉴定双突变体,分析转录本,进行GUS实验,IAA28 western分析,鉴定表型35 s: IBR5C129年代行。MMA了35 s: IBR5C129年代构造,转化为植物,并进行IBR5西方分析。BB构思并协调了这项研究。所有作者都参与了稿件的起草和编辑,并阅读并批准了最终稿。
电子辅助材料
12870 _2007_249_moesm1_esm.pdf
附加文件1:规范化ibr5双突变体生长素反应缺陷。生长素的反应ibr5双突变体归一化后表示为模拟处理幼苗的根长。(pdf 902kb)
12870 _2007_249_moesm2_esm.pdf
附加文件2:IBA诱导侧根、IBA抑制下胚轴伸长和ABA抑制根伸长的正常生长素响应突变体缺陷。植物的IBA和ABA响应ibr5将双突变体归一化后表示为模拟处理的幼苗。(pdf 610kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Strader, L.C,门罗-奥古斯都,M. &巴特尔,B. IBR5磷酸酶通过一种不同于tir1介导的抑制因子降解的新机制促进拟南芥生长素反应。BMC植物生物学8,41(2008)。https://doi.org/10.1186/1471-2229-8-41
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-41
关键字
- 生长素响应
- Unsupplemented介质
- 生长素反应因子蛋白
- 生长素流入载体
- 双特异性蛋白磷酸酶