摘要
背景
StWhy1是植物特异性Whirly单链dna结合蛋白家族的一员,首次被鉴定为参与细胞核激活的转录因子PR-10a马铃薯防御相关胁迫的基因跟踪。在拟南芥最近研究表明旋流主要局限于细胞器中。该家族的两个代表AtWhy1和AtWhy3被导入质体,而AtWhy2定位于线粒体。它们在细胞器中的功能目前尚不清楚。
结果
为了了解线粒体旋风在高等植物中的作用,我们制作了答:芥线与改变的表达atwhy2基因。细胞器DNA免疫沉淀实验表明,AtWhy2与线粒体DNA结合。过度的atwhy2通过导致转录水平和mtDNA含量的降低,从而导致包含mtDNA编码亚基的呼吸链复合体的低活性水平,从而扰乱线粒体功能。线粒体活性的降低导致植物体积缩小,叶片扭曲,表现出加速衰老。过度的atwhy2也导致成熟叶片中衰老标记转录本的早期积累。失活atwhy2基因不影响植物发育,对线粒体形态、呼吸链复合体活性、转录或mtDNA存在量没有可检测到的影响。这种缺乏表型的废除atwhy2表达表明存在Whirlies的功能同源物或线粒体中补偿机制的激活。
结论
AtWhy2与mtDNA相关,其过表达导致功能障碍线粒体的产生。这一报告首次证明了旋风在细胞器中的作用。我们认为它们可能在调控细胞器的基因表达机制中发挥作用。
背景
植物细胞由三种细胞器(细胞核、质体和线粒体)组成,它们拥有并保持遗传信息。这些细胞器中基因表达的协调对植物的发育和生存至关重要[1,2].由于内共生事件导致质体和线粒体整合到真核细胞中,大部分在蓝藻和α-变形菌祖先中发现的遗传信息已经转移到细胞核中。然而,在细胞器中仍然发现了原始基因组的残余。在拟南芥中,线粒体基因组包含大约87个基因的编码序列,主要编码翻译装置和电子传递链的组成部分[3.].由于拟南芥线粒体基因组中不存在参与一般DNA代谢的蛋白质,因此该细胞器中的基因表达受核控制。其结果是,广泛的顺行(细胞核到细胞器)和逆行(细胞器到细胞核)信号对于核和细胞器基因的共同调节是必需的,这些基因编码蛋白质在细胞器中协同工作,以及线粒体的一般稳态。
旋体形成了一个单链DNA (ssDNA)结合蛋白的小家族,主要存在于植物王国。StWhy1, Whirly的原型茄属植物tuberosum,被认为是致病相关基因的转录激活因子PR-10a马铃薯块茎被诱导或损伤后[4- - - - - -6].在应激后,它被证明与位于基因启动子中的包含反转重复区域的单链形式具有高亲和力PR-10a两者都称为激发子反应元件(ERE)在体外而且在活的有机体内[6].StWhy1的晶体结构分析表明在活的有机体内旋舞采用四聚体形式。每个原聚体由两个相互垂直排列的反平行β片组成,形成叶片状延伸,从α-螺旋核心突出,形成稳定的四聚体。这些“叶片”形成的表面被认为是形成Whirly ssdna结合域[7].按照StWhy1的作用美国tuberosum,拟南芥同源物AtWhy1被证明是对专性生物营养体的完全基础和特异性抗病性反应所必需的霜霉属parasitica[6].
通过对多种开花植物Whirly蛋白的一级序列分析,我们预测它们可能定位于细胞器[5].最近,这被证实为拟南芥旋转的代表。其中两个Whirlies, AtWhy1 [TAIR:At1g14410]和AtWhy3 [TAIR:At2g02740]是在质体中导入的,而AtWhy2 [TAIR:At1g71260]是针对线粒体的([8]和我们未发表的数据)。值得注意的是,当有足够的序列信息时,所有开花植物都包含至少两个Whirly代表,一个预计是质体定位的,另一个预计是线粒体中的。在最近的事态发展中,由于AtWhy1被证明与端粒长度稳态有关,另一种核功能也被提出[9].尽管在同一个细胞中,Whirlies对细胞核和细胞器的双定位仍有待证明,但在某些情况下,如特定的压力或发育线索,Whirlies可能在细胞间室之间穿梭,因此是前/逆行信号传导的良好介质候选者。为了更好地理解Whirlies的核功能和它们对细胞器的主要定位之间的关系,我们决定阐明Whirlies在线粒体中的功能。
结果
AtWhy2过表达干扰线粒体功能
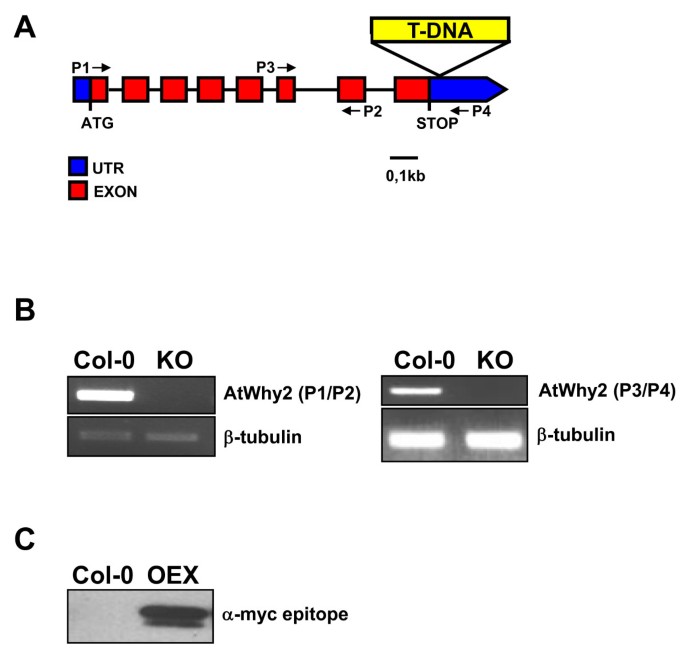
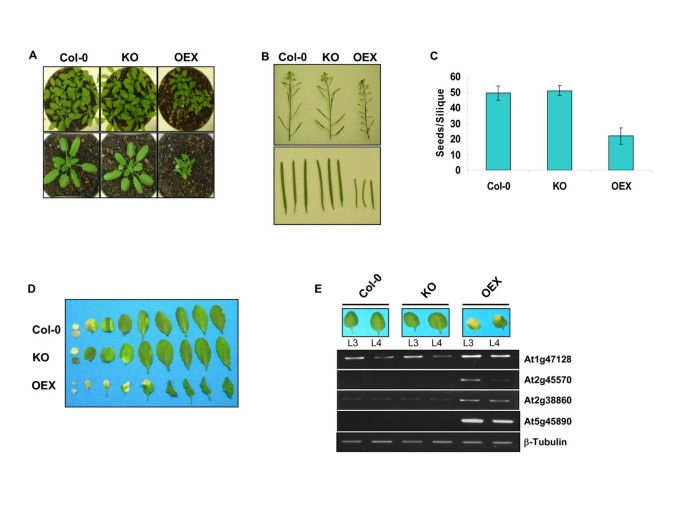
为了研究线粒体Whirlies的作用,我们制作了改变线粒体Whirlies表达的植物atwhy2(At1g71260)基因。纯合子植物携带T-DNA插入在3'非翻译区,完全缺乏atwhy2得到的表达式(图1而且1 b).此外,在CaMV 35S启动子的控制下,植物组成性过表达myc标记的AtWhy2版本(图1 c).而敲除植株(KO)则没有明显的表型(图2),植物过度表达atwhy2(OEX)更小,产生更短的角果,其种子数量约为野生型植物的一半(图2 b而且2摄氏度).有趣的是,与野生型(Col-0)或KO植物相比,OEX植物也发育出墨绿色扭曲的叶片,其成熟叶片表现出早期衰老的迹象(图)2而且二维).为了记录这种加速的细胞死亡,我们使用RT-PCR在每个基因型的5周龄植物的第三和第四片叶子中监测了许多先前描述的衰老相关基因(sag)的表达水平2 e).这些基因都被描述为叶片衰老的分子标记,因为在这种基因编程现象中,它们的丰度显著增加[10,11].与Col-0和KO植物相比,所有测试sag的mrna在OEX中明显更丰富,从而证实了叶片早期变黄是过度表达植物叶片更快进入衰老状态的标志atwhy2.为了确定观察到的表型不是由于线粒体靶向myc标签过表达的非特异性效应,我们生产了组成性表达AtWhy2未标记版本的转基因植物,并观察到相同的表型(数据未显示)。
基因表达改变的植物表型特征atwhy2.一个.对在土壤中生长的4周龄的指示基因型植株进行拍照。B.从所示基因型的6周龄植株上拍摄了具有代表性的花序和单个角果。C.对来自上述基因型的20个成熟角果进行解剖,并计算其平均种子含量。D.从6周树龄的植物上取相应的叶子并拍照。叶子按照年龄从左到右排列。E.OEX植物成熟叶片中衰老标记转录本的早期积累。RT-PCR检测3株植物的Col-0、KO和OEX RNA样品理查德·道金斯(L3)和4th(L4) 5周龄植物的叶片,使用寡核苷酸设计来特异性扩增以下基因:At1g47128:半胱氨酸蛋白酶RD21A, At2g45570: YLS6,细胞死亡相关细胞色素,At2g38860: YLS5,蛋白酶I和At5g45890: SAG12,半胱氨酸蛋白酶。采用半定量条件和引物进行β微管蛋白扩增,以确保所有样品都有足够的加载量。
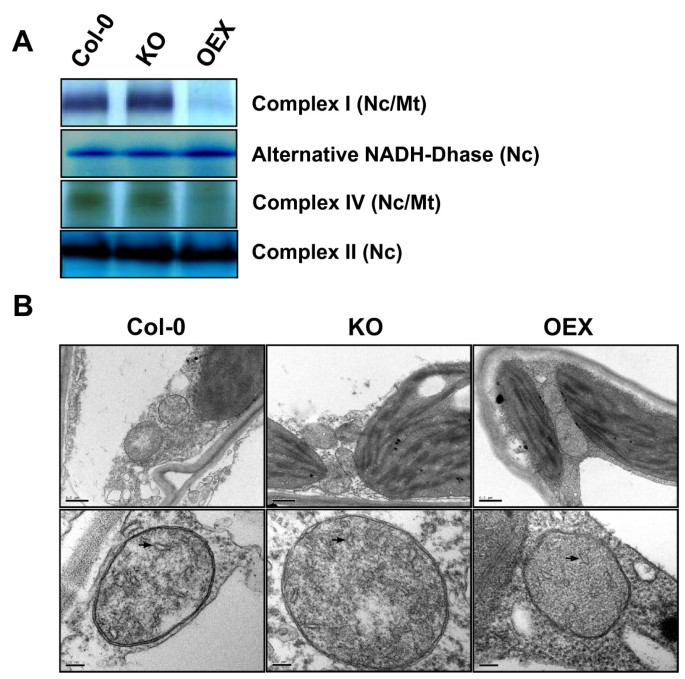
最近的报道强调了线粒体在包括酵母、开花植物和哺乳动物在内的许多生物的衰老调节中的作用[12- - - - - -15].因为已经证明AtWhy2被导入线粒体在活的有机体内,这些观察促使我们验证植物中的线粒体是否发生了改变atwhy2表达仍然有效。为了监测线粒体呼吸链复合物的活性,我们使用蓝原聚丙烯酰胺凝胶电泳(BN-PAGE)耦合凝胶内组织化学染色酶活性[16].使用该方法,我们能够评估NADH脱氢酶、琥珀酸脱氢酶(复合体II)和细胞色素C氧化酶(复合体IV)的个体活性。所有观察到的复合体的活性在Col-0和KO植物之间没有发现差异(图2)3).相比之下,OEX植物表现出强烈的复合物I和IV缺陷,而它们的替代NADH脱氢酶和复合物II仍然与野生型和KO中发现的一样有效。有趣的是,在OEX植物中,只有包含线粒体基因组编码的亚基的复合物受到影响。完全由核基因组中编码的多肽组成的复合物是完整的。这些观察结果促使我们使用电子显微镜来监测不同品系中细胞器的数量和超微结构。所有植物含有大约相同数量的线粒体,大小相似(图3 b上半部分)。在高倍镜下,OEX植物的线粒体结构比Col-0和KO植物的线粒体结构更简单。总的来说,OEX植株的嵴含量略低3 b下面板(黑色箭头))。对于每种基因型,内膜内陷计数在10个大小相似的线粒体切片上。所有观察切片的嵴密度平均值(单位:嵴/μm2), Col-0、KO和OEX分别为24.2±7.9、23.3±10.3和17.1±7.1。总之,这些结果表明线粒体功能损害过度表达atwhy2.
过量AtWhy2植物线粒体基因表达和mtDNA水平普遍下调
Whirlies的ssdna结合能力可能是细胞器中基因表达的重要调节因子。由于StWhy1已被证明是转录激活子PR-10a因此,AtWhy2可能参与了线粒体转录的调控[4,6].这种最终的功能是通过监测线粒体基因表达的植物atwhy2用RNA凝胶印迹检测。
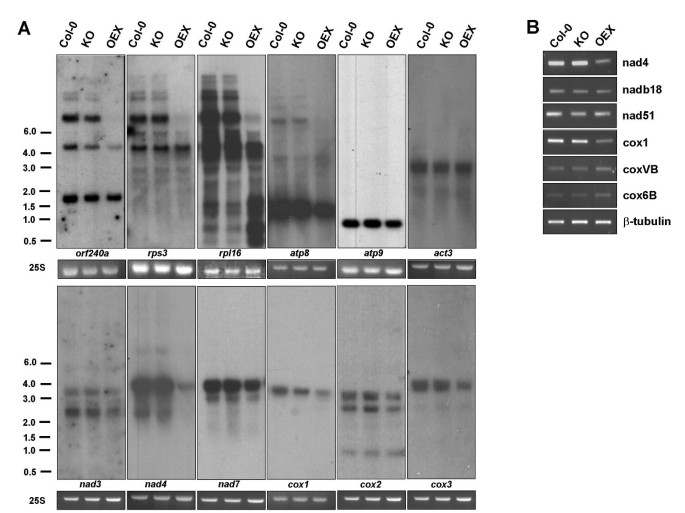
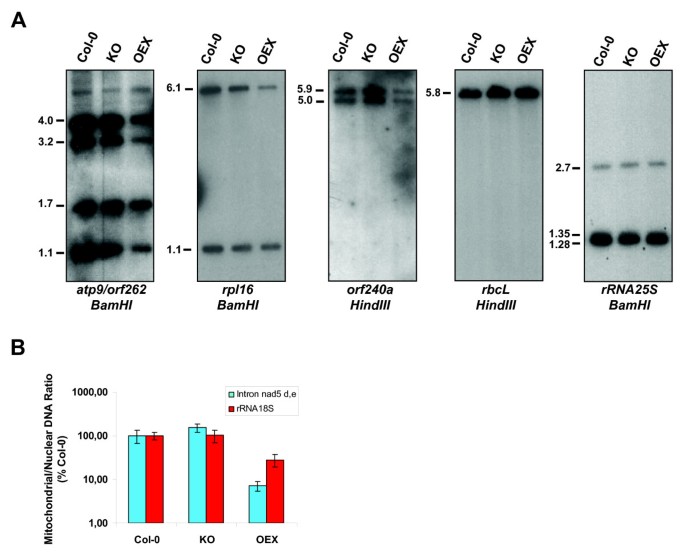
由于呼吸链复合体I和IV在OEX植物中功能受损,我们评估了这些复合体中每个线粒体基因组编码的三个亚基的表达水平。如图所示4的稳态RNA水平nad3,nad4,nad7和cox1,cox2而且cox3OEX植株均显著低于Col-0和KO植株。所有探针检测到的稳态RNA水平在Col-0和KO植物之间没有变化。这与在各自的超络合物中观察到的类似活性是一致的(图3).线粒体基因也得到了类似的结果Atp8, atp9,或者f240a, rps3而且rpl16.经过仔细检查,我们观察到最小的RNA形式(可能代表成熟的翻译RNA)通常比较大的形式(可能代表初级转录本)受影响较小。令人惊讶的是rpl16与KO和野生型植物相比,OEX中最小的RNA产物更丰富。我们认为,这些不同大小的rna丰度之间的差异可能是由于转录后稳定补偿了大型初级转录本的减少。
AtWhy2从未在细胞核中被检测到,一直被描述为线粒体蛋白([8]和我们未发表的数据)。然而,在OEX植物中观察到的线粒体复合物的缺陷至少有一部分可能是由于核基因组编码呼吸链亚基的表达缺陷或RNA代谢的一般缺陷。为了验证这一点,我们首先通过溴化乙锭染色检测了核25S rRNA水平。数字4表明25S rRNA的数量在三种植物中没有变化。然后我们测量了act3mRNA,编码肌动蛋白,并表明这些水平在所有植物中保持不变(图4).我们还利用半定量RT-PCR评估了编码NADH脱氢酶(Complex I)和细胞色素C氧化酶(Complex IV)亚基的两种不同核基因的表达。在Col-0、KO和OEX植株中,无差异表达nadb18[TAIR: At2g02050],nad51[TAIR: At5g08530],coxVb[TAIR: At1g80230]cox6b[TAIR:At1g22450]基因4 b).设计用于扩增β-微管蛋白cDNA的寡核苷酸被用作负载对照。成绩单水平nad4而且cox1编码在线粒体基因组中的cDNA在OEX植物中被减少(图4 b), RNA凝胶印迹(图4).总之,这里提供的数据强调线粒体RNA积累特别受AtWhy2过表达的影响。这些观察结果表明,AtWhy2可能影响线粒体中RNA的成熟。或者,它可能会影响转录或导致线粒体DNA (mtDNA)数量的减少,从而导致所有编码基因的转录积累下降。
为了评估后一种可能性,我们监测了植物中mtDNA的水平。针对atp9,rpl16而且orf240a利用线粒体基因组编码序列,采用Southern blot技术对Col-0、KO和OEX植物中mtDNA的含量进行了测定。这些探针检测到的所有线粒体DNA区域都在过表达AtWhy2的植物中大量减少(图5).野生型和KO个体之间mtDNA数量没有差异。的rpl16探针在总DNA消化后检测到6.1 kb的条带BamHI.这个波段的强度,它对应于的编码区域rpl16在线粒体基因组中,在OEX植物中显著降低。该探针还检测到在染色体2上以1.1 kb带的形式发现的核序列,在过表达的植物中不受影响atwhy2,说明OEX植株的核DNA数量与KO和Col-0植株相似。为了确认mtDNA受到AtWhy2过表达的特异性影响,我们还使用了针对质体基因的探针:编码25S rRNA的核基因。我们发现这两个序列在Col-0、KO和OEX植物中均等量存在。因此,观察到的线粒体基因表达水平的降低与mtDNA水平的降低相关。定量PCR (qPCR)证实了OEX植株mtDNA数量的减少。引物被设计用于扩增线粒体和核基因组的独特区域,并比较了两个基因组的DNA比率。与通过Southern blotting定量的区域一样,通过比较Col-0和KO DNA样本,mt/核DNA比值之间的差异不能被突出显示(图5 b).然而,与DNA凝胶印迹结果一致,两个OEX线粒体区域的mt/核DNA比值显著降低(外显子d和e之间的内含子的野生型比值为7.1%nad5而野生型比例为28.2%的一部分核糖体rna 18岁基因)。
研究表明,高等植物线粒体重组调节系统的改变可导致正常亚化学计量DNA分子(升华子)的积累[17- - - - - -19].由于Whirlies与ssDNA结合,因此不能排除其在DNA重组中的作用。线粒体基因组中特别活跃的重组位点答:芥位于atp9基因。这个区域包含大量的小重复序列,能够重组产生新的DNA分子。为了研究AtWhy2作为mtDNA重组调节因子的潜在作用,我们用BamHI限制性内切酶消化了这3个系的全部DNA,并用环绕整个探针观察检测到的各种带atp9吉恩和5'部分orf262.在所有基因型中都存在1.1、1.7、3.2和4.0 kb的预期条带,但在OEX中数量有所减少(见[17]以识别个别波段)(图5).AtOSB1是细胞器单链DNA结合蛋白家族的线粒体定位成员,RecA3和MSH1是MutS家族的同源物(以前是CHM1),已涉及线粒体重组活性的调节[17- - - - - -20.].当这些基因被敲除时,它们会产生类似于过度表达AtWhy2(扭曲的叶片)所观察到的表型。这些基因的缺失也会导致异常重组产物的积累,当使用探针指向dna时,这些异常重组产物在Southern blotting中可见atp9地区。与这些突变体相反,AtWhy2 KO和OEX植株中没有出现新的条带。此外,还有另外两个探针指向rpl16而且orf240a,我们没有观察到假定的异常重组产物的积累,这表明AtWhy2不参与线粒体重组的调控。然而,虽然我们无法检测到周围的变化atp9,rpl16而且orf240a区域,我们只检测了8.2%的拟南芥线粒体基因组(约350 kb中的28.2 kb)。因此,我们不能排除OEX植物mtDNA中其他重复序列发生重组的可能性。有趣的是,分离杂合子OEX植物产生的1/4的野生型植物表现为原始的Col-0生态型(数据未显示)。这表明AtWhy2蛋白的过量产生不会永久性地影响线粒体基因组,而该蛋白的增加对于产生和维持所观察到的线粒体缺陷是必要的。
AtWhy2基因与线粒体DNA有关
在藜线粒体DNA,即长而丰富的单链DNA,存在并分布在整个基因组中[21].在培养的烟草细胞的线粒体中也有ssDNA的存在[22].因此,在这些物种中,其中一些区域可能与线粒体靶向的Whirlies结合,以控制植物中尚待定义的过程。为了确定拟南芥中AtWhy2是否结合以及哪些DNA区域被AtWhy2结合,我们对AtWhy2进行免疫沉淀,并通过PCR扩增检测与AtWhy2结合的DNA(图6).寡核苷酸根据其生物学意义被设计用来扩增四种类型的DNA区域:在启动子区域附近[23],在基因内,在没有任何编码序列的孤立区域内,在线粒体基因组的两个大重复区域内(图6).
在这些实验中,我们预测使用多克隆抗atwhy2抗体特异性下拉的区域对于Col-0植物应该扩增到一定水平,并且应该在OEX中扩增到相同或更高的水平。在KO植物中,PCR产物应该没有或低于OEX和Col-0植物(mtDNA在植物细胞中特别丰富,可能会发生一些非特异性免疫沉淀)。数字5 b(输入)表明,对于所有扩增区域,OEX中mtDNA的数量都低于Col-0和KO植物,这证实了我们之前对该突变系mtDNA数量减少的观察。免疫沉淀后,在Col-0和OEX植物中,所有测试的DNA区域都被下拉,但在KO植物中没有,或者在更小的程度上,这表明AtWhy2在线粒体基因组中与这些不同的区域相互作用(图5 b、IP)。有趣的是,尽管OEX植物的mtDNA输入量低于Col-0或KO,但与Col-0植物的裂解液相比,我们通常能够从这些提取物中免疫沉淀出等量或更高的DNA,这表明在过表达植物中,总mtDNA的比例要高得多,它们与AtWhy2结合。因此,这些结果表明AtWhy2结合到mtDNA上并不区分编码序列和非编码序列。
讨论
为了缩小线粒体旋风在高等植物中的潜在作用,我们制作了答:芥线与改变的表达atwhy2基因。过度的atwhy2通过导致转录水平和mtDNA含量的降低而损害线粒体功能。这导致包含在软骨体编码的亚基的电子传递链复合物的活性降低。由于每叶面积线粒体数量没有明显减少,OEX中mtDNA数量的减少表明这些细胞器的基因组拷贝数低于Col-0和KO植物。我们的研究结果表明,OEX植物线粒体活性的改变可能是这些植物体积更小和观察到的更快的叶片衰老表型的原因,这与衰老标记基因的早期诱导有关。最近有报道称,在酵母中,线粒体基因表达的下降与实际寿命的缩短有关。此外,电子传递链各组成部分的不平衡似乎对酵母寿命更有害(在[12])。在OEX植物中,这两种情况都存在,因为我们观察到mtdna编码基因表达的普遍下调与氧化磷酸化机制的不平衡耦合。事实上,琥珀酸脱氢酶复合体的活性在拟南芥中完全编码在细胞核中,在OEX植物中不受影响,而mt编码复合体的活性则受到极大的干扰(图3).因此,我们的研究结果表明,酵母和植物中类似的线粒体功能障碍能够影响细胞的有效寿命。
线粒体Whirly表达改变的植物使我们能够确定AtWhy2与mtDNA组成性相关,最有可能是通过Whirly结构域与线粒体类核中发现的丰富ssDNA的直接相互作用。结合位点似乎沿着线粒体基因组的长度出现,因为我们无法检测到Whirlies不与mtDNA结合的区域。有趣的是,拟南芥和芥菜纯化部分中已分离出含有转录活性染色体的plastidial Whirlies,这表明它们也与叶绿体中的核样DNA相互作用[24].因为在OEX植物中,较高比例的mtDNA被AtWhy2结合(图5 b),有可能过量的线粒体Whirlies可以通过使核样DNA无法被转录和/或复制机制的组成部分结合来修改线粒体中的基因表达,从而降低稳态RNA水平和产生的mtDNA的数量。
自Whirly家族成员被发现以来,我们和其他团队已经使用ssDNA亲和层析法独立纯化了它们[4,25,26].当我们的实验室使用包含反转重复的单链激发子响应元件作为诱饵时[4], Vermel和同事使用亲和色谱显示随机牛ssDNA序列[25]而另一组使用了拟南芥端粒末端的六聚体重复[26].事实上,Whirlies能够与所有这些不同的dna具有高亲和力,这至少表明其序列特异性较弱在体外.我们的mtDNA免疫沉淀结果表明,这种低序列特异性也适用于线粒体Whirlies在活的有机体内.由于超声处理后DNA片段的大小被确定为大约在350到1000 bp之间(数据未显示),对于所获得的结果,另一种解释可能是AtWhy2与mtDNA的结合是特定于各种免疫沉淀区域共同的某些序列。
线粒体漩涡的假定功能
我们的结果表明,AtWhy2参与了线粒体基因表达的调控。漩涡在高等植物的线粒体和质体中被发现。在质体中,转录受两种类型的RNA聚合酶的控制,一种独特的真细菌型质体编码聚合酶(PEP)和多种噬菌体型核编码聚合酶(NEPs)(在[27]和[28])。这些rna聚合酶特异性地调节不同基因亚群的转录,但也可以共同调节部分质体基因[29].在高等植物的线粒体中,转录仅受NEPs调控。这些事实,加上StWhy1作为转录激活剂的作用,表明Whirlies也可以作为细胞器中的转录调节因子。例如,它们可能构成噬菌体型RNA聚合酶的加工辅助因子。可以认为,由于AtWhy2的结合也在线粒体基因组的非编码区域被观察到,转录可能不是这个Whirly的唯一功能。然而,在全基因组蛋白质- dna相互作用研究中,许多经典的核转录因子与非编码区域和非共识位点结合已被报道(综述于[30.]),因此在mtdna编码的AtWhy2基因转录中的作用仍然是可能的。
在哺乳动物中,转录对线粒体DNA的复制很重要,为起始提供了必要的引物(在[31])。然而,在高等植物中,这些过程之间的相互关系仍有待证明。在OEX植物中观察到的mtDNA含量的减少暗示了AtWhy2在线粒体基因组复制/维护中的作用。来自原生生物的TIF1蛋白是Whirlies的遥远同源物四膜虫thermophyla在DNA复制和遗传信息的忠实代际传递中都有涉及,并且是由DNA损伤触发的s期内检查点激活所必需的[32- - - - - -34].因此,线粒体漩涡可能在软骨体的复制、维持和转录中发挥多种作用。
由于AtWhy2的过表达对各种形式的线粒体RNA有不同的影响,因此Whirlies可能与mtRNA的成熟有关。例如,它们可以稳定特定形式的RNA或促进从多顺子未成熟RNA到最终可翻译RNA形式的加工。最近,一种晶体结构异四聚体的MRP1和MRP2的线粒体rna结合蛋白从锥虫属brucei解决了。虽然这两种蛋白质与Whirlies没有主要序列相似性,但它们采用了Whirly-like折叠。这些蛋白质参与RNA编辑,并与指导RNA (gRNAs)结合,以指定在线粒体pre-mRNA序列中添加或删除尿嘧啶残基的位置[35].我们通过克隆和测序测试了Whirlies是否可以在编辑中发挥作用nad7而且ccb206互补脱氧核糖核酸。这些RNA通常在28 (nad7)及39个地点(ccb206)在拟南芥中[36].这2个基因的编辑频率在WT、KO和OEX植物间无显著差异(数据未显示)。因此,在开花植物中,对mtRNA的正确编辑过程似乎不需要Whirlies。这并不意外,因为开花植物的编辑机制与开花植物的编辑机制非常不同锥虫属brucei(见[37,38])。此外,在绿藻中还发现了涡藻家族的代表衣藻reinhardtii而且Ostreococcus taurii其中细胞器RNA的编辑过程似乎缺失[39].AtWhy2在编辑过程中没有作用并不排除Whirlies参与RNA成熟的其他步骤。
最后,虽然过度表达atwhy2KO系中该基因失活不影响植物发育,对线粒体形态及其呼吸链复合物的活性没有可检测到的影响。此外,稳定状态下的mtRNA水平或mtDNA的数量没有变化。因此,AtWhy2对于的生存能力不是必要的拟南芥以及正常生长条件下线粒体的正确功能。这可以用存在于细胞器中的其他蛋白质的功能冗余来解释。当植物受到特定的胁迫时,线粒体Whirlies的作用也可能被强调,类似于StWhy1的转录激活剂作用,它与生物胁迫后其ssdna结合活性的诱导相关。在我们能够确切地确定这些有趣的蛋白质在细胞器中的作用之前,还需要对质体和线粒体涡状蛋白进行进一步的实验。
结论
我们已经证明AtWhy2与mtDNA组成结合,首次证明Whirlies可以与细胞器中的DNA结合。AtWhy2和mtDNA之间的相互作用似乎发生在整个线粒体基因组中,这表明Whirlies可能调节多种对细胞器核酸代谢重要的过程。异位过度产生AtWhy2明显影响了线粒体的基因表达机制,减少了mtDNA的数量和它编码的基因的表达水平。这些缺陷导致植物更小,叶片衰老加速。AtWhy2调控基因表达的机制细节尚不清楚。
方法
T-DNA插入线表征
SALK研究所基因组分析实验室提供了序列索引T-DNA插入线SALK_118907 [40].这些植物含有一个相对于STOP密码子的核苷酸+29插入。用引物P3, 5'-GTAGCGGCTACTTCATCT CA-3'、p4,5 '-TTCGTGTGCACCAAATGCCA-3'和lbb1,5 '-GCGTGGACCGC TTGCTGCAACT-3'进行PCR鉴定。用TRIZOL从纯合突变体中分离RNA®试剂(Invitrogen)根据制造商的说明。使用引物P1, 5'-ATGAA GCAAGCCCGCTCTTT-3'和P2, 5'- cagcttttgtgacaggaac -3'以及P3和P4进行RT-PCR,证实AtWhy2基因无表达。
过表达AtWhy2和AtWhy2-myc的植物生产
通过PCR -blunt- ii - topo -myc载体(美国北卡罗来纳大学Jeff L. Dangl博士的厚礼),使用以下引物扩增了6个c-myc表位副本:5'-CCCAAGCTTAGCTATG-3'和5'-CCGCTCGAGTC ATCGATTTCGAACCCGGGGTAC-3”。扩增子经HindIII和XhoI酶切后克隆至pBS-SK(+)载体。全长atwhy2使用以下引物从cDNA中扩增出5'- ATAAGAATGCGGCCGCATGATGAAGCAAGCCCGCTCTTTG-3'和5'-GACTAGTTTTATCCCAC TCCAGCTCTAACTG-3”。扩增子随后用NotI和SpeI限制性内切酶消化,并在pBS-SK(+)-6-c-myc载体中与c-myc表位克隆。的标记atwhy2然后使用以下引物重新扩增:5'-TCTAGAGGCGCGCCATGATG AAGCAAGCCCGCTCTTTG-3'和5'-TCTAGAAGGCCTTCATCGATTTCGA ACCCGGGGTAC-3'克隆到a pGREENII022935S载体[41].该结构与同伴向量pSOUP共转换为GV3101 pMP90根癌土壤杆菌压力。植物转化采用花浸法进行,如所述[42].利用pGREENII0229载体赋予的BASTA抗性在土壤上选择转化植株。所有表达该结构的植物都表现出这里所呈现的表型。由于纯合子系几乎完全不育,杂合子系是从T1植物中衍生出来的,并用于这里所示的实验。通过正常外观鉴定了约占子代1/4的WT植株,并将其移除用于成熟植株的实验。植物过度表达一种未标记的atwhy2在CaMV 35S启动子的控制下,表型复制了过量产生AtWhy2-myc结构的植物,从而消除了表型可能是表位对线粒体生物发生的某种非特异性作用的结果的可能性。
抗体生产
重组AtWhy2如前所述表达和纯化[6].免疫家兔,采集抗血清。在蛋白凝胶印迹分析中,抗血清的浓度通常为1:1000至1:2500。
DNA, RNA凝胶印迹和寡核苷酸
用TRIZOL从4周龄植物中分离RNA®试剂(Invitrogen)根据制造商的说明。使用CTAB DNA提取方案从植物中分离DNA [43].样品的运行和凝胶的印迹按所述进行[44].本研究中所有PCR产物均采用以下引物进行DNA PCR扩增:Rrna26smfor, 5' -gcgt accttttgcatgatggg-3 ', rrna26smrev, 5'- cctagccattggaggaccattcga gc -3', nad7rev, 5'- ttggagatccccaatccc -3', atp9r ev, 5'- accaccatgttaggcaaacaa -3', cox1for, 5'- gaccattccgcccagagaggaccgag -3', cox1rev, 5'- tacacctggatgaccgag - accgag -3', atp8for, 5'- ggagatggagtacttgaccgag -3', atp8rev, 5' -tccattcctcgtgagccactt-3 ', rps3for, 5' -ccatga ccgattaccctcttgccagccactt -3', rps3for, 5' -ctgtaagcttcttccctgtgc-3 ', rps3rev, 5'- ctgtacttcttcccctgtgc -3', rps3rev, 5'- ctgtacttcttcccccctgtgc -3', rps3rev, 5'- ctgtacttcttcccccctgtgc -3',5'- cctgcggaagattattctactcgt -3', RPL16REV, 5'- agcgttctaagatcactgagg -3', ORF240aREV, 5'- agctttgagatcgagatcgagagca -3', ATP9ORF262FOR, 5'- gctagctcaaccggagatgttagagca -3', ATP9ORF262REV, 5'-GGCTAGATAGCACCATTGTGTCA-3', PSBAREV, 5'- ccgaatacaccagcccgcaggactacacct -3', UPCOX1FOR, 5'- gctagctcatccgcaggagac -3', UPCOX1REV, 5'- gctagctcatccgcaggaaatc -3', UPCOX1REV, 5'- gtacccttccgccgccgcaggaatc -3', UPRPS3REV, 5'- gtacccttccgccgccgccgtctac -3', UPRPS3REV, 5'- cgcgcttagaaaggttcttctctac -3',5'- gcactctaccagagagctacac -3', uprrna26srev, 5'- ggagccttggataagcaactg -3', uprrna18srev, 5'- cagttgcttatccaggccagagagagagagagagac -3', upatp9652for, 5'- ggatcgcatgagtacgagaga -3', upatp9652rev, 5'- gattcgcatgagtacgagaga -3', repeatiibfor, 5'- ctaaacgagtcagccctctc -3', trnaglyfor, 5'- gttggacagagagagctctcc -3', trnaglyrev, 5'- gttggacagagagctctcc -3', trnaglyrev, 5'- gttggaca tctgctctcc -3', trnaglyrev, 5'- gttggaca tctgctctcc -3',Trnafmetfor, 5'- ggttgttggtccaacgactct -3', trnafmetrev, 5'- agtacacactgtgcaccatcca -3', er265000for, 5'- ttctccctgcctccgacatggg -3', er84000f或,5'- ttctcgtgctctccgtaggaa -3', er84000rev, 5'- gccattcttctctggtaggac -3', repeat1afor, 5'- gccattcttctctggtaggac -3', repeat1bfor, 5'- tggactaccaaagacccagc -3', repeat1bfor, 5'- tggactaccaaagaccccagc -3', repeat1brev, 5'- tcggattcttgaccagctccatcagg -3', repeat1brev, 5'- tcggattcttgaccagctccatcagg -3', repeat1brev, 5'- tcggattcttgccatacggc -3'5' -gtcctgatcgagcaactagtc-3 ', nad3for, 5'- tttactcccgatccgaagac -3', nad3rev, 5'- ttccaaacaggaaccaccgt -3', nad4rev, 5'- caccagattcatatgggaccacctac -3', cox3for, 5' -caagtccatggcctatttcgg-3 ', cox3rev, 5'- accatgcagcttcaaagc -3', cox3rev, 5'- ttgtgatgcagcttcaaagg -3', cox2rev, 5'- ttgtgatgcagcggcaaagg -3', cox2rev, 5' -ttgtgatgcagcggaaccatg-3 ', 5' -ttgtgatgcagcggaaccatg-3 ', 5' -ttgtgatgcagcggaaccatg-3 ', 5' -ttgtgatgcagcggaaccatg-3 '。所有探针随后被克隆到pDRIVE克隆载体(QIAGEN)中并测序。
蓝色原生聚丙烯酰胺凝胶电泳(BN-PAGE)
约200 mg的叶片在0.33 M蔗糖、50 mM双三酸、pH 7.0和750 mM氨基己酸中均质。过滤匀浆,在1000g下旋转10 min。丢弃颗粒,上清液在10000 g下旋转15 min。颗粒富含原油线粒体在50 mM Bis-tris resuspended, pH值7.0,0.5毫米750毫米ACA和EDTA和水溶性n-dodecyl-maltoside 1%冰5分钟。在25000 g离心5分钟后,上层富含线粒体复合物是补充5% (w / v)原液Coomassie蓝色(美国赛瓦)溶液化中最后一个1:4的比例(w: w) Coomassie洗涤剂,并受BN-PAGE根据(45].分离凝胶由5-13% (w/v)丙烯酰胺线性梯度和4.5% (w/v)丙烯酰胺堆叠凝胶组成。所使用的阴极缓冲液为50mm Tricine, 15mm Bis-Tris pH 7.0(4°C)和0.02%考马斯蓝(w/v),新鲜制备并添加0.02%洗涤剂。电泳在65 V下进行1小时,4°C或直到蛋白质进入堆叠凝胶,然后在140 V恒压下进行过夜。电泳后,用MilliQ水简单冲洗凝胶,然后在无试剂的反应缓冲液中平衡10分钟。然后在新鲜缓冲液中加特定试剂孵育凝胶。所有步骤都在室温下进行。反应介质如所述[16].通过将凝胶固定在45%甲醇(v/v)和10%醋酸(v/v)中,反应在不同长度的时间内停止。凝胶在同一溶液中染色过夜,以去除残留的考马斯蓝。
半定量rt - pcr
cDNA是从4周龄植物中分离出的总RNA中提取的,在使用RevertAid™第一链cDNA合成试剂盒(Fermentas)之前,根据制造商的说明用无RNA的DNAseI进行消化。采用以下寡核苷酸进行PCR:NADB18FOR, 5'- atggaggttccaggttccagaggaacagcagc -3', NAD51REV, 5'- cacgttccacgaagtcaaagggccc -3', COXVBFOR, 5'- gtgatggcttcatcccc -3', cox6bv, 5'- tcaagaactccatcgctctccga -3', cox6bv, 5'- tcaagaactccatcgctctccga -3', 5At2g45570, 5'- agctctcgcaaggtcgccatct -3', 3At2g45570, 5'- cttcaccttgttccctcatcaaccattagc -3', 5at1g471285 '- gcagttgctcatcaaccattagc -3', 3at1g471285 '- gcagttgctcatcaaccattagc -3', 3at1g471285 '- gcagttcctcatcaaccattagc -3',5At2g38860、5'-CGGCGGTTTATGACCTTGAGGATG-3'、3At2g38860、5'-AAAAAGGCAGGCAGATCCGTGGCT-3'、5'-GGTGGAGCCTTACAACGCTACTTT-3'、3-TUBURT、5'- tcgcctgaacatctcttggatggga -3'、5AT5G45890、5'- ggctgcgaagggggtttaatggat -3'、3AT5G45890、5'-CGCCGTATCCAATCGCAGTTACTG-3'。
实时定量PCR
从各基因型等鲜重中提取的DNA作为模板。384个孔板格式的PCR反应使用每个DNA样本2 μl, TaqMan PCR Master Mix (Applied Biosystems, CA) 5 μl,每个引物2 μl, Universal TaqMan探针1 μM,总体积为10 μl。选择基因组DNA引物扩增基因AT5G08530中一个独特的核区域:5'-GCGTTTGAATCTAGAGAAGGCTA-3'和5'-CAGAACCAC ATGCATTCTTCC-3'。来自通用库的Taqman探测器#54被选中。引物被选择扩增在线粒体中发现的一个独特的区域18 s rRNA基因:5'-TTTCGAAACCAATTCACTTGAG-3'和5'-TGTAGATTTC ACCCCTCCACA-3'。来自通用库的Taqman探测器82号被选中。另一个独特的线粒体区域发现在内含子之间的外显子d和enad5用引物5'- ctctccgcaggg GAATCT-3'和5'- AACCCCCATGATGTGGTAA-3'检测基因。来自通用库的Taqman探测器#38被选中。ABI棱镜®7900 HT序列检测系统(Applied Biosystems)用于检测扩增产物,并被编程为在95°C下的初始步骤为10分钟,然后在95°C下进行45个周期,每次15秒,在60°C下进行1分钟。所有反应重复三次,用平均值进行量化。目的基因的相对定量采用ΔΔCT法。简单地说,将线粒体区域的Ct(阈值循环)值归一化到核区域(ΔCT = Ct线粒体- Ct核),并与校准器(Col-0样本)进行比较:ΔΔCT = ΔCt样本- ΔCt Col-0样本。相对表达量(RQ)采用序列检测系统2.2.2软件(Applied Biosystems)计算,公式RQ = 2——ΔΔCT.
显微镜
将4周龄植株的叶肉组织切成1-2 mm进行透射电镜观察2用pH为7.4的0.2 M碳酸钠缓冲液清洗两次,清洗10分钟。组织在含1% em级戊二醛的碳酸酯缓冲液中孵育6小时固定。样品被涂上环氧树脂,切割成80纳米的截面,并安装在镍/formvar网格上。用醋酸铀酰和柠檬酸铅对样品进行染色。用JEOL (JEM1230)透射电子显微镜在80 kV下进行观察。照片是用Gatan DualVision相机拍摄的。
线粒体中的DNA免疫沉淀
叶片组织在1%甲醛中真空固定15分钟。甘氨酸加入0.125 M滴定剩余甲醛,固定组织用蒸馏水冲洗3次。粗粒线体在线粒体提取缓冲液(350 mM甘露醇,30 mM MOPS pH 7.3, 0.2%牛血清白蛋白,0.6%聚乙烯吡罗烷酮,1 mM EDTA)中使用研杵研磨制备。研磨组织通过2层miraccloth (Calbiochem)过滤,在微型离心机中以1000克的速度旋转5分钟,将大多数质体制成颗粒。回收上清液,在11000 g的微型离心机中旋转,将线粒体和剩余的质体制成颗粒。将颗粒重悬于IPP缓冲液(50 mM Tris-HCl pH 7.5, 150 mM NaCl, 1% NP-40, 0.5%脱氧胆固醇钠,1片完全蛋白酶抑制剂(Roche))中,在冰上裂解2分钟,裂解液在11000 g下旋转15分钟。用布兰森微尖超声仪对上清液进行恢复和超声检测。超声材料通过蛋白-a -琼脂糖珠(Roche)在旋转平台上4°C孵育1小时预先清除。将预先清除的材料以11000 g的速度旋转15分钟,将上清液转移到新鲜管中。蛋白质定量,100 μg作为输入材料,500 μg用1/200兔多克隆抗atwhy2血清进行免疫沉淀,最终体积为1ml。 Immunoprecipitations were carried out for 1 hour at 4°C before adding 50 ul of protein-A-agarose beads. Complexes were allowed to form overnight. Beads were pelleted at 100 g for 1 minute and were washed 2 times 5 minutes with IPP buffer, 2 times 5 minutes with low salt buffer (50 mM Tris-HCl pH 7.5, 0.1% NP-40, 0.05% sodium deoxycholate), 2 times 5 minutes with high salt buffer (50 mM Tris-HCl pH 7.5, 500 mM NaCl, 0.1% NP-40, 0.05% sodium deoxycholate), 2 times 5 minutes with LiCl buffer (50 mM Tris-HCl pH 7.5, 0.1% NP-40, 0.05% sodium deoxycholate, 250 mM LiCl) and 2 times 5 minutes with TE pH 7.5 (10 mM Tris-HCl pH 7.5, 1 mM EDTA). Beads were pelleted at 11000 g for 20 seconds and resuspended in TE buffer containing 1% SDS. Complexes were eluted from the beads by heating at 65°C for 15 minutes. Beads were spun down at 11000 g for 5 minutes and the supernatant transferred to a new tube. One tenth volume of 2 M NaCl was added and the eluted complexes were incubated at 65°C overnight for decrosslinking. Glycogen was added to a final concentration of 0.5 μg/ul and twice the volume of 100% ethanol was added. DNA was precipitated at -80°C for 1 hour. Tubes were spun at 11000 g for 20 minutes. DNA pellets were resuspended in TE buffer. DNA was subjected to a phenol/chloroform extraction and to a chloroform extraction before being reprecipitated as above. After a final wash with 70% ethanol, DNA was resuspended in water. This DNA was used for PCR reactions. To further control the specificity of the experiment, we determined the size of DNA fragments following sonication and found that they were between 350 and 1000 bp in length, indicating that for any given region immunoprecipitated specifically, it can be assumed that there is at least one Whirly binding-site within a maximum of 1000 bp starting from the center of the amplified region. Additionally, we used primers to amplify a plastidial DNA region in thepsbA由于AtWhy2只定位于线粒体,因此不应该与叶绿体基因组相互作用,因此作为阴性对照基因。我们发现,我们只能在Col-0、KO和OEX植物中扩增相似背景水平的质体基因,这证实了AtWhy2和质体DNA之间缺乏特异性相互作用在活的有机体内(数据未显示)。
参考文献
- 1.
李志强,李志强,李志强,等。质核逆行信号的研究进展。植物生物学年度回顾。2006, 35(4): 457 - 459。10.1146 / annurev.arplant.57.032905.105310。
- 2.
Liu Z, Butow RA:线粒体逆行信号。遗传学年度回顾。2006, 40: 159-185。10.1146 / annurev.genet.40.110405.090613。
- 3.
unsell M, Marienfeld JR, Brandt P, Brennicke A:拟南芥线粒体基因组包含57个基因,共366,924个核苷酸。自然遗传学。1997,15(1): 57-61。10.1038 / ng0197-57。
- 4.
Desveaux D, Despres C, Joyeux A, Subramaniam R, Brisson N: PBF-2是马铃薯PR-10a基因激活的一种新型单链DNA结合因子。植物细胞。2000, 12(8): 1477-1489。10.2307 / 3871144。
- 5.
戴伟,李志刚,李志刚。旋转转录因子:防御基因的调控。植物科学发展趋势。2005, 10(2): 95-102。10.1016 / j.tplants.2004.12.008。
- 6.
Desveaux D, Subramaniam R, Despres C, Mess JN, Levesque C, Fobert PR, Dangl JL, Brisson N:拟南芥水杨酸依赖性抗病的转录因子。细胞发育。2004, 6(2): 229-240。10.1016 / s1534 - 5807(04) 00028 - 0。
- 7.
杜文杰,李文杰,李文杰,等:植物转录因子家族的一种新的ssdna结合表面。自然结构生物学。2002, 9(7): 512-517。10.1038 / nsb814。
- 8.
Krause K, Kilbienski I, Mulisch M, Rodiger A, Schafer A, Krupinska K:拟南芥Whirly家族dna结合蛋白靶向细胞器。2月的信件。2005, 579(17): 3707-3712。10.1016 / j.febslet.2005.05.059。
- 9.
刘海辉,权春,李敏敏,郑益益:单链DNA结合因子AtWHY1调节拟南芥端粒长度稳态。植物学报,2007,49(3):442-451。10.1111 / j.1365 - 313 x.2006.02974.x。
- 10.
Gepstein S, Sabehi G, Carp MJ, Hajouj T, Nesher MF, Yariv I, Dor C, Bassani M:叶片衰老相关基因的大规模鉴定。植物学报,2003,36(5):629-642。10.1046 / j.1365 - 313 x.2003.01908.x。
- 11.
Yoshida S, Ito M, Nishida I, Watanabe A:拟南芥叶片衰老潜在分子标记基因的分离与RNA凝胶印迹分析。植物细胞生理学杂志,2001,42(2):170-178。10.1093 /卡式肺囊虫肺炎/ pce021。
- 12.
Bonawitz ND, Shadel GS:重新思考衰老的线粒体理论:线粒体基因表达在寿命决定中的作用。细胞周期(乔治城,德克萨斯州)。2007,6(13): 1574-1578。
- 13.
Maxwell DP, Nickels R, McIntosh L:线粒体参与诱导与病原体攻击和衰老相关的基因所需的信号转导的证据。植物学报,2002,29(3):269-279。10.1046 / j.1365 - 313 x.2002.01216.x。
- 14.
安春春,李俊华,李黄安,金文伟,白海峰:禁酒素参与植物线粒体生物发生。植物学报,2006,46(4):658-667。10.1111 / j.1365 - 313 x.2006.02726.x。
- 15.
郭志刚,李文波,李志刚,陈志刚:哺乳动物衰老过程中线粒体DNA突变与细胞凋亡的关系。中国癌症杂志,2006,26(3):339 - 339。10.1158 / 0008 - 5472. - 05 - 4670。
- 16.
王晓明,王晓明,王晓明,等:植物线粒体呼吸链复合体的组织化学染色及定量分析。植物学报,2005,44(5):893-901。10.1111 / j.1365 - 313 x.2005.02577.x。
- 17.
Zaegel V, Guermann B, Le Ret M, Andres C, Meyer D, Erhardt M, Canaday J, Gualberto JM, Imbault P:植物特异性ssDNA结合蛋白OSB1参与拟南芥线粒体DNA的化学计量传递。植物细胞。2006,18(12): 3548-3563。10.1105 / tpc.106.042028。
- 18.
Shedge V, Arrieta-Montiel M, Christensen AC, Mackenzie SA:植物线粒体重组监测需要不寻常的RecA和MutS同源物。植物细胞。2007,19(4): 1251-1264。10.1105 / tpc.106.048355。
- 19.
Sakamoto W, Kondo H, Murata M, Motoyoshi F:叶绿体突变体诱导拟南芥母体畸变叶突变体线粒体基因表达的改变。植物细胞。1996, 8(8): 1377-1390。10.2307 / 3870308。
- 20.
马志刚,王志刚,王志刚,王志刚,等:拟南芥CHM基因突变促进线粒体基因组重排。植物细胞。1992, 4(8): 889-899。10.2307 / 3869457。
- 21.
Backert S, Lurz R, Oyarzabal OA, Borner T: Chenopodium album (L.)线粒体中单链DNA的高含量、大小和分布。植物分子生物学。1997,33(6): 1037-1050。10.1023 /: 1005791310886。
- 22.
陈晓明,王晓明,王晓明,等。烟草细胞线粒体DNA复制的研究进展。植物细胞。1996, 8(3): 447-461。10.2307 / 3870324。
- 23.
Kuhn K, Weihe A, Borner T:多启动子是拟南芥线粒体基因的共同特征。核酸研究。2005,33(1): 337-346。10.1093 / nar / gki179。
- 24.
Pfalz J, Liere K, Kandlbinder A, Dietz KJ, Oelmuller R: pTAC2, -6和-12是转录活性质体染色体的组成部分,是质体基因表达所必需的。植物细胞。2006,18(1): 176-197。10.1105 / tpc.105.036392。
- 25.
Vermel M, Guermann B, Delage L, Grienenberger JM, Marechal-Drouard L, Gualberto JM:植物线粒体特异的rm型rna结合蛋白家族。美国科学院学报,2002,99(9):5866-5871。10.1073 / pnas.092019599。
- 26.
Kwon C, Chung IK:拟南芥rna结合蛋白与植物单链端粒DNA的相互作用调节端粒酶活性。生物化学杂志。2004, 27(6): 528 - 528。10.1074 / jbc.M312011200。
- 27.
酒井A,高野H,黑岩T:高等植物细胞器核:结构、组成、功能与进化。国际细胞学评论。2004, 38(4): 457 - 457。
- 28.
Shiina T, Tsunoyama Y, Nakahira Y, Khan MS:高等植物中的质体RNA聚合酶,启动子和转录调控因子。国际细胞学评论。2005, 44: 1-68。10.1016 / s0074 - 7696(05) 44001 - 2。
- 29.
Hajdukiewicz PT, Allison LA, Maliga P:在烟草质体中,由细胞核和质体室编码的两种RNA聚合酶转录不同的基因组。EMBO期刊。1997, 16(13): 4041-4048。10.1093 / emboj / 16.13.4041。
- 30.
陈晓峰,陈晓峰,陈晓峰:转录因子与dna相互作用的基因组研究。化学生物学的最新观点。2005,9(1): 38-45。10.1016 / j.cbpa.2004.12.008。
- 31.
Bonawitz ND, Clayton DA, Shadel GS:起始和超越:人类线粒体转录机制的多种功能。分子细胞。2006,24(6): 813-825。10.1016 / j.molcel.2006.11.024。
- 32.
Morrison TL, Yakisich JS, Cassidy-Hanley D, Kapler GM: TIF1抑制rDNA复制启动,但促进正常S期进展和染色体传输。细胞的分子生物学。2005,16(6): 2624-2635。10.1091 / mbc.e05 - 02 - 0107。
- 33.
Saha S, Nicholson A, Kapler GM:四膜虫起源结合蛋白TIF1的克隆和生化分析:体外和体内竞争性DNA结合的关键rDNA复制决定因素。生物化学杂志。2001, 27(4): 457 - 457。10.1074 / jbc.M106162200。
- 34.
Yakisich JS, Sandoval PY, Morrison TL, Kapler GM: TIF1激活四膜虫二倍体微核和无丝分裂多倍体大核s期内检查点反应细胞的分子生物学。2006,17(12): 5185-5197。10.1091 / mbc.e06 - 05 - 0469。
- 35.
Schumacher MA, Karamooz E, Zikova A, Trantirek L, Lukes J:布氏小锥虫MRP1/MRP2导联RNA结合复合物的晶体结构揭示了RNA配对机制。光子学报,2006,26(4):344 - 344。10.1016 / j.cell.2006.06.047。
- 36.
Giege P, Brennicke A:拟南芥线粒体RNA编辑对orf 441 C到U变化的影响。美国国家科学院学报,1999,96(26):15324-15329。10.1073 / pnas.96.26.15324。
- 37.
Shikanai T:植物细胞器中的RNA编辑:机制、生理功能和进化。细胞生命科学,2006,63(6):698-708。10.1007 / s00018 - 005 - 5449 - 9。
- 38.
刘志刚,王志刚,王志刚。着丝质体鞭毛虫线粒体基因组和转录组的复杂性。目前的基因。2005, 48(5): 277-299。10.1007 / s00294 - 005 - 0027 - 0。
- 39.
Hiesel R, Combettes B, Brennicke A:除苔藓植物外,所有主要陆地植物组的线粒体RNA编辑的证据。美国科学院学报,1994,91(2):629-633。10.1073 / pnas.91.2.629。
- 40.
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P, Stevenson DK, Zimmerman J, Barajas P, Cheuk R,等:拟南芥全基因组插入诱变。科学通报,2003,29(3):344 - 344。10.1126 / science.1086391。
- 41.
Hellens RP, Edwards EA, Leyland NR, Bean S, Mullineaux PM: pGreen:农杆菌介导植物转化的一种多功能灵活的二元Ti载体。植物分子生物学。2000, 42(6): 819-832。10.1023 /: 1006496308160。
- 42.
Clough SJ, Bent AF:花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。
- 43.
Weigel D, Glazebrook J:拟南芥:实验室手册。纽约州冷泉港:冷泉港实验室出版社2002年出版。
- 44.
李文杰,李志强,李志强。分子克隆:实验室手册。第二版。纽约州冷泉港:冷泉港实验室,1989年。
- 45.
Schagger H, von Jagow G:分离酶活性形式的膜蛋白复合物的蓝色天然电泳。分析生物化学。1991, 199(2): 223-231。10.1016 / 0003 - 2697 (91) 90094 - a。
确认
我们感谢Richard Janvier在电子显微镜方面的出色技术支持。这项研究得到了加拿大自然科学与工程研究委员会(NSERC)的资助。AM由NSERC和Fonds Québécois de la Recherche sur la Nature and les Technologies提供的奖学金支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
AM制作了AtWhy2和AtWhy2-myc过表达系,表征了线粒体Whirly突变体的表型,设计了研究并起草了手稿。JSP获得atwhy2 KO植株,帮助产生抗体,并进行RT-PCR实验。MS进行了BN-PAGE和凝胶酶测定,并参与了研究的设计。FVL参与mtDNA免疫沉淀实验。CAR参与了植物的RNA和DNA凝胶印迹分析。NB参与了研究的设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Maréchal, A.,父母,JS。,萨巴尔,M。et al。mtdna相关的AtWhy2过表达会损害线粒体功能。BMC植物生物学8,42(2008)。https://doi.org/10.1186/1471-2229-8-42
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-42
关键字
- 线粒体基因组
- 呼吸链复合体
- 线粒体基因表达
- 基因表达机制
- 通用库