摘要
背景
在细菌中,如鼠伤寒沙门氏菌以吲哚-3-甘油磷酸(IGP)为原料,用色氨酸合成酶αββα异四聚体合成色氨酸。植物进化出多个α (TSA)和β (TSB)同源体,其生物学功能和亚基相互作用能力可能存在差异。有证据表明拟南芥中存在色氨酸合成酶(TS)复合体。另一方面,玉米(玉米)表达高效裂解IGP的tsa同源物BX1和IGL,与TSB的相互作用无关。
结果
为了阐明色氨酸是如何在玉米中合成的,两种TSA同系物,迄今尚未被表征Zm评选TSA和Zm评选tsa相似,进行了功能分析。Zm评选TSA定位于质体,质体是植物色氨酸生物合成的主要部位。它催化色氨酸合成酶α-反应(IGP的裂解),与色氨酸合成酶形成络合物Zm评选TSB1在体外.络合物的形成大大提高了α-反应的催化效率。从玉米叶片中部分纯化了一个160kd的色氨酸合成酶复合物Zm评选质谱分析表明TSA是该配合物的原生α-亚基。Zm评选同样的,没有在体外检测到活性,定位在细胞质中。Zm评选TSAlike、BX1和IGL在叶片的原生色氨酸合成酶复合体中未检测到。
结论
这是证明在活的有机体内而且在体外玉米形成色氨酸合成酶复合体Zm评选TSA在该络合物中起α-亚基的作用。
背景
色氨酸是人体必需的营养氨基酸。在谷物粒中,如玉米(玉米),色氨酸含量低,限制了营养价值。在培育色氨酸含量提高的玉米品系方面作出了重大努力[1,2].除了作为蛋白质成分的功能外,植物利用色氨酸作为大量次生代谢物的前体,如萜类吲哚生物碱、吲哚硫代葡萄糖苷酸和吲哚植物抗毒素(见:[3.,4])。特别重要的是色氨酸来源的植物激素吲哚-3-乙酸(IAA),它参与许多过程,包括胚胎发育、顶端优势和向性[4,5].色氨酸的这些基本功能强调了更详细地了解其在植物中的合成的必要性。
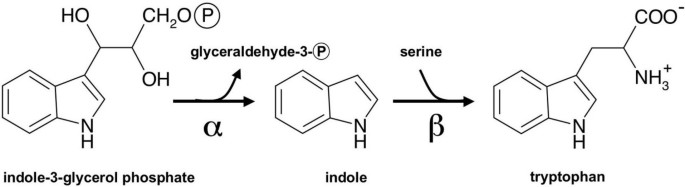
在细菌中,如大肠杆菌而且鼠伤寒沙门氏菌,色氨酸由吲哚-3-甘油磷酸(IGP)通过色氨酸合成酶(TS)配合物合成[6].IGP被TS α-亚基(TSA)裂解成吲哚和甘油醛-3-磷酸(α-反应)。然后,吲哚通过30 Å分子间通道被运送到色氨酸合成酶β-亚基(TSB),后者催化吲哚和丝氨酸缩合(β-反应)生成色氨酸(图)1;有关回顾,请参阅[7,8])。这种底物通道保证了吲哚不会从酶复合体中逸出。对该细菌αββα配合物的反应机理进行了详细的研究。α-和β-亚基以高度合作的方式相互作用,并通过变构相互作用相互调节。此外,在一些原核生物中表达的替代tsb具有高活性,独立于唯一的TSA的相互作用[9].在真菌中,TSA和TSB的相互作用是专性的,因为这两种功能都存在于单一多肽上[9,10].
这种情况在高等植物中更为复杂。细菌的同系物运输安全管理局而且TSB基因通常是重复的,例如拟南芥基因组包含两个假定的运输安全管理局和四个假定的TSB基因。目前,这些不同亚型的作用还没有完全了解。功能的相关性在TSA1 (At3g54640)和在TSB1 (At5g54810)由兼性色氨酸营养不良突变体证实trp3而且trp2分别为(11,12].在TSA1和在TSB1都定位于质体[11,13,14].免疫亲和层析结果表明,这两个蛋白形成了一个活性αβ复合物[14].然而,目前尚不清楚这种复合物的形成是否是植物中的普遍现象。
在谷物中,关于TSA和TSB同系物的信息最多的是玉米:这是两种高度相似的作物TSB基因(ZmTSB1而且ZmTSB2),在成熟蛋白水平上具有96%的同一性。Zm评选TSB1和Zm评选TSB2是功能冗余的活性TSB酶。虽然任何一个基因的单一突变都不会影响色氨酸的合成,但双突变橙果皮(orp1=Zmtsb1,orp2=Zmtsb2)是色氨酸营养不良者[15,16].有四种TSA同源物:BX1, IGL,Zm评选TSAlike [17),而Zm评选TSA(这项工作)。BX1对于提供吲哚作为天然农药2,4-二羟基-7-甲氧基- 2h -1,4-苯并恶嗪-3(4H)- 1 (DIMBOA)的前体是必不可少的[18].三维BX1结构已被确定,并被证明与细菌tsa的活性构象非常相似[19].Igl昆虫摄食时会触发转录,IGL为寄生蜂提供吲哚作为挥发性信号[17,20.].BX1和IGL有效地裂解IGP形成吲哚,而细菌TSA亚基的活性依赖于与β-亚基的相互作用[17,18].这些酶的特性,其特异的转录调控,以及生长缺陷的缺乏bx1系列而且igl突变植物表明额外的tsa同源物参与了色氨酸的生物合成。
在这项研究中,我们旨在从玉米中识别参与色氨酸生物合成的TSA同源物。Zm评选TSA具有催化活性和相互作用Zm评选含有β-亚基的TSA显著提高了α-反应的催化效率。一种蛋白质纯化策略被用于获得被子植物,类似于细菌,形成色氨酸合成酶复合体的直接证据。
方法
植物材料和生长条件
下列玉米(玉米)系分析:B73(野生型),bx1系列突变体(21),tsb突变体(orp1 +/orp1 orp2)和(orp1 orp2/+ orp2)[15这是玉米遗传库存中心好心提供的。种子在滚在湿滤纸(603/N, 75克米)的烧杯中萌发-2在28°C的黑暗条件下,3天后将幼苗转移到土壤中,在Heraeus HPS 2000生长室(光照:100 μmol m)中培养-2年代-1;16 h / d)。
ZmTSA的鉴定及标准蛋白的异源表达
从12日龄树苗中分离cdna文库bx1系列[21被使用[17].一个ZmTSAlike根据基因组序列分离出cDNA克隆[17,并被RACE确认为全长。的ZmTSA基于EST AY107255(基因库)和EST- tug克隆cDNA [GenBank:EU334442]Zm评选玉米基因组数据库Tuc03-08-11.4557,根据基因组序列确认为全长。Zm评选TSA和Zm评选使用“TargetP”和“iPSORT”程序对质体靶向序列进行tssimilarity分析[22,23].
BX1和IGL的表达和纯化已经在前面进行了描述[17,18].的异源表达Zm评选TSA和Zm评选TSAlike,一个NdeI/ bglii片段,用于Zm评选用PCR扩增出TSB1表达的NdeI/ bamhi片段,其中不含质体靶向序列。使用了以下引物:Zm评选TSA: GCATATGCCGCGCAGCATCTCCG TCTTACGCTCTTTGCTAACGAAAATGG;Zm评选TSAlike: CGCATATGGCCAACGGCGGCG GGGAGTGAGATCTGCTCACGGC;Zm评选TSB1: CATATGGCGGCCTCCCCCGCTGCCG CTCGGATCCAGCCCTCCTCTCCGGTG。将编码序列克隆到pET28a His-tag载体中,异质表达,根据制造商(Qiagen, Hilden, Germany)的建议,使用Ni-NTA琼脂糖进行His-tag亲和纯化,在原生条件下进行纯化。
用于检测TSA/TSB络合物的形成在体外使用100 mM Tris-HCl, pH 8.0, 100 mM KCl,每分钟0.5 ml进行洗脱色谱(HiLoad™16/60 Superdex™200 prep级,Amersham Biosciences, Little Chalfont, UK)-1和20°C。用蛋白质标准细胞色素c (12.4 kD)、碳酸酐酶(29 kD)、牛白蛋白(66 kD)、酒精脱氢酶(150 kD)和β-淀粉酶(200 kD)校准柱。
转录分析
检测ZmTSA而且ZmTSAlike从野生型系B73中分离表达总RNA,用LightCycler/Syb进行实时荧光定量PCR®-绿色染料系统(罗氏,曼海姆,德国),有以下引物对:ZmTSA: GGTTCATGGCAATGCGGCCT CACTGCTGGAGACCCTGACT;ZmTSAlike: GCCTCGCTCCTCAGCAACGTCGTCT CCACAAAGGCAGCGCTCGGAGGTG;GAPDH C: GCTAGCTGCACCACAAACTGCCT TAGCCCCACTCGTTGTCGTACCA。
分析的组织如下:12 d老植株的叶片(12 d叶片),12 d叶片茉莉酸甲酯处理,12 d叶片诱导子处理[20.], 4 d苗暗生,6 d苗暗生,6 d苗浅生,3周根,10周冠根,8周茎,10周叶,皮,丝,穗轴,流苏,授粉后1周果仁(wap),果仁3 wap。
色氨酸合酶活性测定
植物蛋白(200 μg)或纯化的重组酶(2 μg)分别在30℃、pH 8.2、80 mM磷酸钾缓冲液中培养3 h、重组蛋白培养5 min。24];β-反应:50 μM吲哚、60 mM l -丝氨酸、50 μM吡哆醛磷酸盐;αβ-反应:100 μM IGP, 60 mM l -丝氨酸,50 μM吡哆醛磷酸盐,分析浓度范围,测定动力学参数。
产物吲哚和色氨酸采用高效液相色谱(rp -柱:LiChroCART 125-4, RP-18, 5 μm;默克,西点,宾夕法尼亚州)使用二极管阵列(PDA-100, Dionex, Idstein,德国)和荧光检测(RF-10AXL,杜伊斯堡岛津,德国;激发:285 nm,发射:360 nm)。流动相以1 ml / min的流速输送-1初始混合物为15% (v/v) MeOH, 0.3% (v/v) HCOOH,随后15分钟线性梯度至100% MeOH。
植物蛋白纯化
叶片组织(50 g)在液氮中均质,提取于5 ml 50 mM Tris-HCl, pH 8.0,含10 mM EDTA, 5 mM DTE, 1 mM PMSF和10% Polyclar AT (sera,海德堡,德国)中,在10 000 g(4℃)下离心20分钟。将上清液置于阴离子交换柱(MonoQ HR 5/5, Amersham)中,与100 mM Tris-HCl平衡,pH 8.0, 10 mM EDTA, 5 mM DTE, 100 mM NaCl, 4℃。然后用10卷相同的缓冲液洗涤柱,用100 mM Tris-HCl洗脱,pH 8.0含10 mM EDTA, 5 mM DTE和1 M NaCl在20卷线性梯度。在450 mM NaCl附近的分数表现出TS活性,并且受到0.5 ml min-1, 20°C)到凝胶渗透色谱(HiLoad™16/60 Superdex™200 prep grade, Amersham,平衡100mm Tris-HCl, pH 8.0,包括100mm KCl)。用相同的缓冲液(180 ml, 0.5 ml / min)洗脱柱-1).收集1 ml馏分,检测α-和β-活性。加入10% TCA沉淀54 ~ 56 ml,用10 μl 10 mM Tris-HCl, pH 6.8, 20 mM DTT, 2% (w/v) SDS, 0.01% (w/v)溴酚蓝,10% (w/v)甘油重溶,SDS- page测定。
用40% (v/v) MeOH/10% (v/v) HOAc溶液固定> 2小时后,在水中洗涤2 × 10分钟,用考马斯亮蓝染料(0.08% (w/v)考马斯亮蓝G250, 1.6% (w/v)染色过夜。昊图公司-磷酸,8% (w/v) (NH4)2所以4, 20% (v/v) MeOH)和1% (v/v) HOAc [25].将25 - 60kd之间的蛋白条带剪掉,并将凝胶片进一步在200 mM NH与水(2 × 30 min 37°C)的热混合器中分离4HCO3.pH 7.8 (2 × 30 min 37°C), 50%乙腈(ACN) (2 × 5 min 37°C)。凝胶片在100% ACN中收缩,除去液体上清,在SpeedVac中干燥5min。
色氨酸合成酶蛋白组分的鉴定:样品制备
胰蛋白酶消化:100 μl胰蛋白酶溶液(200 ng μl-1, Promega)直接移液于凝胶片上,冰上孵育10分钟,使胰蛋白酶进入凝胶中,然后用500 μl 25 mM NH覆盖4HCO3.37°C孵育16 h。加10%三氟乙酸50 μl停止消化,将上清转移到新管中。采用连续碱提和酸提的方法提取多肽。基本萃取物:50 μl 40 mM NH4HCO3.加入凝胶中,在37°C摇动30分钟,上清转移到新的试管中。加50 μl ACN后孵育相同。重复这两个步骤并将上清汇集。酸提取:凝胶片在50 μl 5% (v/v) HCOOH中提取2次30min,在50 μl ACN中收缩2次。所有收集的上清液汇集,在SpeedVac中干燥,溶解在100 μl 20 mM醋酸铵缓冲液中,pH 7.4, 10% (v/v) ACN, 5mm DTT中。
在10 μl胰蛋白酶溶液,200 ng μl中进一步消化-1, 8小时,37°C),以应用最大数量的水解肽没有裂解。后者对于合格肽的可重复性鉴定很重要。
液相色谱-质谱(LC-MS)
安捷伦微型高效液相色谱系统(系列1100,Waldbronn,德国)由一个第四级毛细管泵(G1376A),一个脱气装置(G1379A),一个自动进样器(G1377A)和一个设置为40°C的恒温器柱(G1316A)组成,与单个飞行时间质谱仪(LC/MSD TOF,安捷伦科技,Santa Clara,美国)结合使用。色谱分离采用Zorbax SB C18色谱柱(150 × 0.5 mm id;5 μm,安捷伦技术公司,圣克拉拉,美国)8 μl样品注射。注射前,胰蛋白酶化蛋白样品与200 μl 20 mM NH混合4Ac, 10% ACN (v/v), 5mm DTT, pH 7.4,超声处理15分钟,高压过滤器过滤,储存在自动采样瓶中。HPLC分离流速为50 μl min-1.在每次色谱运行开始时,流动相的组成保持在95% 20 mM NH4Ac/5% ACN (v/v),梯度至20% 20 mM NH4Ac/80% ACN (v/v)在5分钟内,这个最终值保持15分钟。
质谱测量在正电离模式下使用配备ESI源的质谱仪进行。应用MS参数如下:350°C干燥气体温度,420 Lh-1干燥气体流速,20 psig雾化器气体压力,4000 V毛细管电压,60 V脱脂器电压和215 V破碎器电压。质量范围设置为150 - 3200 m/z,数据采集为0.88循环/秒。干燥气体氮由氮气发生器提供(氮纯度≥99.5%,Domnick Hunter, Willich, Germany)。系统控制采用ChemStation软件(Rev. B.01.01, Agilent, Waldbronn, Germany), Analyst QS软件(LC-MS TOF software, Ver。A.01.00 (B663), 2004年6月)用于数据采集。
的表达Zm评选运输安全管理局,Zm评选TSAlike-GFP-fusion蛋白质
构建gfp融合蛋白表达载体[26的停止密码子Zm评选TSA编码序列被BglII限制位点取代,使用以下引物:5'-CGACTACACCAAATGAAAGAATGGAG-3'(正向),5'-CTCGAGAGATCTGGCAATGCGGCCTTCAGG-3'(反向)。完整的尺寸Zm评选去除停止密码子的TSA cDNA片段,用EcoRI/BglII从载体上切割,克隆到pEZS-NL载体的EcoRI/BamHI位点上(D. Ehrhardt, Carnegie Institution)。的Zm评选TSA-eGFP嵌合体用EcoRI切割、钝化、XbaI切割,克隆到pPCV pvuii -缺失的smi /XbaI位点上E35E植物转换向量。同样的策略也被用于建造Zm评选tsalik - egfp嵌合cDNA,引物对为CAAGCTGGCATACATGGAC/GGTACCAGATCTGGCATAGCAGCCTTCATA。
玉米原生质体的转染和共聚焦显微镜
玉米LG22幼苗在黑暗8小时、20°C/16 h、26°C条件下生长6 ~ 8天,然后转移到黑暗3天。原生质体从第二片真叶中分离出来,基本上如上所述[27,28].在1% (w/v)纤维素酶R10, 0.5% (w/v)粗凝酶R10(均来自益力多Honsha), 0.6 M甘露醇,10 mM MES, pH 5.7, 1 mM CaCl中进行消化2在28°C的旋转振动筛上(40转/分钟)搅拌2小时。通过65 μm尼龙网过滤后,在200 g离心3 min,然后在100 g漂浮溶液(25%蔗糖(w/v), 10 mM MES, 20 mM KCl)中离心收集原生质体。漂浮原生质体在0.6 M甘露醇、4 mM MES、20 mM KCl中洗涤并计数。用2.5 × 10进行电穿孔5原生质体和每个质粒40 μg在300 μl 4 mM MES-KOH, pH 5.7, 0.6 M甘露醇,20 mM KCl中。转化的原生质体在25°C的黑暗中培养20小时,在4 mM MES-KOH, pH 5.7, 0.6 M甘露醇,4 mM KCl中培养。
共聚焦显微镜图像使用奥林巴斯FV1000共聚焦激光显微镜与40×水物镜。eGFP检测的激发波长为488 nm。
结果
隔离Zm评选运输安全管理局
在玉米中,有四个编码TSA同源物的基因。Bx1系列,Igl,ZmTSAlike已在前面描述过[17,18].对GeneBank和玉米基因组数据库的搜索(参见URL的可用性和需求部分)揭示了假定的TSA序列,它们不构成的等位基因Bx1系列,Igl,或ZmTSAlike.这些序列,部分由试探性独特基因(TUG)表示ZMtuc03-08-11.4557对应一个新的基因,现在指定ZmTSA。ZmTSA位于第7染色体上(基因库AC191027组)。一个完整的ZmTSA获得cDNA克隆[GenBank:EU334442]。大多数植物tsa具有发散的n端序列,在细菌中没有对应的序列,是质体输入的过境肽。当这个可变部分从分析中排除时,Zm评选TSA与BX1相同的有63%,与IGL相同的有67%,与BX1相同的有72%Zm评选tsa在蛋白质水平上是相似的[关于对齐,参见附加文件1].
表达和亚细胞定位
以进一步表征密切相关的基因ZmTSA而且ZmTSAlikeRT-PCR法测定其在不同组织和发育阶段的转录水平。ZmTSA而且ZmTSAlike在所分析的16个组织中均检测到转录本[见附加文件]2),一般来说,ZmTSA主要亚型是否表达。平均转录水平相对于GAPDH在这些制剂中测定为1.80±0.93 fg-1为Zm评选TSA和0.20±0.15 fg-1为Zm评选运输安全管理局就像.的几乎同质的表达ZmTSA而且ZmTSAlike使其成为在玉米色氨酸生物合成中发挥作用的候选分子。相比之下,Bx1系列主要在幼苗和Igl是针对食草动物攻击而特别诱导的[17,18,20.].
有大量数据表明植物色氨酸的生物合成主要定位于质体[13,29].Zm评选TSA和Zm评选分析了TSAlike在网上使用"TargetP"和"iPSORT"的假定目标序列[22,23].Zm评选TSA被预测为质体定位,而Zm评选TSAlike的n端短45个氨基酸,有望保留在细胞质中。
为获得实验证据,质粒授予表达Zm评选运输安全管理局,Zm评选将TSAlike-GFP融合蛋白转化为玉米原生质体。用共聚焦显微镜分析GFP和叶绿素自身荧光2).在的情况下Zm评选TSA GFP荧光与叶绿体的叶绿素自身荧光相一致(图2 a - c的塑性定位Zm评选TSA。相比之下,Zm评选tsalik - gfp定位于细胞质(图2 d-f).
ZmTSA具有色氨酸合成酶α活性
测定了两种催化剂TS α-反应的动力学参数。纯化的重组Zm评选用TSA检测IGP转化为吲哚的情况。IGP周转率低,但明显可见(K猫= 0.006年代-1)1).重组蛋白无α活性Zm评选在类似实验中检测到TSAlike。
色氨酸合成酶复合体的形成在体外
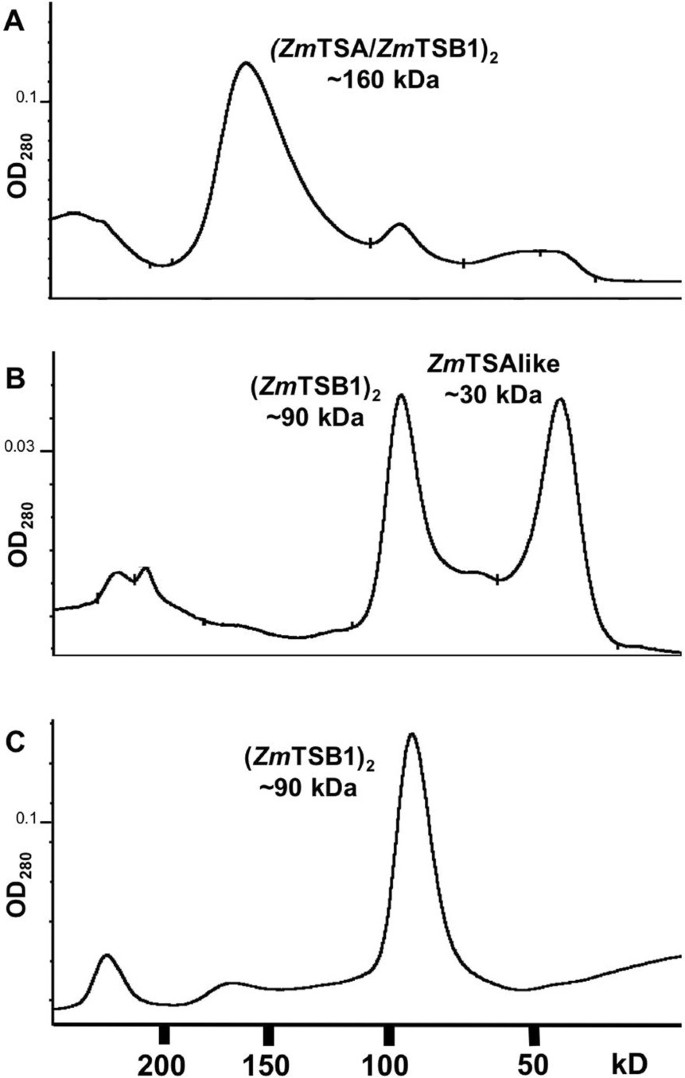
在细菌α中,TS复合物的活性比TSA单独的活性高两个数量级。因此,Zm评选允许TSA与纯化的重组蛋白相互作用Zm评选TSB1在4℃下1小时添加60 mM丝氨酸和50 μM吡哆醛磷酸盐。用…研究复杂的形成Zm评选TSB1在体外,Zm评选TSA /Zm评选TSB1混合物进行尺寸排除色谱(图3.).Zm评选TSA和Zm评选TSB1形成了约160kd的络合物(图3),根据SDS-PAGE分析(数据未显示),该蛋白以1:1的化学计量法包含两种蛋白质。这些结果与a的形成一致Zm评选运输安全管理局2Zm评选TSB12heterotetramer。的动力学参数Zm评选美国运输安全管理局,Zm评选TSB1,Zm评选TSA /Zm评选TSB1异构体的测定(表1).Heteromerisation与Zm评选TSB1使催化效率提高了32倍Zm评选TSA。
没有相互作用Zm评选TSB1与Zm评选TSAlike、BX1或IGL均可检测到。原生的分子质量Zm评选TSAlike、BX1和IGL经凝胶过滤估计在30kd左右,表明这些蛋白在溶液中是单体(图3 b数据没有显示)。Zm评选TSB1明显形成了约90kd的二聚体(图3 b, C).未观察到明显的较大络合物。Zm评选当β-亚基添加到制剂中时,以IGP为底物的TSAlike仍然不活跃(表2)1).用凝血酶消化蛋白重复实验,以排除由于His-tag引起的空间障碍而导致的配位不足,产生相同的结果(数据未显示)。
叶蛋白提取物中色氨酸合成酶活性
进行调查,是否α2β2TS络合物也会形成在活的有机体内B73野生型玉米和突变系的蛋白质提取bx1系列,Zmtsb1,Zmtsb2用粒径排除色谱法分离。分别对IGP转化为吲哚+甘油醛-3-磷酸(α反应)和吲哚+丝氨酸转化为色氨酸(β反应)进行了测试(图)4).在代表蛋白质的分数中。α-和β-活性均检测到160kd(应用K米显卡= 47±7 μm;应用K。米吲哚= 5±2 μm, b73)。在所有被测试的基因型中,该组分也能够进行总(αβ) TS反应(IGP到色氨酸的转化率为96到122 pmol mg)-1最小值-1).β-活性在约。90kd蛋白质,假设β-二聚体的大小。的Zmtsb1 Zmtsb2(orp1 orp2)双突变体缺乏β活性并表现出严重的生长缺陷[15].这里是各自的单个突变体Zmtsb1(orp1 + / orp1 orp2),Zmtsb2(orp1 orp2 / + orp2)进行了测试,每一种都在90 kD和160 kD的复组分中产生β-活性(图4 d).这表明Zm评选TSB1和Zm评选TSB2是功能冗余的,可以形成活性β-二聚体和活性αββα TS配合物。从B73野生型中提取,以及Zmtsb1或Zmtsb2突变体的第二个α-活性峰约为30 kD,对应于TSA同源物的单体大小。提取的bx1系列突变体的这种活性不存在,表明叶片中单体α-活性主要是由于BX1酶的活性。
Zm评选TSA是玉米色氨酸合成酶复合体的组成部分
目的:鉴定160 kD TS配合物的成分在足底采用质谱为基础的方法。序列限定肽,即允许注释的肽,得到的Zm评选美国运输安全管理局,Zm评选TSAlike, BX1, IGL,和Zm评选通过使用液相色谱-飞行时间质谱耦合电喷雾电离(LC-ESI-ToF-MS)分析重组蛋白的胰蛋白酶消化分析TSB1。将得到的多肽检测信号与理论上预期的胰蛋白酶肽质量进行比较[见附加文件]3.而且4].覆盖率为46.0%Zm评选美国运输安全管理局,为36.5%Zm评选TSAlike, 40.4%Zm评选TSB1、BX1和IGL分别为50.0%和56.9%。
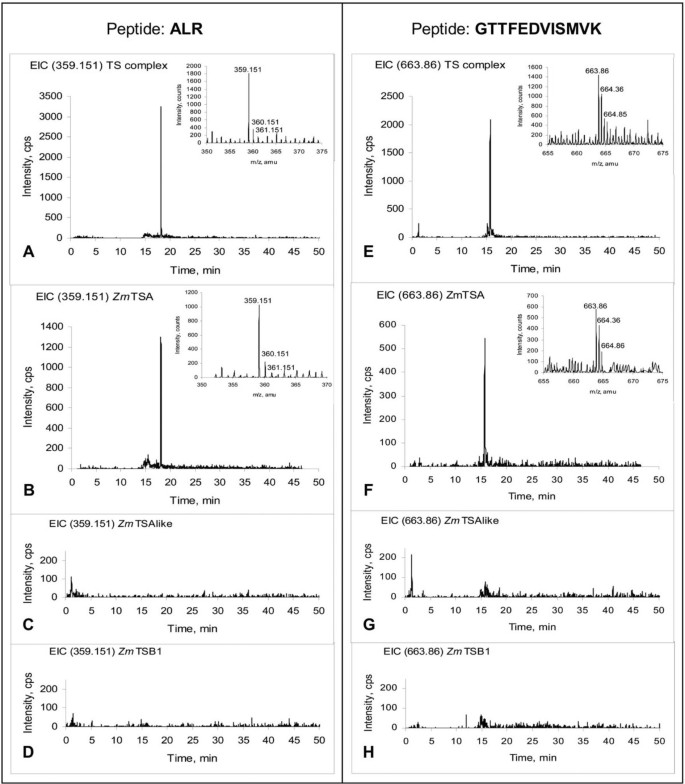
为了鉴定玉米TS复合物的活性α-亚基,通过离子交换和尺寸排除色谱法从玉米叶片提取物中部分纯化TS活性。将提取的160kd蛋白浓缩,SDS-PAGE分离。约之间的蛋白质。从凝胶中切割出25kd(小于TSA大小)和60kd(大于TSB大小)。用LC-ESI-ToF-MS分析这些蛋白的胰蛋白酶消化,并检测符合条件的肽序列Zm评选美国运输安全管理局,Zm评选TSAlike, BX1, IGL,和Zm评选TSB1。
四种多肽特征Zm评选TSA在含有活性TS的160kd部分的胰蛋白酶消化中作为主要肽信号出现(表2,图5).一个特定的随机十二肽的概率,如已识别的GTTFEDVISMVK,约为10-15年.因此,Zm评选TSA被确定为玉米TS复合物的组成部分。没有针对Zm评选检测到TSAlike、BX1或IGL[见附加文件]3.].ADGTGPLIYLK和DATSEAIR多肽被鉴定为高度相似的活性肽Zm评选TSB亚型。为Zm评选TSB1为特异性肽QALNVFR。没有Zm评选TSB2特异性肽被明确分配。然而,根据Zmtsb1变异分析(图4也很可能Zm评选TSB2存在于TS复合体中在活的有机体内.总之,Zm评选TSA和Zm评选TSB1经lc - esi - tof - msa鉴定为TS配合物的成分。
讨论
拟南芥的免疫亲和层析为植物中色氨酸合成酶α和β亚基的物理相互作用提供了证据[14)和玉米的粒径排除色谱法(本研究)。用于玉米色氨酸合成酶成分的鉴定在活的有机体内,通过LC-MS确定特异性序列限定肽。这种方法可以分析酶复合体,这些酶复合体不够稳定,不能应用更多种类的色谱分离,而色谱分离是纯化到均匀性所必需的。应用这种方法,Zm评选TSA被鉴定为色氨酸合成酶复合物的α-亚基。
表观分子量强烈表明,玉米色氨酸合成酶具有αββα异四聚体的功能,与细菌相似[30.,31].在玉米Zm评选TSA是络合物的主要α亚基。催化效率Zm评选TSA通过与β-亚基的相互作用增强了30多倍(表2)1).这种α-和β-亚基之间的激活相互作用在细菌中也很常见大肠杆菌(表1).在大肠杆菌这种激活是相互的,即β活性在α形成时强烈增加2β2TS复杂(32].相比之下,玉米β亚基没有明显的激活作用Zm评选观察TSA(表1).细菌酶和植物酶之间存在差异的原因尚不清楚。
在玉米中,祖先的tsa被用于二次代谢。TSA同源物BX1和IGL催化吲哚的形成,吲哚作为DIMBOA前体或挥发性信号[17- - - - - -19)(表1)和BX1单体活性观察叶提取物(图4).此外,在树叶提取物中观察到的TSB二聚体(图4),在体外(图3.),它可能通过转化为色氨酸来挽救吲哚。BX1单体和TSB二聚体之间的机制是否对色氨酸的总代谢通量有显著贡献仍未可知。的bx1系列突变和bx1系列igl双突变体(M. Frey,未发表数据)完全存活;因此,这个过程在开发的任何阶段都不是必要的。
我们认为,尽管存在高活性单体BX1和IGL,但玉米色氨酸主要是通过色氨酸合成酶复合体合成的Zm评选TSA和Zm评选TSB1或Zm评选分别TSB2。这个复合物可能在色氨酸合成的进化过程中被保留了下来,因为它使底物通道和变构调节成为可能。敲除突变体可以作为最终证据Zm评选TSA是至关重要的。因此,我们广泛筛选了公共数据库以及大型先锋HiBred TUSC集合μ转座子插入突变体[33在Zm评选TSA。然而,没有发现插入等位基因。它仍然是开放的,不管Zm评选Tsa敲除突变体是致命的。
基于进口研究、亚细胞分离和目标序列预测,有人认为在植物中芳香氨基酸的生物合成主要定位于质体(综述,参见[29])。与这些数据一致Zm评选TSA含有叶绿体靶向序列和Zm评选TSA: GFP融合蛋白靶向于质体(图2).有趣的是,TSA的同系物Zm评选TSAlike缺乏这样的转运肽和Zm评选TSAlike::GFP融合蛋白位于细胞质中(图2).芳香族氨基酸的生物合成是否在细胞质中也有部分活性一直存在争议,例如,拟南芥中表达了一种胞浆亚型的chorismate mutase [34].作为重组Zm评选TSAlike,表达大肠杆菌,没有显示任何α活性,尚不清楚Zm评选TSA类似于细胞质TSA亚型。Zm评选TSAlike可能需要特定的条件和修饰,或者在植物代谢中具有未知的功能。
结论
玉米中存在四种TSA同源物。这些异构体中只有一种Zm评选TSA参与了色氨酸合成酶复合体的形成。根据我们的数据和之前的结果拟南芥我们认为一种普遍存在的色氨酸合成酶复合体负责被子植物中色氨酸的形成,如真菌和细菌。
可用性和需求
玉米基因组数据库:http://www.maizegdb.org
缩写
- 雨:
-
乙腈
- bx1系列:
-
benzoxazinless1
- GAPDH:
-
glyceraldehyde-3-phosphate脱氢酶
- IGL:
-
indole-3-glycerol磷酸裂解酶
- 显卡:
-
indole-3-glycerol磷酸
- 运输安全管理局:
-
色氨酸合酶α亚基
- TSB:
-
色氨酸合酶β亚基
- wap:
-
周后授粉。
参考文献
- 1.
Gibbon BC, Larkins BA:开发优质蛋白玉米的分子遗传学方法。生物学报,2005,21(4):227-233。
- 2.
Huang S, Frizzi A, Florida CA, Kruger DE, Luethy MH:由19-和22-kD α -玉米蛋白减少引起的高赖氨酸和高色氨酸转基因玉米。植物生物学杂志,2006,31(3):525-535。
- 3.
植物生物碱生物合成:生物化学、细胞生物学、分子调控和代谢工程应用。植物生理学报,2001,27(3):369 - 369。
- 4.
Kriechbaumer V:色氨酸代谢网络中的生长素生物合成。纳米与生物技术学报,2005,2:55-58。
- 5.
张丽娟,张丽娟,张丽娟。拟南芥中吲哚-3-乙酸的合成、偶联、分解和稳态研究。植物生理学报,2004,25(4):369 - 371。
- 6.
Crawford IP:大肠杆菌色氨酸合成酶分离成两种蛋白质组分的研究。美国国家科学院学报。1958年,44:1161 - 1170。
- 7.
色氨酸合酶:一种具有分子内通道的多酶复合体。化学通报,2001,1(2):140-151。2002/03/15
- 8.
Miles EW:色氨酸合成酶:结构、功能和亚基相互作用。中华生物学报,1999,19(4):394 - 394。
- 9.
Leopoldseder S, hetwer S, Sterner R:多酶复合物的进化:以色氨酸合酶为例。生物化学,2006,45(47):14111-14119。
- 10.
色孢霉色氨酸合成酶的亚单位结构。中国生物医学工程学报,2004,25(4):369 - 369。
- 11.
最后RL, Bissinger PH, Mahoney DJ, Radwanski ER, Fink GR:拟南芥色氨酸突变体:复制色氨酸合酶β基因的后果。植物科学学报,1998,3(4):345-358。
- 12.
拟南芥色氨酸合成酶α亚基突变体的鉴定。中国生物医学工程学报,2004,25(3):356 -361。
- 13.
赵军,最后:拟南芥色氨酸生物合成酶的免疫学特性和叶绿体定位。中国生物医学工程学报,2004,23(4):369 - 369。
- 14.
赵娟,张晓燕,张晓燕,等。拟南芥色氨酸合成酶α基因的克隆、表达及亚基互作。中国生物医学工程学报,2004,24(6):557 - 557。
- 15.
Wright AD, Moehlenkamp CA, Perrot GH, Neuffer MG, Cone KC:玉米营养不良突变桔果皮在色氨酸合酶β的重复基因中存在缺陷。植物生态学报,1994,4(6):711-719。
- 16.
Wright AD, Sampson MB, Neuffer MG, Michalczuk L, Slovin JP, Cohen JD:变异玉米橙果皮中吲哚-3-乙酸的生物合成。科学通报,1994,25(5):593 - 598。
- 17.
Frey M, Stettner C, Pare PW, Schmelz EA, Tumlinson JH, Gierl A:一种草食动物激发子激活玉米吲哚释放基因。中国生物医学工程学报,2000,29(3):369 - 369。
- 18.
Frey M, Chomet P, glaischnig E, Stettner C, Grün S, Winklmair A, Eisenreich W, Bacher A, Meeley RB, Briggs SP, Simcox K, Gierl A:草中化学植物防御机制的分析。科学通报,1997,27(6):696-699。
- 19.
Kulik V, Hartmann E, Weyand M, Frey M, Gierl A, Niks D, Dunn MF, Schlichting I:两种进化相关的酶——鼠伤寒沙门菌色氨酸合成酶α亚基和玉米BX1的催化机制和调控的结构基础。中华分子生物学杂志,2005,32(3):369 - 369。
- 20.
Frey M, Spiteller D, Boland W, Gierl A:玉米吲哚形成基因Igl的转录激活:昆虫诱导活性n -酰基谷氨酰胺的结构-活性研究。植物生态学报,2004,29(4):359 - 359。
- 21.
Hamilton RH:一个缺乏2,4-二羟基-7-甲氧基-1,4-苯并恶嗪-3-酮的玉米突变体,对阿特拉津的耐受性改变。《杂草》1964,12:27-30。
- 22.
Bannai H, Tamada Y, Maruyama O, Nakai K, Miyano S: n端蛋白质分选信号的广泛特征检测。生物信息学,2002,18(2):298-305。2002/02/16
- 23.
Emanuelsson O, Nielsen H, Brunak S, von Heijne G:基于蛋白质n端氨基酸序列的亚细胞定位预测。中华分子生物学杂志,2000,300(4):1005-1016。2000/07/13
- 24.
大肠埃希菌色氨酸合成酶反应机理的稳态动力学研究。中国生物医学工程学报,2000,20(1):1-10。
- 25.
纽霍夫V型:用考马斯亮蓝染料在聚丙烯酰胺凝胶中染色,清晰的背景和高度敏感的蛋白质:系统分析。电泳,1985,6:427-448。
- 26.
Cutler SR: GFP::cDNA融合使拟南芥细胞亚细胞结构的可视化在高频率。美国国家科学院学报。2000年,97:3718 - 3723。
- 27.
辛:玉米丙酮酸、磷酸二激酶基因差异表达的分子机制。植物生态学报,1998,3(3):225-245。
- 28.
高等植物的转录代谢抑制。植物生态学报,2004,25(4):366 - 366。
- 29.
高等植物石草酯途径的分子组织。植物化学学报,2003,24(3):349 - 349。
- 30.
Kirschner K, Lane AN, Strasser AW:色氨酸合酶双酶复合体的裂解酶和合酶活性位点之间的相互交流。生物化学,1991,30(2):472-478。
- 31.
Weischet WO, Kirschner K:大肠杆菌色氨酸合成酶α亚基催化合成磷酸吲哚甘油的稳态动力学研究。与alpha2 β 2复合体的比较。中国生物医学工程学报,2004,25(2):369 - 369。
- 32.
Lane AN, Kirschner K:大肠杆菌色氨酸合成酶的催化机理。吲哚与l -丝氨酸配合物反应的动力学。中国生物医学工程学报,2003,24(3):369 - 369。
- 33.
Mena M, Ambrose BA, Meeley RB, Briggs SP, Yanofsky MF, Schmidt RJ:玉米花发育过程中c功能活性的多样性。科学通报,1996,29(5):533 - 536。
- 34.
Eberhard J, Ehrler TT, Epple P, Felix G, Raesecke HR, Amrhein N, Schmid J:拟南芥胞质和可塑性chorismate mutase同工酶的分子表征和酶学性质。植物学报,1996,10(5):815-821。1996/11/01
- 35.
Kawasaki H, Bauerle R, Zon G, Ahmed SA, Miles EW:斑疹伤寒沙门菌色氨酸合成酶α亚基的位点特异性突变。将精氨酸179改为亮氨酸改变了底物诱导的α和β 2亚基之间构象变化的相互传输。中国生物医学工程学报,1998,22(4):378 - 378。
- 36.
Stettner C: DIMBOA-Biosynthese in Mais: Isolierung und funktionelle Charakterisierung des Bx1-Gens。Lehrstuhl für Genetik, TU München 1998。
确认
我们感谢U. Genschel对手稿的评论,并感谢K. Fütterer和S. Grosse的实际帮助。安捷伦技术公司获得了HPLC系统的贷款。这项工作得到了德国Forschungsgemeinschaft的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
VK设计、实施和分析了大部分的实验,并支持起草手稿。LW进行了LC-MS分析。AF分析了蛋白质的亚细胞定位。TL设计并监督LC-MS分析和解释。MF进行了转录分析,监督定位研究和克隆,并修改了手稿。AG构思了这个项目,协调了小组,并修改了手稿。EG负责督导项目,支持实验设计和分析,撰写稿件初稿。所有作者阅读并批准了该手稿。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
克里奇鲍默,V.,魏钢,L.,菲ßelmann, A。et al。玉米色氨酸合酶α亚基的特征。BMC植物杂志8日,44(2008)。https://doi.org/10.1186/1471-2229-8-44
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-44
关键字
- 色氨酸
- 吲哚
- 尺寸排阻色谱法
- 色氨酸生物合成
- 玉米原生质体