摘要
背景
对流层臭氧是最丰富的空气污染物,对包括人类在内的动植物健康有害。在敏感的植物物种中,即使暴露在这种强氧化剂(200 - 300nl)中几个小时。l-1)导致严重的氧化应激,表现为可见的细胞死亡。在具有抗性的植物中,暴露在类似臭氧浓度下通常观察不到明显的症状。植物对急性臭氧的自然变化为研究植物对臭氧响应差异的分子基础提供了宝贵的资源。从我们之前的研究中Medicago truncatula结果表明,Jemalong是臭氧敏感品种,PI 464815 (JE154)是臭氧抗性品种。分析臭氧敏感和耐臭氧的转录组变化,将为理解调控植物臭氧反应的分子变化提供重要线索。
结果
急性臭氧处理(300nl L-1)导致敏感的Jemalong在熏蒸6小时后出现活性氧(ROS)爆发。与Jemalong相比,在耐药JE154中ROS水平的增加大大降低。基于ROS分析结果,进行微阵列分析的时间点为臭氧处理后1小时、处理结束和12小时臭氧诱导的ROS爆发。利用17k寡核苷酸阵列对这两个种质进行了重复转录组分析,结果显示有2000多个基因存在差异表达。使用聚类富集分析程序鉴定显著富集的基因本体(GOs)。一个引人注目的发现是JE154在改变其基因表达模式以响应臭氧方面的敏捷性,与Jemalong的延迟转录反应形成鲜明对比。参与信号、激素途径、抗氧化剂和次生代谢的GOs在两种材料中都发生了改变。然而,在这些类别中反应的基因库在两个品系之间是不同的。实时PCR分析证实了这些基因的一个子集的差异表达模式。
结论
这项研究提供了一个令人信服的观点,在一个独特的和共享的转录反应的臭氧抵抗和敏感接入,例证了植物氧化信号的复杂性。基于这项研究和拟南芥的相关文献,我们推测对急性臭氧敏感的植物对这种氧化剂作用产生的初始信号的感知能力受损。这反过来又导致臭氧敏感植物的转录反应延迟。在抗性植物中,几种信号通路的快速和持续激活能够部署多种机制,以最大限度地减少这种反应分子的毒性作用。
背景
臭氧是对流层烟雾的主要成分,由于其氧化性质,对生命有害。[1,2].在臭氧敏感的植物中,急性暴露于这种有毒污染物会导致叶肉细胞不受控制地死亡,从而导致坏死[3.,4].在同一物种的抗性植物中,暴露在相似的臭氧浓度下没有明显的细胞死亡。生理参数,特别是气孔导度被认为是决定植物对臭氧敏感性的重要因素,因为它决定了多少臭氧能进入细胞[5,6].然而,一些研究表明,在各种植物中,臭氧敏感性与气孔导度之间的相关性很差[7- - - - - -9].
臭氧在细胞壁界面处迅速降解为各种ROS种类[10- - - - - -12].植物对臭氧敏感性的一个生化标志是臭氧处理后的外质体ROS爆发,这种爆发在耐臭氧植物中不存在或减少[12- - - - - -14].ROS作为信号分子的作用正受到越来越多的关注[15- - - - - -20.].因此,植物对臭氧的反应必须在ROS在高浓度时具有细胞毒性,在较低浓度时作为关键信号分子的背景下进行检查[21- - - - - -24].
臭氧引起的ROS代谢改变会影响植物整体的氧化还原状态[24- - - - - -26].抗氧化剂,如抗坏血酸和谷胱甘肽,氧化还原信号的关键成分,已报道在臭氧的响应下发生变化[4,8,27- - - - - -34].鉴于抗坏血酸酯是对抗臭氧的第一道防线,抗坏血酸酯水平的差异已被认为是决定植物对臭氧的抗性或敏感性的一个主要因素[35].这得到了拟南芥的支持vtc1突变体,其抗坏血酸水平降低,对臭氧敏感[29].由于抗坏血酸是一种重要的信号转导分子[36在这种抗氧化剂含量较低的植物中,大量的基因表达重编程已被证明[37].同样,臭氧与抗坏血酸的相互作用可能导致大量的转录组变化。
植物激素水杨酸(SA)和乙烯(ET)是氧化应激信号的重要第二信使,在臭氧介导的细胞死亡过程中参与损伤起始和传播[5,38- - - - - -44].茉莉酸(Jasmonic acid, JA)通过下调SA和ET在PCD遏制中发挥重要作用[40].据报道,具有较高乙烯含量的拟南芥生态型和突变体对臭氧敏感[42,43].因此,不同植物中臭氧的自然变化可能是由于植物激素水平的内在差异。
有几份报告使用微阵列检测植物基因表达对臭氧的响应变化[4,45- - - - - -50].这些研究大多集中在耐臭氧或臭氧敏感的品系上,或在一个时间点上检测基因表达的变化。这些研究之间的交叉比较受到臭氧处理条件、微阵列平台和植物物种差异的阻碍。在这项研究中,我们使用臭氧敏感的Jemalong和耐臭氧的JE154加入对急性臭氧处理的基因表达变化进行了时间过程分析。选择的时间点为治疗开始后1小时、6小时和12小时。我们提出了这个微阵列分析的结果,并讨论了重要的基因本体论(GOs)是独一无二的m . truncatula这些基因在臭氧/ROS信号通路中的可能作用。
结果
臭氧处理的截叶M的ROS谱
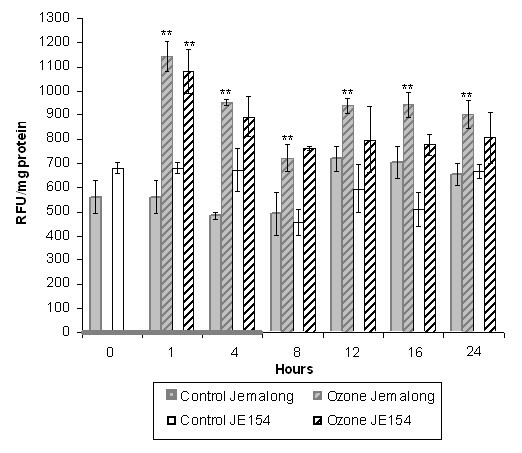
两种标本的ROS分析显示,熏蒸过程中1小时内“臭氧来源”的ROS峰值(图1).尽管JE154的气孔导电性低于Jemalong [8]这一数据表明,两种处理的臭氧进入和初始反应相似。治疗开始12小时后,在Jemalong观察到明显的“植物源性”ROS爆发(图1).Jemalong在治疗开始后24小时内仍保持高水平的ROS。臭氧熏蒸后JE154的ROS水平略高于对照,但无统计学意义。一个有趣的观察结果是,与Jemalong相比,JE154对照植物的ROS天生水平更高。ROS分析为选择时间点进行表达式分析提供了基础。之所以选择一个小时的时间点,是因为在两个样本中,臭氧产生的ROS水平都显著上升。6个小时的时间点代表臭氧熏蒸的结束。12小时的时间点标志着Jemalong持续的植物源性ROS爆发的开始。
臭氧引起基因表达模式的变化
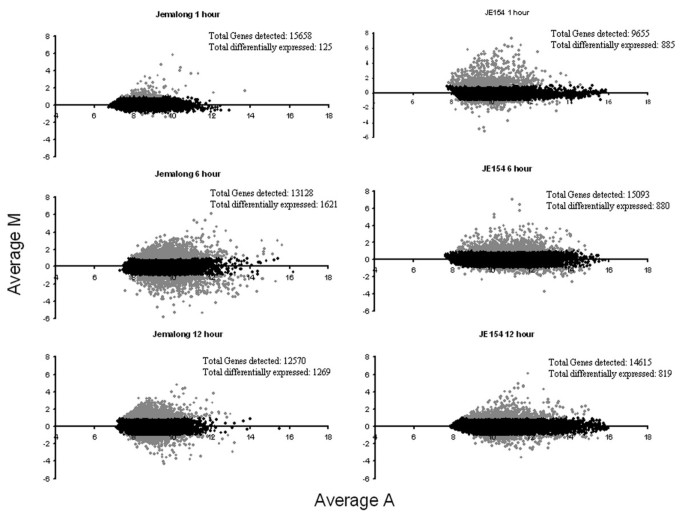
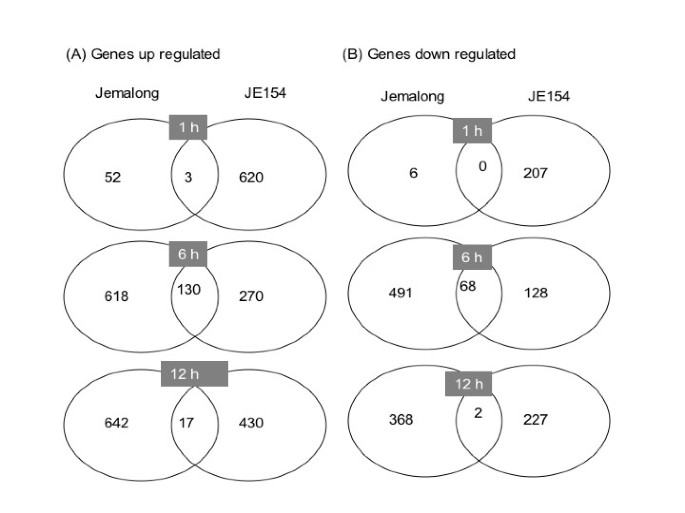
生物重复的微阵列数据的总体相关性在0.7-0.87之间。在JE154中,2102个基因在臭氧响应的所有三个时间点上表达差异,而在Jemalong中,2397个基因被分类为臭氧响应[见附加文件]1,2,3.,4,5,6].虽然两个种质间差异表达的基因总数相似,但在三个测试时间点上观察到显著差异。比例-强度图显示了两种种质在基因表达的时间模式上在数量和方向上的显著对比(图2)2).在Jemalong中,上调和下调调控基因的变化模式相似。在臭氧处理的早期,转录组的变化很少,而在处理结束时观察到最大的变化。与6小时时间点相比,治疗后差异表达的基因数量略低(图3.).在JE154中,诱导基因数量的变化与Jemalong相反,在臭氧处理早期诱导基因最多,在臭氧处理结束时变化较少。与Jemalong一样,臭氧处理后诱导基因的数量增加。这些诱导基因的对比模式可能是导致这些资源之间臭氧相关表型差异的重要因素。在JE154中,下调基因的数量在三个时间点上是相似的(图3.).
通常在处理结束时,不同品种间的差异表达基因达到最大值。在一项对敏感和抗性辣椒品种臭氧反应基因的研究中也报道了类似的模式[46].尽管JE154在12小时时间点(与6小时时间点相比)有更多的诱导和抑制基因,但在这个时间点与Jemalong差异表达基因的重叠非常低(图3.).这表明臭氧处理后不同的信号通路发生了改变,这可能对臭氧表型的表现至关重要。
臭氧反应基因的基因本体
为了深入了解不同种质间差异表达基因的生物学意义,我们使用聚类富集分析(clustered Enrichment Analysis, CLENCH)检测了GOs [51].包含三个或三个以上基因的非重叠GOs见表1.氧化石墨烯的三个层次分类(过程、功能和隔室)在鉴定臭氧响应基因时都是重要的。在JE154中,17个GOs在治疗1小时后被确定为显著(表2)1).6小时时,杰马隆有35个自治政府代表明显过多。这与在这个时间点发现的差异表达基因数量最多的事实是一致的。在JE154中,12小时后,14个独特的GO基因被上调,4个被下调。在Jemalong中,12小时观察到相反的模式,其中11个GOs被抑制,5个GOs上调。尽管Jemalong在12 h诱导的基因比JE154多33%,但鉴定出的GOs数量非常低,表明敏感植物的反应不协调。JE154诱导基因中有4个GOs(损伤反应、SA反应、紫外线反应、多药转运)在所有时间点都是相同的,而Jemalong中没有一个符合这一标准。JE154诱导基因组中的5个GOs (Defense response, response to JA, response to氧化应激,Cellulose and pectin containing cell wall, ER)在两个时间点上是相同的。在Jemalong中被抑制的基因中,GO类别、对JA的反应和养分库活性在6小时和12小时时都得到了增强(表2)1).
JE154和Jemalong的go反应截然不同
氧化应激反应
氧化应激反应基因GO - 9个基因中有7个在12 h时受到相反的调控。其中HSP17.6、过氧化物酶73、钙网蛋白、异黄酮还原酶、查尔酮合成酶、2-烯烃还原酶和SAG21在JE154中表达上调,而在Jemalong中表达被抑制。JE154中过氧化物酶和2-烯烃还原酶的诱导表明抗性加入在减少氧化损伤方面是主动的。Jemalong中这些基因的下调可能导致ROS的积累和随后的氧化细胞死亡。
响应SA和JA
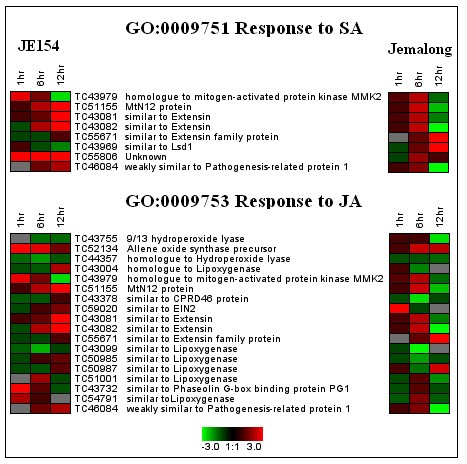
通过CLENCH分析,在JE154和Jemalong中都发现了几种与植物激素相关的GOs。只有JE154在1小时时间点观察到SA和JA反应基因显著上调(图4).我们推测,与Jemalong相比,JE154可能由于更高的内在ROS而迅速增加其SA水平(图1).臭氧处理一小时后,两种土壤的ROS水平相似,这进一步证实了这一点,但Jemalong没有出现氧化石墨烯。JE154中较高水平的ROS也有可能降低sa诱导基因诱导的阈值水平,因为这个GO在6小时和12小时的时间点也上升了。
与JA刺激相关的基因在各种质间表现出显著差异。JE154中JA反应基因在1小时和12小时时间点上调,在6小时时间点下调。JE154中12小时JA生物合成基因的富集表明这种植物激素可能在抑制ros诱导的细胞死亡中发挥保护作用[52].Jemalong的JA反应基因在6小时和12小时被抑制。与乙烯信号相关的基因在Jemalong的12 h时间点下调。在Jemalong中,SA、JA和乙烯信号通路被抑制,而在JE154中,JA的生物合成和SA、JA通路相关基因被诱导。激素信号基因的不同反应支持了这样一种观点,即植物激素在决定植物对臭氧的反应中起着重要作用[5,40,53].
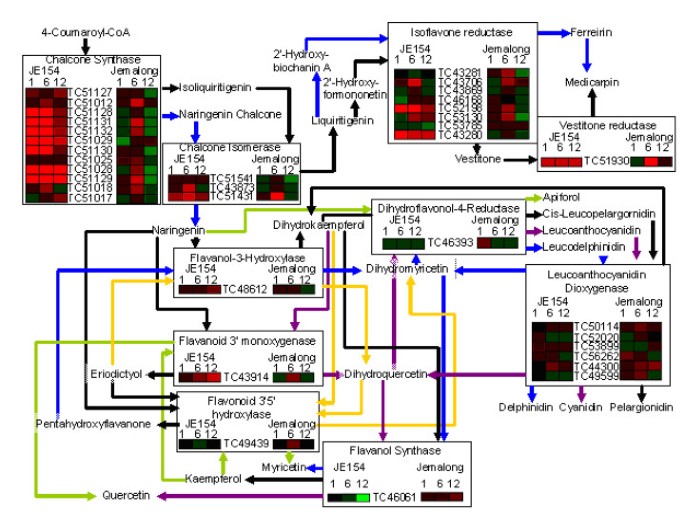
类黄酮途径
在臭氧响应的所有时间点上,JE154中观察到参与类黄酮生物合成的基因转录的增加(图5).Jemalong在6小时后才显示出类黄酮生物合成基因的调节。此外,上调水平低于在JE154中观察到的上调水平。我们重点鉴定了两种资源之间不同调控的类黄酮途径的子集。在1小时时间点,JE154上调了导致medicarpin生物合成通路相关基因的表达,而Jemalong下调了查尔酮合成酶同源物的表达。6小时后,两种处理均上调了类黄酮生物合成途径中的大部分基因(图5).显著的差异是JE154在几个基因中有更大程度的上调,最显著的是查尔酮合成酶同源物。考虑到查尔酮合成酶在整个途径中的关键作用,显著的上调可能最终导致更广泛的类黄酮化合物[54,55].
12小时后,JE154上调了导致medicarpin合成的基因,以及二氢山奈酚和二氢槲皮素(图5).此外,JE154还下调了以二氢山奈酚和二氢槲皮素为底物合成黄酮醇的黄酮醇合成酶[56,57].随着黄酮-3-单加氧酶的上调,负责将二氢山奈酚转化为二氢槲皮素的酶[58],在JE154中12小时,数据表明二氢槲皮素的积累。在Jemalong中,我们观察到一个普遍下调的途径,特别是导致medicarpin,和上调的白花青素双加氧酶同源物,参与黄酮醇生物合成。
是JE154独有的
异戊二烯生物合成
类异戊二烯已被证明是植物中重要的抗氧化剂,特别是在对臭氧的反应中[59].在JE154的12小时时间点,类异戊二烯生物合成途径中的关键基因被强烈上调。异戊二烯生物合成的胞质和质体途径基因均上调。在脱氧-木酮糖途径中,第一个作用酶是脱氧-木酮糖-5-磷酸还原酶,倒数第二个作用酶是异戊二烯-二磷酸合酶。胞质米黄酸途径中第一个参与的酶3-羟基-3-甲基戊二酰辅酶a还原酶也被上调。在细胞质和质体区室中参与异戊二烯生物合成的关键基因的激活表明异戊二烯在JE154对臭氧的抗性反应中起着重要作用。
这是詹姆龙独有的
过氧化物酶活性
在6小时的时间点,Jemalong上调了6种不同的过氧化物酶,这表明它正在采取积极措施减少ROS的数量。有趣的是,这种氧化石墨烯(由6个基因中的5个组成)在12小时的时间点被下调。与过氧化物酶的下调一致,在Jemalong中观察到ROS水平的增加持续了24小时(图1).
抗坏血酸生物合成
在Jemalong的6小时时间点,抗坏血酸生物合成中的两个重要基因,gdp -甘露糖-1-磷酸guananyl转移酶和gdp -甘露糖外素酶下调。同时,编码l -抗坏血酸氧化酶的铜离子结合蛋白上调。在烟草植物中,该酶的同源物定位于外质体,在其中它氧化抗坏血酸,从而增强臭氧敏感性[34,36].我们推测,由于较高水平的ROS和伴随的抗坏血酸生物合成的减少,抗坏血酸的氧化可能导致Jemalong臭氧敏感性的增加。
实时PCR分析
我们用实时荧光定量PCR检测了15个基因的表达变化。根据基因在1小时、6小时或12小时的表达变化来选择基因。选择Jemalong或JE154特有的基因进行分析。来自jemalong的4个基因和来自JE154的11个基因与微阵列数据比较结果一致(表1)2).
讨论
ROS爆发在植物中很常见,是对环境扰动的响应,由多个细胞过程产生[60- - - - - -65].基于活性氧对臭氧和无毒病原体反应的相似性,臭氧已被描述为植物中活性氧的典型非生物激发子[66].以前的研究表明,在臭氧敏感的植物中,臭氧处理后会产生ROS爆发,而同一物种的抗臭氧植物中不存在这种情况[12- - - - - -14,41].我们的研究证实,在敏感人群中存在持续的ROSM truncatula入世杰玛隆,臭氧后处理。在耐药JE154的12 h时间点观察到ROS水平有很大变化。这可能是由于以前在其他植物品种的抗性材料中报道的零星显微细胞死亡[5,67].
的时间转录组分析M truncatula这些数据提供了对臭氧抗性或敏感性很重要的基因表达和类型的差异的见解。大量的转录组变化,特别是大量的转录因子[见附加表]7]和早期差异调控的信号基因可以帮助JE154快速适应胁迫。下调翻译起始过程可能允许JE154调整其蛋白质组,以限制臭氧诱导ROS造成的损伤程度(表2)1).相反,Jemalong在早期时间点的转录应答减弱表明臭氧来源的ROS的感知和/或信号通路薄弱,即使一小时内的ROS水平与JE154相似(图1).
我们推测,激酶活性的早期上调,特别是oxe1激酶的同源物[68], mapkkk [69]和几种钙/钙调蛋白依赖蛋白激酶促进了JE154转录组向防御性的重编程。JE154中防御和激素反应基因的持续上调可能有助于观察到的臭氧抗性。相反,Jemalong的防御反应基因和激素反应基因下调,特别是在ROS水平显著高的12小时时间点,可能导致其对臭氧诱导的氧化应激的易感性。
拟南芥和烟草植物中SA积累的增加与臭氧敏感性有关[41,70].在逆境中,SA增强了光合组织中ROS的生成,而ROS反过来又在前馈自我放大回路中触发SA的产生[41,70- - - - - -72].近年来的研究表明,在拟南芥植物中,病原菌诱导的NADPH氧化酶衍生的ROS抑制细胞死亡,并依赖于SA [73].人们很容易推测,在JE154中,臭氧诱导的ROS和SA可能同样抑制细胞死亡。Jemalong过氧化物酶基因在12h时间点下调可能导致ROS的积累。再加上JA信号通路的抑制,这可能会导致Jemalong细胞死亡病变的扩散。
Jemalong的臭氧诱导表型的另一个方面是广泛的褪绿症。在对几个大豆品种臭氧响应的比较研究中,高气孔导度伴随叶绿素损失是敏感品种的共同特征[74].Jemalong的气孔导度高于JE154 [8], Jemalong在6小时内参与叶绿素生物合成的基因下调支持了所观察到的表型,并与大豆品种臭氧敏感性的报道一致。
基于微阵列数据的比较,转录对臭氧和UV-B的反应有相似的报道[75].这种共同的反应可能是由于产生了抗氧化剂异黄酮类化合物[76- - - - - -78].鉴于这些豆类天然产品的重要性[79,80],我们检查了聚焦于类黄酮通路的微阵列数据(图5).鉴于二氢槲皮素和槲皮素性质的差异,类黄酮通路在12小时时间点的差异表达谱是至关重要的。二氢槲皮素因其在动物系统中的抗氧化特性而被研究,它能够作为一种低毒性的抗氧化剂[81- - - - - -84].它还被发现可以抑制大鼠的脂质过氧化[82].由于JE154上调了黄酮-3-单加氧酶,我们推测它可能通过二氢槲皮素的抗氧化作用降低了12小时的ROS水平。此外,下调黄酮醇合酶可能有助于防止槲皮素的积累。有趣的是,二氢槲皮素和槲皮素在结构上因一个双键而不同,但在响应细胞应激时却有非常不同的性质[85].在暴露于热应激和化学处理的人内皮细胞中,槲皮素显著增加细胞死亡,而二氢槲皮素处理导致细胞死亡率与对照细胞相似[85].这表明JE154对臭氧的抗性可能是由于它能够调节类黄酮通路,以最大限度地提高抗氧化剂促进细胞存活。
在JE154中,异戊二烯生物合成途径的上调可能是限制臭氧熏蒸后ROS水平的重要因素。异戊二烯对臭氧环境下的植物具有很强的抗氧化作用,并能降低细胞膜,特别是叶绿体膜的脂质过氧化[59,86].因此,JE154的臭氧抗性表型可以归因于它对压力的快速反应和它招募的防御、激素和抗氧化基因的多样性。Jemalong对臭氧最初的迟缓反应,由于抗坏血酸生物合成和激素信号通路的下调而加剧,可能有助于其敏感性。
结论
截断木对急性臭氧自然发生的遗传变异为氧化信号通路的分子遗传分析提供了有用的资源。敏感株Jemalong和抗性株JE154对急性臭氧熏蒸反应的ROS水平存在显著差异。在处理过程中,臭氧产生的ROS爆发在两种资源中是相似的。然而,臭氧诱导的ROS在处理结束6小时后爆发,在两种处理之间是不同的。ROS谱分析显示,与烟草类似,在截叶木中,抗性JE154中观察到臭氧响应的双相ROS爆发,而在敏感Jemalong中则没有。其次,这两种材料中生理相关的植物内诱导ROS的显著差异为检测该时间点基因表达的差异提供了令人信服的理论依据。
同时使用耐臭氧接入和敏感接入进行时间过程表达谱分析对于理解基因表达响应臭氧变化的时间动态非常有用。最引人注目的发现是,与JE154基因表达的巨大变化相比,Jemalong在早期时间点上似乎有naïve反应。我们在拟南芥的臭氧敏感Ws-0生态型中也观察到了类似的反应[4].这表明,在抗性植物中,臭氧或臭氧诱导的信号分子被迅速感知,这反过来导致下游信号事件的激活。利用这两种接入的作图策略将有助于鉴定这种耐臭氧基因。此外,对其他植物物种中耐臭氧和敏感系的检测将有助于确定臭氧敏感性是否是由于基因表达变化的被动反应。
在抗性JE154中,转录组分析表明多种信号通路如植物激素、抗氧化剂、防御反应和次生代谢的早期和持续激活。在拟南芥的耐臭氧哥伦比亚生态型中已报道了多种信号通路的诱导[47,49,50].如上所述,对其他植物物种的抗臭氧和敏感系的检测将有助于确定一组常见的臭氧响应基因,这可以用于筛选作物植物种质,在植物育种计划中增强臭氧抗性性状。
方法
植物生长条件
基于JE154和Jemalong对臭氧胁迫的不同反应,本研究选择了它们[8].植物在Metro Mix 200 (scott - sierra园艺产品公司,Marysville, OH)的生长室中在100 μmols的光源下栽培-1米-2光照时间为10小时,黑暗时间为14小时,环境温度为O3.水平(25-30 nmol mol-1)五十天。植物种植在2英寸的花盆中,每个花盆有1-2株植物。花盆放在塑料托盘上,每隔3-5天用Peters Excel 15-5-15肥料浇水(scott - sierra园艺产品公司,Marysville, OH)。
臭氧处理
JE154和Jemalong的50日龄植株暴露在300 nL L的环境中-1在上午10点到下午4点之间持续6个小时。对照植物在环境臭氧条件和相同的照明和温度设置的生长室内。在每个时间点从三个不同的花盆中随机选择植物。每株至少有3-4株三叶。分别于处理开始后0、1、4、6、8、12、16、24小时收获幼叶和老叶,液氮冷冻,-80℃保存。进行了两次生物复制,并将相应时间点的叶片样本汇集起来进行ROS分析和芯片实验。
ROS量化
如前所述,使用Versa-Fluor荧光计(Bio-Rad)在对照和臭氧处理的叶片样品中测量ROS [8].实验重复四次,结果取平均值。
微阵列和杂交技术
含有70 mer寡核苷酸的微阵列载玻片来自Samuel Roberts Noble Foundation,并在前面描述[87].
使用Trizol试剂(Invitrogen, Carlbad, CA)在臭氧处理开始后1小时、6小时和12小时从叶片样品中分离总RNA。RNA质量采用GAPDH基因特异性探针进行northern blot分析。
用Cy-3和Cy-5染料进行氨基烯丙基标记[49].在大多数杂交中,对照cDNA用Cy3标记,臭氧处理样品用Cy-5标记。每个时间点进行一次技术重复,对照cDNA用Cy5标记,臭氧处理样品用Cy-3染料标记。杂交在42°C下进行过夜。将载玻片用2 × SSC、0.2% SDS冲洗5分钟,然后依次用1 × SSC冲洗3分钟,0.5 × SSC冲洗2分钟,1 × SSC冲洗1分钟,0.05 × SSC冲洗15秒。将载玻片在500转/分的离心机中旋转5分钟,然后在阵列扫描仪(ScanArray Express, PerkinElmer Life Sciences, Boston, MA)中进行扫描。
微阵列数据分析
本研究共使用19张微阵列载玻片。对于Jemalong,在1小时和6小时时间点进行了4个生物重复,在12小时时间点进行了3个重复。JE154杂交在1小时和6小时时间点有3个生物重复,在12小时时间点有2个重复。扫描图像使用GenePix软件(Molecular Devices, Toronto)进行分析。网格划分是利用Noble Foundation (Ardmore, OK)提供的地图文件进行的。在两个染料通道上显示信号饱和的斑点被标记并从分析中删除。使用信号强度的平均值。背景值为300,是根据本分析所考虑的载玻片非斑点区域的平均荧光强度选择的。
GenePix分析的预处理结果输入GenePix自动处理器(GPAP) [88,这是一个基于网络的应用程序,利用R(统计计算和图形学语言)和Bioconductor(基因组学数据集免费软件)。使用局部LOWESS归一化来平衡绿色和红色通道之间的平均荧光强度。基于该程序选择基因表达发生2倍或2倍以上变化(p值< 0.05)的基因进行进一步详细分析。
聚类富集分析
握紧拳头2.0 [51]对微阵列数据进行分析,获得丰富的基因本体聚类。自m . truncatula基因组的特征不如答:芥,基因进行BLAST搜索答:芥同系物和用于CLENCH分析。总基因列表由每次加入和每个时间点在微阵列上可靠检测到的所有基因组成。统计学意义上的上调和下调基因在每个时间点分别进行分析。Slim-Terms(由TAIR提供)是完整GO术语的一个更粗略的视图,在此分析中使用。
类黄酮途径的模板是从KEGG数据库中检索的[89].使用Microsoft Paint程序对路径进行修改和颜色编码。从微阵列分析中得到的热图是使用Genesis程序生成的[90].
实时PCR分析
用于微阵列分析的总RNA被稀释至约200 ng/uL。使用上标逆转录酶(Invitrogen),将该总RNA的1微克用于cDNA合成,按照制造商的说明进行。用1:10和1:20稀释cDNA进行实时PCR分析。
选取JE154和Jemalong在不同时间点上调和下调的基因进行分析。在这两个品系中表达相等的四个基因被用作对照。引物使用Primer express program (Applied Biosystems)设计,扩增80-100碱基对片段,所用引物列于表中2.
采用iQ SYBR Green kit (Bio-Rad)进行实时RT-PCR,每次25 μL反应,加入12.5 μL Master mix、0.75 μL 10 μM正、反引物和1 uL cDNA模板。使用GeneAmp 7500 Real Time PCR仪运行和分析样品,循环协议为95°C 10分钟,95°C 15秒,52°C 20秒,72°C 45秒,共40个循环。
用delta delta- ct法对对照基因进行归一化。使用不同的cDNA制剂重复实验两次,用标准偏差绘制两个重复的平均delta - delta Ct值。为了确定delta Ct值,用臭氧处理样品的平均Ct值减去对照样品的平均Ct值。折叠变化的计算方法是将delta Ct值乘以2。为了调整cDNA浓度的差异,对三个时间点中每个时间点表达相似的基因进行实时PCR。为了调整cDNA浓度的差异,从这些实验中产生的折叠变化值然后从样品的折叠变化中减去。Jemalong 1小时,Jemalong 12小时,JE154 6小时,用TC56786基因建立cDNA浓度差异。用TC51792基因归一化Jemalong 6小时的cDNA浓度差异。用TC46232基因归一化JE154中cDNA浓度的差异,1小时。最后用表达没有变化的TC46973和TC52875两个基因的平均值,建立JE154 12小时时间点cDNA浓度的差异。
参考文献
- 1.
Heagle AS:臭氧和农作物产量。植物病理学杂志,1998,27(3):397-412。
- 2.
Murphy JJ, Delucchi MA, McCubbin DR, Kim HJ:机动车臭氧空气污染对作物的影响。环境科学学报,1999,29(3):344 - 344。10.1006 / jema.1999.0256。
- 3.
Long SP, Naidu SP:氧化剂在生物化学、细胞和生理水平上的影响,特别是对臭氧的影响。空气污染与植物生命。编著:Bell JNB, Treshow M. 2002,伦敦:J. Wiley, 69-88。
- 4.
马海林,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕。臭氧诱导拟南芥氧化信号通路的研究进展。植物生态学报,2006,29(4):457 - 457。10.1111 / j.1365-3040.2006.01516.x。
- 5.
杨晓明,王晓明,王晓明,等。臭氧胁迫下植物细胞凋亡与信号通路的关系。植物细胞与环境,2005,28:1021-1036。10.1111 / j.1365-3040.2005.01325.x。
- 6.
Saji S, Bathula S, Kubo A, Tamaoki M, Kanna M, Aono M, Nakajima N, Nakaji T, Takeda T, Asayama M, Saji H:拟南芥c -4-二羧酸转运体样蛋白编码基因的破坏通过调节气孔反应来增加臭氧敏感性。植物生理学报,2008,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcm174。
- 7.
Karenlampi L, Metsarinne S, Paakkonen E:桦树叶片的气孔导度-在决定臭氧剂量的变量中有很多变化。环境科学学报,1998,36(3):344 - 344。10.1016 / s0045 - 6535(97) 10106 - 0。
- 8.
王晓明,王晓明,王晓明,等:臭氧诱导氧化胁迫对紫花苜蓿生理生化特性的影响。植物化学学报,2007,45:70-79。10.1016 / j.plaphy.2006.12.004。
- 9.
杨晓明,李志刚,李志刚:空气污染物对植物气孔行为的影响。实验植物学杂志,1998,49:461-469。10.1093 / jexbot / 49. suppl_1.461。
- 10.
Kanofsky JR, Sima PD:臭氧与植物叶片反应产生单线态氧。生物化学学报,1995,27(3):357 - 357。10.1074 / jbc.270.14.7850。
- 11.
梅尔霍恩,张志刚,张志刚:臭氧胁迫下植物自由基形成的电子自旋共振证据。植物生理学报,2000,27(3):377- 388。10.1111 / j.1399-3054.1990.tb06756.x。
- 12.
Schraudner M, Moeder W, Wiese C, Van Camp W, Inze D, Langebartels C, Sandermann H:臭氧生物监测植物臭氧诱导氧化爆发,烟草Bel W3。植物学报,1998,16:235-245。10.1046 / j.1365 - 313 x.1998.00294.x。
- 13.
Wohlgemuth H, Mittelstrass K, Kschieschan S, Bender J, Weigel HJ, Overmyer K, Kangasjarvi J, Sandermann H, Langebartels C:氧化爆发的激活是暴露于空气污染物臭氧的敏感植物的普遍特征。植物生态学报,2002,25:717-726。10.1046 / j.1365-3040.2002.00859.x。
- 14.
杨晓明,李志强,李志强,等。臭氧诱导白桦叶片细胞产生过氧化氢的亚细胞定位。植物学报,1999,20:349-356。10.1046 / j.1365 - 313 x.1999.00613.x。
- 15.
Apel K, Hirt H:活性氧:代谢,氧化应激和信号转导。植物学报,2004,29(3):344 - 344。10.1146 / annurev.arplant.55.031903.141701。
- 16.
Gadjev I, Vanderauwera S, Gechev TS, Laloi C, Minkov IN, Shulaev, Apel K, Inze D, Mittler R, Van Breusegem F:拟南芥转录组足迹揭示活性氧信号的特异性。植物生理学报,2006,29(4):344 - 344。10.1104 / pp.106.078717。
- 17.
Gechev TS, Minkov IN, Hille J:过氧化氢诱导的拟南芥细胞死亡:转录和突变分析揭示了氧戊二酸依赖的双加氧酶基因在细胞死亡过程中的作用。中国生物医学工程学报,2005,29(3):344 - 344。10.1080 / 15216540500090793。
- 18.
王晓明,王志强,王志强,王志强,王志强,王志强。烟草叶片氧化胁迫基因表达的研究进展。美国国家科学院学报,2002,99:10870-10875。10.1073 / pnas.152337999。
- 19.
李志强,李志强,李志强。氧化应激过程中信号转导的研究进展。实验植物学杂志,2002,53:1227-1236。10.1093 / jexbot / 53.372.1227。
- 20.
Wagner D, Przybyla D, op den Camp R, Kim C, Landgraf F, Lee K, Wursch M, Laloi C, Nater M, Hideg E, Apel K:拟南芥单线态氧胁迫响应的遗传基础。科学通报,2004,30(3):344 - 344。10.1126 / science.1103178。
- 21.
杨晓明,杨晓明,杨晓明,等。活性氧在植物细胞死亡中的作用。植物生理学报,2006,29(4):344 - 344。10.1104 / pp.106.078295。
- 22.
Carol RJ, Dolan L:活性氧在细胞生长中的作用:从根毛中吸取教训。实验植物学杂志,2006,57:1829-1834。10.1093 / jxb / erj201。
- 23.
葛晓峰,陈志伟,陈志伟,陈志伟,陈志伟。活性氧对植物胁迫响应和细胞程序性死亡的影响。生物学报,2006,28:1091-1101。10.1002 / bies.20493。
- 24.
Mahalingam R, Fedoroff N:应激反应,细胞死亡和信号:活性氧的许多方面。植物生理学报,2003,19(4):366 - 366。10.1034 / j.1399-3054.2003.00156.x。
- 25.
Foyer CH, Noctor G:植物中的氧化剂和抗氧化信号:在生理背景下氧化应激概念的重新评估。植物生态学报,2005,29(4):344 - 344。10.1111 / j.1365-3040.2005.01327.x。
- 26.
Foyer CH, Noctor G:氧化还原稳态和抗氧化信号:应激感知和生理反应之间的代谢界面。植物学报,2005,17:1866-1875。10.1105 / tpc.105.033589。
- 27.
臭氧对植物叶片沉积的化学作用——抗坏血酸的作用。环境科学与技术,1998,23:595-600。10.1021 / es00063a013。
- 28.
Chen Z, Gallie DR:通过增加叶片抗坏血酸来增加对臭氧的耐受性,比增加避免臭氧提供更大的保护。植物生理学报,2005,38(3):344 - 344。10.1104 / pp.105.062000。
- 29.
康林PL, Williams EH, Last RL:抗坏血酸缺乏拟南芥突变体的环境胁迫敏感性。美国国家科学院学报,1996,93:9970-9974。10.1073 / pnas.93.18.9970。
- 30.
Gomez LD, Noctor G, Knight MR, Foyer CH:谷胱甘肽对钙信号和基因表达的调控。实验植物学杂志,2004,55:1851-1859。10.1093 / jxb / erh202。
- 31.
杨晓明,李志刚,李志刚:杨树叶片光合作用和细胞抗氧化剂对臭氧的响应。植物生理学报,2001,26(3):357 - 357。
- 32.
Mittova V, Theodoulou FL, Kiddle G, Gomez L, Volokita M, Tal M, Foyer CH, Guy M:协同诱导谷胱甘肽生物合成和谷胱甘肽代谢酶与番茄耐盐性相关。《科学通报》,2003,29(4):344 - 344。10.1016 / s0014 - 5793(03) 01214 - 6。
- 33.
李志刚,李志刚,李志刚,李志刚:臭氧与抗坏血酸直接反应的研究进展。植物学报,2000,29(4):344 - 344。10.1007 / PL00008153。
- 34.
Sanmartin M, Drogoudi PD, Lyons T, Pateraki I, Barnes J, Kanellis AK:抗坏血酸氧化酶在转基因烟草外体中过度表达导致抗坏血酸和谷胱甘肽氧化还原状态改变,并增加对臭氧的敏感性。植物学报,2003,26(3):344 - 344。
- 35.
Conklin PL, Barth C:抗坏血酸,一种常见的小分子,在植物对臭氧、病原体和衰老的反应中交织在一起。植物学报,2004,27:959-970。10.1111 / j.1365-3040.2004.01203.x。
- 36.
Pignocchi C, Foyer CH:异型抗坏血酸代谢及其在细胞信号调节中的作用。植物学报,2003,6:379-389。10.1016 / s1369 - 5266(03) 00069 - 4。
- 37.
Pastori GM, Kiddle G, Antoniw J, Bernard S, Veljovic-Jovanovic S, Verrier PJ, Noctor G, Foyer CH:叶片维生素C含量通过激素信号调节植物防御转录本和控制发育的基因。植物学报,2003,29(3):344 - 344。10.1105 / tpc.010538。
- 38.
郭俊敏,阮v,施罗德JI:活性氧在激素反应中的作用。植物生理学报,2006,29(3):344 - 344。10.1104 / pp.106.079004。
- 39.
Moeder W, Barry CS, Tauriainen AA, Betz C, Tuomainen J, Utriainen M, Grierson D, Sandermann H, Langebartels C, Kangasjarvi J:臭氧胁迫下1-氨基环丙烷-1-羧酸合酶和1-氨基环丙烷-1-羧酸氧化酶基因双相诱导调控乙烯合成对过氧化氢积累和细胞死亡的影响。植物科学学报,2002,29(3):344 - 344。10.1104 / pp.009712。
- 40.
黄志强,李志强,李志强,等。活性氧与激素对细胞死亡的影响。植物科学进展,2003,8:335-342。10.1016 / s1360 - 1385(03) 00135 - 3。
- 41.
Rao MV, Davis KR:臭氧诱导的细胞死亡在拟南芥中通过两种不同的机制发生:水杨酸的作用。植物学报,1999,17:603-614。10.1046 / j.1365 - 313 x.1999.00400.x。
- 42.
Rao MV, Lee H, Davis KR:臭氧诱导的乙烯生成依赖于水杨酸,水杨酸和乙烯共同调节臭氧诱导的细胞死亡。植物学报,2002,32:447-456。10.1046 / j.1365 - 313 x.2002.01434.x。
- 43.
Tamaoki M, Matsuyama T, Kanna M, Nakajima N, Kubo A, Aono M, Saji H:拟南芥对臭氧的敏感性及其对乙烯合成的影响。植物学报,2003,26(3):344 - 344。
- 44.
王晓燕,王晓燕,王晓燕,王晓燕,等。臭氧对两种不同基因型白杨慢性臭氧熏蒸的影响。乙烯和水杨酸的作用。植物生理学报,2003,27(3):357 - 357。10.1104 / pp.102.018630。
- 45.
D’haese D, Horemans N, De Coen W, Guisez Y:拟南芥o -3晚期响应基因的cDNA微阵列分析。植物生理学报,2006,29(3):344 - 344。10.1111 / j.1399-3054.2006.00711.x。
- 46.
李淑娟,尹秀生:臭氧胁迫对辣椒转录组的影响。分子化学学报,2006,21(2):197-205。
- 47.
王晓明,王晓明,王晓明,等。臭氧诱导的拟南芥氧化胁迫基因转录谱分析。中国生物医学工程学报,2004,26(4):529 - 529。
- 48.
Mahalingam R, Gomez-Buitrago A, Eckardt N, Shah N, Guevara-Garcia A, Day P, Raina R, Fedoroff NV:拟南芥胁迫/防御转录组的特征分析。中国生物工程学报,2003,4:R20-10.1186/gb-2003-4-3-r20。
- 49.
马海林,王丽娟,王晓明,等。拟南芥氧化胁迫响应的时间演化。植物学报,2005,27(3):357 - 357。10.1007 / s11103 - 005 - 2860 - 4。
- 50.
Tosti N, Pasqualini S, Borgogni A, Ederli L, Falistocco E, Crispi S, Paolocci F: o -3处理拟南芥的基因表达谱。植物生态学报,2006,29(4):366 - 366。10.1111 / j.1365-3040.2006.01542.x。
- 51.
Shah NH, Fedoroff NV: CLENCH:一个使用基因本体计算聚类富集的程序。生物信息学,2004,20:1196-1197。10.1093 /生物信息学/ bth056。
- 52.
饶mv, Lee H, Creelman RA, Mullet JE, Davis KR:茉莉酸信号通路调节臭氧诱导的超敏细胞死亡。中国生物医学工程学报,2000,29(4):344 - 344。10.1105 / tpc.12.9.1633。
- 53.
Rao MV, Davis KR:臭氧生理学诱导细胞死亡。植物学报,2001,29(3):344 - 344。10.1007 / s004250100618。
- 54.
Katsuyama Y, Funa N, Miyahisa I, Horinouchi S:利用大肠杆菌生物合成途径合成非天然黄酮类化合物和二苯乙烯。化学生物学报,2007,14:613-621。10.1016 / j.chembiol.2007.05.004。
- 55.
Verhoeyen ME, Bovy A, Collins G, Muir S, Robinson S, de Vos CHR, Colliver S:通过改变类黄酮生物合成途径提高番茄中的抗氧化水平。实验植物学杂志,2002,53:2099-2106。10.1093 / jxb / erf044。
- 56.
黄酮转化为黄酮、二氢黄酮醇和黄酮醇的酶法研究。中国生物科学,2001,26(4):349 - 349。
- 57.
Sutter a, Grisebach H:葡萄糖-黄酮醇- 3-葡萄糖转移酶反应的自由可逆性。生物化学与生物物理学报,2004,19(4):444-447。10.1016 / 0003 - 9861(75) 90485 - 3。
- 58.
Hagmann ML, Heller W, Grisebach H:微体类黄酮3'-羟化酶的诱导和表征。中国生物化学杂志,2003,23(4):457 - 457。10.1111 / j.1432-1033.1983.tb07601.x。
- 59.
Loreto F, Velikova V:叶片产生的异戊二烯保护光合装置免受臭氧破坏,抑制臭氧产物,减少细胞膜的脂质过氧化。植物生理学报,2001,27(3):379 - 379。10.1104 / pp.127.4.1781。
- 60.
Allan AC, Fluhr R:烟草表皮细胞诱导活性氧的两种不同来源。植物科学学报,1997,26(3):357 - 357。10.1105 / tpc.9.9.1559。
- 61.
Boveris A, Sanchez R, Beconi M:抗抗霉素和氰化物呼吸和超氧阴离子生成在新鲜和陈年马铃薯块茎线粒体。清华大学学报(自然科学版),1997,33(4):344 - 344。10.1016 / 0014 - 5793(78) 80781 - 9。
- 62.
kriger - liszkay A:光合作用中单线态氧的产生。实验植物学杂志,2005,56:337-346。10.1093 / jxb / erh237。
- 63.
Moller IM:植物线粒体和氧化应激:电子传递,NADPH周转和活性氧的代谢。植物生理学与分子生物学研究进展。2001,52:561-591。10.1146 / annurev.arplant.52.1.561。
- 64.
潘文杰,李志强,李志强,等。青椒果实线粒体产生超氧化物的研究进展。植物生理学报,2003,19(4):349 - 349。10.1111 / j.1399-3054.1995.tb00993.x。
- 65.
Vianello A, Macri F:植物细胞表面超氧阴离子和过氧化氢的生成。生物膜学报,1998,23:489 - 497。10.1007 / BF00771012。
- 66.
饶MV,科赫JR,戴维斯KR:臭氧:探测植物细胞程序性死亡的工具。植物学报,2000,29(3):357 - 357。10.1023 /: 1026548726807。
- 67.
Overmyer K, Tuominen H, Kettunen R, Betz C, Langebartels C, Sandermann H, Kangasjarvi J:臭氧敏感拟南芥rcd1突变揭示了乙烯和茉莉酸盐信号通路在调节超氧化物依赖性细胞死亡中的相反作用。植物科学学报,2000,12:1849- 1852。10.1105 / tpc.12.10.1849。
- 68.
Rentel MC, Lecourieux D, Ouaked F, Usher SL, Petersen L, Okamoto H, Knight H, Peck SC, Grierson CS, Hirt H, Knight MR: ox1激酶在拟南芥氧化爆发介导的信号传导中是必要的。自然科学学报,2004,27(3):344 - 344。10.1038 / nature02353。
- 69.
张志刚,张志刚,张志刚,张志刚:植物氧化胁迫诱导的丝裂原活化蛋白激酶级联的功能分析。美国科学院学报,2000,97:2940-2945。10.1073 / pnas.97.6.2940。
- 70.
Pasqualini S, Antonielli M, Ederli L, Piccioni C, Loreto F:臭氧敏感性不同烟草品种对臭氧吸收及其光合参数的影响。植物生理学报,2002,30(4):344 - 344。10.1016 / s0981 - 9428(02) 01426 - 2。
- 71.
Borsani O, Valpuesta V, Botella MA:水杨酸在NaCl和渗透胁迫下拟南芥幼苗氧化损伤中的作用。植物生理学报,2001,26(3):344 - 344。10.1104 / pp.126.3.1024。
- 72.
植物防御中的水杨酸环。植物学报,2003,26(3):366 - 366。10.1016 / s1369 - 5266 (03) 00058 - x。
- 73.
马志刚,李志刚,李志刚:拟南芥中NADPH氧化产物对细胞死亡扩散的抑制作用。《自然科学》,2005,37:1130-1134。10.1038 / ng1639。
- 74.
陈晓峰,李志刚,李志刚:不同品种菜豆对臭氧的响应。植物营养学报,2003,29(3):357 - 357。10.1111 / j.1469-8137.1993.tb03851.x。
- 75.
Tamaoki M, Nakajima N, Kubo A, Aono M, Matsuyama T, Saji H:拟南芥o -3暴露的转录组分析表明,多个信号通路相互拮抗诱导基因表达。植物学报,2003,29(3):344 - 344。10.1023 / B: PLAN.0000019064.55734.52。
- 76.
陈松,黄娟,邓平:黄酮类化合物对NAD(P)H:醌受体氧化还原酶的抑制作用及其结构-活性研究。生物化学与生物物理学报,1993,32(3):344 - 344。10.1006 / abbi.1993.1182。
- 77.
李艳,李志刚,李志刚,李志刚,李志刚。黄酮类化合物对人NAD(P)酶的抑制作用。自由基生物学与医学杂志,2005,39:257-265。10.1016 / j.freeradbiomed.2005.03.013。
- 78.
黄酮类化合物在植物抗性研究中的意义。环境科学学报,2006,30(4):457 - 457。10.1007 / s10311 - 006 - 0068 - 8。
- 79.
王丽娟,刘佳杰,王丽娟,王丽娟:苯丙素通路与植物防御的基因组学研究。植物病理学杂志,2002,3:371- 371。10.1046 / j.1364-3703.2002.00131.x。
- 80.
Dixon RA, Sumner LW:豆类天然产品:理解和控制人类和动物健康的复杂途径。植物生理学报,2003,31(3):344 - 344。10.1104 / pp.102.017319。
- 81.
Haraguchi H, Mochida Y, Sakai S, Masuda H, Tamura Y, Mizutani K, Tanaka O, Chou W:二氢黄酮醇对黄果仁氧化损伤的保护作用。生物科学与工程,1998,29(4):489 - 497。
- 82.
Kravchenko L, Morozov S, Tutel'yan V:黄酮类化合物对微粒体抗脂质过氧化的影响在体外而且体外.实验生物学与医学通报,2003,36(3):344 - 344。10.1023 / B: BEBM.0000020207.67705.59。
- 83.
Teselkin I, Zhambalova B, Babenkova I, Tiukavkina N:二氢槲皮素的抗氧化性能。生物工程学报,1996,26(3):344 - 344。
- 84.
Teselkin Y, Babenkova I, Kolhir V, Baginskaya A, Tjukavkina N, Kolesnik Y, Selivanova I, Eichholz A:二氢槲皮素在四氯甲烷肝炎大鼠抗氧化防御中的作用。植物科学进展,2000,30(4):344 - 344。10.1002 / (SICI) 1099 - 1573(200005)十四3 < 160::AID-PTR555 > 3.0.CO; 2 y。
- 85.
Budagova K, Zhmaeva S, Grigor'ev A, Goncharova A, Kabakov A:与槲皮素不同,类黄酮二氢槲皮素在细胞应激条件下不能抑制热休克蛋白的表达。生物化学(Mosc)。2003, 68(9): 1055-1061。10.1023 /: 1026081016923。
- 86.
Loreto F, Mannozzi M, Maris C, Nascetti P, Ferranti F, Pasqualini S:异戊二烯的臭氧猝灭特性及其在叶片中的抗氧化作用。植物生理学报,2001,26(3):344 - 344。10.1104 / pp.126.3.993。
- 87.
铃木华,徐瑞,马田SP,狄克森RA:三萜类皂苷生物合成早期的基因组学研究。植物学报,2002,32:1033-1048。10.1046 / j.1365 - 313 x.2002.01497.x。
- 88.
- 89.
- 90.
Sturn A, Quackenbush J, Trajanoski Z:微阵列数据的聚类分析。生物信息学,2002,18:207-208。10.1093 /生物信息学/ 18.1.207。
确认
这项研究得到了俄克拉荷马州农业实验站的资金支持。作者非常感谢Hua Weng女士在数据分析方面的帮助,以及Ulrich Melcher博士、Steve Marek博士、Andrew Mort博士和Niranjani Jambunathan博士的评论和建议。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MCP进行了ROS分析、RNA分离、臭氧处理、微阵列杂交、数据分析、Real-time PCR并撰写稿件。YT提供了微阵列幻灯片,杂交方案,并提供了对手稿的评论。RM设计了这项研究,进行了微阵列杂交并编辑了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2008_254_moesm1_esm.xls
附加文件1:JE154-1 h时间点微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls5mb)
12870 _2008_254_moesm2_esm.xls
附加文件2:JE154-6 h时间点的微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls5mb)
12870 _2008_254_moesm3_esm.xls
附加文件3:JE154-12 h时间点的微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls4mb)
12870 _2008_254_moesm4_esm.xls
附加文件4:杰马龙-1 h时间点微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls5mb)
12870 _2008_254_moesm5_esm.xls
附加文件5:杰马龙-6 h时间点微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls5mb)
12870 _2008_254_moesm6_esm.xls
附加文件6:杰马龙-12 h时间点微阵列数据。给出了多个重复序列中每个基因的M值和a值。还给出了多个重复的平均M值和a值以及相关的p值。(xls5mb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
唐玉玲,唐玉玲,唐玉玲,等。急性臭氧诱导的耐药和敏感细胞转录组变化Medicago truncatula登记入册。BMC植物生物学8日,46(2008)。https://doi.org/10.1186/1471-2229-8-46
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-46
关键字
- 活性氧
- 臭氧
- 水杨酸
- 活性氧含量
- 臭氧处理